P 8 Związki organiczne zawierając azot
Azot należy do ważniejszych pierwiastków występujących w związkach organicznych. Główne grupy połączeń, w których występuje azot to: związki nitrowe, aminy, amidy kwasowe, aminokwasy i białka. Wszystkie filmiki związane z tymi połączeniami znajdują się na płycie III, poświęconej połączeniom organicznym, w części III pt. Związki chemiczne w żywieniu i życiu codziennym. Tak więc tradycyjnie odniesienia do filmików będą posiadały notację np. 5/III co oznacza 5 doświadczenie w części III i oczywiście dotyczy to płyty nr3, gdyż tylko na tej płycie znajdują się filmiki związane z chemią organiczną. Obecność azotu w związku chemicznym stwierdza się wykonując próbę pokazaną na filmiku 3/III.
Związki nitrowe
Pod tym pojęciem rozumie się połączenia organiczne zawierające grupę nitrową -NO2 związaną z węglem alifatycznym lub aromatycznym. Nazwy nitrozwiązków tworzy się przez dodanie przedrostka nitro- do nazwy węglowodoru np. CH3-NH2 to nitrometan. W grupie nitrowej mamy dwa atomy tlenu związane z azotem podwójnymi wiązaniami, bilans elektronowy wskazuje jednak, że jeden z atomów tlenu połączony jest wiązaniem koordynacyjnym
-N→![]()
||
|O|
Otrzymywanie:
Alifatyczne związki nitrowe otrzymuje się przez działanie na chlorowcoalkany azotanem(III) srebra: R-Cl + AgNO2 → R-NO2 + AgCl
W praktyce większe znaczenie mają aromatyczne związki nitrowe, zaś reakcję nitrowania uważa się za reakcję charakterystyczną węglowodorów aromatycznych. Reakcja nitrowania benzenu przebiega wolno. Podczas tej reakcji jeden z atomów wodoru w pierścieniu benzenowym, formalnie biorąc, tworzy z grupą -OH wodę i na jego miejsce zostaje podstawiona grupa nitrowa. Reakcja taka nosi nazwę reakcji nitrowania Polega ona na działaniu mieszaniną kwasów azotowego(V) oraz siarkowego(VI) tzw. mieszaniną nitrującą na węglowodór. Obecność kwasu siarkowego(VI) powoduje utworzenie grupy nitrowej oraz związanie, dzięki właściwościom higroskopijnym, powstającej wody co powoduje przesunięcie równowagi w prawo (na stronę produktów).
C6H6 + HO-NO2 ![]()
C6H5-NO2 + H2O grupa nitrowa należy do podstawników II rodzaju, to znaczy kieruje kolejny podstawnik w położenie meta
Aminy - to pochodne amoniaku, w cząsteczce którego atomy wodoru są podstawione rodnikami węglowodorowymi. Tak więc ogólny wzór aminy to R-NH2. Aminy otrzymuje się w wyniku reakcji fluorowcopochodnej z amoniakiem, następuje wówczas substytucja fluorowca grupą aminową. Specyfika tej grupy powoduje, że zawierające ja związki posiadają charakter zasadowy. Atom azotu w grupie aminowej, podobnie jak w amoniaku, posiada wolną parę elektronową, którą może przekazać i w ten sposób zgodnie, z teorią Lewisa, staje się zasadą. W zależności od tego, ile atomów wodoru w amoniaku zastaje podstawionych rodnikami węglowodorowymi, rozróżnia się aminy pierwszo (I-), drugo (II-) i trzeciorzędowe (III-)
H R R R
| | | |
:N- H : N- H : N-R :N- R
| | | |
H H H R
amoniak amina I-rzędowa amina II-rzędowa amina III-rzędowa
Nazwy amin o bardziej złożonej budowie tworzy się według ogólnie przyjętych zasad nazewnictwa systematycznego, traktując grupę aminową jako podstawnik.
H2N-CH2-CH2-CH2-NH2 1,2-diaminopropan
CH2=CH(NH2)-CH2-CH3 3-amino-1-penten
Pochodne amin podstawione w grupie aminowej, mają przedrostek N, np. C6H5NH2 - anilina; C6H5-NH-CH3 N- metyloanilina
Aminy można również otrzymać w wyniku działania amoniaku na fluorowcopochodne: CH3I+ NH3→CH3NH2 + HI
Aminy aromatyczne, które mają większe znaczenie praktyczne, otrzymuje się przez redukcję nitrozwiązków wodorem atomowym, który powstaje w równoległej reakcji cynku z kwasem solnym: C6H5NO2 + Zn + 6HCl → C6H5NH2 + ZnCl2 + 2H2O
Dzięki właściwościom zasadowym aminy reagują z kwasami, np.
CH3 -NH2 + HCl → CH3-NH3+Cl- chlorowodorek metyloaminy
Aminy aromatyczne są słabszymi zasadami ponieważ podstawnik aromatyczny jest bardziej elektroujemny i mocniej przyciąga wolną parę elektronową atomu azotu.
Amidy kwasowe - amidami kwasowymi nazywamy pochodne kwasów karboksylowych, w których grupa hydroksylowa jest zastąpiona grupą aminową.
R-C=O
|
NH2
Amidy otrzymuje się zasadniczo dwiema metodami:
Przez działanie amoniaku na chlorek kwasowy
O O
|| ||
R-C-Cl + HNH2 → R-C-NH2 + HCl
Przez ogrzewanie soli amonowej kwasu karboksylowego
O
||
CH3COONH4 ![]()
CH3-C-NH2 + H2O amid kwasu octowego lub acetamid
Istotną cechą amidów jest ich zdolność do hydrolizy, np. amid kwasu octowego ulega hydrolizie w obecności kwasu nieorganicznego do kwasu karboksylowego i amoniaku:
CH3-CO(NH2) + H2O ![]()
CH3COOH + NH3
Mocznik jest diamidem kwasu węglowego (NH2)2CO. Dorosły człowiek wydziela dziennie około 30 g mocznika jako końcowego produktu przemiany materii. Doskonale rozpuszcza się w wodzie, nie posiada właściwości zasadowych jednak reaguje z mocnym kwasem azotowym(V) dając połączenie o barwie intensywnie żółtej, wykorzystywane do ilościowego oznaczenia mocznika w moczu. H2N-CO-NH2+ HNO3→ H2N-CO-HN2•HNO3
Mocznik ulega hydrolizie z wydzieleniem dwutlenku węgla i amoniaku:
(NH2)2CO + H2O ![]()
2NH3 + CO2
Podczas ogrzewania dwie cząsteczki mocznika dają biuret wydzielając jednocześnie amoniak
O O
|| ||
C C
/ \ / \
H2N NH2 / NH2
H2N NH2 → H-N + NH3
\ / \ NH2
C \ /
|| C
O ||
O
W środowisku zasadowym biuret tworzy z kationami miedzi(II) związek kompleksowy o barwie różowo fioletowej. Reakcję tę wykorzystuje się w tzw. próbie biuretowej, która służy do wykrywania białek, a konkretnie połączeń, w których występuje charakterystyczne dla białek, wiązanie biuretowe -CO-NH- (ćw.4/III).
Aminokwasy - zawierają w swej cząsteczce dwie grupy funkcyjne, grupę karboksylową i aminową. W związkach naturalnych grupa aminowa jest zawsze połączona z atomem węgla do którego przyłączona jest grupa karboksylowa a więc do tzw. atomu węgla α. Ogólna nazwa tego typu aminokwasów to α - aminokwasy. Aminokwasy występują jako tzw. jony wewnętrzne, które powstają w wyniku przeniesienia ładunku - protonu wodoru
COO-
|
H3N+- C - H
|
R
Obojnaczy jon aminooctowy jest efektem odszczepienia protonu wodoru od grupy karboksylowej i jego koordynacyjnego połączenia z atomem azotu grupy aminowej. Większość aminokwasów wykazuje czynność optyczną. Podręczniki podają nazwy wielu możliwych aminokwasów, jednak zasadniczo wystarczy zapamiętać dwa: kwas aminooctowy czyli glicynę i α - aminopropionowy czyli alaninę.
W zależności od pH środowiska mogą występować w trzech formach: w formie anionu, w formie kationu oraz jonu obojnaczego. Zjawisko to uwarunkowane jest tzw. reakcjami protolitycznymi grup funkcyjnych podczas rozpuszczania w wodzie:
R-COOH + H2O ↔ R-COO- + H3O+
R-NH2 + H2O ↔ R-NH3+ + OH-
Reakcje te są odwracalne a ich kierunek zależy od pH roztworu. Istnieją jednakże takie wartości pH roztworów, w których aminokwas nie porusza się w polu elektrycznym. Wielkość ta jest charakterystyczna dla każdego konkretnego aminokwasu i nosi nazwę punktu izoelektrycznego (pI)
Jedną z ważniejszych właściwości aminokwasów jest ich zdolność do połączenia się z sobą (polikondensacja). Powstają wówczas wiązanie peptydowe a powstałe związki noszą nazwę dipeptydów, tripeptydów lub ogólnie polipeptydów.
R1 O R2 R1 O H R2
| || | | || | |
H2N-CH-C-OH + H2N-CH-COOH → H2N- CH-C - N - CHCOOH + H2O
W wyniku działania alkoholi na aminokwasy powstają estry i są one, w przeciwieństwie do aminokwasów, lotne.
Białka, to wielkocząsteczkowe struktury zbudowane z około 20 rodzajów aminokwasów połączonym wiązaniami peptydowymi (biuretowymi). Białka są najważniejszymi związkami organicznymi stąd ich nazwa proteiny, bowiem protos z greckiego oznacza pierwszy. Do białek zalicza się cząsteczki zbudowane z więcej niż 100 aminokwasów. Związki o mniejszej ilości aminokwasów to oligopeptydy zaś o większej to polipeptydy. Obecność azotu w cząsteczkach białek można stwierdzić za pomocą próby pokazanej w doświadczeniu 3/III. Wyróżnia się cztery rzędy określenia struktury białek
struktura I- rzędowa określa sekwencję aminokwasów
struktura II - rzędowa rodzaj utworzonej helisy
struktura III - rzędowa wzajemne przenikanie się dwóch helis
struktura IV - rzędowa koordynację białek o określonej strukturze III -rzędowej wokół jonów metalu np. żelaza w hemoglobinie.
Jako podstawę klasyfikacji białek przyjęto ich skład chemiczny, budowę przestrzenną cząsteczki oraz ich właściwości, zwłaszcza zaś rozpuszczalność. Najpowszechniejszy jest podział na białka proste czyli proteiny oraz złożone czyli proteidy. Białka proste w zależności od kształtu dzieli się na fibrylarne i globularne. Najpopularniejszymi białkami globularnymi są albuminy (rozpuszczalne w wodzie) i proteiny (nierozpuszczalne). Do białek fibrylarnych należą skleroproteidy (kolagen, keratyna)
Nazwy białek złożonych zależą od rodzaju występującego w nich składnika niebiałkowego np. lipoproteidy zawierają cząsteczki tłuszczów, glikoproteidy węglowodanów, chromoproteidy jony metali nadające barwę itd. Reakcje stosowane do wykrywania białek to reakcja ksantoproteinowa ze stężonym kwasem azotowym(V) (4/III) i biuretowa (4/III)
Białka reagują z kwasami, alkoholem, roztworami soli ulegając denaturacji. (5/III).
Przykłady zadań
Omów reakcję hydrolizy mocznika i jego reakcję z kwasem azotowym
Ile dm3 gazowego amoniaku można otrzymać w wyniku hydrolizy 85 g mocznika w warunkach normalnych
Napisz równanie reakcji hydrolizy amidu kwasu octowego i nazwij jej produkty.
Czym różnią się aminy aromatyczne od alifatycznych?
Napisz wzory strukturalne: dietyloaminy, trimetyloaminy, etylo-difenyloaminy
Napisz odpowiednie równania reakcji i oblicz, ile aniliny można otrzymać wychodząc z 120 g benzenu, przyjmując 80% wydajności poszczególnych procesów.
Omów reakcję mocznika z stężonym kwasem azotowym(V)
Napisz równania reakcji następującego ciągu przemian: acetylen → benzen → nitrobenzen → aminobenzen (anilina)
Napisz równania następujących przemian: amoniak → etyloamina; amoniak → mocznik; amoniak → kwas azotowy(V) → nitrobenzen → anilina
Napisz równania następującego ciągu przemian: etanol → eten → chloroetan → chlorowodorek etyloaminy → etyloamina
Rozwiązania zadań
Zad.1
Hydroliza mocznika, jak i innych amidów kwasowych, prowadzi do odpowiedniego kwasu, w przypadku diamidu kwasu węglowego będzie to oczywiście dwutlenek węgla (jako bezwodnik kwasu węglowego oraz amoniak
(NH2)2CO + H2O → 2NH3 + CO2
mocznik przejawia tylko w bardzo znikomym stopniu właściwości zasadowe, reaguje jednak z kwasem azotowym(V) dając azotan mocznika charakteryzujący się żółtą barwą. Natężenie barwy żółtej służy to ilościowego oznaczania mocznika w moczu.
Zad.2
Równanie reakcji hydrolizy mocznika: (NH2)2CO + H2O → 2NH3 + CO2 wynika:
Z 1 mola mocznika, czyli z 60 g powstają 2 mole amoniaku czyli 44,8 dm3
85 g mocznika daje x dm3
x = 63,7 dm3 amoniaku
Zad. 3
CH3CONH2 + H2O → CH3COOH + NH3
produktami hydrolizy amidu kwasu octowego są kwas octowy oraz amoniak
Zad.4
Tak aminy alifatyczne jak i aromatyczne wykazują właściwości zasadowe, wynikające z faktu, że azot grupy aminowej może być donorem pary elektronowej. Para ta jest jednak łatwiej oddawana w sytuacji, gdy grupa aminowa jest połączona z mniej polarnym rodnikiem alifatycznym. Aminy aromatyczne są słabszymi zasadami ze względu na silniej elektroujemny charakter rodnika aromatycznego (sekstet elektronów zdelokalizowanych pierścienia benzenowego).
Zad. 5
CH3-CH2-N-CH2-CH3 CH3-N-CH3 CH3-CH2-N-C6H5
| | |
H CH3 C6H5
Dietyloamina trimetyloamina etylodifenyloamina
Zad. 6
Odpowiednie równania reakcji:
C6H6 + HNO3
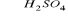
C6H5NO2 + H2OC6H5NO2 + 6[H] → C6H5NH2 + 2H2O
Przy założeniu 100% wydajności, na podstawie równania reakcji można stwierdzić:
Z 1 mola benzenu czyli 78 g powstaje 1 mol czyli 93 g aniliny
120 g powstanie x g aniliny x = 143 g aniliny
przeliczamy na określoną w zadaniu wydajność:
143 g przy 100% wydajności, czyli ułamek procentowy 1
x g przy 80% x 80% wydajności, ułamek procentowy 0,64
x = 91,6 g aniliny
Zad. 7
Reakcję mocznika z kwasem azotowym(V) omówiono przy okazji rozwiązania zadania 1
(powstaje azotan mocznika o barwie intensywnie żółtej. Reakcję tę wykorzystuje się do ilościowego oznaczania mocznika w moczu)
Zad. 8
Równania reakcji wskazane w cyklu przemian
3C2H2 → C6H6
C6H6 + HNO3
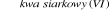
C6H5NO2 + H2OC6H5NO2 + 6[H] → C6H5NH2 + 2H2O
Zad. 9
Amoniak → etyloamina NH3 + C2H5Cl → C2H5NH2 + HCl
Amoniak → mocznik 2NH3 + CO2 → (NH2)2CO + H2O
Amoniak → kwas azotowy(V) 2NH3 + 2½O2 → 2NO + 3H2O
2NO + O2 → N2O4
N2O4 + H2) → HNO3 + HNO2
Kwas azotowy(V) → nitrobenzen C6H6 + HNO3 ![]()
C6H5NO2
Nitrobenzen → anilina C6H5NO2 + 3Zn + 6HCl → C6H5NH2 + 2H2O + 3ZnCl2
Zad. 10
Etanol → eten C2H5OH ![]()
C2H4 + H2O
Eten → chloroetan C2H4 + HCl → C2H5Cl
Chloroetan → chlorowodorek etyloaminy C2H5Cl + NH3 → CH3-CH2-NH2·HCl
Chlorowodorek etyloaminy → etyloamina
CH3-CH2-NH2·HCl + NaOH → CH3-CH2-NH2 + NaCl + H2O
5
Wyszukiwarka