Chemia i technologia nitrowych pochodnych chlorobenzenu.
2,4-chlorodinitrobenzen, trinitrochlorobenzen. Nitrowe pochodne bifenylu i analogów
Nitrowe pochodne chlorobenzenów mają duże znaczenie jako produkty przejściowe przy produkcji MW, barwników i szeregu innych związków. Najważniejszym wśród nitrohalogenobenzenów jest dinitrochlorobenzen, którego produkcja realizowana jest w dużej skali. Trinitrochlorobenzen produkowany jest w mniejszej ilości. Stosuje się go jako produkt przejściowy przy syntezie cennych MW o wysokiej odporności termicznej.
Poza nielicznymi i już historycznymi wyjątkami, nitrowe pochodne związków chloroaromatycznych nie mają zastosowania jako MW. Chlorek pikrylu był produkowany i stosowany jako MW w czasie I wojny światowej. Nie zyskał jednak szerszego znaczenia jako MW głównie wskutek nadmiernej reaktywności i łatwości tworzenia kwasu pikrynowego, a z metalami pikrynianów.
Znaczenie dinitrochlorobenzenu jako półproduktu w syntezie innych MW obrazuje poniższy schemat:
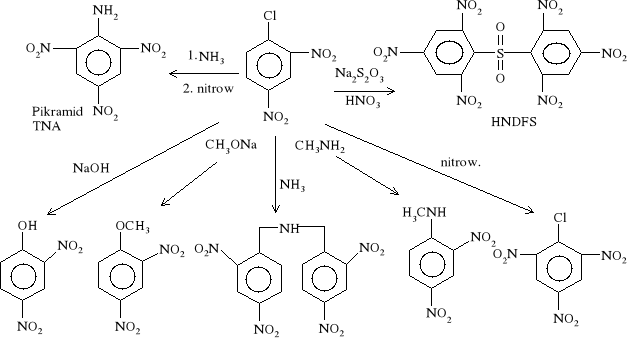
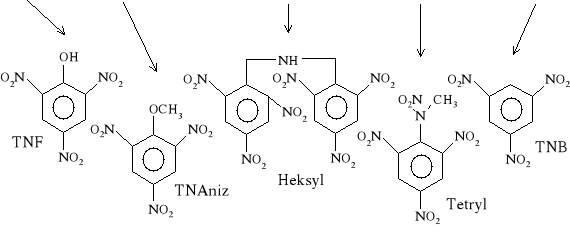
Chloronitrozwiązki otrzymuje się prawie wyłącznie przez nitrowanie odpowiednich chlorowęglowodorów. Chlor przy pierścieniu benzenowym ułatwia nieco wprowadzenie grup nitrowych (ale w mniejszym stopniu niż grupa -CH3) i w związku z tym możliwe jest otrzymanie trinitrowej pochodnej chlorobenzenu przez bezpośrednie nitrowanie.
Cl - podstawnik drugiego rodzaju kierujący w położenie o i p → na skutek konkurencyjnego działania ujemnego efektu indukcyjnego z dodatnim efektem mezomerycznym.
Przy nitrowaniu chlorobenzenu mieszaniną nitrującą tworzy się mononitrochlorobenzen w postaci trzech izomerów orto-, para- i meta. Niska wydajność izomeru meta to wynik kierującego wpływu chloru, będącego co prawda podstawnikiem drugiego rodzaju ale kierującym w położenie orto i para na skutek stłumienia ujemnego efektu indukcyjnego dodatnim efektem niezomerycznym. Stosunek izomerów w produkcie można regulować poprzez zmianę temperatury i stężenia H2SO4 w mieszaninie nitrującej. Np. zależność wydajności izomeru para [w %] od tych parametrów wyraża się wzorem:
X = (0,13 - 0,0027s)T+ 70.6
s - stężenie H2SO4 [%], T - temperatura procesu [°C].
DNClB właściwości fizykochemiczne i wybuchowe:
Przy nitrowaniu technicznego MClB tworzy się DNClB w postaci trzech izomerów: 2,4-(produkt podstawowy), 2,6- i 3,4- (w niewielkich ilościach). Wszystkie trzy izomery występują w kilku odmianach krystalograficznych z różnymi temperaturami topnienia. Temperatura topnienia technicznego DNClB wynosi 46-47°C. Główny składnik (izomer 2,4-) ma następujące właściwości fizykochemiczne i wybuchowe:
Jasnożółte kryształy, dobrze rozpuszczalne w alkoholach, acetonie, benzenie, toluenie, chloroformie, nierozpuszczalny w wodzie, występuje w trzech odmianach krystalograficznych. Wszystkie izomery DNCB są silnymi truciznami → wywołują egzemę, stężenie dopuszczalne 1mg/m3.
Nitrowanie DNClB wysoko stężonymi mieszaninami nitrującymi daje TNClB. Z powodu dużego zużycia kwasów (H2SO4 i HNO3), kilkakrotnie przewyższającego teoretyczne zapotrzebowanie, cena TNClB jest bardzo wysoka.
1-chloro-2,4,6-trinitrobenzen TNClB
Symetryczny TNClB jest żółtą krysztaliczną substancją, dobrze rozpuszczalną w alkoholu, acetonie, chloroformie, benzenie, toluenie, octanie etylu i bardzo słabo rozpuszczalną w wodzie.
C6H2N3O6Cl
tt 83°C
Vpb 315 cm3
D1,76 7200 m/s
TNClB - właściwości chemiczne:
Całokształt nitrowania chlorobenzenu do trinitrowych pochodnych wraz z podaniem warunków reakcji i charakterystyka poszczególnych substancji przedstawia następujący schemat:
tt. 81,5-83oC tt.116oC
Technologia otrzymywania DNClB
Nitrowanie chlorobenzenu do DNClB prowadzi się w aparaturze ciągłego działania:
Do nitratora 4 ciągle podaje się chlorobenzen, kwasy odpadkowe z drugiego etapu nitrowania i świeży HNO3. Mieszanina poreakcyjna ścieka do separatora 5, skąd mononitrochlorobenzen trafia do podstawowego nitratora 9 - drugiego etapu nitrowania. Tutaj dozowany jest 94% H2SO4 i HNO3 ze zbiorników 7 i 8. Mieszanina reakcyjna ścieka następnie do kolejnego nitratora 10 pracującego w wyższej temperaturze (105°C). Stąd kierowana jest na separator 11. Kwasy odpadkowe zawracane są na pierwszy etap nitrowania, a DNClB kierowany jest na kolumnę wymywającą 15, gdzie kontaktuje się z 0,5% roztworem Na2CO3 i parą wodną utrzymującą temperaturę na poziomie 60°C. Roztopiony i częściowo przemyty produkt przechodzi następnie do mieszalnika 17 gdzie jest wymywany ciepłą wodą. Emulsja stopionego DNClB spływa następnie do separatora 18 skąd DNClB kierowany jest na suszenie.
Trinitrotrichlorobenzen TNCB
Związek ten nie ma znaczenia jako samodzielny MW gdyż sym TClB jest kosztowną substancją wyjściową otrzymywaną przez chlorowanie aniliny i następne deazotowanie poprzez etap związku diazowego. Bywa jednak używany do wyrobu substancji wybuchowych o pewnych cennych właściwościach np.:
Otrzymywanie TNTClB:
Nitrowe pochodne bifenylu i jego analogów
1. Heksanitrobifenyl (HNBF)
HNBF jest żółtą krystaliczną substancją nie rozpuszczalną w wodzie. Rozpuszcza się w alkoholu, benzenie i toluenie.
Jest inercyjnym chemicznie i odpornym termicznie związkiem o wysokiej temperaturze topnienia. Pod względem właściwości wybuchowych nieznacznie przewyższa TNT. Jest wrażliwszy na bodźce mechaniczne i posiada wyższą prędkość detonacji. Dzięki wysokiej temperaturze topnienia i termoodporności jest interesującym MW, jednak skomplikowana synteza i wysoka cena sprawiają, że nie znajduje szerszego zastosowania.
HNBF otrzymywany jest w wyniku działania miedzi na chlorek pikrylu rozpuszczony w nitrobenzenie.
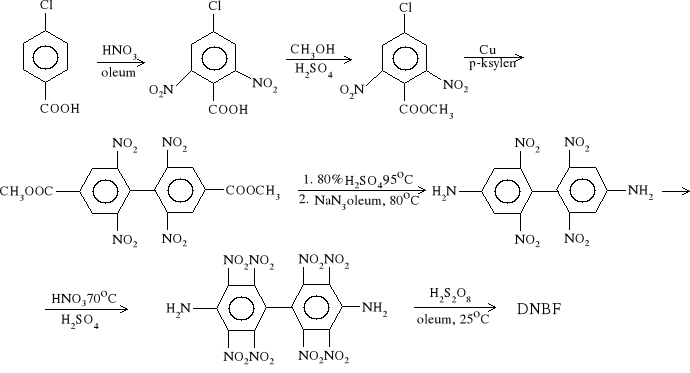
2. Dekanitrobifenyl (DNBF)
DNBF jest drugim po heksanitrobenzenie aromatycznym nitrozwiązkiem nie zawierającym wodoru w cząsteczce. Został otrzymany przez Nielsena w 1983r. Pod względem właściwości chemicznych jest bardziej reaktywny i mniej stabilny niż HNB. Reaguje z wodą i alkaliami dając różnorodne nitrowe pochodne fenolu. Jego zawiesina w benzenie reaguje z amoniakiem z utworzeniem pochodnych aminonitrowych. DNBF wytrącony z mieszaniny ponitracyjnej ma postać żółtych kryształów rozkładających się w temperaturze 243-248°C. Rozpuszcza się we wrzącym acetonitrylu i 1,2-dichloroetanie.
Otrzymywany jest z 10% wydajnością w siedmioetapowej syntezie startującej z kwasu 4-chlorobenzoesowego.
3. Heksanitrodifenylosiarczek (HNDFS)
HNDFS jest żółto-złotą krystaliczną substancją. Bardzo słabo rozpuszcza się w alkoholu i eterze i dość dobrze w acetonie. Jest odporny na działanie wysokich temperatur. Jego parametry detonacyjne są wyższe niż dla TNT (zbliżone do parametrów kwasu pikrynowego). Podczas I wojny światowej był stosowany przez Niemców do elaboracji bomb lotniczych w stopach z TNT (50/50) lub w mieszaninach z saletrą amonową.
Produkowano go na skalę przemysłową z trinitrochlorobenzenu działając na ten ostatni tiosiarczanem sodowym i węglanem magnezu w roztworze alkoholowym.
Produkt oddzielano na wirówkach, przemywano etanolem, rozcieńczonym kwasem solnym (w celu usunięcia resztek MgCO3 ) i wodą. Wydajność procesu osiągała 90% wydajności teoretycznej.
4. Heksanitrodifenylosulfon (HNDFSU)
Jest jasnożółtą krystaliczną substancją. Rozpuszcza się w acetonie oraz słabo w benzenie i toluenie. Jest stabilniejszym związkiem niż HNDFS. Charakteryzuje się także niższą wrażliwością i wyższymi parametrami detonacyjnymi. Stosowano go w mieszaninach z TNT i NH4NO3 do elaboracji bomb lotniczych.
Otrzymywany jest przez utlenianie HNDFS za pomocą HNO3
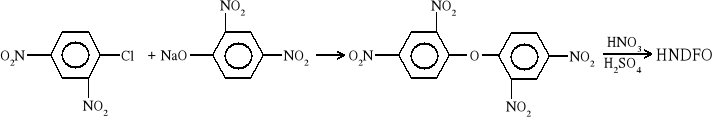
5. Heksanitrodifenylotlenek (HNDFO)
Żółta krystaliczna substancja rozpuszczalna w wodzie oraz słabo rozpuszczalna w EtOH i EtoEt. Jest bardzo stabilnym MW, mniej wrażliwym na uderzenie i silniejszy niż kwas pikrynowy. Otrzymywany jest przez nitrowanie di-, tri-, tetra- nitrowych pochodnych eteru difenylowego mieszaniną nitrującą:
6. Heksanitrostilben (HNS)
HNS jest jasnożółtą krystaliczną substancją. Charakteryzuje się dużą stabilnością i odpornością termiczną. Parametry detonacyjne HNS-u są zbliżone do odpowiednich wartości dla TNT. Jest stosowany jako termoodporny MW elaborowany do wyrobów wykorzystywanych w głębokich odwiertach poszukiwawczo-wydobywczych, w których temperatura przekracza 200°C. W ostatnich latach HNS zyskał na znaczeniu ponieważ stwierdzono, że dodany w niewielkich ilościach (0,5-1%) do stopionego TNT zmienia strukturę odlewów, TNT krystalizuje w postaci drobnych ziaren przez co odlew jest jednorodny i mało porowaty.
HNS jest produkowany na skalę przemysłową we Szwecji według metody startującej z TNT.
Przy nadmiarze NaOCl tworzy się HNS, a przy niedostatku heksanitrodibenzyl.
9
Wyszukiwarka