Zasady działania urządzeń chłodniczych
1.Procesy chłodnicze
Chłodzenie jest procesem odprowadzania ciepła lub wykonywania pracy połączone z obniżeniem temperatury ciała lub środowiska poniżej temperatury otoczenia i utrzymywania jej na tym poziomie.
Ilość ciepła, którą może pochłonąć medium chłodnicze w określonym przedziale czasu decyduje o wydajności
chłodniczej procesu. Proces może być naturalny bądż też sztuczny. Chłodzenie naturalne polega na obniżeniu
temperatury drogą samorzutnej wymiany z otoczeniem (np. z naturalnym lodem).Sztuczne chłodzenie musi
odbywać się przy udziale urządzeń chłodniczych.W urządzeniach tych jest czynnik termodynamiczny,który
krążąc pośredniczy w wymianie ciepła między środowiskiem chłodzonym a otoczeniem.Czasem proces sztucznego
chłodzenia nazywany jest również ziębieniem.
Urządzenia chłodnicze wykorzystują efekty chłodnicze następujących procesów fizycznych:
a) LLzmiana stanu skupienia połączonych z pochłanianiem ciepła, do których należą:
-przejście ze stanu stałego w ciekły (topnienie),
-przejście ze stanu stałego w gazowy (sublimacja),
-przejście ze stanu ciekłego w gazowy (parowanie),
-rozpuszczanie soli;
b)rozprężanie gazów połączonego z wykonywaniem pracy zewnętrznej lub ekspansji gazów połączonej z
dławieniem przepływu(efekt Joule'a-Thomsona);
c)zjawiska chłodniczego wirowego (rurka Ranque'a);
d)przepływu prądu elektrycznego przez złącze dwóch metali lub półprzewodników (zjawisko termoelektryczne
Seebecka i Peltiera);
e)rozmagnesowania ciała stałego (zjawisko magnetotermiczne);
f)desorbcji gazów.
1.1. Zmiana stanu skupienia
W trakcie zmiany stanu skupienia temperatura ciała jednorodnego w zasadzie zachowuje wartość stałą.Proces
topnienia-krzepnięcia ciał stałych o budowie krystalicznej przebiega w stałej temperaturze, a ciałach o budowie
bezpostaciowej w pewnym przedziale temperaturowym o niewyrażnych granicach.
W czaasie topnienia lodu zmienia się jego objętość oraz następuje wymiana pewnej ilości energii między ciałem
podlegającemu procesowi zmiany stanu skupienia a otoczeniem.
Zmiana entalpii jednostki masy ciała w czasie chłodzenia przy przechodzeniu układu ze stanu 1 do stanu 2 wynosi:
![]()
(1)
gdzie:
h-entalpia właściwa ciała, J/kg
Efekt energetyczny (1) wynika z budowy atomowej (bądż cząsteczkowej) materii.Jak już wcześniej wspomniano procesowi topniienia-krzepnięcia towarzyszy zmiana objętości a tym samym również gęstości ciała podlegającego
przemianie. Przy przechodzeniu z fazy o większej gęstości do mniejszej w tej samej temperaturze konieczne jest
dostarczenia pewnej ilości energii do pokonania sił międzycząsteczkowych. Ilość tej energii jest równa różnicy
energii potencjalnej sił międzycząsteczkowych.Przyrost entropii jednostki masy ciała następujący przy zmianie
stanu skupienia jest równy stosunkowi zmiany entalpii do temperatury :
![]()
(2)
Przy przechodzeniu ciała ze stanu ciekłego do gazewego (wrzenie), jeżeli jest to substancja czysta chemicznie
temperatura procesu jest stała (przy stałym ciśnieniu).Temperatura wrzenia odpowiada stanowi równowagi
trwałej między cieczą a gazem (rys. 1).
Rys. 1. Zależność ciśnienia nasycenia od temperatury nasycenia.
Krzywa przedstawiająca zależność ciśnienia nasycenia od temperatury
nazywa się krzywą nasycenia (lub wrzenia).Krzywa ta biegnie od punktu potrójnego, który jest punktem
równowagi fazy stałej ciekłej i gazowej, do punktu krytycznego K , powyżej którego faza ciekła nie istnieje.
Rys. 2. Obszar pary i cieczy w układzie ciśnienie - objętość właściwa.
Para nasycona oddzielona od cieczy i następnie podgrzana powyżej temperatury nasycenia nosi nazwę pary
przegrzanej. Powstanie pary wiąże się ze znacznym wzrostem objętości właściwej (rys. 2).Odcięta punktu A'
odpowiada objętości właściwej wrzącej cieczy, a punkt B' podaje stan pary nasyconej suchej,czyli takiej, która
nie zawiera kropelek wrzącej cieczy.Gałąż krzywej granicznej biegnąca przez punkty A',A'' do punktu K nosi
nosi nazwę dolnej lub lewej krzywej granicznej. Natomiast ramie krzywej zawierające punkty B',B'' nosi nazwę
górnej lub prawej krzywej granicznej. Stany układu leżące na dolnej krzywej oznacza się indeksem ' (prim),
natomiast na górnej ''(bis). Ciepłem parowania r nazywa się ilość ciepła, jaką trzeba doprowadzić do 1kg wrzącej cieczy , aby w tej samej temperaturze i w tym samym ciśnieniu otrzymać 1kg pary nasyconej:
r = h''-h' = (u''+pv'') - (u'+pv') = u''-u'+p(v''-v') (3)
Różnica h''-h' określa energię niezbędną do przejścia cieczy w parę, natomiast ostania część równania opisuje
pracę niezbędną do pokonania ciśnienia zewnętrznego. Dlatego , że ciepło parowania odnosi się do procesu
izotermicznego zachodzi następująca zależność :
r = T(s''-s') (4)
gdzie:
(s''-s') - przyrost entropii właściwej przy przejściu cieczy w stan gazowy
W obszarze znajdującym się pod krzywą graniczną znajduje się para nasycona wraz z wrzącą cieczą. Para , która znajduje się w tym obszarze nazywa się parą nasyconą wilgotną. Aby określić stan pary z tego obszaru wprowadza się współczynnik, zwany również stopniem suchości :
![]()
(5)
Współczynnik ten opisany jest przez odpowiednie objętości właściwe(5).
Rys. 3. Linie stałego stopnia suchość w obszarze pary i cieczy w układzie ciśnienie - objętość właściwa ..
Rys. 4. Linie stałego stopnia suchość w obszarze pary i cieczy w układzie temperatura -entropia właściwa ..
Przemiany jakim poddawana jest para przedstawiają wykresy : ciśnienie-objętość właściwa oraz temperatura-
-objętość właściwa (rys.3 i 4). Stopień suchości stanów leżących na dolnej krzywej granicznej przyjmuje wartość
zero , natomiast na górnej jeden. Zachodzą następujące zależności :
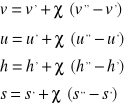
(6)
Rys. 5. Przemiana izobaryczna pary w układzie ciśnienie - objętość właściwa .
Rys. 6. Przemiana izobaryczna pary w układzie temperatura - entropia .
Wukładzie współrzędnych ciśnienie-objętość właściwa izobara jest linią poziomą (rys. 5), natomiast w układzie temperatura-entropia (rys. 6) można wyróżnić trzy części tej linii o różnych przebiegach. Odcinek AB biegnie
obok krzywej granicznej i odpowiada ogrzewaniu cieczy do stanu wrzenia. Drugi odcinek przemiany BC pokrywa
się z izotermą i znajduje się w obszarze pary nasyconej wilgotnej. Przemiana CD zachodzi w obszarze pary
przegrzanej. Pracę zewnętrzną przemiany izobarycznej 1 od stanu 1 do stanu 2 można wyliczyć na podstawie
wzoru :
![]()
(7)
Gdy przemiana zachodzi całkowicie w obszarze pary nasyconej, to:
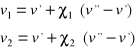
(8)
Po podstawieniu (8) do (7) otrzymuje się :
![]()
(9)
Przyjmuje się , że procesy parowania czynnika chłodniczego w parowniku i kondensacji w skraplaczu przebiegają w warunkach izobarycznych. W obszarze pary nasyconej przemiana izobaryczna jest zarazem przemianą izotermiczną.
W układzie p-v proces izotermiczny można podzielić na procesy zachodzące w cieczy AB, w parze nasyconej
wilgotnej BC i w parze przegrzanej CD. Ciepło właściwe przemiany izotermicznej jest równe :
![]()
(10)
W obszarze pary nasyconej wzór ten przechodzi w zależność :
![]()
(11)
Praca przemiany izotermicznej jest równa :
![]()
(12)
Związek między zmianą ciśnienia p i zmianami temperatury T podczas procesu zmiany stanu skupienia podaje równanie Clapeyrona-Clausiusa, w postaci równania równowagi fazowej :
![]()
(13)
gdzie :
r - ciepło zmiany stanu skupienia, J/kg
![]()
-zmiana objętości właściwej zachodząca w czasie tej przemiany, ![]()
Z równania Clapeyrona-Clausiusa wynika , że podczas parowania i sublimacji ciśnienie pary nasyconej nad ciecząlub ciałem stałym wzrasta wraz z temperaturą. Równanie (13) służy do obliczania ciepła parowania , które trudno jest wyznaczyć doświadczalnie.
1.2. Rozprężanie gazów
Podczas politropowego rozprężania gazów doskonałych od stanu 1 do stanu 2, połączonego z wykonywaniem pracy zewnętrznej, następuje obniżenie temperatury :
(14)
gdzie :
![]()
-temperatura i ciśnienie gazu w stanie sprężonym,
![]()
-temperatura i ciśnienie powietrza po ekspansji,
m-wykładnik politropy;
Podczas rozprężania politropowego wymiana ciepła z otoczeniem nie następuje ,a entropia jest stała. W przemianie adiabatycznej wykładnik politropy m=k. W przypadku powietrza wielkość ta jest równa k=1,4.
Rys. 7. Przemiany politropowego rozprężania gazu w układzie temperatura - entropia .
Na wykresie przemiany politropowego rozprężania gazu w układzie T-s ( rys. 7) widać przemianę izentropową , reprezentowaną przez linię 1-2, a proces z dopływem ciepła przedstawia linia 1-2+. Proces z odbiorem ciepła od gazu przez otoczenie podaje linia 1-2-. W przypadku gazu doskonałego i przemiany izentropowej s=const. otrzymuje się :
![]()
(15)
W przypadku rozprężania gazu rzeczywistego wykonywana jest dodatkowa praca związana z pokonaniem sił wewnętrznych przyciągania się cząsteczek. Przy przepływie przez zwężenie następuje nagłe obniżenie ciśnienia,
zwane dławieniem. Zakłada się, że podczas tego procesu gaz nie wykonuje pracy zewnętrznej oraz pomija się zmianę energii kinetycznej gazu.W związku z dużą szybkością procesu dławienia nie następuje też wymiana ciepła między gazem a otoczeniem. Wobec tego dławienie jest procesem izentalpowym.
Ekspansja adiabatyczna gazu jest połączona z obniżeniem jego temperatury. Rozprężenie gazu połączone z wykonywaniem pracy zewnętrznej daje większy efekt temperaturowy niż dławienie. Zjawisko Jouele'a-Thomsona wykorzystywane jest w chłodnictwie do uzyskiwania bardzo niskich temperatur.
1.3. Efekt chłodniczy wirowy - rurka Ranque'a
Rurka Ranque'a służy do równoczesnego ochłodzenia oraz ogrzania gazu. Rurkę tę nazywa się czasem dynamiczną chłodziarką powietrza. Zasada działania rurki wykorzystuje przepływ wirowy, któremu towarzyszy temperaturowe rozdzielenie gazu. Doprowadzony z zewnątrz sprony gaz rozpręża się w dyszy i następnie wypływa z prędkością
200-400 m/s stycznie do ścianki rurki. Przepływ w przewodzie charakteryzuje się zarówno dużymi prędkościami stycznymi, jak i też ociosowymi.
Stopień obniżenia temperatury wyraża się stosunkiem spadku temperatury gazu w rurce do zmniejszenia temperatury w procesie adiabatycznej ekspansji przy takim samym zakresie ciśnień :
(16)
gdzie :
p1 , T1 - ciśnienie i temperatura gazu dopływającego do rurki
p2 , T2 - ciśnienie i temperatura gazu zimnego wypływającego z rurki
k - wykładnik adiabaty
Rurki Ranque'a charakteryzują się prostą konstrukcją i niezawodnością działania. Jednak ich zastosowanie ogrranicza niska sprawność energetyczna.
1.4. Przepływ prądu przez złącze dwóch metali
W obwodach elektrycznych dochodzi do stałych relacji między procesami cieplnymi a elektrycznymi. jednym z takich
zjawisk mace wpływ na ww relacje jest efekt Peltiera. Polega on na wydzieleniu lub pochłaniu ciepła na spojeniu dwóch różnych przewodnikach prądu, w zależności od kierunku przepływu prądu.Generowana wartość ciepła jest proporcjonalna od wartości natężenia przepływającego prądu. Współczynnik proporcjanalności zależy od temperatury spoiny oraz od rodzaju stykających się przewodników (lub półprzewodników). Wydzielenie lub pochłonięcie ciepła na spojeniu związane jest z przepływem ładunku elektrycznego przez nieciągłość potencjału wywołaną różnicą prac wyjścia elektronów z materiałów tworzących obwód elektryczny. W spojeniu, w którym ładunek przechodzi przez spadek potencjału następuje wydzielenie ciepła, a w przypadku odwrotnym jego pochłonięcie.
1.5. Rozmagnesowanie ciała stałego
Praca układu przeciwko siłom zewnętrznym w ciałach paramagnetycznybh wykonywana jest kosztem energii wewnętrznej. W związku z tym procesowi takiemu towarzyszy obniżenie temperatury.
Proces ten polega na umieszczeniu chłodzonego ciała w naczyniu próżniowym i namagnesowaniu za pomocą silnego pola magnetycznego. Po wyłączeniu pola następuje adiabatyczne rozmagnesowanie próbki, w czasie którego temperatura obniża się.
1.6. Desorpcja gazów
Podczas procesów sorpcyjnych następuje przenikanie masy na powierzchnię graniczących ze sobą faz. W zależności od mechanizmu pochłaniania wyróżnia się procesy absorpcyjne, adsorpcyjne i chemisorpcję. Adsorpcja polega na przenikaniu jednej fazy w głąb innej w procesie dyfuzji. Adsorpcja wiąże się z zagęszczeniem cząsteczek substancji na powierzchni pochłaniającego ciała. Chemisorpcja to powstawanie wiązań chemicznych między substancją pochłanianą a ciałem stałym. Prooces odwrotny nazywa się desorpcją.
Wymienionym procesom towarzyszą dodatnie bądż ujemne efekty cieplne. Ciepło sorpcji fizycznej jest niewielkie, natomiast chemisorpcji duże porównalne do efektu cieplnego odpowiedniej reakcji chemicznej.
Literatura
[1] Wacławik J., Cygankiewicz J., Knechtel J.: Warunki klimatyczne w kopalniach głębokich, Poradnik, PAN, Kraków 1995
Wyszukiwarka