Wstęp teoretyczny
Gdy do układu dwóch praktycznie nie mieszających się cieczy i rozpuszczalników doda się trzeciej cieczy (lub ciała stałego) rozpuszczonej w dwu pierwszych, wówczas po ustaleniu się stanu równowagi stosunek stężeń roztworów rozcieńczonych (lub aktywności w przypadku roztworów bardziej stężonych tego składnika) w obu fazach ciekłych jest wielkością stałą w danej temperaturze, zwaną współczynnikiem podziału Nernsta:
![]()
![]()
(1)
a1,2- aktywności substancji rozpuszczonej w pierwszej i drugiej cieczy,
C1,2- stężenie substancji rozpuszczonej w pierwszej i drugiej cieczy,
KD- współczynnik podziału Nernsta.
Stałość stosunku stężeń w równowadze podziału zachowana jest wyłącznie w przypadku spełnienia założenia, że substancja rozpuszczona występuje w obu rozpuszczalnikach w postaci identycznych cząsteczek, a roztwór jest rozcieńczony.
Jeżeli w jednej z faz ciekłych następuje asocjacja lub dysocjacja cząsteczek substancji rozpuszczonej, wówczas wartość współczynnika podziału przestaje być stała. W tym przypadku współczynnik Nernsta można przedstawić następująco:
![]()
(2)
n - stosunek masy cząsteczkowej M1 substancji rozpuszczonej w pierwszej cieczy do masy cząsteczkowej M2 tejże substancji rozpuszczonej w drugiej cieczy.
Istnieją również układy, w których substancja rozpuszczona występuje w postaci kilku rodzajów cząsteczek. W tym przypadku ustala się równowaga podziału tej substancji między dwie fazy i równowaga asocjacji (dysocjacji) w danej fazie. Prawo podziału należy wówczas stosować do każdego rodzaju cząsteczek z osobna.
Zależność współczynnika podziału od temperatury ujmuje wzór izobary Van`t Hoffa:
![]()
(3)
gdzie: HD jest entalpią przejścia 1 mola danej substancji z jednej fazy ciekłej do drugiej.
Po scałkowaniu powyższej zależności przy założeniu, że HD jest niezmienne w badanym zakresie temperatur, otrzymuje się wyrażenie:
![]()
(4)
Wyznaczywszy eksperymentalnie stałą podziału dla różnych, lecz niezbyt odległych od siebie temperatur, można wyliczyć HD w oparciu o wzór:

Tabele pomiarowe i obliczenia przykładowe
Aby móc przystąpić do ćwiczenia musieliśmy wykonać odpowiednie ilości (1 l) roztworu CH3COOH. Korzystając ze wzorów
![]()
i po ich odpowiednim przekształceniu policzyliśmy stężenie molowe roztworu CH3COOH
![]()
i ilość potrzebną do wykonania roztworów o odpowiednich stężeniach molowych
Roztwór wyjściowy |
Warstwa wodna po ustaleniu się równowagi |
Stężenie C1 |
logC1 |
a2=a1-b1 |
Stężenie C2
|
logC2
|
KD |
||||
Lp |
Objętość zużytego odczynnika a1 [ml] |
Średnie a1 |
Lp. |
Objętość zużytego odczynnika b1 [ml] |
Średnie b1 |
|
|
|
|
|
|
1 |
2,00 2,40 2,30 |
2,23 |
1 |
1,20 1,40 1,30 |
1,30 |
0,112 |
-0,952 |
0,933 |
0,047 |
-1,331 |
2,39 |
2 |
4,80 4,70 5,00 |
4,83 |
2 |
2,50 2,80 3,00 |
2,77 |
0,242 |
-0,617 |
2,067 |
0,103 |
-0,986 |
2,34 |
3 |
8,10 8,40 8,30 |
8,27 |
3 |
3,80 3,60 3,80 |
3,73 |
0,413 |
-0,384 |
4,533 |
0,227 |
-0,645 |
1,82 |
4 |
11,10 10,90 10,20 |
10,73 |
4 |
4,30 4,10 4,40 |
4,27 |
0,537 |
-0,270 |
6,467 |
0,323 |
-0,490 |
1,66 |
Po obliczeniu średniej z trzech pomiarów miareczkowania obliczyliśmy stężenie c1 z wzoru
c1=objętość zużytego odczynnika*stężenie odczynnika / objętość próbki
z uwagi na fakt, że zarówno wykres zależności ![]()
oraz ![]()
są nie liniowe dlatego posłużyłem się zależnością poniżej przedstawioną w celu obliczenia stałej podziału.
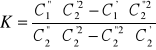
K=2,44
Wnioski
Z uwagi na fakt, że doświadczenie przeprowadzaliśmy tylko w jednej temperaturze nie było możliwości obliczenia HD. Wykresy dały możliwość zaobserwowania tego iż oprócz równowagi podziału ustaliła się równowaga asocjacji(lub też dysocjacji) substancji badanej w jednej z warstw. Obydwa wykresy nie są idealnymi prostymi, ale pierwszy przypadek (c1=f(c2)) jest prawie linią prostą gdy nie weźmie się pod uwagę pierwszego jej odcinka.
Wyszukiwarka