19.5 Pomiary pH i wyznaczanie stałej dysocjacji.
Wykonanie ćwiczenia.
a) Włączyć pH-metr przyciskiem "~". Do naczyńka pomiarowego z tworzywa wlać do 1/3 wysokości roztwór buforowy o pH = 4,0. Przycisnąć metalowy uchwyt i ostrożnie wyjąć elektrodę pomiarową z kolbki stożkowej. Opłukać ją woda destylowana z tryskawki podstawiając pod spód zlewkę. Następnie zanurzyć ją do naczyńka z roztworem buforowym i sprawdzić czy wyświetlacz wskazuje właściwe pH. Ewentualną różnicę skorygować potencjometrem "bufor" z dokładnością 0,05 jednostki. Po zakończeniu skalowania roztwór buforowy wlać z powrotem do butelki a elektrodę i naczyńko pomiarowe starannie przepłukać wodą z tryskawki.
b) Zmierzyć pH wody wodociągowej wlewając do naczyńka dla każdego pomiaru nową jej porcję. Pomiar zakończyć gdy wyniki trzech kolejnych próbek różnią się nie więcej niż 0,05 jednostki. Czas pomiaru każdej próbki ograniczyć do około 0,5 minuty.
c) Zmierzyć pH wody destylowanej postępując jak wyżej.
d) Z otrzymanych roztworów kwasu i soli sporządzić roztwory buforowe odmierzając starannie do małych kolbek stożkowych przy pomocy dwóch pipet o pojemności 5 cm3 (oddzielnej dla kwasu i soli) następujące objętości:
Kolbka Nr. |
Roztwór kwasu |
Roztwór soli |
1 |
5 cm3 (jedna pipeta) |
20 cm3 (cztery pipety) |
2 |
10 cm3 (dwie pipety) |
10 cm3 (dwie pipety) |
3 |
20 cm3 (cztery pipety) |
5 cm3 (jedna pipeta) |
Roztwory starannie wymieszać. Wlać niewielką porcję cieczy do naczyńka pomiarowego i przez zanurzenie przepłukać w niej elektrodę. Wlać do naczyńka nową porcję roztworu i zmierzyć jego pH.Obliczyc stałą dysocjacji oddzielnie dla kazdego roztworu posługując się wzorem:
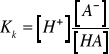
gdzie: [A-] - stężenie soli, [HA] - stężenie kwasu.
Z otrzymanych wyników obliczyć średnią arytmetyczną i wpisać ją do tabelki sprawozdania.
Przykład obliczenia:
W kolbce 1 zmieszano jedna porcję kwasu i cztery porcje jego soli.
Stosunek stężęnia soli do kwasu wynosi: ![]()
Z pomiaru pH tej mieszaniny otrzymano pH = 5,6
Z definicji pH = -log[H+]
Podstawiamy w miejsce pH dane z pomiaru: -log[H+] = 5,6 ; log[H+] = -5,6 = ![]()
i obliczamy [H+].
Obliczając liczbę logarytmowaną przy pomocy tablic należy posługiwać się wartością ![]()
a przy pomocy kalkulatora posiadającego funkcje 10 x wartość -5,6
[H+] = 2,5 * 10-6 stąd K1 = 2,5 * 10-6* 4
Podobnie obliczamy pozostałe wartości stałych K2 i K3. Średnią obliczamy ze wzoru:
![]()
Wyszukiwarka