KOD ZDAJ¥CEGO
MCH-W1A1P-021
EGZAMIN MATURALNY
Z CHEMII
Arkusz I
Czas pracy 90 minut
Instrukcja dla zdaj¹cego
1.
Proszê sprawdziæ, czy arkusz egzaminacyjny zawiera 12 stron.
Ewentualny brak nale¿y zg³osiæ przewodnicz¹cemu zespo³u
nadzoruj¹cego egzamin.
2.
Do arkusza do³¹czone s¹ dwie karty sta³ych chemicznych.
Proszê je zatrzymaæ po zakoñczeniu pracy z arkuszem I.
Bêd¹ one s³u¿yæ równie¿ do pracy z arkuszem II.
3.
Proszê uwa¿nie czytaæ wszystkie polecenia i informacje do
zadañ.
4.
Rozwi¹zania i odpowiedzi nale¿y zapisaæ czytelnie w miejscu
na to przeznaczonym przy ka¿dym zadaniu.
5.
W rozwi¹zaniach zadañ rachunkowych trzeba przedstawiæ tok
rozumowania prowadz¹cy do ostatecznego wyniku oraz
pamiêtaæ o jednostkach.
6.
W trakcie obliczeñ mo¿na korzystaæ z kalkulatora.
7.
Proszê pisaæ tylko w kolorze niebieskim lub czarnym; nie pisaæ
o³ówkiem.
8. Nie
wolno u¿ywaæ korektora.
9.
B³êdne zapisy trzeba wyranie przekreliæ.
10.
Brudnopis nie bêdzie oceniany.
11.
Obok ka¿dego zadania podana jest maksymalna liczba
punktów, któr¹ mo¿na uzyskaæ za jego poprawne rozwi¹zanie.
12.
Do ostatniej kartki arkusza do³¹czona jest karta odpowiedzi,
któr¹ wype³nia egzaminator.
¯yczymy powodzenia !
ARKUSZ I
MAJ
ROK 2002
Za rozwi¹zanie
wszystkich zadañ
mo¿na otrzymaæ
³¹cznie 40 punktów
(Wpisuje zdaj¹cy przed rozpoczêciem pracy)
PESEL ZDAJ¥CEGO
Miejsce
na naklejkê
z kodem
(Wpisuje zdaj¹cy przed
rozpoczêciem pracy)
Zadanie 1. (1 pkt)
Liczba cz¹stek elementarnych w atomie
56
26
E wynosi:
liczba
elektronów
liczba neutronów liczba protonów
A.
30 26 26
B.
26 26 30
C.
30 30 26
D.
26 30 26
Zadanie 2. (1 pkt)
Konfiguracjê elektronow¹ 1s
2
2s
2
2p
6
3s
2
3p
6
maj¹ atomy i jony:
A.
Mg
2+
, Cl
-
, K
+
B.
Ar , S
2-
, K
+
C.
Ar , Na
+
, K
+
D.
S
2-
, Mg
2+
,
Cl
-
Informacja do zadañ 3. i 4.
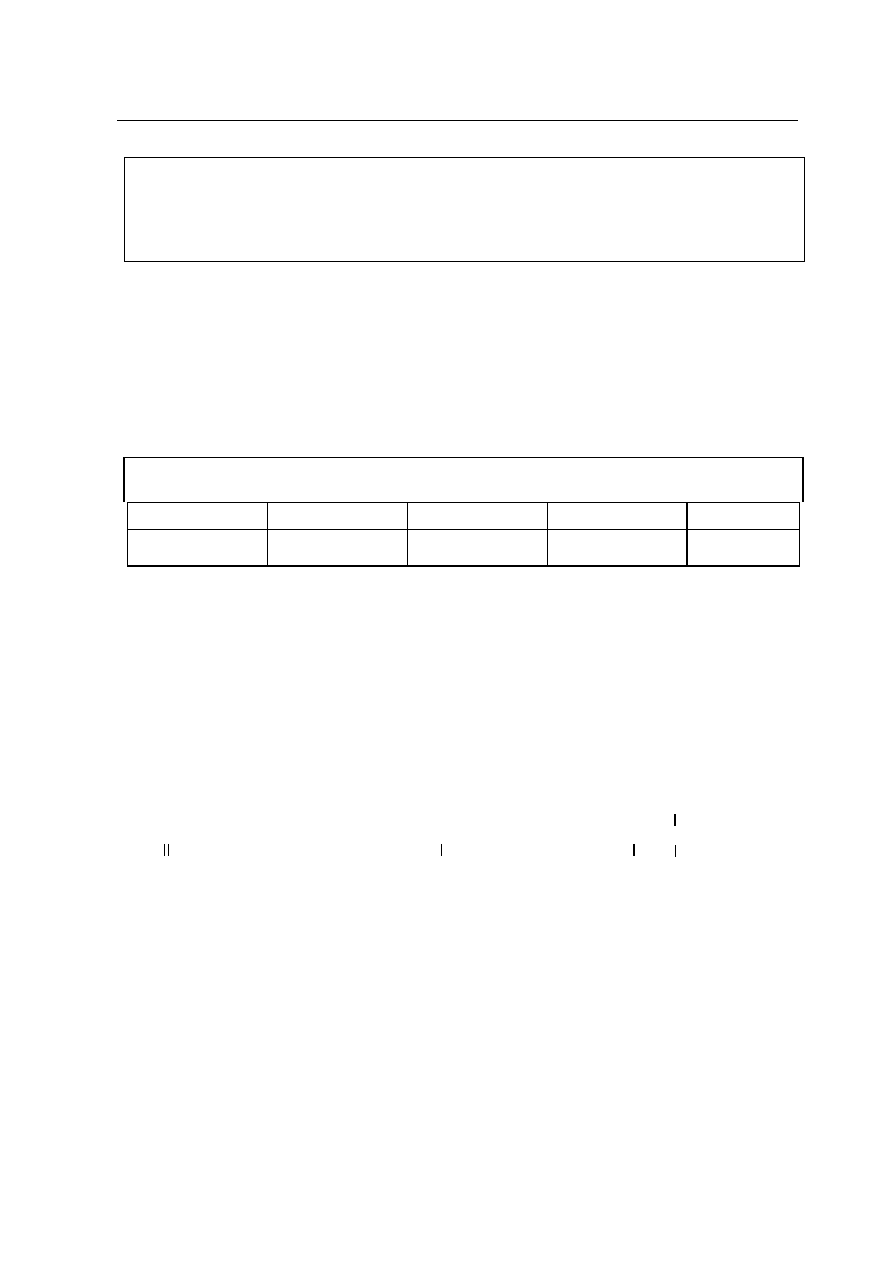
Przedstawicielem alkenów jest propen o wzorze grupowym:
1 2 3
CH
2
= CH – CH
3
Zadanie 3.
(1 pkt)
W cz¹steczce propenu wystêpuje nastêpuj¹ca liczba wi¹zañ ó i ð:
wi¹zania ó wi¹zania ð
A.
5 1
B.
6 1
C.
8 1
D.
9 0
Zadanie 4. (1 pkt)
Stopnie utlenienia atomów wêgla 1, 2, 3 w cz¹steczce propenu wynosz¹:
stopnie utlenienia atomów wêgla
1 2 3
A.
-II -I -III
B.
II I III
C.
-II -III -I
D
II III I
2
Egzamin maturalny z chemii
Arkusz I
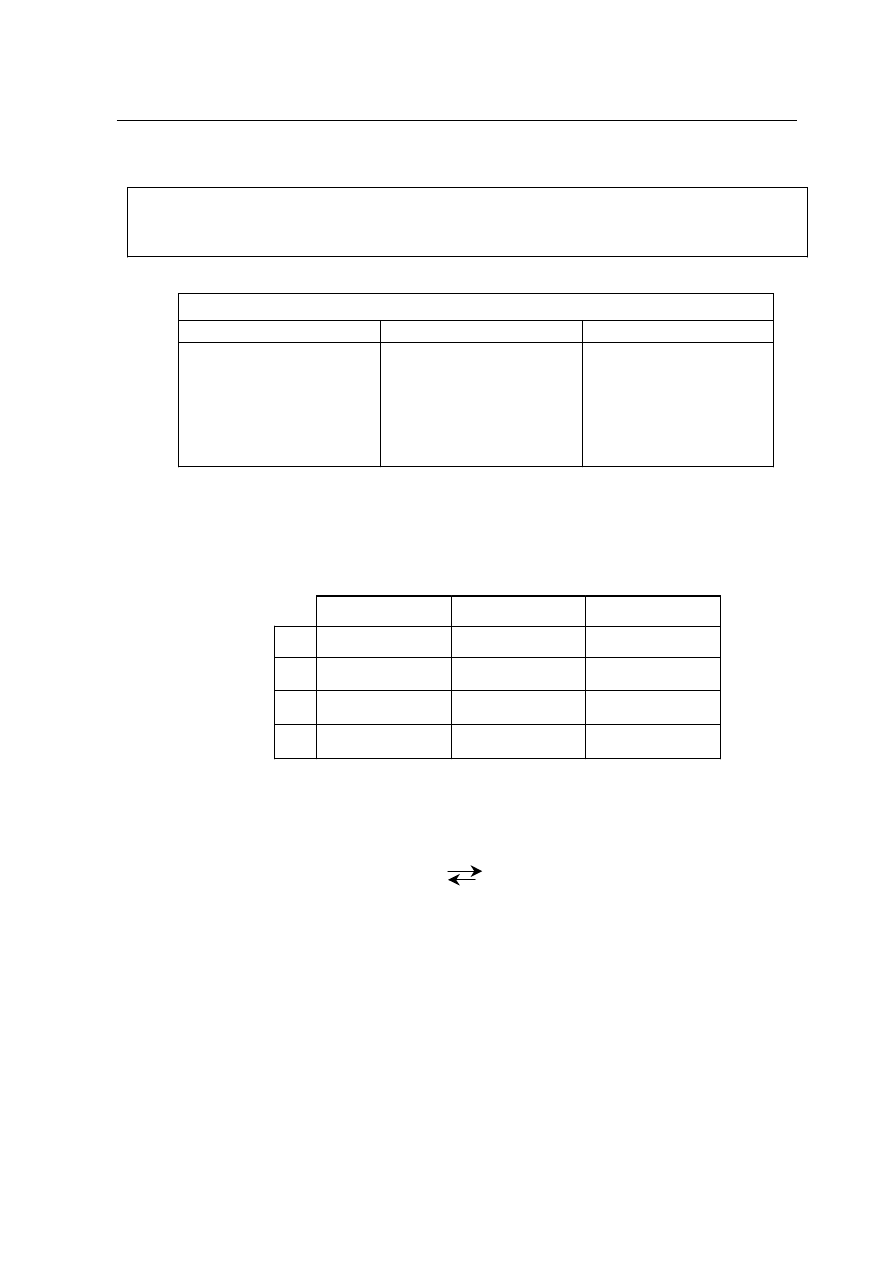
Informacja do zadania 5.
Uczeñ otrzyma³ w trzech probówkach substancje: kwas octowy (etanowy), etanal i etanol.
W
celu identyfikacji substancji wykona³ szereg dowiadczeñ, a wyniki zestawi³ w tabeli:
substancje w probówkach
I II
III
•
nie reaguje z wodorotlen-
kiem miedzi(II)
•
reaguje z sodem
•
po podgrzaniu tworzy
z
substancj¹ z probówki II
wobec stê¿. H
2
SO
4
zwi¹zek
o przyjemnym zapachu
•
tworzy z wodorotlenkiem
miedzi(II) niebieski, kla-
rowny roztwór
•
barwi papierek uniwersal-
ny na kolor czerwony
•
reaguje z wodorotlen-
kiem miedzi(II), tworz¹c
po ogrzaniu ceglastopo-
marañczowy osad
Zadanie 5. (1 pkt)
Wybierz odpowied, w której przedstawiono prawid³ow¹ identyfikacjê substancji
w probówkach I, II, III.
I
II
III
A.
kwas octowy
etanol
etanal
B.
etanol
etanal
kwas octowy
C.
etanol
kwas octowy
etanal
D.
etanal
kwas octowy
etanol
Zadanie 6. (1 pkt)
Aby przesun¹æ stan równowagi reakcji
HCOOH + C
2
H
5
OH HCOOC
2
H
5
+ H
2
O
w kierunku tworzenia estru nale¿y:
A.
dodaæ wody,
B.
zmniejszyæ stê¿enie kwasu mrówkowego,
C.
od
destylowaæ ze rodowiska reakcji mrówczan etylu,
D.
zmniejszyæ iloæ alkoholu etylowego.
Egzamin maturalny z chemii
3
Arkusz I
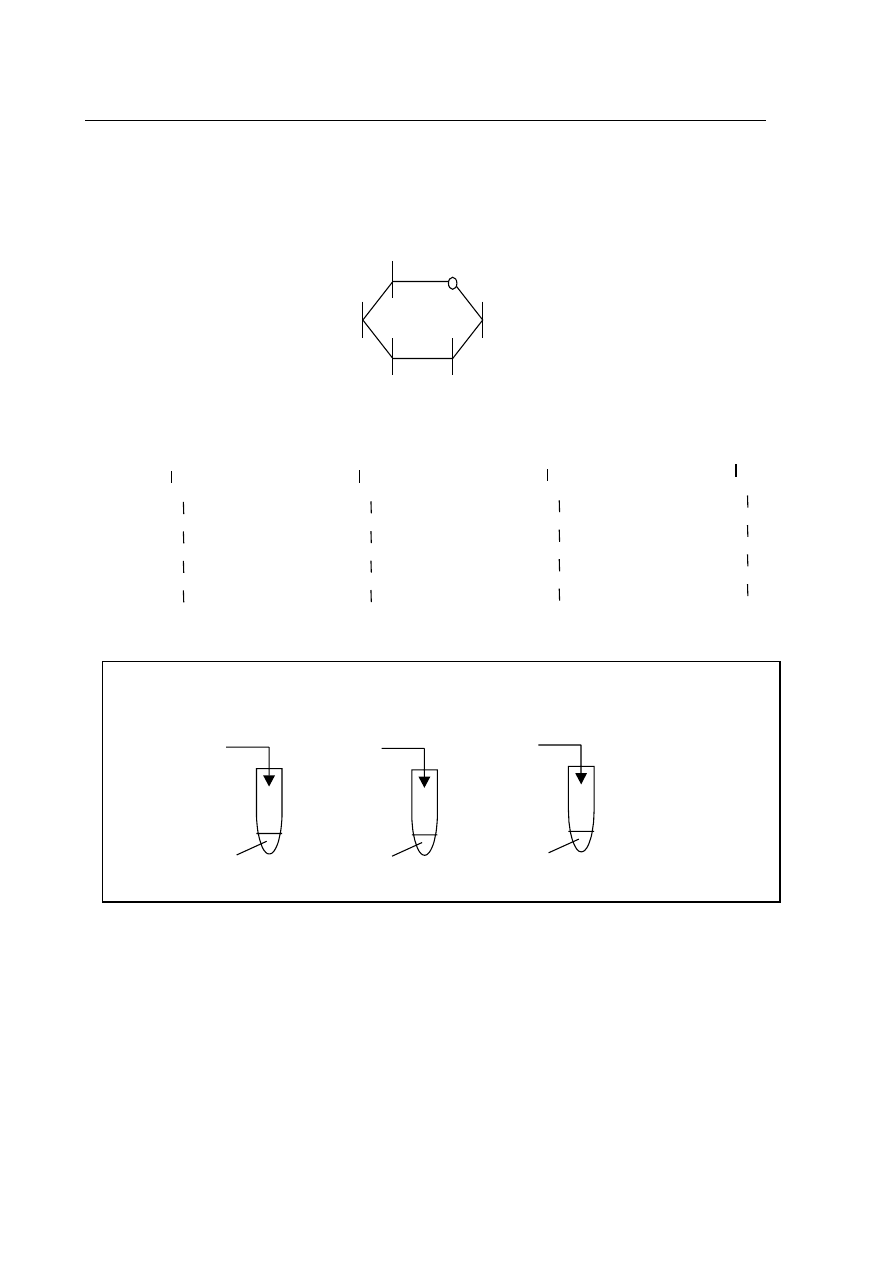
Zadanie 7. (1 pkt)
Wzorowi Hawortha (I
) dla formy piercieniowej cukru przyporz¹dkuj w³aciwy wzór
Fischera (A, B, C lub D
) dla formy ³añcuchowej.
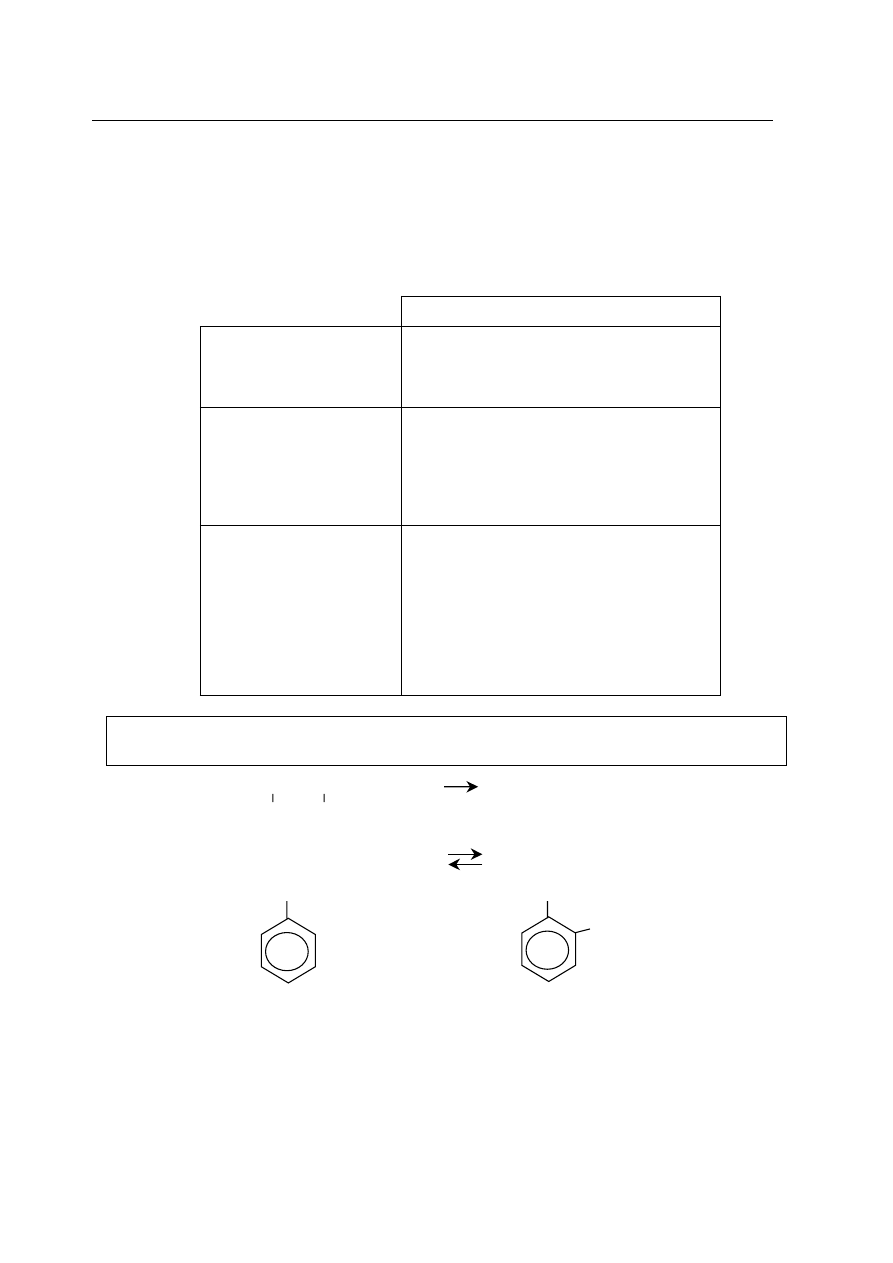
Informacja do zadania 8.
W laboratorium przeprowadzono dowiadczenia (jak pokazano na rysunku), w wyniku
których otrzy
mano zwi¹zki chemiczne:
Zadanie 8. (3 pkt)
Napisz w formie jonowej równania reakcji chemicznych zachodz¹cych w probówkach: I, II i III.
Równanie I .............................................................................................................................
Równanie II ............................................................................................................................
Równanie III ...........................................................................................................................
H
2
O
KOH
(aq)
Na
2
O
H
2
SO
4(aq)
NaOH
(aq)
FeCl
3(aq)
II
I
III
CHO
H – C – OH
HO – C – H
HO – C – H
H – C – OH
CH
2
OH
CHO
H – C – OH
HO – C – H
H – C – OH
HO – C – H
CH
2
OH
CHO
H – C – OH
HO – C – H
H – C – O H
H – C – OH
CH
2
OH
CHO
HO– C – H
H – C – O H
HO – C – H
HO – C – H
CH
2
OH
A.
C.
B.
D.
CH
2
OH
OH
OH
OH
OH
H
H
H
H
H
I
4
Egzamin maturalny z chemii
Arkusz I

Informacja do zadania 9.
Sporz¹dzono dwa wodne roztwory soli:
siarczanu(VI) sodu,
azotanu(III) sodu.
Zadanie 9. (3 pkt)
Który z wy¿ej wymienionych roztworów soli nie bêdzie mia³ odczynu obojêtnego? Uzasadnij
odpowied i napisz w formie jonowej skróconej równanie odpowiedniej reakcji chemicznej.
..................................................................................................................................................
..................................................................................................................................................
..................................................................................................................................................
Równanie .................................................................................................................................
Zadanie 10. (3 pkt)
Wyjanij, jak zmieni siê pH wody po rozpuszczeniu w niej siarkowodoru.
Uzasadnij swoj¹ odpowied i zapisz w formie jonowej równanie zachodz¹cej reakcji.
..................................................................................................................................................
..................................................................................................................................................
..................................................................................................................................................
Równanie ................................................................................................................................
Informacja do zadania 11.
Na ska
lê przemys³ow¹ chlorek miedzi(II) mo¿na otrzymaæ, miêdzy innymi, w wyniku reakcji
siarczanu(VI) miedzi(II) z chlorkiem baru.
Zadanie 11. (3 pkt)
Napisz równanie reakcji otrzymywania chlorku miedzi(II) podan¹ w informacji metod¹.
Wyja
nij, dlaczego w tym procesie stosuje siê chlorek baru, a nie mo¿na stosowaæ tañszej soli
kamiennej (chlorek sodu).
Równanie .................................................................................................................................
..................................................................................................................................................
..................................................................................................................................................
..................................................................................................................................................
..................................................................................................................................................
..................................................................................................................................................
Egzamin maturalny z chemii
5
Arkusz I

Informacja do zadania 12.
W pracowni chemicznej otrzymuje siê chlor w wyniku utleniania kwasu solnego. Reakcja
przebie
ga wed³ug równania:
2KMnO
4
+ 16HCl 2KCl + 2MnCl
2
+ 5Cl
2
+ 8H
2
O
Zadanie 12. (3 pkt)
Oblicz, ile gramów manganianu(VII) potasu wzi
ê³o udzia³ w reakcji z kwasem solnym, je¿eli
powsta³o 5,6 dm
3
chloru odmierzonego w warunkach normalnych?
Informacja do zadania 13.
W pewnych warunkach równowaga reakcji:
2N
2
+ O
2
2N
2
O
ustali³a siê przy nastêpuj¹cych stê¿eniach: [N
2
]=0,72 mol
.
dm
-3
, [O
2
]=1,12 mol
.
dm
-3
,
[N
2
O]=0,84 mol
.
dm
-3
.
Zadanie 13. (2 pkt)
Oblicz sta³¹ równowagi dla podanej w informacji reakcji chemicznej.
6
Egzamin maturalny z chemii
Arkusz I
Informacja do zadania 14.
Podczas spalania wêgla na potrzeby energetyki powstaj¹ py³y, które zaliczane s¹ do
pierwot
nych zanieczyszczeñ powietrza. Py³y nie zatrzymane przez urz¹dzenia odpylaj¹ce
wydostaj¹ siê do atmosfery i tworz¹ dymy zanieczyszczaj¹ce rodowisko naturalne. Dym
jest uk³adem dyspersyjnym.
Zadanie 14. (2 pkt)
Okrel, który sk³adnik dymu jest faz¹ rozpraszaj¹c¹ (dyspersyjn¹), a który faz¹ rozproszon¹
(zdysper
gowan¹).
Faza rozpraszaj¹ca ...............................................................................................................
Faza rozproszona ..................................................................................................................
Informacja do zadania 15.
W tabeli przedstawio
no rozpuszczalnoæ chlorku potasu .
T [K]
273
293
298
313
Rozpuszczalnoæ
[g w 100g H
2
O ]
27,78
34,03
35,54 40,04
Zadanie 15. (1 pkt)
Okrel, jaki roztwór (nasycony, nienasycony) powstanie, je¿eli rozpuci siê 16 g chlorku
potasu w 50g wody w T=298K.
..................................................................................................................................................
..................................................................................................................................................
Zadanie 16. (3 pkt)
Podaj nazwy systematyczne (IUPAC) zwi¹zków:
CH
3
CH
3
– C – CH
2
– CH
2
– CH
3
CH
3
– CH
2
– CH – COOH
CH
3
– CH – C – CH
2
– CH
3
O
NH
2
CH
3
CH
3
I
II
III
Nazwa zw
i¹zku I ..................................................................................................................
Nazwa zwi¹zku II ................................................................................................................
N
azwa zwi¹zku III ...............................................................................................................
Egzamin maturalny z chemii
7
Arkusz I
Zadanie 17. (3 pkt)
Podaj wzory grupowe (pó³strukturalne) alkoholi:
a) 2-metylopentan-3-olu,
b) 2-metylopropan-2-olu,
c) 3-metylobutan-1-olu,
zapisuj¹c je w odpowiednim miejscu tabeli.
wzór grupowy alkoholu
alkohol I-
rzêdowy
alkohol II-
rzêdowy
alkohol III-
rzêdowy
Informacja do zadania 18.
Dane s¹ równania reakcji:
A. CH
2
– CH – CH
3
+ Zn CH
2
= CH – CH
3
+ ZnCl
2
Cl Cl
B. CH
3
COOH + C
2
H
5
OH
CH
3
COOC
2
H
5
+ H
2
O
CH
3
CH
3
Br
C. + Br
2
→
3
FeBr
+ HBr
Zadanie 18. (2 pkt)
Z podanych równañ reakcji A, B, C wybierz te, które przedstawiaj¹ reakcjê substytucji
i
reakcjê eliminacji.
Reakcja substytucji ...............
Reakcja eliminacji ................
H
+
8
Egzamin maturalny z chemii
Arkusz I
Informacja do zadañ 19. i 20.
Kwas salicylowy ma w³aciwoci antyseptyczne. Alkoholowy roztwór tego kwasu pod
nazw¹ spirytusu salicylowego u¿ywany jest do dezynfekcji. Pochodne kwasu salicylowego,
np. aspiryna, salol, PAS to leki.
Zadanie 19. (2 pkt)
Obl
icz, ile gramów kwasu salicylowego potrzeba do sporz¹dzenia 250 gramów 2% spirytusu
salicylowego.
Zadanie 20. (2 pkt)
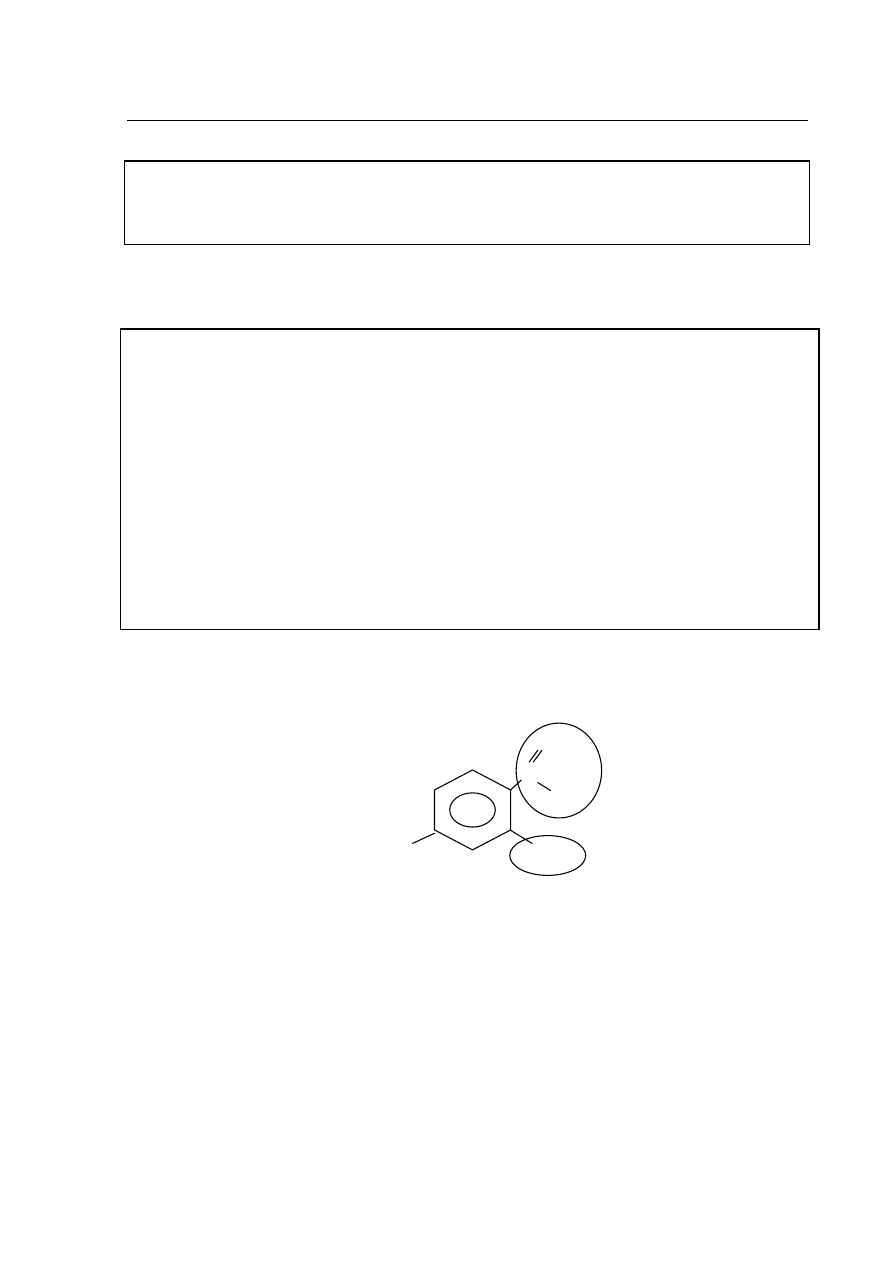
Lek przeciwgruliczy PAS ma wzór:
Podaj nazwy zaznaczonych grup.
Nazwa grupy
A
.................................................................................................................
Nazwa grupy
B
.................................................................................................................
H
2
N
OH
OH
O
C
A
B
Egzamin maturalny z chemii
9
Arkusz I
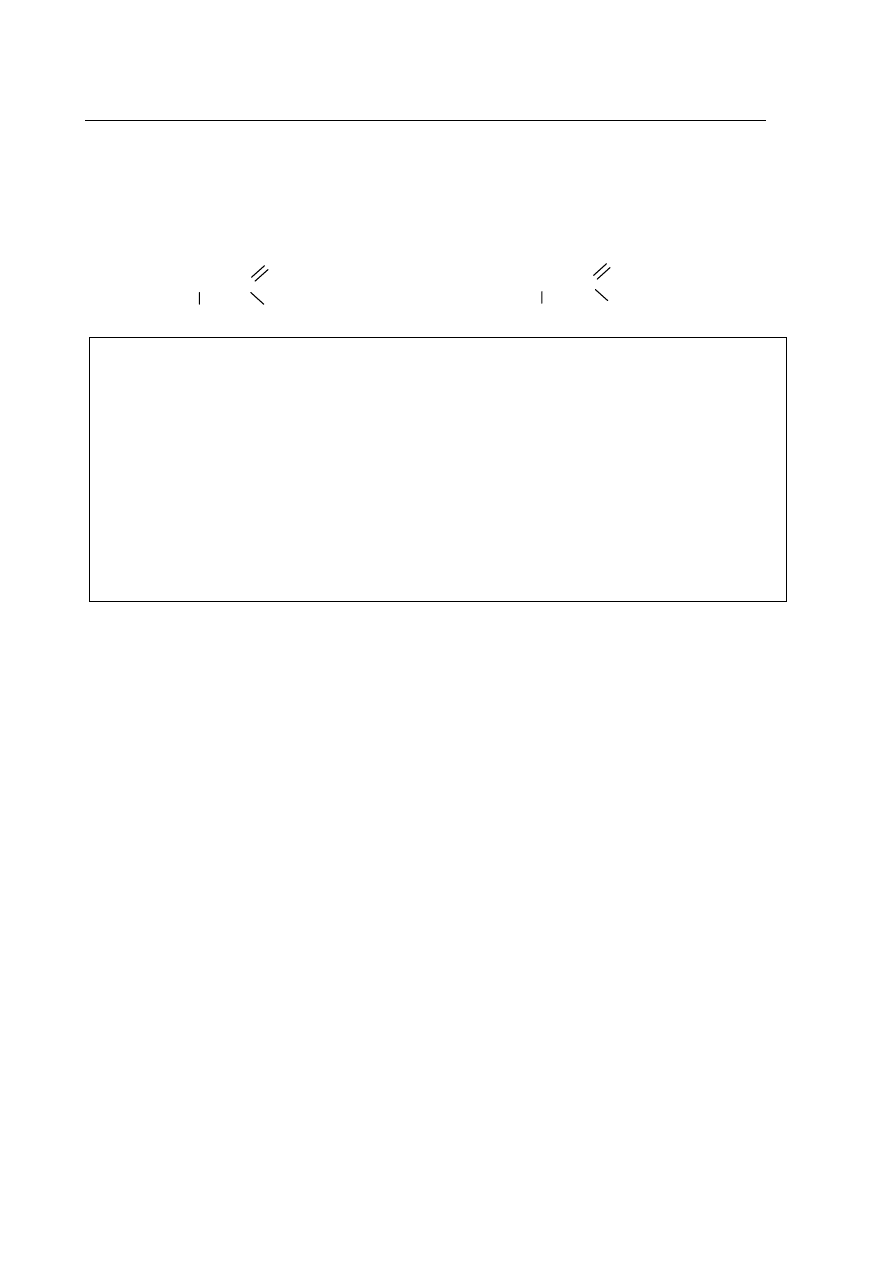
Zadanie 21. (1 pkt)
Utwórz wzór grupowy (pó³strukturalny) dipeptydu powsta³ego w wyniku polikondensacji
aminokwasów:
O
O
CH
3
- CH – C HO - CH
2
– CH – C
OH
OH
NH
2
NH
2
10
Egzamin maturalny z chemii
Arkusz I

ARKUSZ I
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
•
Zdaj¹cy otrzymuje punkty tylko za ca³kowicie prawid³ow¹ odpowied.
•
Gdy do jednego polecenia s¹ dwie odpowiedzi (jedna prawid³owa, druga nieprawid³owa )
to zdaj¹cy nie otrzymuje punktów.
•
Je¿eli polecenie brzmi: Napisz równanie reakcji...,to w odpowiedzi zdaj¹cy powinien
napisaæ równanie reakcji chemicznej, a nie jej schemat.
•
Brak wspó³czynników w równaniu reakcji chemicznej obni¿a punktacjê o 1 pkt, je¿eli
punktacja za równanie jest równa 2 pkt.
•
Brak jednos
tek przy rozwi¹zaniu zadañ rachunkowych obni¿a punktacjê o 1 punkt.
•
Ca³kowicie poprawne rozwi¹zanie zadañ rachunkowych, uwzglêdniaj¹ce inny tok
rozumowania ni¿ w podanym opisie, nale¿y oceniæ pe³n¹ liczb¹ punktów.
Punktacja
Nr
zad.
Przewidywana odpowied
Za
czyn
noæ
Suma-
rycznie
1.
Odpowied: D 1
1
2.
Odpowied: B
1 1
3.
Odpowied: C
1 1
4.
Odpowied: A
1 1
5.
Odpowied: C 1
1
6.
Odpowied: C 1
1
7.
Odpowied: C lub B 1
1
8.
Za ka¿de prawid³owo napisane równanie reakcji po 1 pkt.
Równanie I Na
2
O + H
2
O 2Na
+
+ 2 OH
-
Równanie II OH
-
+ H
+
H
2
O
lub 2H
+
+ SO
4
2-
+ 2K
+
+ 2OH
-
2K
+
+ SO
4
2-
+ 2H
2
O
lub H
+
+ HSO
4
-
+ K
+
+ OH
-
K
+
+ HSO
4
-
+ H
2
O
Równanie III Fe
3+
+ 3 OH
-
Fe(OH)
3
lub Fe
3+
+ 3Cl
-
+ 3Na
+
+ 3OH
-
3Na
+
+ 3Cl
-
+ Fe(OH)
3
1
1
1
3
Za odpowied: Nie bêdzie mia³ odczynu obojêtnego roztwór
azotanu(III) sodu”; (nazwa lub wzór soli).
1
Za uzasadnienie np. „Azotan(III) sodu ulega w wodzie hydrolizie”
lub „siarczan(VI) sodu nie hydrolizuje” lub inne poprawne
uzasadnienie.
1
9.
Za napisanie równania reakcji: NO
−
2
+ H
2
O HNO
2
+ OH
−
1
3
Za okrelenie zmiany pH typu: pH zmaleje lub pH zmniejszy siê.
1
Za wyjanienie s³owne np.: W wyniku reakcji siarkowodoru z wod¹
wzronie stê¿enie jonów H
+
lub powstaje kwas lub powstaj¹ jony
H
3
O
+”.
1
10.
Za napisanie równania reakcji np.: H
2
S H
+
+ HS
−
lub
H
2
S 2H
+
+ S
2-
lub H
2
S + H
2
O H
3
O
+
+ HS
−
lub
H
2
S + 2H
2
O 2H
3
O
+
+ S
2
−
1
3
11
Egzamin maturalny z chemii
Arkusz I
Za napisanie równania reakcji :CuSO
4
+ BaCl
2
CuCl
2
+ BaSO
4
lub pe³ne równanie jonowe.
1
11.
Za wyjanienia np.:
Stosuj¹c chlorek baru powstaje trudnorozpuszczalny osad.
Stosuj¹c NaCl otrzyma siê roztwór zawieraj¹cy mieszaninê jonów.
1
1
3
Za obliczenie masy molowej KMnO
4
(158 g?mol
-1
).
1
Za obliczenie na podstawie równania reakcji.
1
12.
Za poprawny wynik wraz z jednostk¹ (15,8g).
1
3
Za zapis wyra¿enia
K
=
12
,
1
)
72
,
0
(
)
84
,
0
(
2
2
⋅
1
13.
Za obliczenie wyniku
1,215 (nie wymagane jest podanie jednostek).
1
2
14.
Za ka¿d¹ prawid³owo wskazan¹ fazê 1 pkt.
Faza rozpraszaj¹ca – gaz lub powietrze lub mieszanina gazów.
Faza rozproszona –
py³ lub sta³e zanieczyszczenia lub sadza, wêgiel,
„C”.
1
1
2
15.
Odpowied: roztwór nienasycony.
1 1
16.
Za ka¿d¹ poprawn¹ nazwê zwi¹zku 1 pkt.
Nazwa zwi¹zku I pentan-2-on (2-pentanon)
Nazwa zwi¹zku II kwas 2-aminobutanowy
Nazwa zwi¹zku III 2,3,3-trimetylopentan
1
1
1
3
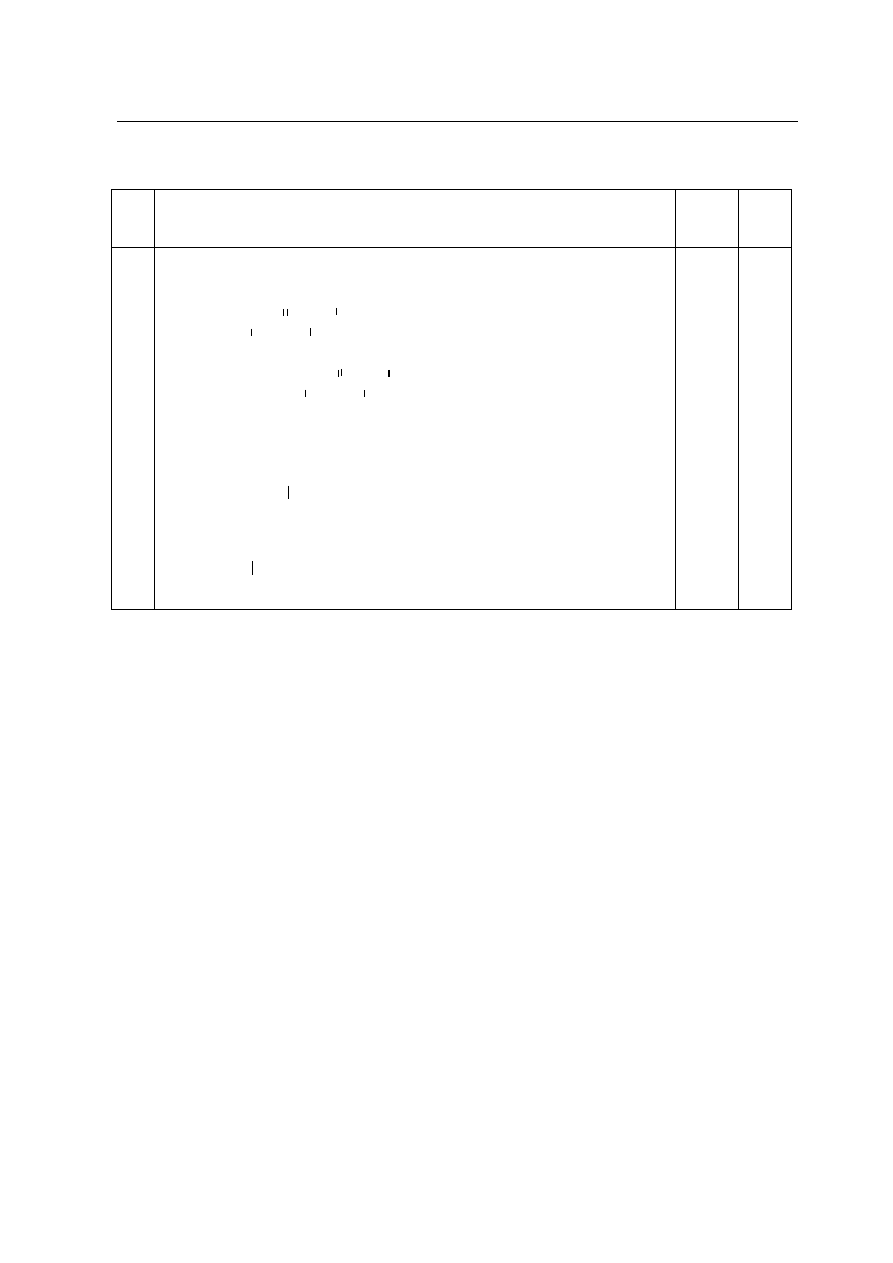
Za poprawnie podane trzy wzory 2 pkt, za poprawnie podane dwa
wzory – 1 pkt,
za poprawne przyporz¹dkowanie rzêdowoci 1 pkt.
CH
3
– CH – CH
2
– CH
2
alkohol I-
rzêdowy | |
CH
3
OH
alkohol II-
rzêdowy CH
3
– CH – CH – CH
2
– CH
3
| |
CH
3
OH
17.
CH
3
|
alkohol III-
rzêdowy CH
3
– C – CH
3
|
OH
3
Reakcja substytucji: C lub B lub C i B.
1
18.
Reakcja eliminacji: A.
1
2
Za prawid³owe obliczenie masy substancji rozpuszczonej.
1
19.
Za poprawn¹ wartoæ liczbow¹ wraz z jednostk¹ (5g).
1
2
2
Egzamin maturalny z chemii, maj 2002 r.
Arkusz I
20.
Za ka¿d¹ prawid³owo nazwan¹ grupê 1pkt.
Nazwa grupy A - grupa karboksylowa.
Nazwa grupy B - grupa hydroksylowa lub wodorotlenowa.
1
1
2
21. Za podanie wzoru dipeptydu
O CH
2
OH
CH
3
– CH – C – N – CH – COOH
NH
2
H
O CH
3
lub HO – CH
2
– CH – C – N – CH – COOH
NH
2
H
lub produkty kondensacji dwóch cz¹steczek
HO – CH
2
– CH – COOH
NH2
lub produkty kondensacji dwóch cz¹steczek.
CH
3
– CH – COOH
NH2
1
1
Egzamin maturalny z chemii, maj 2002 r.
3
Arkusz I
Wyszukiwarka
Podobne podstrony:
chemia matura maj 2005 arkusz 2 56UX3BDIJHTIJZIJ3U3GBS
Matematyka Matura Maj 2002 Arkusz 1
Fizyka Matura Maj 2002 Arkusz 2 (2)
chemia matura maj 2005 arkusz 1 AHSWEJB3G5ZHA6H3ADSLFU
Matematyka Matura Maj 2002 Arkusz 2
fizyka matura maj 2002 arkusz 1 66IITMLZEE2P6AFAKADBFT
Matematyka Matura Maj 2002 Arkusz 1
Matematyka Matura Maj 2002 Arkusz 2
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
Matematyka Matura Maj 2003 Arkusz 2
chemia-matura-styczeń 2001, arkusz 2
chemia matura styczen 2005 arkusz 1 Q3GMLEHQH36EPLCUOQ7DNK
Matematyka Matura Maj 2003 Arkusz 1
chemia matura styczen 2003 arkusz 2 DOOLNKVR7PUVYFDVTTSM5B
Matematyka Matura Maj 2005 Arkusz 1
Matematyka Matura Maj 2005 Arkusz 2
chemia matura styczen 2003 arkusz 1 7NL7HMDRBPQUD5O26HUGWX
stara matura maj 2002 lubelskie model odpowiedzi
więcej podobnych podstron