
15. Metabolizm węglowodorów (ropy
naftowej)
Prof.dr hab. inż. Korneliusz Miksch
Silesian University of Technology, Gliwice, Poland
Environmental Biotechnology Department

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Skład ropy naftowej
Ropa naftowa stanowi złożoną, wieloskładnikową mieszaninę
związków chemicznych. Podstawową jej masę stanowią
węglowodory: parafinowe, naftenowe i aromatyczne. W 80-95
% są to ciekłe oraz rozpuszczone w nich stałe węglowodory
parafinowe o liczbie atomów węgla w cząsteczce od 1-60. W
szeregu homologicznym alkanów pierwsze cztery od C
1
do C
4
są
gazami (w normalnych warunkach ciśnienia i temperatury), od
C
5
do C
15
–cieczami, a powyżej C
15
- ciałami stałymi. Obok
węglowodorów n-parafinowych występują również parafiny
rozgałęzione tzw. izoparafiny, wśród których najlepiej poznany
jest pristan i fitan. Węglowodory te wykorzystywane są jako
biomarkery do śledzenia przemian geochemicznych materii
organicznej.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Skład ropy naftowej
Kolejną liczną grupę związków węglowodorowych w ropie
naftowej stanowią cykloparafiny tzw. związki naftenowe
(wśród których w największych ilościach występują
metylocyklopentan
i
metylocykloheksan).
Węglowodory
aromatyczne wchodzące w skład ropy naftowej zawierają
przynajmniej jeden pierścień aromatyczny, a w frakcjach
wyżej wrzących większą liczbę pierścieni skondensowanych.
Typowymi reprezentantami jednopierścieniowych związków
aromatycznych oraz ich alkilowych pochodnych są: benzen,
toluen, ksylen i styren. Z kolei ciężkie oleje gazowe, oleje
smarowe oraz pozostałości podestylacyjne ropy zawierają
związki, których cząsteczki składają się z 2 do 13
skondensowanych pierścieni benzenowych. Są to tzw.
wielopierścieniowe węglowodory aromatyczne WWA (ang. PAH-
policyclic aromatic hydrocarbons) zwykle silnie toksyczne i
kancerogenne.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
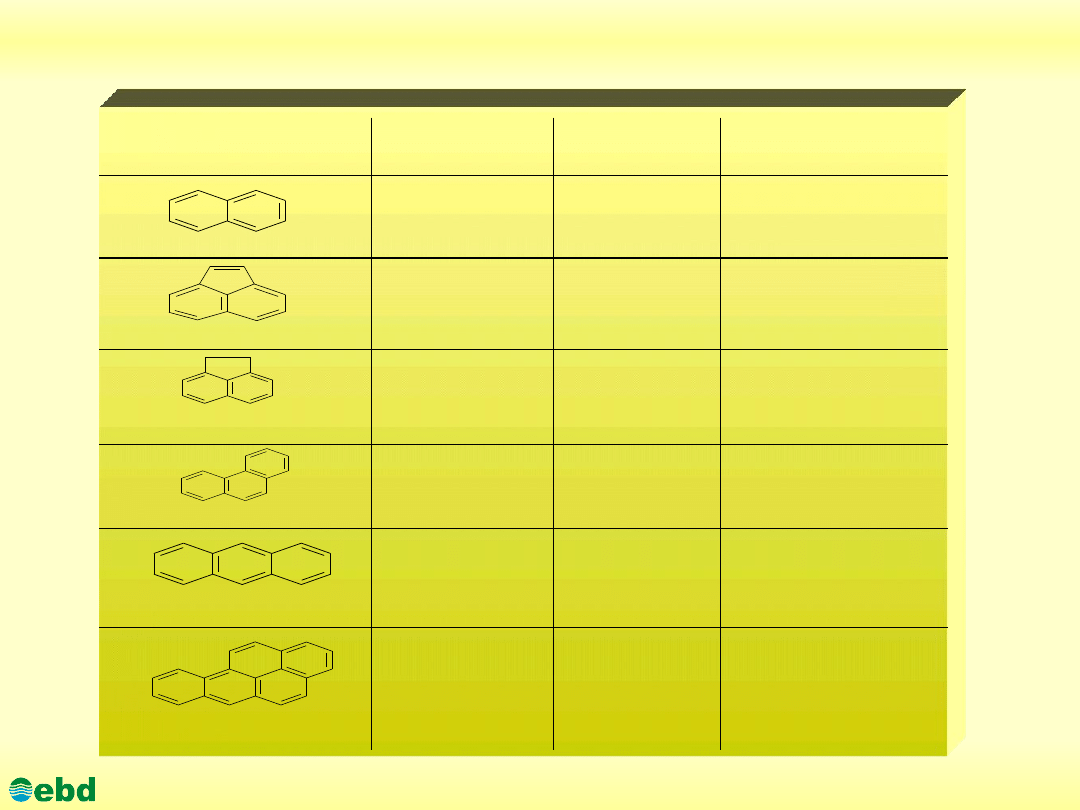
Charakterystyka wybranych PAH, obecnych w ropie
naftowej
Nazwa węglowodoru
Masa molowa
Temp. topnienia
[
0
C]
Kancerogenność/
Mutagenność
naftalen
acenaftylen
acenaften
fenantren
antracen
benzo[a]piren
128
80
- / -
152
92-3
- / -
154
96,2
- / -
178
100
- / -
178
218
- / -
252
178,1
+ / +

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Produkty destylacji ropy naftowej
wyniku przeróbki ropy naftowej otrzymuje się cztery klasy
handlowe produktów naftowych:
•
aliwa
•
leje smarowe
•
mary plastyczne
•
rzetwory do użytku przemysłowego i domowego
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
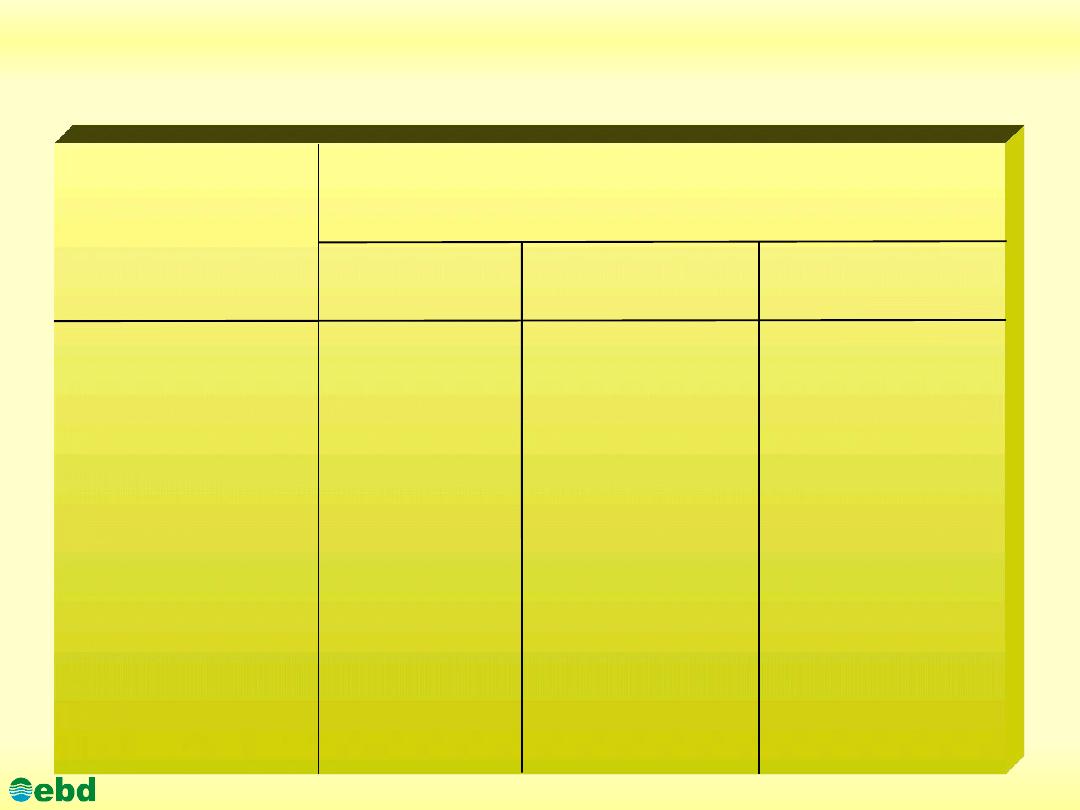
Skład chemiczny najważniejszych produktów
przerobu ropy naftowej [% v/v.]
Węglowodory
Rodzaj
paliwa
Alifatyczne Naftenowe Aromatyczne
Benzyna ciężka
68,65 15,00 16,35
Benzyna 60,35
5,45 34,20
Samochodowa
Paliwo do silników
61,35
19,14
19,55
odrzutowych
Olej napędowy
45,90
34,30
19,80
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
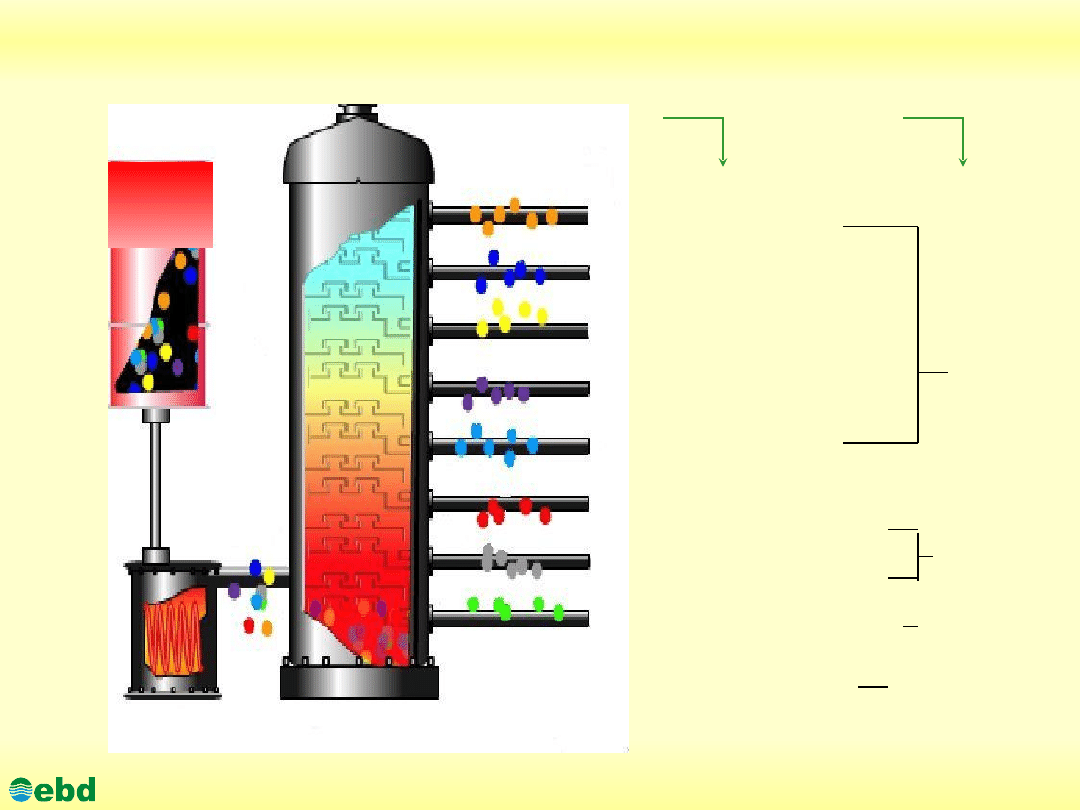
Schemat przeróbki ropy naftowej do produktów handlowych
Paliwa
Destylat próżniowy średni
Smary plastyczne
Gaz suchy i płynny
Benzyna lekka
Benzyna ciężka
Nafta
Lekki olej napędowy
Destylat próżniowy lekki
Destylat próżniowy ciężki
Frakcja P-30
Klasy produktów
naftowych
Oleje
smarowe
Ropa
naftowa
20
0
C
150
0
C
240
0
C
350
0
C
Frakcje destylacji
ropy naftowej
Pozostałość próżniowa (gudron)
Kolumna rektyfikacyjna

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Wycieki ropy i produktów naftowych
Zużywanie w światowej energetyce i transporcie olbrzymich
ilości ropy naftowej dochodzące w 2003 roku do 18 mln ton
związane jest w sposób nieunikniony z przedostawaniem się
części tych materiałów do środowiska. Surowa ropa naftowa
i jej produkty przedostają się do środowiska na skutek
procesów wydobywczych ropy, jej przerobu oraz awarii
podczas transportu i magazynowania. Wśród produktów
uwalnianych do środowiska gruntowego i wodnego należy
wyróżnić: benzynę silnikową, paliwa dieslowe, oleje opałowe,
oleje smarowe, smary plastyczne, substancje żywiczno-
asfaltowe, a także zużyte oleje i płyny hydrauliczne.
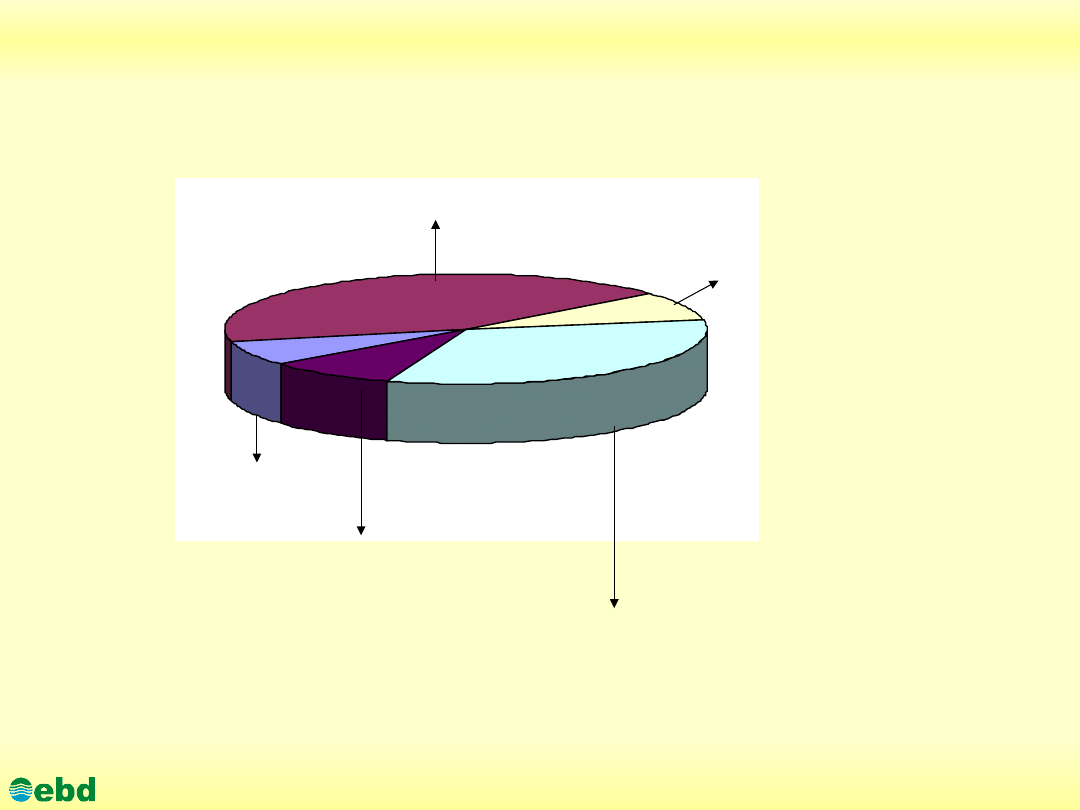
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Niekontrolowane źródła wycieków ropy naftowej
35 % %
9 %
%
8 %
%
45 % %
3 % %
Wycieki samoistne
Operacje w strefie akwenów wodnych (wiercenia poszukiwawcze,
wydobycie, załadunek, transport, katastrofy tankowców)
Węglowodory naftowe z
atmosfery
Gospodarka komunalna
i działalność przemysłowa
Rafinerie i przetwórnie
ropy i produktów
naftowych

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Niekontrolowane źródła wycieków ropy naftowej
Oszacowano, że w latach 1980-2003 do środowiska przedostało
się rocznie blisko 9 mln ton przetworzonej ropy naftowej. W
Polsce roczne zrzuty produktów ropopochodnych do środowiska
szacuje się na poziomie 16-40 tys. ton czyli około 0,1-0,25 %
zużycia produktów naftowych. Skutki wycieków ropy, które
miały miejsce w przeciągu ostatnich dwudziestu lat, nie mogą
być precyzyjnie oszacowane, gdyż jedynie megawycieki
są rejestrowane i bilansowane, a tysiące małych, nie
powodujących większych uszkodzeń ekosystemu, są wręcz
ukrywane. Jednak wiele spośród awarii z ostatnich lat miało
rekordową skalę. W samym tylko 2002 roku do środowiska
przedostało się 81 tys. ton ropy naftowej (przy czym
przyczyną uwolnienia 77 tys. ton ciężkiej frakcji ropy
naftowej była katastrofa zbiornikowca Prestige u wybrzeży
Hiszpanii).

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi biodegradacji produktów naftowych
Przewidywanie i ocena zachowania się produktów naftowych
w środowisku wymagają badania procesów związanych z ich
przemianami
fizykochemicznymi,
jak
i
biologicznymi
(biodegradacja, biotransformacja, mineralizacja). Przebieg
procesów mikrobiologicznego rozkładu węglowodorów zależy
od struktury chemicznej związku. Dla niektórych typów
związków szlaki rozkładu ograniczają się do kilku reakcji, dla
innych zaś są bardzo rozbudowane. Najłatwiej przebiega
biodegradacja węglowodorów alifatycznych od C
10
-C
18,
nieco
trudniej
alkanów
rozgałęzionych,
następnie
alkenów,
cykloalkanów aż po grupę związków wykazujących wysoką
oporność na biodegradację np. benzenu i wielopierścieniowych
węglowodorów aromatycznych.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
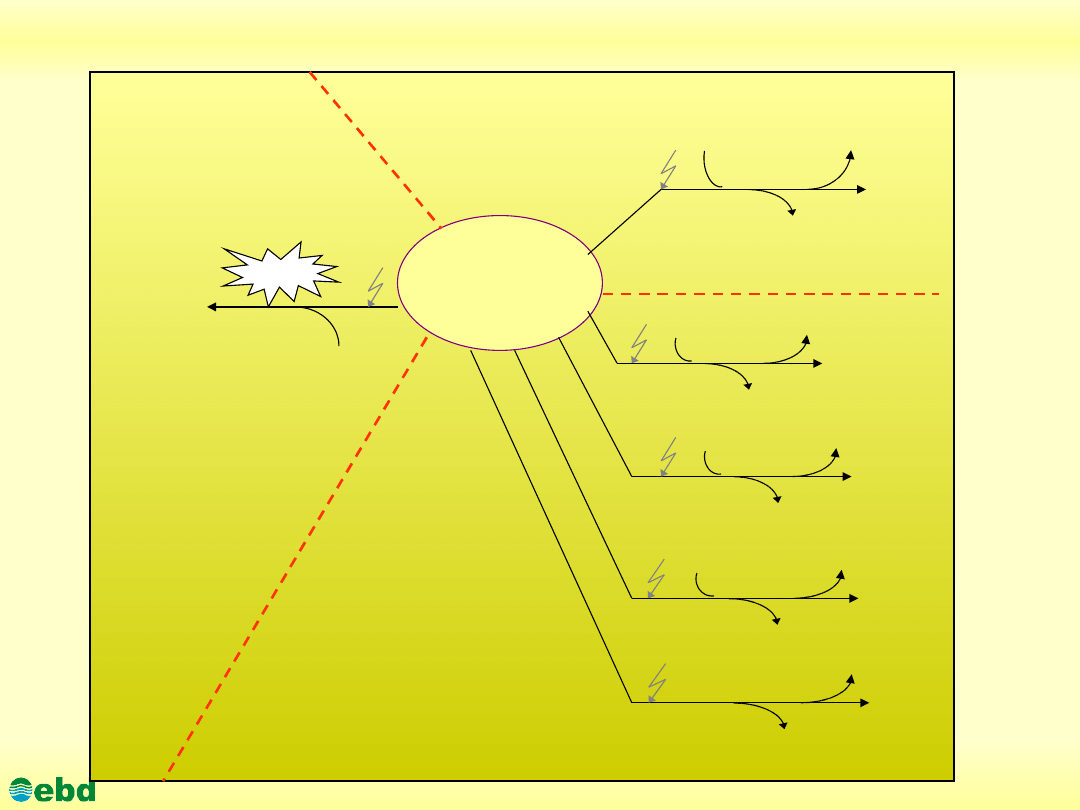
Główne procesy przemian węglowodorów w środowisku
Węglowodory
C
n
H
m
światło
Fotoautotrofy
O
2
Biomasa
C0
2
H
2
0
Heterotrofy tlenowe
C0
2
Biomasa
NO
3
-
Biomasa
C0
2
N
2
Fe(III)
Biomasa
C0
2
Fe(II)
SO
4
2-
Biomasa
C0
2
H
2
S
Biomasa
C0
2
CH
4
Heterotrofy beztlenowe

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Enzymy w szlakach biodegradacji węglowodorów
W procesy degradacyjne produktów naftowych (w warunkach
tlenowych) włączone są głównie enzymy należace do klasy
oksydoreduktaz (oksydazy, oksygenazy, dehydrogenazy),
hydrolaz i liaz (dekarboksylazy).
Oksydazy - stanowią grupę enzymów katalizujących odrywanie
się elektronów od utlenionego substratu i dwu- lub
czteroelektronową redukcję cząsteczki tlenu. Po połączeniu się
z protonami powstaje cząsteczka H
2
O
2
lub H
2
O. Do tego
zespołu należą m.in. oksydazy cytochromowe.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Enzymy w szlakach biodegradacji węglowodorów
Oksygenazy - katalizują proces wbudowywania tlenu w
cząsteczkę. Wyróżnia się oksygenazy właściwe tj. dioksygenazy
oraz monooksygenazy, do których zalicza się hydroksylazy.
Dioksygenazy- włączają dwa atomy tlenu do substratu. Istnieją
dwa rodzaje diooksygenaz. Dioksygenazy wymagające udziału
NADH i NADPH, katalizujące reakcje hydroksylacji substratu
oraz drugi typ dioksygenaz nie wymagający udziału NAD(P)H,
katalizujący rozerwanie pierścienia aromatycznego

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Enzymy w szlakach biodegradacji węglowodorów
Monooksygenazy – katalizują włączenie jednego z atomów tlenu
do hydroksylowanego substratu, podczas gdy drugi atom tlenu
wiązany jest w cząsteczkę wody z udziałem NADH lub NADPH,
zgodnie z równaniem:
RX
RX-OH
O
2
H
2
O
NADP
H
+
H
+
NADP
+

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Enzymy w szlakach biodegradacji węglowodorów
Dehydrogenazy – katalizują odrywanie atomów wodoru od
utlenionego substratu i przenoszą je na inne enzymy czy
związki pośrednie. Nie mają zdolności przenoszenia elektronów
bezpośrednio na tlen. Akceptorem atomów wodoru może być:
NAD
+
, NADP
+
, FMN lub FAD.
Hydrolazy –katalizują proces rozpadu substratu z udziałem
cząsteczek wody.
Dekarboksylazy – należą do klasy liaz tj. enzymów
katalizujących rozerwanie pojedynczych wiązań –C-C-węgiel-
węgiel.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Mechanizmy biodegradacji
węglowodorów w warunkach
tlenowych

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja n-alkanów
Szkielet węglowy alkanów (parafin) ma kształt łańcucha
prostego lub rozgałęzionego, a wszystkie wiązania pomiędzy
atomami węgla są pojedyncze. Mikrobiologiczny rozkład n-
alkanów może przebiegać wg trzech
mechanizmów:
mechanizm hydroksylacji w którym rozkład n-alkanów
katalizowany jest przez monooksygenazy (lub oksygenazy
o funkcji mieszanej), które działają na peryferyjny atom węgla,
przekształcając cząsteczkę węglowodoru w pierwszorzędowy
alkohol. W procesie tym pośredniczy zwykle układ cytochromu
P-450,
który
katalizuje
reakcję
hydroksylacji
węglowodorowego substratu zgodnie z równaniem:
R- CH
2
CH
3
+
O
2
+ NAD(P)
H
+
H
+
R- CH
2
CH
2
O
H +
H
2
O
+ NAD(P)
+
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
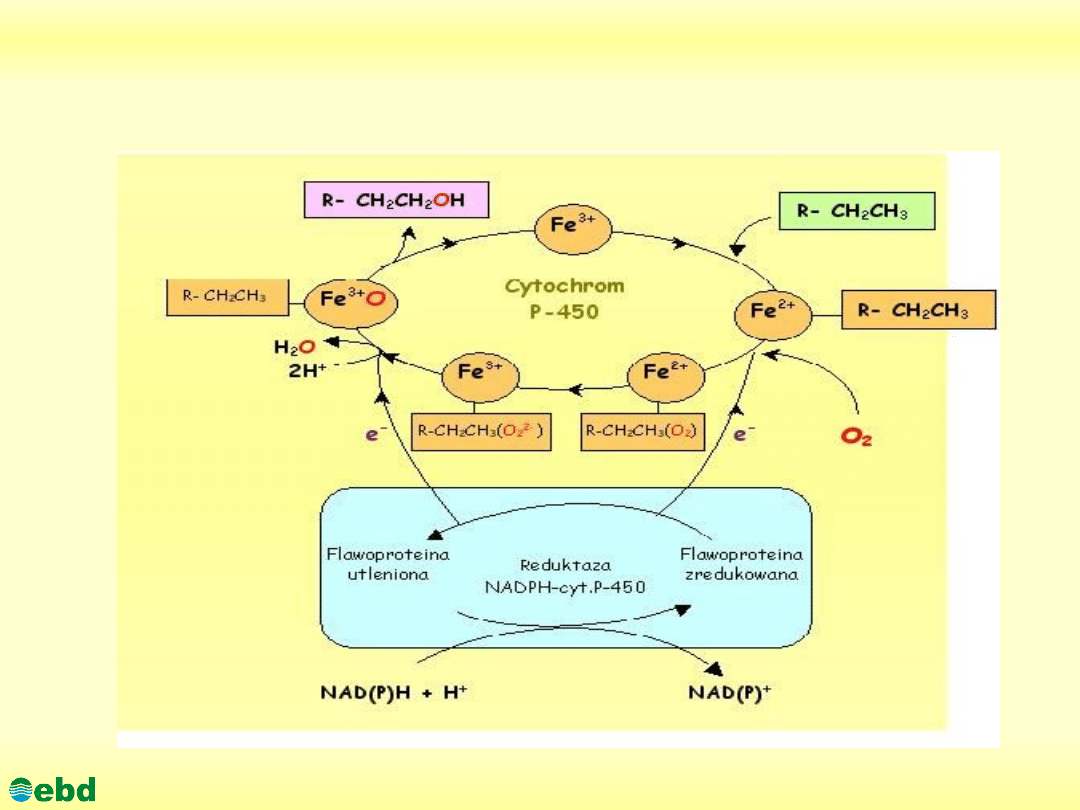
Mechanizm utleniania n-alkanów z udziałem
monooksygenazy związanej z cytochromem P-450

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Rozkład n-alkanów
mechanizm dehydrogenacji (odwodornienia)
Rozkład n-alkanów odbywa się na drodze dehydrogenacji z
udziałem dehydrogenazy współdziałającej z NAD
+
. W wyniku
reakcji odwodornienia powstaje cząsteczka alkenu która
następnie ulega hydratacji (addycja cząsteczki H
2
O) z
wytworzeniem pierwszorzędowego alkoholu.
mechanizm wolnorodnikowej oksydacji
Rozpad cząsteczki n-alkanu nastepuje w szeregu reakcji
wolnorodnikowych (prekursorem rodników jest tlen). W
układzie tym pośredniczą dioksygenazy, które katalizują
włączenie tlenu poprzez przekształcenie cząsteczki alkanu
do alkilonadtleneku, a następnie przez reakcję redukcji do
alkoholu.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Rozkład n-alkanów
Właściwości fizykochemiczne alkanów oraz struktura
przestrzenna cząsteczek są istotnymi parametrami
wpływającymi na tempo ich utlenienia i metabolizowania przez
mikroorganizmy. Alkany od C
1
do C
4
występują w postaci
gazowej i są wykorzystywane jako źródło węgla przez niewiele
szczepów bakterii. Alkany o liczbie atomów węgla C
5
- C
9
charakteryzują się stosunkowo wysoką toksycznością, a
biodegradacji ulegają jedynie w niskich stężeniach. Najmniej
toksyczne i najłatwiej metabolizowane są alkany o liczbie
atomów węgla C
10
-C
22
. Spośród nich bardziej oporne są związki
o łańcuchach rozgałęzionych w porównaniu do związków o
prostych łańcuchach. Węglowodory o dłuższych łańcuchach
węglowych (powyżej C
22
) są metabolizowane znacznie wolniej.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Rozkład n-alkanów
Biorąc pod uwagę strukturę chemiczną związku oraz skład i
aktywność flory bakteryjnej - rozkład n-alkanów może odbywać
się na drodze:
•
oksydacji terminalnej,
•
oksydacji subterminalnej,
•
bądź
ω
- oksydacji.
Droga terminalnej oksydacji n-alkanów polega na
wstępnym
utlenieniu
węglowodoru
do
alkoholu
pierwszorzędowego.
W
procesie
tym
pośredniczą
monooksygenazy, które działając na jeden z peryferyjnych
atomów węgla, przekształcają cząsteczkę w alkohol (tzw.
oksydacja monoterminalna), bądź działając na dwa peryferyjne
atomy węgla utleniają cząsteczkę do diolu, tzw. oksydacja
diterminalna. Dalsze utlenianie terminalne alkoholi, przez
odpowiednie aldehydy i kwasy organiczne, kończy proces
β
-
oksydacji.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja n-alkanów- oksydacja mono- i diterminalna
CH
3
– (CH
2
)
n
- CH
2
- CH
3
NAD(P)H + H
+
NAD(P)
+
- H
2
O
O
2
CH
3
– (CH
2
)
n
- CH
2
- CH
2
OH
Oksydacja monoterminalna
2H
+
+ 2e
NAD(P)H + H
+
NAD(P)
+
O
2
- H
2
O
dehydrogenaza
alkoholowa EC 1.1.1.1
CH
3
– (CH
2
)
n
- CH
2
- CHO
HOCH
2
– (CH
2
)
n
- CH
2
- CH
2
OH
dehydrogenaza
aldehydowa EC 1.2.1.3
NAD(P)
+
+ H
2
O
NAD(P)H + H
+
CH
3
– (CH
2
)
n
- CH
2
- COOH
1-monooksygenaza
alkanowa EC 1.14.15.3
HOCH
2
– (CH
2
)
n
- CH
2
- COOH
ω
- oksydacja
monooksygenaza
(
ω
-hydroksylująca)
HOOC
– (CH
2
)
n
- CH
2
- COOH
β
- oksydacja
Oksydacja diterminalna
R
– CH
2
- CH
2
-
COOH
HS-CoA
ATP
AMP+ PP
i
R
– CH
2
- CH
2
-
CO
∼
SCoA
acylo-CoA
R
– CH= CH-
CO
∼
SCoA
H
2
O
FAD
FADH
2
R
– HOCH- CH
2
-
CO
∼
SCoA
L-3-hydroksyacylo-CoA
R
–CO- CH
2
-
CO
∼
SCoA
3+ketoacylo-CoA
NAD
+
NADH+H
+
CoA-SH
CH
3
-
CO
∼
SCoA
acetylo-CoA
R- CO
∼
SCoA
acylo-CoA krótszy o dwa
atomy węgla
Trans-?
2
-enoilo- CoA
+
syntaza
acylo-CoA
EC 6.2.1.3
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja n-alkanów- oksydacja subterminalna (1.9)
CH
3
– (CH
2
)
n
- CH
2
- CH
2
- CH
3
NAD(P)H + H
+
NAD(P)
+
- H
2
O
O
2
CH
3
– (CH
2
)
n
- CH
2
- CH- CH
3
OH
CH
3
– (CH
2
)
n
- CH
2
- C- CH
3
O
?
CH
3
– (CH
2
)
n
- CH
2
-O- C- CH
3
O
?
HOOC- CH
3
+
CH
3
– (CH
2
)
n
- CH
2
- OH
β
- oksydacja
C
6
C
5
C
4
C
4
Cykl
Krebsa
NADH
CO
2
NADH
CO
2
NADH
FADH
2
GTP
monooksygenaza
alkanowa
dehydrogenaza
alkoholowa
2H
+
+ 2e
Reakcja
Baeyer-Villager

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja alkanów rozgałęzionych
Przykładem związku z szeregu izoparafin jest pristan
(2,6,10,14- tetrametylopentadekan). Związek ten ze względu na
wyjątkową oporność na rozkład mikrobiologiczny jest często
stosowany jako marker lub standard wewnętrzny w procesach
utleniania mieszanin węglowodorów.
Próby rozkładu pristanu z udziałem szczepów należących do
rodzaju:
Brevibacterium
,
Corynebacterium
i
Rhodococcus
wykazały możliwość degradacji tego typu związków poprzez
β
-
i
ω
-oksydację. Obecność podstawników jest czynnikiem
hamującym proces
β
- oksydacji.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja alkanów rozgałęzionych (1.10)
+
COOH
COOH
HOOC
COOH
HOOC
COOH
HOOC
COOH
HOOC
COOH
HOOC
HOOC
COOH
COOH
HOOC
pristan
(2,6,10,14-
tetrametylopentadekan)
kwas 2,6,10,14-
tetrametylopentadekanowy
kwas 2,6,10,14-
tetrametylopentadekanodiowy
kwas 2,6,10-
trimetylotridekanodiowy
kwas 2,6,10-
trimetyloundekanodiowy
kwas 2,6-
dimetylononanodiowy
kwas 2,6-
dimetyloheptanodiowy
kwas 2-
metylopentanodiowy
kwas 2-
metylomalonowy
kwas
bursztynow
y
C
3
C
2
C
3
C
3
C
2
C
2
C
3
COOH
kwas 4,8,12-
trimetylotridekanowy
C
2
COOH
kwas 2,6,10-
trimetyloundekanowy
C
3
Degradacja ?

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja cykloalkanów
Cykloalkany to związki pierścieniowe zbudowane z połączonych
wiązaniami pojedynczymi atomów węgla, zwane też
cykloparafinami bądź naftenami.
Biodegradacja cykloalkanów zachodzi głównie z udziałem
konsorcjum mikroorganizmów, na drodze kometabolizmu.
Cykloalkany o małych masach cząsteczkowych wykazują zwykle
znaczną toksyczność w stosunku do mikroorganizmów, stąd też
metabolizowane są jedynie w niskich stężeniach i w obecności
substratów wspomagających. Jak wynika z opublikowanych
dotąd danych, zdolność do metabolizowania związków
alicyklicznych w charakterze substartu wzrostowego wykazuje
zaledwie kilka gatunków mikroorganizmów. Wśród bakterii
główną rolę pełnią bakterie z rodzaju:
Brevibacterium,
Acinetobacter i Pseudomonas
.
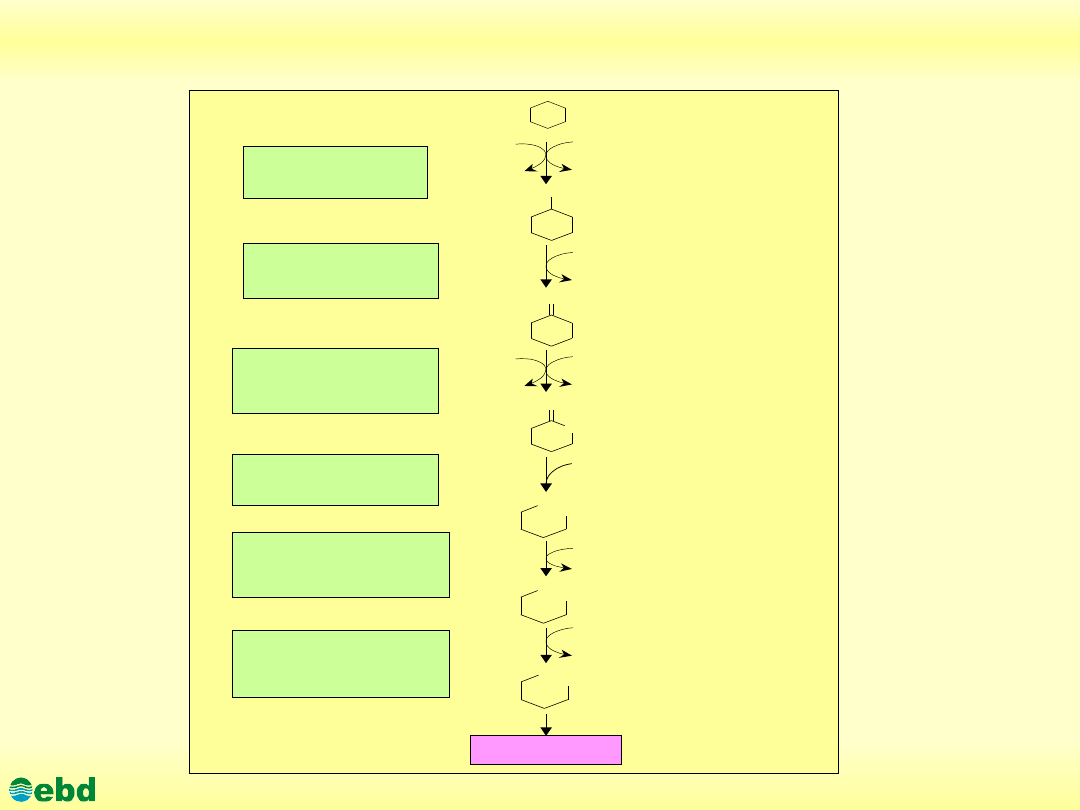
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja cykloalkanów (1.11)
NAD(P)
NAD(P)H
NAD(P)H
NAD(P)
O
2
H
2
O
O
2
H
2
O
NAD(P)H
NAD(P)
O
O
H
2
O
COOH
CH
2
OH
COOH
CHO
O
COOH
COOH
NAD(P)H
NAD(P)
NAD(P)
NAD(P)H
O
H
β
- oksydacja
Cykloheksan
Cykloheksanol
Cykloheksanon
ε
-kaprolakton
Kwas
6-
hydroksyheksanow
y
Kwas
6-
oksoheksanowy
Kwas
adypinowy
monooksygenaza
butanowa
EC 1.14.15.-
dehydrogenaza
cykloheksanolowa
EC 1.1.1.245
1,2-
monooksygenaza
cykloheksanonowa
sprzężona z NADPH
EC 1.14.13.22
hydrolaza
ε
-kaprolaktonowa
EC 3.1.1.-
dehydrogenaza
6-hydroksyheksanianowa
sprzężona z NAD (NADP)
EC 1.1.1.258
dehydrogenaza
6-oksoheksanianowa
sprzężona z NAD (NADP)
EC 1.2.1.6.3

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja alkenów
Alkeny (olefiny) stanowią grupę węglowodorów nienasyconych,
zawierających jedno lub więcej wiązań podwójnych pomiędzy
atomami węgla. Metabolizm alkenów może przebiegać poprzez
utlenienie podwójnego wiązania, bądź oksydację w dowolnej
części łańcucha węglowodorowego, tak jak ma to miejce w
przypadku asymilacji alkanów.
Istnieją cztery drogi inicjujące proces degradacji alkenów:
•oksydacja terminalnych grup metylowych do odpowiednich
nienasyconych alkoholi i kwasów,
•subterminalne utlenienie do odpowiednich alkoholi i kwasów,
•utlenienie w miejscu podwójnego wiązania do odpowiednich
epoksydów,
.utlenienie w miejscu podwójnego wiązania do odpowiednich
dioli.
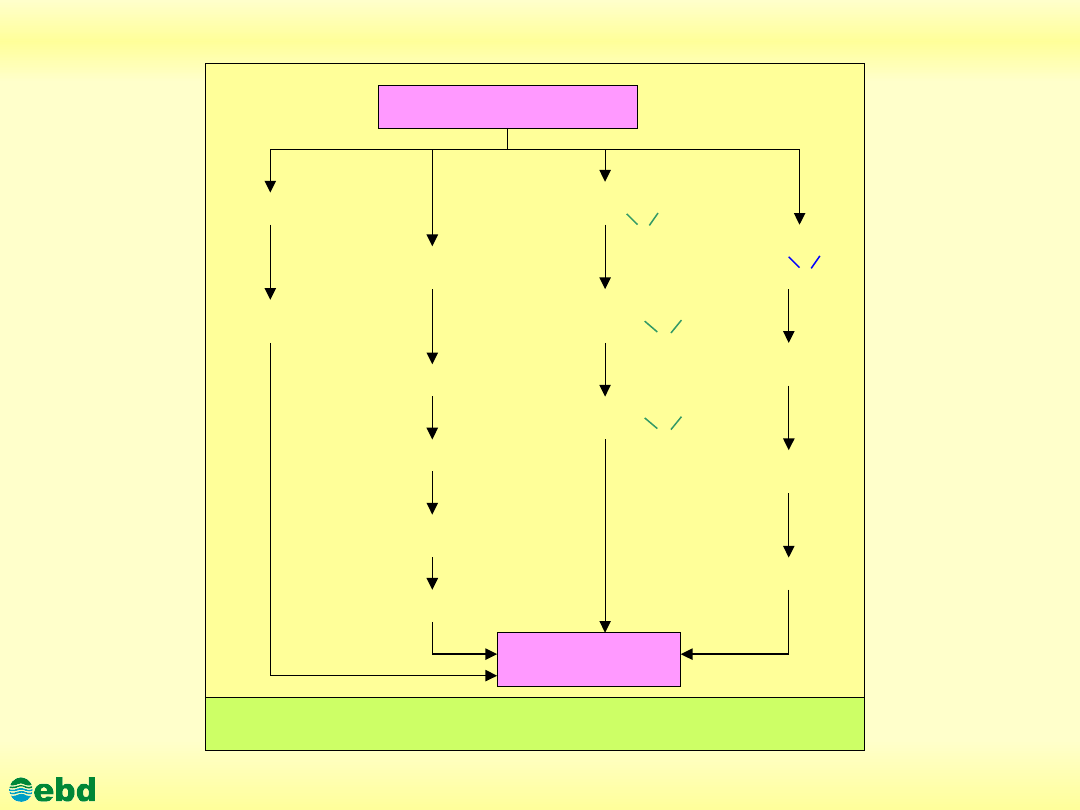
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi degradacji alkenów (powyżej 6 atomów węgla) (1.12)
CH
3
- (CH
2
)
n
– CH = CH
2
HOCH
2
-(CH
2
)
n
-
CH=CH
2
HOOC-(CH
2
)
n
-
CH=CH
2
CH
3
-(CH
2
)
n
-CHOH-
CH
3
CH
3
-(CH
2
)
n
-CO-
CH
3
CH
3
-(CH
2
)
n
-O-CO-
CH
3
CH
3
-(CH
2
)
n-1
-
CH
2
OH
CH
3
-(CH
2
)
n-1
-
COOH
CH
3
-(CH
2
)
n
-CH-
CH
2
O
HOCH
2
-(CH
2
)
n
-CH-CH
2
O
HOOC -(CH
2
)
n
-CH-CH
2
O
CH
3
-(CH
2
)
n
-CH-
CH
2
O
CH
3
-(CH
2
)
n
-CHOH-
CH
2
OH
CH
3
-(CH
2
)
n
-CHOH-
COOH
CH
3
-(CH
2
)
n
-COOH +
CO
2
β
- oksydacja
1
-
monooksygenaza
alkenowa
2
- dehydrogenaza
3
- dekarboksylaza
(*)
- reakcja spontaniczna
1
1
1
1
2
1
2
(*)
2
3
2
4
2
2

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja alkenów krotkołańcuchowych
Mechanizm oksydacji alkenów krótkołańcuchowych oparty jest
o szereg reakcji prowadzących w efekcie końcowym
do karboksylacji epoksydów z udziałem koenzymu M (CoM, kwas
2-merkaptoetanosulfonowy)
i
powstania
β
-oksokwasu.
Cząsteczka alkenu przy udziale monooksygenazy alkenu ulega
transformacji do epoksyalkanu, a następnie z udziałem CoM do
2-hydroksyalkilo-CoM

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja alkenów krotkołańcuchowych (1.13)
C
CH
3
C
H
H
H
C
C
O
H
H
H
CH
3
C
C
O
H
H
H
CH
3
NADH
+
H
+
+
O
2
NAD
+
+ H
2
O
R-epoksypropan
S-epoksypropan
C
O
H
CH
3
CH
2
O
3
S-CH
2
-CH
2
-S
H
-
C
O
CH
2
O
3
S-CH
2
-CH
2
-S
H
H
CH
3
-
-
O
3
S-CH
2
-CH
2
-SH
( CoM )
-
O
3
S-CH
2
-CH
2
-SH
2-R-hydroksypropylo-CoM
2-S-hydroksypropylo-CoM
O
3
S- CH
2
- CH
2
- S
-CH
2
- C- CH
3
O
-
2-ketopropylo-CoM
NADPH
+ CO
2
-
O
3
S-CH
2
-CH
2
-SH
+ NADP
+
O- C-
CH
2
- C- CH
3
O
O
-
Szlaki metabolizmu pośredniego
acetylooctan
monooksygenaza alkenowa
EC 1.14.13.69
liaza 2-hydroksypropylo-CoM
EC 4.4.1.23
NAD
+
NADH
NAD
+
NADH
dehydrogenaza
2-S-hydroksypropylo-CoM
EC 1.1.1.269
dehydrogenaza
2-R-hydroksypropylo-CoM
EC 1.1.1.268
reduktaza
2-oksopropylo-CoM
EC 1.8.1.5

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja węglowodorów aromatycznych
Węglowodory aromatyczne (areny) stanowią liczną grupę
związków zawierających od jednego do kilku, a nawet
kilkunastu pierścieni aromatycznych w cząsteczce. Liczne
badania potwierdzają obecność mikroorganizmów zdolnych do
rozkładu tej grupy związków na drodze metabolicznej, bądź w
procesie kometabolizmu. Większość spośród związków
aromatycznych występujących w przyrodzie, w pierwszym
etapie mikrobiologicznej degradacji ulega oksydacji do
katecholu bądź kwasu protokatechowego
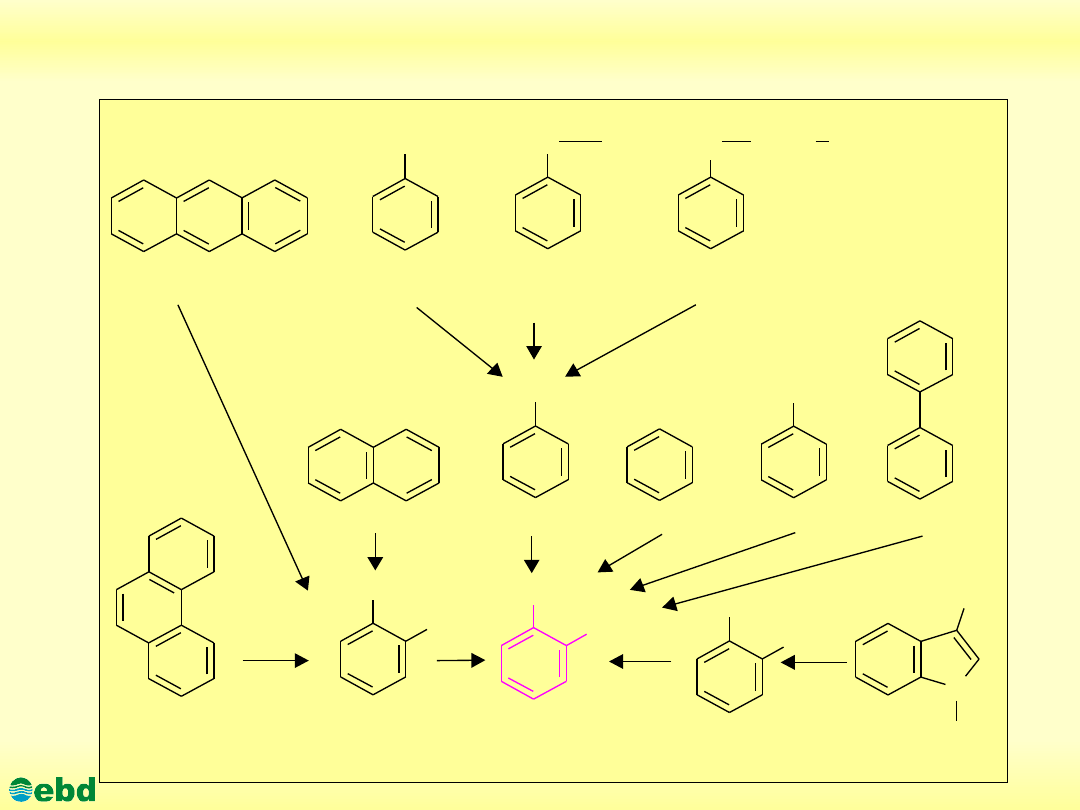
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Związki aromatyczne rozkładane do katecholu (1.14)
CHOH
COOH
C
H
2
CHNH
2
COOH
COOH
OH
COOH
OH
COOH
NH
2
N
R
H
OH
OH
naftalen
kwas benzoesowy
kwas salicylowy
katechol
rodnik alkilowy
antracen
alkilobenzen
kwas
migdałowy
fenyloanalina
benzen
fenol
bifenyl
antranilan
Grupa alkilowa
Kwas antranilowy
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
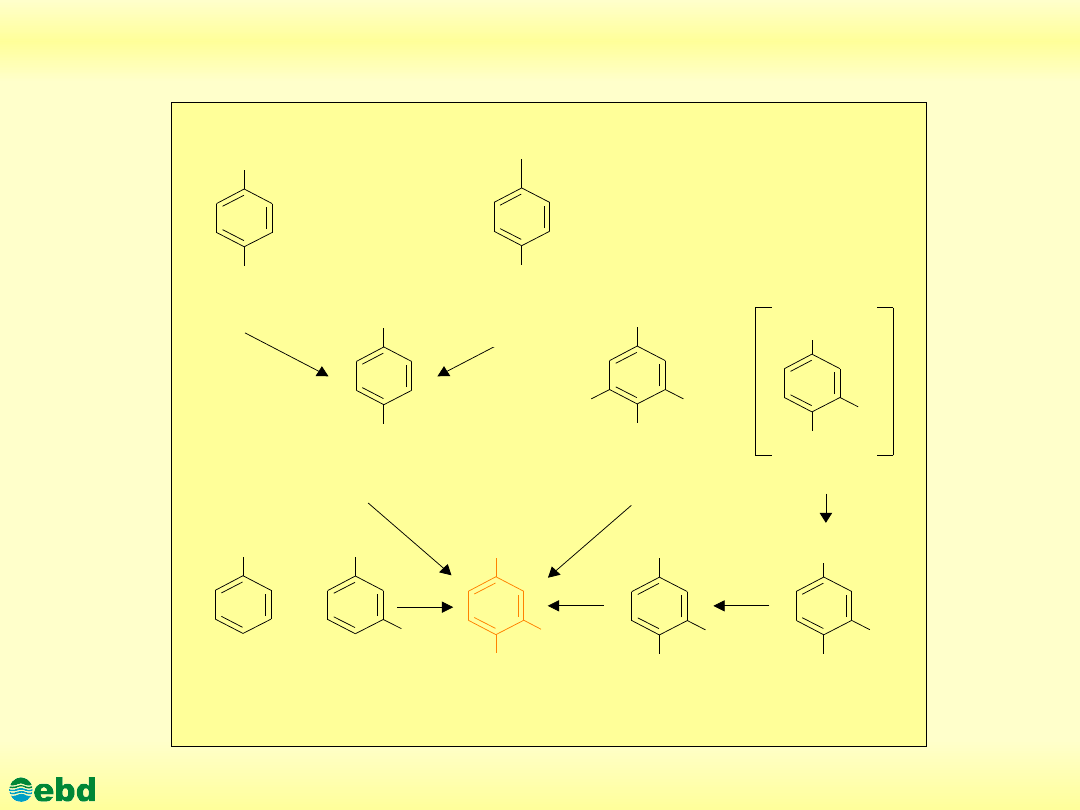
Związki rozkładane do kwasu protokatechowego (1.15)
CH
3
COOH
OH
COOH
OH
COOH
OH
O
H
OH
C
3
O
O
COOH
COOH
OH
COOH
OH
OH
COOH
OCH
3
OH
C
3
OCH
3
OH
grupa alkilowa
kwas
toluilowy
kwas hydroksy-
benzoesowy
alkilofenol
n
kwas
szikimowy
lignina
kwas
benzoesowy
kwas
hydroksy-
benoesowy
kwas
waniliowy
kwas
protokatechowy
p- alkilofenol
Kwas m-
hydroksy-
benzoesowy
wanilinowy

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja węglowodorów aromatycznych
Do katecholu degradowane są pojedynczo lub podwójnie (w
pozycji 1,2-) podstawione pierścienie aromatyczne, np. w
fenyloalaninie, toluenie, benzenie itp. Pierścienie aromatyczne
podstawione w pozycjach 1,3- i 1,4- oraz pierścienie
podstawione wielokrotnie są przekształcane do kwasu
protokatechowego.
Szlaki rozkładu węglowodorów aromatycznych prowadzą przez
szereg reakcji: hydroksylacji, demetylacji i dekarboksylacji
podstawników alkilowych w pierścieniu aromatycznym z
udziałem różnych grup enzymów, po rozszczepienie pierścienia
aromatycznego i w efekcie końcowym włączenie produktów
przemian do szlaków metabolizmu pośredniego.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja węglowodorów aromatycznych
Mikrobiologiczny rozkład węglowodorów aromatycznych
rozpoczyna się procesem przyłączenia do pierścienia grup
hydroksylowych. W przypadku związków niefenolowych
struktura 1,3- dihydroksybenzenu (rezorcyny), niezbędna do
rozszczepienia pierścienia, powstaje na skutek podwójnej
hydroksylacji katalizowanej przez diooksygenazy, podczas gdy
dla związków fenolowych wprowadzenie atomu tlenu do
cząsteczki zachodzi z udziałem monooksygenaz. Pochodne
metylowe benzenu ulegają oksydacji poprzez utlenienie grupy
metylowej do karboksylowej, a następnie oksydację pierścienia
aromatycznego do katecholu. Podstawniki zaś chlorowe,
nitrowe i sulfonowe są zastępowane grupami hydroksylowymi.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja węglowodorów aromatycznych
Nastepny etap mikrobiologicznego rozkładu związków
aromatycznych obejmuje proces rozszczepienia pierścienia
aromatycznego z udziałem dioksygenaz i wbudowanie tlenu
cząsteczkowego. Rozszczepienie pierścienia w pozycji
orto-
(tj. między dwoma sąsiadującymi hydroksylowanymi atomami
węgla) prowadzi do powstania kwasu
cis, cis
- mukonowego
(produkt rozszczepienia katecholu) bądź kwasu 3-karboksy-
cis, cis
- mukonowego (produkt rozszczepienia kwasu proto-
katechowego). Produkty tych reakcji ulegają dalszym
przemianom metabolicznym poprzez ten sam związek pośredni
tj. kwas 3-oksoadypinowy, a następnie w wyniku aktywacji z
udziałem transferazy-CoA do bursztynylo-CoA i acetylo-CoA,
które w końcowym etapie procesu degradacji są włączane
do szlaków metabolizmu pośredniego.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja węglowodorów aromatycznych
Rozszczepienie pierścienia w pozycji
meta-
(tj. między
hydroksylowanym i niehydroksylowanym atomem węgla),
katalizowane przez dioksygenazy powoduje powstanie
semialdehydu kwasu 2-hydroksymukonowego, który następnie
wchodzi w szlaki metabolizmu pośredniego poprzez pirogronian,
aldehyd octowy i inne produkty pośrednie, zależnie od typu
podstawienia powstałych kwasów alifatycznych.
Wielopierścieniowe węglowodory aromatyczne, zawierające
struktury skondensowane, rozkładne są przez sukcesywne
otwieranie kolejnych pierścieni, a mechanizm rozszczepiania
pierścieni zbliżony jest do mechanizmu rozszczepiania
benzenu.
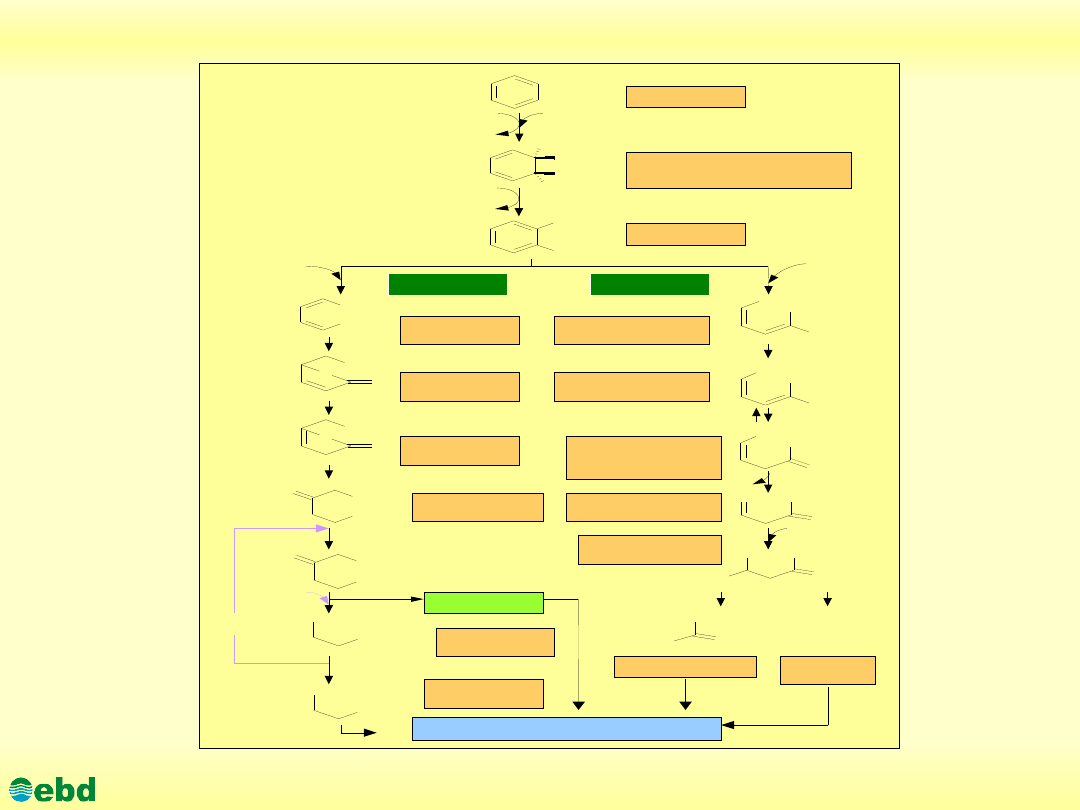
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Rozszczepienie orto- i meta- pierścienia benzenu
OH
OH
H
H
OH
OH
COOH
COOH
O
O
COOH
O
O
COOH
COOH
COOH
O
COOH
O
CO-SCoA
CO-S-CoA
COOH
COOH
COOH
CoA
Cykl Krebsa
NAD
+
O
2
NADH + H
+
NAD
+
O
2
O
2
COOH
OH
CHO
COOH
OH
COOH
COOH
COOH
O
COOH
CH
2
O
COOH
O
CH
3
O
H
COOH
O
C
H
3
CH
3
CHO
Katechol
Benzen
cis-cykloheksa- 3,5-dien-
1,2- diol
meta-
orto-
Kwas cis, cis-
mukonowy
4-adypin- 3-
enolakton
+
Mukono-
lakton
Kwas
3-oksoadypinowy
Kwas
bursztynowy
Bursztynylo-
CoA
Acetylo-CoA
Semialdehyd 2-
hydroksymukonowy
Kwas 2-hydroksy
mukonowy
Kwas -
(2-okso)-heks-4eno-
1,6- diowy
Kwas 2-oksopent- 4-
enowy
Kwas 4-hydroksy-
2-oksowalerianowy
Kwas pirogronowy
Aldehyd
octowy
NADH
1
2
3
4
5
6
7
8
3
4
5
6
7
8
CO
2
H
2
O
CoA

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Enzymy uczestniczące w rozszczepieniu pierścienia benzenu
Enzymy pośredniczące w rozszczepieniu
orto-
pierścienia benzenu
•
. 1,2- dioksygenaza benzenowa
EC 1.14.12.3
•
. dehydrogenaza cis- 1,2-dihydrobenzeno-1,2-diolowa
EC 1.3.1.19
•
. 1,2- dioksygenaza katecholowa
EC 1.13.11.1
•
. cykloizomeraza mukonianowa
EC 5.5.1.1
•
. izomeraza mukonolaktonowa
EC 5.3.3.4
•
. enololaktonaza 3-oksoadypinianowa
EC 3.1.1.24
•
. transferaza 3-oksoadypino-CoA
EC 2.8.3.6
•
. C-acetylotransferaza acetylo-CoA
EC 2.3.1.16
Enzymy pośredniczące w rozszczepieniu
meta-
pierścienia benzenu
•
. 1,2- dioksygenaza benzenowa
EC 1.14.12.3
•
. dehydrogenaza cis- 1,2-dihydrobenzeno-1,2-diolowa
EC 1.3.1.19
•
. 2,3- dioksygenaza katecholowa
EC 1.13.11.2
•
. hydrolaza semialdehydu 2-hydroksymukonianowego
EC 3.7.1.9
•
. izomeraza
•
. dekarboksylaza
•
. hydrataza 2-okso-4-pentenianowa
EC 4.2.1.80
•
. aldolaza 4-hydroksy-2-oksowalerianowa
EC 4.1.3.17
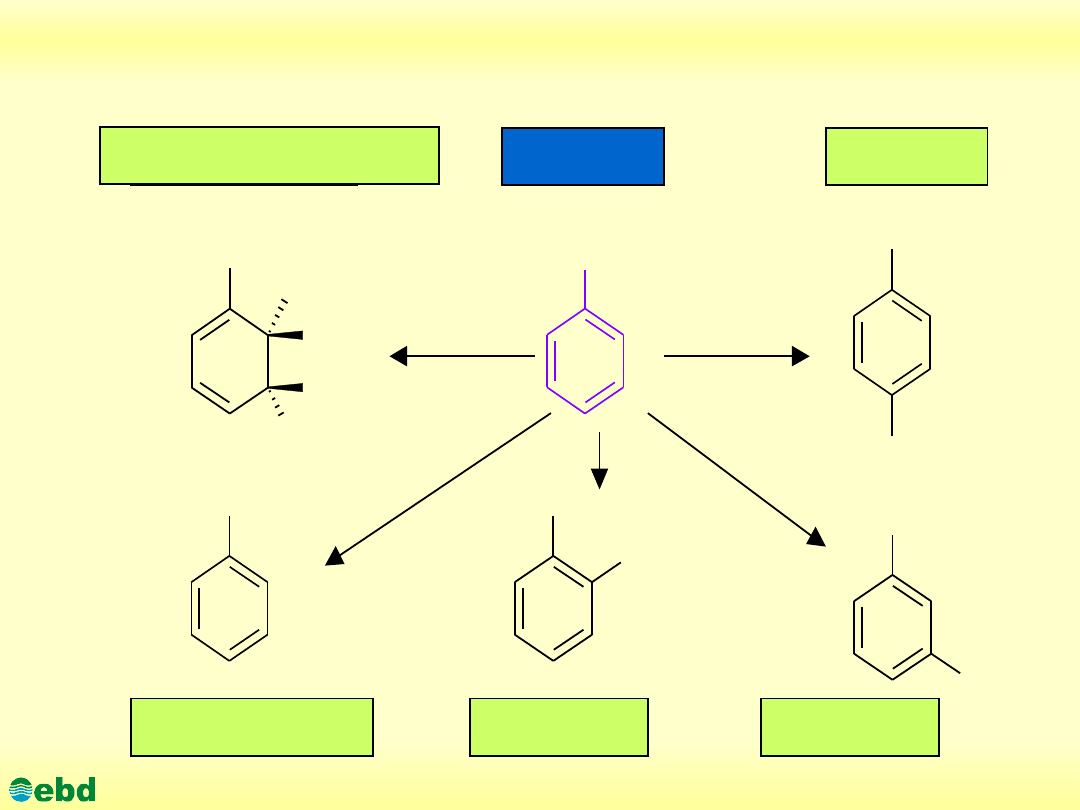
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
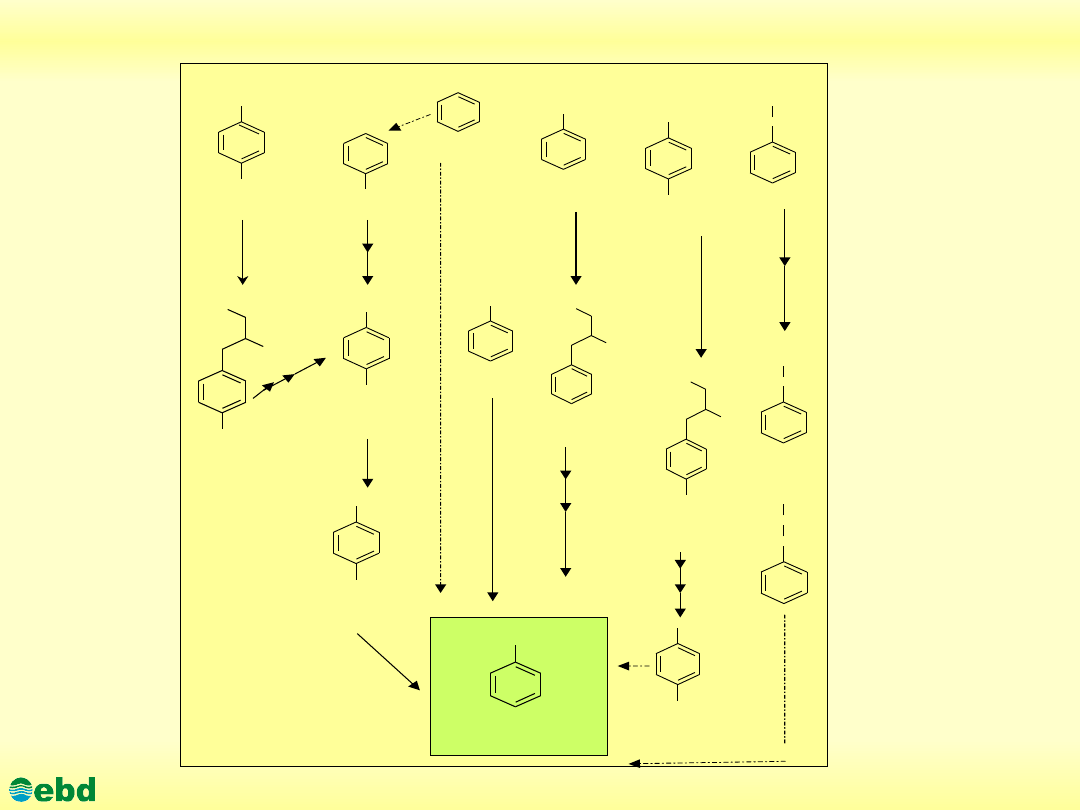
Proponowane drogi biodegradacji toluenu
(1.17)
CH
3
CH
3
OH
OH
H
H
CH
2
OH
CH
3
OH
CH
3
OH
CH
3
OH
Cis
-
dihydrotoluen
p- krezol
Toluen
Alkohol
benzylowy
o- krezol
m- krezol
cis- 2,3-
dihydroksytoluen
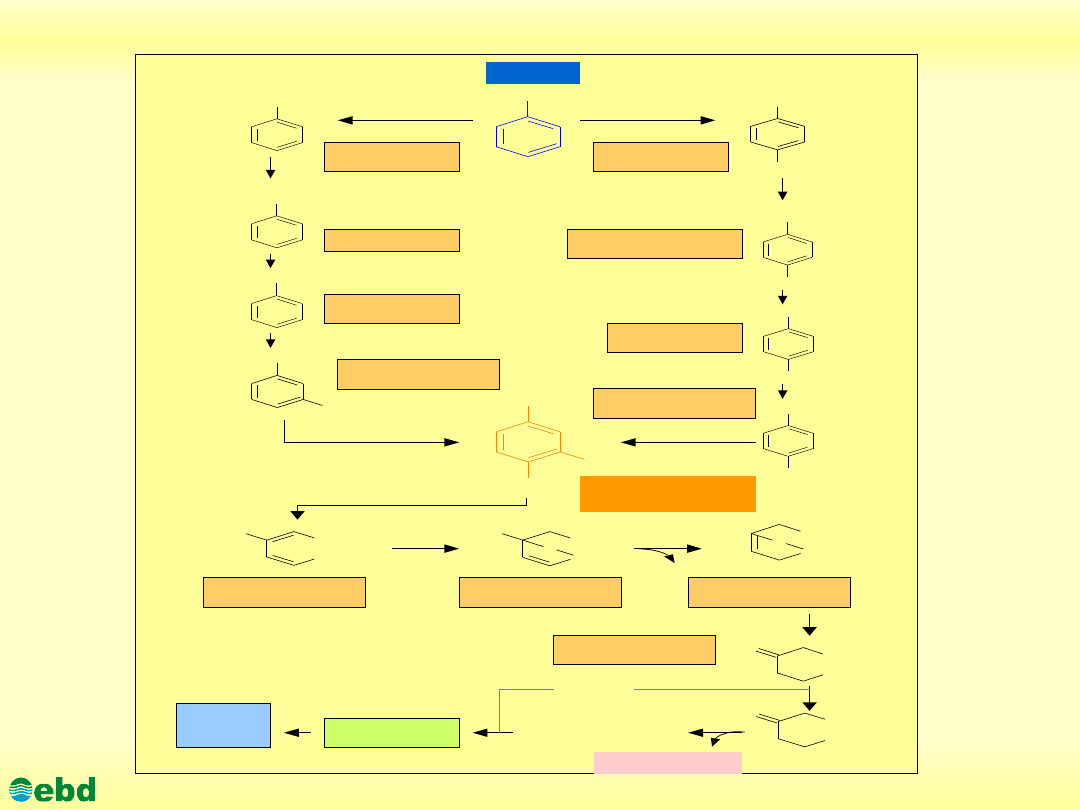
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi biodegradacji toluenu
(1.18a)
CH
2
OH
CHO
COOH
COOH
OH
CH
3
OH
OH
CH
2
OH
OH
CHO
OH
COOH
COOH
COOH
HOOC
CO
COOH
HOOC
O
CO
COOH
O
COOH
COOH
O
COOH
O
CO-SCoA
bursztynylo-
CoA
bursztyni
an
Co
A
Cykl
Krebs
a
Toluen
CH
3
Alkohol
benzylowy
Benzaldehyd
Kwas
benzoesowy
4-hydroksy-
toluen
Kwas 3-hydroksy-
benzoesowy
Alkohol 4-hydroksy-
benzylowy
4-hydroksy-
benzaldehyd
Kwas 4-hydroksy-
benzoesowy
COOH
OH
OH
Kwas
protokatecho
wy
Kwas 3-karboksy-
-
cis,cis
- mukonowy
4-karboksy-
mukonolakton
4- adypin- 3- eno-
lakton
Kwas
3-oksoadypinowy
3-ketoadypilo-CoA
CO
2
acetylo-CoA
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
a)
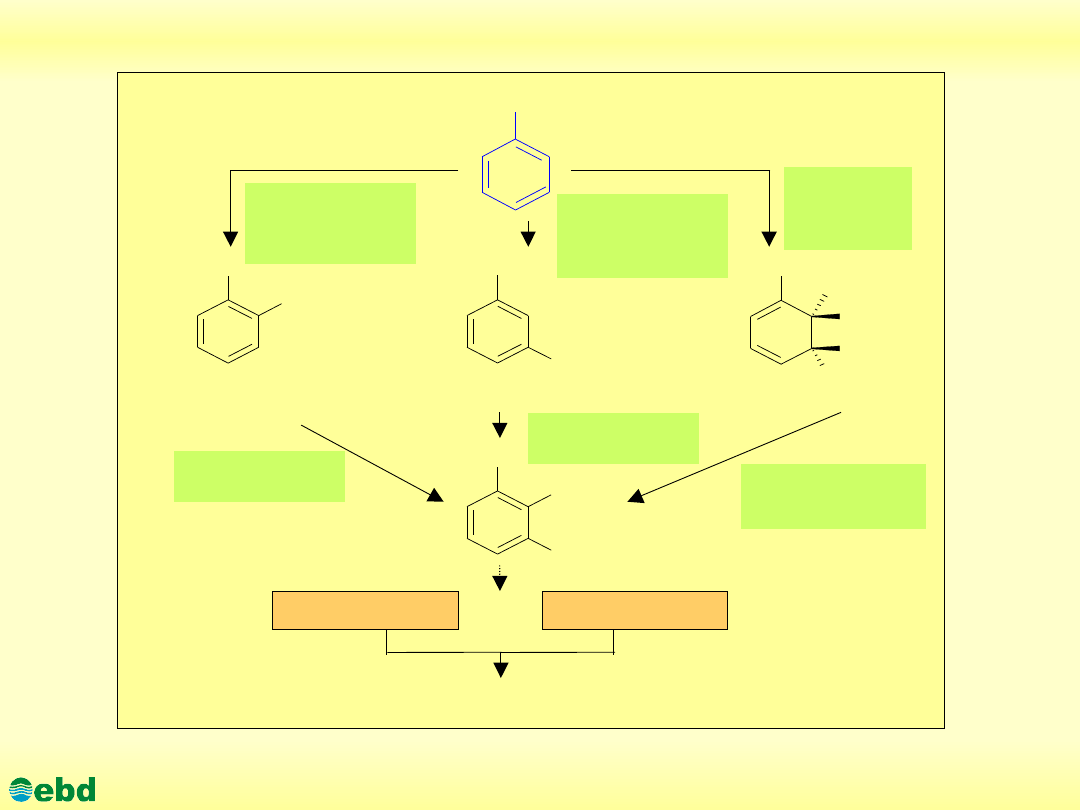
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi biodegradacji toluenu
(1.18b)
CH
3
CH
3
OH
CH
3
OH
CH
3
OH
OH
H
H
CH
3
OH
OH
Kwas pirogronowy
Aldehyd octowy
+
Cykl Krebsa
o- krezol
m- krezol
Toluen
2-monooksygenaza
toluenowa
EC 1.14.13.-
dioksygenaza
toluenowa
EC 1.14.12.11
3-monooksygenaza
toluenowa
EC 1.14.13.-
3-metylokatechol
3-monooksygenaza
toluenowa
dehydrogenaza cis-
dihydrotoluenowa
2-monooksygenaza
toluenowa
b)

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Enzymy uczestniczące w rozszczepieniu pierścienia toluenu
•
. monooksygenaza toluenowa
EC 1.14.13.-
•
.
dehydrogenaza benzylowa
EC 1.1.1.90
•
. dehydrogenaza benzaldehydowa
EC 1.2.1.28
•
. 3-monooksygenaza benzoesanowa
EC 1.14.13.12
•
. 3-monooksygenaza hydroksybenzoesowa
EC 1.14.13.2
•
. 4-monooksygenaza toluenowa
EC 1.14.13.-
•
. 4-monooksygenaza hydroksytoluenowa
•
. dehydrogenaza 4-krezolowa
EC 1.17.99.1
•
. dehydrogenaza 4-hydroksybenzaldehydowa
EC 1.2.1.64
10. 3-monooksygenaza 4-hydroksybenzoesanowa
EC 1.14.13.2
•
1. 3,4-dioksygenaza protokatechanowa
EC 1.13.11.3
•
2. izomeraza 3-karboksymukonianowa
•
3. dekarboksylaza 4-karboksymukonolaktonowa
•
4. enololaktonaza 3-oksoadypinianowa
EC 3.1.1.24
•
5. transferaza 3-oksoadypino-CoA
EC 2.8.3.6
•
6. C-acetylotransferaza acetylo-CoA
EC 2.3.1.16
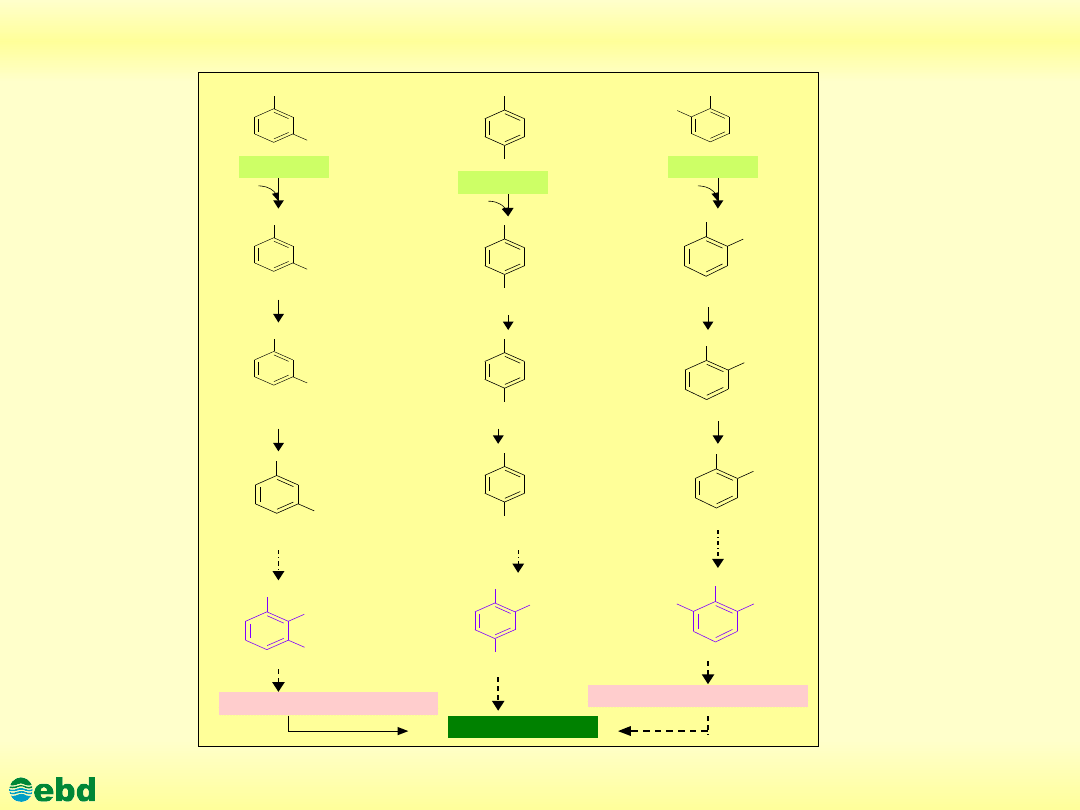
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi biodegradacji o-,m-, p-ksylenu (1.19)
CH
3
CH
3
CH
3
CH
3
CH
3
C
H
3
m-
ksylen
p-
ksylen
o-
ksylen
CH
3
CH
2
OH
CH
3
CH
2
OH
Alkohol m-metylobenzylowy
Alkohol p-metylobenzylowy
Alkohol o-metylobenzylowy
CH
3
CHO
CH
3
CHO
Aldehyd m-toluilowy
Aldehyd p-toluilowy
Aldehyd o-toluilowy
CH
3
COOH
CH
3
COOH
Kwas m-toluilowy
Kwas p-toluilowy
Kwas o-toluilowy
CH
3
OH
OH
CH
3
OH
OH
O
2
O
2
O
2
EC 1.14.13.-
EC 1.1.1.90
EC 1.14.13.-
EC 1.1.1.90
CH
3
CH
2
OH
CH
3
CHO
COOH
CH
3
CH
3
OH
O
H
3-metylokatechol
Kwas pirogronowy + aldehyd octowy
Cykl Krebsa
4-metylokatechol
3-metylokatechol
Kwas pirogronowy + aldehyd octowy
EC 1.2.1.7
EC 1.2.1.7
EC 1.14.12.10
EC 1.13.11.2
EC 1.2.1.7
EC 1.14.12.10
EC 1.3.1.67
EC 1.14.13.-
EC 1.1.1.90
EC 1.14.12.-
EC 1.3.1.68
EC 1.13.11.2
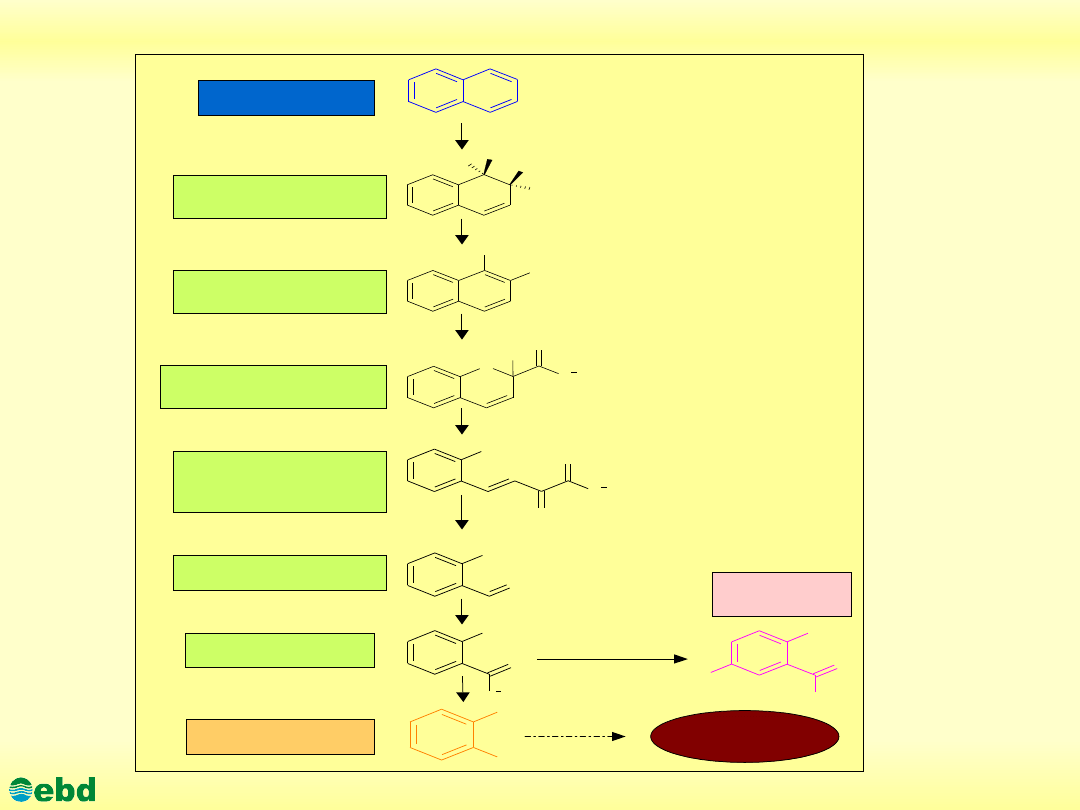
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi mikrobiologicznej degradacji WWA (naftalen) (1.20)
OH
OH
H
H
OH
OH
O
OH
O
O
OH
O
O
O
OH
O
OH
O
O
OH
OH
Naftalen
cis
-1,2-
dihydroksy-1,2-
dihydronaftalen
1,2-
dihydroksynaftale
n
2-
hydroksychromeno-
2- karboksylan
(HCCA)
??
Trans
-o-
hydroksybenzylide
no-pirogronian
(tHBPA)
Aldehyd
salicylowy
Salicylan
Kwas
gentyzowy
Katechol
Cykl Krebsa
1,2- dioksygenaza
naftalenowa
dehydrogenaza
cis
1,2-
dihydroksy-1,2-
dihydronaftalenowa
dioksygenaza 1,2-
dihydroksynaftalenowa
aldolaza kwasu trans-o-
hydroksy-
benzylopirogronianowego
dehydrogenaza
salicyloaldehydow
a
OH
O
O
H
OH
5-hydroksylaza salicylowa
EC 1.14.13.-
1-monooksygenaza
salicylanowa
EC 1.14.12.12
EC 1.3.1.29
EC 1.13.-
EC 5.3.99.-
EC 1.2.1.65
EC 1.14.13.1
EC 4.2.1.-
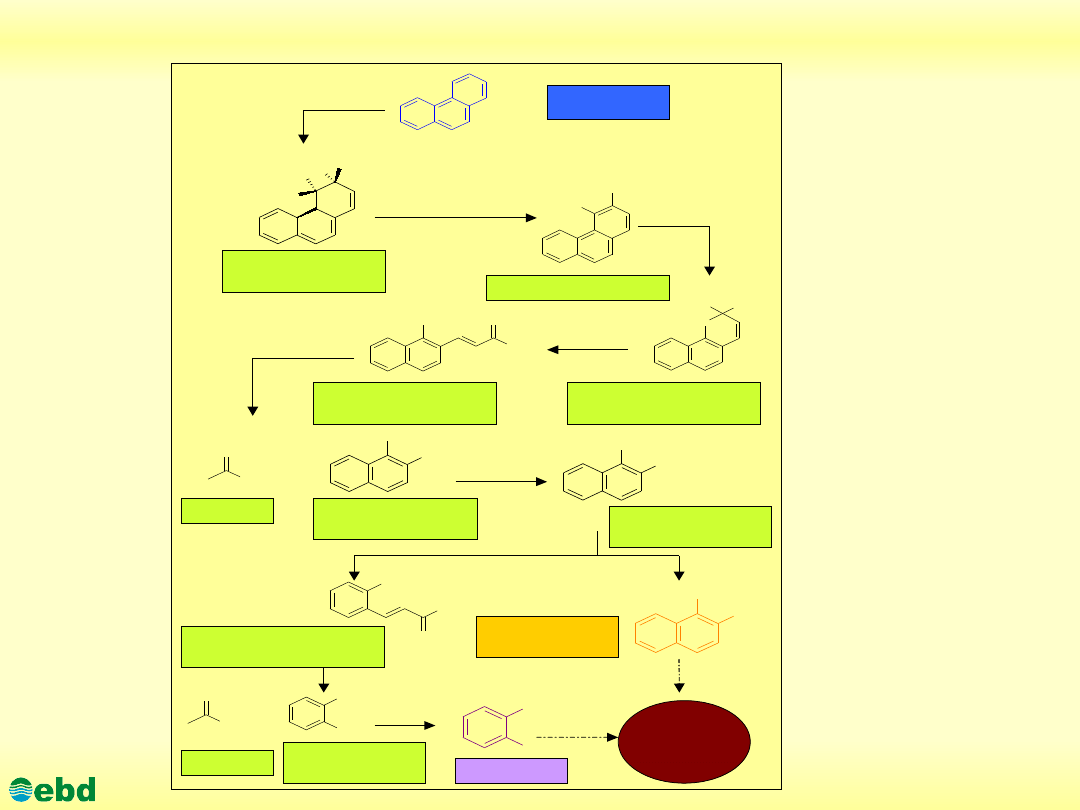
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drogi mikrobiologicznej degradacji WWA (fenentren) (1.21)
EC 1.13.11-
H
H
OH
O
H
OH
O
H
O
OH
HOOC
COO-
O
OH
OH
CHO
COO-
O
+
OH
COO-
OH
OH
COO-
COO-
O
COO-
O
COO-
CHO
+
Szlaki
metabolizmu
pośredniego
fenantren
cis-3,4-dihydroksy-
3,4-dihydrofenantren
3,4-dihydroksyfenantren
2-hydroksy-2H benzo[h]-
chromeno-2-karboksylan
cis-4-(1΄-hydroksynaft-
2΄ylo)-2-oksobut-3-enian
pirogronian
1-hydroksynaftaleno-
2-karboaldehyd
1-hydroksynaftaleno-
2-karboksylan
trans 4-(o-karboksyfenylo)-
but-3-enian
1,2-dihydroksy-
naftalen
Kwas 2-
formylobenzoesowy
pirogronian
o-ftalan
dioksygenaza
fenantrenowa
dehydrogenaza
cis-3,4-
dihydrofenantreno-3,4-
diolowa
dioksygenaza 3,4-
fenantrenowa
izomeraza
hydrataza-aldolaza
cis-4-
(1΄-hydroksynaft-2΄ylo)-
2-oksobut-3-enianowa
dehydrogenaza
1,2-dioksygenaza 1-
hydroksy-2-
naftenianowa
hydroksylaza
aldolaza 4-(2-karboksyfenylo)-2-
oksobut-3-enonianowa
EC 4.1.2.34
dehydrogenaza
COO-
COO-
EC 1.13.11-
EC 1.3.1.49
EC 5.1.2-
EC 4.2.1-
EC 1.2.1-
EC 1.14.13-
EC 1.13.11.38
EC 1.13. -
EC 1.2.1.-

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Mechanizm biodegradacji
węglowodorów w warunkach
beztlenowych

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Mechanizm biodegradacji węglowodorów w warunkach
beztlenowych
Do niedawna najczęściej badano rozkład węglowodorów
przebiegający wwarunkach tlenowych, w których tlen pełnił rolę
końcowego akceptora elektronów.
Obecnie istotnym postępem w procesach biodegradacji
węglowodorów jest wzrastająca ilość badań dotycząca
stosowania innych niż tlen atmosferyczny akceptorów
elektronów. Mogą to być siarczany, węglany, jak również
azotany wykorzystywane przez drobnoustroje anaerobowe jako
nieorganiczne akceptory elektronów w procesach beztlenowego
rozkładu węglowodorów.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Akceptory elektronów uczestniczące w procesach
beztlenowego rozkładu węglowodorów
Akceptor
elektronów
Produkt
redukcji
Typ oddychania
Mikroorganizmy
S, H
2
S
NO
2
-
, NH
3,
N
2
Denitryfikac-
ja
Bacillus,
Pseudomonas
SO
4
2-
NO
3
-
redukcja
siarczanów
Desulfovi-
brio
CO
2
CH
4,
fermentacja
metanowa
Fe
3+
Fe
2+
redukcja żelaza
Shewanella
putrefaciens

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Mechanizm biodegradacji węglowodorów w warunkach
beztlenowych
Wielocząsteczkowe substancje organiczne ulegają rozkładowi
do prostszych połączeń wg poniższej zależności:
Substrat + (
NO
3
-
, Mn
4+
, Fe
3+
, SO
4
2-
, CO
2
)
→
Biomasa + CO
2
+ (
N
2,,,
Mn
2+
,Fe,S
,
CH
4
)
Istotne znaczenie w przebiegu metabolizmu degradacji
węglowodorów w warunkach beztlenowych odgrywają reakcje o
charakterze
oksydoredukcyjnym,
w
których
związki
nieorganiczne (jony azotanowe, siarczanowe, węglanowe oraz
jony żelaza i manganu) pełnią funkcję akceptora elektronów
(tab. 1.7.). W zależności od rodzaju obecnego w danym
środowisku akceptora elektronów procesy biodegradacji
węglowodorów mogą być prowadzone przez bakterie
denitryfikujące, redukujące siarczany i żelazo oraz bakterie
metanogenne.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja n-alkanów
W szlaku degradacji n-alkanów z udziałem szczepów
redukujących
siarczany
rozkład
zachodzi
poprzez
karboksylację łańcucha alkilowego w pozycji C3, a następnie
eliminację dwóch atomów węgla (w pozycji C1 i C2)
i przekształcenie
cząsteczki
węglowodoru
do
kwasu
tłuszczowego. Kwasy tłuszczowe dalej są degradowane na
drodze
β
-oksydacji. Inny mechanizm rozkładu n-alkanów
obserwowano z udziałem bakterii denitryfikujących. Istotna
różnica dotyczyła mechanizmu inicjacji rozpadu cząsteczki n-
alkanu. W wyniku reakcji wolnorodnikowej cząsteczki alkanu
(1)
z fumaranem powstaje (1-metyloalkilo)-bursztynian
(2)
.
Przyłączenie fumaranu katalizowane przez syntetazę
bursztynianową zachodzi w pozycji C2 łańcucha alkilowego.
Dalsze utlenianie przez odpowiednio: (1-metyloalkilo)-
bursztynylo-CoA
(3)
, (2-metyloalkilo)-malonylo-CoA
(4)
, 4-
metyloalkanoilo-CoA
(5)
kończy proces
β
-oksydacji.
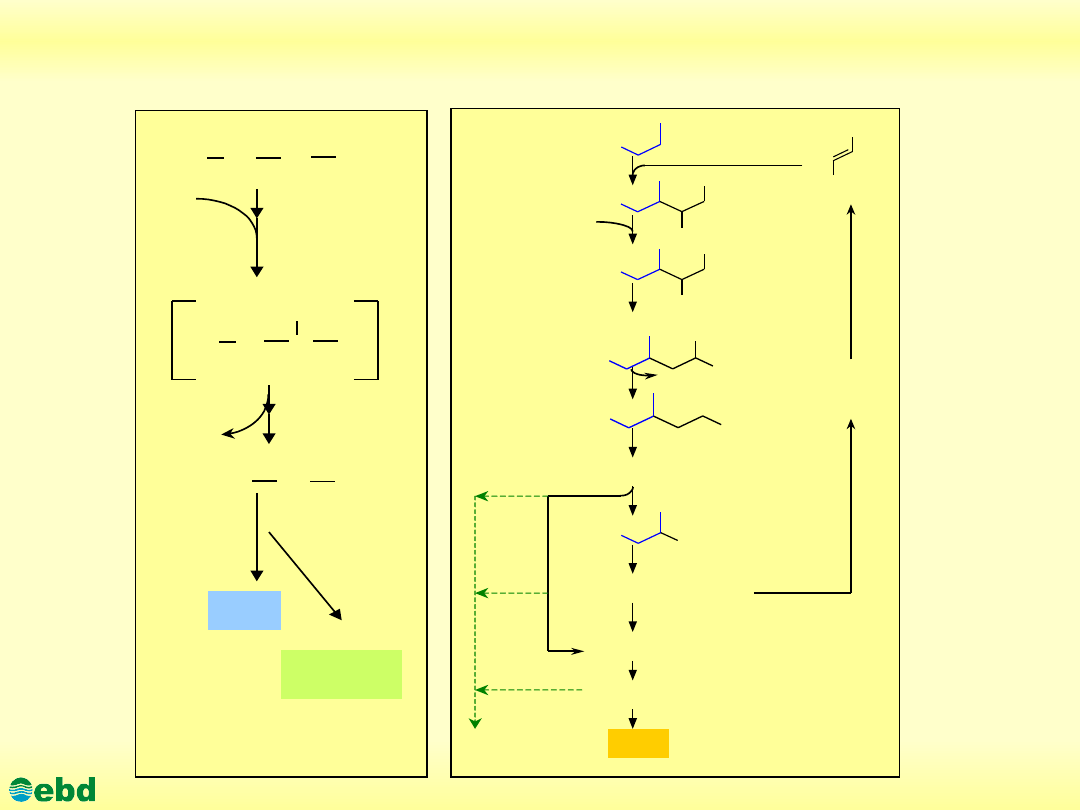
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Szlaki degradacji n-alkanów w warunkach beztlenowych
(1)–
szczep redukujący siarczany,
(2)
-szczep redukujący azotany
C
H
3
CH
2
CH
2
R
+ CO
2
C
H
3
CH
2
R
CH
COOH
- C
2
CH
2
R
HOOC
β
-oksydacja
CO
2
Materiał
budulcowy
komórki
R
R
COO-
COO-
R
COO-
CO-SCoA
R
CO-SCoA
R
COO-
CO-SCoA
β
-
oksydacja
R
CO-SCoA
Kolejne etapy degradacji
Terminalna oksydacja
CH
3
CO-SCoA
CO
2
COO-
COO-
Szlak
alternatywny
[H]
[H]
[H]
Redukcja akceptora
elektronów
(1)
(2)
Reakcja wolnorodnikowa
HSCoA
(+ energia)
Przegrupowanie
szkieletu węglowego
CO
2
1
2
3
4
5
6

http://kbs.ise.polsl.pl
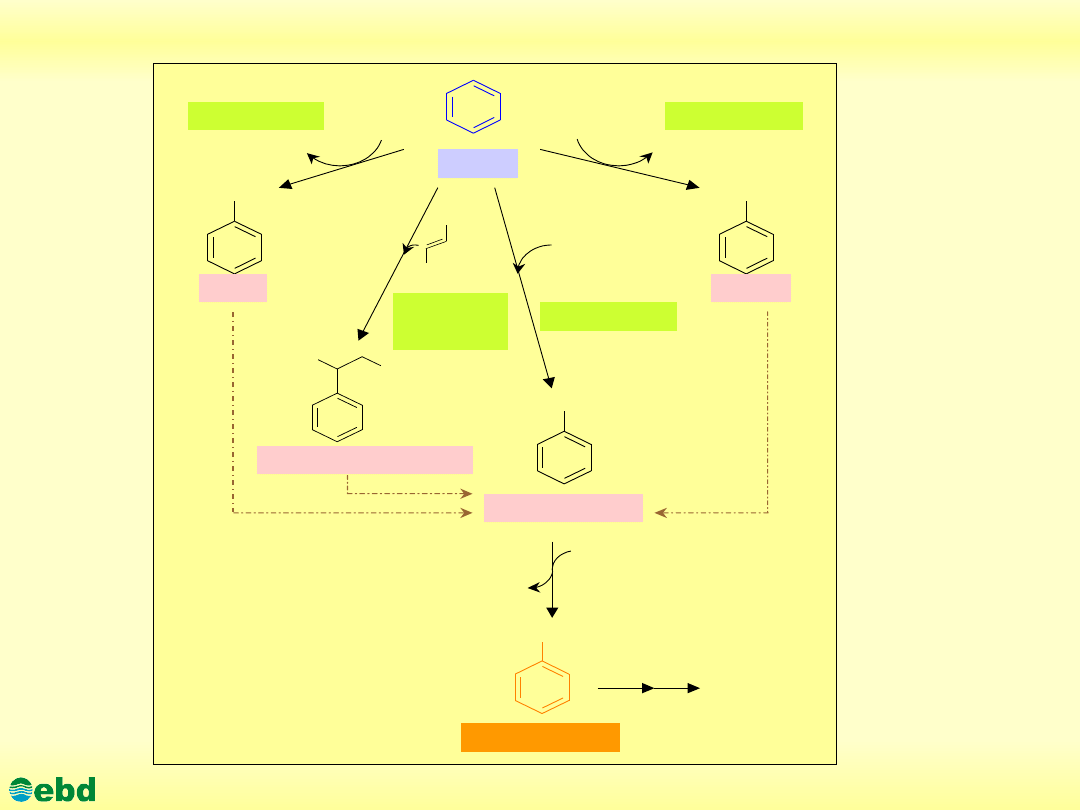
Environmental Biotechnology Department, SUT
Biodegradacja węglowodorów aromatycznych
Rozkład
węglowodorów
aromatycznych
w
warunkach
anaerobowych jest procesem skomplikowanym. Trudność
degradacji tego typu związków wynika z dużej stabilności
układów aromatycznych, jak również z braku tlenu
cząsteczkowego
ułatwiającego
rozerwanie
pierścienia
aromatycznego. Beztlenowa biodegradacja węglowodorów
aromatycznych jest procesem dwustopniowym:
•1. w pierwszym etapie związki aromatyczne są przekształcane
do jednego z trzech centralnych metabolitów tj. floroglucyny
(1,
3,
5-
trihydrosybenzenu),
rezorcyny
(1,
3-
dihydroksybenzenu) bądź benzoilo-CoA (który ma największe
znaczenie, rys. 1.24.);
•2. w drugim etapie następuje kolejno redukcja pośredników do
związków
alicyklicznych,
rozerwanie
pierścienia
i
transformacja produktów reakcji poprzez
β
- oksydację do
centralnych metabolitów tj. acetylo-CoA i CO
2.
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Beztlenowa biodegradacja benzenu i jego pochodnych(1.24)
CH
3
OH
OH
CH
3
CH
2
CH
3
CH
3
CH
3
m, p-
krezol
fenol
benzen
toluen
m,o, p-
ksylen
etylobenze
n
OH
COOH
HOOC
OH
COOH
COOH
kwas
benzoesow
y
CO-SCoA
OH
COOH
HOOC
COOH
HOOC
CH
3
CO
CH
3
CO
CH
2
COOH
CH
3
CO-SCoA
CO-SCoA
Benzoilo-CoA
Kwas p-
hydroksybenzylo-
bursztynowy
Kwas 4-
hydroksybenzoesowy
Kwas
benzylobursztynowy
acetofenon
Kwas p-
metylobenzylo-
bursztynowy
4-hydroksy-
benzoilo-CoA
4-metylo-
benzoilo-CoA
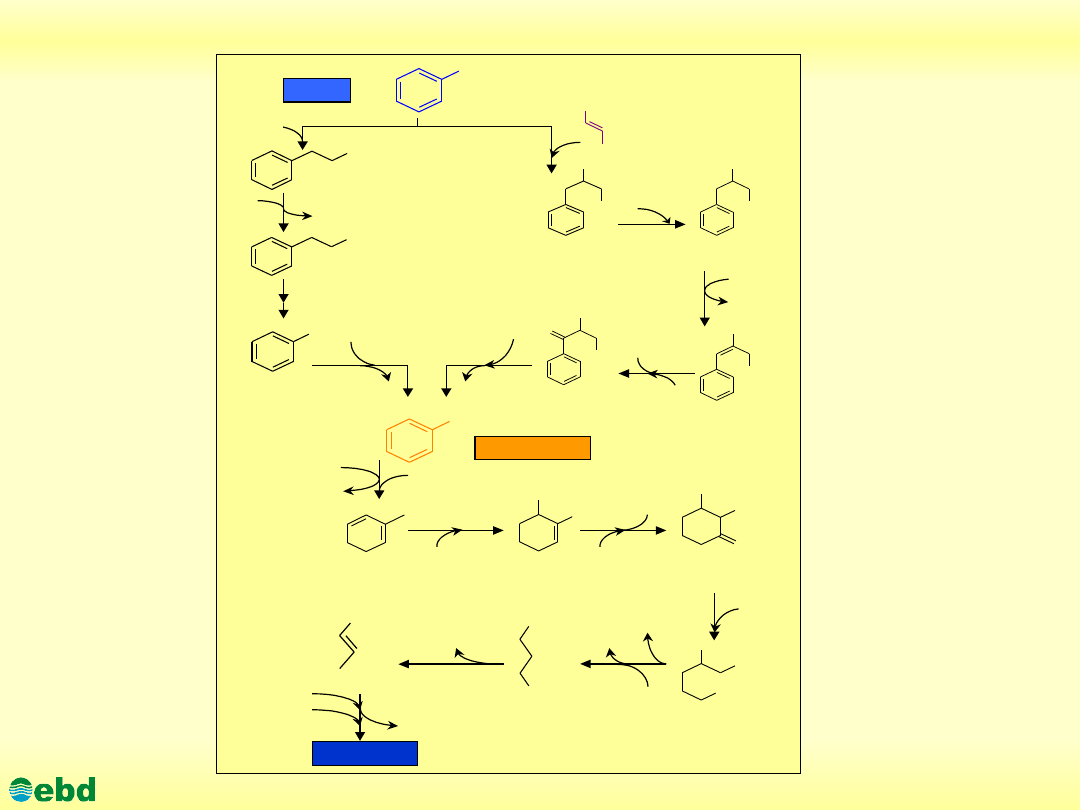
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Proponowane drogi beztlenowej degradacji benzenu (1.25)
OH
H
2
O
H
+
fenol
CH
3
toluen
benze
n
CH
3
-X
X
COOH
COOH
COOH
HOOC
COOH
CO
2
Kwas
benzoesowy
CoASH + ATP
AMP + PP
i
COSCoA
Benzoilo-CoA
CO
2
metylowanie
karboksylac
ja
addycja do
kwasu
fumarowego
hydroksylac
ja
Kwas 2- fenylobursztynowy
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
2 ETF
ox
2 ETF
red
CH
3
CO-SCoA
COOH
COOH
CO-SCoA
COOH
COOH
COOH
COSCoA
COOH
COSCoA
COOH
COSCoA
O
CO-SCoA
CO-SCoA
OH
CO-SCoA
O
OH
CO-SCoA
COOH
CO-SCoA
CO-SCoA
COOH
OH
2 acetylo-CoA
toluen
benzoilo-
CoA
CoASH
H
2
O
2 [H]
CoASH
bursztynylo-CoA
COOH
COOH
Acetylo-CoA
CoASH
H
2
O
CoASH
AMP + PP
i
2 ATP
2 ADP + P
i
2 [H]
H
2
O
H
2
O
2 [H]
H
2
O
Acetylo-CoA
CoASH
2 [H]
2 [H] + CO
2
H
2
O
CoASH
2 [H]
2
1
fumaran
Kwas
benzylobursztynowy
Benzylobursztynylo-CoA
Fenyloitakonylo-CoA
Benzoilo-
bursztynylo-CoA
1,5-Cykloheksadienylo-
1-karboksylo- CoA
6-hydroksy-1-cyklo-
heksenylo-1-karboksylo CoA
2-okso-6-hydroksycyklo-
heksylo-1-karboksylo- CoA
3-hydroksypimelinylo-
CoA
Glutarylo- CoA
Krotonylo-CoA
2 ETF
ox
2 ETF
red
Metabolizm toluenu i dalsze losy benzoilo-CoA (1.26)
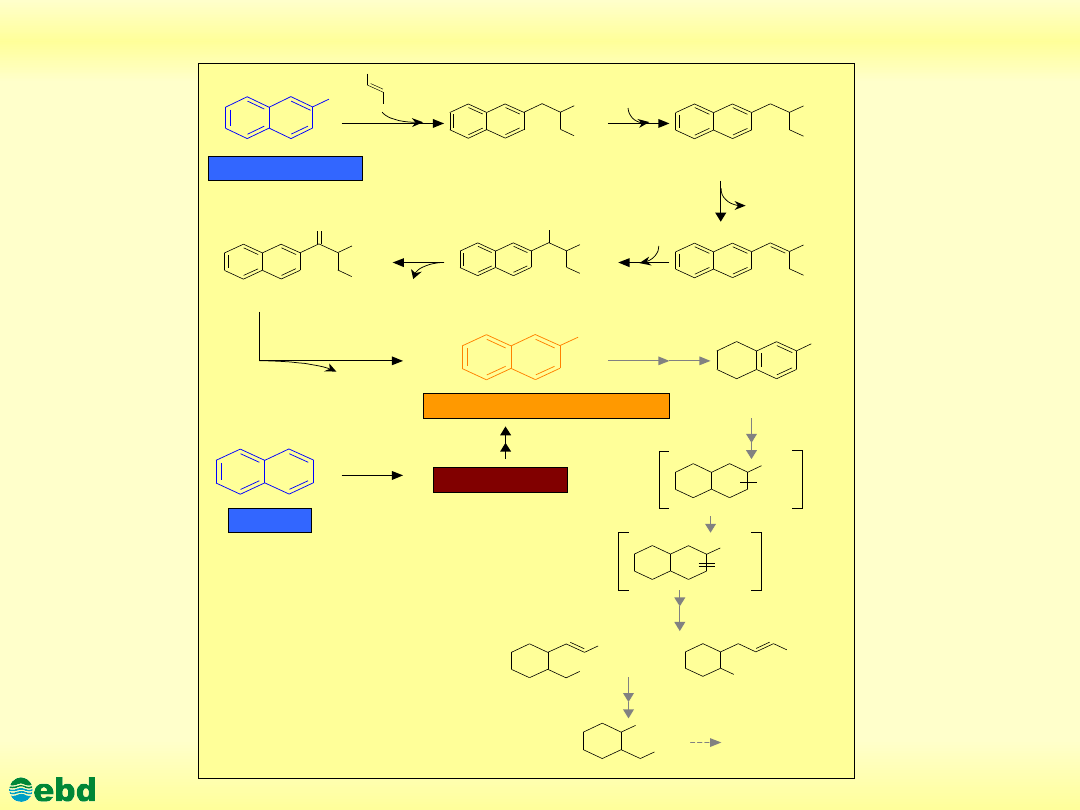
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Biodegradacja naftalenu i jego pochodnych
(1.28)
CH
3
COOH
COOH
COOH
COOH
COOH
CO-SCoA
COOH
CO-SCoA
CoASH
2 [H]
COOH
CO-SCoA
OH
COOH
CO-SCoA
O
COOH
Karboksylacja
hydrogenacja
COOH
H
2
O
2 [H]
Bursztynylo-CoA
COOH
OH
COOH
O
COOH
COOH
COOH
COOH
COOH
COOH
lub
2-
metylonaftalen
Kwas 2-
naftalenokarboksylowy
naftale
n
Kwas 2- metylonaftylo -
bursztynowy
2- metylonaftylo-
bursztynylo-CoA
2- metylenonaftylo-
bursztynylo-CoA
2-hydroksymetylonaftylo-
bursztynylo-CoA
2-oksometylonaftylo-
bursztynylo-CoA
Kwas 5,6,7,8-tetrahydro-2-
naftalenokarboksylowy
Kwas oksodekahydro-2-
naftalenokarboksylowy
Kwas
2-karboksycykloheksylooctowy
?

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Metabolizm-podsumowanie
Generalnie w procesach transformacji węglowodorów z
udziałem drobnoustrojów do związków o krótszym łańcuchu
węglowodorowym bądź związków o zwiększonej podatności na
degradację (metabolitów pośrednich) zachodzą następujące
reakcje utleniania:
Terminalna oksydacja.
Najczęściej włączenie (insercja)
aktywnego tlenu następuje przy końcowym węglu w łańcuchu
alkilowym węglowodorów z wytworzeniem alkoholu. Dalsze
utlenianie alkoholi, przez kolejno aldehydy i kwasy organiczne,
kończy proces
β
- oksydacji.
Diterminalna oksydacja
.
Insercja tlenu następuje na obu
końcach łańcucha alkilowego alkanów, co w efekcie kolejnych
reakcji utleniania daje kwas dikarboksylowy.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Metabolizm-podsumowanie
Subterminalna oksydacja. Oksydacja dotyczy atomów węgla
położonych subterminalnie w cząsteczkach węglowodorów i
prowadzi do przekształcenia ich w drugorzędowe alkohole, a
następnie w ketony i estry.
β
- oksydacja. Cykl rozkładu kwasów tłuszczowych w
powtarzajacej się sekwencji czterech reakcji: utlenienia przez
FAD, uwodnienia, utlenienia sprzężonego z redukcją NAD
+
oraz
tiolizy przez CoA. W rezultacie każdego cyklu tych reakcji
łańcuch węglowodorowy grupy acylowej jest skracany o dwa
atomy węgla oraz powstaje FADH
2
, NADH i acetylo-CoA.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Metabolizm-podsumowanie
ω
- oksydacja. Proces
ω
- oksydacji jest charakterystyczny
dla degradacji alkanów rozgałęzionych. Obecność podstawników
jest czynnikiem hamującym proces
β
-oksydacji, z tego względu
kwasy tłuszczowe są atakowane na drugim końcowym węglu
prowadząc do powstania kwasów dikarboksylowych.
Oksydacja podwójnego wiązania
.
Alkeny terminalne są
stosunkowo łatwo degradowane przez atak na końcowy atom
węgla bądź utlenienie bezpośrednio atomów węgla połączonych
podwójnym wiązaniem z wytworzeniem epoksydów lub dioli.
Alkeny z wiązaniem podwójnym zlokalizowanym wewnątrz
cząsteczki węglowodorowej są rozkładane w procesie
mikrobiologicznym wolniej niż alkeny terminalne; metabolitami
końcowymi są zarówno nasycone, jak i nienasycone kwasy
tłuszczowe.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Metabolizm-Podsumowanie
Oksydatywne rozszczepienie pierścienia aromatycznego.
Rozszczepienie pierścienia aromatycznego zachodzi poprzez
wprowadzenie dwóch atomów tlenu do cząsteczki z udziałem
dioksygenaz, a nastepnie przez reakcje dehydrogenacji do
pochodnych dihydroksylowych. Rozerwanie pierscienia może
mieć miejsce między dwiema sąsiadującymi grupami
hydroksylowymi (rozszczepienie typu
orto-
) albo między
hydroksylowanym i sąsiadującym niehydroksylowanym atomem
węgla (rozszczepienie typu
meta-
).

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Metabolizm-czynniki biologiczne
Obok czynników o charakterze fizyko-chemicznym zasadniczą
rolę w procesie metabolizowania produktów naftowych
odgrywają czynniki biologiczne (tj. skład jakościowy i ilościowy
drobnoustrojów, ich aktywność metaboliczna i zdolności
adaptacyjne). Drobnoustroje zdolne do wykorzystywania
węglowodorów w charakterze jedynego źródła węgla i energii
są szeroko rozpowszechnione w przyrodzie. Wśród nich
znajdują się szczepy zarówno bakterii, grzybów, jak
i promieniowców. W środowisku skażonym produktami
naftowymi szybkość rozkładu węglowodorów oraz liczebność
drobnoustrojów zdolnych do ich rozkładu stopniowo wzrasta od
momentu skażenia. Zjawisko to wynika z selekcji
drobnoustrojów, polegającej na eliminacji gatunków wrażliwych
na toksyczne oddziaływanie wprowadzonych związków, a także
ze stopniowej adaptacji mikroorganizmów do nowego substratu
wzrostowego.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Drobnoustroje zdolne do rozkładu węglowodorów
Mikroorganizmy rozkładające węglowodory są szeroko
rozpowszechnione w przyrodzie, występują w ekosystemach
wodnych i lądowych, a w większych ilościach w miejscach
zanieczyszczonych produktami naftowymi.
Liczebność drobnoustrojów heterotroficznych zdolnych do
rozkładu węglowodorów jest różna dla poszczególnych
ekosystemów wodnych i glebowych.
Częstość występowania tego typu organizmów wśród:
•- grzybów glebowych waha się od 0,13 % do 50 %,
•- bakterii glebowych od 6 % do 82 %
•- bakterii wodnych od 0,03 % do 100 %
w stosunku do ogólnej liczebności mikroorganizmów.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Metabolizm-czynniki biologiczne
W praktyce metody oparte na naturalnym doborze mikroflory,
nie zawsze pozwalają na szybką i skuteczną biodegradację
trudnorozkładalnych związków. Dlatego też, coraz częściej
prowadzi się badania nad przyśpieszaniem biodegradacji
stosując w charakterze inokulantów aktywne czyste kultury
drobnoustrojów wyizolowanych ze skażonych środowisk natu-
ralnych (bioaugmentacja). Szczególną rolę w adaptacji
genetycznej odgrywają plazmidy. Znane są wśród nich
plazmidy zawierające geny kodujące enzymy szlaków
degradacji węglowodorów np. CAM- alkany, TOL- toluen, TOM-
toluen czy metylofenole, NAH- naftalen. Obecnie wiele uwagi
poświęca się konstruowaniu techniką inżynierii genetycznej
mikroorga-nizmów degradujących wybrane węglowodory z
wysoką wydajnością. Przykładem jest
Pseudomonas putida
z
konstytu-tywnie wytwarzaną hydroksylazą n-alkanów i
hydroksylazą alkoholową tj. enzymami katalizującymi dwa
pierwsze etapy utleniania węglowodorów aromatycznych.
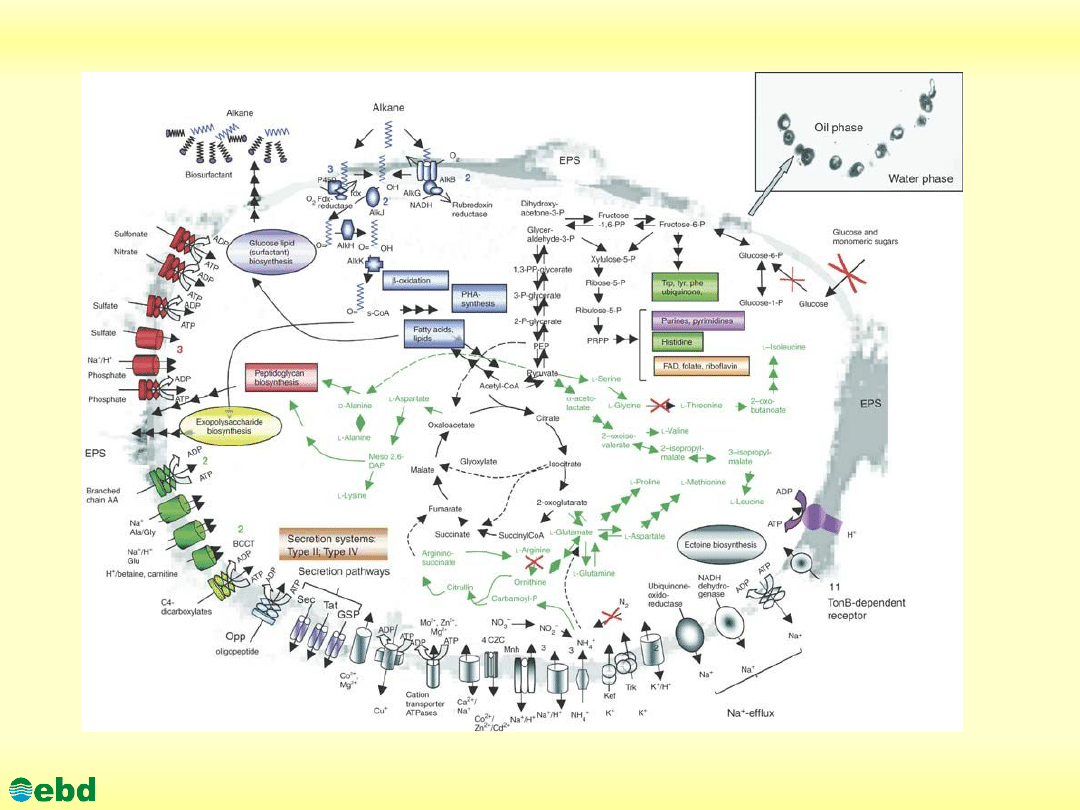
http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Transport i metabolizm w
A. Borkumensis
(schemat)

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Genome sequence of the ubiquitous hydrocarbon-
degrading marine bacterium
Alcanivorax borkumensis
Susanne Schneiker
1, 3, 8
, Vítor AP Martins dos Santos
2, 8
, Daniela Bartels
3
, Thomas Bekel
3
,
Martina Brecht
1, 3
, Jens Buhrmester
1
, Tatyana N Chernikova
2, 4
, Renata Denaro
5
, Manuel
Ferrer
2, 7
, Christoph Gertler
2, 4
, Alexander Goesmann
3
, Olga V Golyshina
2, 4
, Filip Kaminski
2
, Amit
N Khachane
2
, Siegmund Lang
6
, Burkhard Linke
3
, Alice C McHardy
3, 7
, Folker Meyer
3
, Taras
Nechitaylo
2, 4
, Alfred Pühler
1, 3
, Daniela Regenhardt
2, 7
, Oliver Rupp
3
, Julia S Sabirova
2, 4
,
Werner Selbitschka
1, 3
, Michail M Yakimov
2, 5
, Kenneth N Timmis
2, 4
, Frank-Jörg Vorhölter
1, 3
,
Stefan Weidner
1, 3
, Olaf Kaiser
1, 3, 8
& Peter N Golyshin
2, 8
1
Lehrstuhl für Genetik, Fakultät für Biologie, Universität Bielefeld, D-33594 Bielefeld,
Germany.
2
Division of Microbiology, German Research Center for Biotechnology, D-38124 Braunschweig,
Germany.
3
Center for Biotechnology (CeBiTec), Universität Bielefeld, D-33594 Bielefeld, Germany.
4
Institute for Microbiology, Technical University of Braunschweig, D-38106 Braunschweig,
Germany.
5
Istituto per l'Ambiente Marino Costiero (CNR), I-98122 Messina, Italy.
6
Institute of Biochemistry and Biotechnology, Technical University of Braunschweig, D-38106
Braunschweig, Germany.
7
Present adresses: Institute of Catalysis, Campus UAM, E-28049 Madrid, Spain (M.F.),
Bioinformatics & Pattern Discovery Group, IBM Thomas J Watson Research Center, Yorktown
Heights, New York 10598. USA (A.C.McH.), Division Biogeochemistry, Research Centre
Rossendorf, D-01314 Dresden, Germany (D.R.).

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Transport i metabolizm w
A. Borkumensis
(opis)
The background is a transmission electron micrograph
(TEM) of an A. borkumensis cell grown on hexadecane
(courtesy of H. Lünsdorf). The insert in the right upper
corner shows a TEM of A. borkumensis SK2 cells at the
oil-water interface of hydrocarbon droplets in salt water.
Predicted pathways for alkane degradation are depicted in
marine blue. Predicted transporters are grouped by
substrate specificity: inorganic cations (gray), inorganic
anions (dark orange), amino acids/peptides/amines/puri-
nes/pyrimidines and other nitrogenous compounds (dark
green), carboxylates (light green), drug efflux and other
(dark gray). Export or import of solutes is designated by
the direction of the arrow through the transporter.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Transport i metabolizm w
A. Borkumensis
(opis)
The energy coupling mechanisms of the transporters are
also shown: solutes transported by channel proteins are
shown with a double-headed arrow; secondary
transporters are shown with two arrowed lines indicating
both the solute and the coupling ion; ATP-driven
transporters are indicated by the ATP hydrolysis
reaction; transporters with an unknown energy-coupling
mechanism are shown with only a single arrow. The P-type
ATPases are shown with a double-headed arrow to
indicate they include both uptake and efflux systems.
Where multiple homologous transporters with similar
substrate predictions exist, the number of that type of
protein is indicated in parentheses.

http://kbs.ise.polsl.pl
Environmental Biotechnology Department, SUT
Dziękuję za uwagę
Wyszukiwarka
Podobne podstrony:
15 IPICS 2008 Practical Securit Nieznany
07 BIOCHEMIA 2008 metabolizm tluszczow
2008-09. WE.Cwiczenia z Makroekonomii.30+15. Dzienne, EKONOMIA, Rok 1, Podstawy makroekonomii
15 BIOCHEMIA Metabolizm weglowodorow
MIGRENA 2008 id 300249 Nieznany
biochemia cukry instrukcja id 8 Nieznany (2)
instrukcja bhp przy obsludze we Nieznany
biochemia kolo id 86264 Nieznany (2)
15 Slowek G i inni Beton natrys Nieznany
p 15 test 1 read&writ part 3 b Nieznany
odp maj 2008 id 332083 Nieznany
Przemiany roli nauczyciela we w Nieznany
Egzamin 2008 poziom rozszerzony Nieznany
001 Prawo budowlane stan prawny na 15 12 2008 r
2008 01 We Help You To Choose the Best Anti spyware [Consumer test]
Z Wykład 15.03.2008, Zajęcia, II semestr 2008, Analiza matematyczna
więcej podobnych podstron