
Politechnika Łódzka
Wydział Inżynierii Procesowej i Ochrony Środowiska
Katedra Inżynierii Molekularnej
Instrukcja do ćwiczeń z przedmiotu:
Energia ze źródeł niekonwencjonalnych
Ćwiczenie nr 1
Wytwarzanie wodoru w procesie elektrolizy wody
Opracował: mgr inż. Przemysław Makowski
Zatwierdził: prof. dr hab. inż. Jacek Tyczkowski
Łódź 2012
2
1. CEL ĆWICZENIA
Celem ćwiczenia jest zapoznanie się z procesem elektrolizy wody i budową elektrolizera typu PEM oraz
przebadanie procesu wytwarzania wodoru z wody na elektrolizerze typu PEM. Źródłem prądu stałego będzie
bateria fotowoltaiczna oraz zasilacz o stałym napięciu. Przebadana zostanie stechiometria powstawania wodoru
i tlenu w procesie rozkładu wody. Sporządzona zostanie charakterystyka napięciowo–prądowa elektrolizera
PEM
oraz
określona
zostanie
teoretyczna
i
rzeczywista
ilość
produkowanego
wodoru
na elektrolizerze, czyli tzw. wydajność Faradaya oraz wydajność energetyczna produkowanego w ten sposób
wodoru.
2. WSTĘP TEORETYCZNY
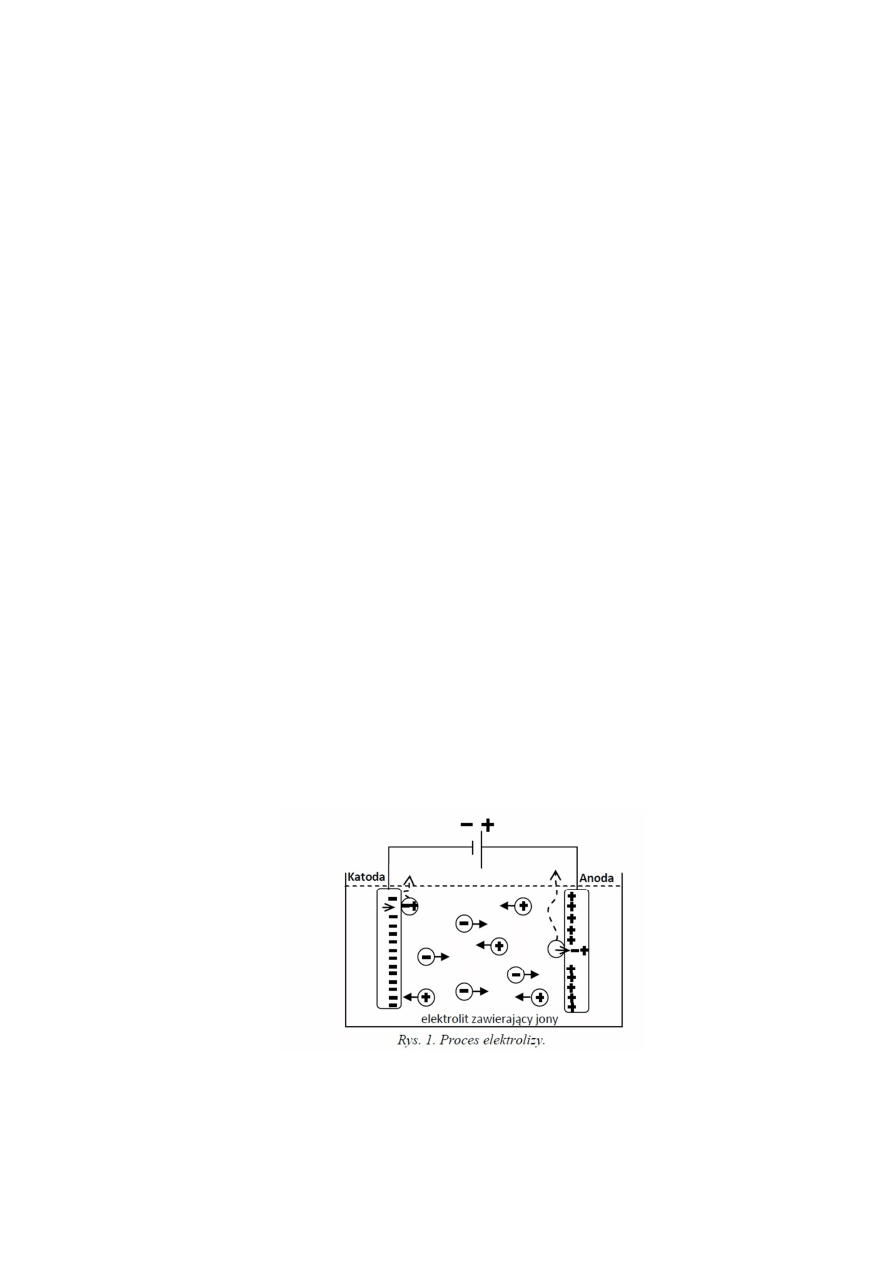
Elektrolizę można zdefiniować jako szereg reakcji utleniania i redukcji wywołanych przepływem prądu
elektrycznego pomiędzy elektrodami zanurzonymi w roztworach elektrolitów (lub ich formach stopionych).
Elektrody połączone są obwodem z zewnętrznym źródłem prądu. Elektroliza jest procesem niesamorzutnym,
więc wymuszana jest poprzez przepływ prądu.
Elektrolizę realizuje się w urządzeniach zwanych elektrolizerami. Klasyczne elektrolizery składają się
z dwóch elektrod połączonych ze sobą przewodem elektrycznym z wpiętym w niego źródłem prądu stałego
o określonym napięciu powodującym powstanie różnicy potencjałów na elektrodach. Obie elektrody zanurzane
są w tym samym roztworze zawierającym jony (zwanym elektrolitem), zamykając w ten sposób obwód
elektryczny. Elektrody nazywane są odpowiednio katodą (połączona jest ona z ujemnym biegunem źródła prądu)
i anodą (połączona jest ona z dodatnim biegunem źródła prądu). Ruch elektronów od anody do katody odbywa
się zewnętrznym przewodem elektrycznym łączącym elektrody. Kationy w roztworze poruszają się natomiast w
kierunku elektrody zwanej katodą, a ujemnie naładowane aniony przesuwają się w stronę dodatnio naładowanej
elektrody zwanej anodą. Katoda dostarcza elektrony kationom, które przyłączają elektrony (zachodzi reakcja
redukcji) i przechodzą w stan atomowy (gaz lub ciało stałe). Anoda odbiera elektrony od anionów (zachodzi
reakcja utlenienia), które przechodzą również w stan atomowy lub cząsteczkowy (gaz lub ciało stałe).
Schematycznie proces elektrolizy przedstawiony został na rysunku 1.
Ważną częścią elektrolizerów jest roztwór elektrolitu. Rozróżnia się elektrolity właściwe i elektrolity
potencjalne. Elektrolity właściwe to substancje o cząsteczkach zbudowanych z jonów (np. NaCl, NaOH),
w których po wprowadzeniu do rozpuszczalnika następuje dysocjacja wszystkich wiązań jonowych połączona
z solwatacją jonów (dysocjacja jonowa). Natomiast elektrolity potencjalne to związki, w których występują
3
N
at
ę
że
n
ie
p
rą
d
u
I
[m
A
]
spolaryzowane wiązania kowalencyjne, ulegające dysocjacji na jony dopiero w wyniku chemicznego
oddziaływania z polarnymi cząsteczkami rozpuszczalnika (np. HCl, CH
3
COOH).
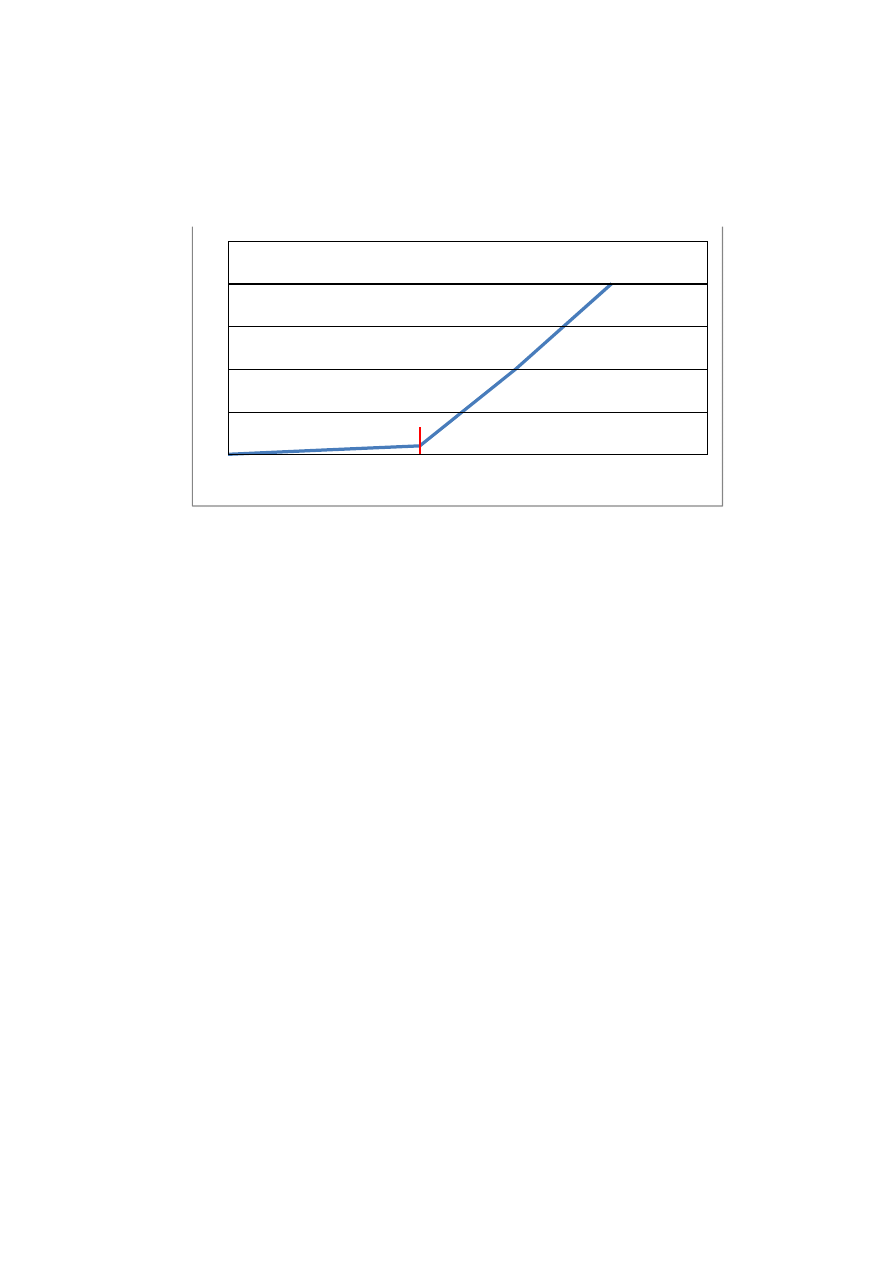
Wydzielanie się produktów elektrolizy ma miejsce dopiero wtedy, gdy przyłożona różnica potencjałów
pochodząca od zewnętrznego źródła przekracza wartość zwaną napięciem rozkładowym U
rozkł
. Na rysunku 2
została przedstawiona zależność między przyłożonym napięciem a otrzymanym natężeniem prądu podczas
prowadzenia elektrolizy.
2
1
U
rozkł
Napięcie U [V]
Rys. 2. Natężenie prądu w funkcji napięcia podczas procesu elektrolizy.
W etapie początkowym (etap 1, rys. 2) wzrost napięcia nie powoduje powstawania produktów elektrolizy.
Ma to związek z tym, że katoda i anoda pokrywają się warstewkami produktów elektrolizy. Wydzielone
produkty elektrolizy powodują powstanie na elektrodach siły elektromotorycznej SEM, skierowanej przeciwnie
do przyłożonego napięcia. Dopiero kiedy przyłożone do elektrod elektrolizera napięcie (U
rozkł
) jest co najmniej
równe, a w praktyce nieco większe od siły elektromotorycznej utworzonej na elektrodach elektrolizera,
obserwujemy proces elektrolizy i stopniowy wzrost natężenia prądu wraz ze wzrostem napięcia powyżej U
rozkł
(etap 2, rys.2). W praktyce wartość napięcia rozkładowego U
rozkł.
powiększana jest o tzw. nadnapięcia
na elektrodach oraz spadek napięcia związany z oporem elektrolitu i dopiero wtedy określa się je napięciem
rozkładowym, przy którym proces elektrolizy zachodzi z optymalną prędkością. Przy napięciu rozkładowym
nie powiększonym o nadnapięcie proces elektrolizy będzie zachodził, ale bardzo wolno. Na wartość nadnapięcia
wpływają:
•
materiał elektrody oraz stan jej powierzchni,
•
gęstość prądu,
•
składu roztworu elektrolitu,
•
temperatura.
Wielkość napięcia rozkładowego niezbędnego do przeprowadzenia jonów różnych pierwiastków w obojętne
atomy zależy od położenia pierwiastka w szeregu napięciowym. Ta właściwość jest wykorzystywana
do elektrolitycznego rozdzielenia metali.
Elektrolizę opisują dwa prawa zwane prawami elektrolizy Faraday’a.
I prawo: masa substancji wydzielonej na elektrodzie w wyniku procesu elektrolizy jest wprost proporcjonalna
do ładunku przepływającego przez elektrolit:

4
m = k · I · t = k · Q
gdzie:
k - równoważnik elektrochemiczny [g/C],
I - natężenie prądu [A],
t - czas trwania elektrolizy [s],
m - masa substancji wydzielonej na elektrodzie [g],
Q - ładunek elektryczny [C].
II prawo: stosunek mas substancji wydzielonych na elektrodach podczas przepływu jednakowych ładunków
elektrycznych jest równa stosunkowi ich równoważników elektrochemicznych i stosunkowi ich mas
równoważnikowych :
m
1
=
k
1
=
R
1
gdzie:
m
2
k
2
R
2
m
1
, m
2
– masy substancji wydzielonych na elektrodach [g],
k
1
, k
2
- równoważnik elektrochemiczne substancji [g/C],
R
1
, R
2
– masy równoważnikowe [g/mol].
Z praw Faradaya można wywnioskować, że do wydzielenia jednego gramorównoważnika dowolnej
substancji potrzebny jest ten sam ładunek. Ładunek ten nosi nazwę stałej Faradaya i wynosi
F=96485 C/mol. Wstawiając tę wartość do wzoru z I prawa Faradaya w miejsce ładunku Q, a w miejsce masy
m – masę jednego gramorównoważnika m=M/z, otrzymuje się:
zatem I prawo Faradaya można zapisać jako:
k
=
M ,
z·F
m
=
M
⋅
I·t
z·F
a z tego wynika wzór:
Q = n · z · F
gdzie:
M – masa molowa substancji wydzielonej na elektrodzie [g/mol],
n – liczba moli substancji wydzielonej na elektrodzie [mol],
F – stała Faradaya [C/mol],
z – liczba elektronów biorąca udział w reakcji, w której powstaje 1 mol substancji o masie molowej M.
W praktyce obserwuje się wydzielanie mniejszej masy produktów niż wyliczona na podstawie prawa
Faradaya. Przyczynami tego mogą być:
•
nieuwzględnienie w obliczeniach reakcji ubocznych (jednoczesne wydzielanie na elektrodzie dwóch
lub więcej produktów elektrolizy),
•
reakcje wtórne pomiędzy produktami elektrolizy a otoczeniem.

5
Stosunek wydzielonej masy m rozpatrywanego produktu elektrolizy do masy wyliczonej z prawa Faradaya m
F
nazywa się wydajnością prądową elektrolizy. Wielkość tę mnoży się przez 100 % i wyraża w procentach.
Elektroliza jest procesem stosowanym na skalę przemysłową m.in. do:
•
produkcji metali: aluminium, litu, sodu, potasu,
•
produkcji rozmaitych związków chemicznych, w tym kwasu trifluorooctowego, wodorotlenku sodu
i potasu, chloranu sodu i chloranu potasu,
•
produkcji gazów: wodoru, chloru i tlenu,
•
galwanizacji - pokrywanie cienką warstwą metalu innego metalu.
Elektroliza wody to proces rozkładu wody na wodór i tlen na skutek działania prądu elektrycznego.
Zazwyczaj nie stosuje się w elektrolizie czystej wody, ze względu na stosunkowo małą zdolność
do przewodzenia prądu (mała wartość stopienia dysocjacji wody, co powoduje małą ilość jonów H
+
i OH
−
i
duże straty energii elektrycznej związane z wysokim oporem). Można używać wodnych roztworów
wodorotlenków, kwasów lub soli, ale w praktyce stosuje się wyłącznie wodne roztwory tych pierwszych
(wodne roztwory kwasów powodują korozję elektrod, a wodne roztwory soli maja niższą przewodność
właściwą). Zastosowanie w elektrolizie wody najczęściej znajdują roztwory NaOH (16-18%) i KOH (25-29%).
Należy pamiętać, że nie wszystkie elektrolity nadają się do wytwarzania wodoru.
W przypadku elektrolizy wodnych roztworów o pH >7, np. roztworów wodnych NaOH, na elektrodach
aparatu zachodzą następujące reakcje:
Katoda (-): 4 H
2
O + 4 e
−
= 2 H
2
+ 4 OH
−
Anoda (+): 4 OH
−
= 4 e
−
+ O
2
+ 2 H
2
O
Sumarycznie: 2H
2
O → 2H
2
+ O
2
Na katodzie powstaje wodór o wysokiej czystości. W przypadku roztworów o pH < 7 źródłem protonów
redukujących się na katodzie jest woda utleniająca się na anodzie. Podczas utleniania wody na anodzie oprócz
powstających protonów wydziela się również tlen. Przy pH = 7 źródłem protonów jest także woda utleniająca
się na anodzie z wydzieleniem tlenu. Na katodzie natomiast woda jest redukowana, powstają jony hydroksylowe
z jednoczesnym wydzieleniem wodoru.
Teoretyczna minimalna wartość napięcia rozkładu (przy pH = 14, nie uwzględniając nadnapięć i spadku
napięcia na elektrolicie) potrzebna do zainicjowania procesu elektrolizy wody wynosi 1,23 V. W praktyce
stosuje się wyższe napięcia w celu przyspieszenia procesu powstawania wodoru i tlenu.
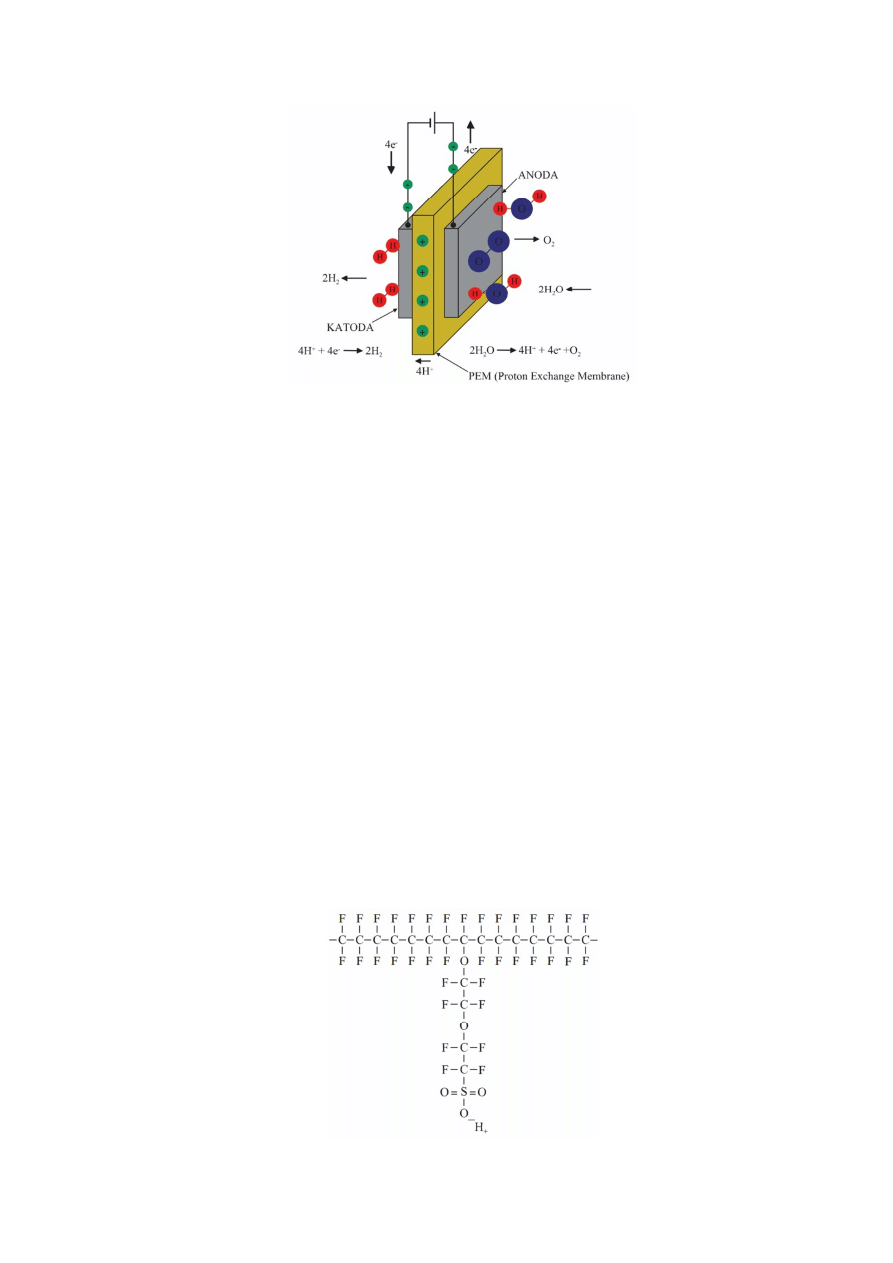
Zasadniczą częścią elektrolizera typu PEM jest zespół dwóch elektrod (anody i katody), wykonanych
z materiałów o właściwościach katalitycznych, przedzielonych cienką membraną polimerową przewodzącą
protony, tj. jony H
+
– pełniącą funkcję elektrolitu. Budowa i zasada działania elektrolizera typu PEM oraz
zachodzących w nim reakcji na anodzie i katodzie przedstawia rysunek 3. Na anodzie zachodzi proces utleniania
wody, podczas którego powstają cztery protony i jedna cząsteczka tlenu, z jednoczesnym wydzieleniem czterech
elektronów. Protony te przechodzą przez polimerową membranę i trafiają na katodę, elektrony pochodzące od
zewnętrznego źródła obwodem również trafiają na katodę, gdzie łącząc się z protonami (reakcja redukcji) tworzą
dwie cząsteczki wodoru. Sprawność tego typu elektrolizerów wynosi ok. 85%.
6
Rys.3 Budowa i zasada działania elektrolizera typu PEM.
Źródło: P.Grygiel, H.Sadowski „Laboratorium Konwersji Energii”, Wydział Fizyki Technicznej i Matematyki Stosowanej
Politechnika Gdańska 2006.
Elektrolizery typu PEM dzięki elektrolitowi w postaci ciała stałego charakteryzują się prostą i zwartą
budową. Ze względu na pracę w niskich temperaturach (np. w temperaturze pokojowej), wymagają one
stosowania katalizatora reakcji (np. platyny). Cienka folia przewodząca protony (PEM) wytwarzana jest
z użyciem sulfonowanych fluoropolimerów. PEM wytwarza się z polietylenu (PTE), w którym następnie
zastępuje się wodór fluorem, tworząc politetrafluoroetylen – PTFE (zwyczajowo zwany Teflonem). Jest
on wytrzymały mechanicznie i odporny na działanie agresywnych związków chemicznych oraz silnie
hydrofobowy. Następnie PTFE poddaje się sulfonowaniu, które polega na dołączeniu bocznego łańcucha,
zakończonego grupą sulfonową –SO
3
H (przykładowa struktura PEM – rys.4). Wodór w grupie –SO
3
H jest
związany jonowo. Zakończeniem bocznego łańcucha jest więc na stałe przyłączony do niego jon –SO
3
–
i jonowo związany z nim jon H
+
. Cząsteczki łańcuchów bocznych dążą do tworzenia klasterów wewnątrz
struktury materiału. Grupy sulfonowe są wysoce hydrofilowe. Zatem membrana PEM jest materiałem
hydrofobowym (PTFE) z lokalnymi obszarami hydrofilowymi wokół klasterów sulfonowanych łańcuchów
bocznych. Obszary hydrofilowe charakteryzują się tym, że silnie pochłaniają wodę. Wewnątrz nawodnionych
regionów, jony H
+
są stosunkowo słabo związane z jonami –SO
3
–
i możliwy jest ich ruch – jak
w przypadku wodnego roztworu kwasu. W rezultacie możemy mówić o kwaśnych obszarach w silnie
hydrofobowej strukturze membrany. Typowa wartość przewodności osiągana przez nawodnione membrany PEM
to około 0,1 S · cm
−1
.
Rys.4. Przykładowa struktura PEM.

7
3. PRZEBIEG ĆWICZENIA
Ć
wiczenie składa się z trzech części:
1. Pomiar ilości powstającego wodoru i tlenu podczas rozkładu wody na elektrolizerze
PEM z użyciem ogniwa fotowoltaicznego jako źródła stałego napięcia.
Przyrządy:
- elektrolizer PEM 0-2 V,
- dwa zbiorniki z podziałką max. 30 cm
3
(na wodór i tlen),
- ogniwo fotowoltaiczne do 2V,
- źródło światła (lampa halogenowa OSRAM HALOPAR 30 75W),
- multimetr (woltomierz/amperomierz),
- przewody elektryczne i węże z tworzywa.
Wykonanie:
a. Za pomocą czterech węży z tworzywa połączyć górne i dolne wyjścia z elektrolizera PEM
z odpowiadającymi im wyjściami obu zbiorników do gromadzenia wodoru i tlenu. Umieścić dwa
węże z tworzywa z drugiej strony obu zbiorników – tzw. węże wylotowe (po jednym na zbiornik),
następnie nałożyć na nie opaski zaciskowe i zamknąć delikatnie (według rysunku 5). Nalać wodę
destylowaną do obu zbiorników do górnego poziomu zaznaczonego na zbiornikach, otworzyć
klamrę zaciskową – wraz ze spadkiem poziomu wody następuje usuwanie powietrza z obu
zbiorników. Woda powinna dostać się również na elektrolizer PEM. Zamknąć klamry, poziom
wody w obu zbiornikach powinien znajdować się na poziomie 0 cm
3
.
Rys. 5. Schemat połączenia elektrolizera PEM ze zbiornikami do gromadzenia wodoru i tlenu.
b. Do elektrolizera PEM podłączyć źródło zasilania – ogniwo fotowoltaiczne (zgodnie z opisami
biegunów znajdującymi się na elementach) - układ powinien mieć konfigurację jak na rys. 6.
Lampę halogenową umieścić w odległości kilkunastu centymetrów od ogniwa
fotowoltaicznego. Poprosić prowadzącego o sprawdzenie poprawności złożenia układu.
Włączyć lampę halogenową oświetlającą ogniwo fotowoltaiczne. Od tego momentu powinno
zostać zaobserwowane wydzielanie wodoru i tlenu. Zaraz po rozpoczęciu eksperymentu podłączyć
do ogniwa fotowoltaicznego woltomierz i sprawdzić wartość napięcia (jego wartość powinna
wynosić od 1,6 V do 1,8 V). Następnie odłączyć ostrożnie woltomierz i nie zmieniać położenia
lampy halogenowej i ogniwa fotowoltaicznego względem siebie do końca eksperymentu.

8
Rys. 6. Schemat podłączenia baterii fotowoltaicznej i układu elektrolizera typu PEM.
c. Gdy w zbiorniku, w którym gromadzi się wodór zostanie osiągnięta wartość 10 cm
3
(ok. 20 min),
szybko odłączać ogniwo od elektrolizera PEM oraz zgasić lampę, jednocześnie spisując objętość
uzyskanego tlenu ze zbiornika z tlenem oraz objętość wodoru ze zbiornika z wodorem. Następnie
odłączyć źródło zasilania, otworzyć klamrę zaciskową na wężu wylotowym - najpierw jedną,
odczekać chwilę do momentu usunięcia całej objętości jednego z gazów i zamknąć, operację
powtórzyć dla zbiornika z drugim gazem. Przed przystąpieniem do kolejnej części ćwiczenia
zadbać, aby w wężach prowadzących do zbiorników nie zalegał wodór i tlen.
2. Wyznaczenie charakterystyki napięciowo–prądowej elektrolizera PEM.
Przyrządy:
- elektrolizer PEM 0-2 V,
- dwa zbiorniki z podziałką max. 30 cm
3
(na wodór i tlen),
- ogniwo fotowoltaiczne do 2V,
- zasilacz 2V (bateria),
- źródło światła (lampa halogenowa OSRAM HALOPAR 30 75W),
- dwa multimetry (woltomierz/amperomierz),
- rezystor nastawny,
- przewody elektryczne i węże z tworzywa.
Wykonanie:
a. Złożyć układ według schematu elektrycznego zamieszczonego na rys. 7. Jako źródło napięcia użyć
zasilacza 2 V. Rezystor nastawny nastawić na opór nieskończenie duży (symbol ∞).
Do elektrolizera PEM podłączyć za pomocą węży zbiorniki na tlen i wodór. Zacisnąć węże
wylotowe z obu zbiorników za pomocą klamer zaciskowych. Zalać zbiorniki woda według zasad
z pierwszej części ćwiczenia. Poprosić prowadzącego o sprawdzenie poprawności złożenia
układu.
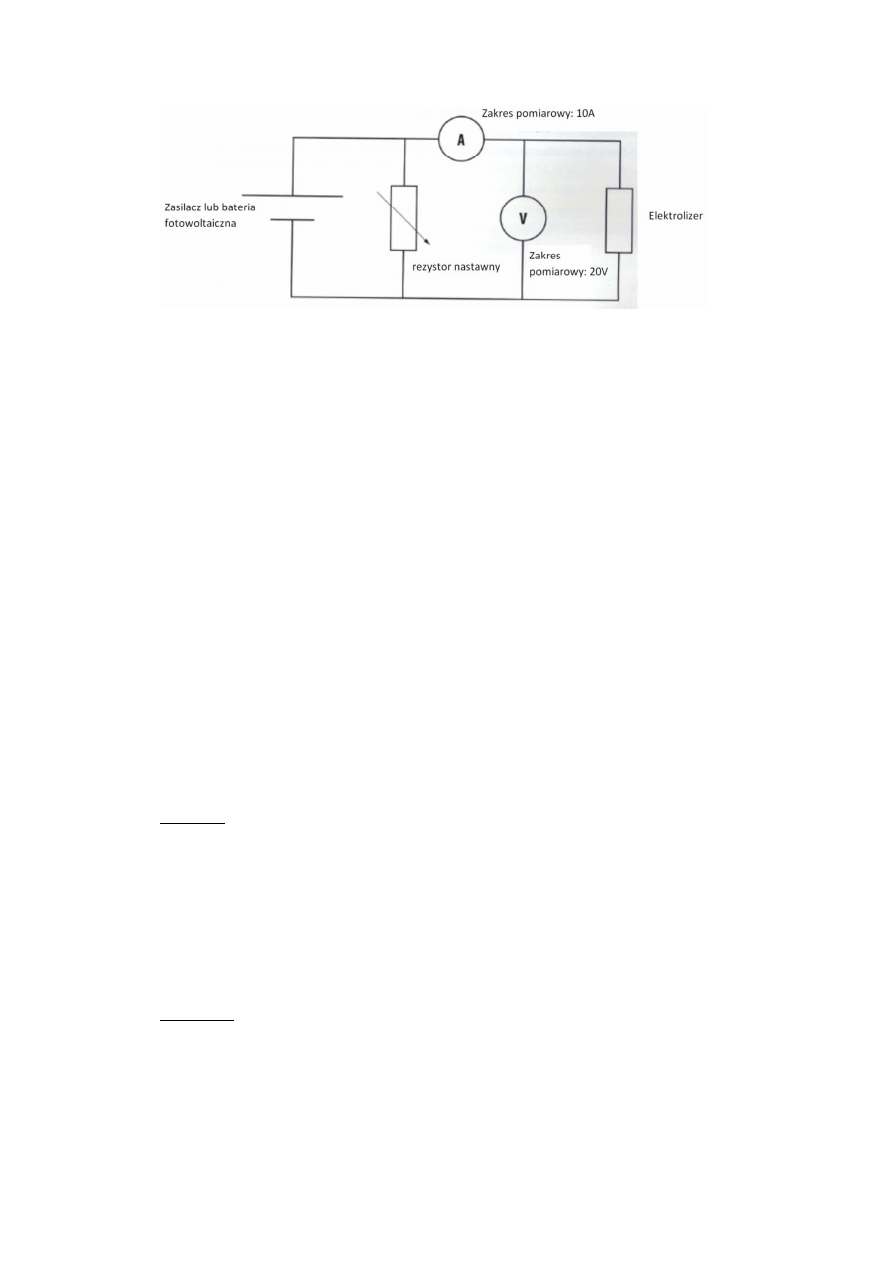
9
Rys. 7. Schemat podłączenia układu do wyznaczenia charakterystyki napięciowo-prądowej
elektrolizera.
b. Po złożeniu układu, załączyć zasilanie i zacząć kolejno zmniejszać opór na rezystorze
nastawnym. Po każdej zmianie oporu spisać z multimetrów wartości napięcia i odpowiadające
mu wartości natężenia prądu. Obserwować zmianę szybkości powstawania wodoru i tlenu wraz
ze zmianą zadanego oporu. Sporządzić tabelę wyników, w której umieszczone będą nastawione
wartości oporu elektrycznego, wartości napięcia i natężenia prądu. Zaznaczyć w tabeli wartość
napięcia, przy którym zaobserwowano przepływ prądu.
c. Tę sama procedurę przeprowadzić z użyciem ogniwa fotowoltaicznego jako źródło zasilania.
Podobnie jak w poprzednim ćwiczeniu zaraz po rozpoczęciu eksperymentu podłączyć do ogniwa
fotowoltaicznego woltomierz i sprawdzić wartość napięcia (od 1,6 V do 1,8 V). Następnie odłączyć
ostrożnie woltomierz i nie zmieniać położenia lampy halogenowej i ogniwa fotowoltaicznego
względem siebie do końca eksperymentu.
d. Następnie odłączyć źródło zasilania, otworzyć klamrę zaciskową na wężu wylotowym - najpierw
jedną, odczekać chwilę do momentu usunięcia całej objętości jednego z gazów i zamknąć, operację
powtórzyć dla zbiornika z drugim gazem. Przed przystąpieniem do kolejnej części ćwiczenia
zadbać, aby w wężach prowadzących do zbiorników nie zalegał wodór i tlen.
3. Określenie wydajności energetycznej i wydajności Faradaya (prądowej) elektrolizera
PEM.
Przyrządy:
- elektrolizer PEM 0-2 V,
- dwa zbiorniki z podziałką max. 30 cm
3
(na wodór i tlen),
- ogniwo fotowoltaiczne do 2V,
- źródło światła (lampa halogenowa OSRAM HALOPAR 30 75W),
- dwa multimetry (woltomierz/amperomierz),
- czasomierz/stoper,
- przewody elektryczne i węże z tworzywa.
Wykonanie:
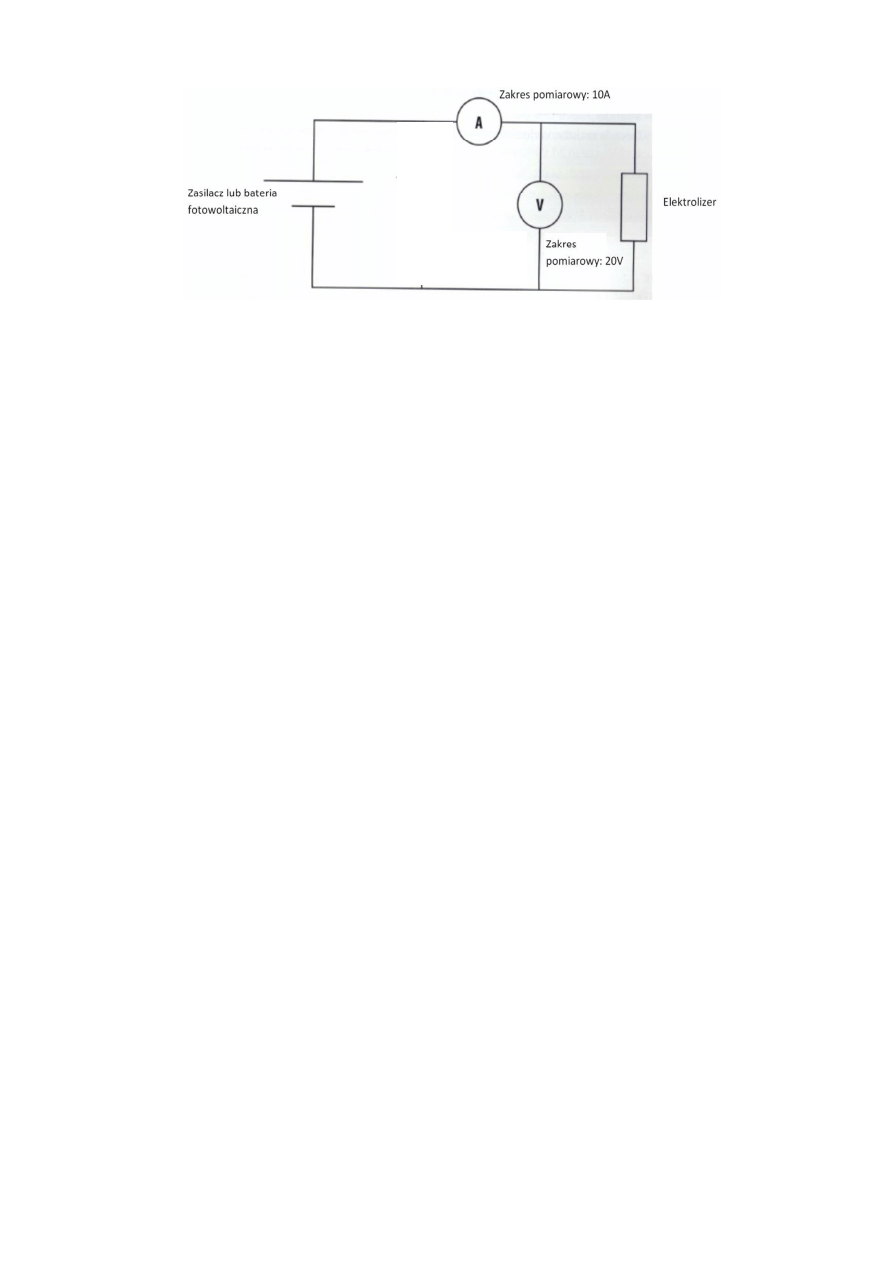
a. Złożyć układ według schematu elektrycznego zamieszczonego na rys. 8. Jako źródło napięcia użyć
ogniwa fotowoltaicznego. Lampę halogenową, po ustalaniu jej odległości od baterii
fotowoltaicznej (wartość napięcia 1,6 V – 1,8 V), wyłączyć oraz odłączyć jeden z przewodów
elektrycznych łączący baterie fotowoltaiczną z układem. Następnie do elektrolizera PEM podłączyć
za pomocą węży zbiorniki na tlen i wodór. Zacisnąć węże wylotowe z obu zbiorników za pomocą
klamer zaciskowych. Zalać zbiorniki woda według zasad z pierwszej części ćwiczenia.
10
Rys. 8. Schemat podłączenia układu do wyznaczenia wydajności energetycznej i wydajności Faradaya
elektrolizera PEM.
b. Włączyć lampę halogenową. Podłączyć ponownie ogniwo fotowoltaiczne do układu jednocześnie
uruchamiając stoper. Notować czasy, dla których objętość wodoru w zbiorniku będzie osiągać
kolejno wartości 5, 10, 15, 20, 25, 30 cm
3
oraz wartości napięcia i natężenia prądu. Sporządzić
tabelę wyników, w której podane będą kolejno: objętości wodoru w zbiorniku; czas, dla którego
zostały osiągnięte te objętości; wartości napięcia i natężenia prądu dla tych objętości wodoru.
c. Po zakończeniu ćwiczenia odłączyć źródło zasilania, otworzyć klamrę zaciskową na wężu
wylotowym - najpierw jedną, odczekać chwilę do momentu usunięcia całej objętości jednego
z gazów i zamknąć, operację powtórzyć dla zbiornika z drugim gazem. Wylać wodę
ze zbiorników i elektrolizera PEM – poprzez węże wylotowe.
4. OPRACOWANIE SPRAWOZDANIA
4.1 CEL ĆWICZENIA
Zdefiniować cel ćwiczenia.
4.2 METODYKA POMIARÓW
Zamieścić opis metodyki pomiarów dla każdej z części ćwiczenia. Umieścić schematy połączeń
układów wraz z opisem elementów oraz określić mierzone wartości dla każdej z części.
4.3 WYNIKI POMIARÓW
Umieścić wyniki i tabele pomiarów dla każdej z części wraz z prawidłowymi jednostkami.
4.4 OPRACOWANIE WYNIKÓW
Tam, gdzie to konieczne przyjąć, że ciśnienie w laboratorium wynosi p = 1000 hPa, a temperatura
T=25
o
C.
Część 1.
Określić stosunek uzyskiwanego wodoru do tlenu na podstawie zmierzonych wartości. Obliczyć
ilość moli uzyskanego wodoru i tlenu.
Część 2.
Na podstawie zgromadzonych danych sporządzić wykresy charakterystyki napięciowo–prądowej
elektrolizera PEM (I = f(U)) dla źródła zasilania w postaci zasilacza i ogniwa fotowoltaicznego.
Określić napięcie rozkładu na obu wykresach, a następnie wyliczyć średnie napięcie rozkładu.
11
Część 3.
Na podstawie zgromadzonych danych sporządzić wykres uzyskanych objętości wodoru w funkcji
czasu (V
H2
= f(t)) dla danej mocy uzyskiwanej na elektrolizerze.
Wyznaczyć wartość mocy w każdym punkcie pomiarowym oraz określić średnią moc podczas
całego pomiaru.
Obliczyć:
1.
Wydajność energetyczną:
gdzie:
E
wodoru
- energia, jaką uzyskałoby się ze spalenia 30 cm
3
wyprodukowanego wodoru
na elektrolizerze PEM [J],
wartość opałowa wodoru: 12,745*10
6
J/m
3
.
E
elektr
- energia wykorzystana do uzyskania 30 cm
3
wodoru na elektrolizerze PEM [J].
2.
Wydajność Faradaya (prądową):
gdzie:
3
V
H
2
(wyprodukowana)
– objętość wodoru równa 30 cm
3
, wyprodukowana na elektrolizerze PEM w
czasie określonym podczas ćwiczenia i przy danej wartości prądu elektrycznego oraz danych
warunkach ciśnienia i temperatury [cm
3
],
V
H
2
(obliczona)
– teoretyczna objętość wodoru, która powinna zostać wyprodukowana w tym
samym czasie w procesie elektrolizy wody przy tych samych wartościach prądu elektrycznego,
ciśnienia i temperatury [cm
3
].
W celu określenia wartości V
H
2
(obliczona)
wykorzystać należy równanie stanu gazu doskonałego
(Clapeyrona), podstawiając do niego odpowiednio przekształcone pierwsze prawo Faradaya:
m
=
M
⋅
It
zF
(opis oznaczeń znajduje się w części teoretycznej).
4.5. WNIOSKI
Sformułować odpowiednie wnioski do każdej z części ćwiczenia.
=
(
)
(
)
=
!"
Wyszukiwarka
Podobne podstrony:
Konspekt do cwiczenia 2, Elektronika i Telekomunikacja, z PENDRIVE, Politechnika - EiT, 2011 2012 -
Instrukcja do ćwiczenia, elektronika
Instrukcja do ćwiczenia(6), elektronika
Instrukcja do ćwiczenia(5), elektronika
Instrukcja do ćwiczenia(4), elektronika
Instrukcja do cwiczenia, elektronika
Instrukcja do ćwiczenia(3), elektronika
Instrukcja do ćwiczenia(9), elektronika
Konspekt do cwiczenia 1, Elektronika i Telekomunikacja, z PENDRIVE, Politechnika - EiT, 2011 2012 -
Konspekt do cwiczenia 5, Elektronika i Telekomunikacja, z PENDRIVE, Politechnika - EiT, 2011 2012 -
Ćwiczenia1 Elektroforeza
instrukcja cwiczenie 7
Instr. kontr.urz.gaszącego, Instrukcje w wersji elektronicznej
Instr. wciNgarek hydr.- Nocek, Instrukcje w wersji elektronicznej
Instr.spawarki, Instrukcje w wersji elektronicznej
Instruktaz cwiczen domowych Sc,Thdex
więcej podobnych podstron