
1
1
Zadanie 1.
20 cm
3
roztworu zawiera 47,5 mg MgCl
2
.
Obliczyć stężenie molowe tego roztworu jeżeli d = 1 g
/cm
3
. M.at. Mg = 24; Cl = 35,5.
Wskazówka: jeżeli w danych zadania masę podano w
mg, a objętość w cm
3
, to wygodniej stosować milimole niż
mole.
M. molowa MgCl
2
= 24 + 2 x 35,5 = 95
Masa jednego mola wynosi 95 g
Masa jednego milimola 95 mg.
2
Obliczamy jaką część milimola stanowi masa 47,5 mg
MgCl
2
.
1 milimol – 95 mg
x milimola – 47,5 mg
x = 47,5/95 = 0,5 milimola
Czyli 0,5 milimola znajduje się w 20 cm
3
roztworu.

2
3
Zadanie 2. Do 25 cm
3
1% roztworu KBr dodano 60
cm
3
4% roztworu tej soli. Obliczyć końcowe stężenie
molowe tego roztworu jeżeli d = 1 g /cm
3
. M.at. K = 39;
Br = 80. M. mol KBr = 119.
Zaczynamy od obliczenia masy substancji znajdującej się
w każdym roztworze.
Z definicji stężenia procentowego wiadomo, że 1%
roztwór zawiera 1 g substancji rozpuszczonej.
W 25 cm
3
1% roztworu znajduje się 25/100 x 1 g KBr
czyli 0,25 g = 250 mg.
W 60 cm
3
4% roztworu mamy 60/100 x 4 g KBR czyli
2,4 g = 2400 mg.
4
Obliczamy masę i objętość końcową.
Masa końcowa 250 mg + 2 400 mg = 2 650 mg
Objętość końcowa 25 cm
3
+ 60 cm
3
= 85 cm
3
Przeliczamy 2 650 mg na ilość mmoli.
1 mmol – 119 mg
x mmol – 2 650 mg
Czyli x = 2650/119 = 22,27 mmola
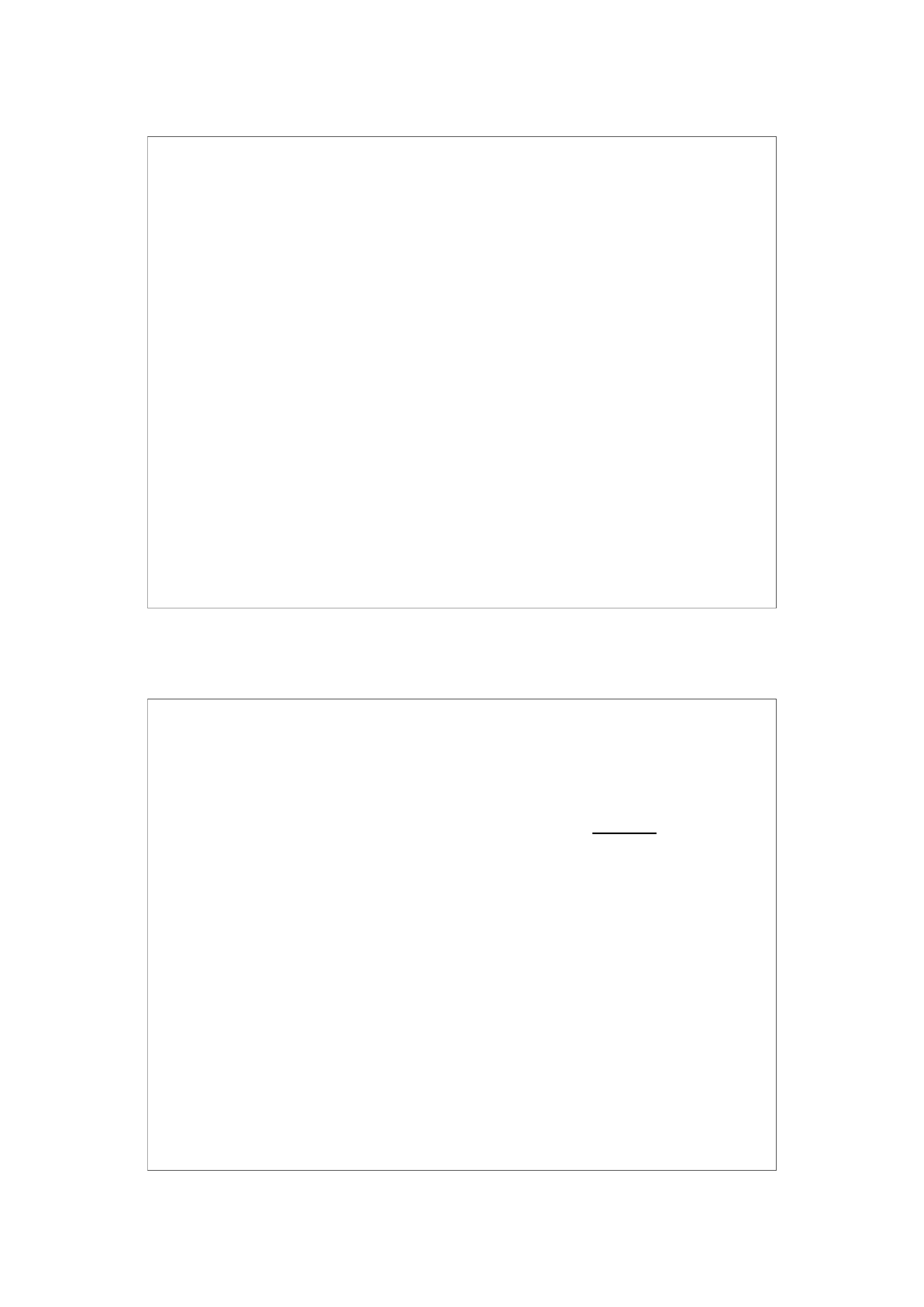
3
5
Zadanie 3. Na zmiareczkowanie 10 cm
3
roztworu NaCl
zużyto 4,7 cm
3
0,15 molowego AgNO
3
. Obliczyć stężenie
molowe miareczkowanego roztworu oraz masę NaCl (w
mg) znajdującą się w jego 100 cm
3
. M.mol. Na = 23;
Takie zadania rozwiązujemy w oparciu o równanie:
c
1
·V
1
= c
2
·V
2
Gdzie:
C
1
i V
1
to stężenie i objętość roztworu miareczkowanego
(w tym przypadku NaCl)
c
2
i V
2
to stężenie i objętość roztworu, którym
miareczkowano (w tym przypadku AgNO
3
)
6
Obliczmy więc c
1
(NaCl).
c
1
= c
2
·V
2
/ V
1
czyli c
1
= 4,7 cm
3
· 0,15 molowy / 10 cm
3
= 0,0705 molowy
Teraz obliczamy masę NaCl zawartą w 100 cm
3
roztworu.
Należy pamiętać, że iloczyn stężenia
c · V(cm
3
) to liczba
milimoli
danej substancji zawartej w objętości V.
mg NaCl =
C
2
· V
2
· masa molowa (mg) x 10.
Mnożymy przez 10, ponieważ miareczkowano 10 cm
3
a
obliczamy masę dla 100 cm
3
czyli objętości 10 razy
większej.

4
7
mg NaCl = 4,7 cm
3
· 0,15 molowy · 58,5 mg
·
10 = 412 mg
Zadanie 4. Ile cm
3
0,2 molowego HCl należy użyć, aby
zobojętnić 250 mg NaOH? M.mol NaOH = 40.
Obliczamy ilu milimolom odpowiada 250 mg.
1 mmol – 40 mg
x mmol – 250 mg
X = 250/40 = 6,25 mmola NaOH
Do zobojętnienia potrzeba więc tyle samo HCl, jego stężenie
znamy (0,2 molowy), trzeba tylko obliczyć objętość w której
jest 6,25 mmola.
8
Liczba mmoli HCl x = c
·
V(cm
3
)
A więc V = x/c = 6,25 mmol/0,2 molowy = 31,25 cm
3
.
Zadanie 5. Do 50 cm
3
0,03 molowego KOH dodano 250 cm
3
wody. Obliczyć pH roztworu. Wsp. aktywności f = 1.
pH = -log a ponieważ f = 1 to pH = -log [H
3
O
+
]
Dla roztworów wodorotlenków najpierw trzeba obliczyć pOH
pOH = - log [OH
-
]
[OH-] = [KOH], trzeba więc policzyć stężenie KOH
Po dodaniu wody sumaryczna objętość roztworu wynosi
50 cm
3
+ 250 cm
3
= 300 cm
3

5
9
Objętość wzrosła 6 razy więc stężenie zmalało 6 razy
[KOH] = 0,03/6 = 0,005 molowe
pOH = - log 0,005 = 2,3
Na podstawie iloczynu jonowego wody wiemy, że
pH + pOH = 14, czyli pH tego roztworu wynosi
pH = 14 – 2,3 = 11,7
10
Zadanie 6. Zmieszano ze sobą 300 cm
3
0,12 molowego
NaOH oraz 500 cm
3
0,15 molowego HCl. Obliczyć pH
powstałego roztworu. Wsp. aktywności f = 0,95.
Obliczamy liczbę milimoli NaOH i HCl które były w
zmieszanych roztworach.
mmole NaOH = 300 cm
3
·
0,12 molowy = 36
mmole HCl = 500 cm
3
·
0,15 molowy = 75
NaOH i HCl reagują ze sobą, pozostaje nadmiar HCl, który
wynosi
75 – 36 = 39 mmol

6
11
Nadmiar 39 mmoli HCL znajduje się w objętości
300 + 500 = 800 cm
3
Można już obliczyć końcowe stężenie HCl
C = 39 mmoli/ 800 cm
3
= 0,049 molowy HCl
Obliczamy aktywność H
3
O
+
i podstawiamy do wzoru na pH
a = f
·
c = 0,95
·
0,049 = 0,0465
pH = - log 0,0465 = 1,33
12
Zadanie 7. Ile mg CaSO
4
znajduje się w 1,5 dm
3
nasyconego roztworu tej soli? K
s
= 1,4 × 10
-9
.
M. mol CaSO
4
= 136.
Należy obliczyć rozpuszczalność (S) stężenie molowe
nasyconego roztworu, następnie obliczyć ile moli znajduje się
w 1,5 dm
3
i przeliczyć to na masą w mg.
Dla związków składających się z jednego anionu i jednego
kationu zależność między rozpuszczalnością (S) i K
s
wyrażona jest wzorem:
K
s
= S
2
Czyli S =
√
K
s

7
13
Podstawiamy do wzoru
S =
√
1,4 × 10
-9
= 3,74 ×10
-5
W 1 dm
3
nasyconego roztworu znajduje się 3,74 × 10
-5
mola CaSO
4
.
W 1,5 dm
3
jest 1,5 × 3,74 ×10
-5
= 5,6 ×10
-5
mola
Po przeliczeniu na masę otrzymujemy
5,6 × 10
-5
× 136 g = 7,63 ×10
-3
g = 7,63 mg
14
Zadanie 8. Obliczyć czy wytrąci się osad, jeżeli do 2
dm
3
0,01 molowego roztworu Pb(NO
3
)
2
dodano 1 cm
3
0,001 molowego Na
2
SO
4
. Iloczyn rozpuszczalności
PbSO
4
= 4 x 10
-4
.
Osad wytraci się jeśli po zmieszaniu roztworów iloczyn
stężeń Pb
2
+
oraz SO
4
2-
będzie równy lub wyższy K
s
.
Stężenie Pb
2+
nie ulega zmianie, bo zmiana objętości
jest minimalna i zostaje pominięta. [Pb
2+
] = 0,01

8
15
Obliczamy tylko stężenie SO
4
2-
po zmieszaniu
roztworów.
Objętość wzrosła 2000 razy, więc stężenie siarczanu
zmalało 2000 razy i wynosi
[SO
4
2-
] = 0,001/2000 = 5 × 10
-7
Obliczamy teraz iloczyn stężeń jonów:
[Pb
2+
] × [SO
4
2-
] = 0,01 × 5 ×10
-7
= 5 × 10
-9
Jest to liczba mniejsza od K
s
więc osad nie powstanie.
16
Zadanie 9. Obliczyć ciśnienie osmotyczne roztworu
powstałego w wyniku zmieszania 250 cm
3
0,4
molowego NaCl i 150 cm
3
0,3 molowej sacharozy.
T = 273K, f = 1.
Dla T = 273K przyjmujemy, że RT = 2,27 MPa
Ciśnienie osmotyczne roztworu jest wielkością
addytywną. Czyli jest sumą wszystkich ciśnień
cząstkowych pochodzących od substancji obecnych w
roztworze.
Trzeba więc policzyć
π NaCl, π sacharozy i dodać ich
wartości.

9
17
Aby obliczyć
π trzeba znać stężenia molowe substancji
po zmieszaniu roztworów.
Zmieszano 250 + 150 = 400 cm
3
Dla NaCl stężenie zmalało tyle razy ile razy wzrosła
objętość, czyli 400/250 = 1,6
Stężenie zmalało 1,6 razy
0,4 molowe / 1,6 = 0,25 molowe
Dla sacharozy wzrost objętości wynosi 400/150 = 2,67
razy, czyli stężenie zmniejszyło się 2,67 razy.
Końcowe c sacharozy wynosi więc 0,3 / 2,67 = 0,11.
18
Obliczamy
π NaCl
π
1
= i·f·c·2,27 MPa = 2·1·0,25·2,27 MPa = 1,135 MPa
Obliczmy
π sacharozy
π
2
= i·f·c·2,27 MPa = 1·1·0,11·2,27 MPa = 0,25 MPa
π
1
+
π
2
= 1,135 + 0,25 = 1,385 MPa

10
19
Zadanie 10. Obliczyć pH roztworu powstałego ze
zmieszania 100 cm
3
0,2 molowego HCl i 500 cm
3
0,2
molowego NH
3
. Stała dysocjacji NH
3
= 2 x 10
-5
.
Po pierwsze trzeba obliczyć jakie ilości mmoli kwasu i
amoniaku zostały zmieszane.
HCl = 100 cm
3
· 0,2 molowy = 20 mmoli
NH
3
= 500 cm
3
· 0,2 molowy = 100 mmoli
Związki te reagują ze sobą i po reakcji powstaje
20 mmoli NH
4
+
oraz 80 mmoli NH
3
.
20
Ponieważ oba składniki znajdują się w tej samej objętości
nie jest konieczne obliczanie ich rzeczywistych stężeń,
wystarczy podstawić do wzoru ilości mmoli NH
4
+
i NH
3
.
W zadaniu nie podano pK
a
jonu amonowego, lecz K
amoniaku.
Jest to stała zasadowa!
Na podstawie jej wartości można obliczyć pK
a
jonu
amonowego ponieważ z iloczynu jonowego wody wynika,
że:
pK
a
+ pK
b
= 14
pH = pK
a
+ log
C
zasada
C
kwas
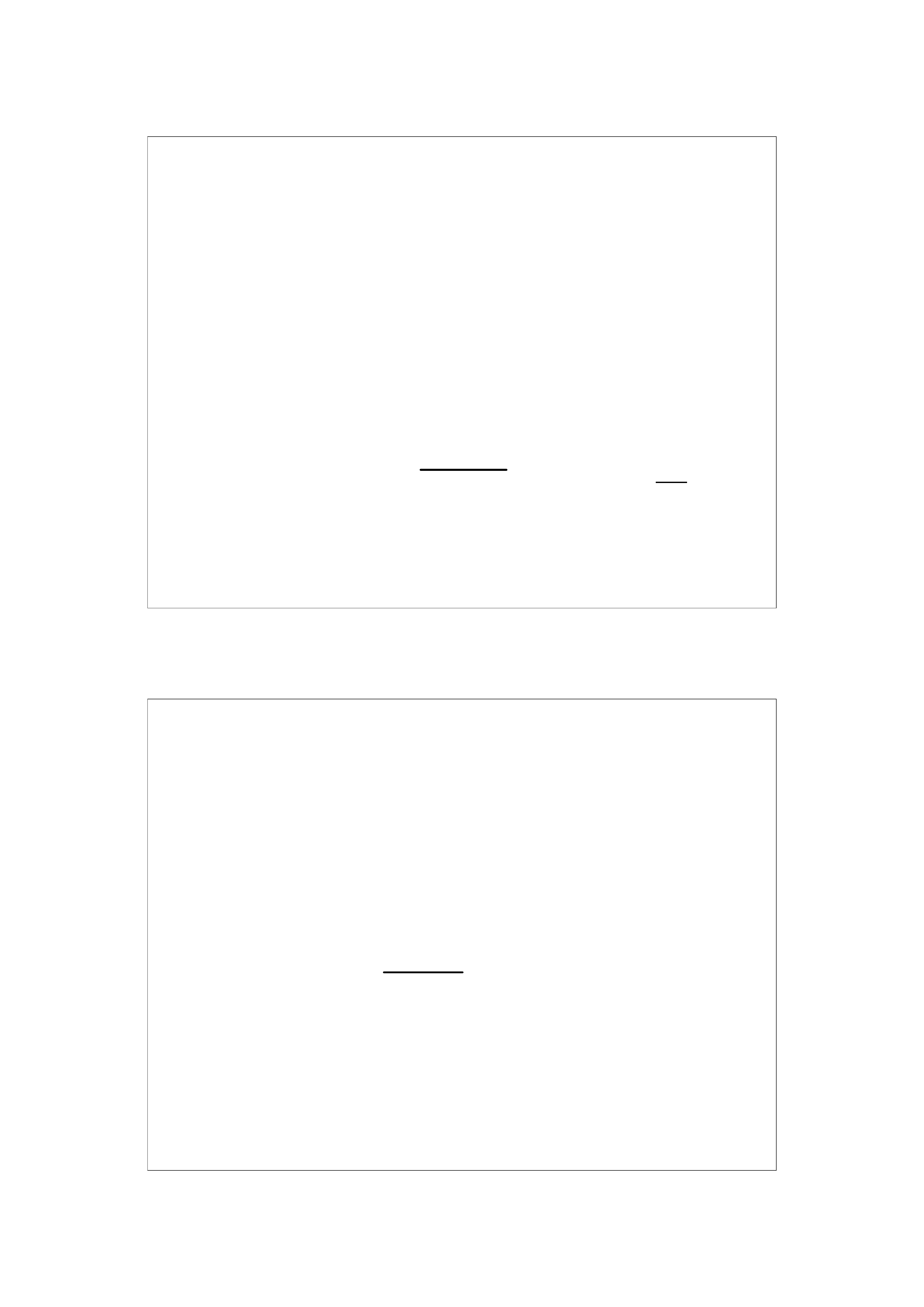
11
21
pH = 9,3 + log
80
20
= 9,3 + 0,6 = 9,9
Obliczamy pK
b
amoniaku
pK
b
= - log 2 x 10
-5
= 4,7
Możemy już obliczyć pKa jonu amonowego
pK
a
= 14 - pK
b
= 14 – 4,7 = 9,3
Mamy już wszystkie dane do obliczenia pH
22
Zadanie 11. Ile cm
3
1 molowego HCl należy dodać do
100 cm
3
buforu fosforanowego zawierającego NaH
2
PO
4
oraz Na
2
HPO
4
aby obniżyć pH z wartości 7,3 do 7,0?
Suma mmoli NaH
2
PO
4
+ Na
2
HPO
4
w 100 cm
3
tego
roztworu wynosi 10. Wartość pK
2
dla kwasu fosforowego
wynosi 7.
pH = pK
a
+ log
C
zasada
C
kwas
pH buforu jest wyższe o 0,3 od pK
a
czyli logarytm stosunku
C
zasada
/c
kwas
wynosi 0,3.
7,3 = 7 + 0,3
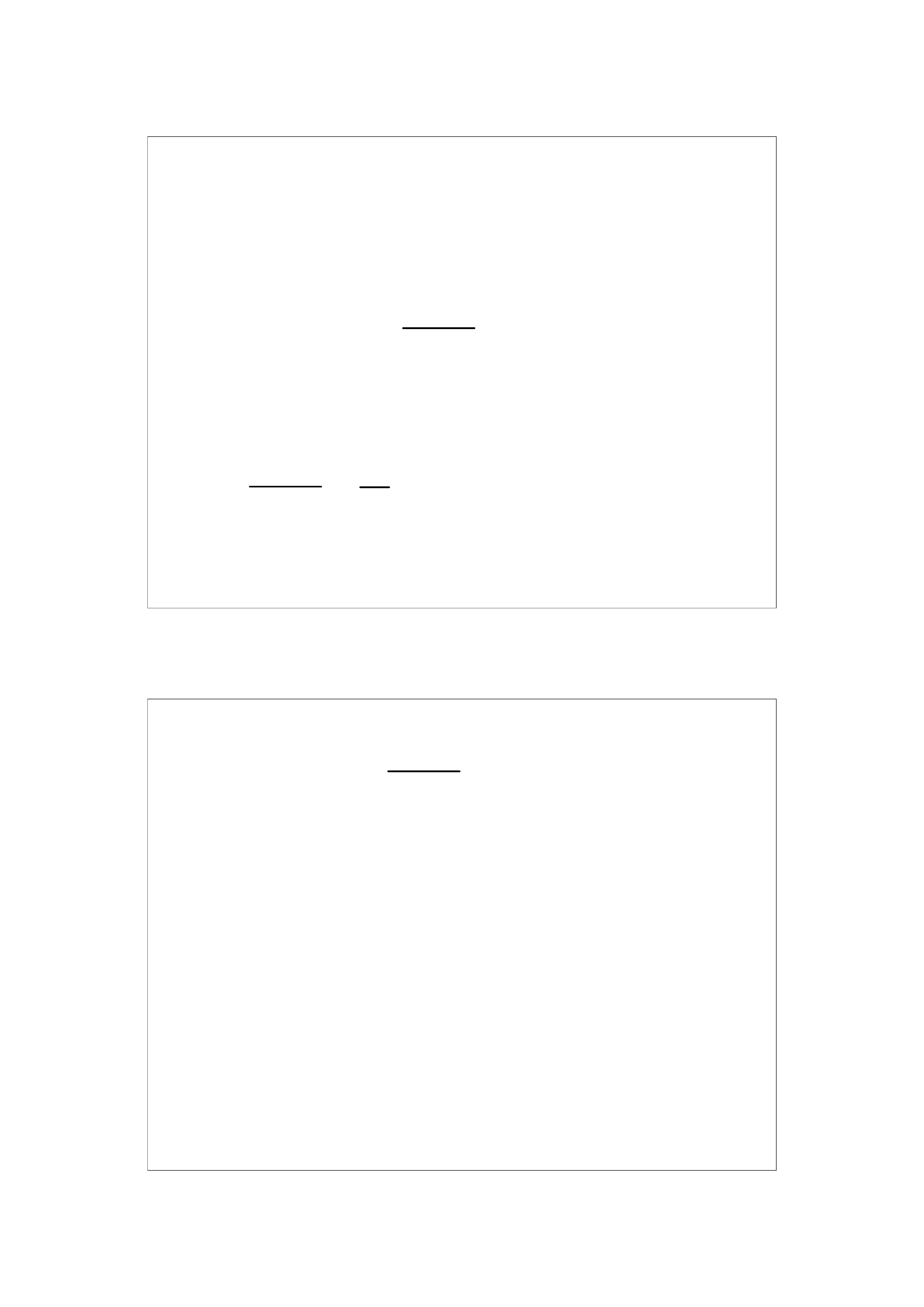
12
23
Znając logarytm można obliczyć liczbę logarytmowaną x.
log x = 0,3 x = 10
0,3
x = 2
Z tego wynika że
Wiemy też, że suma mmoli obu składników wynosi 10 i
zasady jest więcej od kwasu. Można to przedstawić jako
C
zasada
C
kwas
= 2
C
zasada
C
kwas
=
2
1
oraz
C
zasada
+ C
kwas
= 10
24
Dlaczego 5? W celu obniżenia pH do 7, trzeba zmienić
stosunek zasady do kwasu, tak aby wynosił 1, wtedy
pH = pK
2
. Suma mmoli obu składników wynosi 10, więc
stosunek 1 otrzymamy przy równych ilościach 5 + 5.
Trzeba rozwiązać powyższe równanie, gdzie x jest liczbą
mmoli kwasu, która obniży pH o 0,3 jednostki.
Po rozwiązaniu x = 1,67 mmoli HCl
5 + x
5 - x
= 2

13
25
Ostatni etap, to odpowiedź na pytanie ile cm
3
1 molowego HCl zawiera 1,67 mmoli tego kwasu.
x mmoli = c · V(cm
3
)
V(cm
3
) = x mmoli / c
Podstawiamy dane do wzoru
V = 1,67 mmoli / 1 = 1,67 cm
3
Wyszukiwarka
Podobne podstrony:
Chemia ogolna wyklady 5 6 2012 Nieznany
Chemia ogólna wykład 2 2012
Chemia ogólna wykład 4 2012
Chemia ogólna wykład 4-2012
Chemia ogolna wyklad 3 2012 id Nieznany
Chemia ogólna wykład 1 2012
Chemia ogolna wyklady 5 6 2012 Nieznany
Cząsteczka (VB), CHEMIA, semestr 1, chemia ogólna, wykłady
Chemia ogólna program 2012 2013
Slownik ChemLab, Studia, Chemia ogólna wykład
Kinetyka chemiczna, CHEMIA, semestr 1, chemia ogólna, wykłady
Elektrody, CHEMIA, semestr 1, chemia ogólna, wykłady
Budowa atomu 2, CHEMIA, semestr 1, chemia ogólna, wykłady
więcej podobnych podstron