Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2012
Z
K
am or
1
Badanie wyników nauczania z chemii
poziom RozszeRzony
(chemia ogólna)
czas pracy 45 minut
Za rozwiązanie wszystkich zadań można otrzymać łącznie 30 punktów
zadanie 1. (2 pkt)
1.1
Zapisz konfiguracje elektronowe (zapis skrócony z symbolem helowca) dla atomów podanych pier-
wiastków w stanie podstawowym oraz dla wybranych jonów prostych tych pierwiastków. Uzupełnij
poniższą tabelę.
Symbol metalu Konfiguracja elektronowa atomu Wzór jonu
Konfiguracja elektronowa jonu
Fe
Fe
3+
As
As
3+
zadanie 2. (1 pkt)
2.1
Najbardziej trwały izotop złota
197
Au, który można otrzymać w reaktorze atomowym, np. z rtęci, w wyniku
reakcji opisanej równaniem:
199
80
Hg +
2
1
D →
197
79
Au +
4
2
α
jest cennym „surowcem” do syntezy innych pierwiastków chemicznych.
Uzupełnij podane równanie reakcji jądrowej pozwalającej z izotopu
197
Au uzyskać pierwiastek, który
występuje w przyrodzie w znikomych ilościach w minerałach uranowych.
197
79
Au +
22
10
→
212
87
+
4
2
α + …
zadanie 3. (3 pkt)
3.1 3.2 3.3
Pierwiastek Y tworzy z wodorem związek typu YH
4
, a z tlenem związki typu YO, YO
2
. Jeden z tlenków pier-
wiastka Y jest tlenkiem kwasowym reagującym z wodą, drugi to tlenek obojętny o silnych właściwościach
redukcyjnych.
a) Podaj symbol pierwiastka Y oraz symbol bloku energetycznego (konfiguracyjnego), do którego
pierwiastek ten należy.
Symbol pierwiastka Y: ……………....…..…
Symbol bloku: ………..….……….
b) Narysuj wzór elektronowy cząsteczki YO uwzględniający rodzaje występujących w niej wiązań
chemicznych.
Wzór elektronowy cząsteczki YO:
c) Określ, jaki kształt ma cząsteczka YO
2
.
Kształt cząsteczki YO
2
: ...............................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2012
Z
K
am or
2
zadanie 4. (2 pkt)
4.1
Oceń prawdziwość poniższych zdań i uzupełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe,
lub literę F, jeżeli jest fałszywe.
zdanie
P/F
Cząsteczki KCl
(s)
są zbudowane z kationów potasu K
+
i anionów chlorkowych Cl
–
.
Kationy potasu K
+
i aniony chlorkowe Cl
–
mają konfigurację elektronową argonu.
Promień jonowy K
+
ma taką samą długość jak promień jonowy Cl
–
.
Promień atomu potasu K jest większy od promienia jonu potasu K
+
, a promień atomu
chloru Cl jest taki sam jak promień anionu chlorkowego Cl
–
.
Stopiony chlorek potasu przewodzi prąd elektryczny.
zadanie 5. (2 pkt)
5.1 5.2
Do roztworu zawierającego jony Fe
2+
, Cu
2+
i Zn
2+
o jednakowych stężeniach molowych wprowadzano jony
siarczkowe S
2–
. Zaobserwowano wytrącenie się osadów o różnej barwie. Wartości iloczynów rozpuszczal-
ności dla siarczków wymienionych metali wynoszą: I
rFeS
= 1 · 10
–17
, I
rCuS
= 1 · 10
–35
, I
rZnS
= 1 · 10
–20
.
Podaj wzór siarczku, który wytrącił się jako pierwszy. Odpowiedź uzasadnij.
Jako pierwszy wytrącił się osad: ...........................................
Uzasadnienie: ................................................................................................................................................
.........................................................................................................................................................................
zadanie 6. (3 pkt)
6.1 6.2
Reakcja cynku z kwasem azotowym(V ) przebiega zgodnie z poniższym równaniem:
… Zn + … HNO
3
→ … Zn(NO
3
)
2
+ … NH
4
NO
3
+ … H
2
O
a) napisz w formie jonowej skróconej z uwzględnieniem pobranych lub oddanych elektronów
(zapis jonowo-elektronowy) równania procesów redukcji i utleniania.
Równanie procesu redukcji: ................................................................................................................
Równanie procesu utleniania: ..............................................................................................................
b) Dobierz i uzupełnij współczynniki stechiometryczne w poniższym równaniu.
… Zn + … HNO
3
→ … Zn(NO
3
)
2
+ … NH
4
NO
3
+ … H
2
O
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2012
Z
K
am or
3
zadanie 7. (2 pkt)
7.1 7.2
Korzystając z podanych w tabeli wartości energii wiązań
(e
w
), oblicz standardową entalpię reakcji syntezy amoniaku
(∆Hº) oraz standardową entalpię tworzenia (∆Hº
tw
) produktu
tej reakcji:
n
2(g)
+ 3h
2(g)
→ 2NH
3(g)
Wiązanie
e
w
[kJ · mol
–1
]
N–N
163
N=N
419
N=–N
937
N–H
390
H–H
436
Obliczenia:
Odpowiedź: ................................................................................................................................................
zadanie 8. (1 pkt)
8.1
Ustal, jak należy zmienić (zwiększyć / zmniejszyć) ciśnienie i temperaturę, aby reakcję spalania amo-
niaku znajdującą się w stanie równowagi:
4nh
3(g)
+ 3o
2(g)
→
← 2n
2(g)
+ 6h
2
o
(g)
∆Hº = –1297 kJ
przesunąć w kierunku wzrostu wydajności tworzenia produktów.
Aby reakcję spalania amoniaku znajdującą się w stanie równowagi przesunąć w kierunku wzrostu wydaj-
ności tworzenia produktów, należy ……………………… ciśnienie oraz …………………… temperaturę.
zadanie 9. (2 pkt)
9.1
Do reakcji syntezy chlorowodoru HCl
(g)
użyto 6,02 · 10
22
cząsteczek H
2(g)
i 1,204 · 10
23
cząsteczek Cl
2(g)
.
Zakładając 100% wydajność reakcji, oblicz, jaką objętość, w przeliczeniu na warunki normalne,
zajmą gazy w mieszaninie poreakcyjnej.
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2012
Z
K
am or
4
zadanie 10. (2 pkt)
10.1 10.2
Zmieszano jednakowe objętości wodnych roztworów chlorowodoru i amoniaku o jednakowym stężeniu
molowym.
Ustal odczyn mieszaniny poreakcyjnej. Odpowiedź uzasadnij, pisząc odpowiednie równanie reakcji
w formie jonowej skróconej.
Odczyn roztworu po reakcji: .........................................................................................................................
Uzasadnienie: ................................................................................................................................................
zadanie 11. (2 pkt)
11.1
Oblicz pH wody barytowej, wiedząc, że 200 cm
3
jej roztworu zawiera 1,71 g Ba(OH)
2
.
Obliczenia:
Odpowiedź: ................................................................................................................................................
zadanie 12. (2 pkt)
12.1
Określ, jak zmieni się stopień dysocjacji jednoprotonowego kwasu (ile razy zwiększy się / nie zmie-
ni się / ile razy zmniejszy się), jeżeli jego wodny roztwór o stężeniu 0,1 mol/dm
3
rozcieńczymy stukrot-
nie (k
a
= 5,0 · 10
–8
).
Obliczenia:
Odpowiedź: ................................................................................................................................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Badanie wyników nauczania z chemii. Poziom rozszerzony
Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2012
Z
K
am or
5
zadanie 13. (2 pkt)
13.1
Oceń prawdziwość poniższych zdań i uzupełnij tabelę, wpisując literę P, jeżeli zdanie jest prawdziwe,
lub literę F, jeżeli jest fałszywe.
zdanie
P/F
Produktami elektrolizy stopionego chlorku ołowiu(II) są metaliczny ołów na katodzie
i gazowy chlor na anodzie.
Produktami elektrolizy wodnego roztworu KNO
3
są tlen na anodzie i wodór na katodzie,
wydzielone w stosunku objętościowym 1 : 1.
Podczas elektrolizy wodnego roztworu Na
2
SO
4
stężenie soli się zmniejsza.
Podczas elektrolizy wodnego roztworu NaCl odczyn elektrolitu zmienia się z obojętnego
na zasadowy.
Podczas elektrolizy wodnego roztworu zawierającego jony Ag
+
, Cu
2+
i Sn
2+
o jednakowych
stężeniach molowych na katodzie wydzielą się metale w kolejności: cyna, miedź, srebro.
zadanie 14. (2 pkt)
14.1
Reakcja chemiczna opisana schematem: A + 2B → AB
2
przebiega według równania kinetycznego: v = k · [A] · [B]
2
Oblicz, ile razy zwiększy się (zmniejszy się) szybkość tej reakcji, jeżeli stężenie substratu A zwiększy
się dwukrotnie, a stężenie substratu B zmniejszy się dwukrotnie.
Obliczenia:
Odpowiedź: ................................................................................................................................................
zadanie 15. (2 pkt)
15.1
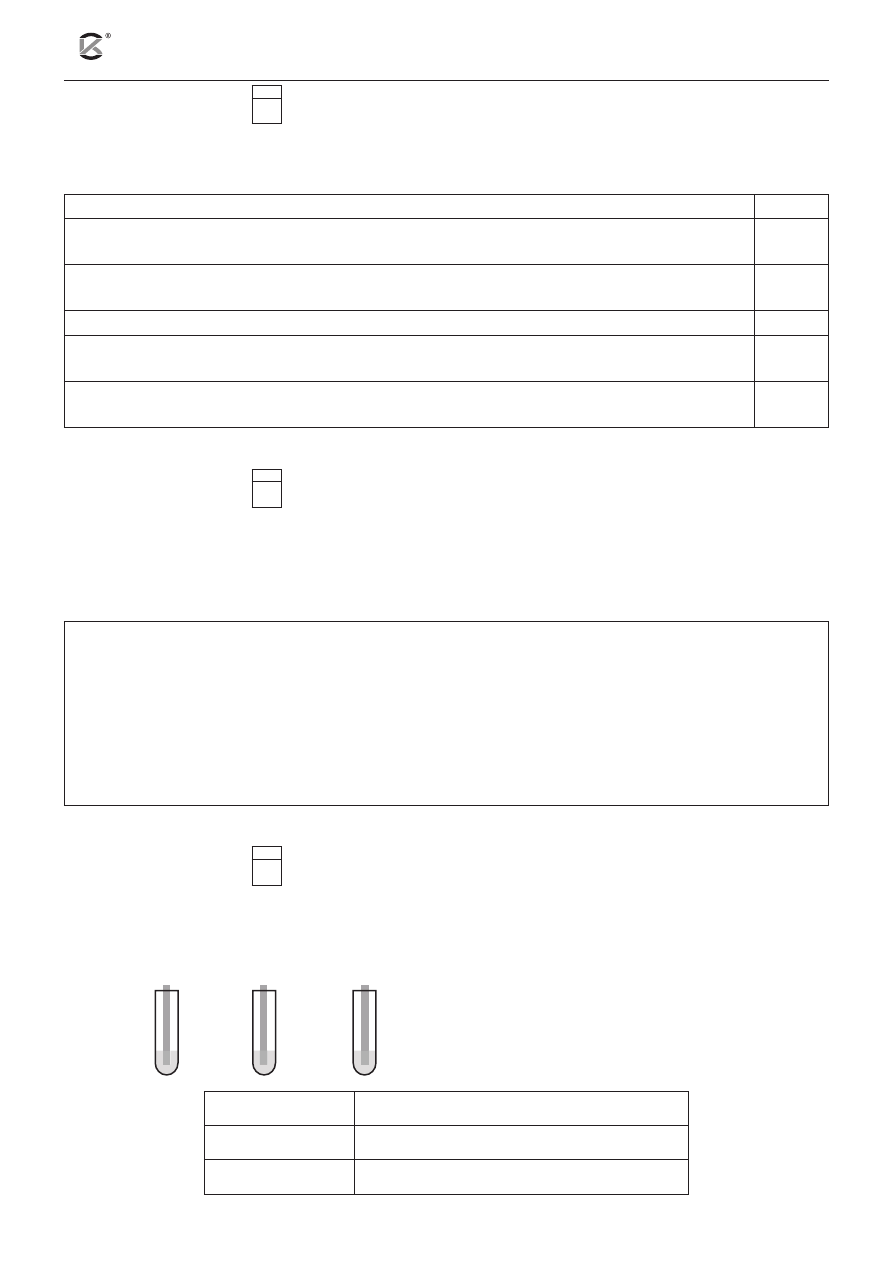
Do probówek zawierających roztwór siarczanu(VI) miedzi(II) o jednakowym stężeniu molowym zanurzono,
według poniższego schematu, płytki: cynkową, srebrną i żelazną o jednakowej masie. Po pewnym czasie
płytki wyjęto, osuszono i zważono.
II
I
Zn
Ag
Fe
III
Określ, jak zmieniła się masa płytek (wzrosła /
zmalała / nie uległa zmianie) w poszczególnych
probówkach. Uzupełnij poniższą tabelę.
Probówka nr I.
masa płytki cynkowej .................................
Probówka nr II. masa płytki srebrnej ....................................
Probówka nr III. masa płytki żelaznej ...................................
Dokument pobrany przez: 25087af0d481e50d7a52e9c006498b9824f8a75b
Wyszukiwarka
Podobne podstrony:
biol prob styczen 2012 id 87360 Nieznany
chemia 3 etap gim 2012 id 11187 Nieznany
EiZI Projekt GiG4 2012 id 15450 Nieznany
Analiza kosztow 2012 id 60726 Nieznany (2)
pp A1 2012 id 381123 Nieznany
czerwiec 2012 2 id 128513 Nieznany
PA termin 3 2012 id 345017 Nieznany
dwujezyczna 2012 id 144693 Nieznany
6 ZKM marzec 19 2012 id 44004 Nieznany (2)
alfik 2012 3 id 56900 Nieznany
Proseminarium7 10 2012 id 40197 Nieznany
Pomoc Spoleczna 2012 id 374827 Nieznany
CHOROBY ZAWODOWE 2012 id 115799 Nieznany
decyzja nr rbg 19 2012 id 13251 Nieznany
NPZ 2012 id 324747 Nieznany
egz lato 2012 id 151206 Nieznany
ZZWK egzamin 18 06 2012 id 5944 Nieznany
cad 1 I Cw 11 2012 id 107651 Nieznany
więcej podobnych podstron