
ROZDZIELANIE STRĄCENIOWE
Rozdzielanie strąceniowe opiera się na różnicach w rozpuszczalności substancji w
środowisku wodnym. Rozdzielanie strąceniowe nie jest bardzo ściśle ilościowe z racji na
rozpuszczalność nawet bardzo trudno rozpuszczalnych oraz z uwagi na zjawisko
współstrącania. Rozdzielanie strąceniowe stosuje się do:
a) rozdzielania makroskładników od siebie
b) rozdzielania mikroskładników od makroskładników.
Nie stosuje się go do rozdzielania mikroskładników, względnie śladów.
Rozdzielanie strąceniowe opisujemy współczynnikami oddzielenia i zatrzymania:
Rozdzielanie strąceniowe składników (A,B)
A- tworzy trudno rozpuszczalny osad
B- pozostaje w roztworze
Współczynnik oddzielenia (składnik A w formie osadu):
R
a
= Q
A, osad
/Q
A, początkowa ilość
Współczynnik zatrzymania (składnik B w roztworze):
R
B
= Q
B, roztwór
/Q
B, początkowa ilość
Dobra metoda:
0,999>=R>=1
W rozdzielaniu strąceniowym wykorzystuje się często podział kationów na grupy analityczne.
W przypadku niektórych osadów, a przede wszystkim wodorotlenków i siarczków, dla
całkowitego wytrącenia należy zapewnić odpowiednie pH roztworu:
ZnS pH > 3
As
2
S
3
pH < 7
Mg(OH)
2
pH > 12
Al(OH)
3
6,5 < pH <8,8
W środowisku kwaśnym:
Al(OH)
3
+ 3 H
+
→ Al
3+
+ 3H
2
O
W środowisku zasadowym:
Al(OH)
3
+ OH
-
→ Al(OH)
4
-
Aby zachować pH czasami w ściśle określonych granicach strącanie prowadzi się stosując
roztwory buforowe.
SPECYFICZNE METODY ROZDZIELANIA STĄCENIOWEGO
a) odparowanie badanego roztworu w obecności odpowiedniego kwasu. Taką metodę stosuje
się do oddzielenia krzemionki. Polega to na odparowaniu badanej próbki z HCl do małej
objętości. Odparowanie próbki z HCl do sucha może wytrącić kwas krzemowy.
Podobnie można wydzielić ilościowo kwas niobowy, wolframowy lub tantalowy. Poprzez
odparowanie z kwasem azotowym możemy wydzielić z roztworu cynę i antymon w postaci
kwasu cynowego i antymonowego.

b) redukcja jonów do postaci elementarnej. Tak wydzielamy metale szlachetne typu: złoto,
srebro, rtęć. Odczynnikami redukującymi są: SnCl
2
, SO
2
, Zn.
Problemem w rozdzielaniu strąceniowym jest kontaminacja (zanieczyszczenie) osadów.
Kontaminację osadów można ograniczyć przez:
a) odpowiedni dobór pH
b) dobór właściwych roztworów do przemywania
c) sączenie wielokrotne
ODDZIELANIE ŚLADÓW Z ZASTOSOWANIEM NOŚNIKÓW
nośnik- jest to substancja dodawana do roztworu w celu współstrącenia z nią substancji
śladowej. Jako nośnik stosuje się na ogół pierwiastki podobne do pierwiastków
śladowych, a jednocześnie nie przeszkadzających w ich dalszym oznaczaniu.
Ślad Nośnik Osady
Pb
2+
Ba
2+
BaSO
4
+ PbSO
4
Al
3+
Fe
3+
Fe(OH)
3
+ Al(OH)
3
Cu
2+
Cd
2+
CdS + CuS
Rozdzielenie elektrochemiczne (elektrolityczne)- polega na wydzieleniu składników z
roztworu za pomocą prądu elektrycznego przy kontrolowanym potencjale. Wyróżnia się:
a) wydzielanie katodowe- polega na tym, że na katodzie wydzielają się metale, jest
często stosowane.
b) wydzielanie anodowe- jest rzadko stosowane, przykładem jest osadzanie się PbNO
2
na
anodzie.
Rozdzielanie elektrolityczne jest z reguły połączone z bezpośrednim oznaczaniem
(elektrograwimetria). Przy stosowaniu oznaczania i rozdzielania elektrolitycznego muszą być
spełnione następujące warunki:
1) Ściśle określony przebieg reakcji elektrodowej, tzn. np. ilościowa redukcja
wydzielonego metalu.
2) Tworzenie się dobrze przylegających osadów.
3) Odpowiednio duża różnica potencjałów wydzielania rozdzielanych jonów.
Metody rozdzielania na podstawie efektów kinetycznych i elektrokinetycznych:
Dializa- jest to metoda pozwalająca na rozdzielenie składników roztworu różniących się
wielkością cząstek, wykorzystująca błony selektywnie przepuszczalne (membrany). Błony te
pozwalają na dyfuzję małych cząstek a zatrzymują cząstki o dużych rozmiarach. Dializa jest
stosowana do rozdzielania cząstek koloidalnych od cząstek roztworów rzeczywistych.
Elektrodializa- jest to dializa prowadzona w stałym polu elektrycznym. Elektrodializa jest
stosowana do oczyszczania roztworów koloidalnych od domieszek którymi są elektrolity.
Elektroforeza- jest to zjawisko elektrokinetyczne związane z ruchem naładowanych
elektrycznie cząstek fazy rozproszonej względem fazy rozpraszającej.
zol, zawiesina środowisko
Elektroforeza- jest to metoda rozdzielania substancji rozpuszczonych lub rozproszonych w
roztworze elektrolitu na podstawie różnych ich ruchliwości w polu elektrycznym.

Zastosowanie elektroforezy to rozdzielanie i izolowanie białek, analiza biochemiczna takich
składników jak enzymy, proteiny.
Metody oparte na lotności substancji: metody te nie są tak powszechne jak chromatografia,
rozdzielenie powierzchniowe czy ekstrakcja, uważane są często za metody specyficzne, są
one bardzo przydatne gdy możemy z próbki usunąć makroskładniki.
a) usuwanie makroskładnikowe:
Si... + 4HF → SiF
4
↑
Drugie zastosowanie metod opartych na lotności to oddzielenie oznaczanego sładnika w
postaci lotnego składnika od pozostałych składników próbki
b) As → AsH
3
↑
Se → H
2
Se↑
Sn → SnCl
4
↑
Hg(II) → Hg↑
METODA WYMIANY JONOWEJ
wymiana jonowa- to metoda rozdzielania składników roztworu oparta na reakcjach jonowych
pomiędzy dwoma fazami: fazą jonitu i fazą roztworu próbki, jonity składają się ze szkieletów
(roztwór wodny)
oraz grup funkcyjnych zawierających wymienne kationy lub aniony. Szkielet jonitów
stanowią nierozpuszczalne w wodzie przeważnie zdolne do pęcznienia silnie usieciowione
polimery wielkocząsteczkowe. Jonity dzielimy na: organiczne i nieorganiczne, 2 podział:
naturalne i syntetyczne (sztuczne). Przykłady nieorganicznych, naturalnych: glinokrzemiany;
organiczne naturalne: torf, celuloza; organiczne syntetyczne: żywice jonowymienne.
Wymiana jonowa polega na tym, że jonit (wymieniacz jonowy) zanurzony w roztworze
elektrolitu pobiera z roztworu kationy lub aniony oddając jednocześnie do roztworu
równoważną liczbę jonów o tym samym znaku ładunku. W zależności od rodzaju grupy
funkcyjnej istnieje różne powinowactwo jonitu do jonu w roztworze.
Wymianę jonową możemy opisać następującymi reakcjami:
wymiana kationów: nA
k
H + Me
n+
(A
k
)
n
Me + nH
+
wymiana anionów mA
A
+ X
m-
(A
A
)
m
X + mOH
-
Równowagi wymiany jonowej opisuje prawo działania mas. Ze względu na dużą moc jonową
na granicy faz zamiast termodynamicznej stałej równowagi stosuje się chemiczną stałą
równowagi K
c
nAj + mBr = nAr + mBj
Proces wymiany jonowej: wymiana jonów B i A między roztworem i jonitem, stałą
równowagi:
K
c
= ([A
r
]
n
[B
j
]
m
)/([A
j
]
n
[B
r
]
m
) K
a
=((a
A
)
r
n
(a
B
)
j
m
)/ ((a
A
)
j
n
(a
B
)
r
m
)
Współczynnik podziału:
D
A
= [A
j
]/[A
r
] D
B
= [B
j
]/[B
r
]
Współczynnika rozdzielenia (rozdziału jonów A i B od siebie)
L = D
B
/D
A
W przypadku jonitów kwasowych z grupą sulfonową jako funkcyjną powinowactwo jonitu do
kationu rośnie wraz z ładunkiem jonu:
K
+
<Ba
2+
<Al
3+
W przypadku kationów o tym samym ładunku powinowactwo jonitu do kationu rośnie wraz z
masą jonu.
Li
+
<Na
+
<K
+
<Rb
+
<Mg
2+
<Co
2+
<Sr
2+
<Ba
2+
W przypadku anionów powinowactwo jonitu rośnie wraz z ładunkiem jonitu:
Cl-<SO
4
2-
<PO
4
3-
Ale przy tym samym znaku szereg nie wykazuje już prawidłowości:
F
-
<OH
-
<Cl
-
<CN
-
<Bi
-
<NO
3
-
Na rozdzielenie jonów ma wpływ dobór warunków w procesie wymiany jonowej:
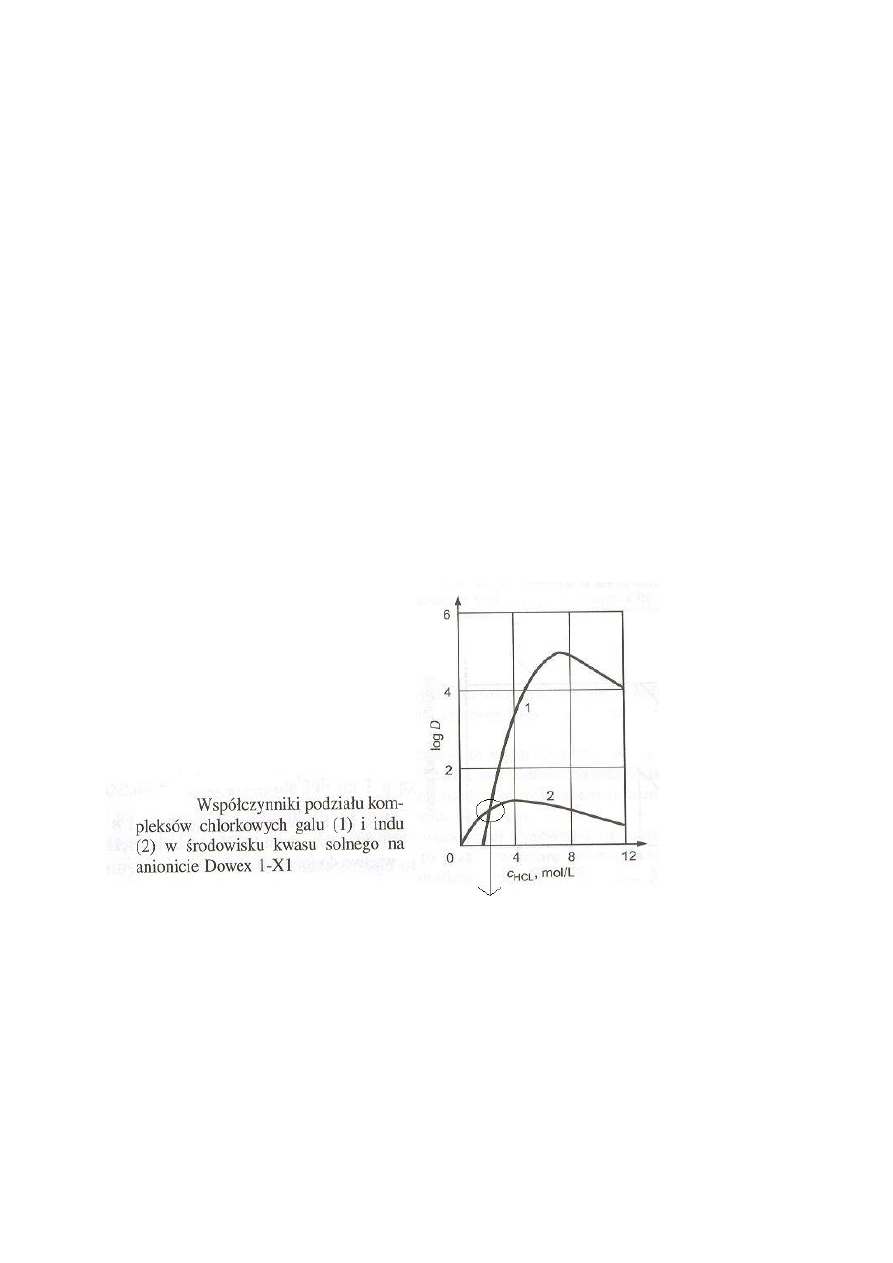
W tym miejscu nie można oddzielić galu od indu
stosując wymianę jonową.
Zastosowanie jonitów:
a) usuwanie jonów przeszkadzających (zanieczyszczających)
b) rozdzielenie jonów
c) zagęszczanie śladów
d) otrzymywanie wody demineralizowanej (dejonizowanej)
EKSTRAKCJA
ekstrakcja- jest to zazwyczaj proces przeprowadzania substancji znajdującej się w jednej fazie
ciekłej od drugiej fazy ciekłej nie mieszającej się z pierwszą. W praktyce analitycznej jedną
fazą jest faza wodna, drugą rozpuszczalnik organiczny (ekstrakcja ciecz- ciecz). Ekstrakcją
nazywamy też ługowanie tzn. wymywanie składników z fazy stałej, próbki stałej→ ekstrakcja
ciało stałe- ciecz. W celu przyspieszenia procesu ekstrakcji stosuje się wymieszanie
mieszaniny.
Proces ekstrakcji podlega regule faz Gibbsa: f = n – s + 2
fazy liczba składników liczba stopni
niezależnych swobody
Stała podziału:
Stężeniowa: K = [B
org.
]/[B
aqua
]
lub aktywnościowa
Tak prosto możemy opisywać układ w którym nie zachodzą reakcje chemiczne.
Współczynnik podziału:
D = (Σ[B
i
]
org.
)/(Σ[B
i
]
aqua
)
Procent ekstrakcji:
%E = 100D/(D + V
aqua
/V
org.
)
np.
D = 10 V
aqua
= V
org.
%E→91
D = 100 V
aqua
= V
org.
%E→99
Warunkiem dobrego rozdzielenia składników jest duża różnica ich współczynników podziału.
Dużą rolę odgrywają też warunki ekstrakcji.
Czynniki które wpływają na efektywność rozdziału w metodzie ekstrakcji to:
a) odczynniki kompleksujące→ najczęściej stosujemy jony chlorkowe, [(cyjanki,
fluorki)- rzadziej]; organiczne: ditizon, dimetyloglioksym, kupferron, jony rodankowe.
b) rozpuszczalniki ekstrakcyjne- podstawową cechą rozpuszczalników ekstrakcyjnych
powinna być nierozpuszczalność w wodzie. Rozpuszczalniki stosowane w ekstrakcji
wybieramy w oparciu o takie parametry jak:
1) gęstość
2) temperatura wrzenia
3) palność
4) rozpuszczalność ekstrahowanego składnika
5) czystość
ad 1
Powinna być różna od gęstości wody, najlepiej większa od gęstości wody.
ad 2
Jak największa
ad3
Powinien być niepalny.
Korzystne jest aby była duża różnica gęstości, wysoka temperatura wrzenia i niska palność
oraz niewielka rozpuszczalność w wodzie.
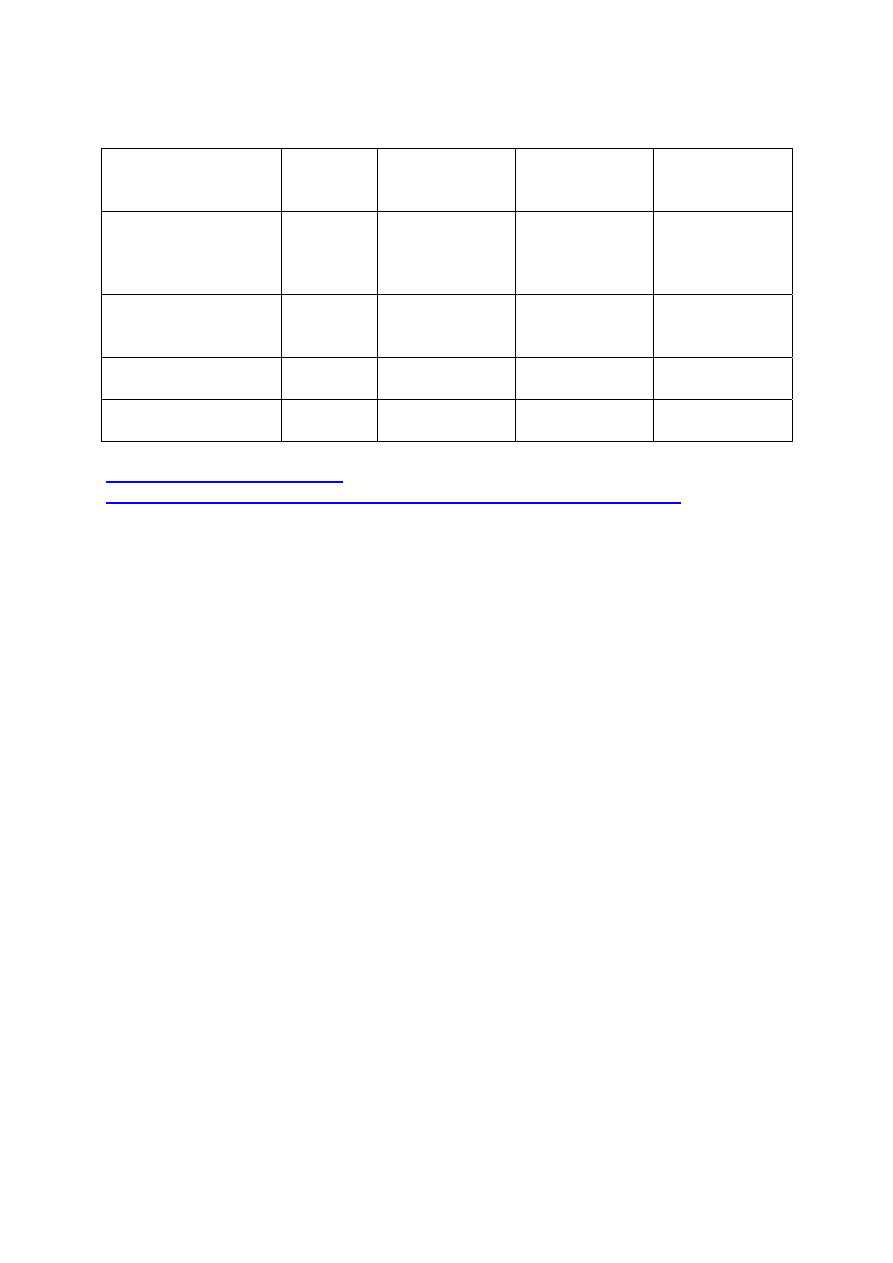
Przykłady złych i dobrych rozpuszczalników:
Rozpuszczalnik Gęstość Temperatura
wrzenia
Względna
przenikalność
elektryczna
Rozpuszczalność
w wodzie
Aceton (nie nadaje się
bo się rozpuszcza w
wodzie i ma niską
temp. wrzenia)
0,891
56,5
20,7
nieograniczona
Alkohol n- pentylowy
(n- amylowy) (nadaje
się)
0,814
138,1
13,8
2,2
Alkohol etylowy (nie
nadaje się)
0,789 78,3
24,3
nieograniczona
Tetrachloroetylen
(nadaje się)
1,631 121,2
2,3
0,02
PRZYKŁADOWE PYTANIE:
W oparciu o jakie parametry wybieramy rozpuszczalnik do ekstrakcji???
Wyszukiwarka
Podobne podstrony:
chemia analityczna wyklad 11 i 12
chemia analityczna wyklad 02
chemia analityczna wyklad 13 i 14
Chemia analityczna wykład prezentacja
Chemia analityczna wykłady
chemia analityczna wyklad 01
analityczna egzamin pohl, Studia PWr, IV semestr, Chemia analityczna, Wykład (Pohl), Egzamin
chemia analityczna wyklad 07
chemia analityczna wyklad 08 i 09
Pytania na kolokwium wykładowe, Chemia, Analityczna, wykład
chemia analityczna wyklad 10
chemia analityczna wyklad 04
chemia analityczna wyklad 05
chemia analityczna wyklad 10
chemia analityczna wyklad 01
chemia analityczna wyklad 11 i 12
więcej podobnych podstron