1
Budowa atomu
1.
Cząstki elementarne występujące w atomach
2.
Liczby kwantowe
3.
Kształty i kierunki orbitali
4.
Elektronowa konfiguracja atomów
5.
Tworzenie jonów
konspekt
%. skład ludzkiego ciała
0,08%
Cl
0,22%
0,31%
1,4%
9,5%
25,5%
63%
P
Ca
Na
C
O
H
%. skład skorupy ziemskiej
2,5%
K
2,5%
3,5%
4,5%
7,9%
28%
47%
Na
Ca
Fe
Al
Si
O
105 (106) pierwiastków
92 w postaci naturalnej
Symbol – 1 lub 2 litery – nazwy łacińskiej
CHEMIA
pierwiastek chemiczny, substancja prosta stanowiąca zbiór atomów o tej
samej liczbie atomowej.
Atomy danego pierwiastka chemicznego mogą się różnić liczbą
neutronów, a zatem i masą jądra.
pierwiastek chemiczny - w opisie makroskopowym substancja, która nie
ulega rozkładowi podczas reakcji chemicznych; w opisie mikroskopowym
zbiór atomów o takich samych właściwościach.
cząsteczka - najmniejsza porcja związku chemicznego
atom - najmniejsza porcja pierwiastka chemicznego, każdy pierwiastek to
zbiór określonych atomów
atomowa jednostka masy - (symbol u) jednostka masy używana do wyrażania
mas drobin, na przykład atomów, cząsteczek
Jednostka masy atomowej jest dwunastą częścią masy jądra atomu węgla
1 u (unit) odpowiada 1.66057 • 10-27 kg.
Alpha () : 2 protony i 2 neutrony (He)
Beta () : elektron ładunek (-)
Pozytron : antymateria elektron o ładunku (+)
Gamma () : promieniowanie o wysokiej energii
(foton)
atom – 8 cząstek- 3 główne - elementarne
cząstki materii
Z
-1
0,00055
9,110*10
-28
g
e
Elektron
N
N=A-Z
0
1,0087u
1,675*10
-24
g
n
Neutron
Z
+1
1,0073u
1,673*10
-24
g
p
Proton
Liczba
Ładunek
1,6*10
-19
C
Masa[u]
j.a.m
Symbol
Cząstka
Z = liczba atomowa = ilość protonów lub elektronów w atomie
zapis :
8
O,
6
C,
A = liczba masowa
A=N+Z
N = liczba neutronów
cząstki elementarne występujące w atomach
Z
1
= Z
2
N
1
= N
2
A
1
= A
2
Z
1
= Z
2
N
1
N
2
A
1
A
2
NUKLIDY
IZOTOPY
masa atomowa = (%m
1
A
1
+ %m
2
A
2
+....... %m
n
A
n
)/100
.
istnieje jeszcze trzeci, promieniotwórczy izotop wodoru, który został
otrzymany sztucznie - tryt
1
3
T
wodór występujący w przyrodzie jest mieszaniną dwóch nuklidów:
1
1
H,
1
2
D
izotop węgla
12
C jest wzorcem masy; z kolei ten sam pierwiastek w
odmianie
14
C jest promieniotwórczy i służy do określania wieku próbek
12
C posiada w jądrze 6 protonów i 6 neutronów
14
C posiada w jądrze 6 protonów i 8 neutronów
4
2
He
ekran
. . . . . .
.
.
.
.
.
.
.
.
. . . .
. . .
. . . . . .
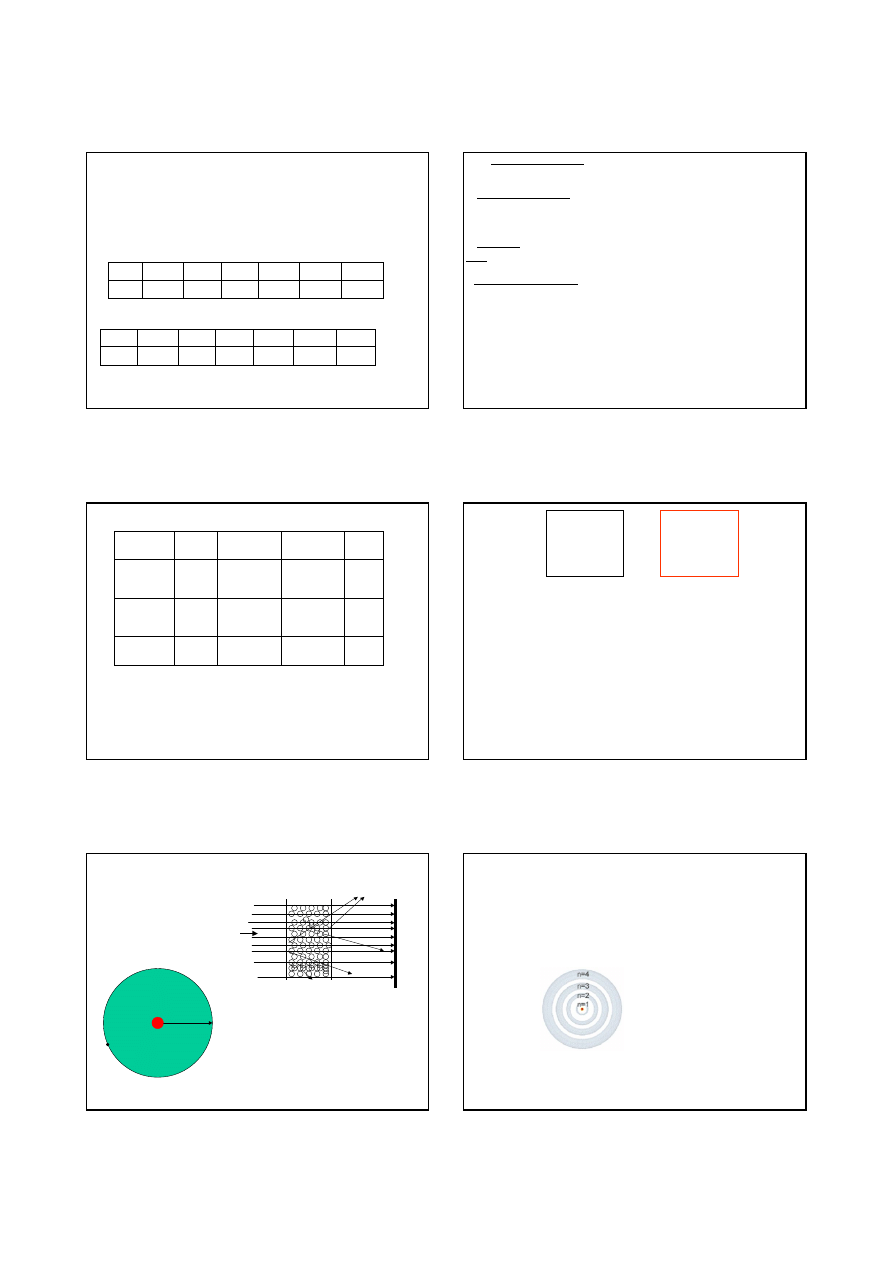
w 1908 roku Rutherford stwierdził, że
promieniowanie to atomy He
pozbawione elektronów
doświadczenie z rozpraszaniem cząstek
na atomach cienkiej złotej folii.
jądra = 10
-15
10
-14
m
atomu = 10
-10
m
5*10
-11
m
proton
elektron
I postulat – orbity stacjonarne
w atomie istnieją ściśle dozwolone
tory
w kształcie
okręgów
,
różniące się
promieniem
a elektron
krąży
po jednej z nich
nie wysyłając i nie pobierając energii
elektron
nie emituje
energii – jego prędkość
nie maleje
orbity stacjonarne to specjalne orbity wokół jądra, na których
elektrony poruszają się bez utraty energii
2n
2
= ilość elektronów
r = 0,53 · 10
-10
m
Model atomu Bohra - planetarny
2
II postulat – zmiana orbity
elektron może pobrać energię doprowadzoną z zewnątrz
na zasadzie jednorazowego, gwałtownego aktu dającego w
efekcie przeskok elektronu na wyższą orbitę
emisja
pobranej energii
w formie fali elektromagnetycznej
h= stała Planck'a
6,6 · 10
-34
J· s
= h ·
13.6 eV - elektrono-Volt- podstawowa jednostka energii w fizyce atomowej
częstość promieniowania
+
•
e
-
E=hc/
+
• e
-
+
• e
-
+
• e
-
E=hc/
E' - E'' = h
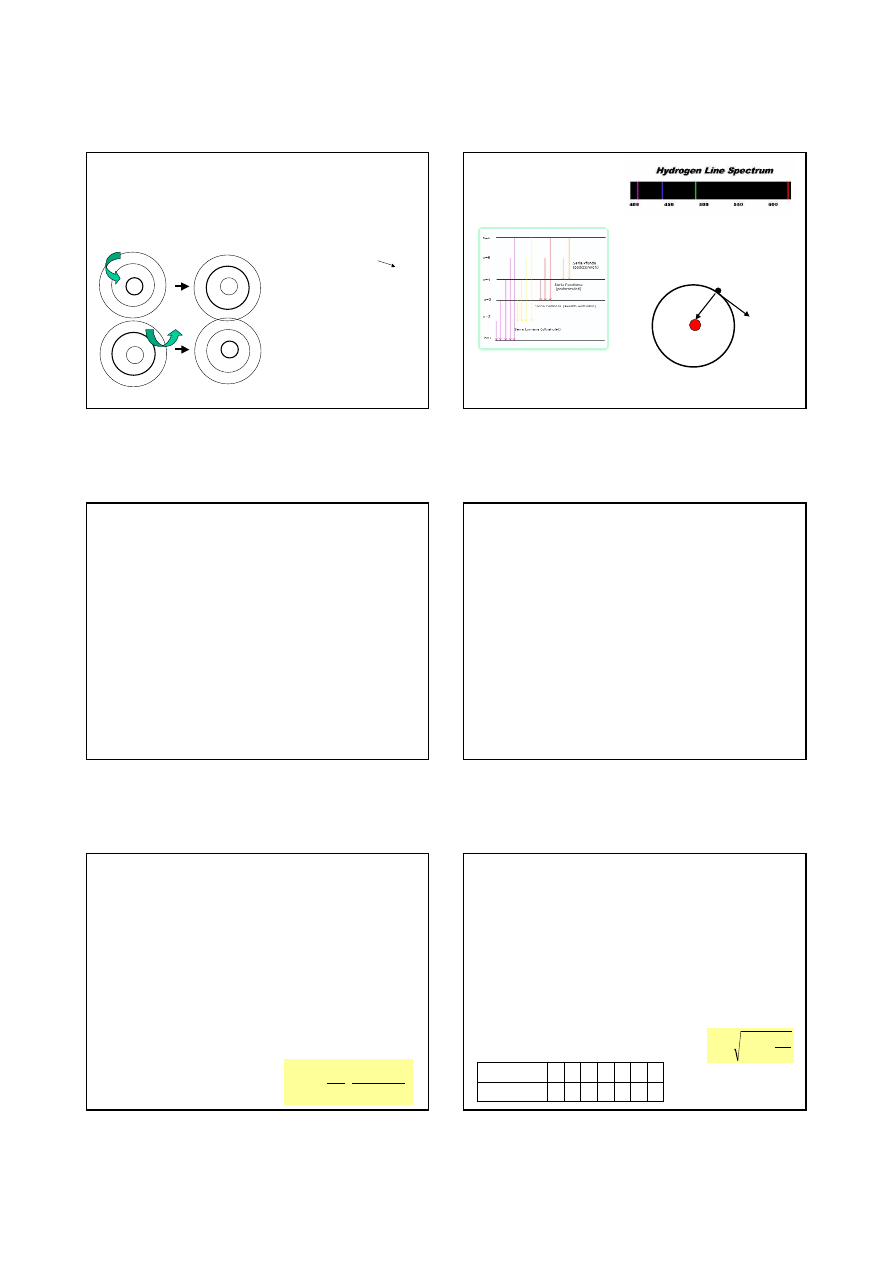
schemat powstawania serii widma
emisyjnego wodoru
widmo wodoru
składa się z linii
Seria Balmera linii widma wodoru atomowego.
Linia o największej długości fali (na lewo) jest
linią, która odpowiada przejściu od stanu
n = 3 do stanu n = 2
III postulat -
przyciąganie elektrostatyczne = siła odśrodkowa
+
-
F
1
F
2
F
1
= F
2
Chemia kwantowa (mechanika kwantowa) - dziedzina z pogranicza fizyki i
chemii, zajmująca się zastosowaniem teorii kwantowej i kwantowej teorii pola w
chemii.
Podstawą chemii kwantowej jest równanie Schrödingera. Chemia kwantowa,
podobnie jak fizyka kwantowa stara się możliwie najdokładniej rozwiązać to
równanie w celu opisania rzeczywistości.
Niedostatek był związany z trudnościami w interpretacji atomów
wieloelektronowych wyjaśnienie tych problemów podała następna teoria:
mechanika kwantowa
Równanie, które dziś nazywamy równaniem Schrödingera,
Erwin Schrödinger podszedł do zagadnienia
dualizmu falowo-korpuskularnego przyrody
przyjmując zależności de Broglie'a (1921) i Planck'a
definiując całkowitą energię cząstki jako:
E = p
2
/2m
o
+ V
m
o
- masa spoczynkowa,
p - pęd,
V - energia potencjalna.
fakt istnienia funkcji falowej oznacza to, że dla
każdej cząstki, czy to dla fotonu, czy elektronu,
istnieje stowarzyszone z nią
pole fal materii
,
(materia), którego amplituda opisana jest funkcją
Y(x, y, z, t), zwaną
funkcją falową
Liczby
kwantowe
stan energetyczny elektronu określany jest przez liczby kwantowe 5 (4)
służą one do kwantowania 5 wielkości fizycznych
każda liczba kwantuje (ściśle określa) jedną wielkość
Symbole liczb kwantowych są tradycyjnie ustalone.
Elektronowi w atomie przypisane są następujące liczby kwantowe:
„n” oznacza numer orbity i przyjmuje wartości całkowitych
liczb dodatnich,
„l” oznacza wartość bezwzględną orbitalnego moment pędu i
przyjmuje wartości liczb naturalnych z zakresu < 0,n − 1 >
,
„m” oznacza rzut orbitalnego momentu pędu na wybraną oś i
przyjmuje wartości liczb całkowitych z zakresu < − l,0,+l >
,
„s” oznacza spin. Dla elektronu przyjmuje wartości +1/2
(„prawoskrętny”) lub – 1/2 („lewoskrętny”)
określa energię elektronu i jego powłokę
przyjmuje wartości
1(K),2(L),3(M),4(N),......
wartość
n –
1, 2, 3, 4, 5, 6...
symbol literowy- K, L, M, N, O, P...
n
- główna liczba kwantowa
zbiór stanów kwantowych o tej samej wartości
głównej liczby kwantowej
zapełnienie
2n
2
powłoka elektronowa
]
2
[
1
2
4
2
2
h
m
e
n
E
n- określa dozwolone wartości energii elektronu na orbicie;
n=1,2,3, ...
l
- poboczna liczba kwantowa
określa podpowłokę, moment pędu i kształt orbitalu
przyjmuje wartości od
0 do n-1
l=0 (s) l=1 (p)
liczbę stanów kwantowych w danej podpowłoce określa się wzorem:
4l + 2
podpowłoka elektronowa
- zbiór stanów kwantowych o takiej samej wartości
głównej liczby kwantowej i pobocznej liczby kwantowej
l = 1, to liczba stanów kwantowych wynosi 6,
l = 4, to liczba stanów kwantowych wynosi 18
orbitalny (zewnętrzny) moment pędu określa się wzorem
2
)
1
(
h
l
l
M
0 l n-1
podpowłoki
s, p, d, f
poboczna liczba kwantowa decyduje o
kształcie obszarów orbitalnych
i..
h
g
f
d
p
s
Symbol podpowłoki
6..
5
4
3
2
1
0
Wartość l
3
s
powierzchnia graniczna orbitalu s
•s
dla serii ostrej /shape/,
•p
dla serii głównej /principle/,
•d
dla serii rozmytej /difusel/
•f
dla serii podstawowej /fundamental/
ORBITAL – każdej kombinacji
liczb kwantowych n, l, m
odpowiada jedna porządna
funkcja spełniająca równanie
Schrödingera, funkcję taką
nazwano orbitalem. Do
oznaczania orbitali używamy
symboli literowych: n = 1 orbital
s, n = 2 orbital p, n = 3 orbital d,
n = 4 orbital f
m
- magnetyczna liczba kwantowa
kwantuje orientacje przestrzenną momentu pędu w postaci rzutu
M na wyróżniony kierunek z
określa na którym orbitalu znajduje się elektron
-l = m = +l
przyjmuje wartości od
-l przez 0 do +l np.
l=2 to m = -2, -1, 0 1 2
określa liczbę orbitali
2
h
m
M
z
orientację przestrzenną momentu
pędu określa wzór
2l + 1
liczba poziomów orbitalnych w powłoce, jest
określana wzorem:
n
2
s
- spinowa liczba kwantowa s = ± 1/2
m
s
– magnetyczna spinowa liczba kwantowa
dodatkowy „wewnętrzny” ruch elektronu wokół
własnej osi
ma tylko jedną
wartość
1/2
kwantuje wartość spinu (własny moment pędu elektronu)
ilość 2
m
s
= + ½
m
s
= - ½
1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
4p
6
5s
2
4d
10
5p
6
6s
2
4f
14
5d
10
6p
6
7s
2
5f
14
6d
6
Zakaz Pauliego
Dwa elektrony mogą zajmować ten sam orbital tylko wówczas, gdy
ich spiny są przeciwne - zorientowane w przeciwnych kierunkach.
maksymalna pojemność powłok wynosi:
K - 2, L - 8, M - 18, N - 32, O - 50
maksymalna liczba elektronów dla podpowłok wynosi:
s - 2, p - 6, d - 10, f - 14
jeden orbital = max.
2
elektrony
Zasada Pauliego:w układzie wieloelektronowym żadne dwa elektrony nie mogą być w tym
samym stanie, tzn. mieć jednakowe wszystkie liczby kwantowe.
Reguła Hunda
Elektrony obsadzają orbitale w taki sposób, aby liczba
niesparowanych elektronów w danej podpowłoce była możliwie
największa
n = 2
1s
2
2s
2
2p
4
1s
2
2s
2
2p
x
2
2p
y
1
2p
z
1
Zasada Hunda: energetycznie najkorzystniejsze (najniższa energia) jest takie
rozmieszczenie elektronów, gdy jak najwięcej z nich ma spiny zgodnie skierowane
elektronowa konfiguracja atomów
konfiguracja elektronowa
pierwiastka to rozmieszczenie
elektronów należących do atomów danego pierwiastka na
poszczególnych jego orbitalach
każdy elektron znajdujący się w atomie opisywany jest przy
pomocy zbioru liczb kwantowych
konfigurację zapisuje się wg pewnej konwencji
wodór
: 1s
1
lub w zapisie "klatkowym":
hel
: 1s
2
neon
: 1s
2
2s
2
2p
6
węgiel – 1s
2
2s
2
2p
2
C: [He] 2s
2
2p
2
zapis klatkowy
argon
sód
chlor
NaCl
tworzenie jonów
H
2
O OH
-
+ H
+
2H
2
O OH
-
+ H
3
O
+
Wyszukiwarka
Podobne podstrony:
chemia 1b druk id 111785 Nieznany
chemia.1a(1), Studia, Chemia, chemia od Ines(1)
chemia.1a, Studia, Chemia, chemia7
1a, Farmacja, III rok farmacji, Chemia leków
BADANIE WYNIKÓW - sprawko 1a, Politechnika Rzeszowska, Chemia
testy - druk, Budownictwo-studia, chemia
KOLOS CHMIA 1a, chemia
teoria do redoksów 1a, Polibuda, II semestr, fizyka, FIZA, lab, Chemia laborki, chemia ogolna nie or
Jako 1A, I rok, I rok, Chemia ogólna, giełdy, Chemia, CHEMIA ORGANICZNA, CHEMIA ORGANICZNA
Chemia fizyczna - kolokwium 1a, OŚ, sem II 1 SOWiG, Chemia Fizyczna, ChF laboratoria
1a i 1b, CHEMIA UŁ, 2 rok, Analiza instrumentalna
druk chemia zywnosci 1
Bakterie spiralne do druk
Chemia Bionie wyk1
chemia powt
więcej podobnych podstron