
1. Co rozumiemy pod pojęciem: pierwiastek chemiczny a co pod pojęciem związek
chemiczny? Wyjaśnić różnicę. Czym różni się mieszanina od związku chemicznego?
Pierwiastek chemiczny – podstawowe pojęcie chemiczne posiadające dwa znaczenia:
•
zbiór wszystkich atomów posiadających jednakową liczbę protonów w jądrze
•
taka substancja chemiczna, która składa się wyłącznie z atomów posiadających
jednakową liczbę protonów w jądrze.
Związek chemiczny - jednorodne połączenie co najmniej dwóch różnych pierwiastków
chemicznych za pomocą dowolnego wiązania.
Różnią się, że substancji złożonej otrzymujemy substancję o odmiennych właściwościach, a
w mieszaninie właściwości są takie same.
2. Co nazywamy masą atomową pierwiastka, w jakich jednostkach je wyrażamy?
Masa atomowa- liczba określająca ile razy masa jednego reprezentatywnego atomu danego
pierwiastka chemicznego jest większa od masy 1/12 izotopu
12
C, przy czym pod pojęciem
'reprezentatywnego atomu' rozumie się atom o średniej masie wyliczonej proporcjonalnie ze
wszystkich stabilnych izotopów danego pierwiastka, ze względu na ich rozpowszechnienie na
Ziemi.
Masa atomowa jest wyrażana w atomowych jednostkach masy [u].
3. Co nazywamy masą cząsteczkową? Obliczyć masy cząsteczkowe(tu odpowiednie związki)
związków.
Masa cząsteczkowa, często mylona z masą molową, to masa:
•
jednej cząsteczki związku (np. O
2
, H
2
O),
•
formalnej jednostki danego związku (np. NaCl o budowie jonowej, a nie
cząsteczkowej),
•
jednego innego indywiduum chemicznego (np. jonu CH
3
COO
-
).
4. Jak brzmi definicja mola? Co rozumiemy przez 1 mol substancji?
Mol – jednostka liczności materii.
Jeden mol jest to liczba cząstek (np. atomów, cząsteczek, jonów, elektronów itp.) równa
liczbie atomów zawartych w 12 gramach izotopu węgla
12
C (przy założeniu, że węgiel jest w
stanie niezwiązanym chemicznie, w spoczynku, a jego atomy nie znajdują się w stanie
wzbudzenia). W jednym molu znajduje się 6,02214179±0,00000030 · 10
23
cząstek. Liczba ta
jest nazywana stałą Avogadra. Mol jest szczególnie istotny dla pojęcia masy molowej, która
ma duże znaczenie praktyczne dla ilościowego doboru składników reakcji chemicznych.
5. Jaki jest związek pomiędzy molem a liczbą Avogadra?
W jednym molu znajduje się 6,02214179±0,00000030 · 10
23
cząstek. Liczba ta jest nazywana
stałą Avogadra.

6. Ile cząsteczek H2 znajduje się w dwóch molach wodoru?(w 2,2 g CO
2
)- przykładowe dane.
2.2*6,02*10^23=12,04*10^23
7. Jak brzmi prawo zachowania masy? Czy prawo to jest zachowane we wszystkich
przemianach?
Prawo zachowania masy, łączna masa produktów reakcji chemicznej jest równa łącznej
masie substratów tej reakcji w układzie zamkniętym. Pewna, zaniedbywalna w praktycznych
obliczeniach, nieścisłość tego prawa wynika ze zamiany części masy na energię (lub
odwrotnie) podczas reakcji chemicznej.
8. Podać stosunek masowy pierwiastków w następujących związkach(przykładowe związki).
a)
CaO –5:2
b)
H
2
O
2
–1:16
c)
CuSO
4
–2:1:2
d)
HNO
3
–1:14:48
9. Siarka z tlenem tworzy następujące związki: SO, SO
2
, SO
3
. Określić stosunek masowy
siarki a tlenu w tych związkach i sformułować prawo stosunków wielokrotnych.
Odp. SO (32:16), SO
2
(32:32). SO
3
(32:48).
Prawo stosunków wielokrotnych - Jeżeli dwa pierwiastki A i B tworzą ze sobą więcej niż
jeden związek, to masy pierwiastka A przypadające na taką samą masę pierwiastka B mają się
do siebie jak niewielkie liczby całkowite.
10. Z jakich cząstek elementarnych składa się atom? Które z nich wchodzą w skład jądra
atomowego?
Składa się z protonów, neutronów, elektronów. W skład jądra wchodzą protony i neutrony.
11. Co nazywamy liczbą masową atomu? W jakiej części atomu skupiona jest jego masa?
Liczba masowa (A) to wartość opisująca liczbę nukleonów (czyli protonów i neutronów) w
jądrze (w nuklidzie) danego izotopu atomu danego pierwiastka.
Jądro atomowe zajmując bardzo niewielką część objętości całego atomu skupia w sobie
praktycznie całą masę atomu.
12. Co określa liczba protonów znajdująca się w jądrze atomowym danego pierwiastka?
Liczba protonów w jądrze danego atomu to jego liczba atomowa, która z kolei jest podstawą
uporządkowania atomów w układzie okresowym pierwiastków.

13. Jak zapisujemy liczbę masową i atomową danego pierwiastka?
liczbę atomową Z i liczbę masową A.
Z = liczbie protonów = liczbie elektronów w obojętnym atomie
Z = p
+
= e
-
A = liczbie nukleonów (protonów i neutronów)
A = nukl = p
+
+ n
0
14. Ile protonów i ile elektronów mają następujące atomy i jony:
a)
K oraz K
+
b)
Cl oraz Cl
-
c)
Ca oraz Ca2
+
d)
Br oraz Br
-
15. Co nazywamy izotopami? Podać przykłady różnych izotopów.
Izotopy – odmiany pierwiastka chemicznego różniące się liczbą neutronów w jądrze atomu (z
definicji atomy tego samego pierwiastka mają tę samą liczbę protonów w jądrze). Izotopy
tego samego pierwiastka różnią się liczbą masową (łączną liczbą neutronów i protonów w
jądrze), ale mają tę samą liczbę atomową (liczbę protonów w jądrze).
16. Jaki charakter mają elektrony: korpuskularny czy falowy? Odpowiedź uzasadnić.
17. Jak brzmi reguła nieoznaczoności Heisenberga? Co nazywamy orbitalem? Ile elektronów
może maksymalnie pomieścić jeden orbital?
18. O czym mówi zakaz Pauliego? Objaśnić na przykładzie.
Zakaz Pauliego głosi, że w danym stanie kwantowym może znajdować się jeden fermion -
albo inaczej, że żadne dwa fermiony nie mogą w jednej chwili występować w dokładnie tym
samym stanie kwantowym.
19. Scharakteryzować poszczególne liczby kwantowe oraz wyjaśnić ich związek z orbitalami.
•
główna liczba kwantowa (n = 1,2,3...) kwantuje energię elektronu, a w praktyce
oznacza numer jego orbity,
•
poboczna liczba kwantowa (l = 0,1,...,n − 1) oznacza wartość bezwzględną orbitalnego
momentu pędu, którą obliczyć można używając relacji J
2
= l(l + 1)(h / 2π)
2
, gdzie h
jest stałą Plancka. W praktyce oznacza numer podpowłoki, na której znajduje się
elektron,
•
magnetyczna liczba kwantowa (m = − l,..., − 1,0,1,...,l) opisuje rzut orbitalnego
momentu pędu na wybraną oś. Długość tego rzutu oblicza się używając wzoru J
z
= mh
/ 2π,

•
spinowa liczba kwantowa s oznacza spin elektronu. Jest on stały dla danej cząstki
elementarnej i w przypadku elektronu wynosi 1/2. Ze względu na stałą wartość tej
liczby kwantowej jest ona niekiedy pomijana,
•
magnetyczna spinowa liczba kwantowa (m
s
= − s,s = 1 / 2, − 1 / 2) pokazuje, w którą
stronę skierowany jest spin, czyli wewnętrzny moment pędu danej cząstki
elementarnej (tu elektronu).
20. Podać konfigurację elektronową( orbitale +wzory klatkowe) następujących atomów: Na,
Mg, Al., Cl, Ar. Porównać konfiguracje elektronowe tych atomów z konfiguracjami
odpowiednich jonów: Na
-
, Mg
2+
, Al
3+
, Cl
-
.
21. Kto sformułował prawo „triad” oraz prawo „oktaw”? O czym mówią te prawa.
Prawo triad pierwiastków chemicznych zostało sformułowane przez J. W. Doebereinera.
Zauważył on, że: w kilku grupach zawierających po trzy pierwiastki, np.: wapń, stront, bar
lub chlor, brom, jod, właściwości fizyczne i chemiczne są podobne i zmieniają się regularnie
ze wzrostem masy atomowej.
Prawo oktaw pierwiastków chemicznych zostało sformułowane przez Johna Alexandera
Reina Newlandsa. Zauważył on, że: po uszeregowaniu wszystkich znanych pierwiastków
zgodnie z rosnącą masą atomową można stwierdzić podobieństwo co do ósmego z nich.
22. Kto jest twórcą układu okresowego pierwiastków? Na jakiej podstawie został ułożony
układ okresowy pierwiastków?
Prawdopodobnie pierwszą osobą, która zauważyła, że pierwiastki ułożone według rosnących
mas atomowych wykazują pewną regularność własności był niemiecki chemik Johann
Wolfgang Döbereiner.
23. Omówić prawo okresowości na dowolnym przykładzie.
24. Jak zmieniają się właściwości pierwiastków grup głównych wraz ze wzrostem ich masy
atomowej?
25. Na jakie bloki można podzielić układ okresowy pierwiastków? Czym różnią się atomy
poszczególnych bloków?
Można podzielić na bloki: s i p (grupy główne), d (grupy poboczne) oraz f (lantanowce i
aktynowce).
26. Co nazywamy potencjałem jonizacyjnym pierwiastka? Jak zmienia się potencjał
jonizacyjny pierwiastków w obrębie jednej grupy? Co rozumiemy przez „pierwszy” i „drugi”
potencjał jonizacji? Ile potencjałów jonizacji mogą wykazywać następujące pierwiastki: Na,
K, Mg, Ca, Al.?
Potencjał jonizacyjny (lub energia jonizacji) atomu lub cząsteczki - najmniejsza energia jaką
trzeba dostarczyć by oderwać elektron od atomu lub cząsteczki znajdującego się w stanie
podstawowym. Używa się określenia pierwszy, drugi, trzeci, n-ty potencjał jonizacyjny
oznacza wówczas energię oderwanie n-tego elektronu przy wcześniejszym oderwaniu n - 1
elektronów.

Pierwszym potencjałem jonizacyjnym nazywamy energię potrzebną do przemiany M -> M
+
,
drugim - do przemiany M
+
-> M
2+
, a trzecim - do przemiany M
2+
-> M
3+
.
Na – 2
K –
Mg – 3
Ca –
Al – 4
27. Jak zmieniają się objętości (rozmiary) atomów w okresach? Omówić na przykładzie.
28. Czy atomy pierwiastków mają taką samą objętość (rozmiar) jak ich jony? Podać
przykłady.
29. Co jest większe i dlaczego:
a)
Atom chloru czy jon chlorkowy
b)
Atom siarki czy jon siarczkowy
c)
Atom sodu czy jon sodowy
d)
Atom magnezu czy jon magnezowy
30. Jaka jest zależność pomiędzy miejscem pierwiastka w układzie okresowym a jego
aktywnością a właściwościami chemicznymi?
31. Co rozumiemy przez elektroujemność pierwiastka?
Elektroujemność to miara tendencji do przyciągania elektronów przez atomy danego
pierwiastka, gdy tworzy on związek chemiczny z atomami innego pierwiastka. Bardziej
elektroujemny pierwiastek "ściąga" do siebie elektrony tworzące wiązanie z atomem mniej
elektroujemnym, co prowadzi do polaryzacji wiązania. W skrajnym przypadku, gdy
elektroujemności obu pierwiastków bardzo się różnią (np. sód i chlor), dochodzi do pełnego
przeskoku elektronów na bardziej elektroujemny atom, co prowadzi do powstania wiązania
jonowego.
32. Jak zmienia się elektroujemność i aktywność pierwiastków w grupach a jak w okresach?
33. Korzystając z elektroujemności pierwiastków określić rodzaj wiązań chemicznych w
związkach: KCl, H
2
O, HCl.
34. Określić rodzaj wiązań w następujących substancjach, przedstawić odpowiednie wzory
kropkowe oraz kreskowe. W przypadku wiązań spolaryzowanych określić kierunkowość
wiązania.
a)
MgCl
2
b)
NaCl
c)
Cl
2
d)
O
2
e)
N
2
f)
CH
4
g)
C
2
H
4
(eten)
h)
C
2
H
2
(acetylen)
i)
HCl
j)
F
2
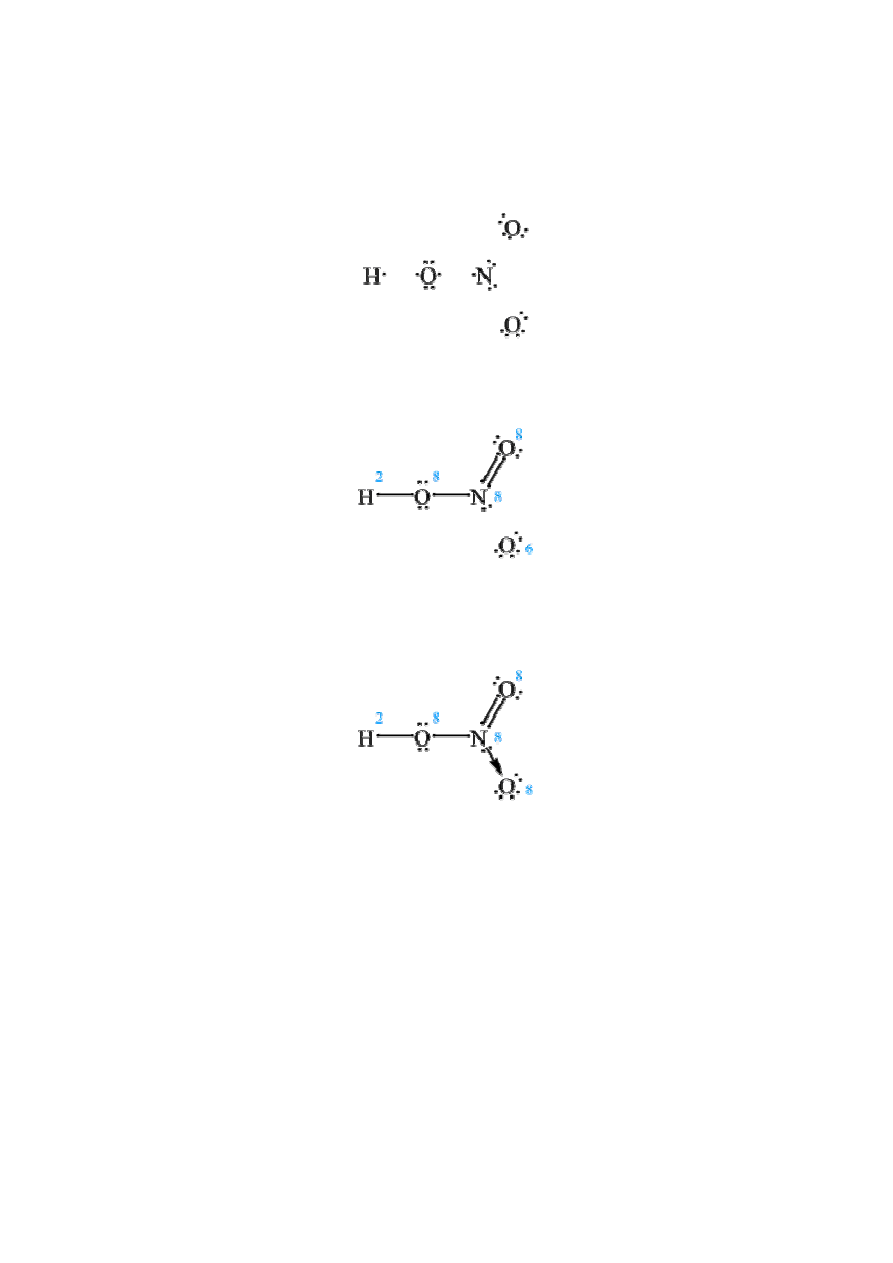
35. Na czym polega tworzenie wiązania koordynacyjnego? Podać przykład.
Rozpisujemy wszystkie atomy i ich elektrony:
Łączymy "luźne" elektrony kreskami i zliczamy ilość elektronów przy każdym atomie.
Pamiętać należy o powstałych parach elektronowych i regule oktetu.
Stąd wynika, że atom azotu, wodoru i dwa z trzech atomów tlenu są "zadowolone", bo
osiągnęły oktet, a wodór dublet. Co jednak z pozostałym atomem tlenu? Otóż jak to w
kwasach tlenowych często bywa przyłączają się on koordynacyjnie:
I teraz wszyscy są "zadowoleni". Możliwe, że ostatni wzór wymaga pewnego komentarza. Za
pomocą strzałki oznaczyliśmy wiązanie donorowo-akceptorowe, (czyli koordynacyjne).
Widać, że polega ono na powstawaniu wspólnej pary elektronowej, ale pochodzi ona od
jednego tylko atomu (donor). Przyjmuje tą parę drugi atom (akceptor), który zyskuje w ten
sposób oktet elektronowy.
36. Co nazywamy wiązaniem wodorowym? Podać przykład związku, w którym tego typu
wiązanie może występować. Jakie właściwości substancji są konsekwencją występowania
wiązania wodorowego?
Wiązanie wodorowe – rodzaj stosunkowo słabego wiązania chemicznego polegającego
głównie na przyciąganiu elektrostatycznym między atomem wodoru i atomem
elektroujemnym zawierającym wolne pary elektronowe.
Przykłady substancji, w których występują wiązania wodorowe: woda (ciecz, lód), kwasy
karboksylowe, KHF
2
, ciekły NH
3
, białka.

Obecność wiązań wodorowych modyfikuje własności fizykochemiczne substancji – wzrastają
np. temperatury topnienia i wrzenia, rośnie przenikalność elektryczna.
37. W której z poniższych substancji wiązanie jest najbardziej zbliżone do teoretycznego
wiązania jonowego: NaCl, CsF, KBr, NaI? Odpowiedź uzasadnić.
38. W którym związku wiązanie jest najbardziej\ najmniej spolaryzowane: HF. HI, HBr, HCl.
HF
39. Co rozumiemy przez wiązanie metaliczne?
Wiązanie metaliczne - ogólna nazwa dla wszelkich wiązań chemicznych występujących
bezpośrednio między atomami metali.
40.Wymienić znane sobie stopy metali. Jakie zastosowanie mają tego typu substancje?
Stop miedzi, żelaza, magnezu, rtęci, ołowiu. Metale i ich stopy mają zastosowanie w technice
począwszy od materiałów konstrukcyjnych do budowy maszyn a skończywszy na materiałach
dekoracyjnych.
41. Co nazywamy tlenkiem? W jakich grupach układu okresowego znajdują się metale,
których tlenki zaliczamy do zasadowych/kwasowych? Co rozumiemy przez tlenek
zasadowy/kwasowy?
Tlenki – nieorganiczne związki chemiczne, zbudowane z tlenu i dowolnego pierwiastka
chemicznego.
zasadowe: tlenki metali I i II grupy układu okresowego
kwasowe: tlenki niemetali
Tlenki zasadowe są tlenkami metali, co bynajmniej nie oznacza, że każdy tlenek metalu jest
zasadowy. Tlenki zasadowe, zwane również bezwodnikami zasadowymi, najczęściej reagują
z wodą tworząc wodorotlenki o charakterze zasadowym.
Tlenki kwasowe są na ogół tlenkami niemetali, chociaż spotyka się tlenki kwasowe wśród tzw.
wyższych tlenków metali, tzn. tlenków, w których metale wykazują wyższą wartościowość
(CrO
3
, Mn
2
O
7
). Tlenki kwasowe , zwane również bezwodnikami kwasowymi (bezwodnik
kwasowy jest tlenkiem, w którym wartościowość niemetalu odpowiada wartościowości tego
niemetalu w cząsteczce kwasu), najczęściej reagują z wodą tworząc kwasy tlenowe
42. Jakie związki nazywamy zasadami/kwasami według teorii Arrheniusa a jakie według
teorii Broensteda? Podać odpowiednie przykłady.
Teoria Arrheniusa: Jedna z teorii kwasów i zasad, postulująca, że kwasem jest związek który
dysocjuje się z wytworzeniem jonu wodorowego (H
+
) a zasadą związek, który dysocjuje z
wytworzeniem jonu hydroksylowego (OH
-
). Paradoksem tej teorii jest to, że woda, jest w jej
myśl jednocześnie kwasem i zasadą.
np kw.chlorowodorowy HCL + H
2
O → H
+
+ Cl
-
zasada sodowa NaOH + H
2
O → Na
+
+ OH
-

Brönsteda teoria kwasów i zasad, teoria sformułowana w 1923 w myśl, której kwasem jest
substancja mogąca oddawać protony, natomiast zasadą - substancja, która ma zdolność
przyłączania protonów.
43. Czy wszystkie kwasy i zasady ulegają w jednakowym stopniu reakcjom dysocjacji
elektrolitycznej? Na czym polega reakcja dysocjacji elektrolitycznej?
Dysocjacja elektrolityczna to proces rozpadu cząsteczek związków chemicznych na jony pod
wpływem rozpuszczalnika np.
NaHCO
3
→ Na
+
+ HCO
3
-
44. Co jest miarą mocy kwasów i zasad? Co to jest stopień dysocjacji i od czego zależy?
Miarą mocy kwasów i zasad jest dysocjacja.
Stopień dysocjacji to stosunek liczby moli cząsteczek danego związku chemicznego, które
uległy rozpadowi na jony do łącznej liczby cząsteczek tego związku, znajdującego się w
roztworze, fazie gazowej lub stopie, w którym zaszło zjawisko dysocjacji elektrolitycznej.
Stopień dysocjacji dotyczy słabych elektrolitów.
Stopień dysocjacji zależy od:
•
struktury związku, dla którego ten stopień jest ustalany
•
rodzaju rozpuszczalnika
•
obecności w roztworze innych związków zdolnych do dysocjacji
•
stężenia roztworu (na ogół wzrasta w miarę rozcieńczania roztworu)
•
temperatury (na ogół nieco wzrasta wraz ze wzrostem temperatury)
45. Co to jest stała dysocjacji i od czego zależy jej wartość? Napisać wzory na stałą dysocjacji
dla kwasu octowego oraz amoniaku(NH3*H2O)
Stała dysocjacji (obecnie często zwana po prostu stałą jonizacji) to stała równowagi reakcji
dysocjacji czyli rozpadu związków chemicznych na poszczególne jony, pod wpływem
rozpuszczalnika, lub pod wpływem np. działania silnego pola elektrycznego.
46. W jakim stopniu dysocjuje woda? Jakie wartości przyjmują stężenia jonów H
+
oraz OH
-
w
czystej wodzie?
47. Co oznacza pH? Jaka jest wartość pH dla czystej wody? W jaki sposób oblicza się pH?
Skala pH – ilościowa skala kwasowości i zasadowości roztworów wodnych związków
chemicznych. Skala ta jest oparta na aktywności jonów hydroniowych [H
3
O
+
] w roztworach
wodnych.
Czysta woda 7
Tradycyjnie pH definiuje się jako:
pH = -log
10
[H
3
O
+
]

48. Objaśnić skale pH. Jakie wartości może przyjmować pH dla roztworów kwaśnych,
obojętnych i zasadowych?
Kwaśne 0:6
Obojętne 7
Zasadowe 8:14
49. Obliczyć pH roztworu kwasu solnego o stężeniu 0.001 mol/dm3.
50. Obliczyć pH roztworu kwasu siarkowego o stężeniu 10-4 mol/dm3.
51. Co nazywamy roztworem? Czy roztwory występują tylko w stanie ciekłym?
Roztwór to nierozdzielająca się w długich okresach czasu mieszanina dwóch lub więcej
związków chemicznych.
52. Każdy roztwór składa się z substancji rozpuszczonej i rozpuszczalnika. Co nazywamy
rozpuszczalnikiem a co substancją rozpuszczoną?
Rozpuszczalnik to ciecz zdolna do tworzenia roztworu po zmieszaniu z ciałem stałym, inną
cieczą lub gazem. Najbardziej znanym rozpuszczalnikiem jest woda.
Substancja rozpuszczona: substancja, która została rozpuszczona w rozpuszczalniku z
utworzeniem roztworu.
53. Wyjaśnić różnicę pomiędzy: roztworem właściwym, układem koloidalnym a zawiesiną.
Podać przykład każdego z układów.
Roztwór właściwy - zwany też roztworem rzeczywistym to układ, w którym cząstki substancji
rozproszonej mają rozmiary mniejsze od 1 nm (nanometr- 10
-9
m)
Zawiesina - układ niejednorodny w postaci cząstek jednego ciała rozproszonych w drugim
ciele, np. cząstek ciała stałego w gazie lub cząstek cieczy w cieczy. Przykładami zawiesiny
są: zupa, błoto, woda w jeziorze czy sok Kubuś.
Układ koloidalny (koloid, układ koloidowy, roztwór koloidalny) – niejednorodna mieszanina,
zwykle dwufazowa, tworząca układ dwóch substancji, w którym jedna z substancji jest
rozproszona w drugiej. Przykłady: powietrze, mgła, dym, mleko.
54. Na czym polega solwatacja i hydratacja?
Solwatacja to proces otaczania cząsteczek rozpuszczanego związku chemicznego przez
cząsteczki rozpuszczalnika.
Hydratacja, uwodnienie – ogół procesów chemicznych lub fizycznych, w których związkiem
chemicznym przyłączanym do innej substancji jest woda, przy czym woda ta jest przyłączana
w całości (nie powstają dodatkowo produkty uboczne). Procesy hydratacji są szczególną
postacią procesów solwatacji.

55. Co nazywamy roztworem nasyconym a co roztworem przesyconym? Jak się otrzymuje
tego typu układy?
Roztwór nasycony to roztwór, który w określonych warunkach termodynamicznych
(ciśnienie, temperatura) nie zmienia swego stężenia w kontakcie z substancją rozpuszczoną.
W praktyce oznacza to, że bez zmian warunków termodynamicznych z roztworu nasyconego
nie wytrąca się żaden osad, ale nie można też w nim rozpuścić już więcej substancji.
Ciekły roztwór nasycony uzyskuje się w laboratoriach zazwyczaj poprzez stopniowe
dodawanie rozpuszczanej substancji aż do momentu, gdy jej kolejna porcja już się nie
rozpuści. Roztwór nasycony można też otrzymywać przez zmianę warunków
termodynamicznych (np. obniżanie temperatury aż do momentu zaobserwowania początków
wypadania osadu) lub poprzez powolne odparowywanie rozpuszczalnika.
Roztwór przesycony to roztwór o stężeniu większym od stężenia roztworu nasyconego w
danej temperaturze. Roztwory przesycone są przykładami substancji w stanie
termodynamicznym niestabilnym metatrwałym.
Roztwór przesycony można otrzymać przez uzyskanie roztworu nasyconego w temperaturze
wyższej, pozbawienie go pozostałej stałej substancji rozpuszczanej (ażeby nie było zarodów
krystalizacji), a następnie ostrożne oziębianie tego roztworu. Roztwór przesycony jest
termodynamicznie nietrwały. Wprowadzenie zaburzenia (np. wstrząs, kurz) może
spowodować krystalizację nadmiaru substancji rozpuszczonej.
56. Co rozumiemy przez rozpuszczalność substancji?
Rozpuszczalność - ilość związku chemicznego, która tworzy roztwór nasycony w 100 g
rozpuszczalnika w określonej temperaturze i ciśnieniu. Rozpuszczalność określa się w tych
samych jednostkach jak stężenie, podając dodatkowo warunki, dla jakich została ona ustalona
(zwykle są to tzw. warunki normalne). Mówiąc inaczej, rozpuszczalność określa jak dużo
danego składnika można rozpuścić w danym rozpuszczalniku w sprecyzowanych warunkach.
57. Jakie cechy charakteryzują układy koloidalne?
Do swoistych cech układów koloidalnych należą: wysokie wartości współczynników dyfuzji
cząstek koloidalnych, podwyższona lepkość, rozpraszanie światła oraz wykonywanie ruchów
Browna przez cząstki koloidalne.
58. W jaki sposób otrzymuje się układy koloidalne? Podać przykład.
59. Wymienić znane sobie typy układów koloidalnych w zależności od ośrodka
rozpraszającego i fazy rozproszonej. Podać przykłady odpowiednich układów.
60. Jakie znamy rodzaje układów koloidalnych? Czym one się charakteryzują, jak są
zbudowane (micela)? (koloidy hydrofobowe i hydrofilowe)
Wyróżnia się następujące rodzaje układów koloidalnych:
•
gaz, w którym rozproszona jest ciecz – emulsja, aerozol, np. mgła
•
gaz, w którym rozproszone jest ciało stałe – aerozol, np. dym
•
ciecz, w której rozproszony jest gaz – piana
•
ciecz, w której rozproszona jest ciecz – emulsja, np. majonez

•
ciecz, w której rozproszone jest ciało stałe – zol, zawiesina koloidalna (suspensja),
roztwór koloidalny
•
ciało stałe, w którym rozproszony jest gaz – piana stała – np. pumeks, styropian
•
ciało stałe, w którym rozproszona jest ciecz – emulsja stała, np. opal
•
ciało stałe, w którym rozproszone jest ciało stałe – zol stały
•
ciało stałe i ciecz przenikające się wzajemnie – żel
61. Na czym polega koagulacja koloidów hydrofilowych/hydrofobowych? Jakie metody
koagulacji stosuje się w zależności od rodzaju koloidu? Od czego zależy zdolność
koagulacyjna elektrolitów?
62. Jakie procesy nazywamy procesami redoks?
Reakcja redoks - to każda reakcja chemiczna, w której dochodzi zarówno do redukcji jak i
utleniania.
63. Jaki jest stopień utleniania poszczególnych pierwiastków w następujących związkach:
H
2
SO
4
, H
2
SO
3
, HNO
3
, H
2
O
2
, KmnO
4
?
64. Co nazywamy utleniaczem a co reduktorem? Podać przykłady.
Utleniacz to pierwiastek lub związek chemiczny, będący w analizowanej reakcji redoks
akceptorem (przyjmującym) elektrony. Utleniacze w reakcjach zmniejszają swój stopień
utlenienia i jednocześnie powodują jego wzrost w pozostałych produktach reakcji. Znane i
często stosowane utleniacze to: kwas siarkowy, kwas azotowy, nadmanganiany, chlorany,
azotany, woda królewska. Przykładowe substancje działające zazwyczaj jako utleniacze, lecz
wykazujące także właściwości redukujące to chlorowce (poza fluorem) i nadtlenek wodoru.
Reduktor - pierwiastek lub związek chemiczny będący w analizowanej reakcji redoks
donorem (dostarczycielem) elektronów. Reduktory w reakcjach zwiększają swój stopień
utlenienia i jednocześnie powodują jego zmniejszenie w pozostałych produktach reakcji.
Silnymi reduktorami są metale alkaliczne (sód, magnez, cynk i inne), wodór i wodorki metali
alkalicznych (wodorek sodu, wodorek litowo-glinowy).
65. Na podstawie bilansu elektronowego dobrać współczynniki w następujących równaniach
redoks, wskazać utleniacz i reduktor, określić stopnie utlenienia odpowiednich pierwistków.
a)
MnO
2
+ 4HCl = MnCl
2
+ Cl
2
+ 2H2O
b)
H
2
O
2
+ 2KI + H
2
SO
4
= I
2
+ K
2
SO
4
+ 2H
2
O
c)
4NH
3
+ 5O
2
= 4NO + 6H
2
O
d)
2ZnS + 3O
2
= 2ZnO + 2SO
2
66. Co to są reakcje hydrolizy? Jakie związki chemiczne ulegają hydrolizie?
Hydroliza - reakcja chemiczna polegająca na rozpadzie cząsteczek związku chemicznego na
dwa lub więcej mniejszych fragmentów w reakcji z wodą lub parą wodną. W przypadku soli
jonowych przez hydrolizę rozumie się zbiór wtórnych reakcji jonów powstałych w wyniku
solwolizy tej soli, które niekiedy prowadzą do zmiany pH środowiska.

67. Na czym polega hydroliza anionowa/kationowa? Podać przykłady.
a)hydroliza anionowa: ulegają jej sole mocnych zasad i słabych kwasów.
Hydrolizie ulegają aniony soli wg równania ogólnego
A-+ H
2
O==HA + OH-
znak = oznacza ze reakcja jest odwracalna
b)hydroliza kationowa: ulegają jej sole mocnych kwasów i słabych zasad
68. Jaki odczyn posiadają wodne roztwory następujących soli i dlaczego (podać odpowiednie
równania dla soli ulegających hydrolizie):
a)
Na
2
CO
3
b)
Na
3
PO
4
c)
KNO
2
d)
CH
3
COOK
e)
AlCl
3
f)
NaNO
3
g)
CH
3
COONH
4
h)
NaCl
69. Co rozumiemy przez szybkość reakcji chemicznej? Jakie czynniki wpływają na szybkość
reakcji chemicznych?
Szybkość reakcji chemicznej wyraża szybkość przybywania lub ubywania składnika w
wyniku przebiegu reakcji chemicznej.
Najważniejszymi czynnikami decydującymi o szybkości reakcji chemicznej są: rodzaj i
stężenie reagujących substancji lub ciśnienie gazów /jeżeli reakcja przebiega w fazie
gazowej/, temperatura, obecność katalizatorów, wpływ promieniowania itp.
70. Przedstawić diagram energetyczny reakcji egzo- oraz endotermicznej. Wskazać energię
aktywacji. Co to jest energia aktywacji i o czym decyduje?
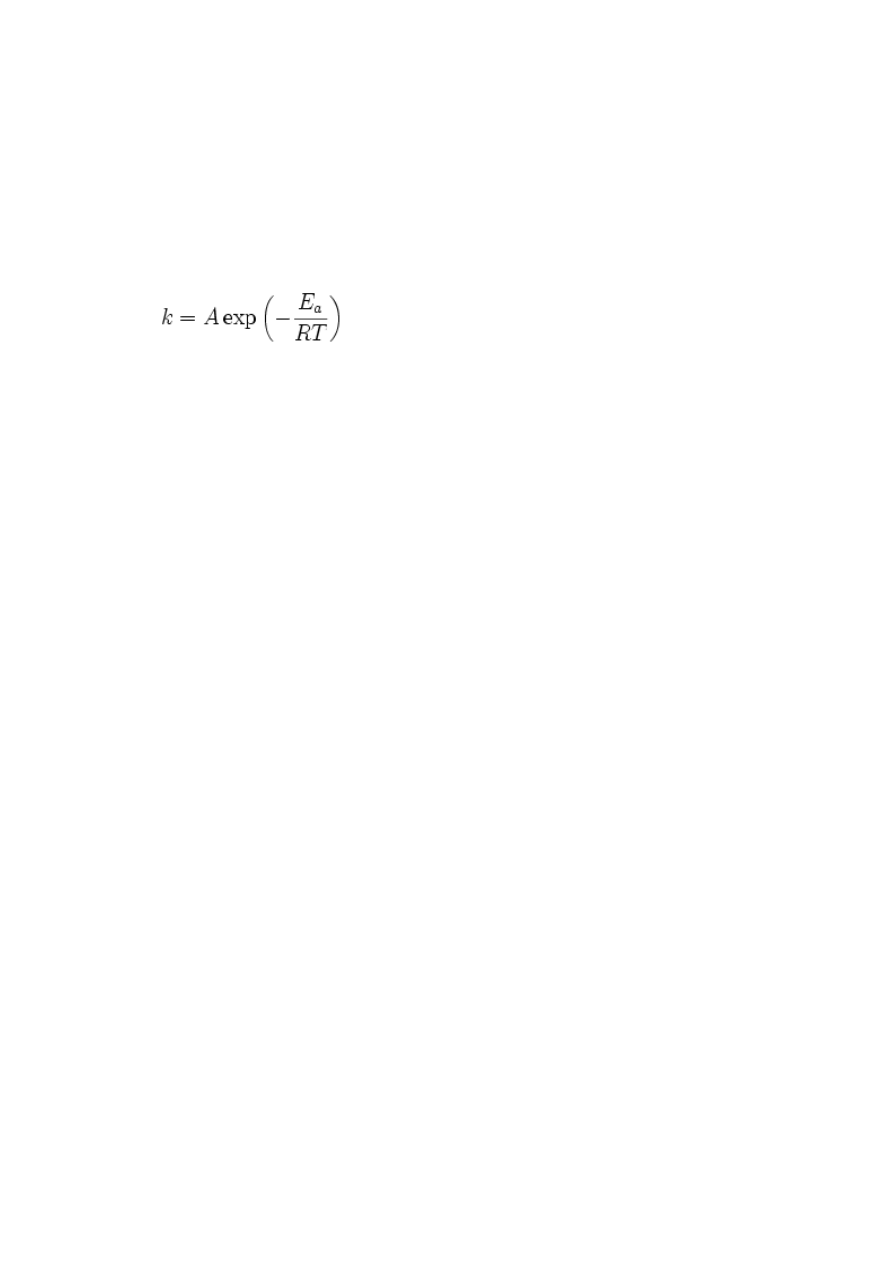
Energia aktywacji jest - podawaną często w przeliczeniu na 1 mol substancji - wielkością
bariery energetycznej (w skali mikroskopowej - bariera potencjału), którą musi pokonać układ
reagujących indywiduów chemicznych, aby doszło do reakcji chemicznej.
71. W jaki sposób szybkość reakcji chemicznej zależy od temperatury? Podać odpowiednie
zależności matematyczne (równanie Arheniusa).
Równanie Arrheniusa, podane przez szwedzkiego chemika Svantego Arrheniusa, wiąże ze
sobą stałą szybkości reakcji z energią aktywacji i temperaturą, w której reakcja zachodzi:
gdzie:
•
k - stała szybkości reakcji
•
A - stała dla danej reakcji, zwana też czynnikiem przedwykładniczym
•
E
a
- energia aktywacji
•
R - (uniwersalna) stała gazowa
•
T - temperatura
72. Co nazywamy katalizatorem? Na czym polega działanie katalizatorów? Podać przykład
reakcji katalitycznej.
Katalizator to substancja chemiczna, która dodana do układu przyspiesza reakcję chemiczną
nie zużywając się samemu.
Katalizator nie ulega trwałej przemianie chemicznej w wyniku reakcji. Nie znaczy to jednak,
ż
e w niej nie uczestniczy. Katalizator wpływa na przebieg reakcji zmieniając jej mechanizm.
Jego działanie opiera się na powstawaniu w reakcji z substratem przejściowego związku
chemicznego lub struktury nadcząsteczkowej, która jest nietrwała, dzięki czemu reaguje dalej
z wytworzeniem produktu końcowego i odtworzeniem wyjściowego katalizatora:
Reakcja bez katalizatora:
A + B → AB
Reakcja z katalizatorem:
A + K → AK (produkt przejściowy)
AK + B → AB + K (produkt końcowy + odtworzony katalizator)
73. Co rozumiemy przez katalizę homogeniczną a co przez katalizę heterogeniczną? Podać
przykład takich reakcji.
Kataliza homogeniczna – katalizator występuje w tej samej fazie co substraty (ma
przyspieszać proces).
Kataliza heterogeniczna – katalizator występuje w innej fazie niż substraty.
74.szereg elektrochemiczny :
Szereg napięciowy metali (inaczej szereg elektrochemiczny, szereg aktywności metali) to
zestawienie pierwiastków chemicznych o własnościach metalicznych, według ich potencjału
standardowego E0. Punktem odniesienia dla tego zestawienia jest elektroda wodorowa, której
potencjał standardowy przyjmuje się umownie za zero.
Szereg ważniejszych metali uporządkowany w kierunku wzrostu potencjału i zarazem spadku
aktywności do tworzenia kationów:
Li K Na Ca Mg Al Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Ag Hg Pt Au
75 / 76. metale wypierające i nie wypierające wodoru wodór .:
Metale o ujemnych potencjałach normalnych mogą wypierać wodór. Metale te są metalami
aktywnymi, nazywane czasami nieszlachetnymi.
Reakcja przebiega tym mniej energicznie, im bliższy zera jest potencjał normalny metali.
Metale o dodatnich potencjałach normalnych nie wypierają wodoru z kwasów.
Metale te nazywane są metalami szlachetnymi. Metale szlachetne reagują z kwasami
tlenowymi z wykorzystaniem ich właściwości utleniających.
77. zadania
78.Zastosowanie szeregu – ochrona metali przed korozją
79.ogniwo galwaniczne , daniella
Ogniwo galwaniczne – ogniwo, w którym źródłem prądu są reakcje chemiczne zachodzące
między elektrodą, a elektrolitem. Dwie elektrody zanurzone w elektrolicie (półogniwa)
tworzą ogniwo galwaniczne. Różnica potencjałów elektrod gdy przez ogniwo nie płynie prąd
jest równa sile elektromotorycznej ogniwa (SEM).
Ogniwo Daniella - ogniwo galwaniczne, w którym pierwsze półogniwo stanowi elektroda
cynkowa zanurzona w roztworze siarczanu cynku ZnSO4, a drugie elektroda miedziowa
zanurzona w roztworze siarczanu miedzi CuSO4. W ogniwie tym oba półogniwa nie stykają
się ze sobą bezpośrednio lecz są połączone kluczem elektrolitycznym, najczęściej
wykonanym z roztworu chlorku potasu (KCl) w agar-agarze. Klucz elektrolityczny
uniemożliwia mieszanie się roztworów elektrolitów oraz zapobiega gromadzeniu się
nadmiaru ładunku ujemnego bądź dodatniego w zalezności czy rozpatrujemy anodę czy
katodę.
80. Siła elektromotoryczna (SEM) – czynnik powodujący przepływ prądu w obwodzie
elektrycznym [1] równy energii elektrycznej uzyskanej przez jednostkowy ładunek
przemieszczany w urządzeniu (źródle) prądu elektrycznego w przeciwnym kierunku do sił
pola elektrycznego oddziałującego na ten ładunek.Siła elektromotoryczna źródła jest
zdefiniowana jako iloraz pracy wykonanej przez źródło do wartości przenoszonego ładunku.
gdzie:
•
- siła elektromotoryczna,
•
W - praca,
•
q - przepływający ładunek.
Jednostką siły elektromotorycznej jest
dżul
na
kulomb
równy
voltowi
.

81. Potencjał standardowy, standardowy potencjał półogniwa, E° –
siła
elektromotoryczna
ogniwa
zbudowanego z ogniwa badanego, zawierającego
jony
o
jednostkowej aktywności, oraz
elektrody wodorowej
, której potencjał przyjmuje się za równy
0 we wszystkich temperaturach, aby było możliwe określenie potencjału badanej elektrody
(lewa strona na schematach). Jeśli badana elektroda jest
anodą
, to jej potencjał jest ujemny,
jeśli natomiast jest
katodą
to jej potencjał jest dodatni. Potencjał standardowy rozumiany jest
również jako wkład elektrody do standardowej siły elektromotorycznej ogniwa.
W
ogniwie galwanicznym
siła elektromotoryczna ogniwa jest różnicą standardowych
potencjałów elektrod, obliczaną ze wzoru:
Gdzie:
•
E° - potencjał ogniwa
•
E°
katoda
- potencjał katody
•
E°
anoda
- potencjał anody
82. Równanie Nernsta - podstawowa zależność elektrochemiczna wyrażająca równowagowy
potencjał elektrody (E) względem jej potencjału standardowego (E
0
) i stężenia substancji
biorących udział w procesie elektodowym.
Ogólna postać równania:
83. zadanie
84. Elektroliza — całokształt procesów zachodzących na elektrolizerze w wyniku przepływu
prądu elektrycznego przez elektrolit.
Elektroliza zachodzi w układach, w których już przed przyłożeniem do elektrod napięcia
występowały wolne jony, a zatem w elektrolitach. Związek chemiczny może stać się
elektrolitem na skutek dysocjacji elektrolitycznej wywołanej przez rozpuszczalnik, na skutek
domieszkowania jonami lub odpowiednio wysokiej temperatury.
Prawa elektrolizy Faradaya to dwa prawa sformułowane przez
Faradaya
w
1834
r.:
1.
Masa substancji wydzielonej podczas elektrolizy jest proporcjonalna do ładunku, który
przepłynął przez elektrolit
2.
. Ładunek Q potrzebny do wydzielenia lub wchłonięcia masy m jest dany zależnością
gdzie:
F - stała Faradaya (w kulombach/mol)
z - ładunek jonu (bezwymiarowe)
M - masa molowa jonu (w kilogram/mol).
Inne, częściej spotykane sformułowanie drugiego prawa elektrolizy Faradaya brzmi:
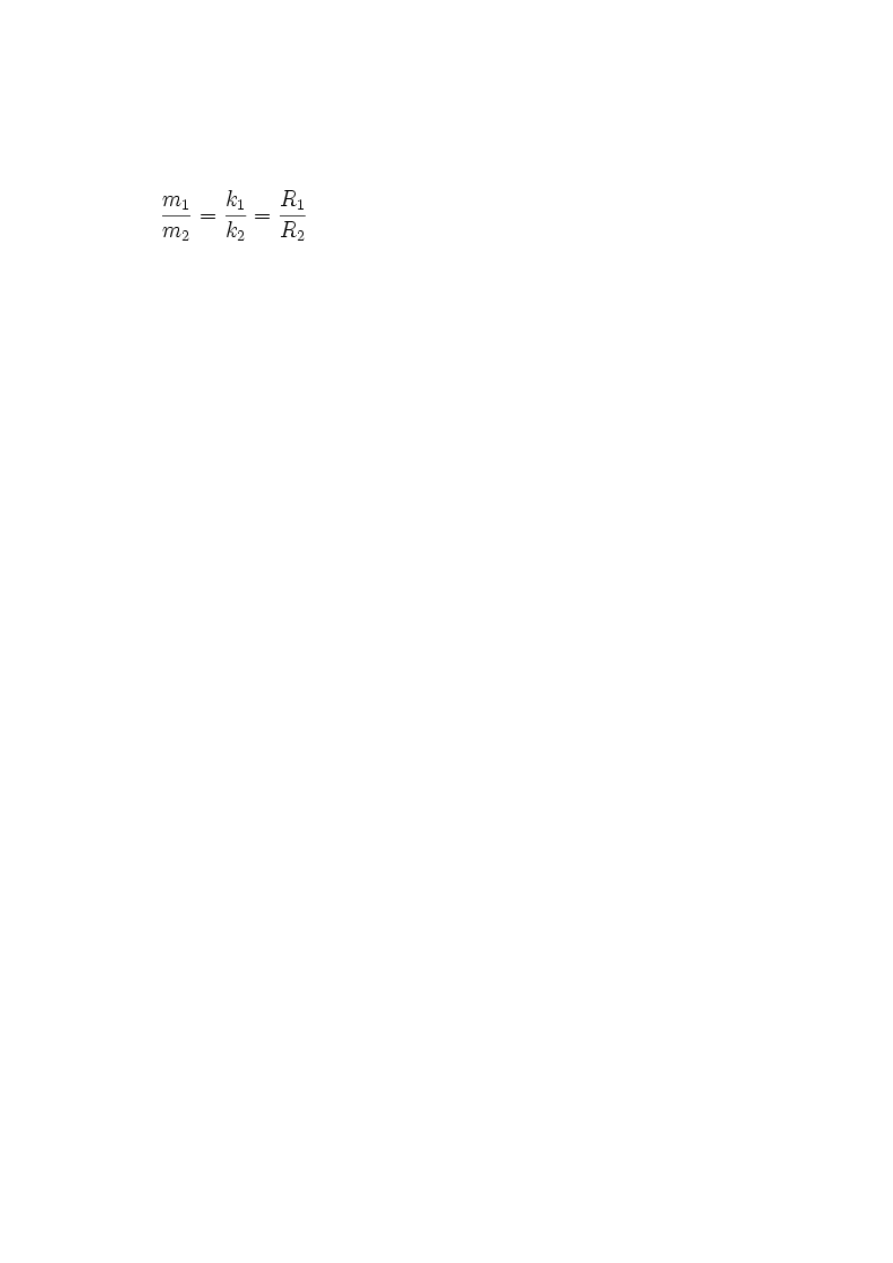
Stosunek mas m
1
oraz m
2
substancji wydzielonych na elektrodach podczas przepływu
jednakowych ładunków elektrycznych jest równy stosunkowi ich równoważników
elektrochemicznych k
1
oraz k
2
i stosunkowi ich mas równoważnikowych R
1
oraz R
2
, czyli:
87. Elektroliza stopionych bezwodnych elektrolitów przebiega podobnie jak w roztworach.
Jony, które w stałym elektrolicie są uporządkowane w sieciach krystalicznych, po stopieniu
poruszają się chaotycznie we wszystkich kierunkach, podobnie jak w roztworze. Po
połączeniu elektrod ze źródłem prądu ruch jonów staje się uporządkowany. Kationy wędrują
do katody, a aniony - do anody.
Elektrolizę stopionych soli stosuje się głównie wówczas, gdy nie można przeprowadzić
elektrolizy wodnych roztworów tych soli, gdyż produkty po wydzieleniu reagują z wodą, albo
też gdy rudy wykorzystywane do elektrolitycznego otrzymywania metali są w wodzie trudno
rozpuszczalne (np. Al2O3). Pierwszą elektrolizę wydzieleniem glinu przeprowadzono w
1886r. Była to elektroliza Al2O3 rozpuszczonego w stopionym Na3AlF6 Równocześnie
stwierdzo że niemożliwe jest przeprowadzenie elektrolizy czystego tlenku glinu, ze względu
na jego wysoką temperaturę topnienia (ok. 1000 C). Temperatura topnienia Na3AlF6 wynosi
również około 1000C ale może być obniżona poprzez dodanie CaF2 R
89. Korozja - ogólna nazwa procesów niszczących mikrostrukturę materiału, które prowadzą
do jego rozpadu. Korozja zachodzi pod wpływem chemicznej i elektrochemicznej reakcji
materiału z otaczającym środowiskiem.
Korozja rozpoczyna się zwykle drobnymi zmianami zaatakowanej powierzchni
występującymi najczęściej w miejscach zagięcia materiału, a następnie postępuje w głąb,
niszcząc substancje najbardziej podatne na korozję. Produkty korozji tworzą czasami warstwę
pasywną chroniącą przed dalszym rozkładem, w innych zaś przypadkach mogą być kolejnym
czynnikiem powodującym korozję.
Czynniki wpływające na proces korozji:
•
obecność zanieczyszczeń
•
odczyn środowiska
•
zmiany temperatury i ciśnienia
•
naprężenie materiału
•
struktura krystaliczna materiału
90. Korozja elektrochemiczna- jest to korozja spowodowana działaniem substancji
chemicznych, gdy reakcjom chemicznym towarzyszy przepływ prądu, np. reakcja metalu z
elektrolitem. Najczęściej występuje w przypadku, gdy metal (żelazo, cynk) jest narażony na
kontakt z elektrolitami w obecności pierwiastków o większym potencjale standardowym. W
takiej sytuacji powstaje ogniwo galwaniczne, w którym pierwiastek bardziej szlachetny (o
większym potencjale standardowym) jest katodą, a metal mniej szlachetny anodą. Za katodę
najczęściej robią domieszki innych metali, jak również ziarenka grafitu. W miarę
rozpuszczania się metalu coraz więcej domieszek zagęszcza się na powierzchni, liczba
mikroogniw wzrasta i proces korozji przybiera na sile.

91. Ochrona metali przed korozją
W celu ochrony metali przed korozją stosuje się:
* powłoki metaliczne i niemetaliczne
* ochronę katodową
* inhibitor korozji
92. Pasywacja - proces, w którym substancja aktywna chemicznie w danym środowisku
wytwarza na swojej powierzchni powłokę pasywną, utworzoną z produktów reakcji
chemicznej tej substancji z otoczeniem. O pasywacji mowa jest wtedy, gdy powłoka ta jest
całkowicie odporna na dalsze reakcje z tym środowiskiem i jednocześnie na tyle szczelna, że
stanowi barierę ochronną dla reszty substancji, którą otacza. Proces pasywacji odnosi się
zasadniczo do metali. Może być procesem naturalnym, wynikającym z właściwości metalu w
danym środowisku lub też może być procesem sztucznie wywołanym przez człowieka. Nie
wszystkie metale ulegają naturalnej pasywacji, a ponadto pasywacja ta przebiega odmiennie
dla różnych środowisk.
95. Typowe układy termodynamiczne to np. wnętrze silnika, naczynie z gazem lub cieczą, w
którym zachodzi jakaś interesująca przemiana, lub np. obszar całej elektrowni, dla którego
musimy obliczyć przepływy ciepła.
Dzięki ograniczeniu danego zjawiska do układu można osobno rozpatrywać procesy
wewnątrz układu i procesy wymiany energii między układem i otoczeniem, o którym dzięki
temu nic nie musimy wiedzieć.
Układy termodynamiczne dzieli się na:
•
otwarte - wymienia z otoczeniem energię i masę,
•
zamknięte - wymienia z otoczeniem energię, nie wymienia masy,
•
izolowane - nie wymienia z otoczeniem ani energii ani masy.
96. Reakcja egzotermiczna to reakcja chemiczna, która ma dodatni bilans wymiany ciepła z
otoczeniem. Można też powiedzieć, że jest to reakcja, w której ciepło znajduje się po stronie
produktów, albo inaczej która emituje ciepło.
Reakcja endotermiczna to reakcja chemiczna, która posiada ujemny bilans wymiany ciepła z
otoczeniem. Można też powiedzieć, że jest to reakcja w której ciepło znajduje się po stronie
substratów, albo inaczej która pochłania ciepło z otoczenia.
97. Entalpia H (zawartość ciepła) - w termodynamice i chemii wielkość fizyczna będąca
funkcją stanu mająca wymiar energii, będąca też potencjałem termodynamicznym, oznaczana
przez H, 'h',I lub χ, którą definiuje zależność:
gdzie:

•
H- entalpia układu
•
U - energia wewnętrzna układu
•
p - ciśnienie
•
V - objętość.
Z powyższego wzoru wynika sens fizyczny entalpii. Entalpia jest równa sumie energii
wewnętrznej, czyli energii jaka jest potrzebna do utworzenia układu gdy jest on tworzony w
otoczeniu próżni oraz iloczynu pV, który jest równy pracy jaką należy wykonać nad
otoczeniem by w danych warunkach uzyskać miejsce na układ.
98. Funkcja stanu to w termodynamice funkcja zależna wyłącznie od stanu układu, czyli od
aktualnych wartości jego parametrów, takich jak masa, liczność materii, temperatura,
ciśnienie, objętość i inne.
W praktyce stosuje się zwykle następujące funkcje stanu:
1.
objętość właściwa, (v),
2.
energia wewnętrzna (U),
3.
entropia (S),
4.
energia swobodna F = U - TS,
5.
entalpia H = U + pV,
6.
entalpia swobodna G = U - TS + pV,
7.
egzergia, (b),
8.
wielki potencjał kanoniczny Ω = F − µN
9.
potencjał chemiczny
10.
stężenie molowe dla reakcji chemicznych
11.
aktywność molowa.
Funkcje stanu są najczęściej wielkościami konceptualnymi, tj. takimi których nie możemy
bezpośrednio zmierzyć i dla których określenia konieczna jest pewna procedura zawierająca
różne założenia i konwencje.
99. Pierwsza zasada termodynamiki - jedno z podstawowych praw termodynamiki, jest
sformułowaniem zasady zachowania energii dla układów termodynamicznych. Zasada
stanowi podsumowanie równoważności ciepła i pracy oraz stałości energii układu
izolowanego
[1]
.
Dla układu zamkniętego zasadę można sformułować w postaci:
Zmiana energii wewnętrznej układu zamkniętego jest równa energii, która przepływa przez
jego granice na sposób ciepła lub pracy.
[1]
Gdzie:
∆
U - zmiana energii wewnętrznej układu,
q - energia przekazana do układu jako ciepło,
w - praca wykonana na układzie.
Druga zasada termodynamiki stwierdza, że w układzie termodynamicznie izolowanym,
istnieje funkcja stanu, zwana entropią S, której zmiana ∆S w procesie adiabatycznym spełnia

nierówność
, przy czym równość zachodzi wtedy i tylko wtedy, gdy proces jest
odwracalny.
W uproszczeniu można to wyrazić też tak:
"W układzie termodynamicznie izolowanym w dowolnym procesie entropia nigdy nie
maleje"
100. Proces samorzutny w termodynamice nazywany też czasem naturalnym to proces, który
można zrealizować bez konieczności wykonywania pracy nad układem. Procesom
samorzutnym towarzyszy zawsze zwiększenie entropii. Procesy w których entropia się
zmniejsza nigdy nie są samorzutne. Wynikiem procesu samorzutnego jest zawsze wykonanie
przez układ pewnej pracy. Procesy niesamorzutne nie mogą wykonać pracy - wręcz
przeciwnie do ich zajścia potrzebne jest wykonanie na nich pewnej pracy.
To że proces jest samorzutny nie oznacza, że zawsze musi zajść. Większość procesów
samorzutnych musi najpierw pokonać, wynikający z ich przebiegu kinetycznego barierę
potencjału energetycznego. Procesy te wymagają więc do zajścia impulsu energetycznego, ale
impuls ten jest zawsze mniejszy niż energia wyzwalana na skutek zajścia procesu, na skutek
czego bilans pracy procesu jest dodatni. Można więc powiedzieć, że samorzutność procesu
jest termodynamicznym wyrazem tendencji do jego zajścia nie zaś absolutną koniecznością
jego zajścia.
Entropia – termodynamiczna funkcja stanu, określająca kierunek przebiegu procesów
spontanicznych (samorzutnych) w odosobnionym układzie termodynamicznym. Jest
wielkością ekstensywną
[1]
. Zgodnie z drugą zasadą termodynamiki, jeżeli układ
termodynamiczny przechodzi od jednego stanu równowagi do drugiego, bez udziału
czynników zewnętrznych (a więc spontanicznie), to jego entropia zawsze rośnie. Pojęcie
entropii wprowadził niemiecki uczony Rudolf Clausius.
102. Termochemia - dział chemii zajmujący się efektami energetycznymi (cieplnymi) reakcji
chemicznych, ich zależnością od warunków fizycznych oraz wymianą energii pomiędzy
układem i otoczeniem.
103. Molowa entalpia przemiany zależy jedynie od stanu początkowego i końcowego
reagującego układu, a nie zależy od drogi przemiany a to oznacza, że entalpia reakcji
sumarycznej może być sumą entalpii etapów, na które tę reakcję można podzielić.
104. Prawo Hessa, zwane też prawem stałej sumy ciepeł, sformułowane w 1840 r. przez
Germana Henri Hessa mówi, że:
Ciepło reakcji chemicznej przebiegającej w stałej objętości lub pod stałym ciśnieniem nie
zależy od tego jaką drogą przebiega reakcja, a jedynie od stanu początkowego i końcowego.
Oznacza to, że ciepło reakcji nie zależy od tego, czy produkty otrzymano z substratów
bezpośrednio czy poprzez dowolne etapy pośrednie. Jeżeli w trakcie reakcji nie występuje
praca użyteczna, wówczas ciepło przemiany będzie zależało jedynie do stanu początkowego i
końcowego.

108.
•
surowce energetyczne to paliwa kopalne: węgiel kamienny i brunatny, torf, ropa
naftowa, gaz ziemny, drewno w procesie spalania zamieniane na energię mechaniczną pary
lub elektryczność
Węgiel kamienny – skała osadowa pochodzenia roślinnego, zawierająca 75-97% pierwiastka
węgla, powstała głównie w karbonie (era paleozoiczna) ze szczątków roślinnych, które bez
dostępu tlenu uległy uwęgleniu. Ma czarną barwę, matowy połysk, czarną rysę.
Węgiel brunatny to skała osadowa pochodzenia organicznego roślinnego powstała w
trzeciorzędzie w erze kenozoicznej ze szczątków roślin obumarłych bez dostępu powietrza.
Zawartość węgla 62-75%. Często stosowany jako paliwo. Jego wartość opałowa waha się od
7,5 do 21 MJ/kg. Węgiel brunatny jest nieodnawialnym źródłem energii.
Ropa naftowa (olej skalny, czarne złoto) – ciekła kopalina, złożona z mieszaniny naturalnych
węglowodorów gazowych, ciekłych i stałych (bituminów), z niewielkimi domieszkami azotu,
tlenu, siarki i zanieczyszczeń. Posiada podstawowe znaczenie dla gospodarki światowej jako
surowiec przemysłu chemicznego, a przede wszystkim jako jeden z najważniejszych
surowców energetycznych.
Antracyt - skała osadowa lub/i metamorficzna, organogeniczna, stanowiąca odmianę węgla
kopalnego.
Gaz ziemny – paliwo kopalne pochodzenia organicznego, gaz zbierający się w skorupie
ziemskiej w pokładach wypełniających przestrzenie, niekiedy pod wysokim ciśnieniem.
Pokłady gazu ziemnego występują samodzielnie lub towarzyszą złożom ropy naftowej lub
węgla kamiennego.
W zależności od składu rozróżnia się "gaz suchy" , zawierający do 99% metan, oraz "gaz
mokry", czyli taki, który zawiera składniki dające się skroplić w temperaturze pokojowej.
Gazolina - mieszanina najlżejszych ciekłych węglowodorów alifatycznych, uzyskiwana
podczas rafinacji lub krakingu ropy naftowej albo w procesie nasycania benzyn gazem
ziemnym. Używana jako rozpuszczalnik kauczuku, tłuszczów i żywic; dodatek poprawiający
liczbę oktanową benzyny.
gazolina stabilizowana - naft. gazolina pozbawiona w większości propanu, butanów oraz
gazów obojętnych i innych zanieczyszczeń.
Rektyfikacja (destylacja frakcyjna, frakcjonowana, frakcjonująca) – z fizycznego punktu
widzenia jest to proces destylacji kaskadowej (wielopoziomowej), w którym każdy stopień
procesu jest zasilany produktem (destylatem) poprzedniego. Jednak z technologicznego
punktu widzenia rektyfikacja jest procesem jednostkowym, w którym mieszanina ciekła jest
rozdzielana na frakcje o różnej (zwykle zbliżonej) lotności.
Kraking, krakowanie - (ang. cracking - pękanie) proces technologiczny stosowany w celu
przerobu ciężkich frakcji ropy naftowej na benzynę i oleje.

Kraking polega na inicjowaniu kontrolowanego rozkładu długich węglowodorów
alifatycznych zawartych w ciężkich frakcjach otrzymywanych w procesie rafinacji ropy
naftowej, na związki o krótszych łańcuchach węglowych, takich jakie występują w benzynie i
oleju napędowym. Reakcje chemiczne zachodzące w czasie krakingu sprowadzają się w
uproszczeniu do pękania pojedynczych wiązań chemicznych węgiel-węgiel z wytworzeniem
wolnych rodników. W wyniku wtórnych reakcji wytworzonych wolnych rodników oprócz
oczekiwanych węglowodorów alifatycznych o stosunkowo krótkich łańcuchach powstaje też
nieco metanu, LPG, nienasyconych węglowodorów oraz koksu.
Reforming (reforming katalityczny, reformowanie benzyny) to wysokotemperaturowe
ogrzewanie lekkich frakcji ropy naftowej lub produktów krakingu pod zwiększonym
ciśnieniem w celu otrzymania paliw o wysokiej liczbie oktanowej.Reforming katalityczny jest
procesem, w czasie którego zachodzą reakcje: izomeryzacji, odwodornienia, cyklizacji,
hydrokrakingu i aromatyzacja. Surowiec przed reformingiem katalitycznym jest poddawany
wstępnemu hydroodsiarczaniu.
Rafinacja - oczyszczanie substancji (np. tłuszczów, benzyn) w celu nadania im odpowiednich
właściwości, np. pozbawienia zabarwienia, poprawienia zapachu, zwiększenia trwałości.
Rafinacja może odbyć się za pomocą metod fizycznych (destylacja, ekstrakcja) lub
chemicznych (działanie kwasami, zasadami)
113. Liczba oktanowa - liczba określająca odporność na niekontrolowany samozapłon paliwa
silnikowego do silników z zapłonem iskrowym, który może powodować jego spalanie
stukowe. Dokładna wartość liczby oktanowej jest równa procentom objętościowym
zawartości izooktanu w takiej mieszaninie izooktanu i n-heptanu, która wywołuje identyczną
liczbę stuków w silniku testowym jak analizowane paliwo.
114. Liczba cetanowa (LC) - wskaźnik zdolności olejów napędowych do samozapłonu. Jeden
z podstawowych parametrów olejów napędowych, zależący od ich składu
chemicznego.Liczbę cetanową wyznacza się porównując czas zapłonu (zob. zwłoka zapłonu)
dla paliwa wzorcowego i analizowanego oleju napędowego, stosując do tego celu specjalne
silniki wzorcowe. Paliwo wzorcowe to mieszanka cetanu (heksadekanu, C16H34) -
posiadającego bardzo krótki czas zapłonu i α-metylo-naftalenu. Gdy analizowany olej
napędowy posiada własności takie jak czysty cetan ma on liczbę cetanową 100. Gdy posiada
własności takie jak mieszanka 50:50 cetanu i α-metylo-naftalenu ma on liczbę cetanową
równą 50.
115. Gaz doskonały – zwany gazem idealnym jest to abstrakcyjny, matematyczny model
gazu, spełniający następujące warunki:
1. brak oddziaływań międzycząsteczkowych z wyjątkiem odpychania w momencie zderzeń
cząsteczek
2. objętość cząsteczek jest znikoma w stosunku do objętości gazu
3. zderzenia cząsteczek są doskonale sprężyste
4. cząsteczki znajdują się w ciągłym chaotycznym ruchu
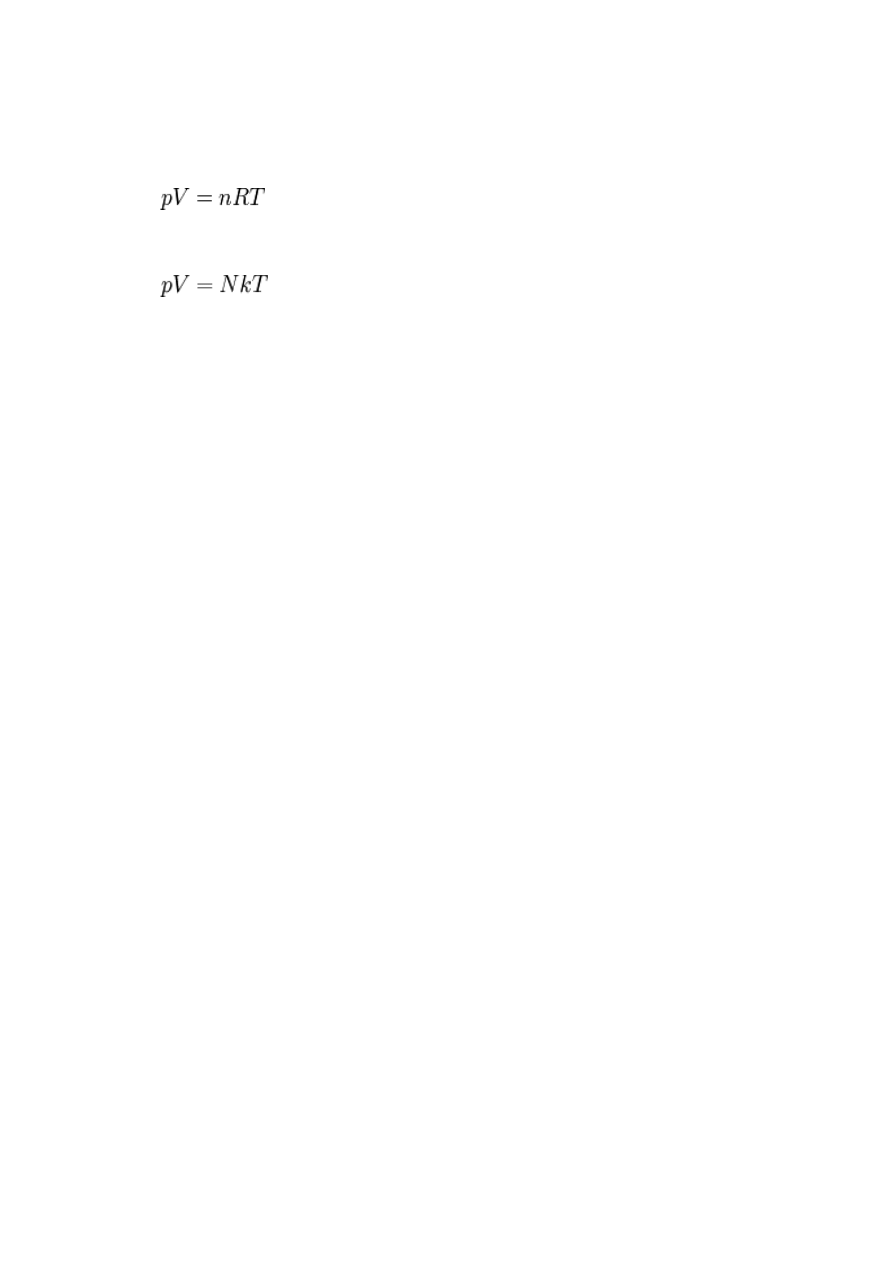
Gaz taki w mechanice klasycznej opisuje równanie Clapeyrona (równanie stanu gazu
doskonałego), przedstawiające zależność między ciśnieniem gazu (p), jego objętością (V),
temperaturą (T) i licznością (n) wyrażoną w molach:
gdzie R jest stałą gazową
lub
gdzie k jest stałą Boltzmanna.
116. Prawo Avogadra (znane też jako hipoteza Avogadra) – prawo fizyki sformułowane przez
Amadeo Avogadro, które brzmi:"W tych samych warunkach fizycznych tj. w takiej samej
temperaturze i pod takim samym ciśnieniem, w równych objętościach różnych gazów
znajduje się taka sama liczba cząsteczek".Prawo Avogadra jest prawem przybliżonym,
którego zakres stosowalności zależy od podobieństwa porównywanych gazów rzeczywistych
do gazu doskonałego. Prawo Avogadra można wyprowadzić wykorzystując równanie
Clapeyrona.
Wyszukiwarka
Podobne podstrony:
opracowanie2 id 338681 Nieznany
chemia zadania 2 id 113035 Nieznany
Opracowanie07v2 id 338680 Nieznany
chemia klucz (2) id 112361 Nieznany
chemia tablice id 112030 Nieznany
Chemia 03 id 557778 Nieznany
ginexy opracowanie id 191652 Nieznany
Najlepsze opracowanie id 313141 Nieznany
Chemia 10 3 id 111757 Nieznany
Chemia 11 3 id 111768 Nieznany
Chemia organiczna W 8 id 112721 Nieznany
arkusz zr Chemia tablice id 625 Nieznany (2)
Promethidion Opracowanie id 40 Nieznany
Immunologia opracowanie id 2121 Nieznany
biotech opracowanie 1 id 89010 Nieznany
Filozofia opracowanie id 170613 Nieznany
ZFHi tech Opracowanie id 932670 Nieznany
Opracowanie 3 id 338046 Nieznany
więcej podobnych podstron