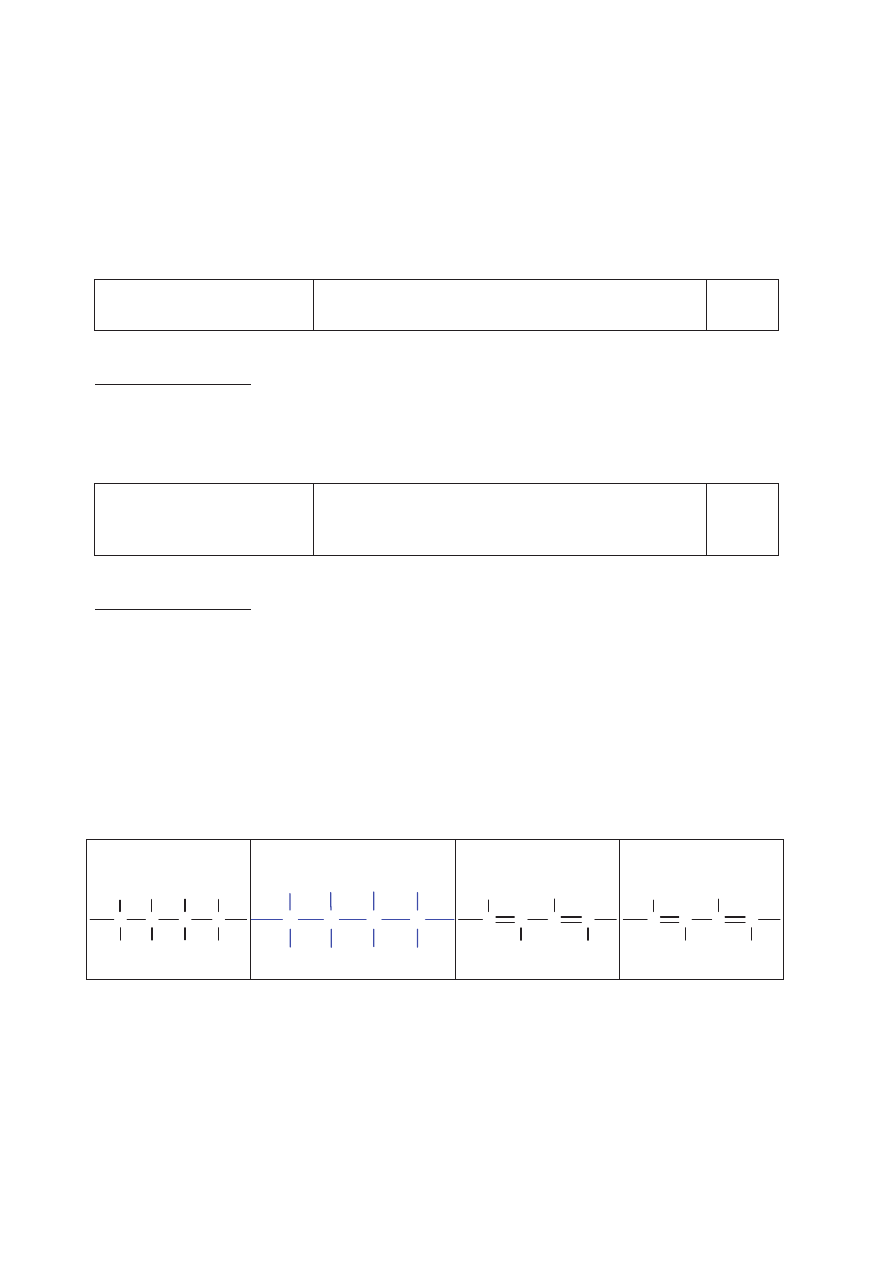
1
Chemia wokół nas
– poziom podstawowy
KLUCZ ODPOWIEDZI
Zadanie 1. (2 pkt)
Źródło: CKE 2009 (PP), zad. 25.
Chemia – poziom podstawowy
Klucz punktowania odpowiedzi
10
Zadanie 25.
a)
Wiadomości i rozumienie
Uzupełnienie równań reakcji przez dobranie
brakujących substratów lub produktów.
0–1
Zdający otrzymuje 1 punkt za identyfikację i podanie wzorów związków A i B.
Poprawna odpowiedź:
A: CH
2
Cl – CH
2
Cl
B: HCl
b)
Wiadomości i rozumienie
Zaklasyfikowanie reakcji przebiegających
z udziałem substancji organicznych do określonego
typu reakcji.
0–1
Zdający otrzymuje 1 punkt za określenie typów reakcji zilustrowanych schematem.
Poprawna odpowiedź:
Typ reakcji I: reakcja addycji
Typ reakcji II: reakcja eliminacji
Zadanie 26.
Korzystanie z informacji
Wykonanie obliczeń stechiometrycznych
na podstawie równania reakcji.
0–2
Zdający otrzymuje 2 punkty, jeśli w rozwiązaniu zadania zastosował właściwą metodę
(wynikającą ze stechiometrii równania reakcji zależność między danymi a szukaną) oraz
wykonał obliczenia i podał wynik liczbowy z jednostką.
Zdający otrzymuje 1 punkt, jeśli zastosował poprawną metodę rozwiązania, ale popełnił błąd
rachunkowy lub dokonał niewłaściwego zaokrąglenia wyniku, lub pominął jednostkę przy
ostatecznym wyniku liczbowym, lub podał błędną jednostkę przy ostatecznym wyniku
liczbowym.
Zdający otrzymuje 0 punktów, jeśli zastosował niepoprawną metodę rozwiązania.
Poprawne rozwiązanie:
M
etanalu
= 44 g·mol
–1
Zależność wynikająca ze stechiometrii równania reakcji:
3
44g
22,4dm
= 77,0g
x
Obliczenie objętości amoniaku:
V
amoniaku
= x =
3
77,0g 22,4 dm
44g
⋅
= 39,2 dm
3
Zadanie 2. (1 pkt)
Źródło: CKE 2008 (PP), zad. 24.
Egzamin maturalny z chemii
Poziom podstawowy
10
Zadanie 22. (2 pkt)
Scharakteryzuj etan i etanol (w temperaturze pokojowej i pod ciśnieniem
atmosferycznym), wybierając ich właściwości spośród podanych poniżej i wpisując je
w odpowiednie kolumny tabeli.
1. gaz, ciecz, ciało stałe
2. bezbarwny, barwny
3. dobrze rozpuszczalny w wodzie, praktycznie nierozpuszczalny w wodzie
4. palny, niepalny
Etan Etanol
1.
gaz
1.
ciecz
2.
bezbarwny
2.
bezbarwny
3.
praktycznie
nierozpuszczalny
w wodzie
3.
dobrze
rozpuszczalny
w
wodzie
4.
palny
4.
palny
Informacja do zadania 23. i 24.
W wyniku reakcji addycji chlorowodoru do węglowodoru X powstaje chloroeten (chlorek
winylu) o wzorze
Cl
CH
C
H
2
−
=
.
Zadanie 23. (2 pkt)
Napisz, stosując wzory półstrukturalne (grupowe) związków organicznych,
a) równanie reakcji węglowodoru X z chlorowodorem.
≡
→
−
2
HC CH+ HCl
H C = CH Cl
b) równanie reakcji chloroetenu z wodorem wobec katalizatora.
, ,
p T katalizator
2
2
3
2
H C CH Cl H
CH
CH
Cl
=
−
+
⎯⎯⎯⎯⎯→
−
−
Zadanie 24. (1 pkt)
Chloroeten ma zdolność ulegania reakcji polimeryzacji.
Spośród poniżej przedstawionych wzorów wybierz ten, który ilustruje budowę
fragmentu łańcucha produktu polimeryzacji chloroetenu (chlorku winylu). Zaznacz
odpowiedź A, B, C lub D.
A. B.
C. D.
C
C
C
C
H
H
H
H
H
H
H
H
C
C
C
C
H
H
Cl
H
H
H
Cl
H
C
C
C
C
H
H
H
H
C
C
C
C
H
Cl
H
Cl
2
Zadanie 3. (1 pkt)
Źródło: CKE 2007 (PP), zad. 13.
Egzamin maturalny z chemii
Poziom podstawowy
6
Zadanie 13. (1 pkt)
W kolumnie I przedstawiono nazwy wybranych zjawisk, a w kolumnie II nazwy substancji,
których nadmiar może być przyczyną występowania tych zjawisk.
Przyporządkuj zjawiskom z kolumny I odpowiednie nazwy substancji z kolumny II.
I
Zjawisko
II
Substancje
I II
1. kwaśne deszcze
A. tlenek węgla(IV)
1.
C
2. eutrofizacja wód
B. fosforany(V)
2.
B
3. efekt cieplarniany
C. tlenki siarki i azotu
3.
A
D. freony
Zadanie 14. (4 pkt)
Na etykiecie wody mineralnej podano informację, że zawiera ona między innymi kationy:
Na
+
, K
+
, Ca
2+
oraz aniony: Cl
–
, SO
4
2–
.
W celu potwierdzenia obecności jonów w tej wodzie przeprowadzono doświadczenie, którego
przebieg przedstawiono na poniższym rysunku. Jako odczynników użyto stężonych roztworów
soli. We wszystkich probówkach zaobserwowano powstanie białych osadów.
AgNO
3
BaCl
2
Na
2
CO
3
I II III
badana woda
Podaj wzory jonów, których obecność potwierdzono, a następnie napisz w formie jonowej
skróconej równania reakcji, jakie przebiegały podczas doświadczenia.
Potwierdzono obecność jonów I:
Cl
–
II:
SO
4
2–
III:
Ca
2+
Równania reakcji (w formie jonowej skróconej):
I
Ag
+
+ Cl
–
→ AgCl ↓
II
Ba
2+
+ SO
4
2–
→ BaSO
4
↓
III
Ca
2+
+ CO
3
2–
→ CaCO
3
↓
Zadanie 4. (1 pkt)
Źródło: CKE 2006 (PP), zad. 26.
Egzamin maturalny z chemii
Arkusz I
12
Zadanie 26. (1 pkt)
W kolumnie I poniższej tabeli przedstawiono skutki działania substancji chemicznych,
a w kolumnie II wymieniono nazwy substancji, które mogą je wywoływać.
Przyporządkuj każdemu skutkowi nazwę jednej substancji, która go wywołuje.
Kolumna I
Kolumna II
Przyporządkowanie:
A. Działanie rakotwórcze
1. fosforany(V)
A. –
2
B. Eutrofizacja zbiorników wodnych
prowadząca do ich zamierania
2. węglowodory
aromatyczne
B. –
1
C. Udział w powstawaniu kwaśnych
deszczów
3. tlenek węgla(II)
C. –
4
4. tlenek siarki(IV)
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997
Zadanie 27. (1 pkt)
Ozon obecny w stratosferze (warstwie atmosfery położonej powyżej troposfery) pochłania
szkodliwe promieniowanie ultrafioletowe. Zmniejszenie ilości ozonu w tej warstwie może mieć
istotny wpływ na funkcjonowanie organizmów. Stężenie ozonu w troposferze (przyziemnej
warstwie atmosfery) jest znacznie mniejsze niż w stratosferze. Wzrost ilości ozonu
troposferycznego pozostaje w ścisłym związku ze wzrostem liczby przypadków astmy
i problemów z układem oddechowym wśród populacji miejskiej.
Na podstawie: Peter O`Niell: Chemia środowiska, Warszawa 1997
Przeanalizuj przytoczony tekst i z poniższych zdań wybierz zdanie prawdziwe.
A. Zmniejszenie ilości ozonu stratosferycznego i wzrost ilości ozonu troposferycznego są
zjawiskami pozytywnymi.
B. Zmniejszenie ilości ozonu stratosferycznego jest zjawiskiem pozytywnym, a wzrost
ilości ozonu troposferycznego jest zjawiskiem negatywnym.
C. Zmniejszenie ilości ozonu stratosferycznego jest zjawiskiem negatywnym, a wzrost
ilości ozonu troposferycznego jest zjawiskiem pozytywnym.
D.
Zmniejszenie ilości ozonu stratosferycznego i wzrost ilości ozonu
troposferycznego są zjawiskami negatywnymi.
Nr zadania
26
27
Maks. liczba pkt
1
1
Wypełnia
egzaminator! Uzyskana liczba pkt

3
2
4⋅120 g FeS
2
8⋅22,4 dm
3
30 g V
2
SO
--------------------------------------------------------------
V
2
SO
=
g
120
4
dm
4
,
22
8
g
30
3
⋅
⋅
⋅
7. - za podanie poprawnej przyczyny, np.: (obecność w powietrzu)
tlenków siarki i azotu, spalanie (zasiarczonego) węgla
(kamiennego) (przez zakłady przemysłowe, elektrownie
węglowe, koksownie, huty), spalanie benzyny w samochodach
bez katalizatorów, erupcje wulkanów lub inne poprawne
przyczyny
1
1
8. - za podanie dwóch właściwości fizycznych sodu,
np.: ciało stałe, srebrzystobiały, mała gęstość, miękki
lub inne prawidłowe odpowiedzi
- za podanie dwóch właściwości fizycznych siarki,
np.: ciało stałe, żółta, krucha, nierozpuszczalna w wodzie,
rozpuszczalna w dwusiarczku węgla, nie przewodzi prądu
elektrycznego lub inne prawidłowe odpowiedzi
Nie uznaje się odpowiedzi „metal”, „niemetal”.
1
1
2
9. - za odp. D
1
1
10. - za odp. probówka I: H
+
+ OH
-
→ H
2
O
lub H
3
O
+
+ OH
-
→ 2H
2
O
probówka II: K
2
O + 2H
+
→ 2K
+
+ H
2
O
lub K
2
O + 2H
3
O
+
→ 2K
+
+ 3H
2
O
probówka III: reakcja nie zachodzi
1
1
1
3
11. - za odp. I i III lub Zn i Mg
- za wyjaśnienie, np.: cynk i magnez reagują z kwasem solnym,
ponieważ w szeregu aktywności znajdują się przed wodorem;
lub ... ponieważ są metalami aktywnymi lub nieszlachetnymi;
lub ... ponieważ są aktywniejsze od wodoru (i wypierają wodór z
kwasów);
lub .... ponieważ mają ujemne wartości potencjałów redoks.
1
1
2
12. - za obserwację, np.: wydzielanie się (pęcherzyków) gazu,
pienienie się cieczy (roztworu)
1 1
13. - za odp. (reakcja) endoenergetyczna
1 1
14. - za schemat doświadczenia przedstawiający dwie probówki
zawierające tlenki i wodę (reagenty mogą być podane w
dowolnej kolejności; nie musi być zaznaczony papierek)
1
Zadanie 6. (1 pkt)
Zadanie 7. (2 pkt)
Źródło: CKE 2007 (PP), zad. 7.
Źródło: CKE 2006 (PP), zad. 16.
3
- za spostrzeżenia,
odpowiednie do zaprojektowanego
doświadczenia np.: w probówce, w której do wody dodano
P
4
O
10
, papierek uniwersalny zabarwił się na czerwono (różowo),
a w probówce, w której do wody dodano Na
2
O, papierek
uniwersalny zabarwił się na niebiesko lub niebiesko-zielono lub
zielono
1
- za wnioski: P
4
O
10
– (charakter) kwasowy
Na
2
O – (charakter) zasadowy
1
3
- za odp. I, II i III
1
15.
- za podanie wniosku, np.: najaktywniejszy jest chlor (Cl, Cl
2
),
(mniej aktywny brom (Br, Br
2
)), a najmniej aktywny jod (I, I
2
)
lub:
aktywność fluorowców maleje ze wzrostem masy (liczby)
atomowej
1
2
16. - za podanie nazwy zjawiska: eutrofizacja, użyźnianie
- za określenie skutku, np.: gwałtowny rozwój flory bakteryjnej
lub glonów, nadmierne zarastanie zbiorników wodnych,
zmniejszenie zawartości tlenu w wodzie, obumieranie
organizmów typowych dla określonych zbiorników, zanik życia
w zbiornikach wodnych, obumieranie zbiorników wodnych i za
inne prawidłowe odpowiedzi
1
1
2
17. - za zastosowanie poprawnej metody obliczenia
- za obliczenie masy roztworu m
r
= 80 g
- za prawidłowy wynik z jednostką C
p
= 10%
Przykładowe poprawne obliczenie:
C
p
=
=
⋅
%
100
m
m
r
s
%
100
g
80
g
8 ⋅
1
1
1
3
18. - za odp. D
1
1
19. - za podanie nazw kwasów o właściwościach silnie
utleniających: stężony kwas siarkowy(VI) i stężony kwas
azotowy(V) lub podanie wzorów: H
2
SO
4
i HNO
3
- za podanie nazw kwasów słabych: kwas siarkowodorowy
i kwas octowy lub podanie wzorów H
2
S i CH
3
COOH
1
1
2
- za napisanie równania reakcji:
3NaOH+ H
3
PO
4
→Na
3
PO
4
+ 3H
2
O
1
20.
- za podanie stosunku molowego n
NaOH
: n
4
3
PO
H
= 3:1
- za określenie stosunku masowego m
NaOH
: m
4
3
PO
H
= 60:49
lub podanie innego poprawnego stosunku matematycznego
1
1
3
21. - za wskazanie probówki II
1
1
22. - za prawidłowe określenie stopni utlenienia azotu:
NH
3
NO
2
-
N
2
O
-III III I
2
1
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
ARKUSZA EGZAMINACYJNEGO I
•
Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające
poleceniom zawartym w zadaniach.
•
Gdy do jednego polecenia zdający poda dwie odpowiedzi (z których jedna jest
prawidłowa, druga nieprawidłowa), to nie otrzymuje punktów za żadną z nich.
•
Jeżeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający powinien
napisać równanie reakcji chemicznej, a nie jej schemat.
•
Dobór współczynników w równaniach reakcji chemicznych może różnić się od
zalecanego (np. mogą być zwielokrotnione). Niewłaściwy dobór lub brak
współczynników powoduje utratę 1 punktu.
•
W rozwiązaniach zadań rachunkowych błędny zapis jednostki lub jej brak przy
ostatecznym wyniku liczbowym powoduje utratę 1 punktu.
•
Za poprawne obliczenia będące konsekwencją zastosowania niepoprawnej metody
zdający nie otrzymuje punktów.
•
Całkowicie poprawne rozwiązanie zadań rachunkowych, uwzględniające inny tok
rozumowania niż podany w modelu, oceniane jest pełną liczbą punktów.
Punktacja
Nr
zad.
Model odpowiedzi
(w nawiasach podano elementy poprawne, ale niewymagane)
za
czynność sumaryczna
1. - za odp. C
1
1
2. - za podanie (liczby masowej A): 34 i (liczby atomowej Z): 16
- za podanie symbolu pierwiastka – S
Dopuszczalne formy zapisu:
16, 34, S lub 34, 16, S lub
S
34
16
lub
E
34
16
, S.
1
1 2
3. - za odpowiedzi: KBr – (wiązanie) jonowe
HBr – (wiązanie) kowalencyjne spolaryzowane
lub atomowe spolaryzowane
1
1
2
4. - za wpisanie każdej wartości - po 1 punkcie:
1 mol O
2
184 g NO
2
lub 4· 46 g NO
2
44,8 dm
3
N
2
O
5
lub 2· 22,4 dm
3
N
2
O
5
1
1
1
3
5. - za uszeregowanie zgodne z zapisem : MgO, CaO, Na
2
O
Zamiast wzorów mogą być podane nazwy tlenków.
1 1
6. - za prawidłową interpretację równania
- za obliczenia
- za wynik z poprawną jednostką V
2
SO
= 11,2 dm
3
Przykładowe poprawne obliczenie:
z 4 moli FeS
2
powstaje 8 moli SO
2
,
mol
g
120
M
2
FeS
=
, więc:
1
1
1
3
1
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
ARKUSZA EGZAMINACYJNEGO I
•
Zdający otrzymuje punkty tylko za poprawne rozwiązania, precyzyjnie odpowiadające
poleceniom zawartym w zadaniach.
•
Gdy do jednego polecenia zdający poda dwie odpowiedzi (z których jedna jest
prawidłowa, druga nieprawidłowa), to nie otrzymuje punktów za żadną z nich.
•
Jeżeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający powinien
napisać równanie reakcji chemicznej, a nie jej schemat.
•
Dobór współczynników w równaniach reakcji chemicznych może różnić się od
zalecanego (np. mogą być zwielokrotnione). Niewłaściwy dobór lub brak
współczynników powoduje utratę 1 punktu.
•
W rozwiązaniach zadań rachunkowych błędny zapis jednostki lub jej brak przy
ostatecznym wyniku liczbowym powoduje utratę 1 punktu.
•
Za poprawne obliczenia będące konsekwencją zastosowania niepoprawnej metody
zdający nie otrzymuje punktów.
•
Całkowicie poprawne rozwiązanie zadań rachunkowych, uwzględniające inny tok
rozumowania niż podany w modelu, oceniane jest pełną liczbą punktów.
Punktacja
Nr
zad.
Model odpowiedzi
(w nawiasach podano elementy poprawne, ale niewymagane)
za
czynność sumaryczna
1. - za odp. C
1
1
2. - za podanie (liczby masowej A): 34 i (liczby atomowej Z): 16
- za podanie symbolu pierwiastka – S
Dopuszczalne formy zapisu:
16, 34, S lub 34, 16, S lub
S
34
16
lub
E
34
16
, S.
1
1 2
3. - za odpowiedzi: KBr – (wiązanie) jonowe
HBr – (wiązanie) kowalencyjne spolaryzowane
lub atomowe spolaryzowane
1
1
2
4. - za wpisanie każdej wartości - po 1 punkcie:
1 mol O
2
184 g NO
2
lub 4· 46 g NO
2
44,8 dm
3
N
2
O
5
lub 2· 22,4 dm
3
N
2
O
5
1
1
1
3
5. - za uszeregowanie zgodne z zapisem : MgO, CaO, Na
2
O
Zamiast wzorów mogą być podane nazwy tlenków.
1 1
6. - za prawidłową interpretację równania
- za obliczenia
- za wynik z poprawną jednostką V
2
SO
= 11,2 dm
3
Przykładowe poprawne obliczenie:
z 4 moli FeS
2
powstaje 8 moli SO
2
,
mol
g
120
M
2
FeS
=
, więc:
1
1
1
3
Zadanie 5. (1 pkt)
Źródło: CKE 2006 (PP), zad. 27.
Egzamin maturalny z chemii
Arkusz I
12
Zadanie 26. (1 pkt)
W kolumnie I poniższej tabeli przedstawiono skutki działania substancji chemicznych,
a w kolumnie II wymieniono nazwy substancji, które mogą je wywoływać.
Przyporządkuj każdemu skutkowi nazwę jednej substancji, która go wywołuje.
Kolumna I
Kolumna II
Przyporządkowanie:
A. Działanie rakotwórcze
1. fosforany(V)
A. –
2
B. Eutrofizacja zbiorników wodnych
prowadząca do ich zamierania
2. węglowodory
aromatyczne
B. –
1
C. Udział w powstawaniu kwaśnych
deszczów
3. tlenek węgla(II)
C. –
4
4. tlenek siarki(IV)
Na podstawie: W. Mizerski, Tablice chemiczne, Warszawa 1997
Zadanie 27. (1 pkt)
Ozon obecny w stratosferze (warstwie atmosfery położonej powyżej troposfery) pochłania
szkodliwe promieniowanie ultrafioletowe. Zmniejszenie ilości ozonu w tej warstwie może mieć
istotny wpływ na funkcjonowanie organizmów. Stężenie ozonu w troposferze (przyziemnej
warstwie atmosfery) jest znacznie mniejsze niż w stratosferze. Wzrost ilości ozonu
troposferycznego pozostaje w ścisłym związku ze wzrostem liczby przypadków astmy
i problemów z układem oddechowym wśród populacji miejskiej.
Na podstawie: Peter O`Niell: Chemia środowiska, Warszawa 1997
Przeanalizuj przytoczony tekst i z poniższych zdań wybierz zdanie prawdziwe.
A. Zmniejszenie ilości ozonu stratosferycznego i wzrost ilości ozonu troposferycznego są
zjawiskami pozytywnymi.
B. Zmniejszenie ilości ozonu stratosferycznego jest zjawiskiem pozytywnym, a wzrost
ilości ozonu troposferycznego jest zjawiskiem negatywnym.
C. Zmniejszenie ilości ozonu stratosferycznego jest zjawiskiem negatywnym, a wzrost
ilości ozonu troposferycznego jest zjawiskiem pozytywnym.
D.
Zmniejszenie ilości ozonu stratosferycznego i wzrost ilości ozonu
troposferycznego są zjawiskami negatywnymi.
Nr zadania
26
27
Maks. liczba pkt
1
1
Wypełnia
egzaminator! Uzyskana liczba pkt
Wyszukiwarka
Podobne podstrony:
Chemia wokół nas
tlenki wokol nas, Wydział Nauk o Żywności, chemia organiczna
matematyka wokol nas wymagania kl 5
matematyka wokol nas wymagania kl 4(1)
Media w metodzie projektów Jesień wokól nas
Prezentacja Czyste powietrze wokół nas (2)
Energia wokół nas i Zjawiska w atmosferze ziemskiej, fizyka
Agresja w nas i wokol nas
Scenariusz zajęcia - PRZYRODA WOKÓŁ NAS, Konspekty, scenariusze
Świat wokół nas (2 4 lat)
czyste powietrze wokol nas
Karty pracy, wid6 k pracy r viii t1 technika wokol nas
więcej podobnych podstron