
Wp³yw antygenów Trichophyton rubrum i Trichophyton
mentagrophytes na transformacjê blastyczn¹ limfocytów
The influence of Trichophyton rubrum and Trichophyton mentagrophytes on lymphocytes
blastic transformation
Anita Hryncewicz-Gwód, Eugeniusz Baran, Ewa Plomer-Niezgoda
Katedra i Klinika Dermatologii i Wenerologii AM we Wroc³awiu
Porównano zdolnoæ antygenów T. rubrum i T. mentagrophytes do stymulowania transformacji blastycznej (TB) limfocytów
zdrowych dawców. Stwierdzono, ¿e T. rubrum by³ s³abszym aktywatorem. Indeks transformacji blastycznej dla T. mentagrophytes
by³ trzykrotnie wy¿szy ni¿ dla T. rubrum. Oceniano wp³yw ekstraktów grzybni (A) i substancji uwalnianych do pod³o¿a (B), które
uzyskano z hodowli p³ynnej T. rubrum, oraz ich frakcji na TB limfocytów aktywowanych PHA (fitohemaglutynin¹). Wykazano,
¿e zarówno ekstrakty, jak i ich frakcje wyranie hamowa³y proliferacjê limfocytów. Ekstrakty A i B w stê¿eniu 500 µg/ml hamowa³y
94 i 90% transformacji blastycznej. Ekstrakt A oddzia³ywa³ jeszcze w stê¿eniu 1 µg/ml, a ekstrakt B w stê¿eniu 10 µg/ml.
Frakcje A1 i A2 hamowa³y odpowied limfocytów stymulowanych PHA w 75 i 70%. Pozosta³e frakcje dzia³a³y wyranie s³abiej.
S³aba immunogennoæ oraz w³aciwoci hamowania procesów immunologicznych przez T. rubrum mog¹ sprzyjaæ rozwojowi
przewlek³ej dermatofitozy.
S³owa kluczowe: Trichophyton rubrum, Trichophyton mentagrophytes, transformacja blastyczna limfocytów
Lymphocyte transformation to T. rubrum and T. mentagrophytes antigens was assessed. T. rubrum was worse activator
than T. mentagrophytes. The influence of T. rubrum on proliferation of lymphocytes stimulated by PHA was examined. An
inhibitory effect on lymphoproliferation of mycelium (A), exoantigen (B) and their fractions was observed. Extracts A and B
at 500 µg/ml concentration inhibited 94 and 90% of lymphocyte transformation. Inhibitory effect was observed in concentration
of 10 µg/ml (extract A) and 1 µg/ml (extract B). A1 and A2 are the most active fractions inhibiting proliferation of stimulated
lymphocytes. The low immunogenicity and the inhibiting property of lymphoproliferation by the antigen of T. rubrum can play
a role in the generation of chronic infections with scanty symptoms.
Key words: Trichophyton rubrum, Trichophyton mentagrophytes, lymphocyte blastic transformation
Prace oryginalne
Mikol. Lek. 1998, 5 (3): 141-148
ISSN 1232-986X
Wstêp
Dermatofity powoduj¹ce infekcjê naskórka i zrogo-
wacia³ych przydatków skóry mog¹ wywo³ywaæ u cz³o-
wieka zaka¿enia o ró¿nym przebiegu. Trichophyton ru-
brum, zaliczany do dermatofitów antropofilnych, jest
przyczyn¹ przewlek³ej i nawrotowej grzybicy skóry oraz
paznokci, któr¹ cechuje s³abo rozwijaj¹cy siê odczyn
zapalny (4). Dermatofitoza wywo³ana przez grzyby zoo-
filne przebiega odmiennie. Infekcja powoduje mianowi-
cie powstanie nasilonego stanu zapalnego, który mo¿e
doprowadziæ do eliminacji czynnika patogennego i sa-
mowyleczenia (12, 15, 16). Przyczyny wystêpowania
u niektórych osób infekcji o charakterze przewlek³ym
nie s¹ do koñca poznane. Pewn¹ rolê mog¹ odgrywaæ
warunki rodowiskowe, jak wilgotne mikrorodowisko
zwi¹zane z noszeniem nieprzewiewnego obuwia, oraz
w³aciwoci osobnicze, jak np. szybkoæ podzia³ów ko-
mórek naskórka i z³uszczania jego powierzchownych
warstw (1). Nieprawid³owoci dotycz¹ce specyficznej
komórkowej odpowiedzi immunologicznej mog¹ rów-
nie¿ wp³ywaæ na przebieg schorzenia. W trakcie infekcji
T. rubrum znacznie rzadziej ni¿ w grzybicy odzwierzêcej
dochodzi do pozytywizacji pónego odczynu skórnego
na trichofitynê (8, 13-15, 21). Poziom transformacji bla-
stycznej limfocytów u chorych, u których stwierdzono tê
infekcjê, pod wp³ywem antygenów grzybiczych mo¿e
byæ równie¿ niski (8, 10). W publikowanych w ostat-
141

142
Anita Hryncewicz-Gwód, Eugeniusz Baran, Ewa Plomer-Niezgoda
Mikol. Lek. 1998, 5 (3)
nich latach pracach próbowano wyjaniæ przyczyny s³a-
bego rozwoju specyficznej odpowiedzi komórkowej
w przebiegu dermatofitoz antropofilnych. Byæ mo¿e, ma
znaczenie s³absza zdolnoæ T. rubrum do indukowania
pewnych procesów immunologicznych, a tak¿e dzia³anie
hamuj¹ce antygenów tego dermatofita na uk³ad odpor-
nociowy (2, 4, 7, 18, 23).
Celem pracy by³o porównanie w³aciwoci immuno-
gennych T. rubrum, wywo³uj¹cego 90% dermatofitoz
przewlek³ych (18), oraz T. mentagrophytes czynnika
patogennego grzybicy z nasilonym stanem zapalnym.
Zbadano transformacjê blastyczn¹ limfocytów od zdro-
wych osób pod wp³ywem ekstraktów grzybni obu der-
matofitów. Oceniono równie¿ wp³yw T. rubrum na od-
powied immunologiczn¹ na podstawie testu trans-
formacji blastycznej limfocytów zdrowych dawców
aktywowanych PHA (fitohemaglutynin¹) w obecnoci
ekstraktów mycelium i metabolitów wydzielanych do
po¿ywki.
Materia³ i metody
Do badania wp³ywu antygenów dermatofitów na
transformacjê blastyczn¹ limfocytów u¿yto krwi zdro-
wych dawców, którzy w wywiadzie nie podawali za-
chorowania na dermatofitozê.
Badaniom poddano szczepy dermatofitów zoofil-
nych (T. mentagrophytes) i antropofilnych (T. rubrum),
które pochodzi³y z kolekcji Pracowni Mikologicznej
Kliniki Dermatologii we Wroc³awiu i by³y izolowane
z przypadków chorobowych. Z wyhodowanych szcze-
pów wykonano ekstrakty i frakcje.
Przygotowanie ekstraktów dermatofitów
T. mentagrophytes i T. rubrum
wed³ug Helandera (10)
Czterotygodniow¹ hodowlê (w temperaturze 20°C)
dermatofitów na pod³o¿u p³ynnym Sabourauda odwiro-
wano, po czym trzykrotnie przemyto roztworem soli fiz-
jologicznej. Uzyskany osad zawieszono w 0,1 M buforze
glicynowym o pH 9,0 i rozbijano ultradwiêkami trzykrot-
nie przez 10 minut. Sonifikat pozostawiono na 12 godzin
w temperaturze 4°C, a nastêpnie odwirowano z prêdko-
ci¹ 3 000 obrotów na minutê przez 20 minut. Do super-
natantu dodano 7,5 g octanu sodu/l. Nastêpnie dodano
dwie objêtoci acetonu i precypitowano przez 2 godziny
w temperaturze 4°C. Precypitat uzyskany po wirowaniu
przy 3 000 obrotów na minutê rozpuszczono w wodzie
destylowanej, przes¹czono i sprawdzono ja³owoæ na
pod³o¿u sta³ym Sabourauda.
Przygotowanie ekstraktu grzybni
T. rubrum (A) wed³ug Hanna (9)
Hodowlê T. rubrum prowadzono na pod³o¿u p³yn-
nym, uzyskuj¹c wzrost g³êbinowy. Inokulat przygotowa-
no w 10 bakteriologicznych probówkach, które zawiera³y
po 10 ml ja³owego pod³o¿a p³ynnego Sabourauda, i in-
kubowano przez 3 tygodnie. Hodowlê g³êbinow¹ prowa-
dzono na pod³o¿u Sabourauda przez 4 tygodnie w tem-
peraturze 27°C. W czasie inkubacji kolby wstrz¹sano
mechanicznie.
Osad grzybni przemyto wod¹ destylowan¹, a na-
stêpnie 400 ml acetonu i wysuszono na szalkach Pe-
triego (w temperaturze oko³o 37°C). Suchy materia³ roz-
tarto w porcelanowym modzierzu, po czym traktowano
400 ml glikolu etylenowego. Czynnoæ tê powtórzono
dwukrotnie. Ekstrakt glikolowo-etylenowy dializowano
przez 3 doby w du¿ej iloci wody (ka¿dorazowo w oko-
³o 12 litrach wody). Po dializie zawartoæ worków liofili-
zowano.
Przygotowanie ekstraktu substancji
wydzielanej do po¿ywki T. rubrum (B)
wed³ug Garga (6)
Nads¹cz czterotygodniowej hodowli na p³ynnym
pod³o¿u Sabourauda przefiltrowano przez bibu³ê What-
man 3. Filtrat zagêszczono 20 razy przez ultrafiltracjê,
przep³ukano dwiema objêtociami wody destylowanej,
a nastêpnie dodano 95% alkoholu etylowego, aby uzy-
skaæ 80-proc. stê¿enie. Po 24 godzinach przechowywa-
nia w temperaturze 4°C i sta³ego mieszania na miesza-
de³ku magnetycznym precypitat oddzielono przez wiro-
wanie przy 6 000 obrotów na minutê przez 30 minut.
Osad rozpuszczono w 60 ml demineralizowanej wody
destylowanej, wirowano przy 2 000 obrotów na minutê,
aby usun¹æ nierozpuszczalne cz¹steczki, a nastêpnie
liofilizowano.
Analiza i rozdzia³ chromatograficzny
ekstraktów T. rubrum wed³ug metody HPLC
Analizê i rozdzia³ chromatograficzny ekstraktów
grzybni i substancji uwalnianych do po¿ywki prowadzo-
no przy u¿yciu chromatografu Waters, wyposa¿onego
w detektor fotodiodowy PDA Waters 996 oraz pompê
wysokocinieniow¹ sterowane za pomoc¹ programu
Millenium 2010. Stosowano kolumny Spherisorb C8
250×4 mm ID (Knauer) i C18, przy przep³ywie 1 ml na
minutê, oraz uk³ad rozpuszczalników metanolwoda
w stosunku 80:20 w systemie izokratycznym.
Oznaczanie cukrów
Cukry ca³kowite neutralne oznaczano metod¹ fenol/
/kwas siarkowy (5).
Monocukry przeprowadzone w lotne pochodne octa-
nów alditoli identyfikowano wed³ug metody chromato-
grafii gazowo-cieczowej sprzê¿onej ze spektrometri¹
masow¹. Do analizy u¿yto chromatografu gazowego
sprzê¿onego ze spektrometrem masowym firmy Hew-
lett-Packard HP 5971 z kolumn¹ kapilarn¹ o wymiarach
0,22 mm×12 m. Pomiary prowadzono w temperaturze
wynosz¹cej 150-270°C (8°C na minutê), u¿ywaj¹c helu
jako gazu nonego (20).
Oznaczanie iloci bia³ka
Bia³ka w preparatach grzybiczych oznaczano wed³ug
metody Lowryego i wsp. (17).
Ocena toksycznoci ekstraktów grzybiczych
Toksycznoæ oceniano in vitro. Sporz¹dzano roz-
cieñczenia preparatu i dodawano zawiesinê limfocytów
ludzkich (PBL), a nastêpnie inkubowano przez 24 go-
dziny. ¯ywotnoæ komórek oceniano wed³ug metody
MTT, porównuj¹c z ¿ywotnoci¹ komórek, do których
nie dodano preparatu.
Izolacja limfocytów
Masê leukocytarn¹ po lizie erytrocytów przemy-
wano dwukrotnie, a nastêpnie zawieszono w p³ynie
143
Wp³yw antygenów Trichophyton rubrum i Trichophyton mentagrophytes na transformacjê blastyczn¹ limfocytów
Hanksa, nawarstwiano na glikol
z dodatkiem uropoliny i wirowa-
no przez 15 minut przy 3 000 ob-
rotów na minutê (3). Piercieñ
zawieraj¹cy komórki zbierano,
przemywano trzy razy p³ynem
Hanksa. Do osadu dodawano
po¿ywki RPMI-1640 z dodatkiem
10% FCS i gentamycyny w stê-
¿eniu 10 µg/ml. Komórki liczo-
no i doprowadzano do gêstoci
2×10
6
/ml.
Transformacja blastyczna
limfocytów (TB)
Limfocyty o gêstoci 2×10
6
/
ml zawieszono w po¿ywce RPMI
z dodatkiem 10% FCS, 2 mM
glutaminy i 10 µg/ml gentamy-
cyny rozlano po 100 µl do p³a-
skodennych mikrop³ytek sk³a-
daj¹cych siê z 96 do³ków (Fal-
kon). Nastêpnie dodawano po
100 µl odpowiednio rozcieñczo-
nych w po¿ywce preparatów (ka¿-
de stê¿enie do 3 do³ków). P³ytki
inkubowano w atmosferze 5%
CO
2
w temperaturze 37°C przez
72 godziny. Wynik proliferacji
komórek mierzono wed³ug meto-
dy izotopowej. Do do³ków, 20 go-
dzin przed zakoñczeniem hodowli, dodawano po 1 uCi
3
H tymidyny (Amersham, specyficzna aktywnoæ 6,9 Ci/
mM). Komórki zbierano pó³automatycznym harweste-
rem na bibu³ê Whatman 934-AH. Radioaktywnoæ ozna-
czono w p³ynnym scyncylacyjnym liczniku (Beckman
LS7500) liczb¹ impulsów na minutê (LI). Komórki sty-
mulowane fitohemaglutynin¹ 10 µg/ml (PHA P Sigma)
stanowi³y kontrolê dodatni¹, a próbki bez preparatów
kontrolê ujemn¹.
Badanie wp³ywu preparatów grzybiczych
na transformacjê blastyczn¹ (TB) limfocytów
stymulowanych PHA
Limfocyty o gêstoci 2×10
6
/ml zawieszano w po¿yw-
ce RPMI z dodatkiem 10% FCS, 2 mM glutaminy i 10
µg/ml gentamycyny rozlewano po 100 µl do p³askoden-
nych mikrop³ytek sk³adaj¹cych siê z 96 do³ków (Falkon).
Nastêpnie dodawano po 50 µl odpowiednio rozcieñczo-
nych w po¿ywce preparatów grzybiczych i 50 µl PHA
o stê¿eniu 20 µl/ml do 3 do³ków. Dalej postêpowano tak
samo, jak podczas badania TB. Proliferacjê limfocytów
oznaczano wed³ug metody MTT (11).
Test MTT. Metoda kolorymetryczna
s³u¿¹ca do oceny ¿ywotnoci komórek
Do ka¿dego do³ka zawieraj¹cego limfocyty dodawa-
no po 10 µl MTT (3-[4,5-dimethylthiazol-2-yl] 2,5-diphe-
nyl-tetrazolium bromide) o stê¿eniu 5 mg/ml, a po 3 go-
dzinach inkubacji (37°C, 5% CO
2
) dodawano p³yn lizu-
j¹cy o sk³adzie: 20% lauryl sulfate (SDS, Sigma) w 50%
N-N-dimethyl formamide (DMF, Sigma) rozcieñczony
w wodzie dejonizowanej z dodatkiem kwasu octowego.
P³yn lizuj¹cy rozpuszcza kryszta³ki formazanu wypro-
dukowanego z MTT przez ¿ywe komórki. Próbki po do-
daniu p³ynu lizuj¹cego inkubowano przez 20 godzin
w tych samych warunkach. Ekstynkcjê odczytywano
w czytniku Dynatech przy fali 550 nm (19).
Wyniki
Stymulacja transformacji blastycznej
przez ekstrakty acetonowe grzybni
T. mentagrophtes i T. rubrum
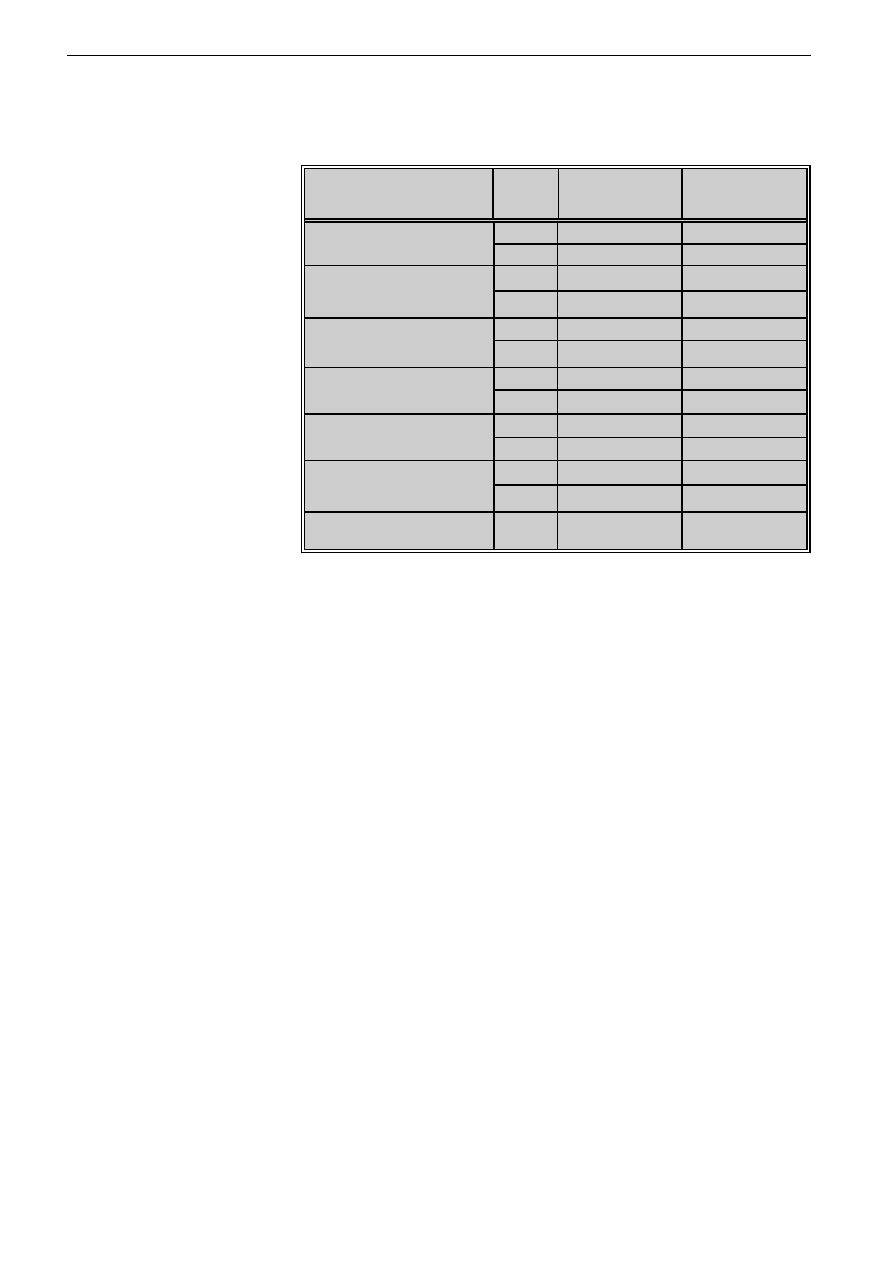
Wykazano, ¿e antygeny grzybicze w s³abym stopniu
indukuj¹ limfoproliferacjê, a indeksy transformacji bla-
stycznej s¹ o wiele ni¿sze ni¿ po stymulacji PHA. Eks-
trakty obydwu dermatofitów w stê¿eniu 100 i 50 µg/ml nie
stymuluj¹ transformacji blastycznej. Optymaln¹ dawk¹
T. rubrum stymuluj¹c¹ limfoproliferacjê jest 0,1 µg/ml
i 1 µg/ml, a indeksy transformacji wynosz¹, odpowiednio:
1,76 i 1,43. Trichophyton mentagrophytes jest najbardziej
aktywny w stê¿eniach 0,1-10 µg/ml (indeksy transforma-
cji wynosz¹ 3,6-2,8). W miarê wzrostu stê¿eñ obu anty-
genów, ich aktywnoæ stymuluj¹ca TB zmniejsza siê
(tab. I).
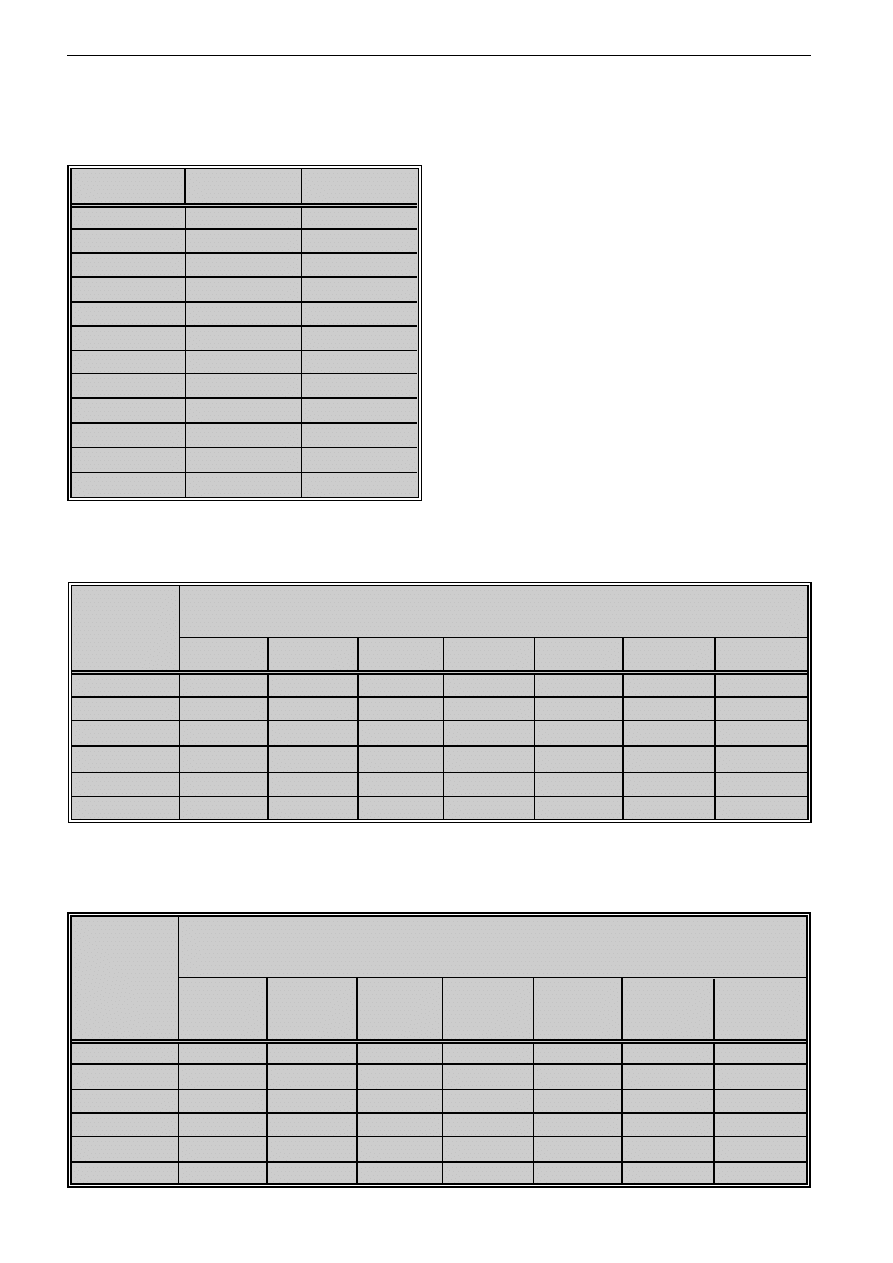
Wp³yw antygenów T. rubrum
na transformacjê blastyczn¹
Wp³yw ekstraktu glikoloetylenowego grzybni (A)
i etylowego substancji uwalnianych do po¿ywki hodowla-
nej (B) T. rubrum na transformacjê blastyczn¹ limfocytów
aktywowanych PHA badano u¿ywaj¹c stê¿eñ 1-500
µg/ml. Wykazano, ¿e obydwa ekstrakty hamuj¹ trans-
formacjê blastyczn¹ limfocytów. Stopieñ zahamowania
Tabela I: Transformacja blastyczna limfocytów pod wp³ywem ekstraktów acetonowych
grzybni T. rubrum i T. mentagrophytes wyra¿ona liczb¹ impulsów na minutê
(LI) i indeksem transformacji (IT)
Table I: Lymphocyte transformation induced by T. rubrum and T. mentagrophytes
mycelium extracts expressed as count per minute (LI) and transformation
index (IT)
Stê¿enie ekstraktu
Extract concentration
[µg/ml]
100
50
10
1
0,1
PHA
10 µg/ml
TB spontaniczna
Tb spontaneous
LI
IT
LI
IT
LI
IT
LI
IT
LI
IT
LI
IT
LI
Ekstrakt grzybni
Mycelium extract
T. rubrum
2898
0,86
2966
0,93
4078
1,16
4631
1,43
6291
1,76
35744
17,8
3245
Ekstrakt grzybni
Mycelium extract
T. mentagrophytes
2506
0,8
2920
1,1
9004
2,8
11592
3,6
9354
3,2
35744
18,0
3240
Podano wartoæ redni¹ z trzech dowiadczeñ / Mean value from three asseys was stated

144
Anita Hryncewicz-Gwód, Eugeniusz Baran, Ewa Plomer-Niezgoda
Mikol. Lek. 1998, 5 (3)
Tabela II: Hamowanie transformacji blastycznej (TB)
limfocytów zdrowych osób stymulowanych
PHA przez ekstrakt grzybni (A) T. rubrum
Table II: Inhibition of lymphoproliferation stimulated
by PHA in presence of mycelium (A) extract
of T. rubrum
Antygen i dawka [µg/ml]
Antigen and dose
[µg/ml]
A 500
A 100
A 10
A 1
PHA
TB spontaniczna
Tb spontaneous
Wartoæ ekstynkcji
Extinction value
274
288
310
339
372
274
% zahamowania TB
TB Inhibition %
94
84
61
32
Podano wartoæ redni¹ z trzech dowiadczeñ
Mean value form three asseys was stated
Tabela III: Hamowanie transformacji blastycznej (TB)
limfocytów zdrowych osób stymulowanych PHA
przez ekstrakt (B) substancji uwalnianych przez
T. rubrum do pod³o¿a
Table III: Inhibition of lymphoproliferation stimulated by
PHA in presence of exoantigen (B) of T. rubrum
Antygen i dawka [µg/ml]
Antigen and dose
[µg/ml]
B 500
B 100
B 10
B 1
PHA 10
TB spontaniczna
Tb spontaneous
Wartoæ ekstynkcji
Extinction value
293
338
411
502
472
282
% zahamowania TB
TB Inhibition %
90
70
31
0
Podano wartoæ redni¹ z trzech dowiadczeñ
Mean value form three asseys was stated
Tabela IV: Sk³ad chemiczny ekstraktu grzybni (A) i ekstraktu substancji wydzielanych do po¿ywki (B) T. rubrum
Table IV: Chemical constitution of mycelium (A) and exoantigen (B) extracts of T. rubrum
Preparat
Preparation
A
B
Cukier ca³kowity
a
[%]
Total sugar [%]
20
1
Bia³ko
b
[%]
Protein
b
[%]
24
47
Wydajnoæ [%]
Output [%]
0,92
c
1,9
d
a
oznaczany metod¹ wykrywaj¹c¹ cukry obojêtne za pomoc¹ fenol/kwas siarkowy / determined by a method detecting neutral sugars using phenol/sulphur acid
b
oznaczane wed³ug metody Lowry i wsp. / determined using Lowry et al. method
c
w mg preparatu z 100 mg grzybni / in mg of preparation out of 100 mg mycelium
d
w mg preparatu z 100 ml nads¹czu grzybni / in mg of preparation out of 100 ml mycelium supernatant
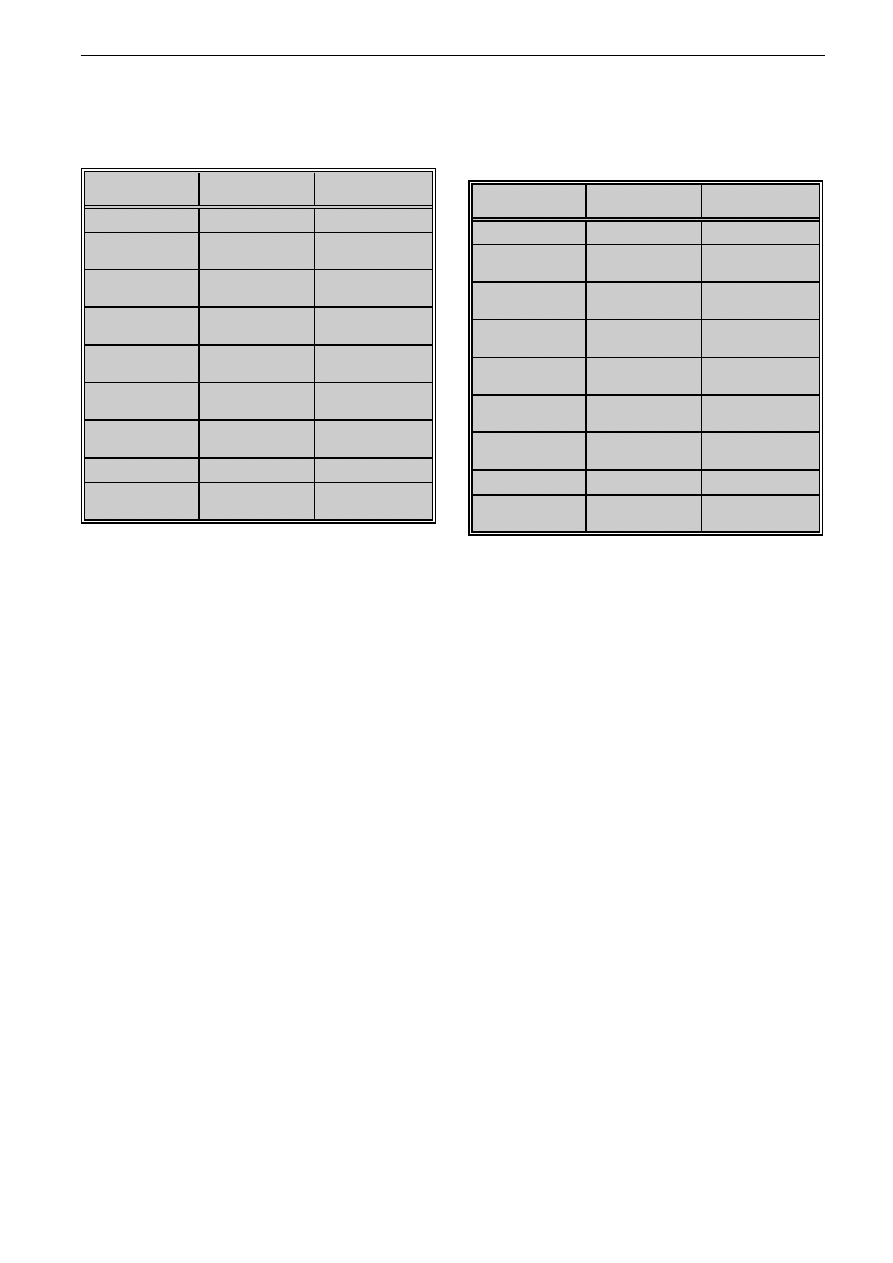
Tabela V: Wyniki analizy jakociowej i ilociowej cukrów ekstraktu grzybni (A) i ekstraktu substancji wydzielanych do po¿ywki (B)
T. rubrum
Table V: Quantity and quality analysis of sugar in mycelium (A) and exoantigen (B) extracts of T. rubrum
Sk³adnik cukrowy*
Sugar constituent*
Ryboza
Ribose
Arabinoza
Arabinose
Ksyloza
Xylose
Mannoza
Mannose
Glukoza
Glucose
Galaktoza
Galactose
Glukozoamina
Glucoseamine
Galaktozoamina
Galactoseamine
Razem
Total
Czas retencji [min]
Retention time [min]
6,82
6,93
7,17
9,83
9,94
10,03
11,60
11,87
1,94
lad
Trace
9,94
2,96
6,67
0,49
0,06
22,01
1,20
0,47
1,52
3,14
1,15
0,71
0,31
8,50
Iloæ w preparacie [%]
Amount in preparation [%]
* sk³adniki cukrowe jako pochodne octanów alditoli cukrów oznaczane wed³ug metody chromatografii gazowo-cieczowej po³¹czonej ze spektrometri¹ masow¹
(GC-MS) / Sugar constituents as derivatives of sugar aldithol acetate determined with GC-MS method
brak sk³adnika / no consitituent
A
B
Wp³yw antygenów Trichophyton rubrum i Trichophyton mentagrophytes na transformacjê blastyczn¹ limfocytów
proliferacji aktywowanych PHA limfocytów zale¿a³
od stê¿enia wykorzystanych ekstraktów. Najsilniejsze
hamowanie stwierdzono, gdy stê¿enie wynosi³o 500
µg/ml. Ekstrakt substancji uwalnianej do pod³o¿a ha-
mowa³ limfoproliferacjê jeszcze w stê¿eniu 10 µg/ml,
ekstrakt grzybni natomiast nawet w stê¿eniu 1 µg/mI
(tab. II, III).
Okrelenie sk³adu chemicznego
ekstraktów A i B i ich frakcji
W celu scharakteryzowania czynnika odpowiedzial-
nego za hamowanie limfoproliferacji przez ekstrakty
A i B, do dalszych badañ u¿yto ich frakcji. Oba ekstrakty
rozdzielono na frakcje wed³ug metody cieczowej chroma-
tografii wysokocinieniowej (HPLC). Uzyskano po szeæ
frakcji z ka¿dego preparatu (A1-A6 otrzymano z grzyb-
ni i B1-B6 z substancji uwalnianej do pod³o¿a).
Ekstrakty wyjciowe i ich frakcje poddano analizie
cukrowej (wed³ug metody kolorymetrycznej i chroma-
tografii gazowej po³¹czonej ze spektrometri¹ maso-
w¹) oraz okrelono zawartoæ bia³ka (wed³ug metody
Lowryego i wsp.). Stwierdzono, ¿e ekstrakt grzybni
zawiera podobne iloci cukru i bia³ka, a przewa¿a-
j¹cym sk³adnikiem ekstraktu substancji uwalnianych
145
Tabela VI: Procentowa zawartoæ bia³ka i cukru w po-
szczególnych frakcjach ekstraktu grzybni (A)
i ekstraktu substancji wydzielanych do po¿ywki (B)
Table VI: Protein and sugar constituents on fractions of
mycelium (A) and exoantigen (B) extracts
of T. rubrum [%]
Frakcje
Fractions
A1
A2
A3
A4
A5
A6
B1
B2
B3
B4
B5
B6
Bia³ko
Protein
0
17,87
1,02
lad /Trace
2,55
2,55
22,74
7,58
7,58
7,58
1,52
0,20
Tabela VII: Sk³ad cukrowy frakcji (A1-A6) otrzymanych z glikolowego ekstraktu grzybni T. rubrum
Table VII: Sugar constituents in mycelium fractions (A1-A6) of T. rubrum
A1
A2
A3
A4
A5
A6
Procentowa zawartoæ w ekstrakcie grzybni cukrów
zidentyfikowanych w poszczególnych jego frakcjach
Percentual contents in mycelium extract of sugers identified in its individual fractions
Frakcje ekstraktu
Extract fractions
A
Arabinoza
Arabinose
0,06
Ksyloza
Xylose
0,02
Mannoza
Mannose
0,35
2,49
0,30
0,13
0,32
1,06
Glukoza
Glucose
0,41
4,16
2,80
0,10
0,21
1,23
Galaktoza
Galactose
0,27
3,70
0,41
0,19
0,50
1,44
Glukozoamina
Glucoseamine
6,26
0,36
0,62
0,72
2,78
Galaktozoamina
Galactoseamine
0,84
0,06
0,08
0,53
brak sk³adnika / no constituent
Tabela VIII: Sk³ad cukrowy frakcji (B1-B6) otrzymanych z etanolowego ekstraktu substancji uwalnianych do po¿ywki T. rubrum
Table VIII: Sugar constituents in exoantigen fractions (B1-B6) of T. rubrum
B1
B2
B3
B4
B5
B6
Procentowa zawartoæ w ekstrakcie substancji wydzielanych do po¿ywki cukrów
zidentyfikowanych w poszczególnych jego frakcjach
Percentual contents in extract of substances secreted to the medium
of sugars identified in its individual fractions
Frakcje ekstraktu
Extract fractions
B
Arabinoza
Arabinose
16
Ryboza +
Ramnoza
Ribose +
Ramnose
30
Mannoza
Mannose
0,07
0,03
0,01
0,008
0,0004
0,009
Glukoza
Glucose
0,31
0,18
0,02
0,09
0,01
0,02
Galaktoza
Galactose
0,15
0,06
0,02
0,01
0,01
Glukozoamina
Glucoseamine
0,18
0,11
0,05
0,02
0,02
Galaktozoamina
Galactoseamine
0,02
0,004
0,002
brak sk³adnika / no constituent
Cukier
Sugar
1,03
10,03
3,5
0,41
1,03
3,71
4,6
2,30
0,40
0,66
0,10
0,40
146
Anita Hryncewicz-Gwód, Eugeniusz Baran, Ewa Plomer-Niezgoda
Mikol. Lek. 1998, 5 (3)
do po¿ywki jest bia³ko (tab. IV). G³ównym sk³adni-
kiem cukrowym ekstraktu grzybni jest mannoza, a eks-
traktu substancji uwalnianych do po¿ywki glukoza
(tab. V).
Analizuj¹c sk³ad cukrowy frakcji ekstraktu grzybni,
wykazano, ¿e dominuj¹cym sk³adnikiem poszczegól-
nych frakcji jest glukoza lub gIukozoamina. Ró¿nice
w rezultatach badañ sk³adu cukrowego ekstraktu
grzybni i jego frakcji mog¹ wynikaæ z adsorpcji nie-
których sk³adników wielkocz¹steczkowych, np. manna-
nu, na filtrach w kolumnach rozdzielaj¹cych oraz roz-
padu wiêkszych cz¹steczek i uwolnienia cukrów pro-
stych. Stwierdzono równie¿, ¿e g³ównym sk³adnikiem
cukrowym frakcji ekstraktu substancji uwalnianych do
po¿ywki, podobnie jak ekstraktu wyjciowego, jest glu-
koza i glukozoamina (tab. VI-VIII).
Wp³yw frakcji ekstraktów
na transformacjê blastyczn¹ limfocytów
aktywowanych PHA
Podczas wy¿ej opisanych dowiadczeñ wykaza-
no, ¿e ekstrakty grzybni i substancji uwalnianych do
pod³o¿a T. rubrum wywo³uj¹ najwiêksze zahamowa-
nie transformacji blastycznej w stê¿eniu wynosz¹cym
500 µg/ml. Dlatego, prowadz¹c badania nad wp³y-
wem frakcji tych ekstraktów na TB, u¿yto stê¿eñ od-
powiadaj¹cych zawartoci danej frakcji w 500 µg/ml
ekstraktu wyjciowego.
Stwierdzono, ¿e frakcje obu ekstraktów (A i B)
w ró¿nym stopniu hamuj¹ transformacjê blastyczn¹ lim-
focytów stymulowanych PHA. Najsilniej hamuj¹co dzia-
³aj¹ frakcje A1 i A2 (75 i 70%). Doæ znaczne hamowa-
nie obserwowano równie¿ w obecnoci frakcji A3 i A6
(37 i 34%). Sporód frakcji ekstraktu B najsilniej hamuj¹
TB frakcje B1, B2 i B3 (33, 41 i 38%). Pozosta³e frakcje
w mniejszym stopniu wp³ywaj¹ na odpowied limfocy-
tów stymulowanych PHA (13-27%) (tab. IX, X).
Omówienie
Komórkowa odpowied immunologiczna odgrywa
du¿¹ rolê w eliminacji czynnika patogennego w prze-
biegu dermatofitozy. W czasie infekcji grzybami antro-
pofilnymi, która cechuje siê przewlek³ym, nawrotowym
przebiegiem oraz s³abo rozwijaj¹cym siê stanem za-
palnym, podczas badañ in vivo, na podstawie póne-
go testu ródskórnego (DTH), obserwowano u wielu
pacjentów brak reaktywnoci komórkowej na antyge-
ny dermatofitów, przy prawid³owej odpowiedzi na inne
antygeny niespecyficzne, jak tuberkulina i kandydyna
(8, 13-15, 21). Przyczyna s³abej selektywnej odpowie-
dzi komórkowej w dermatofitozach przewlek³ych nie
zosta³a do koñca wyjaniona. Wyniki naszych badañ,
uzyskane na podstawie testu transformacji blastycz-
nej, wskazuj¹, ¿e T. rubrum jest s³abszym aktywato-
rem limfocytów ni¿ T. mentagrophytes. S³aba immuno-
gennoæ dermatofitów antropofilnych mo¿e byæ zatem
przyczyn¹ rozwoju przewlek³ego i sk¹poobjawowego
przebiegu schorzenia. Doniesienia na temat badañ in
vitro reaktywnoci komórkowej u chorych na przewle-
Tabela IX: Wp³yw frakcji (A1-A6) ekstraktu grzybni na trans-
formacjê blastyczn¹ (TB) limfocytów zdrowych
osób stymulowanych PHA
Table IX: Inhibition of lymphoproliferation stimulated by
PHA in presence of mycelium extract fractions
(A1-A6) of T. rubrum
Frakcje ekstraktów A zastosowano w stê¿eniach odpowiadaj¹cych zawarto-
ci danej frakcji w 500 µg/ml ekstraktu. Podano wartoæ redni¹ z trzech do-
wiadczeñ
Fractions of A extracts were used in concentrations corresponding to the
contents of a given fraction in 500 mg/ml of extract. Mean value from three
asseys was stated
Antygen
Antigen
A 500 µg/ml
Frakcja A1
Fraction A1
Frakcja A2
Fraction A2
Frakcja A3
Fraction A3
Frakcja A4
Fraction A4
Frakcja A5
Fraction A5
Frakcja A6
Fraction A6
PHA
TB spontaniczna
Tb spontaneous
Wartoæ ekstynkcji
Extinction value
285
333
344
418
452
450
429
477
278
% zahamowania TB
TB Inhibition %
97
75
70
37
17
22
34
Tabela X: Wp³yw frakcji (B1-B6) ekstraktu substancji
uwalnianych do po¿ywki T. rubrum na transforma-
cjê blastyczn¹ (TB) limfocytów zdrowych osób
stymulowanych PHA
Table X: Inhibition of lymphoproliferation stimulated by PHA
in presence of exoantigen extract fractions (B1-B6)
of T. rubrum
Frakcje ekstraktów B zastosowano w stê¿eniach odpowiadaj¹cych zawarto-
ci danej frakcji w 500 µg/ml ekstraktu. Podano wartoæ redni¹ z 3 do-
wiadczeñ
Fractions of B extracts were used in concentrations corresponding to the
contents of a given fraction in 500 mg/ml of extract. Mean value from 3 as-
seys was stated
Antygen
Antigen
B 500 µg/ml
Frakcja B1
Fraction B1
Frakcja B2
Fraction B2
Frakcja B3
Fraction B3
Frakcja B4
Fraction B4
Frakcja B5
Fraction B5
Frakcja B6
Fraction B6
PHA B 10 µg/ml
TB spontaniczna
Tb spontaneous
Wartoæ ekstynkcji
Extinction value
293
421
395
404
450
435
452
469
282
% zahamowania TB
TB Inhibition %
90
33
41
38
15
27
13

147
Wp³yw antygenów Trichophyton rubrum i Trichophyton mentagrophytes na transformacjê blastyczn¹ limfocytów
k³¹ dermatofitozê s¹ niejednoznaczne. Niektórzy auto-
rzy wykazali na podstawie testu transformacji bla-
stycznej os³abion¹ proliferacjê limfocytów pod wp³y-
wem antygenów grzybiczych, a nawet jej brak (8, 10).
Inni natomiast donosz¹ o prawid³owej proliferacji lim-
focytów pod wp³ywem antygenów dermatofitów u cho-
rych na przewlek³¹ grzybicê, równie¿ u pacjentów,
u których odczyn DTH jest ujemny (18, 22). Istnienie
czynników pochodzenia grzybiczego, które hamuj¹
procesy immunologiczne, mo¿e mieæ znaczenie w ogra-
niczeniu rozwijaj¹cej siê odpowiedzi komórkowej. Lokal-
ne oddzia³ywanie tych czynników u chorych na przewle-
k³¹ dermatofitozê, u których reaktywnoæ limfocytów
krwi kr¹¿¹cej w tecie TB jest prawid³owa, mog³oby ha-
mowaæ odpowied immunologiczn¹ w miejscu infekcji
i ograniczaæ mo¿liwoæ eliminowania czynnika pato-
gennego z powierzchni skóry. W trakcie swoich badañ
McGregor, Blake i Grando stwierdzili, ¿e antygeny T.
rubrum oraz mannan wyizolowany z grzybni T. rubrum
w odpowiednich stê¿eniach hamuj¹ proliferacjê limfo-
cytów aktywowanych mitogenami (2, 7, 18). Wyniki
naszych badañ s¹ podobne. Ekstrakty T. rubrum uzy-
skane z grzybni i substancji wydzielanych do po¿ywki
dodane do stymulowanych PHA limfocytów zdrowych
osób hamuj¹ TB. Najsilniejsze hamowanie wywieraj¹
obydwa ekstrakty wyjciowe w stê¿eniu wynosz¹cym
500 µg/ml (90 i 94% zahamowania TB). W mniejszych
stê¿eniach ekstrakt grzybni oddzia³uje silniej ni¿ eks-
trakt substancji uwalnianej do po¿ywki. Przy u¿yciu
100, 10 i 1 µg/ml zahamowanie wywo³ane przez eks-
trakt grzybni wynosi³o, odpowiednio: 84, 61 i 32%,
a przez ekstrakt substancji uwalnianych do po¿ywki
70, 31 i 0%.
Ró¿nice w sile oddzia³ywania na procesy immuno-
logiczne mog¹ byæ zwi¹zane z budow¹ chemiczn¹ obu
badanych ekstraktów. Oznaczono ich sk³ad chemiczny
i stwierdzono, ¿e: ekstrakt grzybni zawiera du¿¹ iloæ
cukru (20%) i podobn¹ iloæ bia³ka (24%), a ekstrakt
substancji uwalnianej do po¿ywki sk³ada siê z przewa-
¿aj¹cej iloci bia³ka (47%) i niewielkiej iloci cukru
(8,5%). Silniejsze hamowanie TB wywo³ane przez eks-
trakt grzybni jest, byæ mo¿e, zwi¹zane z wiêksz¹ za-
wartoci¹ cukrowców, których g³ównym sk³adnikiem
jest mannoza.
Zarówno ekstrakt grzybni, jak i substancji uwalnia-
nych do pod³o¿a rozdzielono wed³ug metody HPLC
i uzyskano po szeæ frakcji. Oznaczono zawartoæ bia-
³ek i cukrów we frakcjach oraz badano ich wp³yw na
TB. Jakociowy sk³ad cukrowy wszystkich frakcji jest
podobny. Dominuj¹ heksozy oraz wystêpuje znaczna
iloæ glukozoaminy. Najsilniejsze dzia³anie hamuj¹ce
wywiera³y dwie frakcje ekstraktu grzybni: A1 (75%) i A2
(70%), co potwierdza wczeniejsze wyniki o silniej-
szym hamowaniu TB przez ekstrakt grzybni ni¿ sub-
stancji uwalnianych do po¿ywki. Pozosta³e frakcje obu
ekstraktów obni¿a³y poziom TB s³abiej (13-41%).
Frakcja A1 sk³ada siê jedynie z cukru, a frakcja A2
ma du¿¹ zawartoæ cukru i bia³ka. Byæ mo¿e, brak bia³-
ka w A1 i obecnoæ najwiêkszej ze wszystkich frakcji
czêci cukrowej w A2 warunkuje mo¿liwoæ dzia³ania
hamuj¹cego cukru. W pozosta³ych frakcjach natomiast
stosunki ilociowe bia³ka i cukru nie sprzyjaj¹ silnemu
oddzia³ywaniu na TB.
Wnioski
1. Antygeny T. rubrum s³abiej ni¿ T. mentagrophy-
tes stymuluj¹ transformacjê blastyczn¹ limfocytów.
2. Ekstrakty grzybni i substancji uwalnianych do
pod³o¿a przez T. rubrum oraz ich frakcje wp³ywaj¹ ha-
muj¹co na proliferacjê limfocytów stymulowanych PHA.
3. S³aba immunogennoæ oraz w³aciwoci hamo-
wania procesów immunologicznych przez T. rubrum
mog¹ sprzyjaæ rozwojowi przewlek³ej dermatofitozy.
Pimiennictwo
1. Aly R.: Dr Raza Aly o immunologii grzybic. Przegl. Mikol.,
1997, 1, 1-2.
2. Blake J.S., Dahl M.V., Herron M.J., Nelson R.D.: An immu-
noinhibitory cell wall glycoprotein (mannan) from Tricho-
phyton rubrum. J. Invest. Dermatol., 1991, 96, 657-661.
3. Boyum A.: Isolation of mononuclear cells and granulo-
cytes from human blood. J. Clin. Lab. Invest., 1968, 28
(supl. 97), 77-89.
4. Dahl M.V., Grando S.A.: Chronic dermatophytosis: what
is special about Trichophyton rubrum? Adv. Dermatol.,
1994, 9, 97-109.
5. Dubois M., Gilles K.A., Hamilton J.K., Robers P.A.,
Smith F.: Colorimetric method for determination of su-
gars and related substances. Anal. Chem., 1956, 28,
350-356.
6. Garg A.P., Muler J.: Preparation of antigens from Tri-
chophyton mentagrophytes using a new semi-solid cul-
ture medium and their characterization by SDS-PAGE
and immunological techniques. Mycoses, 1992, 35,
349-355.
7. Grando S.A., Hostager B.S., Herron M.J., Dahl M.V.,
Nelson R.D.: Binding of Trichophyton rubrum mannan
to human monocytes in vitro. J. Invest. Dermatol., 1992,
98, 876-880.
8. Hanifin J.M., Ray L.F., Lobitz W.C.: Immunological reacti-
vity in dermatophytosis. Br. J. Dermatol., 1974, 90, 1-7.
9. Hann P., Raay-Helmer E.M.H., Boorsma D.M.: Diversity
of antigenic extracts from the dermatophyte Trichophyton
rubrum. Mykosen, 1986, 9, 427-433.
10. Helander I.: The lymphocyte transformation test in der-
matophytoses. Mykosen, 1978, 21, 71-80.
11. Hussain R.F., Nouri A.M.E., Oliver R.T.D.: A new ap-
proach for measurement of cytotoxicity using colorime-
tric assay. J. Immunol. Methods, 1993, 160, 89-96.
12. Jones H.E., Reinhard J.H., Rinaldi M.G.: Acquired im-
munity to dermatophytes. Arch. Dermatol., 1974, 109,
840-848.
13. Jones H.E., Reinhard J.H., Rinaldi M.G.: A clinical, my-
cologial, and immunological survey for dermatophyto-
sis. Arch. Dermatol., 1973, 108, 61-65.
14. Jones H.E., Reinhard J.H., Rinaldi M.G.: Immunologic
susceptibility to chronic dermatophytosis. Arch. Derma-
tol., 1974, 110, 213-220.
15. Jones H.E., Reinhard J.H.: Model dermatophytosis in
naturaly infeceted subjects. Arch. Dermatol., 1974, 110,
369-374.
16. Jones H.E.: Immune response and host resistance of
humans to dermatophyte infection. J. Am. Acad. Derma-
tol., 1993, 28, S12-S18.
17. Lowry O.H., Rosebrough N.J., Fowr A.L., Randall R.J.: Pro-
tein measurement with the Folin phenol reagent. J. Biol.
Chem., 1951, 193, 265-275.

148
Anita Hryncewicz-Gwód, Eugeniusz Baran, Ewa Plomer-Niezgoda
Mikol. Lek. 1998, 5 (3)
18. McGregor J.M., Hamilton A.J., Hay R.J.: Possible mecha-
nism of immune modulation in chronic dermatophytoses
an in vitro study. Br. J. Dermatol., 1992, 127, 233-238.
19. Mosmann T.: Rapid colorimetric assay for cellular growth
and cytotoxity assays. J. Immunol. Methods, 1983, 65,
55-63.
20. Sawardeker J.S., Slonker J.H., Jeanes A.R.: Quantitati-
ve determination of monosaccharides as their alditol
acetates by gas-liquid chromatography. Anal. Chem.,
1965, 37, 1602-1624.
21. Sorensen G.W., Jones H.E.: Immediate and delayed
hypersensitivity in chronic dermatophytosis. Arch. Der-
matol., 1976, 112, 40-42.
22. Svejgaard E.: Immunologic Investigations of Dermato-
phytes and Dermatophytosis. Semin. Dermatol., 1985,
4, 201-221.
23. Weitzman I., Summerbell R.C.: The dermatophytes.
Clin. Microbiol. Rev., 1995, 8, 240-259.
Adres do korespondencji:
Katedra i Klinika Dermatologii i Wenerologii AM
ul. Cha³ubiñskiego 1
50-368 Wroc³aw
Praca wp³ynê³a do Redakcji: 9 czerwca 1998 r.
Zaakceptowano do druku: 26 czerwca 1998 r.
Wyszukiwarka
Podobne podstrony:
GMO i ich wpływ na żywność i środowisko
WIBRACJE – wpływ na zdrowie człowieka
Co ma wpływ na masę kostną, medycyna, Patofizjologia, Ćwiczenia 4-5 (hormony)
MASAŻ I JEGO WPŁYW NA POSZCZEGÓLNE UKŁADY W ORGANIZMIE
Antyinflacyjna polityka pieniężna w PL i jej wpływ na PKB w latach 1993 2007
Algorytmy sumowania w metodzie spektrum odpowiedzi i ich wpływ na obliczaną odpowiedź budynku wysoki
Kultura i jej wpływ na życie, Technik Ochrony Fizycznej Osób i Mienia
Przemoc w rodzinie i jej wpływ na karierę szkolną dziecka, przemoc
leki wplyw na ukl ?renergiczny
TWSN parametry pracy narzędzia i ich wpływ na jakość powierzchni obrabianej
Koloidy glebowe i ich wpływ na właściwości gleby
Zjonizowane powietrze i jego wpływ na nasze zdrowie (2)
Napoje gazowane na?zie sody i ich wpływ na zęby
Geografia Wypracowanie Rozwój turystyki na świecie i jej wpływ na zdrowie człowieka
PATOLOGIE SPOŁECZNE, RODZINY I JEDNOSTKI – WPŁYW NA STAN ZDROWIA POPULACJI
Twórcy i założenia konwencji klasycystycznej we Francji jej wpływ na literaturę polskiego oświecenia
więcej podobnych podstron