Ćwiczenie nr 6
PODZIAŁ ANIONÓW NA GRUPY ANALITYCZNE
REAKCJE ANALITYCZNE WYBRANYCH ANIONÓW
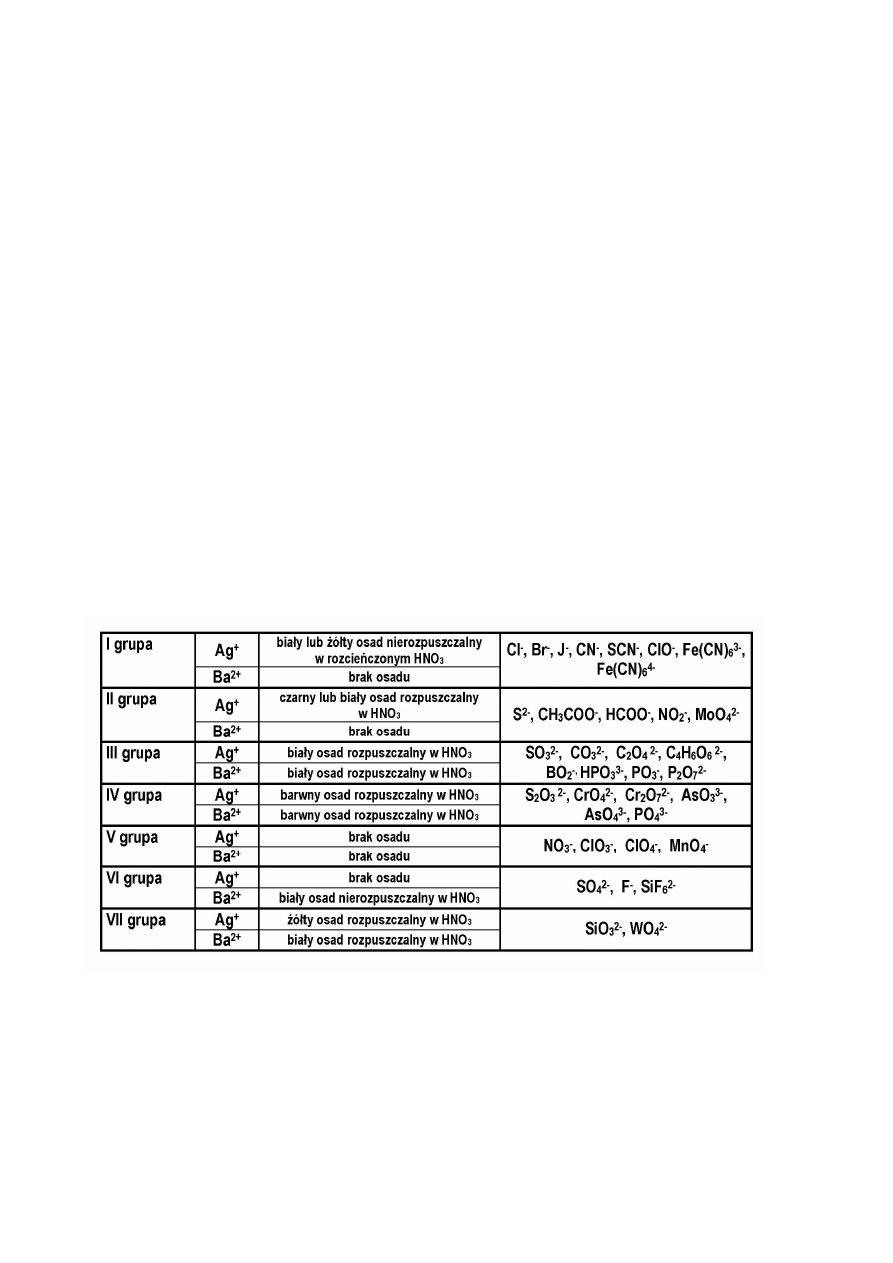
Aniony podzielone są na siedem grup analitycznych. Po raz pierwszy podział ten
zastosował Bunsen, wykorzystując różnice w zachowaniu się poszczególnych anionów, względem
azotanu srebrowego AgNO
3
i chlorku barowego BaCl
2
, oraz roztwarzaniu lub nie roztwarzaniu
powstałego osadu w kwasie azotowym HNO
3
.
Wynika stąd wniosek, że aniony nie posiadają określonego odczynnika grupowego, jak
miało to miejsce w analizie kationów. Stosując ten sposób analizy nie można rozdzielić
mieszaniny anionów na mniejsze frakcje. Można jedynie określić przynależność ich do jednej z
siedmiu grup. Następnie w ramach tej grupy analitycznej, wykonując reakcje charakterystyczne na
poszczególne aniony można zidentyfikować obecność jonu. Analiza anionów wg Bunsena ma
zastosowanie w tych przypadkach gdy nie spodziewamy się dużej różnorodności mieszaniny
anionów. W innych sytuacjach należy posługiwać się bardziej złożonymi metodami.
Podział anionów na grupy analityczne według Bunsena
2
Badania wstępne
Systematyczną analizę anionów poprzedzają zwykle badania wstępne; należą do nich:
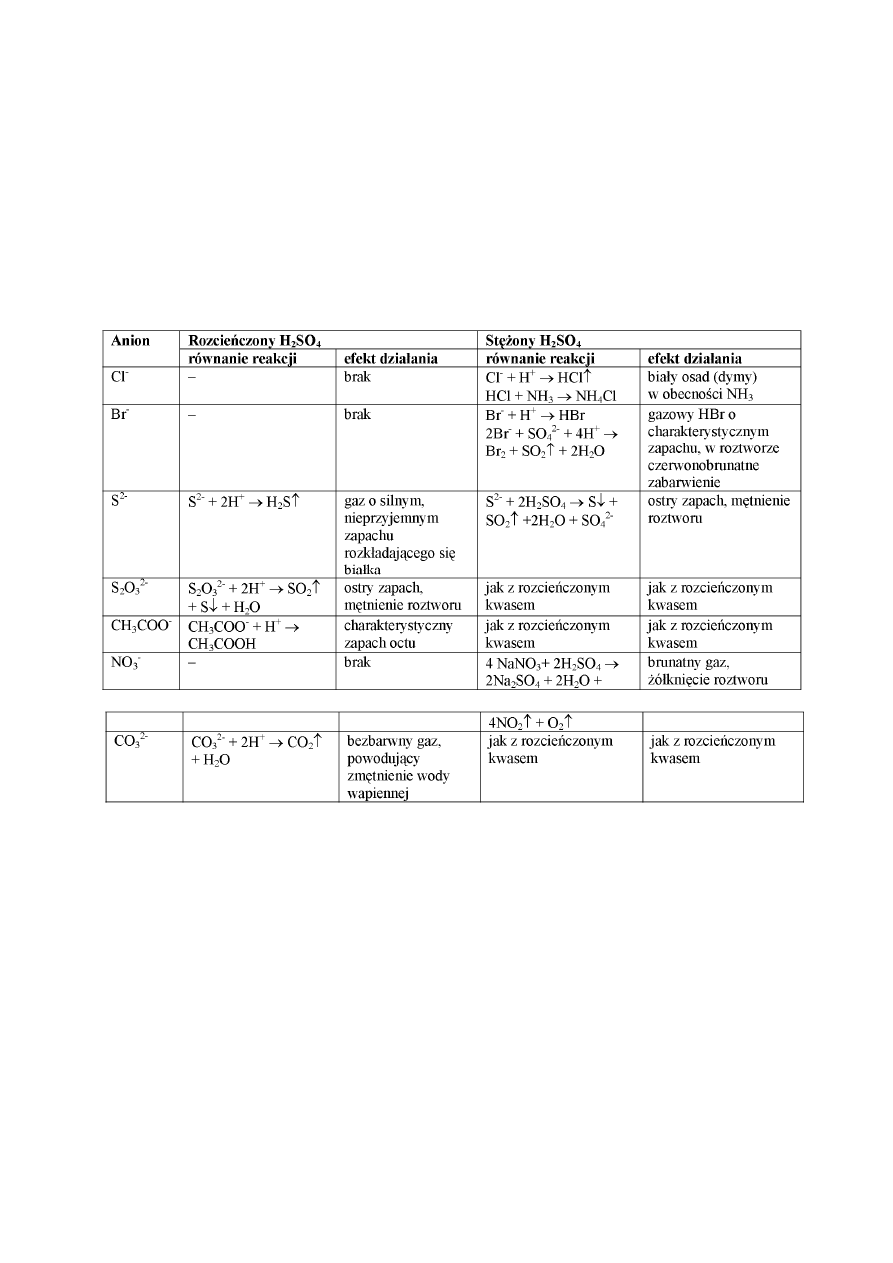
· działanie rozcieńczonym i stężonym kwasem siarkowym(VI),
· badanie właściwości utleniająco-redukujących.
Działanie H
2
SO
4
pozwala wykryć (należy zawsze potwierdzić wynik próby innymi
reakcjami) następujące jony: CO
2
2-
, SO
2
2-
, S
2
O
3
2-
, S
2-
, CN
-
, NO
2
-
, ClO
-
, CH
3
COO
-
.
W tabeli są podane efekty działania kwasem siarkowym(VI) na próbki soli.
Badanie właściwości utleniająco-redukujących przeprowadza się z użyciem odczynników
powodujących utlenienie bądź redukcję anionu. Do takich odczynników należą:
• KJ w środowisku kwasowym (reduktor), na przykład:
2 J
-
+ 2 NO
2
-
+ 4 H
+
→ J
2
+ 2 NO + 2 H
2
O;
• J
2
w KJ (utleniacz), na przykład:
S
2-
+ J
2
→ S + 2 J
-
;
• KMnO
4
(utleniacz), na przykład:
10 Cl
-
+ 2 MnO
4
-
+ 16 H
+
→ 5 Cl
2
+ 2 Mn
2+
+ 8 H
2
O

3
REAKCJE ANALITYCZNE WYBRANYCH ANIONÓW
1.
REAKCJE ANIONU CHLORKOWEGO
Anion chlorkowy występuje w kwasie solnym, chlorkach obojętnych i zasadowych (bizmutu,
antymonu, cyny). Większość chlorków obojętnych jest rozpuszczalna w wodzie (poza
chlorkami I grupy kationów), chlorki zasadowe są słabo rozpuszczalne w wodzie.
Tabela podaje reakcje pozwalające zidentyfikować anion chlorkowy.
Wykonanie oznaczenia.
Do niewielkiej ilości badanego roztworu (2-3 krople) dodać kroplami roztwór AgNO
3
.
Tworzący się biały, serowaty osad świadczy o obecności jonów chlorkowych z I grupy
analitycznej anionów. Próbę należy odstawić i obserwować zmianę barwy osadu. AgCl jest
związkiem światłoczułym (składnik emulsji fotograficznych), który pod wpływem światła
ulega redukcji do srebra metalicznego przybierając szarofioletowe zabarwienie o odcieniu
zależnym od ilości światła i rozdrobnienia koloidalnego srebra.
2.
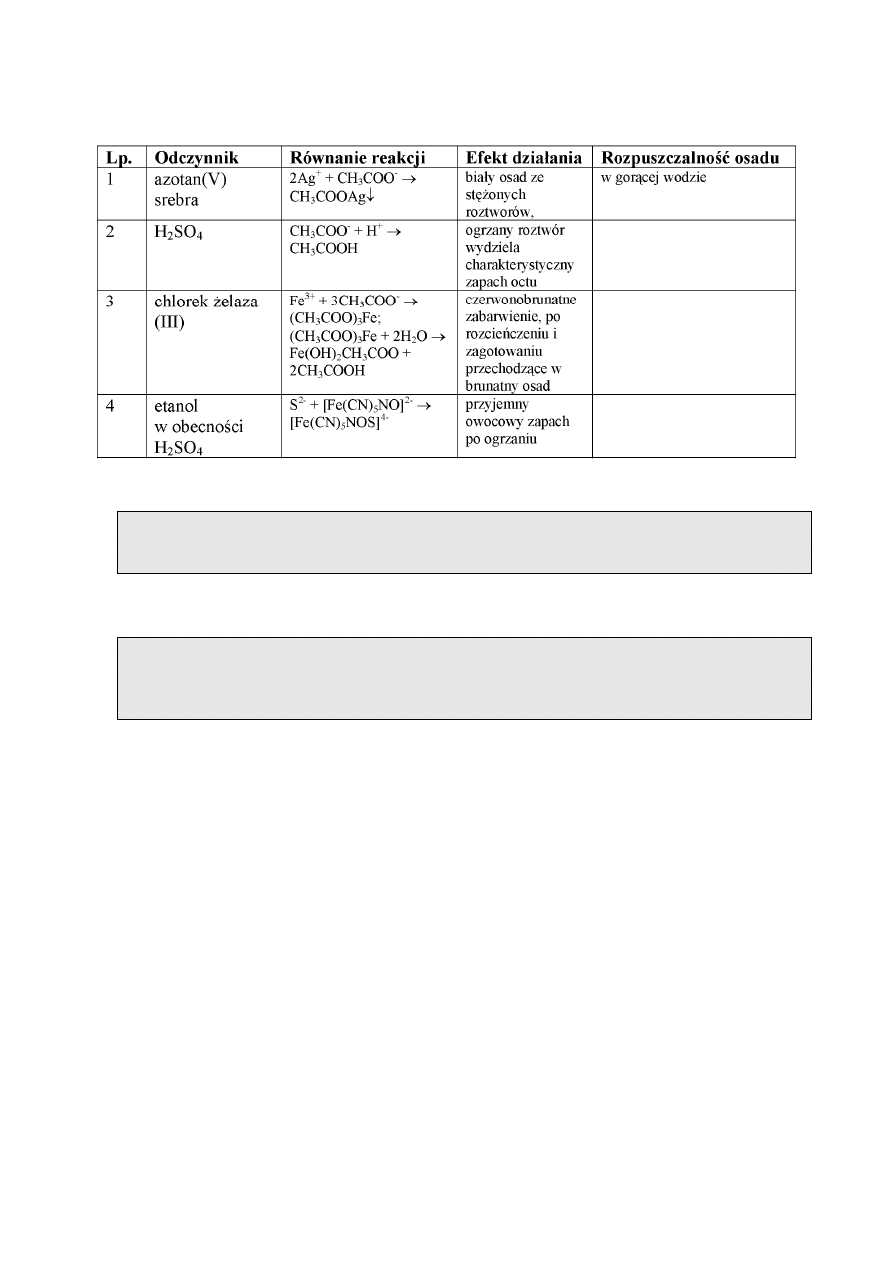
REAKCJE JONU OCTANOWEGO
Jon octanowy występuje w niewielkim stężeniu w kwasie octowym i w octanach. Kwas
octowy jest słabym kwasem organicznym, o charakterystycznym zapachu, w niewielkim stopniu
zdysocjowanym. Jego sole – octany są dobrze rozpuszczalne w wodzie, z wyjątkiem octanu
srebra i rtęci(I). W wodzie ulegają hydrolizie zgodnie z równaniem reakcji:
CH
3
COO
-
+ H
2
O → CH
3
COOH + OH
-
4
Wykonanie oznaczenia.
Do ok. 1 cm
3
badanego roztworu dodać ok. 0,5 cm
3
1 m H
2
SO
4
. Mieszaninę ogrzać
w płomieniu palnika. Ostrożnie powąchać wydzielające się opary. Charakterystyczny zapach
octu świadczy o obecności anionów octanowych z II grupy analitycznej anionów.
Wykonanie oznaczenia.
Do 5 – 10 kropel badanego roztworu dodawać kroplami roztwór FeCl
3
do uzyskania
czerwonobrunatnego zabarwienia roztworu. Rozcieńczyć roztwór niewielką ilością wody
destylowanej z tryskawki a następnie ogrzać w płomieniu palnika do zagotowania.
Wydzielający się brunatny osad świadczy o obecności anionów octanowych.
3.
REAKCJE JONU WĘGLANOWEGO
Anion węglanowy występuje w niewielkim stężeniu w rozcieńczonych roztworach kwasu
węglowego oraz w rozpuszczalnych w wodzie węglanach. Kwas węglowy jest bardzo
nietrwały, rozkłada się z wydzieleniem CO
2
. Węglany są trudno rozpuszczalne w wodzie, poza
węglanami litowców i amonu. W roztworach wodnych wykazują odczyn zasadowy wskutek
hydrolizy zachodzącej zgodnie z równaniami reakcji:
CO
3
2-
+ H
2
O → HCO
3
-
+ OH
-
HCO
3
-
+ H
2
O → H
2
CO
3
+ OH
-
Węglany dobrze się rozpuszczają w kwasach. W tabeli są podane reakcje charakterystyczne
jonu CO
3
2-
.
W tabeli są podane reakcje charakterystyczne jonu octanowego.

5
Wykonanie oznaczenia.
Do ok. 1 cm
3
badanego roztworu dodawać kroplami ok. 1 cm
3
1 m roztworu kwasu np. HCl,
HNO
3
czy H
2
SO
4.
Zaobserwowanie charakterystycznego perlenia się roztworu będącego
efektem wydzielania gazowego CO
2
może świadczyć o obecności anionu węglanowego CO
3
2-
z III grupy analitycznej anionów.
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodać kilka kropel chlorku baru BaCl
2
. Wydzielający się
biały osad może świadczyć o obecności anionów węglanowych. Osad rozpuszcza się
w rozcieńczonych kwasach (np. 1 m HCl, 1 m HNO
3
) z wydzielaniem się pęcherzyków gazu.
4.
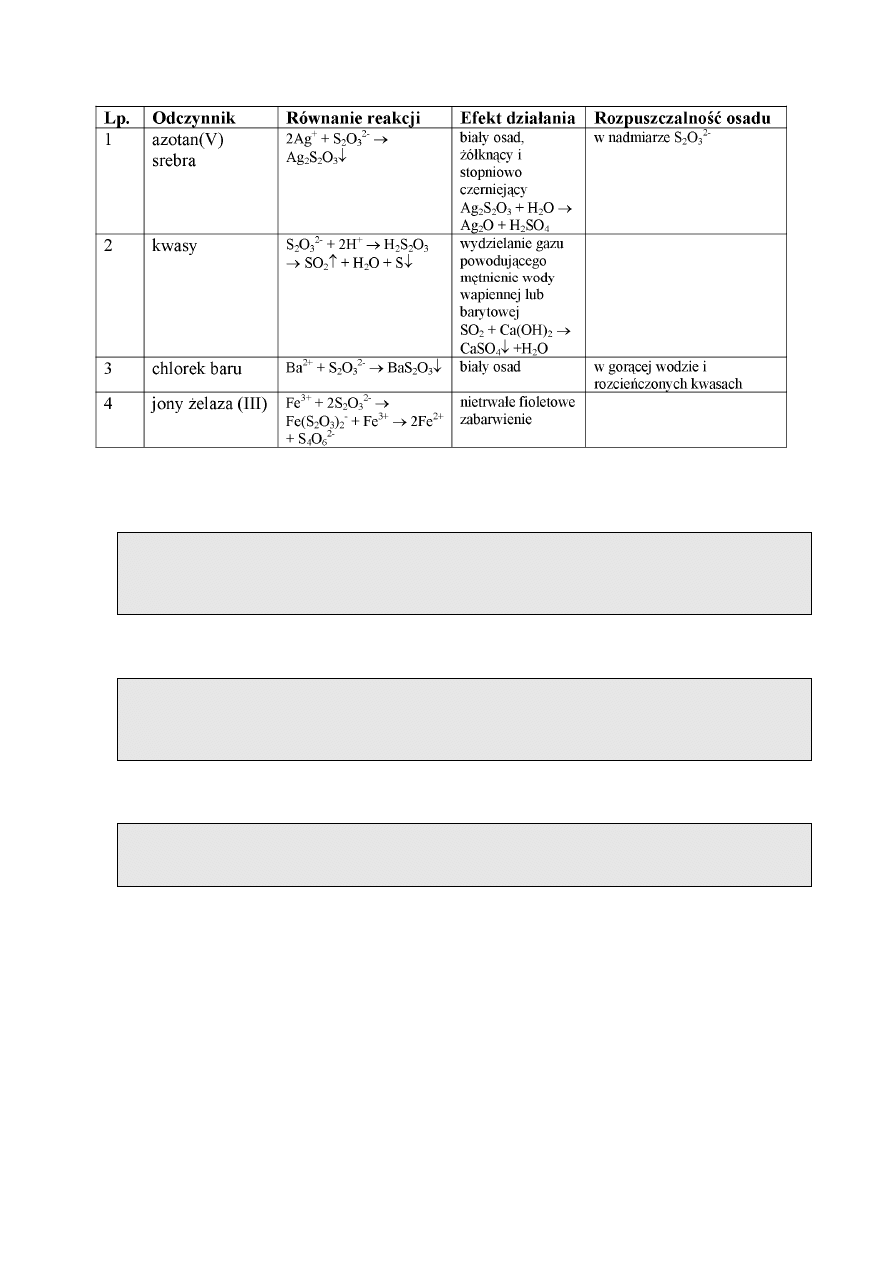
REAKCJE JONU TIOSIARCZANOWEGO(VI)
Anion tiosiarczanowy występuje jako jon w roztworach soli. Kwas tiosiarczanowy nie
jest znany w stanie wolnym, rozkłada się natychmiast na siarkę i ditlenek siarki(IV). Sole
tiosiarczanowe(VI) są trwałe i mają właściwości redukujące. Właściwości te wynikają z
obecności w jonie S
2
O
3
2-
siarki na -II stopniu utlenienia. Jon S
2
O
3
2-
utlenia się do jonu SO
4
2-
(pod działaniem silnych utleniaczy) i do jonu S
4
O
6
2-
(w wyniku działania słabszych
utleniaczy). Większość tiosiarczanów jest dobrze rozpuszczalna w wodzie, z wyjątkiem: soli
baru, miedzi(II), ołowiu(II), srebra(I).
Reakcje charakterystyczne jonu tiosiarczanowego(VI) są podane w tabeli.
6
Wykonanie oznaczenia.
Kilka kropel badanego roztworu zakwasić 1 m roztworem H
2
SO
4
. Powstawanie
charakterystycznego perlenia się roztworu świadczącego o wydzielaniu się gazowego SO
2
połączonego z wytrącaniem się żółtego osadu siarki może świadczyć o obecności jonów
tiosiarcznowych z IV grupy analitycznej anionów
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodać kilka kropel chlorku baru BaCl
2
. Probówkę odstawić
na 10 minut. Wydzielający się biały osad ( w postaci zmętnienia roztworu) może świadczyć
o obecności anionów tiosiarczanowych. Dodać ok. 1-2 cm
3
wody destylowanej i ogrzać
w płomieniu palnika do wrzenia. Osad rozpuszcza się w gorącej wodzie.
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodać kilka kropel chlorku żelazowego FeCl
3
. Powstające
fioletowe zabarwienie roztworu zanikające po pewnym czasie może świadczyć o obecności
jonów tiosiarczanowych.
5.
REAKCJE JONU FOSFORANOWEGO(V)
Anion fosforanowy(V) wchodzi w skład kwasu ortofosforowego(V) oraz ortofosforanów(V).
Kwas fosforowy(V) jest kwasem średniej mocy, dysocjującym trójstopniowo. Najwyższą
wartość ma stała pierwszego stopnia dysocjacji, dlatego w roztworze tego kwasu przeważają jony
H
2
PO
4
-
. Fosforany(V) są trudno rozpuszczalne w wodzie, z wyjątkiem soli litowców i
wodorofosforanów berylowców, które ulegają hydrolizie. Odczyn wodny roztworów soli jest
różny i zależy od rodzaju jonu fosforanowego. Jednometaliczne fosforany(V) litowców
wykazują odczyn słabo kwasowy, dwumetaliczne – słabo zasadowy, a trójmetaliczne – mocno
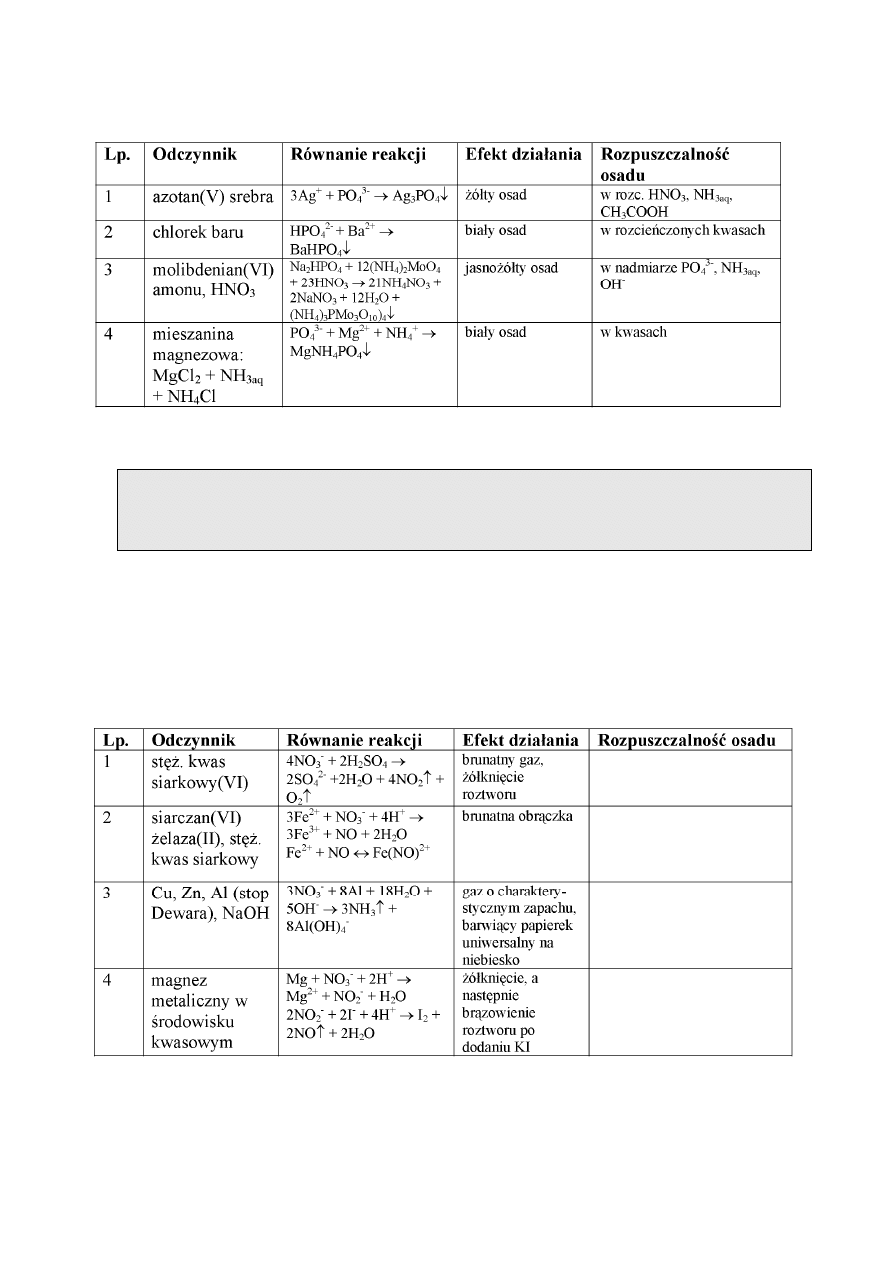
7
zasadowy. Reakcje charakterystyczne jonu fosforanowego(V) są podane w tabeli.
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodać kilka kropel molibdenianu amonowego
(NH
4
)
2
MoO
4
.
Po ściance probówki dodać 2-3 krople 1 m HNO
3
. Wydzielający się jasnożółty
osad może świadczyć o obecności anionów fosforanowych z IV grupy analitycznej anionów.
Osad rozpuszcza się w roztworach alkaliów (np. 1 m Na OH, 1 m KOH).
6.
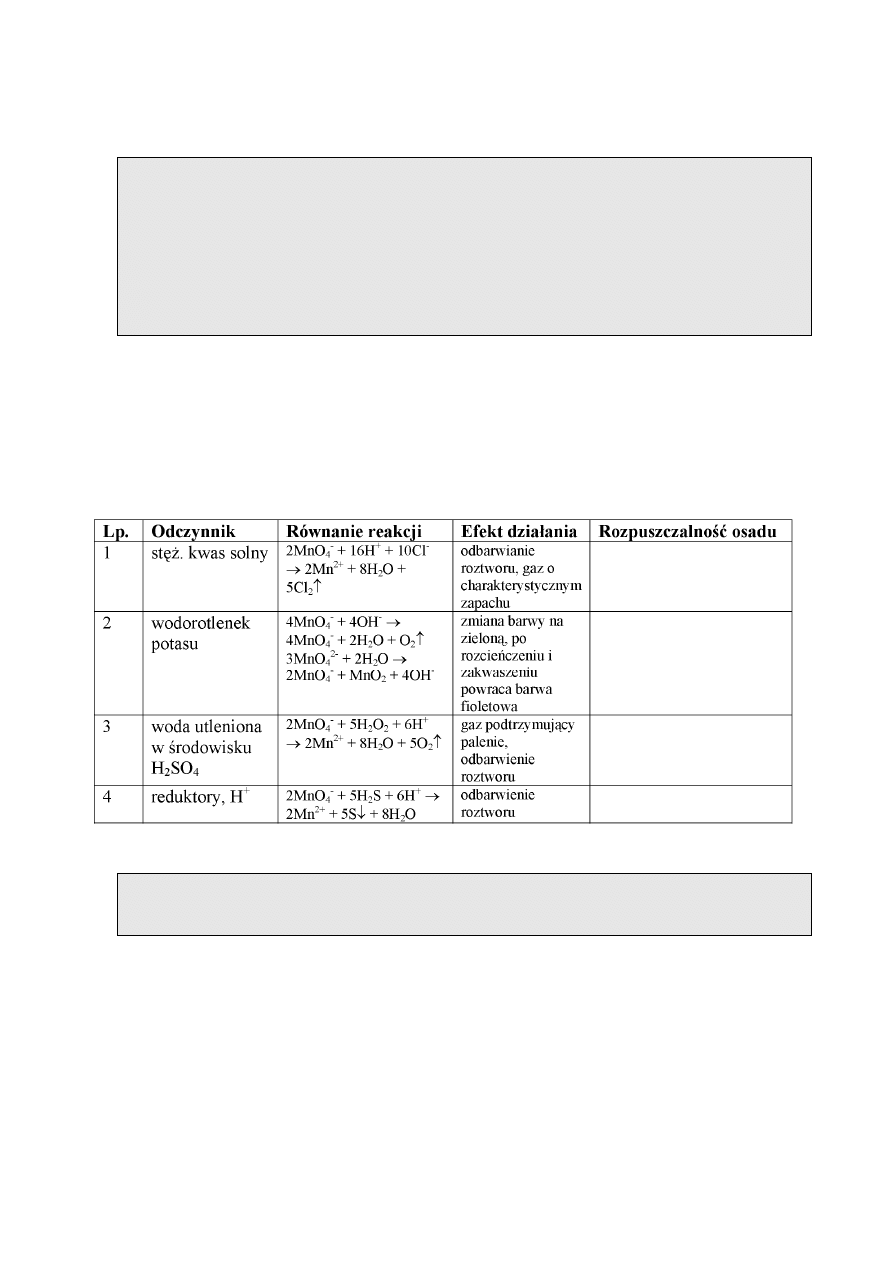
REAKCJE JONU AZOTANOWEGO(V)
Anion azotanowy występuje w mocnym, trwałym kwasie azotowym(V) i w azotanach(V).
Jon azotanowy(V) jest utleniaczem. Azotany(V) są dobrze rozpuszczalne w wodzie, z wyjątkiem
niektórych hydroksosoli (hydroksosoli bizmutu i antymonu). Reakcje charakterystyczne jonu
azotanowego(V) są podane w tabeli.
8
Wykonanie oznaczenia.
Wykonanie „reakcji obrączkowej”. Do probówki wprowadzić 0,5 cm
3
badanego roztworu,
następnie pod wyciągiem dodać 6-7 kropel stężonego kwasu siarkowego H
2
SO
4
(kwas
dodawać ostrożnie po ściankach probówki, obserwując efekt analityczny tej reakcji-patrz
reakcja nr 1 w tabeli). Ponieważ reakcja jest silnie egzotermiczna a powstający w wyniku
„reakcji obrączkowej” jon Fe(NO)
2+
jest nietrwały w wysokich temperaturach, po dodaniu
stężonego kwasu należy probówkę schłodzić pod strumieniem zimnej wody. Po ostudzeniu
próby ostrożnie, po ściance probówki, wprowadzić 1-2 krople roztworu FeCl
2
. Powstające
charakterystyczne brązowe zabarwienie w formie pierścienia (obrączki) w górnej warstwie
próby świadczy o obecności anionów azotanowych NO
3
-
z V grupy analitycznej anionów.
7.
REAKCJE JONU MANGANOWEGO(VII)
Anion manganowy(VII) jest jonem kwasu manganowego(VII), który nie występuje w stanie
wolnym i soli – manganianów(VII). Sole są dobrze rozpuszczalne w wodzie i barwią roztwór na
kolor fioletowy, dlatego są łatwe do identyfikacji. Reakcje jonu manganowego(VII) są podane w
tabeli.
Wykonanie oznaczenia.
Do ok. 0,5 cm
3
badanego roztworu dodać 5-6 kropel stężonego kwasu siarkowego H
2
SO
4
(operację należy wykonać pod wyciągiem) i 5-6 kropel H
2
O
2
. Odbarwienie się roztworu może
świadczyć o obecności anionów manganowych z V grupy analitycznej anionów.
8.
REAKCJE JONU SIARCZANOWEGO(VI)
Anion siarczanowy(VI) jest jonem bardzo mocnego, trwałego, kwasu siarkowego(VI) i jego
soli - siarczanów(VI). Kwas dysocjuje dwustopniowo, dlatego w jego roztworze znajdują się jony:
SO
4
2-
i HSO
4
-
.
Stężony kwas jest silnym utleniaczem, rozcieńczony nie posiada tej właściwości. Większość
siarczanów(VI) i wodorosiarczanów(VI) jest dobrze rozpuszczalna w wodzie. Do trudno
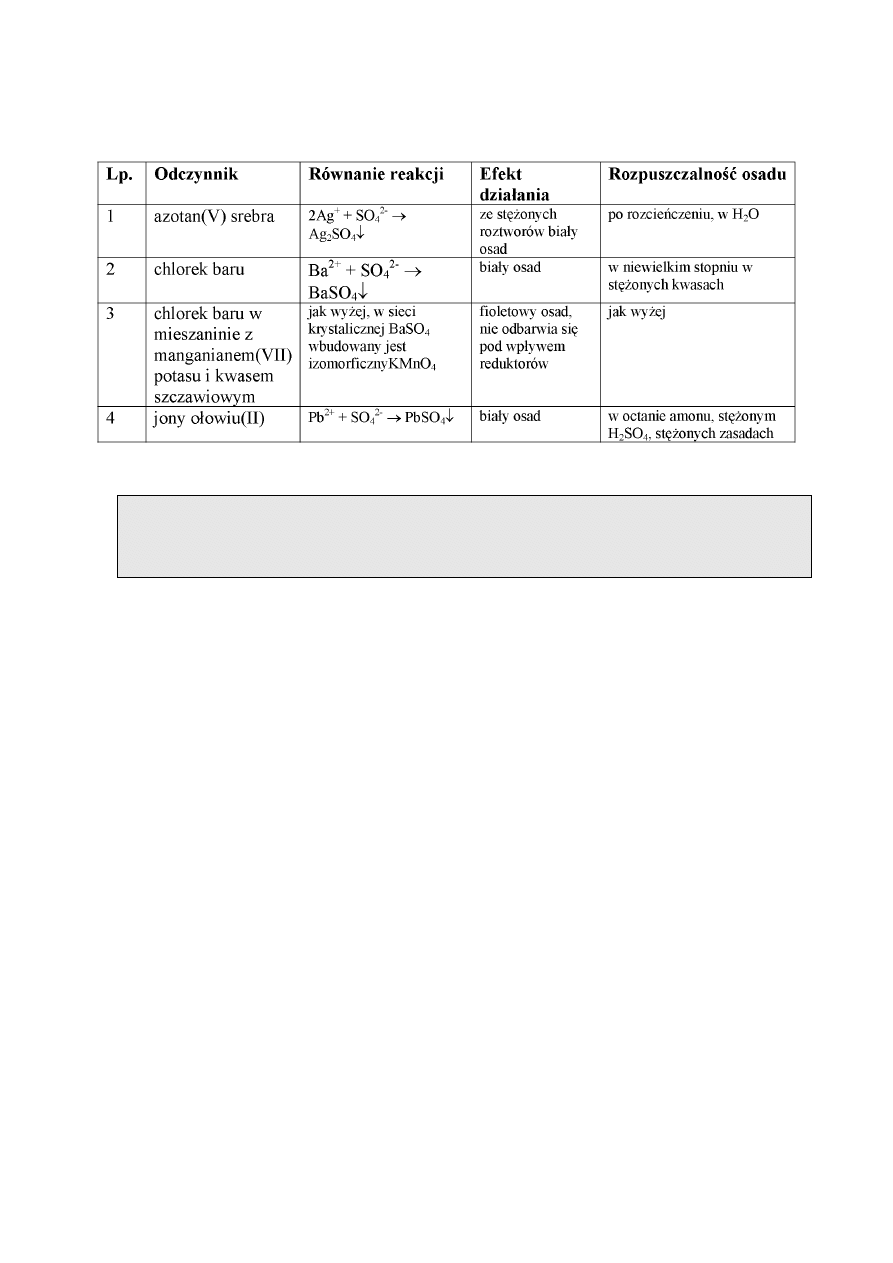
9
rozpuszczalnych należą: siarczany(VI) czwartej grupy analitycznej, siarczan(VI) ołowiu(II) i
siarczan(VI) rtęci(I). W tabeli są podane reakcje charakterystyczne jonu siarczanowego(VI).
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodawać kroplami roztwór z jonami Ba
2+
(np. BaCl
2
).
Wytrącający się biały osad może świadczyć o obecności anionów siarczanowych SO
4
2-
z VI
grupy analitycznej anionów. Po dodaniu rozcieńczonych kwasów (np. 1 m HCl), osad nie
rozpuszcza się.
9.
REAKCJE JONU KRZEMIANOWEGO
Anion krzemianowy jest jonem bardzo słabego kwasu metakrzemowego i jego soli –
metakrzemianów. Kwas metakrzemowy występuje w postaci koloidalnej i po zakwaszeniu
wydziela się z roztworu w postaci osadu o różnym składzie, zależnym od warunków strącania,
jest zapisywany w postaci nSiO
2
⋅ mH
2
O. Nie wyodrębniono czystych kwasów krzemowych.
Krzemiany są trudno rozpuszczalne, jedynie metakrzemiany litowców rozpuszczają się w
wodzie ulegając hydrolizie. Roztwory takie mają charakter silnie zasadowy i są nazywane
szkłem wodnym. Reakcje pozwalające zidentyfikować jon krzemianowy są zebrane w tabeli.
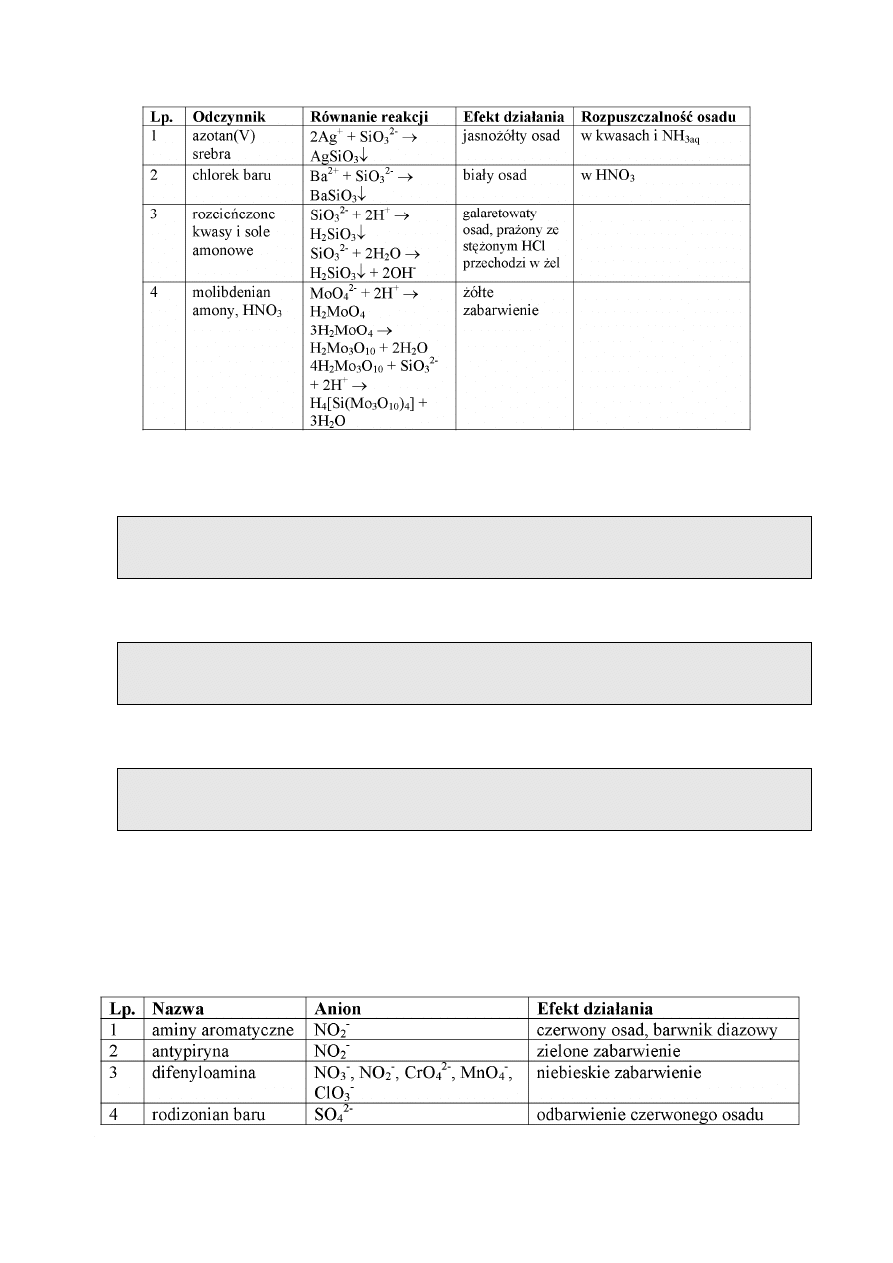
10
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodawać kroplami roztwór zawierający jony Ag
+
(np.
AgNO
3
). Wytrącanie się żółtobrązowego osadu świadczy o obecności anionów krzemianowych
z VII grupy analitycznej anionów. Osad rozpuszcza się w kwasach oraz NH
3
aq.
Wykonanie oznaczenia.
Do kilku kropel badanego roztworu dodać kilka kropel chlorku baru BaCl
2
. Wydzielający się
biały osad może świadczyć o obecności anionów krzemianowych. Osad rozpuszcza się w
kwasie azotowym HNO
3
.
Wykonanie oznaczenia.
Do ok. 1 cm
3
badanego roztworu dodać kilka kropel molibdenianu amonowego (NH
4
)
2
MoO
4
,
zakwasić 1 m HNO
3
. Pojawiające się żółte zabarwienie roztworu świadczy o obecności anionu
krzemianowego w roztworze.
Odczynniki organiczne stosowane w analizie anionów

11
Wyszukiwarka
Podobne podstrony:
Podział kationów na grupy analityczne i ich ogólna charakterystyka
Podział kationów na grupy analityczne
podział kationów na grupy analityczne, STUDIA (ochrona), ROK I, chemia, laboratoria
AJ Podział anionów na grupy analityczne. Reakcje I i i II gr, ~FARMACJA, I rok, chemia (ciul wie co)
Lokalizacja i podział maszyn na grupy
ćwiczenia nr 6, 06.Bakiera
ĆWICZENIE NR 06 - Oznaczanie granicy płynności wl, Mechanika Gruntów
PODZIAŁ PRODUKTÓW NA GRUPY
Lokalizacja i podział maszyn na grupy
0106 30 03 2009, cwiczenia nr 6 , Wrzeciono podziałowe Paul Esz(1)
LABORATORIUM PRACOWNI SPALANIA ZSZ PF 31 Informacja dla slucha, PODZIAú NA GRUPY ĂW. ZSZ-PF-31, PODZ
LABORATORIUM PRACOWNI SPALANIA ZSZ PF 31 Informacja dla slucha, PODZIAú NA GRUPY ĂW. ZSZ-PF-31, PODZ
podzial na grupy seminaryjne nr albumu
Podział na grupy konsultacyjne IPB 2014 2015 końcowy
II Energetyka - harmonogram i podział na grupy, Uczelnia, Semestr 4, Ciepło
Fwd zal, WM 9.15, Lista osób z podziałem na grupy:
więcej podobnych podstron