
Lista 5 – E n z y m y : p o d s t a w o w e p o j ę c i a i k i n e t y k a
- 1 z 3 -
B
IOCHEMIA
I
–
ĆWICZENIA
LISTA 5
do wykładu dr. hab. inż. P. Dobryszyckiego
E n z y m y : p o d s t a w o w e p o j ę c i a i k i n e t y k a
1. Co tworzy kombinacja apoenzymu z kofaktorem? Jakie są rodzaje ko faktorów? Co rozróżnia
grupę prostetyczną od kosubstratu?
2. Które z poniższych stwierdzeń jest poprawne? Zmiana energii swobodnej reakcji:
(a) jeżeli jest ujemna to umożliwia spotaniczne zachodzenie reakcji.
(b) jeżeli jest pozytywna to umożliwia spotaniczne zachodzenie reakcji.
(c) jest większa niż zero kiedy reakcja jest w stanie równowagi.
(d) Określa szybkość w której reakcja osiągnie równowagę.
3. Jeżeli standardowa zmiana energy swobodnej (ΔG°) dla reakcji wynosi 0, to które z poniższych
stwierdzeń o reakcji są prawdziwe?
(a) Entropia (ΔS°) reakcji wynosi 0.
(b) Entalpia (ΔH°) reakcji wynosi 0.
(c) Stała równowagi dla reakcji wynosi 0.
(d) Reakcja jest w równowadze.
(e) Stężenia substratów i produktów wynoszą 1 M w równowadze.
4. Enzym izomeraza triozofosoforanowa katalizuje następującą reakcję:
ΔG°' dla tej reakcji wynosi 1.83 kcal/mol. W świetle tych informacji, które z poniższych stwierdzeń
są prawidłowe?
(a) Reakcja będzie przebiegać spontanicznie od lewej do prawej strony w standardowych warunkach.
(b) Stała szybkości reakcji w kierunku odwrotnym jest wyższa niż stała szybkości reakcji w kierunku do
przodu w stanie równowagi.
(c) Stała równowagi w warunkach standardowych faworyzje syntezę cząsteczki po lewej stronie,
fosfodihydroksyaceton?
(d) Dane podane w zadaniu wystarczają do obliczenia stałej równowagi reakcji.
(e) Dane podane w zadaniu wystarczają do obliczenia stałej szybkości k
1
.
5. Fosdorylaza glikogenu, enzyme zaangażowany w metabolism polimeru węglowodorowego –
glikogenu, katalizuje reakcję:
Bazując na tych danych, które ze stwierdzeń są prawidłowe?
(a) Fosforylaza glikogenu normalnie rozkłada glikogen w metabolizmie komrowym, a paradoksalnie
stała równowagi reakcji faworyzuje syntezę glikogenu.
(b) ΔG°' dla tej reakcji wynosi 1.43 kcal/mol w 25°C.
(c) Fosforolityczne rozcięcie glikogenu konsumuje energię, czyli jest endoergiczne.
(d) Jeżeli stosunek fosforanu do glukozo-1-fosforanu w komórkach jest wystarczająco wysoki,
fosforylaza będzie degradować glikogen.
k
1
fosfodihydroksyaceton aldehyd-3-fosfoglicernowy
k
-1
Glikogen
n
+ fosforan glukozo-1-fosforan + glikogen
n-1
K'
eq
= 0,088
Lista 5 – E n z y m y : p o d s t a w o w e p o j ę c i a i k i n e t y k a
- 2 z 3 -
6. Stan przejściowy reakcji katalizowanej enzymatycznie, która przekształca substrat w produkt:
(a) to przejściowy intermediat formowany zgodnie z kierunkiem reakcji.
(b) ma wyższą energię sowobodną niż substraty i produkty?
(c) jest najliczniejszym rodzajem cząstek w reakcji.
(d) jego stężenie jest zwiększane ponieważ enzym ściśle się z nim wiąże.
(e) determinuje szybkość reakcji.
7. Które z poniższych stwierdzeń są prawdziwe? Enzymatyczna kataliza reakcji chemicznej:
(a) obniża ΔG' tak aby reakcja mogła zachodzić spontanicznie
(b) podwyższa energię stanu przejściowego.
(c) nie zmienia ΔG°', ale raczej stosunek produktu do substartu w rówowadze.
(d) obniża entropię reakcji.
(e) Zwiększa szybkość reakcji zachodzącej w kierunkach do przodu i odwrotnej.
8. Które z poniższych stwierdzeń dotyczących kompleksu enzym-substrat (ES) są prawdziwe?
(a) Stabilność termiczna enzymu często zmienia się pod wpływem związania substartu?
(b) Przy wystarczająco wysokich stężeniach substartu, miejsca katalityczne enzymu są całkowicie
wysycone i reakcja osiąga szybkość maksymalną.
(c) Kompleks enzym-substrat może być wyizolowany (oczyszczony).
(d) Kompleksy enzym-substrat może być zobrazowany za pomocą krystalografii rentgenowskiej.
(e) Zmiany spektroskopowe w substracie bądź enzymie moga być użyte do wykrycia formowania
kompleksu enzym-substart
9. Które z poniższych stwierdzeń dotyczących prostej kinetyki enzymatycznej typu Michaelis-
Menten są poprawne?
(a) Szybkość maksymalana V
max
jest powiązana z maksymalna liczbą cząsteczek substratu jaka może być
skonwertowana w jednostce czasu przez cząsteczkę enzymu.
(b) K
M
jest wyrażona w jednostkach szybkości rekacji (np. mol s
-1
).
(c) K
M
jest stałą dysocjacji kompleksu enzym substart.
(d) K
M
jest stężeniem substratu wymaganego do osiągnięcia połowy V
max
.
(e) K
M
jest stężeniem substratu wymaganym do przekształcenia połowy całkowtego stężenia enzymu w
kompleks enzym-substrat.
10. Wyjaśnij związek pomiędzy K
M
a stałą dysocjacji kompleksu enzym substrat, K
ES
.
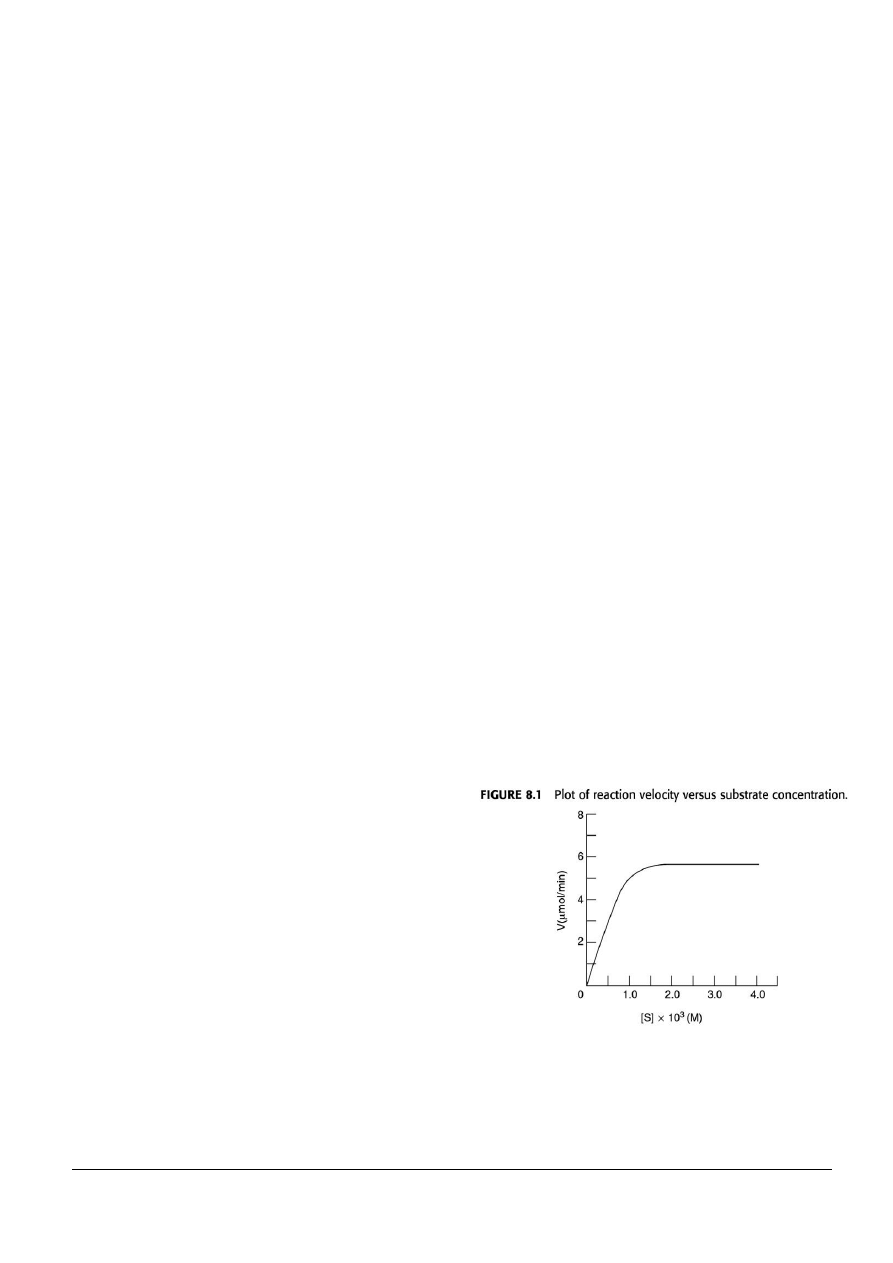
11. Z wykresu szybkości w funkcji stężenia
substratu pokazanym na rysunku 8.1 oblicz
poniższe parametry. (ilość enzymu w
miksturze reakcyjnej wynosi 10
-3
μmol.)
(a) K
M
(b) V
max
(c) k
2
/ K
M
(d) liczbę obrotów
12. Jakie jest znaczenie stosunku k
cat
/K
M
?
Lista 5 – E n z y m y : p o d s t a w o w e p o j ę c i a i k i n e t y k a
- 3 z 3 -
13. Które z poniższych stwierdzeń jest prawidłowe? Liczba obrotów dla chymotrypsyny wynosi 100 s
-1
a dla polimerazy DNA 15 s
-1
. To oznacza, że:
(a) chymotrypsyna wiąże swój substrat z wyższym powinowactwem niż polimeraza DNA.
(b) szybkość reakcji chymotrypsyny jest zawsze większa niż rekacji polimerazy DNA.
(c) szybkość reakcji chymotrypsyny przy szczególnym stężeniu enzymu i wysyceniu substratem, jest
niższa niż polimerazy DNA w tych samych warunkach.
(d) Szybkości reakcji katalizowanych przez oba enzymy przy wysyceniu substartem mogą być równe
jeśli użyje się 6.7 raza więcej polimerazy DNA niż chymotrypsyny.
14. Enzym heksokinaza katalizuje następującą reakcję:
glukoza + ATP glukozo-6-fosforan + ADP
Dla tej reakcji ΔG°' = -4.0 kcal/mol.
(a) Oblicz zmianę energii swobodnej ΔG' dla tej reakcji w typowych warunkach komórkowych używając
następujących stężeń: glucose, 55 mM; ATP, 5.0 mM; ADP, 1.0 mM; i glukozo-6-fosforan, 0.1 mM.
Proszę przyjąć, że temperatura wynosi 25°C.
(b) W typowej komórce, czy reakcja katalizowana przez heksokinazę jest zbliżona do stanu równowagi
czy daleko od niego? Wyjaśnij.
15. Które z poniższych stwierdzeń o różnych typach inhibicji (hamowania aktywności) enzymów są
poprawne?
(a) Hamowanie konkurencyjne zachodzi kiedy substrat konkuruje z enzymeme o wiązanie do białka
inhibitorowego.
(b) Hamowanie konkurencyjne zachodzi kiedy substrat i inhibitor konkurują o to samo miejsce aktywne
enzymu.
(c) Niekonkurencyjne hamowanie enzymu nie można usunąć przez dodanie dużych ilości substratu.
(d) Inhibitory konkurencyjne są często podobne w strukturze chemicznej do substartu hamowanego
enzymu.
(e) Inhibitory niekonkurencyjne często wiążą się do enzymu nieodwracalnie.
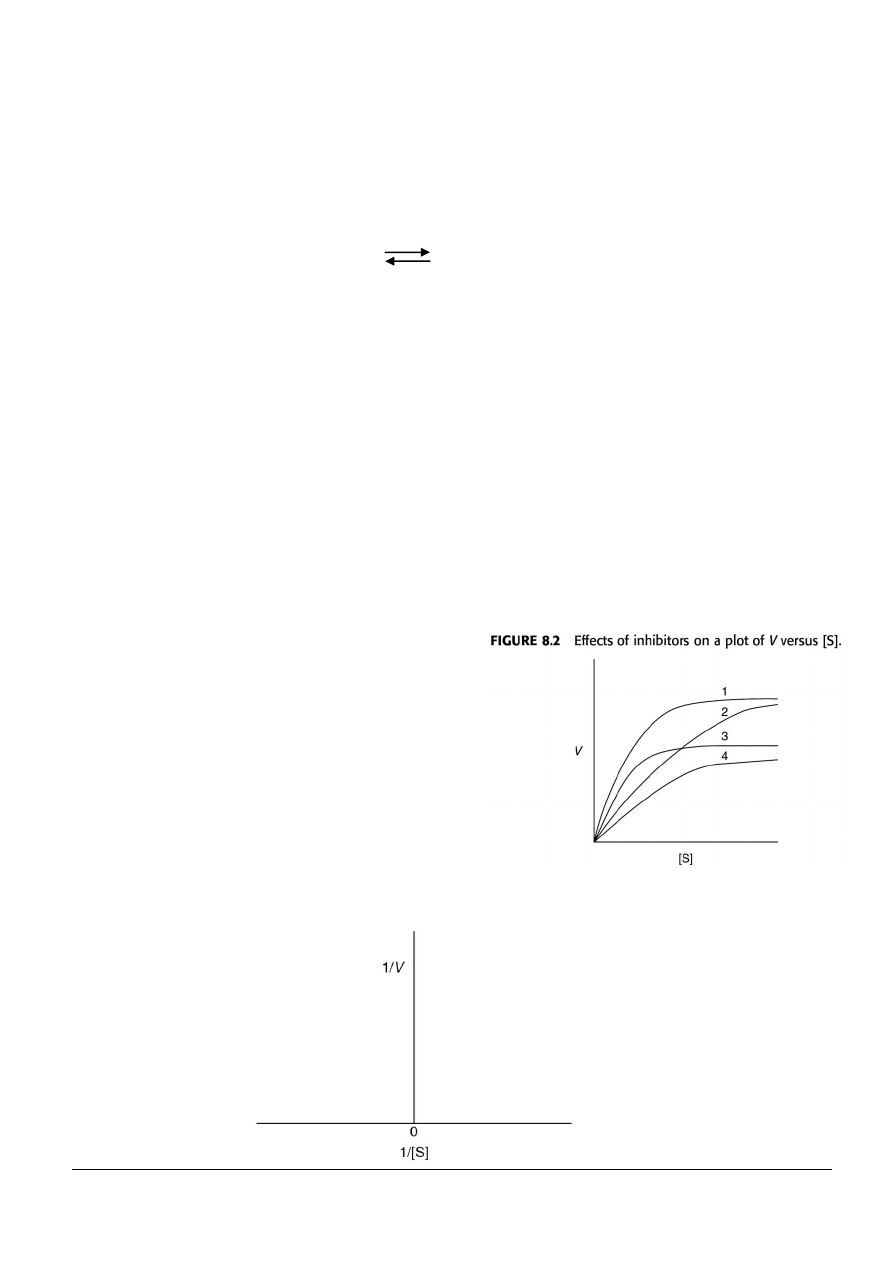
16. Dane kinetyczne dla reakcji enzymatycznej w
obecności
i
niobecności
inhibitora
są
narysowane
na
rysunku
8.2.
Proszę
zidentyfikować odpowiednie krzywe:
(a) Brak inhibitora.
(b) Inhibitor miekonkurencyjny.
(c) Inhibitor konkurencyjny.
(d) Hamowanie mieszane.
17. Proszę narysować w przybliżeniu wykresy
Lineweaver-Burka dla każdego typu hamowania z zadania 16.
Wyszukiwarka
Podobne podstrony:
Biochemia I Lista 02 PL id 86389 (2)
Biochemia I Lista 01 PL id 86385 (2)
Biochemia I - Lista 10 PL, biochemia I
Biochemia I Lista 06 PL(1)
Biochemia I Lista 07 PL
Biochemia I - Lista 11 PL, biochemia I
Biochemia I, Lista 07 PL
Biochemia I Lista 03 PL(1)
Biochemia I Lista 04 PL
Biochemia I, Lista 04 PL
Biochemia I, Lista 05
Biochemia I Lista 08 PL
Biochemia I - Lista 10 PL, biochemia I
więcej podobnych podstron