
1
PRACOWNIA Z WYBRANYCH ZAGADNIEŃ
Z KATALIZY
ĆWICZENIE I
WYZNACZANIE PARAMETRÓW KINETYCZNYCH REAKCJI
ROZKŁADU H
2
O
2
W UKŁADZIE HETEROGENICZNYM
KATEDRA CHEMII MATERIAŁÓW, ADSORPCJI I KATALIZY
WYDZIAŁ CHEMII UMK TORUŃ
2
1.0. WSTĘP
Węgiel aktywowany ma szerokie zastosowanie jako katalizator i nośnik substancji
katalitycznie czynnych w różnych procesach przemysłowych. Badając aktywność materiałów
węglowych w procesie rozkładu H
2
O
2
wnioskujemy o ich własnościach katalitycznych.
Badania kinetyki rozkładu H
2
O
2
przeprowadza się metodą objętościową
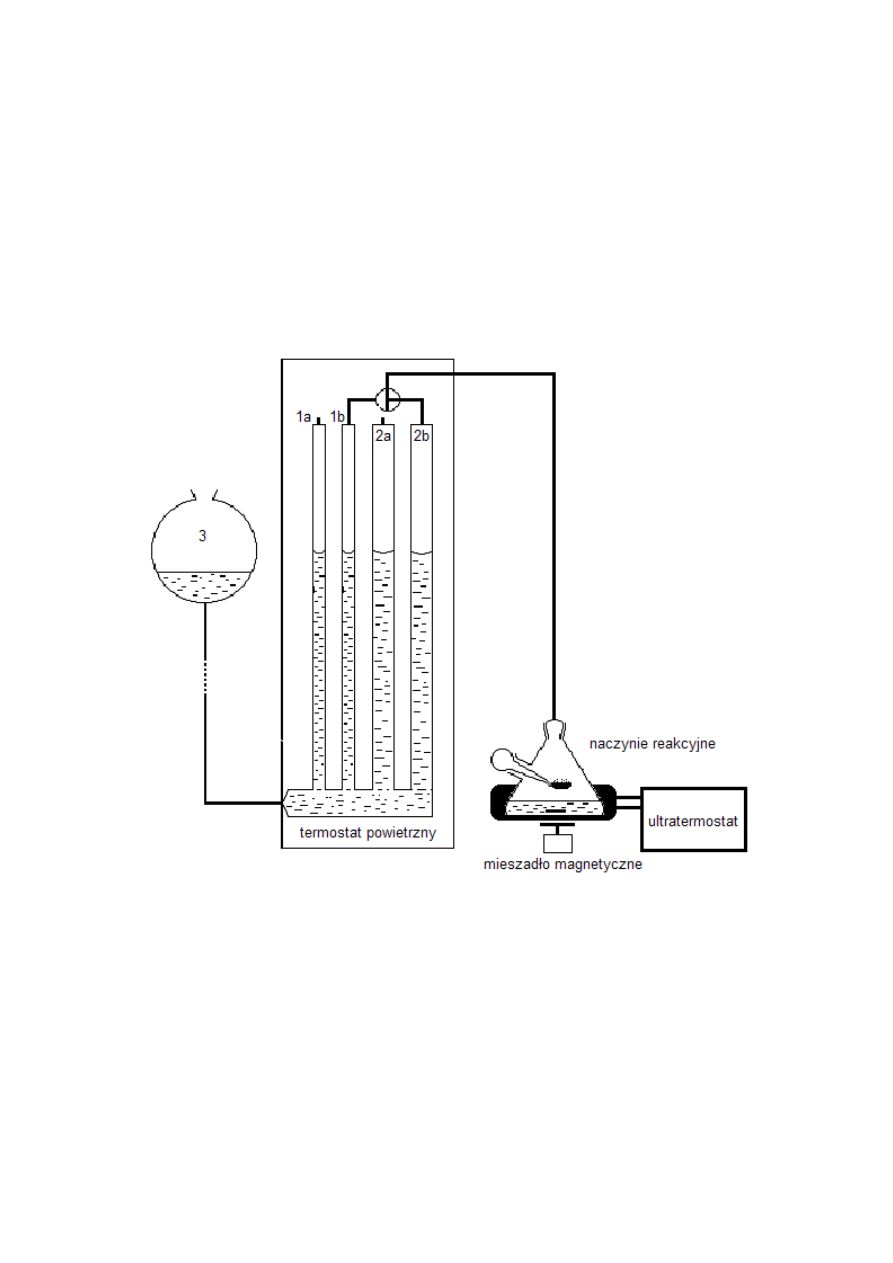
(gazometryczną) w aparaturze widocznej na rysunku poniżej.
Rysunek 1. Schemat zestawu do badania reakcji katalitycznego rozkładu H
2
O
2
.
1a, 2a – biurety porównawcze
1b, 2b – biurety pomiarowe
3 – naczynie wyrównawcze

3
Zasadniczym elementem tej aparatury jest naczynie reakcyjne, które jest połączone z
jedną z dwóch biuret pomiarowych (1b lub 2b). Do wyrównywania poziomu cieczy w
biuretach służy umieszczone na prowadnicy naczynie wyrównawcze (3). Odczytu dokonuje
się przy wyrównanym poziomie cieczy w biurecie pomiarowej oraz biurecie porównawczej
(1a lub 2a) o identycznej średnicy.
Temperatura 30
o
C w termostacie powietrznym utrzymywana jest przez układ grzałek
sprzężonych przez układ przekaźnikowy z termostatem elektronicznym.
Zadana temperatura w naczyniu reakcyjnym utrzymywana jest przez ultratermostat z
zamkniętym obiegiem cieczy w płaszczu naczyńka.
2.0 PRZRBIEG POMIARU.
Do naczyńka reakcyjnego należy wlać 25 cm
3
3% roztworu H
2
O
2
, natomiast badany
węgiel w ilości około 0,025 g oraz mieszadło magnetyczne umieścić na łyżeczce obrotowej.
Naczyńko pomiarowe po wprowadzeniu łyżeczki połączyć z układem biuret, przez
odpowiednie ustawienie kranu trójdrożnego. Włączyć mieszadło magnetyczne.
Po osiągnięciu przez układ reakcyjny zadanej temperatury (ok. 10 minut), do roztworu
H
2
O
2
o określonym stężeniu wprowadzić katalizator (węgiel aktywowany), poprzez obrót
łyżeczki. Od momentu wsypania próbki do roztworu H
2
O
2
mierzyć czas reakcji. Ilość tlenu
wydzielonego w reakcji rozkładu H
2
O
2
odczytywać przy ciśnieniu atmosferycznym (tzn. po
wyrównaniu poziomu cieczy w biuretach, poprzez zmianę położenia naczynia
wyrównawczego). Po upływie określonego przez prowadzącego czasu (15 minut – 3 godzin)
reakcje przerwać.
3.0 SCHEMAT WYKONYWANYCH OBLICZEŃ.
Obliczenia należy wykonać zgodnie z poniższym schematem:
1. Przeliczenie wartości odczytanej z biurety na objętość całkowitą wydzielonego gazu:
odcz
cal
L
b
V
×
=
(1)
gdzie: V
cal
– całkowita objętość wydzielonego gazu [cm
3
]
L
odcz.
– wielkość odczytana z biurety [cm]

4
b – stała kalibracyjna
Metodą wagową, wyznaczone zostały stałe kalibracyjne:
b = 1,45198
- dla biurety dużej
b = 0,27344
- dla biurety małej
2. Rzeczywistą objętość tlenu
(
)
2
3
O
V
cm
é
ù
ë
û w układzie obliczyć ze wzoru:
cal
atm
0
O
H
atm
O
V
p
p
p
V
2
2
×
-
=
(2)
Liczbę mmoli otrzymanego tlenu wyliczyć z równania:
10
RT
V
)
p
p
(
n
2
2
2
O
0
O
H
atm
O
×
×
-
=
(3)
gdzie:
2
O
n
– liczba mmoli wydzielonego tlenu,
p
atm.
– ciśnienie atmosferyczne [hPa],
0
O
H
2
p
– prężność nasyconej pary wodnej [hPa] w temperaturze pomiaru,
R – stała gazowa
úû
ù
êë
é
× K
mol
J
,
T – temperatura pomiaru [K].
Tabela 3 Wartości prężności nasyconej pary wodnej w różnych temperaturach.
temp
[
o
C]
0
O
H
2
p
[hPa]
10
12,28
15
17,05
20
23,39
25
31,68
30
42,46
35
56,23
40
73,81
45
95,83

5
3. Liczbę milimoli nadtlenku wodoru pozostałego w układzie reakcyjnym obliczyć z:
]
mmol
[
nO
2
25
C
n
2
pocz
O
H
2
2
×
-
×
=
(4)
gdzie:
2
2
O
H
n
– stężenie H
2
O
2
w czasie t
4. Zmiany stężenia podczas rozkładu nadtlenku wodoru obliczyć z:
]
mmol
[
25
n
C
2
2
O
H
=
(5)
gdzie: C – stężenie H
2
O
2
w czasie t
Wyniki przeprowadzonych badań zmian stężenia H
2
O
2
w funkcji czasu dla
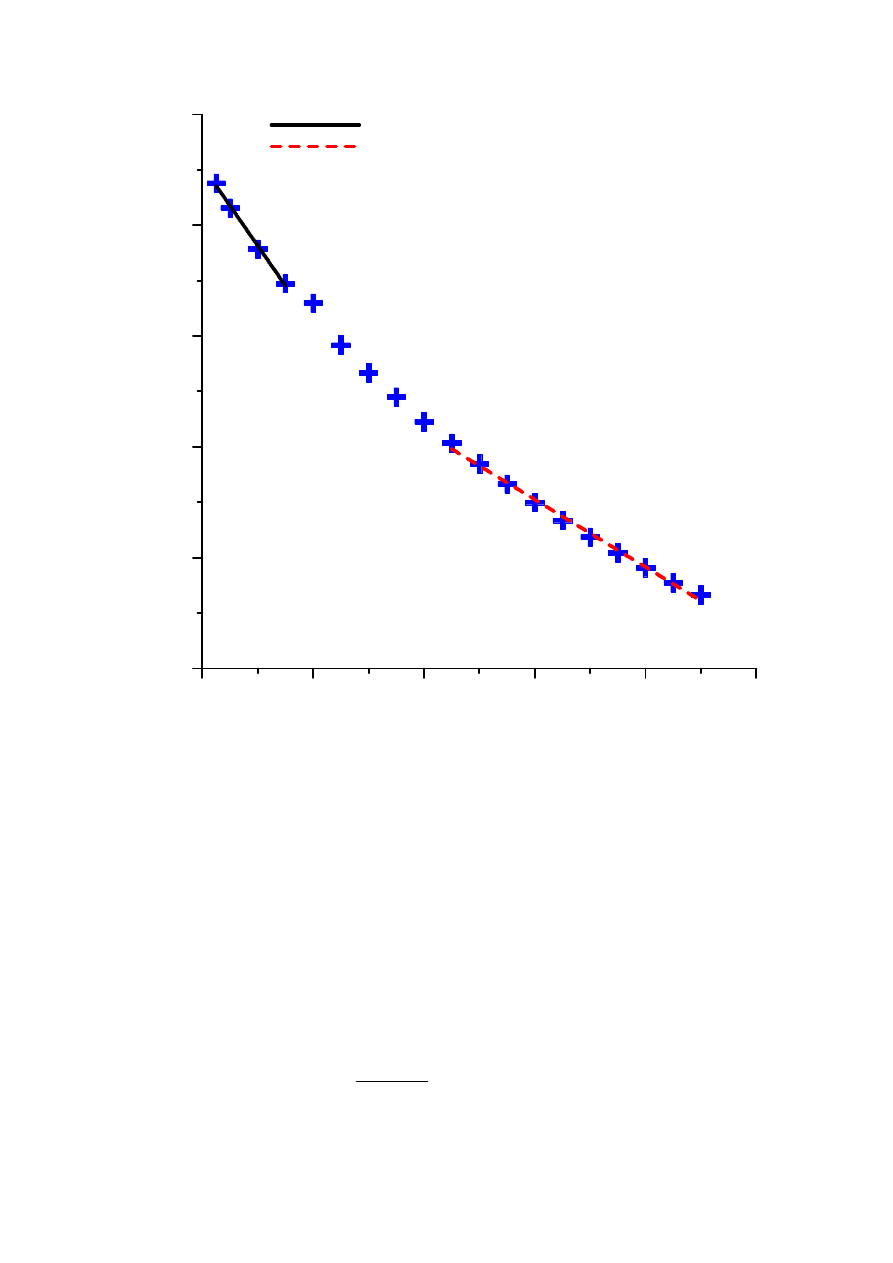
poszczególnych katalizatorów w różnych temperaturach przedstawia się na wykresach
( )
2 2
H O
ln C
f t
=
(6)
Kształt krzywych wskazuje, że dla zastosowanych stężeń H
2
O
2
proces zachodzi w
obszarze kinetycznym jedynie przez około 0.5 h, a po upływie 1.5 h zachodzi praktycznie w
obszarze dyfuzyjnym.
6
0
40
80
120
160
200
Czas [min]
-1.2
-1
-0.8
-0.6
-0.4
-0.2
ln
C
H
2O
2
Obszar kinetyczny - Y = -0.007209460995 * X - 0.2927875722
Obszar dyfuzyjny - Y = -0.00304423239 * X - 0.5296079739
Rysunek 2. Krzywa kinetyczna rozkładu nadtlenku wodoru na materiale węglowym.
4.0 WYZNACZANIE PARAMETRÓW KINETYCZNYCH REAKCJI ROZKŁADU
H
2
O
2
Logarytmując zmiany stężenia H
2
O
2
w czasie (Wykres
( )
2 2
H O
ln C
f t
=
) otrzymuje się
krzywe zależności tych zmian od czasu. Wykresy te są liniami prostymi. Stała szybkość
reakcji „k
hom
" jest współczynnikiem kierunkowym tych prostych.
dt
)
c
(ln
d
k
2
HO
hom
-
=
(7)

7
Przy założeniu, że reakcja rozkładu H
2
O
2
przebiega zgodnie z równaniem pierwszego
rzędu. Zakłada się, że stałe szybkości reakcji wyznaczone z wykresów są stałymi szybkości
reakcji pseudo homogenicznych.
Stałe szybkości reakcji wyznaczyć można graficznie na podstawie wykresu
zależności
( )
2 2
H O
ln C
f t
=
, zarówno dla obszaru kinetycznego jak i dyfuzyjnego.
Rysunek 2 przedstawia zależność i sposób na podstawie, którego wyznacza się
homogeniczne stałe szybkości reakcji rozkładu nadtlenku wodoru dla obszaru kinetycznego i
dyfuzyjnego.
Na podstawie wielkości homogenicznej stałej szybkości oblicza się kolejno
heterogeniczną stałą szybkości k
het
oraz specyficzną stałą szybkości k
m
. Obliczenia dokonuje
się zgodnie z poniższymi wzorami:
cat
cat
hom
sol
het
m
A
m
k
V
k
÷
ø
ö
ç
è
æ
=
(8)
i
cat
hom
sol
m
m
k
V
k
=
(9)
gdzie: k
het
– heterogeniczna stała szybkości reakcji [cm/s]
k
m
– specyficzna stała szybkości reakcji [cm
3
/s g]
cat
m
A
÷
ø
ö
ç
è
æ
– specyficzna powierzchnia katalizatora
V
sol
– objętość roztworu zawierającego katalizator
m
cat
– masa katalizator.
5.0 WYZNACZANIE ENERGII AKTYWACJI REAKCJI ROZKŁADU H
2
O
2
Logarytmując zmiany stężenia H
2
O
2
otrzymamy krzywe zależności tych zmian od
czasu. Wykresy te są liniami prostymi. Stała szybkość reakcji „k" jest współczynnikiem
kierunkowym tych prostych. Przy założeniu, że reakcja rozkładu H
2
O
2
przebiega zgodnie z
równaniem pierwszego rzędu. Zakłada się, że stałe szybkości reakcji wyznaczone z wykresów
są stałymi szybkości reakcji homogenicznych.
Stała szybkości reakcji jest funkcją temperatury, przedstawioną najczęściej
empirycznym równaniem Arrheniusa:

8
RT
E
a
Ae
k
-
=
gdzie: k – stała szybkości reakcji; E
a
– energia aktywacji; R – stała gazowa;
T – temperatura [K]; A – tzw. czynnik częstości uznawany za wartość stałą
Zlogarytmowanie równania Arrheniusa prowadzi do wyrażenia:
RT
E
A
ln
k
ln
a
-
=
Energię aktywacji oblicza się ze wzorów:
Dla większości reakcji chemicznych E
a
wahają się w granicach od
kilkudziesięciu do kilkuset kJ/mol.
R
a
E
A
b
R
E
a
b
ax
y
)
T
1
(
f
k
ln
a
a
×
-
=
=
-
=
+
=
=
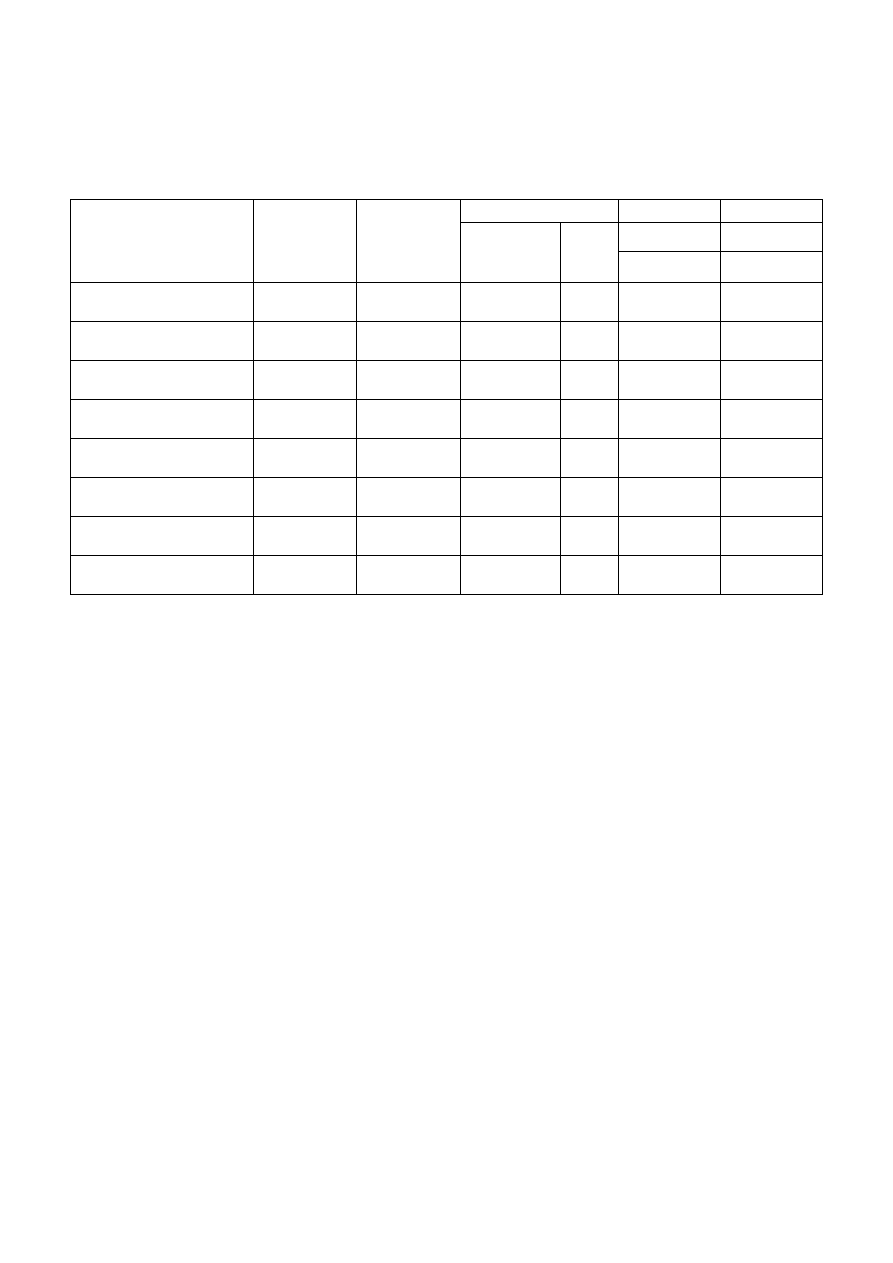
9
Tabela 4. Zestawienie wielkości stałych kinetycznych uzyskanych z badania rozkładu
nadtlenku wodoru metodą objętościową
( T
(komory)
= ............. K, C ≈.............%).
Rodzaj węgla
masa próbki
węgla
[mg]
temperatura
[
o
C]
K
hom
K
het
K
m
*
10
-3
[1/s]
R
2
*
10
-3
[1/s] [cm
3
/s
*
g]
obszar
kinetyczny
obszar
kinetyczny
obszar
kinetyczny
6.0 WYKONANIE DOŚWIADCZENIA I OPRACOWANIE WYNIKÓW
1. Wyznaczyć zależność ln(C
H2O2
) = f(t) i na jej podstawie wyznaczyć parametry
kinetyczne reakcji rozkładu H
2
O
2
,
2. Wyznaczyć energię aktywacji i sporządzić odpowiedni wykres,
3. Uzyskane wyniki przedstawić w formie tabeli,
4. Jakie mają znaczenie poszczególne parametry?,
5. Wnioski.
7.0 LITERATURA
[1] S. Biniak, M. Walczyk, G.S. Szymański, Modified Porous Carbon Materials as Catalytic
Support for Cathodic Reduction of Dioxygen, Fuel Processing Technology 79 (2002) 251–
257
[2] Walczyk M., Wpływ zasadowych właściwości powierzchni elektrodowych materiałów
węglowych na przebieg elektrokatalitycznej redukcji tlenu, Praca magisterska, Toruń 2001.
Document Outline
Wyszukiwarka
Podobne podstrony:
Katalityczny rozkład nadtlenku wodoru
Katalityczny rozkład nadtlenku wodoru
Katalityczny rozkład nadtlenku wodoru
Katalityczne utlenianie SO2 powietrzem ZUSM (uproszczone)
4 nadtlenek wodoru redoks
08 Katalityczny rozkład
KATALITYCZNY ROZKŁAD WODY UTLENIONEJ, CHEMIA
Wartość rokownicza stężenia nadtlenku wodoru w kondensaW, Ratownictwo Medyczne, wykłady
nadtlenek wodoru, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
NADTLENEK WODORU30, BHP KARTA CHARAKTERYSTYKI SUBSTANCJI NIEBEZPIECZNEJ
katalityczny rozklad wody
Katalityczny rozkład wody utlenionej, Katalityczny rozkład wody utlenionej
4 Nadtlenek wodoru
więcej podobnych podstron