
1
BIOCHEMIA
materiały dydaktyczne dla studentów WNoZ
Mirosława Kaszkowiak, Krzysztof Kaszkowiak
Spis treści
REGULAMIN.........................................................................................
2
ZASADY BEZPIECZEŃSTWA I HIGIENY PRACY …………………..
3
1.WĘGLOWODANY.............................................................................
4
1.1 JEDNO- i DWUCUKRY ...................................................................
4
1.2 WIELOCUKRY.................................................................................
10
2. TŁUSZCZE ......................................................................................
13
2.1. TŁUSZCZE PROSTE.......................................................................
13
2.2 TŁUSZCZE ZŁOŻONE ....................................................................
15
3. AMINOKWASY i BIAŁKA ............................................................
17
3.1. AMINOKWASY ............................................................................
18
3.2. BIAŁKA ..........................................................................................
21
4. KWASY NUKLEINOWE.................................................................
25
5. ENZYMY...........................................................................................
27
6. ANALIZA PŁYNÓW USTROJOWYCH.........................................
31
6.1. KREW..............................................................................................
31
6.2. MOCZ..............................................................................................
34
Piśmiennictwo uzupełniające
1. Kłyszejko-Stefanowicz L.(red), Ćwiczenia z biochemii. PWN,
Warszawa 2003.
2. Ostrowski W., Gumińska M., Krawczyk A. Ćwiczenia z chemii
ogólnej i fizjologicznej. PZWL, Warszawa 1986.
3. Pasternak K., Biochemia. Wydawnictwo CZELEJ, Lublin 2005.
4. Stryer L., Biochemia. PWN, Warszawa 1999.

2
REGULAMIN
obowiązujący studentów odrabiających ćwiczenia
w Katedrze Biologii i Ochrony Środowiska
1.
Ćwiczenia należą do zajęć kontrolowanych i nawet usprawiedliwiona nieobecność nie zwalnia studenta z
obowiązku odrobienia opuszczonego ćwiczenia. Student, który nie zaliczył ćwiczenia winien je odrobić w
innym terminie po uprzednim uzgodnieniu z asystentem.
2.
Studenci wykonują ćwiczenia w wyznaczonych pracowniach w czasie wyznaczonym rozkładem zajęć przez
Dziekanat Wydziału Nauk o Zdrowiu. W pracowni mogą przebywać tylko studenci wykonujący ćwiczenia.
3.
Studenci są zobowiązani do aktywnego uczestnictwa w zajęciach.
4.
Asystent może nie wpuścić na zajęcia osoby spóźnionej ponad 15 min.
5.
Samowolne opuszczenie zajęć w trakcie ich trwania jest jednoznaczne z brakiem ich zaliczenia.
6.
Spożywanie posiłków, żucie gumy, korzystanie z telefonów komórkowych i wszelkie zachowania zakłócające
prowadzenie zajęć na sali ćwiczeń skutkują usunięciem z zajęć i brakiem ich zaliczenia. Nagrywanie,
fotografowanie i filmowanie w czasie zajęć jest możliwe tylko po uzyskaniu zgody prowadzącego.
7.
Student przystępując do realizacji ćwiczenia winien być do niego przygotowany teoretycznie oraz posiadać
znajomość podejmowanych czynności praktycznych. Student będzie mógł rozpocząć ćwiczenie po sprawdzeniu
wiadomości przez asystenta. Zakres materiału, jaki obowiązuje na określone ćwiczenie wywieszony jest w
gablocie Katedry Biologii i Ochrony Środowiska.
8.
Każdy student zobowiązany jest do prowadzenia na bieżąco dokumentacji ćwiczeń. Uzyskane wyniki należy
przedstawić osobie prowadzącej,
9.
Zaliczenie ćwiczenia uzyskuje student, który wykazał się znajomością materiału teoretycznego, wykonaniem
ćwiczenia oraz poprawną interpretacją uzyskanego wyniku.
10. Za nie zaliczone uważa się ćwiczenie, na którym student nie był obecny, na którym nie wykazał się znajomością
materiału obowiązującego na ćwiczenia, lub złamał podany regulamin.
11. Zaliczenie przedmiotu uwarunkowane jest: uzyskaniem zaliczenia wszystkich obowiązujących ćwiczeń oraz
pozytywnym wynikiem kolokwium zaliczeniowego obejmującego wiadomości z wykładów i ćwiczeń.
12. Termin kolokwium zaliczeniowego ustala starosta grupy z prowadzącymi zajęcia.
13. Termin kolokwium zaliczeniowego na ocenę i termin egzaminu ustala starosta roku w sekretariacie Katedry.
14. Wejście na egzaminy i zaliczenia możliwe jest po okazaniu indeksu.
15. Wyniki egzaminów i zaliczeń ogłaszane są w gablocie Katedry wg numerów indeksów terminie
siedmiodniowym. Żadne informacje w tym zakresie nie będą udzielane telefonicznie.
16. . W przypadku, kiedy student nie zgłasza się osobiście po wpis, indeksy do których należy dokonać wpisu
przynosi starosta grupy lub roku wraz listą osób, które mu indeksy powierzyły.
17. Wszelkie wątpliwości związane ze stosowaniem niniejszego regulaminu należy zgłaszać Kierownikowi
Katedry.
ZASADY BEZPIECZEŃSTWA I HIGIENY PRACY
obowiązujące na terenie Katedry Biologii i Ochrony Środowiska
Przed przystąpieniem do ćwiczeń laboratoryjnych należy zapoznać się z przepisami bezpieczeństwa i higieny
pracy (BHP) w laboratorium oraz ściśle przestrzegać wskazań asystenta. Ponieważ pomieszczenia Katedry znajdują
się na terenie Szpitala Klinicznego, obowiązują także wszystkie przepisy porządkowe Szpitala.
1.
W pracowniach przebywać można tylko w odzieży ochronnej (fartuchu laboratoryjnym). W razie konieczności
należy używać okularów, rękawic itp. Nie wolno wnosić do laboratorium okrycia wierzchniego.
2.
W pracowniach nie wolno spożywać pokarmów i płynów, palić papierosów, żuć gumy, a także prowadzić
zbędnych rozmów.
3.
Za utrzymanie czystości i porządku na sali podczas ćwiczeń odpowiedzialni są studenci. Podczas pracy na
stołach laboratoryjnych i pod wyciągami mogą znajdować się tylko przedmioty i zestawy aparatury, sprzętu i
odczynników niezbędne do wykonania określonego ćwiczenia, a także należący do studenta skrypt i materiały
do sporządzania notatek.
4.
Roztwory należy wkraplać bezpośrednio z butelki lub pobierać pipetą, przy czym do każdego roztworu należy
używać czystej pipety. Podczas dozowania roztworów należy używać pipet pasteurowskich, pipet
automatycznych bądź pipet z nałożonymi dozownikami – nigdy nie należy pipetować ustami. Po pobraniu
koniecznej ilości roztworu butelkę należy natychmiast zamknąć i odstawić na wyznaczone miejsce.
5.
Nie wolno wlewać z powrotem do butelek roztworów z nich pobranych. Nie wolno używać tej samej pipety do
pobierania różnych roztworów.

3
6.
Zaleca się szczególną ostrożność przy posługiwaniu się stężonymi kwasami i zasadami, które powodują
oparzenia.
- W przypadku oparzenia skóry kwasem bądź zasadą, miejsca oparzone należy dokładnie spłukać bieżącą wodą i
przemyć 2-3% roztworem wodorowęglanu sodowego (po zadziałaniu kwasu) lub 1-2% roztworem kwasu
octowego lub cytrynowego (po zadziałaniu ługu) i przykryć gazą higroskopijną.
- W przypadku dostania się kwasu lub zasady do ust należy przepłukać je dużą ilością wody, a następnie
odpowiednio rozcieńczonym roztworem wodorowęglanu sodowego (po zadziałaniu kwasu) lub roztworem
kwasu octowego (po zadziałaniu ługu).
- W przypadku połknięcia roztworu kwasu lub zasady należy natychmiast wypić dużą ilość mleka, wody z
surowym białkiem jaja lub oleju jadalnego i natychmiast zgłosić się do lekarza.
- W przypadku oparzenia oczu należy przepłukać je obficie wodą, wprowadzając strumień wody do
zewnętrznych kącików oczu, pod powieki i natychmiast zgłosić się do lekarza. ponieważ zmiany powstające w
rogówce i spojówce mogą już po kilku minutach osiągnąć takie rozmiary, że uratowanie wzroku staje się
niejednokrotnie bardzo trudne.
7.
Pipety używane do stężonych kwasów lub zasad należy natychmiast przepłukać wodą. Kroplę ługu lub kwasu,
która przypadkiem upadnie na stół laboratoryjny lub podłogę należy starannie zetrzeć. Nie wolno wlewać wody
do stężonego kwasu, gdyż powstała mieszanina silnie się rozgrzewa i należy się liczyć z pęknięciem naczynia,
co może spowodować oparzenie.
8.
Doświadczenia ze stężonymi kwasami, amoniakiem i bromem należy przeprowadzać pod wyciągiem
9.
Prace z substancjami wydzielającymi trujące lub żrące pary oraz z truciznami (cyjanek, benzen, stęż. kwas
azotowy) należy wykonywać ze szczególną ostrożnością Doświadczenia z takimi substancjami można
wykonywać pod kontrolą asystenta. Płyny ogrzewane w probówce, szczególnie przy użyciu palnika gazowego
należy ustawicznie mieszać, aby uniknąć przegrzania cieczy. Równocześnie nigdy nie kierować wylotu
probówki w stronę siebie lub sąsiada.
10. Prace z substancjami lotnymi, łatwopalnymi należy prowadzić z uwzględnieniem wszelkich zasad
bezpieczeństwa i zgodnie z obowiązującymi w tym zakresie przepisami. Podczas pracy z substancjami
łatwopalnymi nie należy zapalać ognia.
11. W przypadku powstania pożaru natychmiast zgłosić ten fakt asystentowi. W razie zapalenia się mieszaniny
odczynników w probówce należy natychmiast umieścić ją w pojemniku z piaskiem. W razie pożaru lub
włączenia się sygnalizacji alarmowej należy spokojnie opuścić laboratorium wyznaczonymi drogami
ewakuacyjnymi. Zastosowanie środków gaszących (koc azbestowy, odpowiednie gaśnice) należy do asystenta.
12. Przed odwirowaniem próbek należy sprawdzić, czy:
-
poziom cieczy w probówkach nie przekracza poziomu bezpiecznego (ok. 2 cm poniżej górnej krawędzi
probówki);
-
czy na dnie pojemnika z probówkami znajduje się gumowa podkładka;
-
czy masa przeciwległych pojemników z probówkami jest jednakowa (w innym przypadku należy pojemniki
zrównoważyć). W razie stłuczenia probówki w trakcie wirowania należy natychmiast wirówkę wyłączyć i
wezwać asystenta prowadzącego zajęcia.
13. Sprzęt jednorazowego użytku lub sprzętem szklanym, który po użyciu trzeba przepłukać wodą bieżącą i odłożyć
do przeznaczonych na ten sprzęt pojemników. Odpadów stałych, takich jak stłuczka szklana, bibuły, sączki,
osady, nie wolno wrzucać do zlewu lecz tylko do odpowiednio oznakowanych wiader. Po zakończeniu
doświadczeń zawartość probówek usuwamy do specjalnie w tym celu przeznaczonych pojemników
14. W przypadku doznania w czasie pracy obrażeń ciała, należy zastosować się do instrukcji BHP z treścią której
winien zapoznać się każdy student na początku roku akademickiego.
15. Każdy wypadek należy natychmiast zgłosić asystentowi prowadzącemu ćwiczenie.
16. Należy pamiętać, że:
- o powodzeniu przeprowadzonego doświadczenia decyduje dokładne i zgodne z metodyką, jego wykonanie;
- trzeba oszczędzać odczynniki, prąd elektryczny oraz wodę;
- przed opuszczeniem pracowni trzeba uporządkować stanowisko pracy oraz starannie umyć ręce.
17. W przypadku jakichkolwiek wątpliwości należy je bezzwłocznie zgłaszać asystentowi prowadzącemu zajęcia.
18. Aparatura szklana i zestawy specjalne winny być przed rozpoczęciem ćwiczeń sprawdzone przez asystenta.
Uruchomienie aparatury oraz jej wyłączenie może się odbywać tylko pod bezpośrednim nadzorem
prowadzącego zajęcia.

4
1. WĘGLOWODANY
Wymagana jest znajomość następujących zagadnień:
1. Budowa, klasyfikacja i konfiguracja cukrów, stereochemia cukrów.
2. Reakcje cukrów prostych mutarotacja, redukcja i utlenianie, epimeryzacja, estryfikacja).
3. Enolizacja cukrów redukujących. Pochodne cukrów prostych.
4. Tworzenie glikozydów, charakterystyka wiązania glikozydowego. Disacharydy. Wielocukry: homoglikany
(skrobia, glikogen, celuloza) i heteroglikany.
5. Znaczenie biologiczne węglowodanów.
Węglowodany (cukry, cukrowce) występują powszechnie w przyrodzie. Rośliny syntetyzują węglowodany w
procesie fotosyntezy z dwutlenku węgla i wody, wiążąc energię światła słonecznego.
Są grupą związków
karbonylowych (aldehydów, ketonów), które mają kilka grup hydroksylowych. Należą do nich cukry proste
(monosacharydy), oligosacharydy i polisacharydy. Wielocukry są produktami polikondensacji jednocukrów
połączonych ze sobą wiązaniami glikozydowymi. Masa cząsteczkowa wielocukrów waha się w granicach 0d kilku
tysięcy do kilku milionów. Ze względu na budowę chemiczną wielocukry można podzielić na homoglikany
(wielocukry jednoskładnikowe) i heteroglikany (wieloskładnikowe).
Do heteroglikanów o dużym znaczeniu biologicznym należy grupa glikozaminoglikuronoglikanów (kwaśne
mukopolisachary), w skład której wchodzą: zawarte w tkance chrzęstnej wielkie polimery kwasu hialuronowego
(tworzą one rdzeń natywnych proteoglikanów), chondroityna spotykana się w rogówce oka, czy heparyna. Rola
heparyny (wysoko siarkowane formy tego glikanu są biologicznie najbardziej czynne) najdobitniej uwidacznia się w
przedłużaniu czasu krzepnięcia krwi u ssaków.
Węglowodany (np. skrobia i niektóre disacharydy) są wykorzystywane przez organizmy cudzożywne jako
podstawowy składnik pożywienia. W jelicie człowieka są przekształcane do monosacharydów i wchłaniane w takiej
postaci. Postacią „transportową” węglowodanów w krwi jest glukoza. W komórkach jest ona wykorzystywana jako
materiał energetyczny, w celu odzyskania niezbędnej do życia energii lub przetwarzana na inne produkty.
Węglowodanem zapasowym jest glikogen magazynowany przede wszystkim przez wątrobę i mięśnie. Węglowodany
mogą być połączone kowalencyjnie z białkami (glikoproteiny) lub lipidami (glikolipidy) i być składnikiem ścian
komórkowych. W postaci rozpuszczalnej glikoproteiny występują w krwi ( białka osocza).
1.1. JEDNO- i DWUCUKRY
1.1.1. Wykazanie obecności grup alkoholowych cukrów
Na skutek obecności grup alkoholowych cukry mogą łatwo tworzyć rozpuszczalne połączenie kompleksowe z
wodorotlenkami niektórych metali np. wodorotlenkiem miedziowym.
CuSO
4
+ 2NaOH
Cu(OH)
2
(
koloidalny błękitny osad)
+ Na
2
SO
4
Cu(OH)
2
+ R(OH)
2
rozpuszczalny związek kompleksowy
o barwie szafirowej
Wykonanie:
Do 1ml 2M NaOH dodać około 1 ml roztworu 2 % CuSO
4
x 5H
2
O. Następnie do zawiesiny galaretowatego
osadu wkraplać roztwór glukozy
(około 1 ml). Obserwować zmianę barwy zawartości probówki w trakcie dodawania kolejnych odczynników.
Koloidalny, błękitny osad wodorotlenku miedziowego w obecności grup hydroksylowych glukozy tworzy
rozpuszczalny związek koloru szafirowego.
1.1.2. Reakcje redukcyjne cukrów prostych
Wszystkie monocukry (z wolną grupę aldehydową lub ketonową), przejawiają właściwości redukujące,
jednocześnie same utleniając się. W środowisku alkalicznym cukry redukują tlenki lub wodorotlenki metali (Cu, Bi,
Ag, Hg), które w środowisku zasadowym istnieją w postaci łatwo wytrącających się koloidalnych zawiesin. W
obecności związków zawierających, sąsiadujące ze sobą, grupy wodorotlenowe (winian sodowo-potasowy, kwas
winowy, gliceryna) tworzą rozpuszczalne, częściowo zdysocjowane, połączenia kompleksowe, dostarczając małych
ilości jonów metalu, które wchodzą w reakcje redukcji.
2NaOH + CuSO
4
Cu(OH)
2
+ Na
2
SO
4
niebieski osad wodorotlenku miedziowego
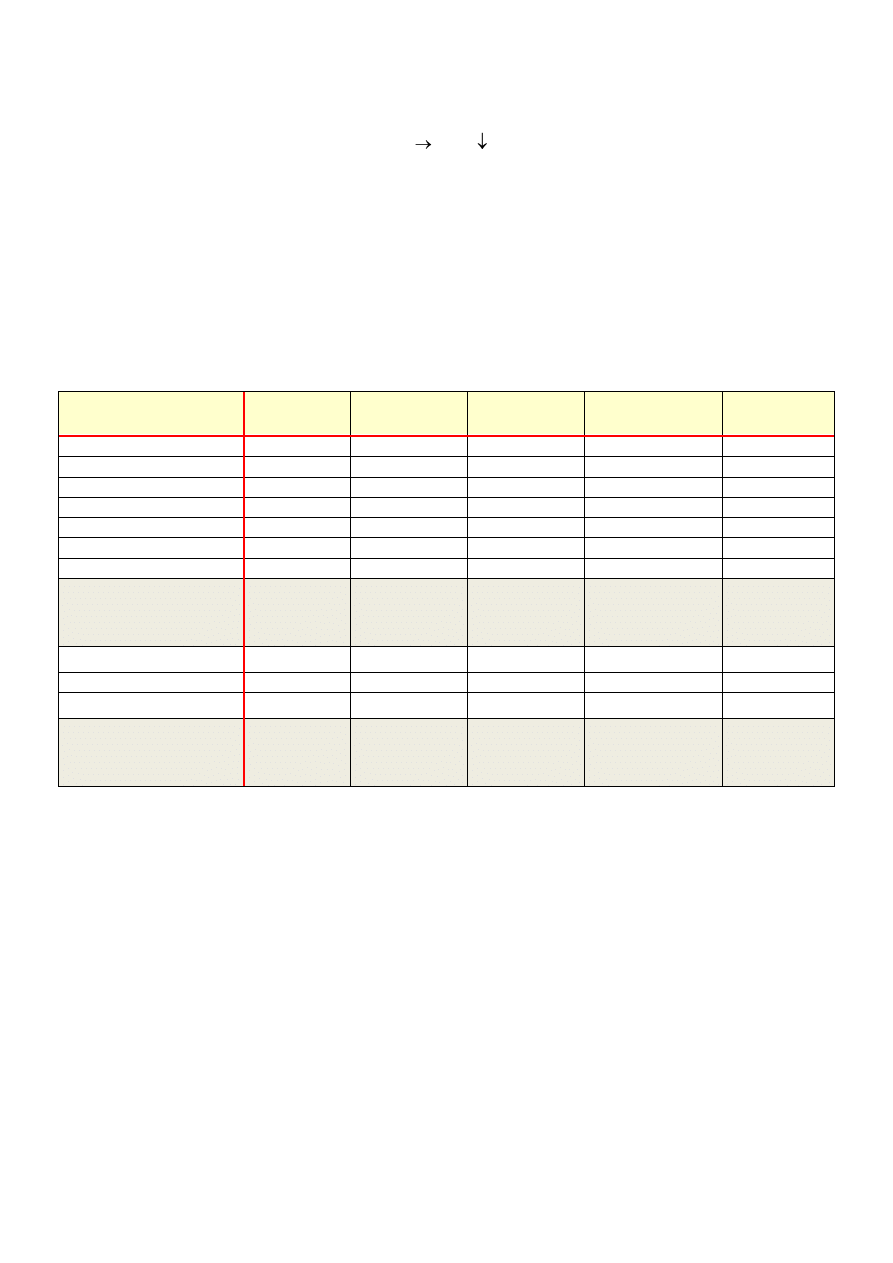
5
Pod wpływem zasady i soli miedziowych w wyniku reakcji z roztworem cukru (związkiem redukującym) po ogrzaniu
powstaje źle rozpuszczalny osad, który może mieć barwę żółtą (dla cząstek drobnych) przez pomarańczową do
czerwonej (dla osadów gruboziarnistych).
2Cu(OH)
2
Cu
2
O + 2H
2
O + 1/2O
2
osad czerwonego tlenku miedziawego
Cukry w środowisku zasadowym mogą redukować także kwas pikrynowy czy błękit metylenowy.
1.1.2.1. Wpływ warunków na przebieg odczynów redukcyjnych
Wykonanie:
Do 5 probówek dodać po 5 kropli 2% roztworu siarczanu miedzi, a następnie kolejno, po 1 ml wody, glicerolu,
winianu sodowo-potasowego, amoniaku i glukozy. Następnie do każdej probówki dodać po 5 kropli 2M NaOH
i umieścić we wrzącej łaźni wodnej na 5 minut. Do probówki 2, 3 i 4 dodać po 5 kropli 1% glukozy i ponownie
ogrzać w 100ºC.
Wynik obserwacji zapisać w tabeli.
W prawidłowo wykonanym doświadczeniu w próbie 1 tworzy się osad koloidalny wodorotlenku miedziowego, w
probówkach 2, 3 i 5 powstają rozpuszczalne kompleksy. W próbie z amoniakiem również powstaje szafirowy
rozpuszczalny kompleks miedzi. W wyniku ogrzewania w probówce 1 wytrąca się czarny tlenek miedziowy, a w
probówce 5 wytrąca się czerwony tlenek miedziawy. Po dodaniu do prób glukozy i ponownym ogrzaniu wytrąca się
osad Cu
2
Ow próbie 2 i 3. Jony amonowe w próbie 4 zapobiegają redukcji do chwili, aż amoniak nie odparuje.
1.1.2.2. Reakcja Fehlinga.
Glukoza redukuje wodorotlenek miedziowy do wytrącającego się z roztworu czerwonego osadu tlenku
miedziawego.
Wykonanie:
Zmieszać w probówce 1ml odczynnika Fehlinga I z 1ml odczynnika Fehlinga II, ogrzać do wrzenia i dodać
1ml 1% roztworu glukozy. Po ponownym ogrzaniu próby pojawia się osad.
1.1.2.3. Reakcja Benedicta
Odczyn Benedicta jest czulszy i bardziej swoisty od odczynu Fehlinga, a z natężenia barwy osadu można
ODCZYNNIK (ml)
Probówka
1
Probówka
2
Probówka
3
Probówka
4
Probówka
5
2% CuSO
4
0,2
0,2
0,2
0,2
0,2
H
2
O (ml)
1
10%Glicerol
1
10%winian Na-K
1
amoniak
1
1% glukoza (ml)
1
2M NaOH ( krople)
0,2
0,2
0,2
0,2
0,2
WYNIK
osad koloidalny
Cu(OH)
2
rozpuszczalne
kompleksy
Cu(OH)
2
rozpuszczalne
kompleksy
Cu(OH)
2
Niebieski kompleks
{Cu(NH
3
)
4
}(OH)
2
szafirowy
rozpuszczalny
kompleks
Cu(OH)
2
OGRZEWAĆ
100ºC, 5 min
+
+
+
+
+
1% glukoza
1
1
1
OGRZEWAĆ
100ºC, 5 min
+
+
+
WYNIK
czarny CuO
czerwony
Cu
2
O
czerwony
Cu
2
O
Jony amonowe
zapobiegają redukcji
do chwili, aż amoniak
nie odparuje.(
Cu
2
O)
czerwony
Cu
2
O
6
wnioskować o ilości glukozy w badanej próbce, nadaje się więc np. do wykrywania glukozy w moczu.
Wykonanie:
Do 1 ml odczynnika Benedicta dodać kilka kropel 1% glukozy i ogrzewać.
W zależności od ilości glukozy tworzy się osad żółty, pomarańczowy lub czerwony wytrąconego tlenku miedziawego.
1.1.2.4. Próba Tollensa
Glukoza redukuje jony srebra ( z dysocjacji Ag(NH
3
)
2
+
) do srebra metalicznego.
Wykonanie:
Do 1 ml 0,1 M amoniakalnego roztworu AgNO
3
dodać 1 ml 1% glukozy i ogrzewać we wrzącej łaźni.
Wydzielanie się na ściankach probówki lustra metalicznego srebra świadczy o właściwościach redukujących glukozy.
1.1.2.5. Odróżnienie cukrów redukujących od nieredukujących
Reakcję wykonuje się z odczynnikiem Benedicta.
Wykonanie:
Przygotować 4 probówki. Do pierwszej dodać kilka kropli roztworu 1% glukozy, do 2. 1% maltozy, do 3.
1% sacharozy, do 4. 1% skrobi. Do wszystkich dodać po 1 ml odcz. Benedicta i ogrzewać przez kilka minut.
Wytrącenie osadu świadczy o obecności cukru redukującego.
1.1.2.6. Próba Barfoeda - odróżnienie cukrów prostych od dwucukrów redukujących
Zjawisko zmniejszania się zdolności redukcyjnych cukrów, w miarę zwiększania kwasowości środowiska,
wykorzystano do różnicowania cukrów. W obecności cukrów redukujących po ogrzaniu z odczynnikiem wypada
czerwony osad tlenku miedziawego.
Wykonanie:
Przygotować probówkę z 0,5 ml 1% glukozy i drugą z 0,5 ml 1% maltozy.
Do obu dodać po 1 ml odczynnika Barfoeda i ogrzewać przez 3 min. w łaźni wodnej w 100ºC.
W takich warunkach dodatni wynik daje tylko próba z glukozą.
Ogrzewać obie próby przez kolejne 15 min.
Dwucukry redukujące dają próbę dodatnią po dłuższym ogrzewaniu i w probówce z maltozą także pojawia się osad
tlenku miedziawego. Próba ma znaczenie kliniczne, gdyż np. w moczu pozwala odróżnić obecność glukozy od
laktozy.
1.1.2.7. Badanie właściwości redukujących produktów powstałych w wyniku kwaśnej hydrolizy sacharozy
Kwas pikrynowy w środowisku alkalicznym ulega redukcji i daje czerwono zabarwiony pikraminian sodu.
Wykonanie:
Do 2 ml 1 % sacharozy dodać 0,5 ml 2 M HCl i ogrzewać kilka minut we wrzącej łaźni wodnej. Próbę
rozdzielić do dwóch probówek i do jednej dodać 1 ml 10% NaOH, a następnie do obu prób dodać po 1 ml
nasyconego roztworu kwasu pikrynowego i ogrzewać przez kilka minut.
W próbie zalkalizowanej obserwujemy czerwone zabarwienie roztworu.
1.1.2.8. Redukcja błękitu metylenowego
Błękit metylenowy spełnia rolę przenośnika wodoru i w wyniku jego redukcji powstaje leukozwiązek.
Wykonanie:
Do 1 ml 0,05% błękitu metylenowego dodać 4 krople 2M NaOH i ogrzać (barwa nie znika).
Następnie dodać kilka kropli 1% glukozy i ponownie zagotować. Następuje odbarwienie próby. Po ostudzeniu i
wstrząśnięciu, pod wpływem tlenu z powietrza, leukozwiązek ponownie utlenia się i obserwujemy powrót
zabarwienia.
S
N
N(CH
3
)
2
(CH
3
)
2
N
-H
2
-H
2
Cl
S
N
N(CH
3
)
2
(CH
3
)
2
N
H
+
+
HCl
błękit metylenowy
leuko
związek (biel metylenowa)
7
1.1.3. Wpływ zasad na cukry (próba Moore’a)
W środowisku zasadowym cukry redukujące ulegają enolizacji, zanika asymetria przy C2 i np. glukoza może
się przekształcić we fruktozę lub mannozę. Wiązanie enolowe łatwo ulega rozerwaniu, więc z cukrów mogą
powstawać pochodne ulegające polimeryzacji (powstają ciała żywicowate). Roztwory glukozy w obecności stężonych
zasad barwią się na kolor nawet brunatnoczerwony przy czym można poczuć zapach karmelu. Na działanie zasad
odporne jest wiązanie glikozydowe.
Wykonanie:
Przygotować cztery probówki. Do pierwszej wlać 1 ml 1% glukozy, do następnych wlać po 1 ml 1%
sacharozy, 1% maltozy i 1% skrobi. Do wszystkich probówek dodać po 1 ml 10% NaOH . Wstawić na kilka
minut do wrzącej łaźni wodnej i obserwować zabarwienie próby
1.1.4. Reakcje barwne cukrów
Cukry proste ogrzewane ze stężonymi kwasami (siarkowym, solnym, octowym) ulegają odwodnieniu np.
pentozy do furfuralu, heksozy do hydroksymetylofurfuralu, które z jednowodorotlenowymi fenolami dają barwne
(triarylometanowe) produkty reakcji (oligosacharydy i polisacharydy ulegają pod wpływem kwasu najpierw
hydrolizie). Metoda fenolowa jest metodą kolorymetryczną pozwalającą na analizę jakościową i ilościową cukrów.
H
2
O
O
H
O
OH
O
CH
OH
O
furfural
+
2
-
O
gólna reakcja „fenolowa”
Wielowodorotlenowe fenole dają z pochodnymi furfuralu barwne połączenia ksantenowe.
O
H
OH
H
OH
O
H
H
O
CH
2
OH
CH
O
O
CH
2
OH
OH
O
O
H
C
H
O
CH
2
OH
O
O
O
H
C
80
H
2
O
O
2
-
-2H
+1/2
Barwne połączenie ksantenowe
Odmianami metody fenolowej są:
- próba Molischa z -naftolem
OH
dająca reakcję z każdą heksozą
-próba Seliwanowa z rezorcyną
OH
OH
na zawartość ketoz
-próba Biala z orcyną
OH
OH
C
H
3
pozwalająca wykryć obecność pentoz
8
W reakcję kondensacji z pochodnymi furfuralu mogą wchodzić także inne związki aromatyczne takie jak, antron,
benzydyna lub difenyloamina. W produkcie kondensacji układ chinoidowy stanowi grupę chromoforowi decydującą o
barwie powstałego związku.
Omówione metody umożliwiają ilościowe oznaczanie zawartości cukrów w białkach czy w kwasach
nukleinowych.
1.1.4.1. Reakcje ogólne. Próba Molischa z -naftolem
Cukry (heksozy) pod wpływem stężonego H
2
SO
4
przekształcają się w wyniku odwodnienia w pochodne
furfuralu, które z -naftolem dają barwne produkty reakcji.
O
H
O
H
O
H
H
OH
OH
-H
2
O
O
CH
OH
O
H
H
O
H
+
hydroksymetylofurfural
-naftol
prawdopodobny produkt barwny
Wykonanie:
Przygotować 3 probówki i do pierwszej wlać 1 ml 1% roztworu glukozy, do drugiej 1 ml 1% sacharozy a do
trzeciej 1 ml 1% skrobi. Do każdej próby dodać 2 krople roztworu -naftolu (odczynnika Molischa),
wymieszać i po ściance wlać około 1 ml stężonego kwasu siarkowego, tak aby utworzyły się dwie dobrze
odgraniczające się warstwy.
Na granicy zetknięcia się obu roztworów powstaje czerwono-fiołkowy pierścień. Pojawiająca się
niecharakterystyczna zielona barwa pochodzi od zanieczyszczeń. Ujemny wynik reakcji wyklucza obecność cukrów,
nawet połączonych z innymi związkami, ale dodatni nie jest wystarczającym dowodem na obecność cukrów, gdyż
odczyn jest czuły, ale nieswoisty. Dodatnią próbę wykazują: aldehydy, aceton, kwasy organiczne (np. mrówkowy,
cytrynowy).
W moczu człowieka znajdują się związki niecukrowe, które także dają dodatni odczyn z -naftolem.
1.1.4.2. Reakcje selektywne
Reakcje barwne wywołane działaniem stężonych kwasów na cukry w obecności pochodnych fenylowych są
reakcjami typu furfuralowego.
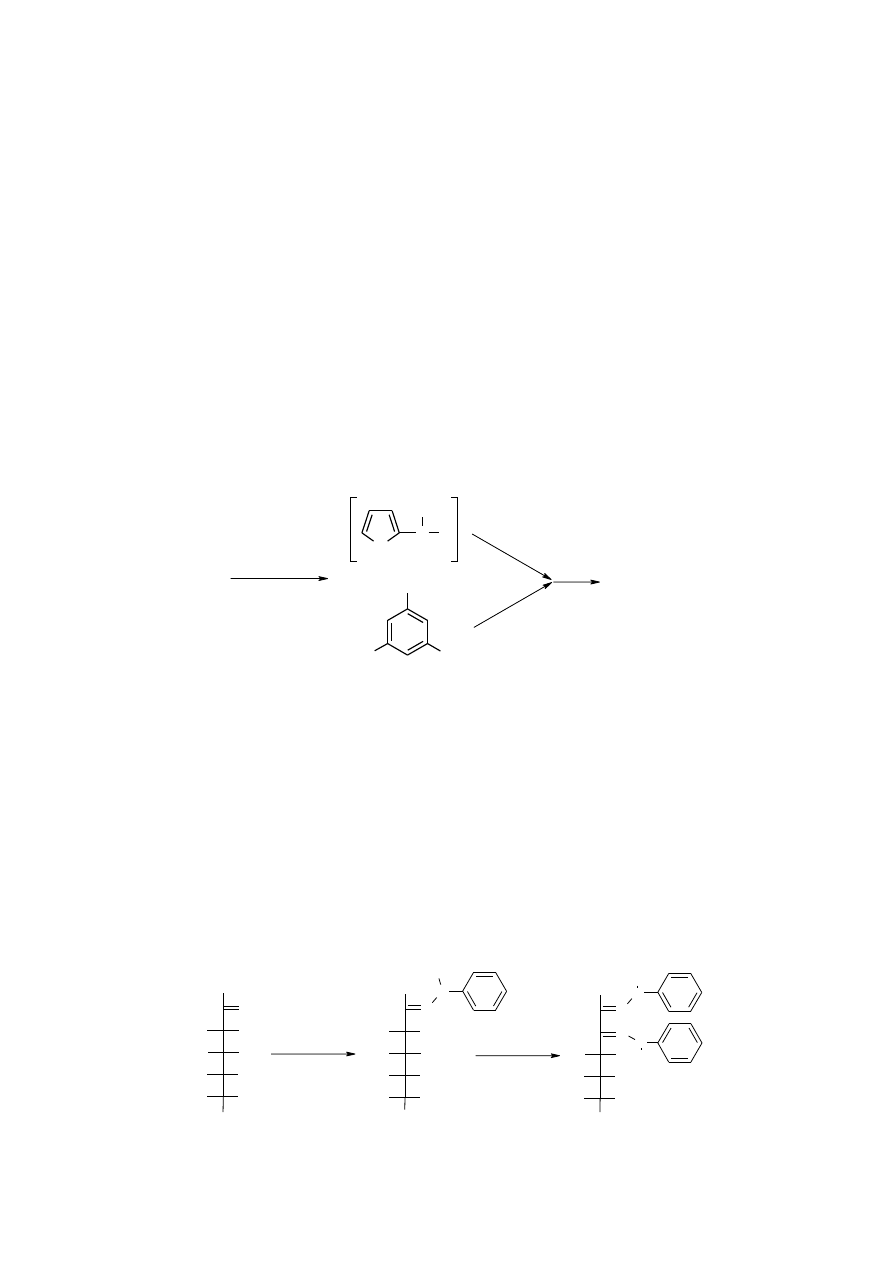
1.1.4.2.1. Reakcja Seliwanowa (wykrywanie ketoz)
Przy zachowaniu ściśle określonych warunków (ogrzewanie przez pół minuty w 100ºC próby badanego cukru
z rozcieńczonym około 12% kwasem solnym) ketozy ulegają przekształcają się w pochodne furfuralowe znacznie
szybciej niż aldozy (doświadczenie pozwala na odróżnienie ketocukrów od aldocukrów).
H
2
O
H Cl
O
H
O
H
O
H
H
fruktoza
-3
hydroksymetylofurfural
rezorcynol
czerwony
produkt kondensacji
Wykonanie:
Przygotować 4 probówki i wykonać doświadczenie z roztworami fruktozy, glukozy i sacharozy. Do czwartej
probówki ( próba odniesienia) wlać 1ml wody. Do 1ml 1% fruktozy dodać 0,5 ml stężonego HCl (uwaga!
nadmiar kwasu uniemożliwia uzyskanie poprawnego wyniku) i ogrzewać w 100ºC (łaźnia wodna) przez pół
minuty. Probówkę ostudzić pod bieżącą wodą. Dodać szczyptę rezorcyny i ponownie próbę ogrzać do wrzenia.
Próbę należy wykonać w taki sam sposób z roztworem: 1% glukozy, 1% sacharozy, oraz wody.
Zaobserwować różnicę w reakcji poszczególnych cukrów.
W obecności ketoz roztwór zabarwia się na kolor łososiowo-czerwony. Reakcje barwne wywołane działaniem
stężonych kwasów na cukry w obecności pochodnych fenylowych są reakcjami typu furfuralowego.
9
1.1.4.2.2. Próba Tollensa z floroglucyną (1,3,5,trihydroksybenzen)
- wykrywanie pentoz
Z pentoz na skutek działania kwasu solnego powstaje furfural, który z floroglucyną daje kompleks o barwie
wiśniowej.
Wykonanie:
Do 0,5 ml 1% rybozy dodać 1 ml stężonego HCl i kryształek floroglucyny. Podobnie wykonać próbę z 1 ml
1% glukozy. Obie próby ogrzewać w łaźni wodnej w 100ºC przez 2 minuty.
W obecności pentoz roztwór w probówce zabarwia się na kolor różowo-wiśniowy. Heksozy dają produkt reakcji o
zabarwieniu żółtym lub brązowym.
Oprócz pentoz dodatnio reaguje galaktoza i kwasy uronowe.
1.1.4.2.3. Próba z orcyną (wykrywanie pentoz)
W obecności stężonego kwasu solnego produkt kondensacji furfuralu z orcyną (orcynolem) ma barwę
brązowo-żółtą.
Wykonanie:
D 0,5 ml 1% rybozy dodać 0,5 ml stężonego kwasu solnego i szczyptę orcynolu krystalicznego. Ogrzać do
wrzenia i utrzymywać w 100ºC przez pół minuty.
Modyfikacją tego odczynu jest próba Biala (wprowadzenie do środowiska reakcji jonów żelaza).
Pod wpływem ogrzewania z kwasem solnym pentozy przekształcają się w furfural, który w kwaśnym
środowisku w obecności soli żelaza (III) z (orcyną) daje produkt kondensacji o barwie zielonej.
Na podstawie tego odczynu można kolorymetrycznie oznaczać ilości rybozy w kwasach nukleinowych.
CH
3
OH
O
H
O
C
O
H
n
Fe
3+
H
2
O
H Cl
orcynol
furfural
kompleks barwny
koloru zielonego
ryboza
-3
ogrzewanie
Wykonanie:
Przygotować 2 probówki z 1 ml odczynnika Biala. Do pierwszej dodać roztworu 0,5 ml 1% rybozy, do drugiej
0,5 ml 1% roztworu glukozy. Próbę wstawić do łaźni wodnej i ogrzewać przez kilka minut w 100ºC.
Pojawiające się zielone zabarwienie świadczy o obecności pentozy. W reakcji z heksozami powstaje w tych
warunkach hydroksymetylofurfural, który słabiej reaguje z orcynolem dając produkt o zabarwieniu żółto-brązowym.
1.1.5. Otrzymywanie osazonów monosacharydów.
Cukry redukujące z fenylohydrazyną tworzą żółte nierozpuszczalne w wodzie związki zwane osazonami,
różniące się temperaturą topnienia i kształtem kryształów. Żółte kryształy dają się łatwo identyfikować pod
mikroskopem. Ponieważ reakcja fenylohydrazyną zachodzi przy dwóch pierwszych węglach, wobec tego cukry
epimeryczne, różniące się rozmieszczeniem podstawników przy tych węglach tworzą identyczne osazony. Wobec
tego glukoza, mannoza, fruktoza nie mogą być różnicowane między sobą na podstawie reakcji tworzenia osazonów.
H
O
OH
H
H
O
H
H
H
CH
2
OH
OH
OH
C
6
H
5
NHNH
2
C
6
H
5
NHNH
2
-C
6
H
5
NH
2
-NH
3
H
2
O
N
H
N
OH
H
H
O
H
H
H
CH
2
OH
OH
OH
H
N
H
N
N
H
O
H
H
H
CH
2
OH
OH
OH
H
N
H
glukoza
fenylohydrazon
2
-2
osazon

10
Odczynniki ( do ćwiczenia 1.1. JEDNO- i WIELOCUKRY)
Roztwory cukrów: 1% glukoza, 1% fruktoza, 1% ryboza, 1% maltoza,
1%sacharoza,
1%skrobia,
H
2
SO
4
, stężony (kwas siarkowy)
HCl, stężony (kwas solny)
HCl, 2M (kwas solny)
HCl, 1M (kwas solny)
NaOH, 10% (wodorotlenek sodowy)
NaOH, 2M (wodorotlenek sodowy, ług sodowy)
NaOH, 1M (wodorotlenek sodowy)
amoniak, 1% (NH
4
OH)
AgNO
3
, 0,1M roztwór amoniakalny (azotan srebra)
winianu sodowo-potasowy, 10%
CuSO
4
·5H
2
O, 2% (siarczan miedziowy uwodniony)
glicerol, 10%
kwas pikrynowy, roztwór nasycony ( około 1,3%)
błękit metylenowy, 0,05%
rezorcyna, krystaliczna (lub rezorcyna, 0,5% roztwór w stężonym HCl)
Odczynniki ( do ćwiczenia 1.1. JEDNO- i WIELOCUKRY)
Odczynnik Fehlinga I:
- siarczan miedzi (CuSO
4
x 5H
2
O) 34,65g.
- kwas siarkowy stężony (H
2
SO
4
) 1 ml.
- woda destylowana - uzupełnić do 500 ml.
Odczynnik Fehlinga II:
- winian sodowo-potasowy – 175g
- 10% NaOH - uzupełnić do 500 ml.
Odczynnik Benedicta:
- cytrynian trójsodowy - 173g
- węglan sodowy bezwodny - 90g
- siarczan miedziowy - 17,3g
- H
2
O - uzupełnić do 1000 ml
(w 600 ml gorącej wody rozpuścić węglan i przesączyć, dodać 100 ml rozpuszczonego siarczanu miedzi, dodać
cytrynian sodowy i uzupełnić do 1000ml)
Odczynnik Barfoeda
- octan miedziowy - 24g (rozpuścić w 450 ml gorącej wody)
- kwas mlekowy - 25 ml (r-r 8,5%) (lub 2,5 ml 85% kwasu mlekowego)
- woda destylowana - uzupełnić do 500 ml.
Odczynnik Biala, (0,3g orcynolu rozpuścić w 500 ml stężonego HCl i dodać 1ml 10% FeCl
3
)
Odczynnik Molischa, (α-naftol, 2% roztwór alkoholowy)
1.2. WIELOCUKRY
Polisacharydy różnią się od mono- i dwucukrów właściwościami fizycznymi i chemicznymi. Nie mają one
słodkiego smaku i są nierozpuszczalne w wodzie. Większość z nich, ze względu na obecność grup hydrofilowych,
pęcznieje w obecności wody dając roztwory koloidowe (wyjątek stanowi celuloza, której cząsteczki łącząc się w
większe skupiska - micele, mają grupy hydrofilowe związane między sobą mostkami wodorowymi).Polisacharydy w
zależności od tworzących je cukrów dzielą się na homoglikany (zbudowana z cząsteczek glukozy skrobia, glikogen,
celuloza, dekstran, z cząsteczek fruktozy – inulina) i heteroglikany (mukopolisacharydy).
1.2.1. Preparatyka skrobi z ziemniaka
1.2.1.1. Izolowanie skrobi.
Wykonanie:
Obrany ziemniak utrzeć na miazgę i wymieszać z wodą (1:4), przesączyć przez gazę do zlewki i odczekać 10
minut. Obserwować osadzanie się skrobi na dnie naczynia. Nadsącz ostrożnie zdekantować, a osad wysuszyć.
1.2.1.2. Przygotowanie kleiku skrobiowego

11
Ziarna skrobi tworzące w wodzie zawiesinę po ogrzaniu pęcznieją i pękają. Tworzy się lepki, koloidalny
roztwór.
Wykonanie:
Około 1g otrzymanej skrobi zawiesić w 10 ml wody i wlewać do 50 ml wrzącej wody stale mieszając.
Otrzymuje się jednolity, opalizujący roztwór skrobi.
1.2.2. Reakcja skrobi z jodem.
Zabarwienie roztworu w reakcji skrobi z jodem powstaje w wyniku adsorpcji cząsteczek jodu na cząsteczkach
polisacharydów. Adsorpcja ma charakter "kanałowy" tzn. cząsteczki jodu wchodzą do kanału utworzonego przez
spiralnie skręcone łańcuchy wielocukru, a na jeden skręt spirali przypada około 6 reszt cukrowych. Barwa zależy od
długości łańcucha; np. amyloza (skrobia) daje z jodem barwę niebieską, a w miarę skracania łańcucha następuje
zmiana barwy na fioletową (amylodekstryny), fioletowo-czerwoną (amylopektyna, glikogen) i czerwoną (dekstryny).
Achro- i malto-dekstryny (maltoza, izomaltoza) i glukoza nie dają zabarwienia z jodem.
Wykonanie:
Do 1ml kleiku skrobiowego, dodać 1 kroplę rozcieńczonego „płynu Lugola” (roztwór J2 w KJ). Próba zabarwia
się na kolor ciemnoniebieski.
1.2.2.1. Wpływ temperatury
Wykonanie:
Probówkę z 1ml kleiku skrobiowego z 1 kroplą roztworu jodu (kolor ciemnoniebieski próby) ogrzewać aż do
zniknięcia barwy. Po ostudzeniu próby barwa powraca.
1.2.2.2. Wpływ pH środowiska
W środowisku zasadowym jod wchodzi w reakcję z wodorotlenkami, uwalniając jon podjodawy i jodkowy
(barwa zanika).
J
2
+ 2NaOH = NaJ + NaJO + H
2
O
Dodanie kwasu solnego powoduje odtworzenie jodu cząsteczkowego (powrót barwy niebieskiej).
NaJ + NaJO + 2HCl = 2Na Cl + J
2
+ H
2
O
KJ + J
2
= KJ
3
Wykonanie:
Przygotować 2 probówki z kleikiem skrobiowym (po 1 ml) i kroplą płynu Lugola. Dodawać kroplami 1M
NaOH do obu probówek, aż do odbarwienia, następnie do jednej z prób dodawać 1M HCl do momentu
ponownego pojawienia się barwy.
1.2.3. Wysalanie skrobi
Wykonanie:
Do 5 ml otrzymanego kleiku dodać 5 ml nasyconego roztworu (NH
4
)
2
SO
4
. Wymieszać i po 10 min przesączyć
przez sączek z bibuły. Do przesączu dodać kroplę roztworu jodu.
Dowodem, że skrobia się wytrąciła i została odsączona jest brak pozytywnej reakcji z jodem.
1.2.3. Hydroliza wielocukrów, wykrywanie produktów ich rozkładu
1.2.3.1.Wpływ rozcieńczonych kwasów – stopniowa hydroliza skrobi
Skrobia pod wpływem kwasu ulega stopniowej hydrolizie do glukozy. Pękają wiązania glikozydowe z
przyłączeniem cząsteczek wody i długie łańcuchy ulegają rozbiciu na coraz krótsze fragmenty. W miarę skracania się
łańcucha zmienia się zabarwienie kompleksu z jodem. W próbach z jodem zabarwienie roztworu zmienia się kolejno
z niebieskiego (skrobia i dekstryny) poprzez fioletowe (amylodekstryny), czerwone (erytrodekstryny) do słomkowego
(w wyniku hydrolizy łańcuchy skrobi są coraz krótsze, a w końcu otrzymujemy achrodekstryny amylozę i glukozę,
które nie dają pozytywnej reakcji z jodem). Przy większych stężeniach kwasu hydroliza skrobi przebiega bardzo
szybko, prowadząc do uwolnienia glukozy.
Kwaśna hydroliza skrobi znalazła zastosowanie w przemyśle spożywczym w produkcji np. syropu ziemniaczanego
czy sztucznego miodu.
Wykonanie:
a). Przygotować: 10 probówek (opisać numerami od 1 do 10) z 3 kroplami rozcieńczonego roztworu jodu
12
każda i
10 probówek (oznaczonych 11 – 20) z 0,5 ml 1M NaOH.
b). Do probówki z około 15 ml otrzymanego kleiku skrobiowego dodać 1 ml stężonego kwasu solnego,
zamieszać, pobrać po 0,5 ml roztworu badanego i przenieść kolejno do probówek oznaczonych nr 1 i 11.
Następnie zakwaszony kleik umieścić w łaźni wodnej i ogrzewać we wrzącej łaźni (100ºC). Po 3 minutach
przenieść 0,5 ml roztworu do probówki oznaczonej numerem 2 (z jodem) i 0,5 ml do probówki oznaczonej jako
12 (z NaOH). Dalej co 3 minuty przenosić po 0,5 ml do kolejnych probówek, aż do nr 10 i 20.
Do prób z NaOH i badanym roztworem hydrolizowanej skrobi dodawać po 1 ml odczynnika Benedicta i
ogrzewać do wrzenia.
Daje się zaobserwować coraz wyraźniejszą reakcję dodatnią, aż do pojawienia się osadu Cu
2
O, co świadczy o
wzroście stężenia redukującej glukozy w wyniku postępującej hydrolizy.
1.2.3.2. Hydroliza celulozy
Wykonanie:
Skrawki bibuły umieścić w probówce, zalać 10 ml H
2
O i dodać 1 ml stężonegokwasu siarkowego. Ogrzewać
kilkanaście minut w łaźni wodnej o temperaturze 100ºC. Następnie próbę ochłodzić i wykonać reakcję na
obecność cukrów redukujących (glukozy).
Pobrać 0,5 ml roztworu hydrolizatu, dodać 0,5 ml 1M NaOH i zamieszać.
Do próby dodać1 ml odczynnika Benedicta. Próbę można wykonać także dodając 1 ml odczynnika
Fehlinga(I+II)
Ogrzewać we wrzącej łaźni wodnej do pojawienia się osadu tlenku miedziawego.
Próba redukcyjna wypadnie dodatnio, ponieważ pod wpływem kwasu celuloza uległa hydrolizie do glukozy.
1.2.4. Dializa roztworu koloidowego (kleiku skrobiowego)
Dializa polega na selektywnej dyfuzji substancji małocząsteczkowych poprzez błonę półprzepuszczalną,
zgodnie z gradientem stężenia, przy równoczesnym zatrzymywaniu cząstek koloidowych i makrocząsteczek.
Wykonanie:
Umieścić w woreczku dializacyjnym 5 ml roztworu 1% skrobi zmieszanej z 2 ml 1% Na
2
CO
3
i 2 ml 1%
glukozy. Woreczek umieścić w zlewce z wodą destylowaną z dodatkiem kilku kropel fenoloftaleiny (roztwór
zewnętrzny) i dializować przez około jedną godzinę.
Po dializie w roztworze zewnętrznym wykonać próby na obecność:
a) węglanów: do 1 ml roztworu zewnętrznego dodać 1ml 0,1 M BaCl
2
.
Pojawiające się zmętnienie wskazuje na obecność węglanów.
b) skrobi: do 1 ml roztworu zewnętrznego dodać 1 kroplę płyn Lugola.
Przy właściwie przeprowadzonej dializie nie obserwuje się dodatniej reakcji na skrobię (nie powinno pojawić się
niebieskie zabarwienie).
c) glukozy: do 1 ml roztworu zewnętrznego dodać 1 ml odczynnika Benedicta i zagotować.
Pojawiający się osad tlenku miedziawego wskazuje na obecność glukozy.
Odczynniki (do ćwiczenia 1.2.4. Dializa...)
skrobia, 1% (kleik skrobiowy), glukoza, 1%
BaCl
2
, 0,1M (clorek baru)
Na
2
CO
3,
1% (węglan sodu)
Fenoloftaleina, wskaźnik
Płyn Lugola (J
2
w KJ)
Odczynniki (do ćwiczenia 2.2.WIELOCUKRY)
H
2
SO
4
, stężony (kwas siarkowy)
HCl, 1M (kwas solny)
kleik skrobiowy, 1% (ziemniaki)
NaOH, 1M (wodorotlenek sodu)
(NH
4
)
2
SO
4,
roztwór nasycony (siarczan amonu)
odczynnik Benedicta (lub odczynnik Fehlinga I + odczynnik Fehlinga II)
Płyn Lugola, (J
2
w KJ,), (0,5% roztwór jodu w roztworze 2% jodku potasu.
Jod rozpuszcza się w wodnym roztworze jodku potasowego, dając nietrwały jon zespolony J
3
-
).

13
2. TŁUSZCZE
Wymagana jest znajomość następujących zagadnień:
1. Kwasy tłuszczowe - budowa i właściwości, nazewnictwo.
2. Charakterystyka tłuszczów prostych i złożonych; podział, budowa i występowanie.
3.
Znaczenie biologiczne lipidów.
Lipidy (tłuszczowce – termin ten obejmuje zarówno kwasy tłuszczowe, jak i pochodne izoprenu np. steroidy,
witaminy) charakteryzuje się przez określenie ich właściwości fizycznych i składu chemicznego. Najbardziej
powszechne są tłuszcze proste, dzielone na tłuszcze właściwe - zbudowane z glicerolu połączonego wiązaniami
estrowymi z cząsteczkami kwasów tłuszczowych oraz woski – estry wyższych jednowodorotlenowych alkoholi i
wyższych kwasów tłuszczowych np. wosk pszczeli. Badanie tłuszczów złożonych (fosfolipidy, glikolipidy,
sulfolipidy), dodatkowo posiadających zasady azotowe, cukry lub reszty kwasu fosforowego, musi być poprzedzone
ich izolacją z materiałów biologicznych. Jako związki powierzchniowo czynne obniżają napięcie powierzchniowe na
granicy faz. Tłuszcze złożone stanowią materiał budulcowy błon plazmatycznych (np. takich jak osłony włókien
nerwowych). W materiale biologicznym występują też prekursory i pochodne lipidów (np. kwasy tłuszczowe, glicerol
i inne alkohole, sfingozyna). Do lipidów zaliczamy sulfolipidy i aminolipidy a także lipoproteiny- cząsteczki, które
biorą udział w dystrybucji i przemianie lipidów w organizmie. Do glikosfingolipidów, które zawierają oprócz kwasu
tłuszczowego i sfingozyny komponent cukrowy zaliczamy obficie występujące w mózgu cerebrozydy (z galaktozą lub
sulfogalaktozą) i gangliozydy (tłuszcze rozpuszczalne w wodzie, za co odpowiedzialny jest składnik cukrowy,
najczęściej heksozy, heksozoaminy i kwas neuraminowy). Gangliozydy stanowiące blisko 6 % substancji szarej
mózgu mają istotne znaczenie fizjologiczne. Transport większości składników lipidowych między narządami i
tkankami odbywa się w kompleksach z białkami – lipoproteinach, których aktualnie wyróżniamy 4 frakcje:
chylomikrony, VLDL, LDL i HDL. Ważnym elementem strukturalnym lipoprotein są składniki białkowe –
apoproteiny, o dużym powinowactwie do receptorów komórkowych a także działające jako aktywatory lub inhibitory
enzymów lipolitycznych.
2.1. TŁUSZCZE PROSTE
2.1.1. Badanie składu i podstawowych właściwości triglicerydów
2.1.1.1. Wykazanie glicerolu za pomocą próby akroleinowej
Akroleina jest nienasyconym aldehydem, który powstaje z glicerolu (składnika tłuszczów) w wyniku utraty
dwóch cząsteczek wody.
H-C
H-C
H-C
OH
OH
OH
H
H
KHSO
4
H
2
O
CH
2
CH
C
H
O
glicerol
akroleina
-2
Wykonanie:
Do suchej probówki wsypać około 0,2g KHSO
4
i 2 krople oleju. U wylotu probówki umieścić pasek bibuły
zwilżony amoniakalnym roztworem azotanu srebra (0,1M AgNO
3
). Probówkę ostrożnie ogrzewać w
płomieniu palnika gazowego.
W trakcie ogrzewania akroleina wydziela się w postaci ciężkiego drażniącego drogi oddechowe dymu, o przykrym
zapachu. Bibuła czernieje na skutek pojawienia się srebra metalicznego (w wyniku redukcji jonów Ag
+
).
2.1.1.2. Zmydlanie tłuszczów (wykazanie reakcją zmydlania obecności kwasów tłuszczowych).
Proces hydrolizy (zmydlanie) polega na ogrzewaniu tłuszczów prostych z mocnymi zasadami (NaOH lub
KOH) co prowadzi do otrzymania glicerolu (w wyniku rozkładu wiązań estrowych) i mieszaniny rozpuszczalnych w
wodzie mydeł (soli wyższych kwasów tłuszczowych)

14
C
C
C
H2
H
H2
O
O
O
C
C
C
R
1
R
2
R
3
O
O
O
C
C
C
H2
H
H2
OH
OH
OH
ONa
C
R
1
O
ONa
C
R
2
O
ONa
C
R
3
O
+ 3NaOH
+
+
TAG
glicerol
mieszanina mydeł
2.1.1.2.1. Otrzymywanie mydła potasowego
Wykonanie:
W probówce umieścić około 5 kropli oleju i 1 ml 10% alkoholowego roztworu KOH. Ogrzewać próbę we
wrzącej łaźni wodnej około 15 minut.
Na dnie probówki powstaje mydło o konsystencji galarety. Do probówki z otrzymanym mydłem dodać 2,5 ml
wody, Powstaje opalizujący roztwór, który przy wstrząsaniu się pieni ( roztwór mydła). Następnie do
probówki dodać około 1 g krystalicznego NaCl i dobrze wymieszać. Dochodzi do wytrącenia wysolonego mydła
( osad tworzy nad roztworem dość zwartą warstwę), które po dodaniu około 5 ml wody rozpuszcza się.
Po dodaniu do roztworu mydła chlorku sodu cząsteczki wody zostają usunięte z powierzchni miceli co powoduje
wytrącenie koloidu. Zjawisko to zwane wysoleniem koloidu jest odwracalne, czyli po dodaniu wody wytrącony
koloid ponownie się rozpuszcza.
2.1.1.2.2. Otrzymywanie mydła nierozpuszczalnego
Z roztworów mydła rozpuszczalnego (sodowego lub potasowego) roztwory zawierające jony wapnia, baru,
ołowiu wytrącają osad nierozpuszczalnego mydła. Sole te nie zmniejszają napięcia powierzchniowego. (Mydła
wapniowe i magnezowe tworzą się w zetknięciu z twardą wodą i nie mają właściwości myjących).
Wykonanie:
Do probówki z 1ml roztworu mydła ( otrzymanego w poprzednim ćwiczeniu) dodać 0,5 ml 0,1M CaCl
2
. Próbę
wykonać podobnie z 0,1 M BaCl
2
.
Wytrąca się osad, który po dodaniu wody nie rozpuszcza się, a więc wytrącanie się nie jest procesem wysalania.
2.1.1.3. Emulgacja tłuszczów
Nierozpuszczalne w wodzie tłuszcze, w obecności substancji emulgujących mogą tworzyć trwałe emulsje.
Mydła należą do substancji obniżających napięcie powierzchniowe i dlatego mogą służyć do wytwarzania trwałej
emulsji z wodą. Tłuszcze spożyte z pokarmami są emulgowane w przewodzie pokarmowym przez kwasy żółciowe
zawarte w żółci.
Wykonanie:
Do dwóch probówek dodać po kilka kropli oleju. Następnie do jednej dodać 0,5 ml roztworu mydła a do
drugiej probówki 0,5 ml wody. Obie próby silnie wstrząsnąć i odstawić na kilka minut.
W probówce zawierającej mydło tworzy się trwała emulsja, próba z dodatkiem wody rozwarstwia się.
2.1.1.4. Badanie rozpuszczalności tłuszczów
Wykonanie:
Do 5 probówek kolejnych rozlać po 1 ml wody, etanolu, chloroformu, benzenu i eteru, a następnie dodać do
każdej po około 0,5 ml oleju.
Obserwować różnicę rozpuszczania się tłuszczu w poszczególnych rozpuszczalnikach.
2.1.1.5. Otrzymywanie z mydeł wolnych kwasów tłuszczowych
Mocny kwas mineralny wypiera z mydeł nierozpuszczalny w wodzie kwas tłuszczowy.
CH
3
(CH
2
)
16
-COONa
H
2
SO
4
CH
3
(CH
2
)
16
-COOH
Na
2
SO
4
2
+
2
+
stearynian sodu
kwas stearynowy
Wykonanie:
Do 2 ml roztworu mydła dodawać kroplami 1M H
2
S0
4
do odczynu kwaśnego (sprawdzić papierkiem
uniwersalnym). Na powierzchni roztworu pojawia się nierozpuszczalny w wodzie film wolnych kwasów
tłuszczowych.
2.1.1.6. Wykazanie obecności kwasów tłuszczowych nienasyconych
N
ienasycone kwasy tłuszczowe zawierają jedno lub więcej wiązań podwójnych. Tłuszcze zawierające takie
kwasy tłuszczowe zdolne są do przyłączenie atomów chlorowca do dwóch sąsiadujących ze sobą węgli połączonych
wiązaniem podwójnym.

15
CH
3
-(CH
2
)
7
CH=CH-(CH
2
)
7
-COOH
C
H
H
CH
3
-(CH
2
)
7
C
Br
Br
(CH
2
)
7
-COOH
Br
2
kwas oleinowy
kwas 9,10 dibromostearynowy
Wykonanie:
W 1 ml chloroformu rozpuścić 2 krople oleju, a następnie do probówki dodać 1 ml wody bromowej.
Następuje zmętnienie warstwy chloroformowej, gdyż powstaje nierozpuszczalny bromowany kwas tłuszczowy na
skutek przyłączenia się bromu w miejscu wiązań podwójnych, zaś woda bromowa odbarwia się (warstwa górna).
Odczynniki (do ćwiczeń 2.1. TLUSZCZE PROSTE)
olej
roztwór mydła
H
2
SO
4 ,
1M (kwas siarkowy)
KHSO
4
,
krystaliczny
AgNO
3
,
0,1M (roztwór amoniakalny), pasek bibuły
KOH, 10% roztwór alkoholowy
NaCl, krystaliczny (chlorek sodu)
BaCl
2
, 0,1M (chlorek baru)
CaCl
2
, 0,1M (chlorek wapnia)
Woda bromowa (w 100 ml wody rozpuścić kilku kropli ciekłego bromu)
2.2. TŁUSZCZE ZŁOŻONE
2.2.1. Izolacja lecytyny i określenie jej składu chemicznego
2.2.1.1. Otrzymywanie lecytyny z żółtka jaja kurzego
Lecytyny, dzięki obecności w cząsteczce grup hydrofilowych, tworzą z wodą roztwory koloidowe. Lecytyny są
dobrze rozpuszczalne w etanolu i eterze, nierozpuszczalne zaś w acetonie, co wykorzystano w preparatyce lecytyn z
żółtka jaja kurzego. Żółtko zawiera dużo tłuszczów złożonych, głównie lecytyn i kefalin i jest dogodnym materiałem
do otrzymywania stosunkowo czystej frakcji lecytyn.
Wykonanie:
W zlewce na 50 ml umieścić około 5 g żółtka jaja i zalać 20 ml mieszaniny etanolu z eterem (1:1).
Odstawić zlewkę z mieszaniną na 10 minut (pod wyciągiem), co jakiś czas mieszając bagietką. Przesączyć
zawiesinę przez gazę do suchej zlewki na 200 ml. Przesącz odparować do sucha na wrzącej łaźni wodnej
(uwaga: odparowywać pod wyciągiem). Ochłodzić próbę.
Suchą pozostałość w zlewce rozpuścić w 3 ml eteru, a następnie wytrącić lecytyny przez dodanie 10 ml
acetonu.
Otrzymane lecytyny odsączyć i pozostawić na sączku.
2.2.1.2. Skład chemiczny lecytyn
P
(CH
3
)
3
N-CH
2
CH
2
-O
O
O
CH
2
C
H
C
H
2
O
O
C
C
R
1
R
2
O
O
+
lecytyna
2.2.1.2.1. Wykazanie glicerolu próbą akroleinową
Wykonanie:
16
Do suchej probówki wsypać około 0,2g KHSO
4
i dodać niewielką ilość otrzymanego osadu lecytyn. U wylotu
probówki umieścić pasek bibuły zwilżony amoniakalnym roztworem azotanu srebra (0,1M AgNO
3
). Probówkę
ostrożnie ogrzewać w płomieniu palnika gazowego.
W trakcie ogrzewania próby akroleina wydziela się w postaci ciężkiego drażniącego drogi oddechowe dymu, o
przykrym zapachu. Bibuła czernieje na skutek pojawienia się srebra metalicznego (w wyniku redukcji jonów Ag
+
).
2.2.1.2.2. Wykazanie obecności fosforu
Wykonanie:
0,2 g lecytyn stopić w probówce z trzykrotną ilością mieszaniny spalającej (2 części Na
2
SO
3
+ 3 części KNO
3
).
Stop rozpuścić w 2 ml wody i przesączyć. Do 1 ml przesączu dodać 0,5 ml stęż. HNO
3
i 1,5 ml 5%
molibdenianu amonu. Po zagotowaniu próby wytrąca się krystaliczny żółty osad fosforomolibdenianu
amonowego.
2.2.1.2.3. Wykazanie obecności choliny (zmydlanie lecytyn)
Pod wpływem ługu w lecytynach ulegają alkalicznej hydrolizie estrowe połączenia glicerolu i kwasów
tłuszczowych. W reakcji otrzymywania mydeł z lecytyn wydziela się trimetyloamina.
Wykonanie:
Do niewielkiej ilości lecytyny dodać 2 ml 10% alkoholowego roztworu KOH i ogrzewać probówkę we wrzącej
łaźni wodnej przez 15 min. Wydziela się lotna trimetyloamina o charakterystycznej woni „śledziowej”, zaś
wilgotny papierek lakmusowy u wylotu probówki staje się niebieski (trimetyloamina ma odczyn zasadowy).
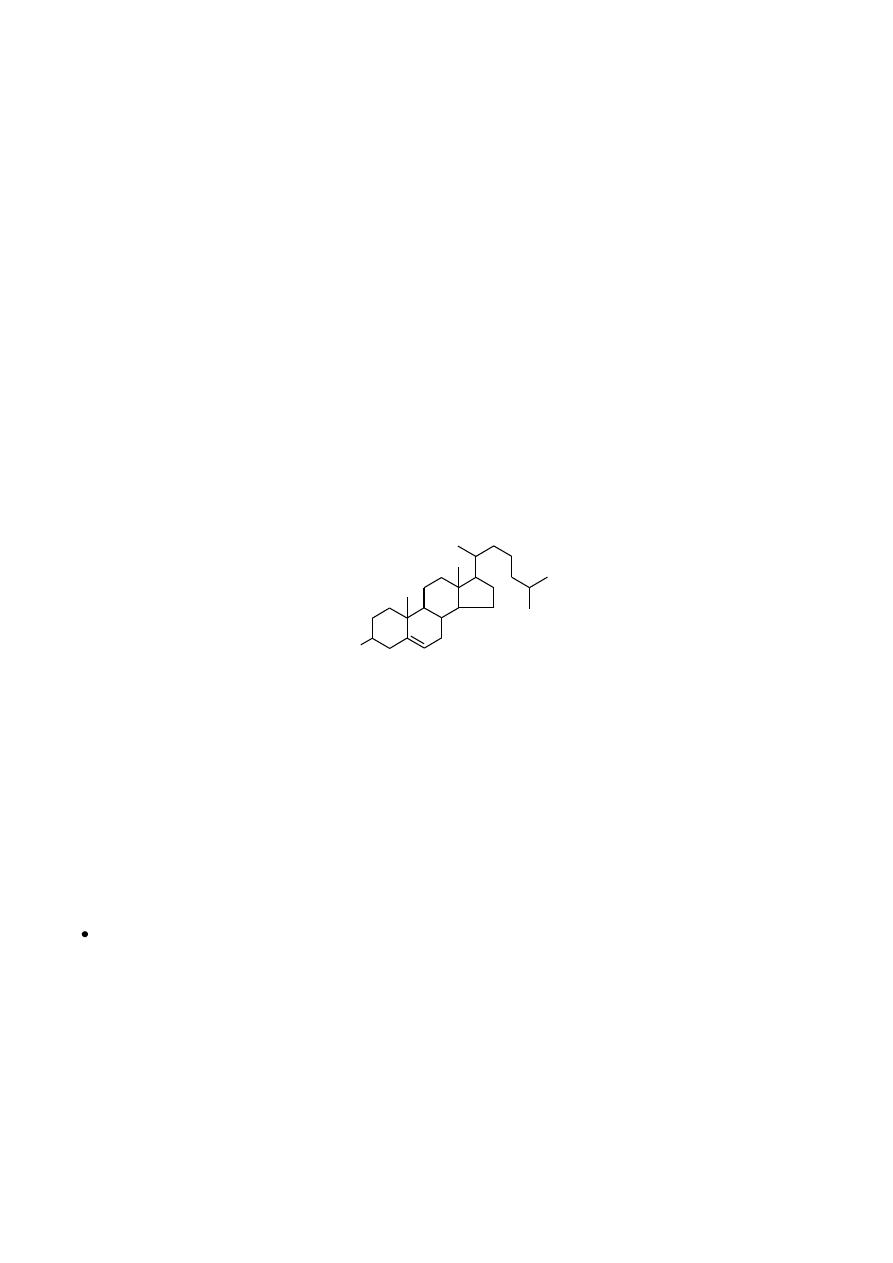
2.2.3. Reakcje na cholesterol.
Cholesterol jest sterydem nierozpuszczalnym w wodzie, występuje w tkankach tak w stanie wolnym, jak też
związanym w postaci estrów z kwasami tłuszczowymi. Jest bardzo ważnym składnikiem błon komórkowych.
O
H
cholesterol
2.2.3.1. Wykazanie obecności cholesterolu reakcją Liebermanna-Burcharda
Pod wpływem kwasu siarkowego następuje odwodnienie cholesterolu. W obecności bezwodnika kwasu
octowego tworzy się zielono zabarwiony produkt (kwas monosulfonowy bicholestadienu).
Wykonanie:
Do probówki zawierającej 1 ml 1% chloroformowego roztworu cholesterolu dodać 0,5 ml bezwodnika kwasu
octowego i ostrożnie kroplę stężonego kwasu siarkowego (! reakcja egzotermiczna). Próba barwi się początkowo
na czerwono, po czym przez kolor niebieski zmienia zabarwienie na zielone.
2.2.3.2. Wykazanie obecności cholesterolu reakcją Salkowskiego
Wykonanie:
W probówce umieścić 0,5 ml chloroformowego roztworu cholesterolu
i ostrożnie podwarstwić 0,5 ml stężonego kwasu siarkowego.
Warstwa choroformowa barwi się na czerwono, dolna kwasowa wykazuje zieloną fluorescencję.
Odczynniki (do ćwiczeń 2.2. TŁUSZCZE ZŁOŻONE )
żółtko jaja kurzego
H
2
SO
4 ,
1M (kwas siarkowy)
bezwodnik kwasu octowego, stężony
KOH, 10% (roztwór alkoholowy
Na
2
SO
3
, krystaliczny (siarczyn sodu)
KNO
3
, krystaliczny (azotan potasu)
HNO
3
stężony (kwas azotowy)
molibdenianu amonu, 5%.
mieszanina etanolu z eterem, (1:1), eter, aceton, cholesterol (1% (roztwór chloroformowy)
3. AMINOKWASY i BIAŁKA

17
Wymagana jest znajomość następujących zagadnień:
2. Budowa, właściwości i podział aminokwasów. Aminokwasy kwasowe i zasadowe.
3. Rola biologiczna aminokwasów; aminokwasy egzogenne i endogenne.
4. Zasady budowy i nomenklatury białek: charakterystyka wiązania amidowego (ugrupowania peptydowego).
Nazewnictwo peptydów
5. Budowa przestrzenna białek. Kształtowanie i zachowanie struktury. Struktury drugorzędowe (helisa,
harmonijkowa, pętle). Białka strukturalne i globularne – oddziaływania stabilizujące natywną konformację.
6. Funkcje biologiczne i właściwości peptydów oraz białek.
Aminokwasy (kwasy 2-aminokarboksylowe), związki stałe, krystaliczne, o dość wysokiej temperaturze
topnienia, nierozpuszczalne w rozpuszczalnikach niepolarnych, są przede wszystkim składnikami peptydów i białek.
Tylko 20 aminokwasów ma trójnukleotydowe odpowiedniki w kodzie genetycznymi i te właśnie występują
powszechnie w białkach w każdym żywym organizmie. Wszystkie aminokwasy, znalezione w produktach hydrolizy
białek zbudowane są wg tego samego schematu (grupa aminowa i grupa karboksylowa związane są z tym samym
atomem węgla). Aminokwasy i ich pochodne mogą wchodzić w skład lipidów (np. fosfatydyloseryna), a niektóre
pełnią funkcje neuroprzekaźników lub są wykorzystywane do syntezy neuroprzekaźników czy hormonów. Określone
aminokwasy stanowią substraty np. glukozy w glukoneogenezie, puryn, pirymidyn czy hemu. Aminokwasy
nieproteogenne są związkami pośrednimi w metabolizmie aminokwasów proteogennych i w cyklu mocznikowym.
Poznanie właściwości i struktury aminokwasów stanowi podstawę zrozumienia budowy białek i ich znaczenia dla
procesów biochemicznych determinujących zjawiska życiowe.
Łańcuchy zawierające ponad 100 reszt aminokwasów określamy jako białka i są to wielkocząsteczkowe
związki o masie cząsteczkowej od ok. 13000 do kilku milionów. Białka, nawet różnego pochodzenia, mają podobny
skład pierwiastkowy (50-55% węgla, 6,6-7,3% wodoru, 25-19% azotu, 19-21% tlenu), mimo to różnią się znacznie
właściwościami fizycznymi, chemicznymi i biologicznymi.
Budowa, funkcje, oraz specyficzne właściwości białek są określone poprzez skład i sekwencję aminokwasów
w łańcuchu, a także poprzez ukształtowanie cząsteczki w przestrzeni.
Wszystkie białka są makrocząsteczkami, co jest przyczyną, że roztwory ich wykazują cechy koloidów (nie
dializują), wywierają ciśnienie koloido-osmotyczne, mają zdolność wiązania jonów, dzięki ładunkowi elektrycznemu
cząsteczki wędrują w polu elektrycznym. Białka w roztworach silnych elektrolitów ulegają wysoleniu, są wrażliwe na
podwyższoną temperaturę i inne czynniki denaturujące. Roztwory białek skręcają płaszczyznę światła
spolaryzowanego w lewo (są zbudowane z aminokwasów (z wyjątkiem glicyny) optycznie czynnych), Cechuje je
duży współczynnik załamania światła, którego wzrost jest proporcjonalny do stężenia białka w roztworze , co
wykorzystuje się do ilościowego białka metodą refraktometryczną. Białka zawierające tyrozynę lub tryptofan
pochłaniają światło nadfioletowe (maksimum przy λ=280 nm), a istnienie wiązań peptydowych warunkuje
pochłanianie przy λ=230 nm.
Białka można podzielić na proste (homoproteiny), składające się prawie wyłącznie z aminokwasów
(protaminy, histony,prolaminy, gluteliny, albuminy, globuliny i skleroproteiny) oraz na złożone (heteroproteiny), w
których poza aminokwasami możemy wykryć związki nieaminokwasowe, mocniej lub słabiej wbudowane w
cząsteczkę białka, w tym: fosfo-, chromo-, gliko-, lipo-, nukleo- i metaloproteidy.
Białka strukturalne są odpowiedzialne za mechaniczną stabilność narządów i tkanek.
Białka pełnią rolę transportową (hemoglobina czy białka osocza). Kanały jonowe i inne białka błonowe
pośredniczą w transporcie jonów oraz metabolitów przez błony biologiczne. W biochemicznych szlakach transdukcji
sygnału białka są cząsteczkami sygnałowymi (hormony, cytokiny) jak i receptorami wiążącymi cząsteczki sygnałowe.
Immunoglobuliny są ważnymi składnikami układu immunologicznego. Najliczniejszymi przedstawicielami
białek są enzymy ( około 2000), bardzo różniące się masą cząsteczkową od 10 000 (dehydrogenaza alkoholowa) do
500 000 (syntetaza glutaminowa). Białka są też odpowiedzialne za skurcz mięśni i inne procesy związane z ruchem.
Białka roślinne są źródłem białek ważnych w pożywieniu człowieka - jako źródło egzogennych aminokwasów , zaś
białka budujące mięśnie mogą być wykorzystywane jako materiał energetyczny (z aminokwasów w procesie
glukoneogenezy powstaje glukoza).
3.1. AMINOKWASY
3.1.1. Wykazanie właściwości amfoterycznych aminokwasów (na przykładzie tyrozyny)
Tyrozyna jest prawie nierozpuszczalna w punkcie izoelektrycznym (pH przy którym aminokwas nie jest
18
obdarzony ładunkiem, nie migruje w polu elektrycznym), a przechodzi do roztworu w środowisku kwaśnym lub
zasadowym. Większość aminokwasów przy obojętnym pH występuje jako jony obojnacze (forma amfoteryczna). W
przypadku aminokwasów punkt izoelektryczny jest identyczny z tzw. punktem izojonowym (czyli takim pH w
którym cząsteczka ma jednakową liczbę protonów uwolnionych od grup karboksylowych i protonów związanych z
grupami aminowymi).
Dla białek pojęcia te nie są jednoznaczne.
Wykonanie:
Rozpuścić w probówce około 0,1g tyrozyny w 0,5ml 1M HCl i dodawać stopniowo po kropli 2M NaOH.
Obserwować wytrącanie się osadu.
Przy pH =4,7 tyrozyna jest prawie nierozpuszczalna , osad rozpuszcza się w nadmiarze NaOH. Należy kontrolować
zmiany pH przy pomocy papierka uniwersalnego.
3.1.2. Reakcje barwne na aminokwasy
Reakcje barwne pozwalają wykazać obecność zarówno aminokwasów wolnych, jak i wchodzących w skład
cząsteczki białka.
3.1.2.1. Reakcja aminokwasów z ninhydryną – wykrywanie wolnych grup aminowych i karboksylowych
Dodatnią reakcję dają ogrzewane z ninhydryną wolne -aminokwasy i peptydy.
Ninhydryna w tych warunkach ulega redukcji, a aminokwas utlenieniu do odpowiedniego aldehydu (uboższy
o 1 atom węgla) z wydzieleniem CO
2
i NH
3
. Ninhydryna łączy się z amoniakiem i zredukowaną cząsteczką
ninhydryny, dając barwny związek. Intensywność barwy jest proporcjonalna do zawartości wolnych -aminowych
grup i może być podstawą do ilościowego oznaczania wolnych aminokwasów, jednak badana próba musi być wolna
od peptydów czy białek.
Uwaga! Barwny test z ninhydryną dają też sole amonowe i aminy (aminocukry).
C
H
COOH
NH
2
R
O
O
OH
OH
O
O
H
OH
CO
2
NH
3
C
O
H
R
O
O
H
OH
O
O
O
H
O
H
O
OH
N
O
O
NH
3
+
+
+
+
+
+
aminokwas
ninhydryna
zredukowana ninhydryna
zredukowana ninhydryna
ninhydryna
barwny kompleks
Wykonanie:
Do 1 ml 0,5M glicyny dodać kilka kropel roztworu 0,1% ninhydryny. Ogrzewać próbę we wrzącej łaźni
wodnej. Podobnie wykonać próbę z 1 ml słabo zakwaszonego roztworu białka jaja.
Pojawiająca się barwa niebieska świadczy o reakcji pozytywnej.
3.1.2.2. Reakcja ksantoproteinowa
Żółta barwa pochodzi od nitrowych pochodnych pierścieni benzenowych (z fenyloalaniny, tyrozyny,
tryptofanu), które pod wpływem zasad zmieniają się w związki o barwie pomarańczowej.
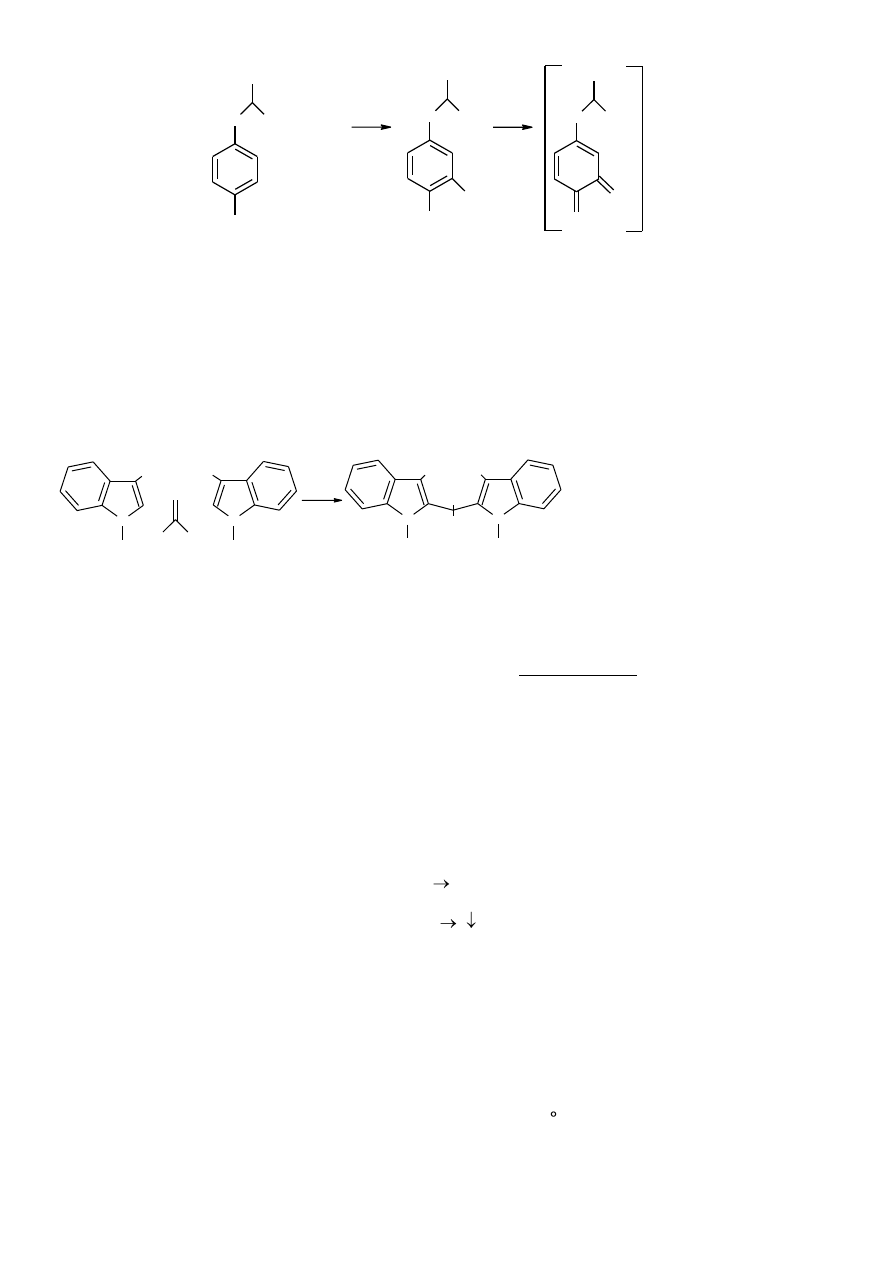
19
C
H
2
OH
COOH
NH
2
HNO
3
C
H
2
OH
COOH
NH
2
NO
2
-H
2
O
C
H
2
O
COO
NH
2
NO
2
n
NaOH
H
2
O
Na
+
+
-2
-
-
+2
pochodna nitrowa
(żółta)
pochodna aci-nitrowa
(pomarańczowa)
tyrozyna
Wykonanie:
Do 1 ml wody dodać kroplę 1M HCl, szczyptę tyrozyny i 0,5 ml stężonego kwasu azotowego. Próbę zagotować.
Po oziębieniu dodać 1ml 30% NaOH. Drugą próbę wykonać z roztworem białka jaja. Do 1 ml białka dodać 0,5
ml stężonego HNO
3
. Żółty osad wytrąconego białka zalać 1ml 30% NaOH (żółta barwa przechodzi w
pomarańczową. Uwaga! Reakcja silnie egzotermiczna.
3.1.2.3. Reakcja aldehydowa - wykazanie pierścienia indolowego w tryptofanie.
Związki zawierające pierścień indolowy (obecny w tryptofanie) w środowisku kwaśnym dają z aldehydami
barwne produkty kondensacji.
N
R
H
N
R
H
O
H
H
N
R
H
N
R
H
H
H
H
2
SO
4
H
2
O
+
+
-
tryptofan
aldehyd
mrówkowy
tryptofan
barwny produkt kondensacji
Wykonanie:
Do probówki z 1 ml roztworu białka (lub surowicy) dodać 1 kroplę roztworu 0,1% aldehydu mrówkowego i 1
kroplę 10% siarczanu rtęciowego (przed użyciem roztwór w butelce zamieszać, ponieważ HgSO
4
osadza się na
dnie w postaci żółtego osadu. Zamieszać i podwarstwić roztwór (bardzo ostrożnie, po ściance probówki) 1 ml
stężonego H
2
SO
4
.
Na granicy warstwy wodnej i kwasu siarkowego powstaje fioletowy pierścień. Po zamieszaniu próba barwi się na
purpurowo.
3.1.2.4. Reakcja cystynowa - wykazanie grup sulfhydrylowych (tiolowych).
Z cystyny i cysteiny w reakcji ze stężonym NaOH wydziela się siarkowodór, króry z octanem ołowiu daje
czarny osad. Z metioniną w tych warunkach próba wypada ujemnie. Białka ogrzewane w ługu sodowym hydrolizują,
a obecne w białku aminokwasy (cystyna i cysteina) przekształcają się w kwas pirogronowy, jony siarczkowe i siarkę.
W obecności jonów Pb
2+
powstaje czarny osad PbS.
(CH
3
COO)
2
Pb + NaOH
Pb(OH)
2
+ 2 CH
3
COONa
Pb(OH)
2
+ H
2
S
PbS + 2H
2
O
Wykonanie:
Do 0,5 ml roztw. białka dodać kilka kropel octanu ołowiawego (0,25M) i 1 ml 30% NaOH. Próbę ogrzewać we
wrzącej łaźni wodnej.
Uwaga! Po dodaniu HCl wydziela się trujący siarkowodór.
3.1.2.5. Reakcja na obecność metioniny.
Metionina i glicyna w reakcji z nitroprusydkiem sodowym dają barwne produkty o nieustalonej budowie.
Wykonanie:
Do 1 ml 1 % metioniny dodać 3 krople 30% NaOH i 3 krople 1% glicyny. Zamieszać i dodać 3 krople
nasyconego roztworu nitroprusydku sodu. Próbę umieścić w łaźni ( 40 C) na 10 minut. Po ostudzeniu dodać
kroplę stężonego kwasu solnego i zamieszać. Pojawiające się czerwone zabarwienie świadczy o obecności
metioniny.

20
3.1.2.6. Odczyn Sakaguchi - wykazanie argininy.
Związki zawierające grupę guanidynynową (arginina) utleniają się podbrominem sodu w obecności -naftolu
do barwnych produktów z jednoczesnym uwolnieniem amoniaku, który pod wpływem podbrominu także się utlenia.
Przy dłuższym działaniu podbrominu powstały barwnik ulega dalszemu utlenieniu i próba odbarwia się. Reakcja
znajduje zastosowanie do ilościowego oznaczania argininy w białku.
COOH
N
H
2
N
H
NH
N
H
2
OH
COOH
N
H
2
N
H
N
H
2
O
NaBrO
NH
3
NaBr
+
+
+
arginina
1-naftol
produkt barwny
(czerwony)
2 NH
3
+ 3 NaBrO
N
2
+ 3 H
2
O + 3 NaBr
Wykonanie:
Do 1 ml roztworu białka dodać 2-3 krople odczynnika Molischa (2% etanolowy roztwór -naftolu) i po
zamieszaniu kilka kropli podbrominu sodowego.
Powstające czerwone zabarwienie roztworu świadczy o obecności w białku argininy.
Odczynniki (do ćwiczenia 3.1. AMINOKWASY)
białko jaja kurzego
surowica krwi
HNO
3,
stężony (kwas azotowy)
H
2
SO
4
, stężony (kwas siarkowy)
HCl, stężony (kwas solny)
HCl, 1M (kwas solny)
NaOH, 2M (wodorotlenek sodu)
NaOH, 30%.
glicyna, 0,5M
glicyna, 1%
metionina, 1%
tyrozyna, krystaliczna
Pb(CH
3
COO)
2
, 0,25M (octan ołowiawy)
HgSO
4
, 10% (siarczan rtęciowy)
aldehyd mrówkowy, 0,1%
nitroprusydek sodu, roztwór nasycony
ninhydryna, 0,1% (roztwór w 50% etanolu)
podbromin sodowy (do 50 ml 40% NaOH dodać kilka kropel bromu)
Odczynnik Molischa ( 2% etanolowy roztwór -naftolu)
3.2. BIAŁKA

21
3.2.1. Amfoteryczność białek
Większość białek dobrze rozpuszcza się w wodzie, niektóre rozpuszczają się tylko w rozcieńczonych
roztworach soli, kwasów i zasad. O rozpuszczalności białek decyduje ich zdolność do hydratacji, budowa, obecność
soli w środowisku oraz pH roztworu. Peptydy i białka mają również swoje punkty izoelektryczne, ale są one istotnie
zróżnicowane w zależności od składu aminokwasowego tych cząsteczek. Ze względu na amfoteryczny charakter
białek można je miareczkować zarówno rozcieńczonym roztworem zasad, jak i kwasów i w ten sposób określić ich
punkt izoelektryczny. Punkt izoelektryczny będzie powyżej pH 7 dla białek zawierających aminokwasy zasadowe
(arginina, histydyna, lizyna) i poniżej pH 7 dla białek zawierających aminokwasy kwaśne (kw.asparaginowy,
glutaminowy). Większość białek globularnych ma punkty izoelektryczne w przedziale pH 4,5-6,5 (ale np. pepsyna
przy pH 1 czy trypsyna przy pH 10,5). Znajomość pI ma znaczenie przy rozdzielaniu i charakteryzowaniu białek. W
punkcie izoelektrycznym można białka najłatwiej wytrącić i wykrystalizować (najmniejsza rozpuszczalność),
wykazują najmniejsze ciśnienie osmotyczne, najsłabiej pęcznieją, mają najmniejszą lepkość i nie reagują z anionami
czy kationami. Białka wykazują różnice w rozpuszczalności w zależności od pH roztworu, temperatury,
rozpuszczalnika, stężenia jonów soli w roztworze (siły jonowej). Niewielkie stężenia jonów wpływają dodatnio na
rozpuszczalność, przy większym stężeniu soli białko wytrąca się. Przyczyną tego zjawiska jest odciąganie cząsteczek
wody od cząsteczek białka przez jony soli. Zjawisko to zostało wykorzystane do rozdziału mieszaniny białek,
ponieważ wysalanie nie zmienia rodzimych właściwości białek, tzn. białko wytrącone siarczanem amonu nie ulega
denaturacji i po oddializowaniu soli otrzymujemy czysty roztwór białka o pełnej aktywności biologicznej. Sole metali
ciężkich w połączeniu z białkami są trudno rozpuszczalne (małe wartości stałych dysocjacji) i np. sole rtęci, ołowiu,
miedzi, wykorzystywane są do wytrącania białek z roztworów. Połączenia z niektórymi anionami, zwłaszcza kwasów
organicznych (kwas sulfosalicylowy, pikrynowy, trichlorooctowy), są nierozpuszczalne. Zjawisko to wykorzystuje się
do odbiałczania roztworów (białka wtedy jednak najczęściej ulegają denaturacji). Alkohole i inne substancje
organiczne (eter, aceton) niszczą warstwę wodną otaczającą cząsteczki białek i powodują wypadanie ich z roztworu
(efekt podobny do wysalania) ale białka wytrącane w ten sposób w niskiej temperaturze (-5 C do -15 C) nie ulegają
denaturacji. Ogrzanie białka powyżej 60 C powoduje również ich denaturację (niezależnie od innych czynników). W
środowisku kwaśnym i zasadowym, mimo denaturacji cieplnej, białko nie wytrąca się.
3.2.1.1. Wykazanie właściwości amfoterycznych żelatyny
Wykonanie:
Przygotować 4 probówki i dodawać odczynniki wg schematu.
Próba
Woda
destylowana
0,5% roztwór
żelatyny
Błękit
bromotymolowy
Zieleń
bromokrezolowa
1.
2 ml
-
-
1 kropla
2.
-
2 ml
-
1 kropla
3.
2 ml
-
1 kropla
-
4.
-
2 ml
1 kropla
-
Do prób 1. i 2. dodawać kroplami z pipety 0,01M HCl, aż do wystąpienia barwy żółtej (zanotować ilość kwasu
solnego dodanego do każdej z prób). Do prób 3. i 4. dodawać po kropli z pipety 0,01M NaOH, aż do
wystąpienia barwy niebieskiej (zanotować ilość wodorotlenku sodowego dodanego do każdej z prób).
Porównać wyniki miareczkowania wody i roztworu białka (żelatyny).
3.2.1.2. Wyznaczanie punktu izoelektrycznego kazeiny.
Dodając kazeinę do roztworów o różnym pH (zawierających odpowiednie stężenia CH
3
COOH i CH
3
COONa)
poszukujemy wartości pH (co odpowiada pI kazeiny) przy którym wystąpił najobfitszy osad.
Wykonanie:
Przygotować 9 probówek. Do pierwszej probówki wlać 1,6 ml 1 M CH
3
COOH i 4,4 ml wody, a do pozostałych
po 2,5 ml wody. Po wymieszaniu zawartości z pierwszej probówki przenieść do drugiej 2,5 ml roztworu , a z
drugiej 2,5 ml do trzeciej itd. Z ostatniej wylać 2,5 ml roztworu. Do każdej próby dodać po 0,5 ml kazeiny ,
wymieszać, odstawić na 30 minut.
Wynik wpisać do tabeli.
numer probówki
1
2
3
4
5
6
7
8
9
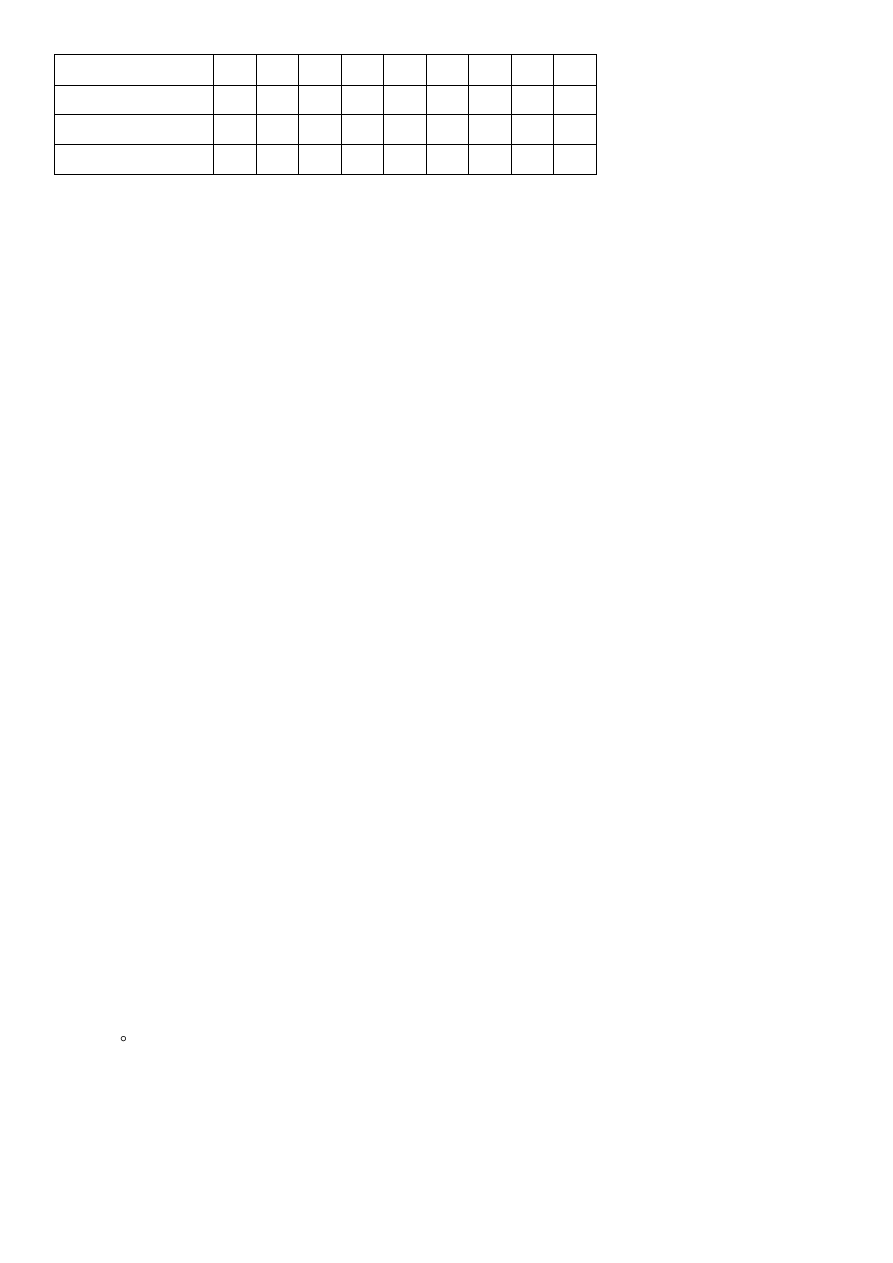
22
0,1 M CH
3
COOH
1,6
0,8
0,4
0,2
0,1
0,05
0,025 0,012 0,006
pH roztworu
3,6
3,8
4,1
4,4
4,7
5,0
5,3
5,6
5,9
zmętnienie
osad
3.2.2.Rozpuszczalność białek. Wysalanie białek.
3.2.2.1. Wpływ pH na rozpuszczalność białek.
Wykonanie:
1 ml surowicy rozcieńczyć dwukrotnie wodą (1:1) i dodawać kroplami 0,1M HCl, aż do zmętnienia roztworu.
Sprawdzić pH. Następnie dodawać kroplami 10% NaOH, aż do rozpuszczenia się osadu.
3.2.2.2. Rozpuszczalność globulin w wodzie i rozcieńczonych roztworach soli.
Globuliny w wodzie są nierozpuszczalne z powodu skłonności do tworzenia agregatów. Kationy i aniony soli
zobojętniają ładunki dipola białkowego i uniemożliwiają agregację. Albuminy są dobrze rozpuszczalne w wodzie
(moment dipolowy mniejszy od globulinowego) wykazują też większe powinowactwo do wody.
Wykonanie:
Do 0,5 ml surowicy krwi dodać 10 ml wody, zmieszać i odstawić na kilka minut.
Pojawia się zmętnienie, które znika po dodaniu kilku kryształków NaCl.
3.2.2.3. Ekstrahowanie białek roślinnych rozcieńczonymi roztworami soli.
Wykonanie:
Około 0,5 g mączki grochowej zalać 10 ml 0,9% NaCl i ekstrahować około 15 minut. Odwirować osad. 1 ml
supernatantu rozcieńczać powoli wodą do pojawienia się zmętnienia (wytrącanie globulin). Dodać parę
kryształków NaCl. Osad białka rozpuszcza się ponownie.
3.2.2.4. Wysalanie białka – oddzielenie albumin od globulin.
Zawartość białka w surowicy wynosi średnio70 g/litr, z czego albuminy stanowią około 60%, a α-globuliny-
12%, β-globuliny-10%, γ-globuliny-18%. Zawartość białka zwiększa się rzadko (np. w szpiczaku pojawia się białko
patologiczne), zmniejsza się częściej np. przy dużej utracie białka z ustroju w nerczycach. Często przy prawidłowym
poziomie białka ogólnego zachodzą przesunięcia w obrębie poszczególnych frakcji. Zmniejszenie frakcji
albuminowej na korzyść frakcji globulinowej powoduje zmniejszenie współczynnika albuminowo-globulinowego
(A/G - normalnie wynosi 1,5). Zmniejszenie ilości albumin może wiązać się z niedostateczną ich podażą, nadmierną
ich utratą z ustroju (białkomocz, wysięki), lub zahamowaniem syntezy (choroby wątroby). Zwiększenie frakcji
globulin występuje w stanach zapalnych, w przewlekłych chorobach zakaźnych lub schorzeniach wątroby.
Albuminy można oddzielić od globulin wykorzystując ich różną rozpuszczalność w stężonych roztworach
soli. Globuliny tracą wodę hydratacyjną już przy 50% nasyceniu siarczanem amonu. Albuminy wysalają się dopiero
przy całkowitym nasyceniu roztworu.
Wykonanie:
Surowicę krwi (0,5 ml) rozcieńczyć solą fizjologiczną (2,5 ml), dodać 3 ml nasyconego siarczanu amonu. Po
dokładnym wymieszaniu (półnasycenie) odsączyć wytrącone globuliny. Do przesączu dodawać powoli
kryształki siarczanu amonu tak długo, aż na dnie probówki pojawią się wytrącone albuminy.
3.2.3. Denaturacja białek
3.2.3.1. Wytrącanie albumin i globulin etanolem.
W środowisku o pH ok. 5 globuliny wytrącają się przy 15%, a albuminy przy 40% stężeniu etanolu. Przy
innych wartościach pH konieczne jest większe stężenie etanolu. Białka wytrącane etanolem lub acetonem w temp.
około –15 C nie ulegają denaturacji, co wykorzystuje się do wydzielania frakcji białek.
Wykonanie:
Do 0,5 ml surowicy dodać 3 ml 0,9% NaCl, oziębić w łaźni lodowej, dodać 1ml wyziębionego 96% etanolu.
Pojawia się zmętnienie, które znika po natychmiastowym rozcieńczeniu.
3.2.3.2. Denaturacja termiczna białek.
Denaturacja białek to zmiany w konformacji łańcucha z utratą rodzimych właściwości pod wpływem
czynników fizycznych (ogrzewanie, wysychanie, ultradźwięki, promieniowanie krótkofalowe, wytrząsanie wodnych

23
roztworów białka w atmosferze powietrza) lub chemicznych (kwasy, zasady, jony metali ciężkich, mocznik,
detergenty, fenol, chloroform, etanol, aceton). Ulega zniekształceniu lub zniszczeniu struktura białka (IV,III,II rzędu)
bez hydrolitycznej degradacji łańcucha. Zagotowanie stężonych roztworów białek powoduje natychmiastowe
wytrącanie się osadu zdenaturowanego białka. By wytrącić białko z rozcieńczonych roztworów konieczne jest
zakwaszenie.
Wykonanie:
Przygotować 2 probówki .
Do pierwszej dodać 2 ml rozcieńczonej surowicy (1:5) i 2 krople 2M CH
3
COOH.
Po zagotowaniu wytrąca się osad białka.
Do drugiej wlać 2 ml rozcieńczonego roztworu białka jaja zagotować i dodać 2 krople 2M CH
3
COOH.
Wytrąca się denaturowane białko.
Ciepło powodując zrywanie wiązań wodorowych w cząsteczkach prowadzi do nieodwracalnej denaturacji białek.
Proces denaturacji cieplnej rozpoczyna się w różnych temperaturach dla różnych białek – między 40 C a 100 C.
Tylko nieliczne białka wytrzymują krótkie gotowanie ( żelatyna, rybonukleaza).
3.2.3.3. Reakcje białek z jonami
3.2.3.3.1. Strącanie białka kationami (solami metali ciężkich).
Jeżeli wartość pH jest większa od pI cząsteczki białka stają się anionami i mogą reagować z kationami
tworząc sole o bardzo małej dysocjacji i trudno rozpuszczalne.
Wykonanie:
Przygotować 4 probówki.
1) Do probówki z 1 ml roztworu białka jaja kurzego dodać parę kropel roztworu 1% FeCl
3
.
Uwaga; delikatny, brunatny osad rozpuszcza się w nadmiarze odczynnika.
2) Do probówki z 1 ml białka jaja kurzego dodać parę kropli roztworu 0,1% CuSO
4
. 5 H
2
O.
Wytrącony jasnobłękitny osad białczanu miedziowego rozpuszcza się w nadmiarze dodanego 2 M NaOH (około 1
ml), dając fiołkowe zabarwienie próby.
3) Do 1 ml roztworu białka jaja kurzego dodać 1 ml roztworu 0,1M AgNO
3
. 4) Podobną próbę wykonać
dodając do probówki z 1 ml białka jaja 1 ml 0,25M (CH
3
COO)
2
Pb.
Obserwuje się wytrącanie białka nierozpuszczalnego w nadmiarze soli.
3.2.3.3.2. Strącanie białka anionami
Po stronie kwasowej punktu izoelektrycznego cząsteczki białka mają ładunek dodatni i zdolność reagowania z
anionami. Niektóre kwasy organiczne w większych stężeniach stosuje się do odbiałczania płynów biologicznych.
Kwasy nieorganiczne denaturują białka (HCl, H
2
SO
4
, HNO
3
), ale tylko kwas azotowy wytrąca je z roztworu.
Wykonanie:
Przygotować trzy probówki i wykonać z roztworem białka poniższe reakcje:
1) Działanie stężonego kwasu azotowego - reakcja Hellera.
Na 1 ml stężonego HNO
3
nawarstwić 0,5 ml roztworu białka jaja kurzego.
Na granicy zetknięcia się warstw pojawia się pierścień z wytrąconego białka.
2) Działanie kwasu trichlorooctowego
Po zadaniu 0,5 ml roztworu białka 3 ml 10% CCl
3
COOH obserwuje się wytrącanie białego osadu
zdenaturowanego białka.
Kwas trichlorooctowy stosuje się najczęściej do odbiałczania płynów biologicznych.
3) Działanie taniny.
Wykonanie:
Do 1 ml roztworu białka dodać 1 ml 5% taniny.
Wytrąca się białko. Lecznicze działanie garbnika na oparzoną skórę polega na powierzchniowym ścięciu się białka,
które tworzy nierozpuszczalną błonę chroniącą uszkodzone tkanki..
3.2.3.4. Reakcje barwne białek.
3.2.3.4.1. Reakcja biuretowa Piotrowskiego

24
H
3
N C
R
1
H
C
O
O
H
3
N C
R
2
H
C
O
O
H
3
N C
R
1
H
C
O
N
H
C
R
2
C
O
O
H
2
O
+
wiązanie peptydowe
+
(Delokalizacja elektronów w obrębie wiązania peptydowego powoduje, że staje się ono polarne i może występować w dwóch
odmianach tautomerycznych!)
Reakcja biuretowa jest swoistą reakcją na obecność wiązania peptydowego (aby zaszła reakcja konieczne są
minimum 2 wiązania)
Opiera się na reakcji jonów miedziowych w środowisku zasadowym z biuretem.
Wykonanie:
Do probówki z1 ml roztworu białka dodać 1 ml 2M NaOH i parę kropel 0,1% CuSO
4
. 5 H
2
O.
W wyniku tej reakcji powstaje czerwono-fiołkowy produkt soli kompleksowej.
3.2.3.4.2. Reakcja Liebermanna.
Wykonanie:
Wlać do probówki 1 ml rozcieńczonej surowicy i 1 ml stężonego HCl i ogrzewać we wrzącej łaźni przez 10
minut.
Roztwór zabarwia się stopniowo na fioletowo. Reakcja ta jest charakterystyczna dla glikoprotein. Białko hydrolizuje
a z cukrów powstają pochodne furfuralu, które z uwolnionymi fenolami dają fioletowe połączenia.
Odczynniki (do ćwiczenia3.3 BIAŁKA)
białko jaja kurzego, surowica krwi, mączka grochowa, żelatyna, 0,5%
HNO
3
, stężony (kwas azotowy)
H
2
SO
4
, stężony (kwas siarkowy)
HCl, stężony (kwas solny)
HCl, 0,1M
HCl, 0,01M
CH
3
COOH, 1M (kwas octowy)
CH
3
COOH, 2M
CCl
3
COOH (kwas trichlorooctowy), 10%
tanina, 5% (kwas taninowy)
NaOH, 1 M (wodorotlenek sodu
NaOH, 2 M
NaOH, 10%
NaOH, 0,01M
NaCl, krystaliczny (chlorek sodu)
NaCl, 0,9%
(NH
4
)
2
SO
4,
krystaliczny (siarczan amonu)
(NH
4
)
2
SO
4
, roztwór nasycony
FeCl
3
, 1% (chlorek żelazowy)
CuSO
4
. 5 H
2
O, 0,1% (uwodniony siarczan miedzi)
AgNO
3,
0,1M
(CH
3
COO)
2
Pb, 0,25M
etanol, 96%, wychłodzony
błękit bromotymolowy i zieleń bromokrezolowa (wskaźniki)
kazeina, 0,1 M w CH
3
COONa ( 0,25 g kazeiny rozpuścić w 25 ml wody ogrzanej do 40 C,
dodać 5 ml 1M NaOH, 5 ml 1M CH
3
COOH i uzupełnić wodą do 50 ml).
3.2.4. Oznaczanie zawartości białka
3.2.4.1. Ilościowe oznaczanie białka surowicy krwi metodą biuretową

25
Aby ilościowo oznaczyć białko w próbie, wykonujemy reakcję biuretową. Intensywność zabarwienia
roztworu jest wprost proporcjonalna do liczby wiązań peptydowych. Ze względu na traktowanie próby NaOH (co
zapewnia utrzymanie białka w roztworze) metoda jest szczególnie przydatna do zawartości białka w płynach
biologicznych, homogenatach tkankowych, zawiesinach podstruktur komórkowych itp. Reakcja ta jest powszechnie
stosowana do oznaczania białka w surowicy krwi w laboratoriach klinicznych.
Wykonanie:
Do 0,1 ml surowicy krwi obwodowej dodać 3,4 ml 0,2M NaOH. Po wymieszaniu dodać 4 ml odczynnika
biuretowego i odstawić na 30 min. Zmierzyć absorbancję przy długości fali = 550 nm wobec próby
odczynnikowej (0,1 ml wody + 3,4 ml 0,2M NaOH + 4 ml odczynnika biuretowego). Wartość absorbancji jest
wprost proporcjonalna do stężenia białka całkowitego. Posługując się wykresem kalibracyjnym należy odczytać
stężenie białka w analizowanej próbie.
Odczynniki
0,2M NaOH (wodorotlenek sodu)
Odczynnik biuretowy: 0,9 g winianu sodowo potasowego i 0,3 g siarczanu miedzi (CuSO
4
x 5 H
2
O) rozpuścić w 40
ml 0,2M NaOH. Dodać 0,5 g KJ i uzupełnić wodą do 100ml.
3.2.4.2. Oznaczanie białka metodą pomiaru absorbancji w nadfiolecie.
Dzięki obecności tyrozyny i tryptofanu białka mogą wykazywać maksimum absorbancji przy = 280 nm.
Zakłócają pomiar kwasy nukleinowe mające maksimum pochłaniania przy = 260 nm. Metoda jest obarczona
znacznym błędem, ale ze względu na szybkość oznaczenia w małej ilości materiału w obecności dużych stężeń soli
jest szeroko stosowana.
Wykonanie:
Dokonać pomiaru absorbancji próby badanej (rozcieńczony roztwór albuminy) wobec próby odczynnikowej (
rozpuszczalnik) przy = 280 nm i = 260 nm i obliczyć orientacyjną zawartość białka ze wzoru:
C białka = 1,55 · A
( 280nm)
─ 0,76 ·A
( 260nm)
Odczynniki : albumina 1% , (roztwór w soli fizjologicznej)
4. KWASY NUKLEINOWE
Wymagana jest znajomość następujących zagadnień:
1.
Nukleotydy: budowa i właściwości.
2. Znaczenie biologiczne wolnych nukleotydów.
3. Kwasy nukleinowe: DNA i RNA, budowa przestrzenna.
4. Organizacja informacji genetycznej( cechy kodu genetycznego) - replikacja, transkrypcja, translacja.
Mutacje i czynniki mutagenne.
Niezwykłe osiągnięcia w dziedzinie chemii i fizjologii kwasów nukleinowych są możliwe dzięki modelowi
struktury przestrzennej DNA (Watsona i Crick - 1953 r.). Istotą życia jest zdolność do powielania przez organizmy
swojej informacji genetycznej i przekazywania jej organizmom potomnym.
Podstawę tej informacji stanowi kwas dezoksyrybonukleinowy i następujący jej kierunek przekazywania:
DNA
RNA
białka
komórka
organizm
Centralnym dogmatem biologii molekularnej jest poniższy schemat przepływu informacji genetycznej:
DNA
DNA
RNA
białko
Synteza potomnej cząsteczki DNA to replikacja, przekazywanie informacji z DNA na RNA – transkrypcja, a
z RNA dla syntezy białka - translacja (przetłumaczenie informacji zapisanej jako sekwencja nukleotydów na „język
aminokwasów”, przekazywanie informacji z RNA na DNA to odwrotna transkrypcja.
Kwasy nukleinowe powstają z połączenia nukleotydów, składających się z zasady azotowej (purynowej lub
pirymidynowej), cukru (pentozy) oraz reszty fosforanowej. Zasady azotowe łącza się z cząsteczkami cukru wiązaniem
N-glikozydowym tworząc nukleozydy, a nukleozyd połączony wiązaniem fosfoestrowym z kwasem fosforowym
tworzy nukleotyd, podstawową jednostkę łańcucha polinukleotydowego Wyróżnia się pierwszo-, drugo-,
trzeciorzędową i wyższe struktury kwasów nukleinowych. Kwasy nukleinowe stanowią niebiałkową część
nukleoprotein. Ogrywają główną rolę w przechowywaniu (DNA) i w procesach ekspresji genów i biosyntezie białek
(RNA).

26
Wolne nukleotydy magazynują energię (ATP, GTP, CTP, UTP) wykorzystywaną w procesach fosforylacji
czy aktywacji związków: aktywna glukoza(UDP-glukoza), aktywna cholina(CDP-cholina), S-adenozylometionina),
Nukleotydy są składnikami koenzymów (NAD,NADP,FAD) jak i wtórnymi przekaźnikami informacji hormonalnej
(cAMP czy cGMP).
4.1. Badanie DNA
4.1.1. Izolowanie kwasu deoksyrybonukleinowego z wątroby
Wykonanie:
W moździerzu utrzeć 5 g wątroby, pociętej na drobne kawałki, z niewielką ilością piasku. Dodać 20 ml 0,9%
NaCl. Zawiesinę przesączyć przez gęstą gazę. W zlewce (na 50 ml) zmieszać 10 ml przesączu z 1 ml siarczanu
dodecylu , którego dodanie tego powoduje wzrost lepkości roztworu i odstawić na 5min. Następnie powoli,
ciągle mieszając dodawać krystaliczny NaCl (około 0,6 g). Odwirować wytrącone białko, a nadsącz umieścić w
zlewce (50 ml) i powoli, ciągle mieszając bagietką, wlewać po ściance 10 ml schłodzonego 96% etanolu (-15
0
C).
Pod wpływem alkoholu wytrącają się włókienka DNA, które można nawinąć na bagietkę i wysuszyć na sączku.
4.1.2. Otrzymywanie hydrolizatu nukleinianów
Wykonanie:
W probówce umieścić otrzymany z wątroby preparat DNA, dodać 2ml wody i 1 ml stężonego H
2
SO
4
i
hydrolizować próbę przez 30 minut we wrzącej łaźni wodnej. Roztwór oziębić i rozcieńczyć dwukrotnie wodą.
4.1.3. Wykrywanie składników kwasów nukleinowych
a. Wykrywanie puryn w kwasach nukleinowych
Wykonanie: Do 1 ml 1% hydrolizatu nukleinianu dodać 0,5 ml amoniaku do słabo zasadowej reakcji i kilka
kropel amoniakalnego roztworu AgNO
3
. Wytrąca się biały, delikatny osad soli srebrowych puryn.
b. Wykrywanie kwasu fosforowego.
Wykonanie : Do 1 ml hydrolizatu dodać 0,5 ml stężonego HNO
3
i 1 ml 5% molibdenianu amonu. Po zagotowaniu
wytrąca się żółty osad, co świadczy o obecności fosforanów.
c. Wykrywanie pentoz
Wykonanie: Do 1 ml hydrolizatu dodać 1 ml roztworu 0,5%floroglucyny i ogrzewać do wrzenia.
Czerwone zabarwienie płynu świadczy o obecności pentoz.
4.1.3.3.1. Wykrywanie deoksyrybozy.
Wykonanie:
Do 1 ml hydrolizatu dodać 2 ml odczynnika dwufenyloaminowego i wstawić do wrzącej łaźni wodnej.
DNA reaguje z dwufenyloaminą w obecności kwasu octowego i siarkowego, dając niebiesko zabarwiony produkt
reakcji. Reakcja ta może być podstawą do kolorymetrycznego oznaczania DNA, bowiem absorpcja światła o długości
fali 600 nm (niebieski zakres widma światła) jest proporcjonalna do zawartości tego kwasu.
Odczynniki
Wątroba, piasek
HNO
3,
stężony (kwas azotowy)
H
2
SO
4,
stężony (kwas siarkowy)
amoniak, stężony (25% woda amoniakalna)
NaCl, krystaliczny (chlorek sodu)
NaCl, 0,9% (sól fizjologiczna)
AgNO
3,
0,1M (roztwór amoniakalny)
etanol, 96% (wychłodzony do -15
º
C).
molibdenian amonu, 5%
siarczanu dodecylu, 5% (roztwór w 50% etanolu)
hydrolizat nukleinianów
floroglucyna, 0,5%
odczynnik dwufenyloaminowy
5. ENZYMY
Wymagana jest znajomość następujących zagadnień:

27
1. Ogólne właściwości enzymów. Klasyfikacja enzymów i nazewnictwo.
2. Mechanizm katalizy enzymatycznej. Centrum aktywne. Specyficzność działania i specyficzność substratowa
enzymów
3. Aktywność enzymatyczna. Jednostki enzymatyczne i czynniki wpływające na szybkość reakcji enzymatycznej,
regulacja aktywności enzymów.
4. Izoenzymy, preenzymy, kompleksy wieloenzymatyczne.
5. Koenzymy, witaminy.
Enzymy są złożonymi, ciepłochwiejnymi wielkocząsteczkowymi białkowymi biokatalizatorami, tzn.
związkami wytwarzanymi przez żywe komórki (ale mogą działać poza komórkami), chociaż znana jest także
aktywność kaltalityczna kwasów rybonukleinowych. Odznaczają się dużą swoistością w przyspieszaniu i nadawaniu
odpowiedniego kierunku reakcjom chemicznym. Cząsteczka enzymu tworzy z substratem przejściowy, labilny
kompleks, z którego po przekształceniu substratu uwalnia się produkt reakcji, a niezmieniony enzym może ponownie
połączyć się z następną cząsteczką substratu.
Wyróżnić można trzy kategorie enzymów:
enzymy - białka proste, w których rolę grupy czynnej spełniają specyficzne zespoły aminokwasów (enzymy
proteolityczne – amylaza, RNaza),
enzymy - białka złożone zawierające nieaminokwasowe grupy chemiczne trwale związane z cząsteczką
białkową tzw. grupy prostetyczne ( katalaza, peroksydaza,
enzymy należące do białek złożonych zawierające związane luźno nieaminokwasowe grypy zwane
koenzymami, część białkowa zwie się wtedy apoenzymem, a aktywny enzym jako całość – holoenzymem (np.
dehydrogenazy, których koenzymem może być NAD+ lub jego fosforan NADP+).
Zorganizowany przebieg procesów metabolicznych (szlaków metabolicznych precyzyjnie - skoordynowanych
ciągów następujących po sobie reakcji chemicznych) umożliwia fakt, że każda komórka korzysta z własnych,
genetycznie zaprogramowanych narzędzi enzymatycznych. Wiele ciągów reakcji enzymatycznych przebiega na
błonach. Enzymy podlegają wielu mechanizmom regulacyjnym w zależności od zmiennych warunków środowiska
wewnętrznego organizmu. Tylko wyjątkowo można oznaczyć ilość enzymu bezpośrednio na podstawie zawartości
białka ( metody cytometryczne, przeciwciała). Biochemiczne oznaczanie opiera się na założeniu, że aktywność
enzymu jest proporcjonalna do jego stężenia, a miarą aktywności jest szybkość katalizowanej reakcji, przebiegającej
w warunkach optymalnych, przy nadmiarze substratu. Funkcja enzymu wyraża się przebiegiem katalizowanej reakcji,
a ilość enzymu w układzie można oznaczyć na podstawie pomiaru szybkości reakcji ( w określonych ściśle
warunkach szybkość ta jest proporcjonalna do ilości enzymu). Jednostką aktywności enzymatycznej jest katal.
Jest to taka aktywność enzymu, która przekształca 1 mol substratu w czasie 1 sekundy, a jej mianem jest „mol/s”.
Jednym z kryteriów jednorodności enzymów jest osiągniecie w wyniku oczyszczania, maksymalnej liczby jednostek
aktywności przypadających na 1 mg azotu białkowego. Otrzymanie enzymów z materiału biologicznego wymaga
takiego postępowania i doboru metod, które pozwalają na zachowanie pełnej ich aktywności. Oznaczenie aktywności
niektórych enzymów w płynach ustrojowych znalazło szerokie zastosowanie diagnostyczne. Całkowita aktywność
enzymu oznaczonego w surowicy może odzwierciedlać rozmiar uszkodzenia, rodzaj wykrywanych we krwi
izoenzymów np. dehydrogenazy mleczanowej wskazuje na miejsce uszkodzenia komórkowego, gdyż każdy gen ulega
w różnych narządach odmiennej ekspresji i każdy narząd ma charakterystyczny profil izoenzymów. Stosunkowo
najlepiej rozwinęła się diagnostyka enzymologiczna schorzeń mięśnia sercowego, wątroby, trzustki czy żołądka.
Występowanie tego samego enzymu w kilku odmianach zwanych izozymami, które różnią się budową i
właściwościami fizycznymi lecz wykazują takie samo działanie utrudnia izolowanie i oczyszczanie enzymów.
Wiele enzymów może występować w różnych konformacjach, które mają różne właściwości katalityczne, a
ich wzajemne przekształcenia są regulowane przez substraty i inne ligandy (np. enzymy alosteryczne).Także
temperatura i wiele substancji może mieć wpływ na aktywność enzymatyczną. Szczególne znaczenie mają inhibitory
enzymów (inhibicję kompetycyjna, niekompetycyjna czy allosteryczna).
5.1. Kinetyka reakcji enzymatycznych
Kinetyka reakcji enzymatycznych obejmuje badania szybkości ich przebiegu w zależności od stężenia
reagujących substancji, temperatury, pH, obecności aktywatorów i inhibitorów. Badanie kinetyki pozwala na
ustalenie charakteru reakcji i poznanie zależności między szybkością reakcji a czasem jej trwania.
Szybkość reakcji jest proporcjonalna do stężenia substancji reagujących i oznacza stosunek przyrostu
(ubytku) stężenia produktu reakcji do czasu, w którym ten przyrost nastąpił, gdyby szybkość reakcji w tym okresie
była niezmienna. Miarą szybkości reakcji jest przyrost stężenia produktu jaki nastąpił w jednostce czasu.
Stała Michaelisa jest to takie stężenie substratu, przy którym szybkość reakcji osiąga połowę szybkości
maksymalnej ; Stała Michaelisa określa liczbowo powinowactwo enzymu do substratu. Niskie wartości Km wskazują
28
na duże powinowactwo enzymu do substratu oraz dużą szybkość procesu i odwrotnie. Wartości Km dla większości
enzymów wahają się w granicach 10-2 10
-5
M. Zależność między stężeniem substratu a szybkością reakcji
enzymatycznej opisuje równanie Michaelisa-Menten.
5.1.1. Badanie enzymatycznej aktywności amylazy ślinowej
Amylaza należy do hydrolaz i powoduje hydrolityczny rozkład skrobi, przez rozrywanie wiązań
glikozydowych pomiędzy cząsteczkami glukozy (budującymi dużą cząsteczkę wielocukru). Skrobia rozpada się
stopniowo poprzez amylo-, erytro-, achrodekstryny do pojedynczych cząsteczek glukozy. Przy pomocy reakcji z
jodem, można śledzić szybkość rozkładu skrobi. Obserwuje się intensywnie niebieską barwę w reakcji z amylozą
(skrobią), amylodekstryny dają barwę fioletową, erytrodekstryny czerwoną, natomiast achrodekstryny, zawierające
niewielką ilość reszt glukozy, nie dają zabarwienia z jodem. Hydrolizat wykazuje właściwości redukcyjne w związku
z pojawiającą się coraz większą ilością wolnych grup aldehydowych.
5.1.1.1. Wpływ temperatury na aktywność amylazy
Wykonanie:
Przygotować preparat amylazy w podany sposób: przepłukać dokładnie usta ciepłą wodą. Następnie nabrać do ust
około 20 ml wody (destylowanej) i po kilku minutach wypluć wodę do zlewki. Przesączyć roztwór śliny przez watę.
Otrzymany roztwór stanowi badany preparat amylazy ślinowej.
Do trzech probówek wprowadzić 1 ml rozcieńczonego (0,005M) roztworu J
2
w KJ, 1 ml buforu (pH 6,6) i 1
ml 1% roztworu skrobi. Zamieszać próby i dodać do każdej po 1 ml roztworu śliny (amylaza). Jedną
probówkę wstawić do zlewki z lodem (0
º
C), drugą pozostawić w temperaturze pokojowej, a trzecią wstawić do
łaźni wodnej o temperaturze 37
º
C. Po paru minutach porównać szybkość reakcji w różnych
temperaturach(czas, który upłynął do odbarwienia próbki). Wskazać optymalną temperaturę dla działania
amylazy.
5.1.1.2. Stopniowy rozkład skrobi przez amylazę
Wykonanie:
Przygotować 2 szeregi po 10 probówek. Do pierwszego szeregu wlać po 1 ml roztworu jodu, do drugiego po 0,5
ml 2M NaOH. W celu hydrolizy probówkę z badanym roztworem (5 ml roztworu 1% skrobi + 5 ml
przygotowanego preparatu amylazy) wstawić do łaźni wodnej o temp. 37
º
C. Co pół minuty pobierać pipetą
próbki hydrolizatu (0,5 ml) i wlewać kolejno do probówek z obu szeregów. Obserwować przebieg reakcji
barwnej z jodem w pierwszym szeregu, a do drugiego dodać po 1 ml odczynnika Benedicta i zagotować w łaźni
wodnej. Obserwować pojawianie się osadu tlenku miedziawego ( reakcja redukcyjna na glukozę).
5.1.1.3. Wpływ jonów chlorkowych na aktywność amylazy (silnie wzmagają aktywność amylazy).
Wykonanie:
Przygotować jedną probówkę z 1 ml wody i drugą z 1 ml 2% NaCl. Do obu dodać po 1 ml 1% skrobi, 1 ml
roztworu amylazy i 1 ml rozcieńczonego do słomkowego koloru roztworu J w KJ (0,005M). Wstawić próby do
łaźni wodnej o temp. 37
º
C i porównać odbarwiania się obu prób.
5.1.2. Stopniowe trawienie kazeiny trypsyną.
Trypsyna jest hydrolazą o dużej specyficzności, która katalizuje tylko wiązania utworzone z grupy
karboksylowej aminokwasów takich jak: lizyna lub arginina, a peptydy powstające w wyniku działania trypsyny mają
te aminokwasy (z wolną grupą karboksylową) jako końcowe. Trypsyna produkowana przez trzustkę (w postaci
nieaktywnego trypsynogenu) ma optimum działania przy pH=7-8
N
H
C
H
CO
R
1
N
H
C
H
R
2
CO
Wykonanie:
Przygotować kilka probówek zawierających po 0,5 ml 10% kwasu trichlorooctowego. Do probówki z 15 ml
roztworu 0,5% kazeiny wlać 1 ml 1% trypsyny i wstawić do łaźni wodnej o temp.37ºC i co minutę pobierać po
0,5 ml hydrolizatu do przygotowanych wcześniej probówek . Hydrolizę prowadzić tak długo, aż w próbie nie
będzie zauważalnego osadu wytrąconego białka.
5.1.3. Oznaczanie aktywności pepsyny metodą Ansona
Pepsyna wytwarzana jest w żołądku w postaci nieczynnego pepsynogenu, który w środowisku kwaśnym (w
29
żołądku) zostaje zaktywowany przez odczepienie od preenzymu kilku oligopeptydów. Produktem katalitycznego
działania pepsyny na białka jest mieszanina polipeptydów, a optimum jej działania leży w zakresie pH 1-2.
Substratem dla pepsyny może być albumina lub hemoglobina. Podczas hydrolizy białka uwolnione zostają
aminokwasy, m.in. tyrozyna i tryptofan, które z odczynnikiem Folina-Ciocalteau tworzą niebieski produkt.
Wykonanie:
Oznaczyć aktywność badanego roztworu pepsyny w następujący sposób:
do czterech probówek dodać po 2 ml roztworu albuminy (1%);
następnie do kolejnych probówek dodawać:
do pierwszej -
0,5 ml 0,03M HCl (pH=4)
do drugiej -
0,5 ml 0,3M HCl (pH=1,6)
do trzeciej -
0,5 ml 2M HCl (pH=0,7)
do czwartej -
0, 5ml wody dest. (pH=6)
Wstawić probówki do łaźni wodnej o temp. 37
0
C i po 5 minutach dodać do każdej po 0,5 ml badanego
roztworu pepsyny. Zanotować czas rozpoczęcia reakcji enzymatycznej. Po 10 min. przerwać reakcję przez
dodanie do każdej próby po 5 ml 0,3M CCl
3
COOH. Następnie próby wymieszać i odwirować lub przesączyć.
Do 2,5 ml klarownego przesączu dodać 5 ml 0,5M NaOH i po wymieszaniu dodać 1,5 ml odczynnika Folina -
Ciocalteau. Po 10 min. zmierzyć absorbancję niebiesko zabarwionego roztworu wobec próby kontrolnej przy
długości fali = 700 nm.
Wykonanie próby kontrolnej:
Zmieszać 5 ml 0,3M kwasu trichlorooctowego, 2 ml roztworu albuminy, 0,5 ml 0,3M HCl i 0,5 ml pepsyny,
wymieszać, po czym odsączyć wytrącone białka. Do 2,5 ml przesączu dodać 5 ml 0,5M NaOH i 1,5ml
odczynnika Folina - Ciocalteau.
Z wykresu kalibracyjnego (dla tyrozyny) odczytać odpowiadającą zmierzonej absorbancji równoważną ilości µmoli
tyrozyny. Wynik podaje się w jednostkach aktywności wg Ansona.
Jednostka aktywności Ansona jest to taka aktywność pepsyny, która w 37
º
C hydrolizuje albuminę z taką szybkością,
że wytworzony w ciągu 1 min. produkt hydrolizy odpowiada 1 µmolowi tyrozyny.
Na koniec należy określić pH odpowiadające maksymalnej aktywności pepsyny przez sporządzenie wykresu
zależności aktywności pepsyny od pH mieszaniny inkubacyjnej.
J. aktywności Ansona µmole tyrozyny · 0,32 (0,32 -
współczynnik uwzględniający rozcieńczenie próby i czas reakcji).
5.1.4. Hydroliza enzymatyczna tłuszczów
Lipaza jest enzymem katalizującym hydrolizę tłuszczów do glicerolu i kwasów tłuszczowych. Lipazy
wykazują niewielką specyficzność i katalizują rozkład estrów utworzonych przekwasi o krótkim i długim łańcuchu,
nasycone i nienasycone oraz alkohole mające łańcuch krótki lub długi, jedno- lub wielowodorotlenowe.
Katalizują więc rozszczepienie wiązania estrowego, a mniejszą rolę odgrywa budowa składników estru.
Procesy trawienne ułatwiają kwasy żółciowe, które aktywują lipazy poprzez obniżanie napięcia powierzchniowego
roztworu i wzmagając przez to lipolityczne działanie enzymu. Mają zwykle optimum działania przy pH 7 do 8,5.
Wykonanie:
W probówce zmieszać 10 ml oleju z 0,5 ml 0,1M roztworu NaOH i silnie zmieszać. Otrzymuje się trwałą
emulsję.
Przygotować 3 opisane probówki i dodawać odczynników zgodnie ze schematem podanym w tabeli.
Numer Próby Roztwór enzymu (lipazy)
Emulsja oleju
Żółć
I
2 ml
1 ml
-
II
2 ml
1 ml
1 ml
III
2 ml
(zagotować przed dodaniem oleju)
1 ml
-
Zawartość probówek silnie zamieszać, a następnie inkubować w łaźni wodnej o temperaturze 37
º
C. Inkubować
próby przez 2 godziny, mieszając co 15 min. Po 2 godzinach próby wyjąć z łaźni, ochłodzić do temperatury
pokojowej i do każdej probówki dodać po 2 krople fenoloftaleiny i zawartość probówek miareczkować
roztworem 0,1M NaOH do różowego zabarwienia.
Różnica w ilości mililitrów 0,1M NaOH zużytego do zobojętnienia prób I a III i II a III obrazuje ilość uwolnionych
przez lipazę kwasów tłuszczowych. Różnica ilości mililitrów 0,1M NaOH zużytego do zobojętnienia pomiędzy próbą
I i II odzwierciedla wpływ żółci na enzymatyczną hydrolizę oleju.
5.1.5. Wykrywanie obecności katalazy i peroksydazy.

30
Katalaza i peroksydaza (obficie występujące np. w ziemniakach, chrzanie) należa do oksydoreduktaz, których
grupą prostetyczną jest żelazo-porfiryna. U zwierząt katalazę znajdujemy w krwinkach czerwonych i wątrobie ,a
peroksydazę w wątrobie, krwinkach białych, mleku. Mechanizm działania tych enzymów jest podobny: akceptorem
elektronów jest nadtlenek wodoru, ale dla katalazy donatorem elektronów jest druga cząsteczka nadtlenku wodoru , a
dla peroksydazy związek taki jak fenol lub amina aromatyczna.
5.1.5.1. Rozkład wody utlenionej przez katalazę.
Wykonanie: Rozcieńczyć 1 kroplę krwi w ok 2 ml wody. Roztwór ten rozlać do 2 probówek. Zawartość jednej z
probówek zagotować Po oziębieniu dodać kilka kropel 3% nadtlenku wodoru. O obecności katalazy świadczy
wydzielanie tlenu i tworzenie obfitej piany
5.1.5.2. Wykrywanie obecności peroksydazy (utlenianie benzydyny)
Peroksydaza w obecności nadtlenku wodoru utlenia benzydynę do błekitu benzydynowego.
N
H
2
NH
2
N
H
NH
- 4H
benzydyna
błękit benzydynowy
Wykonanie:
Do dwóch probówek dodać po 1g skrawków z ziemniaka i zawiesić w 2 ml wody. Jedną z prób zagotować
(inaktywacja enzymu). Po oziębieniu do obu dodać po kropli odczynnika benzydynowego i kilka kropli 3%
H
2
O
2
.
O obecności czynnej peroksydazy świadczy zabarwienie próby na niebiesko. Zdolność katalizowania reakcji
peroksydazowej mają też inne żelazoporfiryny tzw. reakcja pseudoperoksydazowa. Wskutek zdenaturowania białka
enzymatycznego przez zagotowanie próby reakcja peroksydazowa ustanie natomiast pseudo – np. z hemem będzie
przebiegała nadal.
5.1.6. Izolacja sacharazy z drożdży.
Wykonanie: Rozetrzeć w moździerzu 5 g drożdży z niewielką ilością piasku. Dodać 10 ml wody, wymieszać i
próbę odwirować albo przesączyć. Probówkę z przesączem umieścić w łaźni lodowej i dodawać do próby
zimnego acetonu aż do wytrącenia się białego osadu sacharazy, który należy odsączyć i pozostały na sączku
osad wysuszyć.
Sprawdzenie aktywności otrzymanej sacharazy
Miarą zaś jej aktywności jest ilość powstałej podczas hydrolizy sacharozy (dwucukier nieredukujący) oraz
cukrów redukujących tj. glukozy i fruktozy.
Wykonanie:
Rozpuścić niewielką ilość otrzymanej sacharazy w 5 ml wody. Do 2 probówek dodać po 1 ml roztworu
enzymu. Jedną z prób zagotować (inaktywacja enzymu). Do obu probówek dodać po 1 ml roztworu 0,2M
sacharozy. Umieścić w łaźni wodnej w temp. 37
º
C na 10 min. Zawartość produktów reakcji wykazać, dodając
do każdej po 1 ml odczynnika Benedicta.
Po zagotowaniu w próbie dodatniej pojawia się osad tlenku miedziawego, co świadczy o obecności cukrów
redukujących. Sacharoza, w próbie z inaktywowanym enzymem, nie redukuje odczynnika Benedicta.
Odczynniki
preparat amylazy ślinowej , 1% skrobia, 2%. skrobia, kazeina, 0,5% , trypsyna, 1% albumina, 1% , sacharoza, 0,2M
olej, żółć (roztwór 2%), krew, skrawki ziemniaka, drożdże piekarskie, piasek, fenoloftaleina,
roztwór lipazy, aceton (zimny)
bufor fosforanowy (pH 6,6), CCl
3
COOH, 10%, CCl
3
COOH, 0,3M (kwas trichlorooctowy)
NaOH, 0,1M, NaOH, 2M (wodorotlenek sodu), NaOH, 0,5M (wodorotlenek sodu)
HCl 0,03M (kwas solny), HCl 0,3M, HCl 2M
odczynnik benzydynowy, (benzydyna, 4% w kwasie octowym lodowatym), woda utleniona, 3% (H
2
O
2)
)
odczynnik Folina – Ciocalteau
odczynnik Benedicta , Płyn Lugola, (J
2
w KJ, 0,005M, roztwór rozcieńczony do słomkowego kolor
6. ANALIZA PŁYNÓW USTROJOWYCH
6.1. KREW

31
Wymagana jest znajomość następujących zagadnień:
1. Właściwości ogólne krwi. Skład krwi, budowa elementów morfotycznych. Funkcje biochemiczne. Niebiałkowe
składniki organiczne i składniki nieorganiczne krwi.
2. Białka krwi (hemoglobina, funkcje białek osocza, immunoglobuliny).
3. Krzepnięcie krwi (rola fibrynogenu). Antykoagulanty.
Krew swobodnie przemieszcza się w naczyniach krwionośnych i w ustrojach wielokomórkowych spełnia rolę
tkanki transportowej. Składa się w 55% z osocza i zawieszonych w nim elementów upostaciowanych, tj. krwinek
białych, czerwonych i płytek krwi, stanowiących 45% objętości. Osocze składa się w 91 - 92% z wody, resztę
stanowią białka (7-8%), lipidy, cholesterol, monosacharydy, aminokwasy, jony nieorganiczne. Jednym z białek
osocza o dużym znaczeniu fizjologicznym jest fibrynogen, którego przemiana w fibrynę, pod wpływem trombiny i
innych czynników, stanowi istotę krzepnięcia krwi. Osocze pozbawione fibrynogenu (włóknika) to surowica. Skład
krwi odzwierciedla procesy zachodzące w organizmie.
Skład chemiczny krwi jest zależny od stanu metabolicznego poszczególnych narządów i dlatego oznaczenia ilościowe
składników występujących we krwi ma podstawowe znaczenie diagnostyczne (ważna też jest łatwa dostępność
materiału do badań).
Krew bierze udział w gospodarce cieplnej, wodno-elektrolitowej, w utrzymaniu równowagi kwasowo-zasadowej
organizmu, dostarcza komórkom składników odżywczych (tlenu, substratów, koenzymów) i odbiera od nich produkty
pośrednie i końcowe przemian metabolicznych (w tym dwutlenek węgla).
Odczyn krwi utrzymuje się w granicach pH = 7,35-7,42 dzięki obecności układów buforowych (węglanowego,
fosforanowego, białczanowego i układu hemoglobiny i oksyhemoglobiny).
Krew transportując hormony umożliwia przekazywanie informacji chemicznej na drodze humoralnej.
Krew stanowi jedną z pierwszych barier obronnych organizmu ze względu na obecność przeciwciał i komórek
zdolnych do fagocytozy.
6.1.1. Ciśnienie osmotyczne. Hemoliza krwi
Ciśnienie, które trzeba wywrzeć na swobodną powierzchnię roztworu aby zapobiec osmozie (wybiórczemu
przenikaniu cząstek przez błonę półprzepuszczalną) nosi nazwę ciśnienia osmotycznego. Jest wprost proporcjonalne
do stężenia molalnego
(m)
substancji (mol/kg wody) i do temperatury bezwzględnej a nie zależy od rodzaju
rozpuszczalnika i rozpuszczonego związku. Jednakowe ciśnienie mają roztwory o tym samym stężeniu molalnym.
Pomiędzy cieczami ustrojowymi znajdują się różne, wybiórczo działające bariery półprzepuszczalne (błona
komórkowa, śródbłonek naczyń, błony wyścielające jamy surowicze i przewód pokarmowy, nabłonek nerkowy). Dwa
roztwory przedzielone błoną półprzepuszczalną i nie wywierające żadnego ciśnienia (ciśnienia z obu stron błony
równoważą się) noszą nazwę izotonicznych. Roztwór o wyższym ciśnieniu osmotycznym niż drugi określa się jako
hipertoniczny, a roztwór o niższym ciśnieniu jako hipotoniczny. Roztwory 0,3 molalne uważa się za izotoniczne
względem surowicy. W elektrolitach uwzględnia się liczbę jonów, na które dysocjują cząsteczki. Roztworem
izotonicznym jest więc roztwór 0,9% NaCl, 1,12% KCl, 5,4% glukozy, 10,2% sacharozy.
Istnieją błony, które zatrzymują wielkie cząsteczki, a są przenikliwe dla związków małocząsteczkowych. Sole takie
dyfundują bez przeszkód i nie powodują różnicy ciśnień a makrocząsteczki (np. białka) zachowują się zgodnie z
prawami osmozy. Ciśnienie onkotyczne (koloido-osmotyczne) uwarunkowane obecnością koloidów (białek) jest małe
ze względu na stosunkowo niewielką ilość makrocząsteczek, ale odgrywa doniosłą rolę w utrzymaniu określonej
objętości krwi krążącej i wymianie cząsteczek między cieczą międzykomórkową a osoczem.
Błona komórkowa krwinki czerwonej zachowuje się jak błona półprzepuszczalna, jest więc przepuszczalna dla wody,
nieprzepuszczalna dla jonów potasu, sodu, czy wapnia, przy czym ściana włośniczki nie stanowi dla jonów tych
przeszkody. Umieszczenie krwinki w środowisku hipotonicznym powoduje wnikanie wody do jej wnętrza,
pęcznienie, pękanie błony i wylewanie się zawartości na zewnątrz (hemoliza), ponieważ osiągnięta maksymalna
objętość jest ograniczona małą elastycznością błony. Krwinka czerwona w płynie izotonicznym nie zmienia swego
kształtu.
Hemolizę można też wywołać na drodze fizycznej np.: poprzez uszkodzenie błony krwinek przez wytrząsanie krwi,
aspirację krwi do strzykawki pod zmniejszonym ciśnieniem, zamrożenie, zmianę ciśnienia osmotycznego środowiska.
Można też uszkodzić błonę komórkową rozpuszczalnikami działającymi na tłuszcze błonowe, lub działając
substancjami obniżającymi napięcie powierzchniowe (detergenty, mydła, sole żółciowe).
6.1.1.1. Hemoliza krwinek czerwonych czynnikami chemicznymi
Otoczka krwinek czerwonych zachowuje się jak błona półprzepuszczalna (warunkuje zjawisko osmozy).
Przepuszcza łatwo wodę, aniony, mocznik i glukozę, dla kationów sodu i potasu jest natomiast nieprzepuszczalna. W
roztworze izotonicznym krwinki nie ulegają zmianom morfologicznym. Hemolizę krwi w roztworach izotonicznych
można wywołać środkami chemicznymi takimi jak: aceton, eter, sole kwasów żółciowych, saponiny, kwasy, zasady i
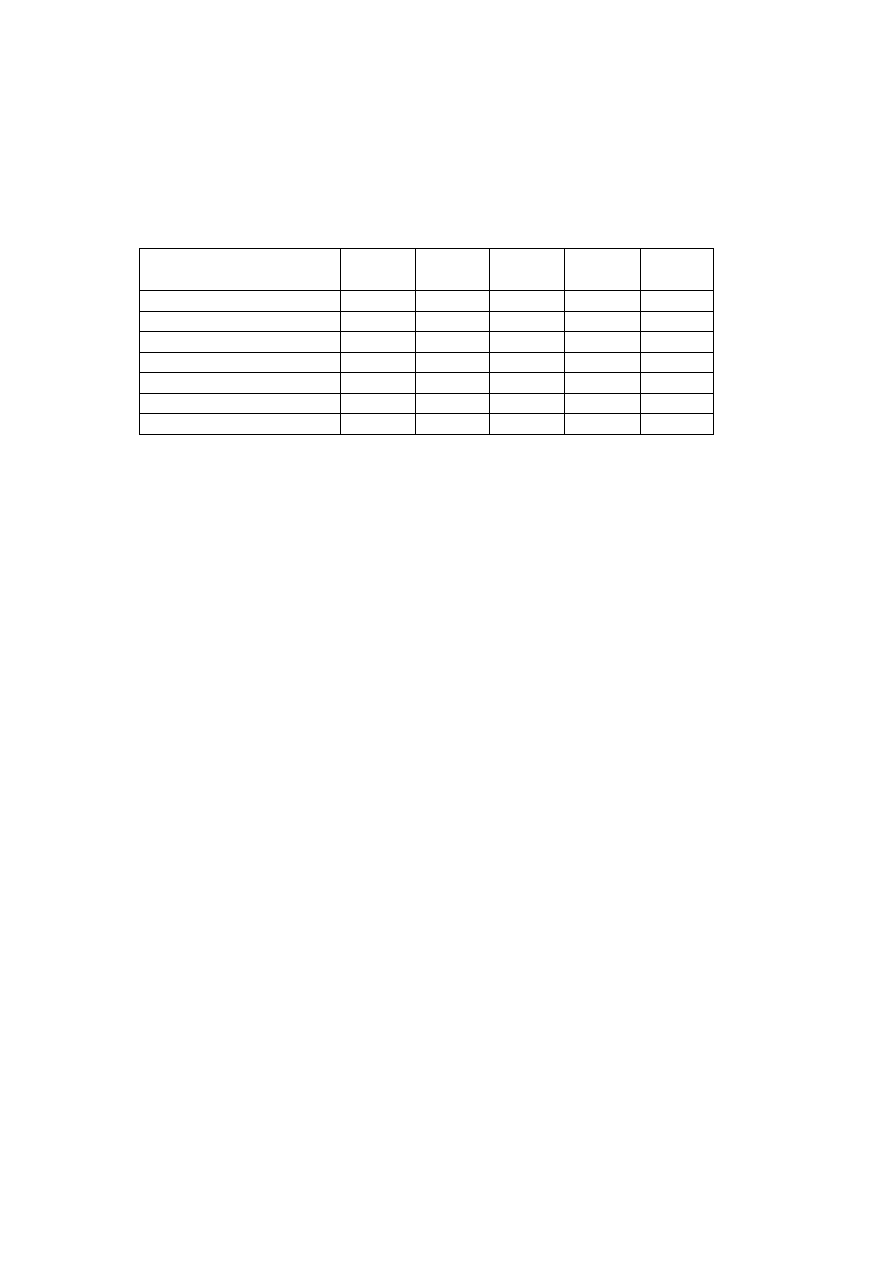
32
jady wężów. Substancje te rozpuszczają błonę komórki lub wchodząc w reakcje ze składnikami błony powodują
zanik jej półprzepuszczalności.
Wykonanie:
Przygotować 5 suchych probówek opisując je numerami od 1 do 5. Dodać do każdej po 2 krople krwi i kolejno
wody, roztworów 0,9% i 2,0% NaCl, acetonu i 2% roztworu mocznika zgodnie ze schematem.
Po zamieszaniu porównać wygląd prób.
Zapisać spostrzeżenia w poniższej tabeli.
Dodawany odczynnik ml
Probówka
1
Probówka
2
Probówka
3
Probówka
4
Probówka
5
krew (krople)
2
2
2
2
2
H
2
O
1
0,9% NaCl
1
1
2,0% NaCl
1
aceton
0,5
2% mocznik
1
Wynik
W poprawnie wykonanym doświadczeniu krew rozcieńczona wodą hemolizuje i roztwór staje się przezroczysty, a
rozcieńczona solą fizjologiczną pozostaje nieprzezroczysta (krwinki pozostały nieuszkodzone i stanowią zawiesinę).
Roztwory hipertoniczne powodują kurczenie się krwinek, które przybierają kształt morwowaty. Po dodaniu acetonu,
mimo roztworu izotonicznego, krwinki ulegają hemolizie w wyniku uszkodzenia błony komórkowej przez
rozpuszczenie lipidów błonowych. Cząsteczki mocznika przenikają swobodnie przez błonę do wnętrza komórki, a
wraz z mocznikiem będzie wnikała odpowiednia ilość wody dążąc do wyrównania ciśnienia osmotycznego. Krwinka
pęcznieje i pęka, czyli następuje hemoliza (roztwór w probówce staje się przezroczysty).
6.1.1.2. Hemoliza przez zamrożenie
Po zamrożeniu krwi, objętość wody zawartej w krwinkach powiększa się, co powoduje pękanie błon
komórkowych.
Wykonanie:
Do dwóch probówek dodać po 2 krople krwi i jedną z nich zamrozić, a drugą pozostawić w temperaturze
pokojowej. Następnie dodać do każdej po 1 ml soli fizjologicznej. Krew, która była zamrożona ulega hemolizie.
6.1.1.3. Badanie oporności osmotycznej krwinek czerwonych.
Środowisko wewnętrzne krwinki jest izotoniczne w stosunku do osocza i odpowiada ciśnieniu osmotycznemu
0,9% NaCl (izotoniczny roztwór NaCl, tzw. roztwór fizjologiczny soli). Roztwór hipertoniczny powoduje kurczenie
się krwinek (morwowacenie), a hipotoniczny pęcznienie krwinek. Z chwilą, gdy różnica ciśnienia osmotycznego
przekroczy granicę oporności krwinki, krwinka pęka a zawarta w niej hemoglobina wylewa się do otaczającego ją
roztworu (płyn ulega hemolizie). Prawidłowe krwinki czerwone ulegają hemolizie w roztworach NaCl o stężeniu
0,32% (oporność maksymalna) do 0,45% (oporność minimalna). W warunkach chorobowych oporność krwinek ulega
zmianie, np. w żółtaczce hemolitycznej hemoliza występuje już przy stężeniu 0,6% NaCl.
Wykonanie:
Do przygotowanych 8 suchych probówek odmierzyć 1% NaCl i wodę zgodnie ze schematem. Wymieszać
zawartość probówek, do każdej dodać po 3 krople krwi i ponownie zamieszać. Pozostawić w temperaturze
pokojowej na 1 - 2 godz.
Określić stężenie NaCl, przy którym obserwuje się początek hemolizy (lekkie żółte zabarwienie nad zawiesiną
komórek) i całkowitą hemolizę (w całej objętości próby przezroczysty czerwony roztwór).
33
6.1.2. Wykrywanie hemoglobiny
Krwinka czerwona składa się w 1/3 ze składników stałych, z czego 30% stanowi hemoglobina (Hb) - barwnik
krwi. Hemoglobina powstaje w szpiku kostnym, jest chromoproteiną o masie cząsteczkowej około 65000 i zawiera
0,34% żelaza. Cząsteczkę hemoglobiny tworzą cztery heliakalne łańcuchy polipeptydowe.
W organizmie człowieka jest nośnikiem tlenu w postaci hemoglobiny utlenowanej (oksyhemoglobiny, Hb-
O
2)
). W procesie utlenowania stopień utlenienia żelaza (FeII) nie zmienia się, powstaje oksyhemoglobina. W reakcji
utleniania z jednoczesnym przyłączeniem H
2
O powstaje methemoglobina (Met-Hb), a żelazo utlenia się (do FeIII).
Hemoglobina 300-krotnie silniej łączy się z tlenkiem węgla i już przy niewielkich stężeniach CO znaczna ilość
hemoglobiny przechodzi w postać tlenkowęglową (karboksyhemoglobinę). Wynikiem jest zatrucie organizmu,
ponieważ następuje wyłączenie hemoglobiny z udziału w transporcie tlenu i blokadą oksydazy cytochromowej,
uczestniczącej w utlenianiu tkankowym.
W 100 ml krwi ludzkiej znajduje się 13 – 16 g hemoglobiny (g %, g/dl)
Prawidłowe stężenie Hb wynosi:
dla mężczyzn 12,5-19,6 g%, (7,8-11,3 mmol/l) .
dla kobiet 11,2-15,5 g%, (7,2-10,0 mmol/l)
dla noworodków 14,2-19,6 g%, (8,8-12,2 mmol/l)
6.1.2.1. Wykrywanie hemoglobiny metodą benzydynową
Hemoglobina ze względu na swoją budowę (obecność hemu) może zachowywać się w reakcjach
chemicznych podobnie jak peroksydaza.
Wykonanie:
Do 5ml wody dodać kroplę krwi. Rozlać do dwóch probówek i jedną z nich zagotować i ochłodzić. Następnie
do obu dodać po 3 krople roztworu benzydyny w kwasie octowym i po 3 krople 3% wody utlenionej.
Płyn barwi się na niebiesko w obu probówkach. Hemoglobina podobnie jak peroksydaza utlenia benzydynę w
obecności wody utlenionej, lecz wynik pozytywny daje także próba po ogrzaniu, ponieważ Hb nie jest enzymem.
Próba benzydynowa znalazła zastosowanie przy wykrywaniu śladów krwi.
6.1.2.3. Ilościowe oznaczanie hemoglobiny metodą Drabkina
Hemoglobina i jej pochodne pod wpływem odczynnika Drabkina ulegają przekształceniu w trwałą pochodną -
cyjanmethemoglobinę wykazującą maksimum absorpcji przy λ 540nm.
Wykonanie: Do 2,5ml odczynnika Drabkina dodać 0,01ml krwi przepłukując mikropipetę odczynnikiem i
całość wymieszać. Po 15 minutach odczytać absorbancję próby badanej i roztworu wzorcowego wobec próby
odczynnikowej (odczynnik Drabkina).
Wstawiając wyniki pomiaru absorbacji do podanego wzoru obliczyć stężenie hemoglobiny w badanej krwi
A próby badanej
Hb (g/100ml)
=
c wzorca (g/100ml)
A wzorca
Stężenie hemoglobiny można obliczyć z podanego wzoru, posługując się milimolowym współczynnikiem absorpcji
(mε przy λ 540nm), którego wartość dla hemoglobiny wynosi 44.
A masa molowa Hb rozcieńczenie krwi
numer probówki
NaCl 1%
(ml)
woda
(ml)
otrzymane
stężenie NaCl
(%)
hemoliza
1
3
7
0,3%
2
4
6
0,4%
3
5
5
0,5%
4
6
4
0,6%
5
7
3
0,7%
6
8
2
0,8%
7
9
1
0,9%
8
10
-
1,0%

34
Hb (g/100 ml)
= —
=
mε 10 1000
A 64 000 · 251
= —
=
44 10 000
= A 36,7
Odczynniki (do ćwiczeń 1.KREW)
krew
NaCl, 0,9 % (sól fizjologiczna), NaCl, 1.0 % (chlorek sodu), NaCl, 2.0 %
aceton
mocznik, 2 %
Odczynnik benzydynowy
(rozpuścić 4 benzydyny w 100 ml kwasu octowego lodowatego),
H
2
O
2
, 3% (woda utleniona)
hemoglobina, roztwór wzorcowy o stężeniu 16 g %
Odczynnik Drabkina
(w kolbie miarowej rozpuścić 0,305 g K
2
[(Fe)CN
6
], 1 g NaHCO
3
i 0,05 g KCN i uzupełnić wodą do 1000 ml)
6.2. MOCZ
Wymagana jest znajomość następujących zagadnień:
1. Rola nerki w utrzymaniu homeostazy organizmu.
2. Funkcja nerki: filtracja, resorpcja zwrotna, sekrecja.
3. Skład chemiczny moczu. Składniki moczu patologicznego.
Rolą nerek jest wydalanie produktów przemiany materii, utrzymywanie i regulowanie stanu homeostazy
ustrojowej, które w tym celu wykorzystują swą zdolność do przesączania (w kłębkach nerkowych), wchłaniania i
wydzielania (w kanalikach nerkowych). Aby utrzymać stałe stężenie jonów wodorowych we krwi i płynach
ustrojowych, pH wydalanego moczu musi zawierać się w granicach 4,8 - 7,4. Najczęściej pH moczu jest słabo
kwaśne, ponieważ nerka wydala nadmiar nielotnych kwasów powstających w organizmie. Gdy pH moczu równa się
pH krwi wówczas z moczem wydala się duża ilość jonów wodorowęglanowych (zwykle w moczu niewykrywalne).
Przez nerki wydalane są głównie fosforany powstające podczas hydrolizy estrów fosforanowych. Wydalenie
nadmiernych ilości (H
2
PO
4
)
+
podwyższa pH krwi, a jonów (HPO
4
)
2+
obniża je. Nerka usuwa nielotne kwasy
organiczne, które powstają w przemianie materii zaoszczędzając zasady (HCO
3
-), bierze udział w utrzymywaniu
stałego stężenia różnych składników w płynach ustrojowych, zwłaszcza elektrolitów, oraz w utrzymywaniu stałej
objętości i stałego pH tych płynów. W wyniku tych procesów z organizmu zostaje wydalony mocz, jest to tzw.
czynność zewnątrzwydzielnicza nerki. Charakterystyczną cechą wydalania nerkowego jest wybiórczość (ponieważ z
moczem wydalane są tylko niektóre składniki), a także zdolność zagęszczania wielu składników krwi. W nerce
odbywa się również synteza związków biologicznie czynnych i jest to tzw. czynność wewnątrzwydzielnicza.
Zależnie od sposobu wydalania wyróżnia się substancje:
a) wysokoprogowe - wchłaniane czynnie i wskutek tego nie występują w moczu lub są tylko w małym stężeniu.
Pojawiają się w moczu, gdy ich stężenie w osoczu przekracza tzw. próg nerkowy (zdolność kanalików nerkowych do
ich resorpcji, transport maksymalny), Substancje wysokoprogowe to np. NaCl, jony potasu, wapnia, jon
wodorowęglanowy, glukoza, aminokwasy, witamina C, kreatyna. Nerka zachowuje te substancje dla ustroju, i tak np.
glukoza zaczyna pojawiać się w moczu, gdy jej stężenie we krwi przekroczy 180 mg%.
b) niskoprogowe - wchłaniane biernie, występują w moczu w stężeniu większym niż w osoczu np.: mocznik, kwas
moczowy, fosforany, siarczany.
c) bezprogowe - nie ma ich w cieczy reabsorbowaniej, a zagęszczeniu ulegają silniej niż inne składniki moczu np.:
kreatynina (wykorzystywana dla celów klinicznych do pomiaru filtracji kłębkowej), inulina.
Mocz jest wytwarzany przez nerki w sposób ciągły, a tzw. mocz ostateczny jest około stukrotnie zagęszczony w
porównaniu do tzw. moczu pierwotnego powstającego w ilości około 120 ml na minutę. Zawiera oprócz wody (92-
99%) szereg końcowych produktów przemian ustrojowych i dlatego badanie właściwości fizycznych oraz składu
chemicznego moczu pozwala na ocenę stanu nerek i innych narządów. Ponieważ skład moczu wydalanego przez
organizm zmienia się w ciągu doby, badania np. ilościowe należy wykonywać w moczu zbieranym przez 24 godziny.
Badanie pH moczu lub badania cytologiczne powinny być wykonywane w moczu świeżym, a np. badania
bakteriologiczne, mikroskopowe osadu i oznaczanie proteinurii wykonuje się w moczu wydalonym po nocy.
Z moczem wydalane są:
35
a) związki azotowe - będące odpowiednikami azotu niebiałkowego krwi. W ciągu doby wydala się około 14 g azotu, z
czego azot mocznika (końcowego produktu przemiany białek) stanowi 85%, kreatyniny i amoniaku po 0,5%, kwasu
moczowego (końcowego produktu przemiany puryn) około 0,25%, a aminokwasów 0,15%
b) związki nieazotowe organiczne - np. glukuronidy, hormony płciowe, bilirubina, różne związki siarkowe (wydalane
w postaci związanej - nietrującej np. takie jak związany fenol), kwas szczawiowy, śladowe ilości glukozy, acetonu.
c) składniki nieorganiczne (sole mineralne) - występują jako jony, przy czym najwięcej jest kationów sodowych i
potasowych, w mniejszej ilości występują wapniowe czy magnezowe, a z anionów występują jony chlorkowe,
siarczanowe i fosforanowe. W moczu zasadowym występują również jony wodorowęglanowe.
Badania fizyczne moczu zwykle ograniczają się do oznaczania:
a) ilości dobowej - u zdrowych ludzi wydala się 1000 - 1500 ml moczu na dobę (znacznie wzrasta np. w cukrzycy)
b) gęstości - waha się w granicach 1,015 do 1,025 g/ml
c) odczynu - przeważnie jest lekko kwaśny pH 5,5 do 6,5 (przy głodzeniu lub diecie mięsno-zbożowej występuje
obniżenie pH, przy jarskiej może być nawet odczyn alkaliczny)
d) barwy - zależy od występujących barwników (urobiliny, porfiryn), przyjętego pożywienia czy leków (mocz
prawidłowy może mieć barwę od jasnożółtej do bursztynowej).
e) przejrzystość - świeży mocz powinien być przejrzysty, po pewnym czasie może pojawić się zmętnienie pochodzące
od niewielkich ilości białka, śluzu, komórek nabłonkowych czy leukocytów. Mogą się też wytrącać sole.
f) zapach - jest swoisty. Woń owocowa wskazuje na obecność ciał ketonowych (acetonu), a amoniaku o rozkładzie
moczu. Może się zmieniać po zjedzeniu np. szparagów, czosnku.
6.2.1. Badanie moczu człowieka
6.2.1.1. Badanie chemiczne moczu prawidłowego
Skład chemiczny moczu prawidłowego
Składnik
zawartość w g/dobę
woda
1000 - 1500
substancje stałe
50 - 70
związki azotowe
mocznik
25 - 35
kreatynina
1 - 1,8
kwas moczowy
0,4 - 1
amoniak
0,4 - 1
kwas hipurowy
0,2 - 1
aminokwasy
0,2 - 0,4
zasady purynowe
0,01 - 0,06
indykan
0,01 - 0,03
fenole
0,1 - 0,2
kwas szczawiowy
0,01 - 0,02
związki organiczne nieazotowe
eterosiarczany (SO
3
)
0,2-0,3
siarka obojętna (SO
3
)
0,2-0,4
sole mineralne
chlorki
6 - 9
sód
3 - 5
potas
1,5 - 3,5
wapń
0,1
magnez
0,1
żelazo
0,001
fosforany
1 - 1,5
siarka całkowita
2-3,4
6.2.1.1.1. Wykrywanie jonów amonowych
Amoniak moczu powstaje w komórkach kanalików nerkowych wskutek rozkładu glutaminianu. W kwasicy
ilość amoniaku w moczu zwiększa się. Sole amonowe pod wpływem ługu w podwyższonej temperaturze rozkładają
się z wydzieleniem amoniaku.
Wykonanie:

36
2ml świeżego moczu zalkalizować 0,1M NaOH wobec fenoloftaleiny (do czerwonego koloru). Probówkę
następnie ogrzać we wrzącej łaźni wodnej. Wydziela się amoniak, który rozpoznajemy po charakterystycznym
zapachu lub po zmianie zabarwienia papierka wskaźnikowego.
6.2.1.1.2. Wykrywanie jonów wapniowych
Zasada wykrywania jonów wapnia polega na wytrącaniu osadu szczawianu wapnia nierozpuszczalnego w
kwasie octowym.
Wykonanie:
Do 2 ml moczu dodać 1 ml nasyconego szczawianu amonu. Sprawdzić rozpuszczalność wytrąconego białego
osadu dodając do próby 1 ml 0,2M CH
3
COOH.
6.2.1.1.3. Wykrywanie jonów chlorkowych
Ilość chlorków w moczu zależy od ilości NaCl pobieranego z pokarmami. Chlorki strąca się w postaci AgCl
(biały osad), który rozpuszcza się w amoniaku na skutek powstawania kompleksowego kationu diaminosrebrowego.
AgCl + 2 NH
3
→ Ag(NH
3
)
2
Cl
Wykonanie:
Do probówki wlać 2 ml moczu, zakwasić paroma kroplami stężonego kwasu azotowego i dodać kilka kropel
0,1 M AgNO
.
Powstały biały osad rozpuścić w 1 ml roztworu amoniaku.
6.2.1.1.4. Wykrywanie jonów siarczanowych
Jony siarczanowe wydalane z moczem pochodzą z przemiany aminokwasów siarkowych. W moczu siarkę
wydalaną głównie w postaci siarczanów (90%) wykrywa się w postaci strątu siarczanu baru.
Wykonanie:
2 ml moczu zakwasić paroma kroplami 2 M kwasu solnego i dodać kilka kropel 0,1 M chlorku baru.
Gdy w moczu znajdują się jony siarczanowe, w probówce obserwujemy wytrącanie się białego osadu
nierozpuszczalnego siarczanu baru.
6.2.1.1.4. Wykrywanie jonów fosforanowych
Wykrywanie fosforanów oparto na ich reakcji z molibdenianem amonu w środowisku kwaśnym z
wytworzeniem żółtego fosforomolibdenianu amonowego.
Wykonanie:
Do 2 ml moczu dodać kilka kropel 2 M kwasu azotowego i kilka kropel 5% molibdenianu amonu. Po ogrzaniu
wytrąca się żółty osad. Gdy w moczu znajdują się substancje redukujące (np. witamina C), barwa próby może
zmienić się na niebieską lub zieloną (powstaje błękit molibdenowy).
6.2.1.1.5. Wykrywanie mocznika
Mocznik jako produkt przemiany aminokwasów jest wydalany z moczem w stężeniu około 100-krotnie
większym niż we krwi. Oddziaływanie podbrominem na mocznik powoduje jego rozkład do dwutlenku węgla
wiązanego przez NaOH, wody i azotu ( objętość wydzielającego się azotu jest proporcjonalna do stężenia mocznika).
CO(NH
2
)
2
+ 3 NaBrO + 2 NaOH → N
2
+ Na
2
CO
3
+ NaBr + 3 H
2
O
Wykonanie:
Do probówki z 1 ml moczu dodać kilka kropel podbrominu sodowego. Zmieszać zawartość.
Wydzielający się gaz (azot) wskazuje na obecność mocznika.
6.2.1.1.6. Wykrywanie kwasu moczowego
Kwas moczowy jest końcowym produktem przemiany puryn. Wykrywanie kwasu moczowego opiera się na
jego zdolności redukcji kwasu fosforowolframowego.
Wykonanie:
Do 1 ml moczu dodać 1 ml odczynnika fosforowolframowego i parę kropel 2M NaOH.
W obecności kwasu moczowego roztwór barwi się na niebiesko (w wyniku redukcji kwasu fosforowolframowego do
mieszaniny zabarwionych na niebiesko tlenków wolframu).
6.2.1.1.7. Wykrywanie kreatyniny
Kreatynina z krwi jest usuwana przez nerki w ilości 700- 2500 mg/dobę i zależy od ogólnej masy
mięśniowej. Kreatynina z kwasem pikrynowym tworzy czerwono zabarwiony kompleks.
Wykonanie:
Do 1 ml moczu dodać 3 krople nasyconego roztworu kwasu pikrynowego i 0,5 ml 10% NaOH. Pojawiające się
czerwone zabarwienie świadczy o obecności kreatyniny. (Pozytywną reakcję dają białka, glukoza, witamina C.)
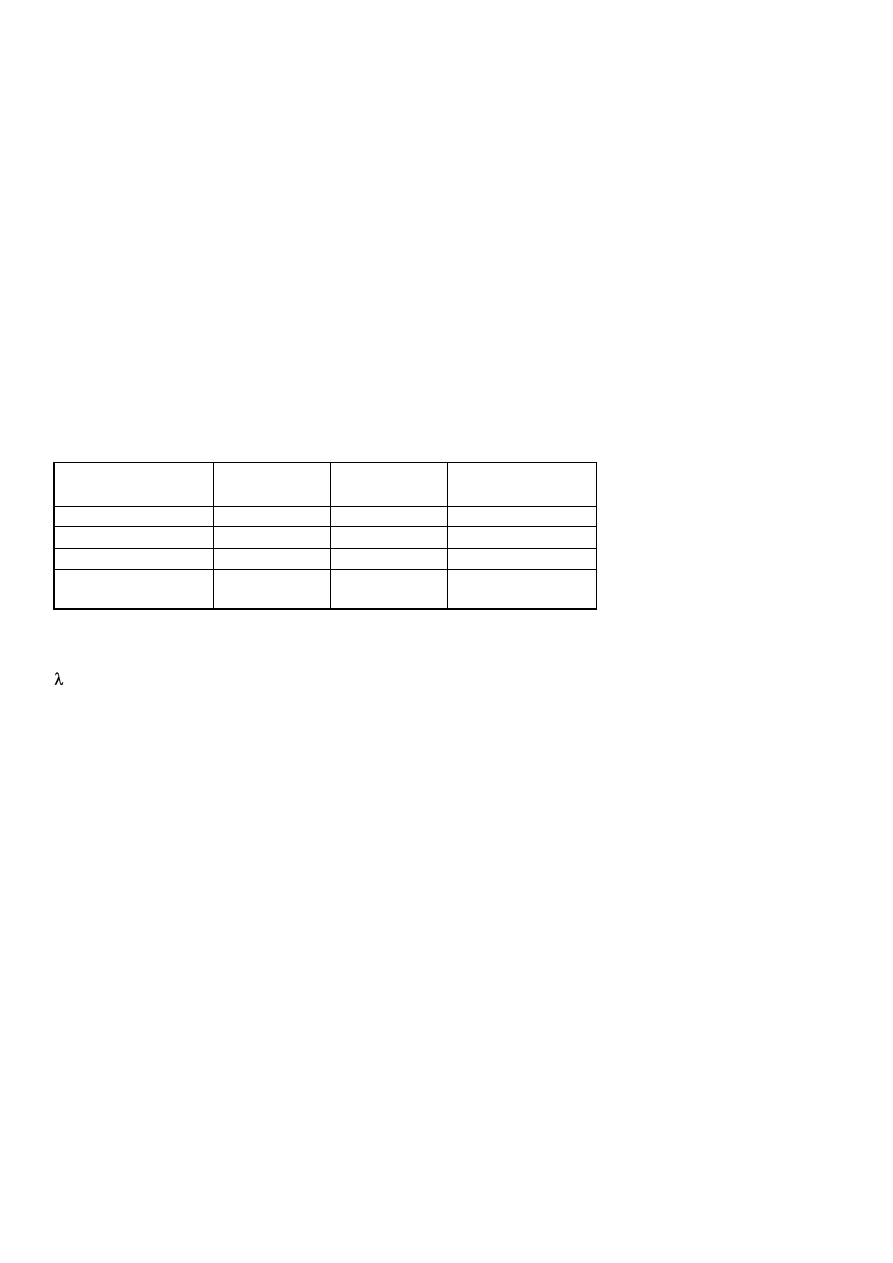
37
6.2.1.2. Badanie chemiczne moczu patologicznego
W stanach patologicznych wykrywa się w moczu takie składniki jak: białko, cukier, związki ketonowe,
barwniki żółciowe, krew i kwasy żółciowe, porfiryny, azotyny.
6.2.1.2.1. Wykrywanie białka
Ilościowe oznaczanie białka w moczu metodą turbidymetryczną Extona
Z moczem prawidłowym może zostać wydalone do kilkudziesięciu mg białka na dobę. W warunkach
patologicznych ilość ta może wzrosnąć tysiąckrotnie (np. w nerczycach). Także białkomocz może pojawić się przy
niedostatecznym ukrwieniu nerek np. białkomocz ortostatyczny, w gorączce, po zimnych kąpielach, po dużym
wysiłku fizycznym. Przy nadmiernym rozpadzie krwinek czerwonych pojawia się w moczu hemoglobina. W moczu
może pojawić się białko patologiczne (w szpiczaku mnogim - białko Bence-Jonesa, łańcuchy lekkie
immunoglobulin), lub mioglobina (m.cz. ok.17000) po zmiażdżeniu mięśnia.
Do wykrywania białka w moczu stosuje się reakcje strątowe (wytrącanie kwasem sulfosalicylowym,
trichlorooctowym, azotowym lub koagulacja cieplna).
Oznaczenie ilościowe opiera się na pomiarze absorbancji zmętnienia roztworu, powstałego w wyniku wytrącenie
białka mieszaniną kwasu sulfosalicylowego i siarczanu sodowego.
Wykonanie:
Przygotować trzy probówki. Dodawać odczynników i moczu zgodnie ze schematem.
próba badana
(ml)
próba kontrolna
(ml)
próba odczynnikowa
(ml)
badany mocz
0,5
0,5
-
0,9% NaCl
-
3,5
0,5
odcz. sulfosalicylowy
3,5
-
3,5
zmierzona
absorbancja
Próby dokładnie wymieszać i odstawić na kilka minut ( 4 – 10) . Następnie próby ponownie wymieszać i
odczytać absorbancję (przy długości fali
= 445 nm), próby badanej i próby kontrolnej wobec próby odczynnikowej (odczynnik sulfosalicylowy)
Odjąć wartość absorbancji próby kontrolnej od absorbancji próby badanej. Dla wyliczonej absorbancji
odczytać stężenie białka z wykresu kalibracyjnego.
6.2.1.2.2. Wykrywanie cukru
Glukoza w moczu może pojawiać się w zaawansowanej cukrzycy. Najczęściej cukry wykrywamy
wykorzystując ich właściwości redukcyjne.
Wykonanie:
Do 1ml moczu dodać 1 ml odczynnika Benedicta. Próbę zagotować.
W razie obecności w moczu cukrów wytrąca się osad tlenku miedziawego.
6.2.1.2.3. Wykrywanie acetonu (próba Lange'go)
Związki ketonowych (tzw. ciała ketonowe: kwas acetooctowy, aceton i kwas β-hydroksymasłowy), mogą
pojawić się w moczu np. w cukrzycy, podczas głodzenia i przy diecie wysokotłuszczowej.
Wykonanie:
Do probówki z 2 ml moczu dodać 5 kropel nasyconego roztworu nitroprusydku sodu i 5 kropel lodowatego
kwasu octowego. Zmieszać i nawarstwić na roztwór 0,5ml stężonego amoniaku.
W wyniku reakcji na granicy roztworów powstaje purpurowy pierścień wskazujący na obecność acetonu.
6.2.1.2.4. Wykrywanie kwasów żółciowych
Kwasy żółciowe (pochodne kwasu cholanowego) należą do końcowych produktów przemian cholesterolu.
Są podstawowym składnikiem żółci i to jest główna droga ich wydalania z organizmu. Zwiększenie ich stężenia we
krwi i pojawienie się w moczu ma miejsce np. w żółtaczce mechanicznej czy w chorobach wątroby. Obecność
kwasów żółciowych manifestuje się obniżeniem napięcia powierzchniowego moczu.
Wykonanie:
Przygotować 2 probówki. Do jednej wlać 2 ml moczu, do drugiej 2 ml wody i do obu, na powierzchnię
roztworu, wrzucić odrobinę siarki sublimowanej.

38
W razie obecności kwasów żółciowych w moczu siarka opada na dno probówki w postaci „deszczu” a w probówce z
wodą pozostaje na powierzchni.
Kwasy żółciowe zbierają się w warstwie powierzchniowej znacznie zmniejszając napięcie powierzchniowe wody, co
umożliwia przerwanie powierzchni płynu przez kryształki i opadanie siarki.
6.2.1.2.5. Wykrywanie krwi w moczu metodą benzydynową
Przyczyną obecności krwi w moczu są choroby nerek, krwi, urazy, zatrucia itp. Reakcja z benzydyną polega
na wykorzystaniu peroksydacyjnych właściwości hemoglobiny.
Wykonanie:
Do 1ml roztworu benzydyny w kwasie octowym dodać kilka kropel moczu i kilka kropel wody utlenionej 3%.
Kolor niebieski próby świadczy o obecności krwi w moczu. Hemoglobina ma zdolność utleniania benzydyny w
obecności wody utlenionej do niebieskiej pochodnej. Odczyn dodatni mogą dawać znajdujące się w moczu leukocyty.
(zawierają peroksydazę).
Odczynniki (do ćwiczenia 5.2.MOCZ)
mocz prawidłowy, mocz patologiczny
HNO
3
, stężony (kwas azotowy)
HNO
3
, 2 M (kwas azotowy)
HCl, 2 M (kwas solny)
CH
3
COOH, lodowaty (kwas octowy)
CH
3
COOH, 0,2M (kwas octowy)
NaOH, 0,1 M (wodorotlenek sodowy)
NaOH, 2M (wodorotlenek sodu)
NaOH, 10% (wodorotlenek sodu)
amoniak, (NH
3
stężony)
NaCl 0,9%, (sól fizjologiczna)
AgNO
3
, 0,1 M (azotan srebra)
BaCl
2
, 0,1 M (chlorek baru)
molibdenian amonu, 5%
szczawian amonu, roztwór nasycony
fenoloftaleina, 2% (roztwór alkoholowy)
nitroprusydek sodu, (roztwór nasycony)
kwas pikrynowy, 1,2 %
siarka, krystaliczna (sublimowana)
Odczynnik fosforowolframowy
Odczynnik Fehlinga I
Odczynnik Fehlinga II
Odczynnik Benedicta
Podbromin sodowy
(do 50 ml 40% NaOH dodać kilka kropli bromu)
Odczynnik sulfosalicylowy – Exstona
(5 g kwasu sulfosalicylowego (dwuwodnego) i 16 g siarczanu sodu (Na
2
SO
2
· 10 H
2
O) rozpuścić i uzupełnić woda do
100 ml)
6.2.3. Testy paskowe w badaniu moczu
Do wykonywania szybkich badań diagnostycznych stosowane są tzw. suche testy, które pozwalająca
wykonanie oznaczeń w niewielkiej ilości materiału, w krótkim czasie i z dość dużą dokładnością. Oznaczanie
wybranych składników oparte jest na specyficznych reakcjach chemicznych i enzymatycznych, stosowanych w
tradycyjnej diagnostyce. Wykonanie oznaczenia zwykle polega na zanurzeniu paska testowego w badanym materiale
biologicznym (moczu, osoczu) i porównaniu powstałego zabarwienie z załączoną skalą barw. Testy pozwalają np. na
oznaczenie w moczu równocześnie takich parametrów jak, pH i ciężar właściwy moczu, zawartość glukozy, białka,
bilirubiny, związków ketonowych, azotanów, obecność krwi czy granulocytów.
Wykonanie:

39
Zanurzyć pasek testowy (pole odczynnikowe) w moczu na 30 sekund. Odczytać wynik porównując powstające
zabarwienie na odpowiednim polu testowym paska z załączoną skalą barw. Porównać odczytane wyniki ze
skalą charakteryzującą wartości prawidłowe i spróbować je ocenić
.
6.2.4. Mikroskopowe badanie osadu moczu
Obraz mikroskopowy ocenia się pod kątem występowania kryształów związków organicznych, soli
nieorganicznych, komórek nabłonkowych, elementów morfotycznych, śluzu, bakterii, pasożytów, odlewów
białkowych kanalików nerkowych itp.
Wykonanie:
Odwirować 10 ml moczu, nadsącz zdekantować, a pozostałość wymieszać. Wykonać preparat - kroplę
zawiesiny nałożyć na szkiełko podstawowe i przykryć szkiełkiem nakrywkowym. Preparat oglądać pod
mikroskopem.
Wyszukiwarka
Podobne podstrony:
E2 2010 id 149235 Nieznany
kinetyka 5 11 2010 id 235066 Nieznany
Arot 2010 07 2010 id 69283 Nieznany
c3 19 12 2010 id 97134 Nieznany
cyw1 skrypt zobowiazania id 126 Nieznany
ARKUSZ POPRAWKA 2010 id 68814 Nieznany
mat prob styczen 2010(1) id 282 Nieznany
kolokwium 2010 id 240526 Nieznany
3 1 2010 id 33377 Nieznany (2)
LATO 2010 id 263802 Nieznany
zestaw pytan MiBM 2010 id 58854 Nieznany
MSI w2 konspekt 2010 id 309790 Nieznany
biochemia II 1 plus id 86425 Nieznany (2)
kt2 2010 id 253072 Nieznany
egzamin 06 2010 1 id 151726 Nieznany
MSI w1 konspekt 2010 id 309789 Nieznany
odp maj 2010 id 332085 Nieznany
więcej podobnych podstron