
Przykładowe pytania egzaminacyjne
1. Dokończ równania reakcji (napisz produkty lub uzupełnij substraty, dobierz współczynniki,
podaj nazwy substratów i produktów). Czy we wszystkich wymienionych tu przykładach
reakcja przebiega? Reakcje napisane pogrubioną czcionką napisz w postaci skróconych
równań jonowych:
a) CuSO
4
+ KOH →
b) Al(OH)
3
↓ + NaOH →
c) Zn(OH)
2
↓ + NaOH →
d) BaCl
2
+ ............→ BaSO
4
↓ +..........
e) AgNO
3
+ ...........→ AgCl↓ + ...........
f) Pb(OH)
2
↓ + HNO
3
→
g) KCl + .........→ KClO
4
↓ +...........
∆
h) ..............→ CaO + CO
2
g) BaO + H
3
PO
4
→
h) Na
2
O + H
2
O →
i) CO
2
+ Na
2
O →
k) K
2
O
2
+ HCl →
l) NaH + H
2
O →
m) H
3
PO
4
+ .........→ NaH
2
PO
4
+ .......
n).......... + KOH → KHSO
4
+ .........
o) Na
2
CO
3
+ HNO
3
→
p) Na
2
SiO
3
+ HCl →
r) NH
4
Cl + NaOH →
s) KCl + NaOH →
t) SiO
2
+ H
2
O →
u)
Na
2
SiO
3
+ ........ → H
2
SiO
3
+ ...........
w)
NiSO
4
+ ...........→ Ni(OH)
2
+............
y) Mg(OH)
2
+ .......... → ........... + NH
4
OH (NH
3
·H
2
O)
z) NH
4
Cl + ............→............. + NH
4
OH (NH
3
·H
2
O)
x) NH
3
+ H
3
PO
4
→
v) NaCl + H
2
SO
4
→
∆
ż) NH
3
x H
2
O →
ź) KOH + NaOH →
2. Podaj po dwa przykłady: tlenków zasadowych , tlenków kwasowych, tlenków obojętnych,
tlenków amfoterycznych.
3. Wykaż (w oparciu o odpowiednie reakcje – zapis cząsteczkowy i jonowy) amfoteryczność
Al(OH)
3
, Zn(OH)
2
i Pb(OH)
2
4. Wymień mocne kwasy i mocne zasady. Napisz równania ich dysocjacji. Podaj przykłady
słabych kwasów i słabych zasad. Napisz równania ich dysocjacji.
5. Podaj przykłady soli ulegających hydrolizie: kationowej, anionowej i kationowo-anionowej
(napisz reakcje odpowiednich jonów z cząsteczkami wody). Określ odczyn roztworów tych
soli.
6. Jaki odczyn wykażą roztwory soli: K
2
SO
4
, NaCl, KNO
3
, NH
4
Cl, NaNO
2
, FeCl
3
, CuSO
4
,
NH
4
NO
2
, Na
2
CO
3
, CH
3
COONa, K
2
SO
3
, Zn(NO
3
)
2
. Napisz równania jonowe
przebiegających reakcji. (czyli reakcje odpowiednio anionu i/lub kationu z cząsteczkami
wody, jeżeli te reakcje zachodzą). Wskaż w tych równiach sprzężone pary kwas-zasada
zgodnie z teorią Brønsteda.

7. Które z wymienionych soli są dobrze rozpuszczalne w wodzie: KCl, NaNO
3
, BaSO
4
, AgCl,
BaCO
3
, K
2
CO
3
, NH
4
Cl, Ba(NO
3
)
2
, CuCl
2
, NaCl, AgNO
3
, MgCl
2
, Na
3
PO
4
, NH
4
NO
3
, KClO
4
,
Na
2
SO
4
?
8. Podaj przykłady roztworów buforowych. Wyjaśnij zasadę działania buforów (octanowego,
amonowego i fosforanowego) w oparciu o teorię Brønsteda.
9. Uzupełnij reakcje redoks (dobierz w współczynniki w oparciu o reakcje połówkowe) ,
wskaż utleniacz i reduktor. Które z podanych reakcji są reakcjami dysproporcjonowania?
a) C
2
O
4
2-
+ MnO
4
-
+ H
+
→ CO
2
+ Mn
2+
+ H
2
O
b) NO
2
-
+ I
-
+ H
+
→ NO + I
2
+ H
2
O
c) HNO
2
+ KMnO
4
+ H
2
SO
4
→ HNO
3
+ MnSO
4
+ K
2
SO
4
+ H
2
O
d) KIO
3
+ HI + H
2
SO
4
→ I
2
+ K
2
SO
4
+ H
2
O
e) KMnO
4
+ KNO
2
+ NaOH → K
2
MnO
4
+ Na
2
MnO
4
+ KNO
3
+ H
2
O
f) KI + H
2
O
2
+ H
2
SO
4
→ I
2
+ H
2
O + K
2
SO
4
g) Cr
2
O
7
2-
+ Sn
2+
+ H
+
→ Cr
3+
+ Sn
4+
+ H
2
O
h) MnO
4
-
+ H
+
+ H
2
O
2
→ Mn
2+
+ O
2
+ H
2
O
i) Cu + HNO
3
→ Cu(NO
3
)
2
+ NO + H
2
O
j) NH
3
+ O
2
→ N
2
+ H
2
O (w NH
3
stopień utlenienia N = -3)
k) NaClO + H
2
O
2
→ NaCl + O
2
+ H
2
O
l) NO
3
-
+
H
+
+ S
2-
→
NO + SO
4
2-
+
H
2
O
ł) K
2
MnO
4
+ H
2
O →KMnO
4
+ MnO
2
+ KOH
m) I
2
+ OH
-
→ I
-
+ IO
3
-
+ H
2
O
n) NH
4
+
+ NO
2
-
→
N
2
+ H
2
O
o) Ag + HNO
3
→ AgNO
3
+ NO
2
+ H
2
O
p) Mg + H
+
+ NO
3
-
→ Mg
2+
+ N
2
O + H
2
O
r) NaOH + Ca(OH)
2
+ C + ClO
2
→ NaClO
2
+ CaCO
3
+ H
2
O
10. Uzupełnij w oparciu o równania połówkowe następujące równania reakcji, wskaż utleniacz
i reduktor, dobierz środowisko reakcji redoks.
a)MnO
4
-
+ ……+ SO
3
2-
→ Mn
2+
+ SO
4
2-
+ H
2
O
b) MnO
4
-
+ ...... + SO
3
2-
→ MnO
2
↓ + SO
4
2-
+ ..........
c) MnO
4
-
+ ..........
+ SO
3
2-
→ MnO
4
2-
+ SO
4
2-
+ H
2
O
d) MnO
4
-
+ Cl
-
+ .......... → Mn
2+
+ Cl
2
+ ........
e) AsO
3
3-
+ I
2
+ .........→ AsO
4
3-
+ I
-
+ ........
f) Bi
3+
+ SnO
2
2-
+ .........→ Bi + SnO
3
2-
+ H
2
O
g) Fe
2+
+ NO
2
-
+ ........→ Fe
3+
+ NO
+ H
2
O
h) H
2
O
2
+ I
-
+ …… → I
2
+ H
2
O
i) NO
2
-
+ I
-
+.........→
NO + I
2
+ ......
j) Fe
2+
+ NO
3
-
+ ........→ Fe
3+
+ NO
+ H
2
O
k) MnO
4
-
+ C
2
O
4
2-
+ .......... → Mn
2+
+ CO
2
+ ........
l) Fe
2+
+ ClO
4
-
+ .........→ Cl
-
+ Fe
3+
+ ………
11. Powtórz: podstawowe prawa chemiczne: prawo zachowania masy, prawo zachowania
energii, prawo stałości składu, prawo stosunków wielokrotnych, prawo stosunków
objętościowych, liczba Avogadro, definicja mola, względna masa atomowa i cząsteczkowa,
masa molowa, objętość molowa gazów w warunkach normalnych i standardowych.
12. Zadania związane z prawami chemicznymi (rozwiązane na wykładzie+ zadania typu 1- 10 ).
1. Ile g magnezu wzięło udział w reakcji z tlenem , jeżeli w wyniku reakcji otrzymano 6,0 g
MgO. Masa molowa magnezu 24 g/mol ( odp.:3,60 g magnezu)

2. Mieszanina wodoru i azotu zawierała po 20 moli obu gazów. Po pewnym czasie w
mieszaninie powstało 6 moli NH
3
.Napisz równanie reakcji otrzymywania amoniaku z
wodoru i azotu. (N
2
+ 3H
2
→ 2NH
3
) Podaj skład końcowy mieszaniny. (odp.11 moli H
2
,
17 moli N
2
, 6 moli NH
3
). Jaka jest objętość ( objętość w warunkach normalnych )
otrzymanego w reakcji amoniaku? (odp.134,4 dm
3
)
3. Ile atomów Na znajduje się w 1 g sodu? B) Jaka jest bezwzględna masa jednego atomu
sodu? (Masa molowa sodu wynosi 23 g/mol). (patrz rozwiązanie przykładu 9 wykład 4-5).
4. Ile cząsteczek wody , atomów wodoru i atomów tlenu znajduje się w 36 g wody?
(podpowiedź:36 g wody to 2 mole wody , 1 mol wody to 6,02 · 10
23
cząsteczek wody, w
jednej cząsteczce wody są 2 atomy wodoru i 1 atom tlenu- te informacje powinny pomóc w
rozwiązaniu zadania). Odp. 1,204·10
24
cząsteczek wody, 1,204·10
24
atomow tlenu,
2,408·10
24
atomów H.
5. W ilu gramach CO
2
znajduje się 3,01·10
23
atomów C? Ile atomów tlenu jest w tej liczbie
moli CO
2
(masa molowa CO
2
44 g/mol). Jaka jest objętość w warunkach normalnych tej
ilości gramów CO
2
. (odp. 22 g CO
2
, 6,02·10
23
atomów tlenu, 11,2 dm
3
)
6. Oblicz ile g KOH przereaguje z 2,8 dm
3
CO
2
(w warunkach normalnych) , jeżeli w wyniku
reakcji powstaje węglan potasu. Napisz równanie reakcji:
(2KOH + CO
2
→ K
2
CO
3
+ H
2
O). Masy molowe: K 39 g/mol, O-16 g/mol, H -1 g/mol)
( Uwaga : objętość molowa CO
2
w warunkach normalnych 22,4 dm
3
odp. 14 g)
7. Oblicz ile gramów siarczku magnezu można otrzymać z 1,00 g magnezu i 1,00 g siarki.
Masy molowe Mg 24 g/mol, S 32 g/mol.(Podpowiedź: Mg+ S→MgS, należy obliczyć ile
moli Mg i ile moli S użyto do tej syntezy, reakcja przebiega w stosunku molowy 1:1, więc
liczba moli powstałego MgS będzie równa liczbie moli tego pierwiastka, którego użyto w
mniejszej liczbie moli. Odp. 1,75 g MgS)
8. W wyniku reakcji 3,0 g dwuwartościowego metalu z kwasem siarkowym wydzieliło się 1,68
dm
3
wodoru (warunki normalne). Oblicz ile atomów jest zawarte w 60,0 g tego metalu.
(podpowiedź: Me + H
2
SO
4
→ MeSO
4
+ H
2
, 1 mol metalu reaguje z 1 molem kwasu,
należy policzyć ile g metalu ( czyli 1 mol) reaguje z wytworzeniem 1 mola wodoru-22,4
dm
3
wodoru., a następnie wiedząc, że w 1 molu (czyli w tej ilości g odpowiadającej masie 1
mola metalu) tego metalu jest 6,02·10
23
atomów, obliczyć ile atomów metalu jest w 60 g ) .
Odp.9,03·10
23
atomów metalu.
9. Siarczan magnezu został zmieszany z węglanem wapnia w stosunku masowym 3:5. Oblicz
w jakim stosunku molowym zmieszano te sole. Masy molowe: Mg 24 g/mol.S 32 g/mol, O-
16 g/mol, Ca 40 g/mol, C 12 g/mol) Odp. 1:2
10. Jaką objętość zajmie tlen (warunki normalne) wydzielony podczas całkowitego rozkładu
10,0 g perhydrolu (30% roztwór nadtlenku wodoru)? (podpowiedź: napisz równanie
rozkładu H
2
O
2
z wydzieleniem tlenu – powstaje tlen i woda. Weź pod uwagę, że 10 g
perhydrolu to roztwór 30%, czyli znajdują się w nim 3g H
2
O
2
) odp. 0,988 dm
3
tlenu.
12.Powtórz: Rodzaje roztworów, sposoby wyrażania stężeń roztworów. Jak wpływa w
roztworze obecność substancji trudno lotnej na temperaturę wrzenia i krzepnięcia roztworu? Na
czym polega osmoza? Czym są koloidy?
Ale głównie zadania związane ze stężeniami procentowymi i molowymi rozwiązane na
wykładzie oraz zadania typu 1-12.
Zadania na stężenia
1. Do 500 cm
3
roztworu azotanu cynku o stężeniu 2,50 mol/dm
3
wsypano 10,0 g tej samej soli.
Zakładając, że objętość roztworu po wsypaniu soli nie uległa zmianie, oblicz jego stężenie
molowe. (masy molowe: Zn 65 g/mol; N 14 g/mol, O 16 g/mol). (odp. 2,608 mol/dm
3
)
2. .Do 20 cm
3
40% roztworu NaOH o gęstości 1,44 g/cm
3
dodano wodę uzyskując 1 dm
3
roztworu. Oblicz stężenie molowe otrzymanego roztworu. Masy molowe Na 23 g/mol, O
16 g/mol. H 1g/mol. (odp. 0,2880 mol/dm
3
).

3. Oblicz stężenie molowe roztworu otrzymanego przez zmieszanie 100 cm
3
12,5% roztworu
HCl o gęstości 1,06 g/cm
3
z 900 cm
3
0,50 molowego kwasu solnego. Masa molowa HCl
36,46 g/mol. (odp. 0,8134 mol/dm
3
). Jakie jest miano tego roztworu?
4. Ze 150 cm
3
4 molowego roztworu KOH o gęstości 1,18 g/cm
3
odparowano 50,0 g wody.
Oblicz stężenie procentowe końcowego roztworu. Masa molowa KOH 56 g/mol.(26,46%).
5. Zmieszano 20 cm
3
4% roztworu H
2
SO
4
o gęstości 1,025 g/cm
3
z 80 cm
3
2,49% roztworu
tego kwasu (d=1,015 g/cm
3
). Oblicz stężenie molowe i procentowe otrzymanego roztworu.
Masa molowa H
2
SO
4
98 g/mol. (0,2900 mol/dm
3
; 2,79%).
6. Ile cm
3
40% NaOH o gęstości d=1,40 g/cm
3
należy użyć do przygotowania 500 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
. Z jaką ilością roztworu kwasu szczawiowego
H
2
C
2
O
4
sporządzonego przez rozpuszczenie 1,2600 g krystalicznego kwasu szczawiowego
w kolbie miarowej o pojemności 200 cm
3
przereaguje 20 cm
3
otrzymanego roztworu NaOH.
(Masy molowe H
2
C
2
O
4
· 2H
2
O 126,06 g/mol; NaOH 40 g/mol).
7. Ile g KI należy dodać do 180 g jego 8% roztworu aby uzyskać roztwór o stężeniu 12%.
(odp. 8,18 g)
8. Ile g chlorku sodu należy odważyć, aby uzyskać 500 cm
3
roztworu soli fizjologicznej
(stężenie 0,9%, gęstość 1,005 g/cm
3
). Jakie będzie stężenie molowe takiego roztworu?
(masa molowa Na 23 g/mol. Cl= 35,5 g/mol) (odp.4,52 g, 0,1545 mol/dm
3
)
9. 10% roztwór glukozy C
6
H
12
O
6
jest podawany dożylnie. Oblicz ile g glukozy należy
rozpuścić w kolbie o pojemności 1 dm
3
, aby otrzymać roztwór glukozy o tym stężeniu.
Gęstość 10% roztworu glukozy wynosi 1,048 g/cm
3
. Jakie jest stężenie molowe takiego
roztworu? (Masy molowe C-12 g/mol, O-16 g/mol, H-1 g/mol)
(odp. 105,8 g; 0,5822 mol/dm
3
)
10. Do marynowania grzybów używany jest 6% roztwór kwasu octowego. Ile wody należy
dolać do 250 cm
3
kupionego w sklepie octu (10% roztwór kwasu octowego CH
3
COOH, o
gęstości d = 1,012 g/cm
3
) aby otrzymać roztwór o stężeniu 6% ? Jakie jest stężenie molowe
marynaty do grzybów? (Masz molowe C-12 g/mol, O-16 g/mol, H- 1 g/mol).(odp. 168,7
cm
3
).
11. Do 150 cm
3
kwasu solnego o stężeniu 0,25 mol/dm
3
dodano 100 cm
3
roztworu NaOH o
stężeniu 0,20 mol/dm
3
. Oblicz stężenie kwasu oraz stężenie NaCl w otrzymanym
roztworze.( HCl- 0,07 mol/dm
3
, NaCl 0,08 mol/dm
3
).
12. Do 250 cm
3
roztworu H
2
SO
4
o stężeniu 0,050 mol/dm
3
dodano 150 cm
3
roztworu tego
kwasu o stężeniu 20% i gęstości 1,14 g/cm
3
. Oblicz stężenie molowe otrzymanego roztworu.
Masa molowa H
2
SO
4
98 g/mol.(0,904 mol/dm
3
)
13. Powtórz założenia teorii dysocjacji Arrheniusa, teorii kwasów i zasad Brønsteda i
Lowry’ego oraz teorię Lewisa.
a)Zdefiniuj kwas i zasadę zgodnie z dwiema ostatnimi teoriami. Podaj przykłady: kwasu, zasady
wg teorii Brønsteda i Lowry’ego oraz teorii Lewisa.
b) Podaj przykład: kwasu cząsteczkowego, anionowego i kationowego w świetle teorii
Brønsteda, oraz cząsteczkowej zasady i anionowej zasady. Napisz wzory sprzężonych zasad do
tych kwasów, oraz wzory sprzężonych kwasów do podanych zasad.
c) Podaj przynajmniej dwa przykłady substancji amfiprotycznych.
W podanych reakcjach protolizy wskaż sprzężone pary kwas-zasada:
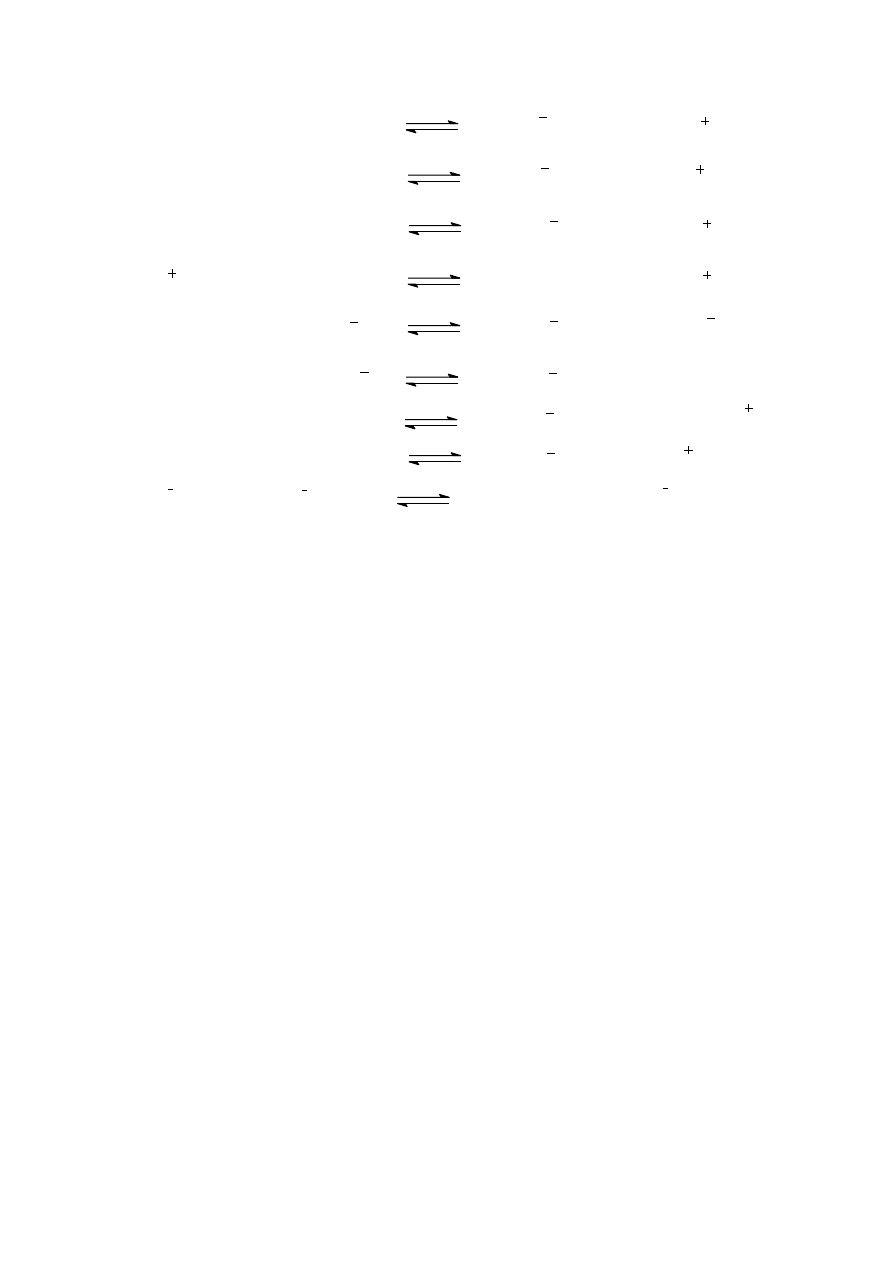
2
SO
4
+
H
2
SO
4
HSO
4
+
HSO
4
H
2
NO
3
+
HSO
4
HNO
3
+
H
2
SO
4
CH
3
CH
2
OH
2
+
Cl
C
2
H
5
OH
+
HCl
CH
3
COOH
+
OH
H2O
+
CH
3
COO
HSO4
+
OH
SO42
+
H2O
H3O
+
NH3
H2O
+
NH4
H3O
+
OH
H2O
+
H2O
NH4
+
Cl
NH3
+
HCl
H3O
+
Cl
H2O
+
HCl
14. Obliczanie
pH mocnych i słabych kwasów. Zadania przykładowe rozwiązane na wykładzie.
Oraz zadania typu
1.Do 100 cm
3
roztworu kwasu solnego o pH 1,25 dodano 400 cm
3
wody. Oblicz stężenie
kwasu i pH w otrzymanym roztworze ( c
k
= 0,01125 mol/dm
3
, pH 1,95)
2. Zmieszano 200 cm
3
roztworu mocnego kwasu jednoprotonowego
o pH 1,40 i 200 cm
3
roztworu tego kwasu o pH = 2,70. Oblicz stężenie i pH otrzymanego roztworu. ( c = 0,02089
pH 1,68)
3. W jakiej objętości 0,015 molowego kwasu H
2
SO
4
znajduje się tyle samo kationów H
+
, co w
150cm
3
0,20 molowego roztworu kwasu octowego zdysocjowanego w 1,0 %. (uwaga:
przyjmujemy założenie, że kwas siarkowy jest zdysocjowany w
100% w obu stopniach
dysocjacji, czyli H
2
SO
4
→2H
+
+ SO
4
2-
) odp. 10 cm
3
.
4. pH roztworu amoniaku wynosi 10,67. Znając stopień dysocjacji elektrolitycznej NH
3
w tym
roztworze α = 0,018 -oblicz jego
stężenie molowe. Czy w oparciu o te dane zawarte w
zadaniu
i obliczone stężenie roztworu amoniaku można obliczyć stałą dysocjacji amoniaku? Podaj
sposób obliczenia tej stałej.
(odp. c (NH
3aq
) = 0,026 mol/dm
3
).
5. Oblicz pH oraz stopień dysocjacji elektrolitycznej roztworu kwasu octowego o stężeniu
0,0825 mol/dm
3
, wiedząc, że K
a
= 1,80 · 10
-5
. (uwaga: należy pamiętać o sprawdzeniu, czy
można zastosować uproszczony wzór Oswalda i czy c/K
a
≥ 400!)
Odp. pH 2,91 α = 1,48%.
6. Do 200 cm
3
roztworu kwasu octowego CH
3
COOH o stężeniu 0,15 mol/dm
3
dodano 200
cm
3
roztworu NaOH o pH =12,70. Znając K
a
=1,80 · 10
-5
, oblicz pH powstałego roztworu.
Potrzebne nam stężenie zasady obliczamy następująco: pOH = 14-12,7 = 1,3 więc stężenie
NaOH = 10
- 1,3
=
0,0501 (mol/dm
3
).
zgodnie z danymi zadania w wyniku dodania zasady do
kwasu octowego powstaje bufor octanowy.
pH = 4,44
7. Do 150 cm
3
roztworu KOH o pH 12,80 wlano 100cm
3
roztworu HNO
3
o stężeniu 0,120
mol/dm
3
. Obliczyć pH powstałego roztworu.

7. Do 100 cm
3
roztworu KOH o pH 12,50 wlano 100cm
3
roztworu HNO
3
o stężeniu 0,150
mol/dm
3
. Obliczyć pH powstałego roztworu.
8. Oblicz pH roztworu azotanu (V)
amonu o stężeniu 0,080 mol/dm
3
, wiedząc, że dla
amoniaku K
b
= 1,80·10
-5
.( Podpowiedź: jest to sól hydrolizująca, mocnego kwasu i słabej
zasady- skorzystaj z odpowiedniego wzoru na stężenie [H
+
]. Odp. 5,18.
9.Oblicz pH roztworu octanu sodu o stężeniu 0,080 mol/dm
3
, wiedząc, że K
a
kwasu octowego
wynosi 1,85 ·10
-5
. (Podpowiedź- jest to sól hydrolizująca słabego kwasu i mocnej zasady –
skorzystaj z odpowiedniego wzoru na stężenie [H
+
] takiej soli, a następnie policz pH. Odp. pH
8,82
10. Oblicz pH octanu amonu znając stałe dysocjacji: amoniaku K
b
= 1,80·10
-5
i kwasu
octowego K
a
=1,85 ·10
-5
(podpowiedź: sól słabego kwasu i słabej zasady-skorzystaj z
odpowiedniego wzoru.) pH = 6,99.
11. Oblicz pH roztworu HCl o stężeniu 0,1 mol/dm
3
.
Do 20 cm
3
tego roztworu dodano
a) 5 cm
3
roztworu NaOH o pH 13
b) 10 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
c) 19,9 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
d) 20 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
e) 20,1 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
f) 25 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
g) 40 cm
3
roztworu NaOH o stężeniu 0,1 mol/dm
3
Oblicz pH w każdym z punktów a-g. Naszkicuj krzywą zależności oś x – liczba dodanych cm
3
roztworu NaOH, oś y – pH roztworu. Jako punkt początkowy krzywej wprowadź wartość pH
roztworu kwasu przed dodaniem zasady (objętość zasady 0 cm
3
).
Co przedstawia powyższy wykres? Jaki wskaźnik jest najlepszy do tego miareczkowania?
Oranż metylowy (zakres zmiany barwy 3,1-4,4), błękit bromotymolowy (zakres zmiany barwy
6,2-7,6), fenoloftaleina (zakres zmiany barwy 8,3-10,0)
15. Budowa atomu i wiązania.
1.Cząsteczka BeF
2
ma moment dipolowy μ = 0. Narysuj wzór strukturalny tej cząsteczki (wiązania i
wolne pary elektronowe). Podaj jaką hybrydyzację ma atom Be w tej cząsteczce.
Jakiego typu wiązanie występuje pomiędzy Be i F?
2.Cząsteczka BCl
3
ma moment dipolowy μ = 0. Narysuj wzór strukturalny tej cząsteczki (wiązania i
wolne pary elektronowe). Podaj jaką hybrydyzację ma atom B w tej cząsteczce.
Jakiego typu wiązanie występuje pomiędzy B i Cl?
3.Cząsteczka CO
2
ma moment dipolowy μ = 0. Narysuj wzór strukturalny tej cząsteczki (wiązania i
wolne pary elektronowe). Podaj jaką hybrydyzację ma atom C w tej cząsteczce.
Jakiego typu wiązanie występuje pomiędzy C i O?
4.Cząsteczka CH
3
OH ma moment dipolowy μ > 0. Narysuj wzór strukturalny tej cząsteczki
(wiązania i wolne pary elektronowe). Podaj jaką hybrydyzację mają atomy C i O w tej cząsteczce.
Jakiego typu wiązanie występuje pomiędzy C i O?
5. Narysuj wiązania wodorowe, które mogą być wytworzone w wodnym roztworze zawierającym
alkohol etylowy (etanol) i propanon (aceton).
6. Narysuj wiązania wodorowe . które mogą być wytworzone w roztworze zawierającym cząsteczki
metanolu, wody i butylo-1-aminy.

Na egzaminie nie można mieć układu okresowego. Znając zasady zapełniania orbitali
atomowych powinni Panstwo umieć odpowiedziec na poniższe pytania
1.Atom 33
75
X
ma _________ protonów, __________ neutronów, __________elektronów.
Należy do _______ okresu,________ grupy, bloku (s, p, d)_________,
jest (metalem, niemetalem)_________________________________________________,
Konfiguracja elektronowa:_____________________________________________________
2
.
Atom
38
88
X
ma ______ protonów, _______ neutronów, ______elektronów.
Należy do ______ okresu,_______ grupy, bloku (s,p,d)________,
jest (metalem, niemetalem)_________________________________________________,
Konfiguracja elektronowa:_____________________________________________________
3.Atom
34
79
X
ma ________ protonów, _________ neutronów, ________elektronów.
Należy do ______ okresu,_______ grupy, bloku (s,p,d)________,
jest (metalem, niemetalem)_________________________________________________,
Konfiguracja elektronowa:_____________________________________________________
4.Atom
25
55
X
ma ________ protonów, _________ neutronów, ________elektronów.
Należy do ______ okresu,_______ grupy, bloku (s,p,d)________,
jest (metalem, niemetalem)_________________________________________________,
Konfiguracja elektronowa:_____________________________________________________
5.Atom
X
70
31
ma ________ protonów, _________ neutronów, ________elektronów.
Należy do ______ okresu,_______ grupy, bloku (s,p,d)________,
jest (metalem, niemetalem)_________________________________________________,
Konfiguracja elektronowa:_____________________________________________________
6.Atom
27
59
X
ma ________ protonów, _________ neutronów, ________elektronów.
Należy do ______ okresu,_______ grupy, bloku (s,p,d)________,

jest (metalem, niemetalem)_________________________________________________,
Konfiguracja elektronowa:_____________________________________________________
1.Podaj skład jądra atomowego (liczbę protonów i liczbę neutronów) , liczbę elektronów oraz ich
konfigurację w zapisie kolejno obsadzanych orbitali atomowych wraz z podaniem ilości elektronów
na każdym orbitalu oraz w zapisie „klatkowym” dla
a)
13
27
3+
X
b)
_
35
80
Y
2.Podaj skład jądra atomowego (liczbę protonów i liczbę neutronów) , liczbę elektronów oraz ich
konfigurację w zapisie kolejno obsadzanych orbitali atomowych wraz z podaniem ilości elektronów
na każdym orbitalu oraz w zapisie „klatkowym” dla
20
40
2+
X
b)
_
34
79
Y
2
3.Podaj skład jądra atomowego (liczbę protonów i liczbę neutronów) , liczbę elektronów oraz ich
konfigurację w zapisie kolejno obsadzanych orbitali atomowych wraz z podaniem ilości elektronów
na każdym orbitalu oraz w zapisie „klatkowym” dla
a)
37
85
+
X
b)
_
16
32
Y
2
4.Podaj skład jądra atomowego (liczbę protonów i liczbę neutronów) , liczbę elektronów oraz ich
konfigurację w zapisie kolejno obsadzanych orbitali atomowych wraz z podaniem ilości elektronów
na każdym orbitalu oraz w zapisie „klatkowym” dla
a)
b)
38
88
+
X
2
_
17
35
Y
\
Chemia organiczna
Znajomość klas związków
1.Nazwij następujące związki, określ do jakich klas należą:
CH
3
CH
2
CH
2
COOH, CH
3
CH
2
CHO, CH
2
CHCH
3
, CH
3
CH
2
CH
2
NH
2
,
CH
3
CH
2
COOCH
3
, CH
3
OCH
3
, CH
3
C
CCH
3
, CH
3
CONH
2
,
OH
CH
3
CHCH
3
OH
CH
3
CH
2
CH
2
Br
CH
3
COCH
2
CH
3
2.Narysuj następujące związki: benzen, kwas propanowy, butanal , propan, 1-butyn (but-1-yn),
1-butyloamina, ester etylowy kwasu etanowego (etanian etylu), eter dietylowy, propen,
propanoamid, cykloheksan, fenol, 2-butanol (butan-2-ol), 1-bromopentan, propanon.
3. Podaj poznane klasy związków – narysuj ich grupę funkcyjną i dla każdej klasy podaj po
jednym przykładzie związku (wzór i nazwa)
4.W podanych wzorach A i B zaznacz grupy funkcyjne – podaj po jednym przykładzie związku
(wzór i nazwa), który ma taką grupę funkcyjną - do jakich klas należą te związki:
HOOCCH
2
CHCNHCHCOOCH
3
NH
2
O
CH
2
A
podpowiedź: w związku są: grupa karboksylowa(COOH- kwasy), grupa aminowa –C-NH
2
( grupa NH
2
połączona z atomem C- aminy), grupa amidowa –CONH- (amidy), grupa estrowa
(-COOCH
3
estry ) i pierścień benzenowy (węglowodory aromatyczne)
Uwaga: w związku nie ma grupy charakterystycznej dla ketonów, ponieważ węgiel związany z
tą grupą jest jednocześnie związany z azotem- co stanowi grupę charakterystyczną dla amidów.
HOCH
2
CHCCH
2
CHCH
2
OCH
3
O
CH
2
Cl
OH
B
Podpowiedź: w podanym wzorze są: grupa alkoholowa OH- połączone z atomem węgla, atom
chlorowca połączony z atomem węgla- halogenopochodne, węgiel związany podwójnym
wiązaniem z tlenem i połączony z dwoma węglami- grupa charakterystyczna dla ketonów ,
grupa charakterystyczna dla fenoli- grupa OH połączona do pierścienia benzenowego, grupa
charakterystyczna dla eterów- atom tlenu połączony wiązaniami pojedynczymi z dwoma
atomami węgla
Izomeria:
1. Istnieje wiele izomerycznych związków o sumarycznym wzorze C
5
H
10
O. Napisz
odpowiadające temu wzorowi sumarycznemu wzory strukturalne następujących związków:
a) aldehydu; b) ketonu; c) nasyconego eteru; d) nasyconego alkoholu; e) nienasyconego
alkoholu.
2. Przykładami odpowiednich par związków zilustruj pojęcia: izomery grup funkcyjnych,
izomery Z i E, enancjomery, izomery szkieletowe, izomery pozycyjne, izomery cis-trans.
3. Istnieje wiele izomerycznych związków o sumarycznym wzorze C
6
H
12
O. Napisz
odpowiadające temu wzorowi sumarycznemu wzory strukturalne następujących związków:
a) aldehydu b) ketonu c) związku optycznie czynnego d) izomeru E e) izomeru cis.
4. Podaj izomery konstytucyjne (szkieletowe, pozycyjne, grup funkcyjnych) dla związku o
wzorze: a)
C
6
H
14
O b)
C
5
H
10
O c)
C
5
H
12
O.

5. Narysuj w postaci wzoru przestrzennego izomery R i S alaniny (kwas 2-aminopropanowy),
w postaci wzory Fischera izomery L i D glukozy, c) wzór chiralnego tłuszczu, d) w postaci
wzoru Fischera D i L rybozę.
Biocząsteczki
1. Podaj przykłady (wzory): tłuszczu roślinnego, tłuszczu zwierzęcego, aminokwasu optycznie
nieczynnego, aminokwasu optycznie czynnego, pentozy, heksozy, aldozy, ketozy, cukru
redukującego, dipeptydu, L-aminokwasu, D-aminokwasu, D-pentozy, L-ketozy, tluszczu
optycznie czynnego.
2. Napisz reakcję utwardzania oraz hydrolizy zasadowej i kwaśnej odpowiednich tłuszczów.
3. Rozszyfruj skróty: NNKT, kwas omega 3, TAG, CLA, C18:2;9,11., Dlaczego wiązanie Z w
kwasach tłuszczowych możemy nazywać wiązaniem cis? Do jakiej klasy związków należą
tłuszcze? Za pomocą jakich reakcji można wykryć te związki
4. Narysuj tłuszcz charakterystyczny dla a) tłuszczów zwierzęcych b) dla tłuszczów
roślinnych
5. Napisz wzór strukturalny kwasu tłuszczowego C18:3;9,12,15 do jakiego szeregu
należy
ten tłuszcz?
Przedstaw 2 izomery tego kwasu tłuszczowego różniące się konfiguracją przy wiązaniach
podwójnych.
Przedstaw wzór tłuszczu zawierający 3 takie same reszty kwasowe (optycznie nieczynny) i
napisz reakcję jego utwardzania. Rysując tłuszcz możesz wykorzystać podany wyżej kwas.
6. Jakie grupy funkcyjne występują: w a) cukrach, b) aminokwasach, c) tłuszczach.
7. Narysuj wzór dipeptydu zbudowanego z glicyny (kwas aminoetanowy)
i alaniny (kwas 2-
aminopropanowy)
Wskaż aminokwas C-końcowy, N-końcowy, obrysuj wiązanie
peptydowe. Jak inaczej nazywamy wiązanie peptydowe? Co to jest sekwencja
aminokwasów? Do jakiego szeregu konfiguracyjnego należą aminokwasy białkowe?
Narysuj wzór L-alaniny i D-alaniny. Co oznacza zapis Gly-Ala a co oznacza zapis Ala-Gly?
8. Napisz w jakiej formie będzie występowała seryna w pH 2, pH =pI, pH =12 (seryna to kwas
2-amino-3-hydroksypropanowy).
9. Narysuj tripeptyd Ser-Gli-Ala, Gli-Ser-Ala, Phe-Gli-Ser
10. Przedstaw w postaci wzoru Fischera glukozę i rybozę. Napisz wzory taflowe tych cukrów.
11. Podaj przykłady: disacharydów (nazwy) i polisacharydów (nazwy). Narysuj wzory Fischera
najważniejszych cukrów prostych (glukoza, ryboza, fruktoza). Do jakiego szeregu należą
cukry obecne w organizmach żywych? Zaznacz na narysowanych wzorach ten fragment
cząsteczki, który wskazuje na przynależność cukrów do określonego szeregu
konfiguracyjnego.
12. Czym są anomery (przykład), enacjomery (przykład), epimery (przykład).
13. Wśród wymienionych związków wskaż cukry, aminokwasy, tłuszcze. Pozostałe związki
przypisz do odpowiednich klas związków organicznych i podaj ich wzory.
Stearynian glicerolu, fruktoza, gliceryna, glicyna, kwas palmitynowy, octan etylu (etanian
etylu, ester etylowy kwasu etanowego), benzen, laktoza, palmitynian glicerolu, alanina,
seryna, glikogen, metanol, chlorek etylu, oleinian sodu, butanal, trioleinian glicerolu,
propanoamid, celuloza, fenyloalanina, kwas masłowy (kwas butanowy), etyloamina.
Student powinien znać wzory: glukozy, fruktozy, rybozy, kwasu palmitynowego i
stearynowego, dowolnego kwasu nienasyconego (oleinowy, linolowy lub linolenowy), wzór
glicyny oraz umieć na podstawie nazwy systematycznej aminokwasu napisać jego wzór.
Uwaga: W przypadku otrzymania innego wyniku niż podano w zadaniu rachunkowym proszę o
zgłoszenie tej informacji na mój mail:
pomyłka leży po mojej stronie.
Wyszukiwarka
Podobne podstrony:
125 pytanid 14024 Nieznany
archiwum panstwowe zadanie egza Nieznany
fizjo opracowane pytania egza(1)
TEMATY WYKADW Z BUDOWNICTWA OGLNEGO i przykadowe pytania 08
Przykadowe pytania z TWF, Przykładowe pytania z TWF
nop sciaga,pytania, alfabetyczn Nieznany
321[07] 01 122 Karta pracy egza Nieznany (2)
341[01] 01 122 Karta pracy egza Nieznany (2)
ELEKTRON przykladowe pytania id Nieznany
341[05] 01 122 Karta pracy egza Nieznany (2)
notatek pl pytania egzaminacyjn Nieznany
7 fiza opracowane pytania id 4 Nieznany (2)
8 przykazan bezpiecznego korzys Nieznany (2)
kolokwium z HLP, pytania, liter Nieznany
Informatyka I sem II 2010 (Egza Nieznany
20 przykazan zdrowego odzywiani Nieznany (2)
do egzaminu pytania przykladowe Nieznany
ekonomika wyklady pytania z eko Nieznany
więcej podobnych podstron