
1
Wydział Inżynierii Materiałowej i Ceramiki
Akademii Górniczo-Hutniczej w Krakowie
Materiały pomocnicze do zajęć seminaryjnych z przedmiotu
„CHEMIA ORGANICZNA”
kierunek: Technologia Chemiczna
Opracowanie:
dr inż. Edyta Stochmal
Kraków 2013

2
SPIS TREŚCI
Str.
1. Wskazówki dotycz
ące nazewnictwa wybranych grup
zwi
ązków organicznych ............................................................................... 3
2. Seminarium, cz
ęść I: Budowa i nazewnictwo związków organicznych ..... 19
3. Seminarium, cz
ęść II: Reakcje związków organicznych ............................ 38

Zasady nazewnictwa związków organicznych
3
1. WSKAZÓWKI DOTYCZĄCE NAZEWNICTWA
WYBRANYCH GRUP ZWIĄZKÓW ORGANICZNYCH
1. Alkany
(w
ęglowodory nasycone łańcuchowe, zawierają jedynie wiązania pojedyncze C-C)
Nazwy alkanów maj
ą końcówkę –an. Ich ogólny wzór to C
n
H
2n+2
(n - liczba całkowita).
Nazwy pierwszych dziesi
ęciu alkanów normalnych (o strukturze prostołańcuchowej):
Liczba atomów
Nazwa
Wzór C
n
H
2n+2
w
ęgla (n)
1
metan
CH
4
CH
4
2
etan
C
2
H
6
CH
3
CH
3
3
propan
C
3
H
8
CH
3
CH
2
CH
3
4
butan
C
4
H
10
CH
3
CH
2
CH
2
CH
3
5
pentan
C
5
H
12
CH
3
CH
2
CH
2
CH
2
CH
3
6
heksan
C
6
H
14
CH
3
CH
2
CH
2
CH
2
CH
2
CH
3
7
heptan
C
7
H
16
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
8
oktan
C
8
H
18
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
9
nonan
C
9
H
20
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
10
dekan
C
10
H
22
CH
3
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
2
CH
3
Nazwy niektórych grup alkilowych (podstawników powstaj
ących z alkanów):
–CH
3
metyl (Me)
–CH
2
CH
3
etyl (Et)
–CH
2
CH
2
CH
3
propyl (Pr)
–CH
2
CH
2
CH
2
CH
3
butyl (n-Bu)
|
CH
3
CHCH
3
izopropyl (i-Pr)
CH
3
CH
3
CH
3
C
tert-butyl (t-Bu)

Zasady nazewnictwa związków organicznych
4
Alkany rozgałęzione
Ogólne zasady nazewnictwa alkanów rozgał
ęzionych:
1.
Nale
ży znaleźć najdłuższy łańcuch węglowy – łańcuch główny, który będzie stanowił
podstaw
ę nazwy. W przypadku, gdy w cząsteczce można wyróżnić kilka łańcuchów o tej
samej długo
ści, podstawę nazwy powinien stanowić ten, który związany jest z większą
liczb
ą podstawników.
2.
Ponumerowa
ć atomy węgla w łańcuchu głównym, rozpoczynając od końca
najbli
ższego rozgałęzienia. W przypadku usytuowania pierwszych rozgałęzień w równych
odległo
ściach od obydwu końców kierować się pozycją kolejnego rozgałęzienia.
3.
Poda
ć położenie i nazwę podstawników, wymieniając je w kolejności alfabetycznej.
4.
Dla identycznych podstawników poda
ć krotność ich występowania za pomocą
odpowiednich przedrostków: di-, tri-, tetra- itd.
5.
Podstawnikom alkilowym nada
ć odpowiednie nazwy reszt węglowodorowych:
etylo-, metylo- itp.
6.
Podstawnik zło
żony nazywany jest zgodnie z powyższymi regułami, rozpoczynając
numerowanie od punktu doł
ączenia do łańcucha głównego (por. podane przykłady).
Nazw
ę tego podstawnika umieszcza się w nawiasie poprzedzonym zapisem numeru
okre
ślającego jego położenie w łańcuchu głównym (por. podane przykłady).
CH
3
CH
2
CCH
2
CHCH
3
CH
3
CH
3
CH
2
CH
3
4-etylo-2,4-dimetyloheksan
CH
3
CH
2
CHCHCH
2
CHCH
2
CH
3
CH
3
CH
2
CH
3
CH
2
CH
3
3,6-dietylo-4-metylooktan
CH
3
C
CH
3
CH
2
CH
3
CH
3
CH
CH
3
CH
CH
2
CH
2
CH
3
CH
3
CH
2
CH
2
CH CH
2
CH
3
CH
2
CH
3
CH
CH
3
CH
3
CH
CH
3
CH
2
CH
2
CH
2
CH
3
CH
CH CH
CH
2
CH
3
C CH
3
CH
2
CH
3
CH
3
CH
3
CH
3
CH
CH
3
2,2-dimetylopropyl
2-etylo-1-metylobutyl
1-metyloetyl
7-etylo-2,3-dimetylo-5-(2,2-dimetylopropylo)nonan
4-(1-metyloetylo)heptan

Zasady nazewnictwa związków organicznych
5
2. Cykloalkany
(w
ęglowodory nasycone pierścieniowe, zawierają wyłącznie wiązania
pojedyncze C-C)
Do nazwy macierzystego w
ęglowodoru o budowie łańcuchowej dodaje się przedrostek cyklo-.
Podstawniki wymienia si
ę w kolejności alfabetycznej ze wskazaniem ich położenia podając
numer w
ęgla, przy którym są położone.
3. Alkeny, alkadieny, alkatrieny
(w
ęglowodory łańcuchowe nienasycone, zawierają
wi
ązania podwójne C=C)
(Reguły podobne jak dla alkanów, ale łańcuch główny musi zawierać wiązanie podwójne)
Nazwy alkenów maj
ą przyrostek –en poprzedzony numerem atomu węgla wskazującego
poło
żenie wiązania podwójnego i są pochodnymi nazw alkanów. Ich ogólny wzór to C
n
H
2n
.
Przy numerowaniu ła
ńcucha głównego pierwszeństwo ma położenie wiązania podwójnego.
Atomy w
ęgla przy podwójnym wiązaniu otrzymują możliwie najniższe numery, a pozycję
wi
ązania podwójnego wskazuje się umieszczając w nazwie numer atomu węgla o niższym
indeksie.
Nazwy zwi
ązków z dwoma podwójnymi wiązaniami (alkadienów) mają końcówkę –dien, z
trzema (alkatrienów) –trien z okre
śleniem położenia, przy czym do podstawy nazwy
pochodz
ącej od nazwy węglowodoru dodaje się łączącą literę „a”.
4. Cykloalkeny
(w
ęglowodory nienasycone pierścieniowe, zawierają wiązanie podwójne
C=C)
(Reguły podobne jak dla cykloalkanów)
Numerowanie rozpoczyna si
ę tak, by wiązanie podwójne było miedzy węglem C1 i C2 i aby
pierwszy podstawnik miał jak najni
ższy numer.
CH
3
CH
2
CH
3
1-etylo-3-metylocykloheksan
CH
2
CHCHCH
3
CH
3
3-metylobut-1-en
CH
3
CH
CHCH
2
CH
2
CH
3
heks-2-en
CH
3
1-metylocyklopenten
CH
2
=CH-CH
2
-CH
2
-CH=CH-CH
3
CH
2
=C-CH
2
-C=CH-CH
3
CH
3
CH
2
CH
3
CH
2
=C=C=CH
2
hepta-1,5-dien
4-etylo-2-metyloheksa-1,4-dien
buta-1,2,3-trien

Zasady nazewnictwa związków organicznych
6
5. Alkiny
(w
ęglowodory łańcuchowe nienasycone, zawierają wiązanie potrójne C
≡
C)
i enyny
(w
ęglowodory łańcuchowe nienasycone, zawierają wiązanie podwójne C=C i potrójne C
≡
C)
(Reguły podobne jak dla alkanów i alkenów, łańcuch główny musi zawierać wiązanie
potrójne w przypadku alkinów i obydwa wiązania wielokrotne w przypadku enynów)
Nazwy alkinów maj
ą przyrostek –in lub –yn poprzedzony numerem atomu węgla
wskazuj
ącego położenie wiązania potrójnego i są pochodnymi nazw alkanów. Ich ogólny
wzór to C
n
H
2n-2
.
W przypadku zwi
ązków zawierających wiązanie podwójne i potrójne (tzw. enynów)
numerowanie ła
ńcucha rozpoczyna się od końca bliższego pierwszego wiązania
wielokrotnego, bez ró
żnicy, czy jest to wiązanie podwójne, czy potrójne. Gdy jednak obydwa
wi
ązania znajdują się w tej samej odległości od każdego z końców cząsteczki, numerację
atomów w
ęgla w łańcuchu należy zacząć od tego końca, bliżej którego znajduje się wiązanie
podwójne.
6. Halogenki alkilowe, R-X
(X = F, Cl, Br, I)
(halogenopochodne alkanów)
(Reguły podobne jak dla węglowodorów alifatycznych)
Fluorowiec traktowany jest jako podstawnik. Numerowanie ła
ńcucha głównego rozpoczyna
si
ę od końca bliższego pierwszego podstawnika, obojętne czy jest to alkil, czy fluorowiec.
Je
żeli w cząsteczce obecne jest wiązanie podwójne lub potrójne, to musi ono znaleźć się
w ła
ńcuchy głównym.
Halogenki alkilowe mo
żna również nazywać traktując atom fluorowca jako grupę funkcyjną;
wówczas zamiast np. chlorometanu b
ędzie chlorek metylu, chloroetanu – chlorek etylu,
2-bromobutanu – bromek izopropylu, itp.
CH
3
C
CCH
3
but-2-yn
CH
3
CHCH
2
CH
2
C
CH
CH
3
5-metyloheks-1-yn
CH
3
CH
CHCH
2
CHCH
2
C
CH
CH
3
4-metylookt-6-en-1-yn
CH
3
CHCH
2
CH
2
CHCH
3
CH
3
Br
2-bromo-5-metyloheksan
ClCH
2
CH
2
CHCHCH
2
CHCH
2
CH
3
CH
3
CH
2
CH
3
CH
2
CH
2
Cl
1,8-dichloro-3,6-dietylo-4-metylooktan
CH
3
-CH=CH-CH
2
-C C-CH
3
hepta-2-en-5-yn
Zasady nazewnictwa związków organicznych
7
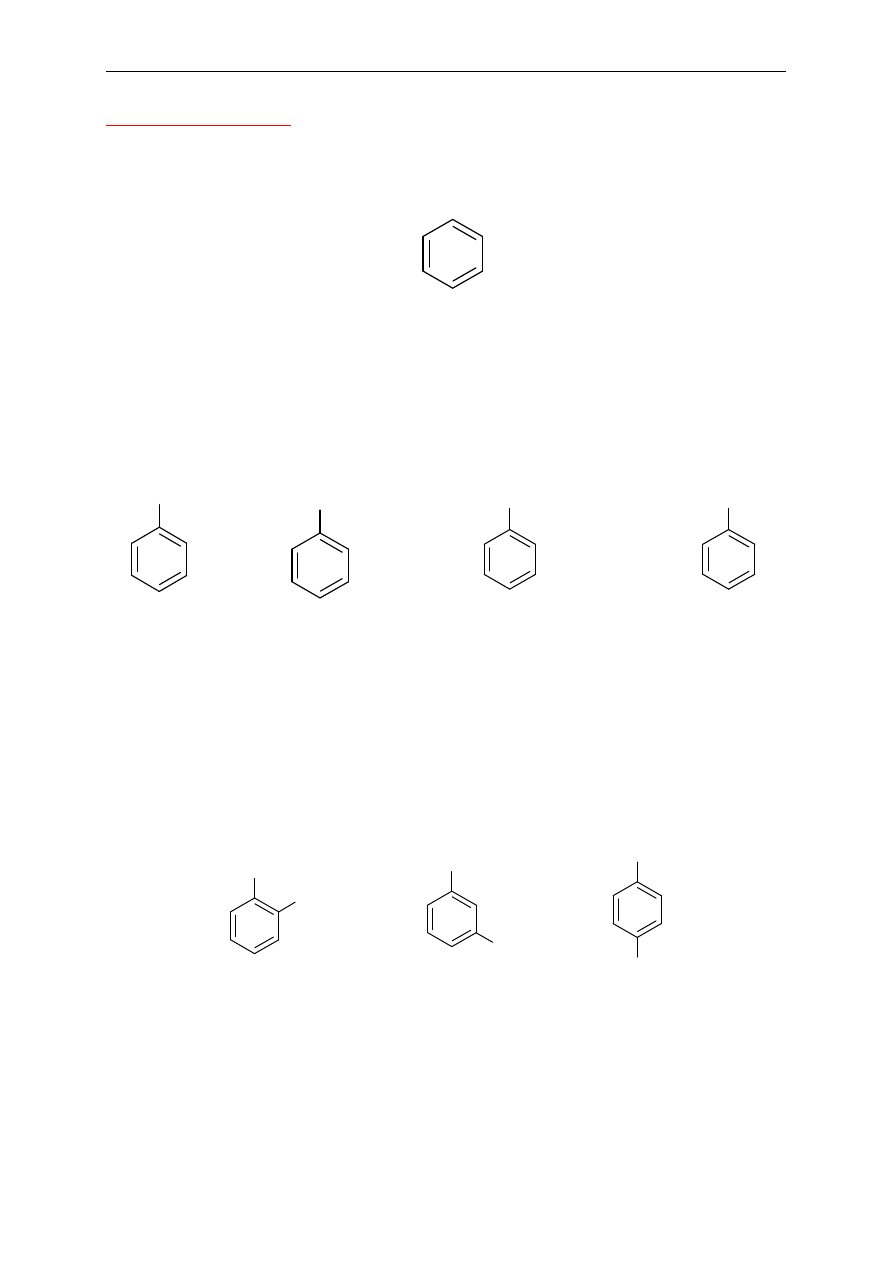
7. Związki aromatyczne
(w
ęglowodory aromatyczne, halogenki arylowe, pochodne benzenu
i zwi
ązków aromatycznych o skondensowanych pierścieniach benzenowych)
Najwa
żniejszym jednopierścieniowym węglowodorem aromatycznym jest benzen:
benzen
Nazwy pochodnych benzenu tworzy si
ę w zależności od rodzaju i liczby podstawników
w pier
ścieniu; wiele z nich ma też nazwy zwyczajowe.
Jednopodstawione pochodne benzenu
Do podstawowej nazwy - benzen dodaje si
ę nazwę podstawnika.
CH
3
metylobenzen
(toluen)
Nazwy zwyczajowe stosowane w przypadku takich podstawników, jak grupy: CH
3
, OH,
COOH, NH
2
to odpowiednio: toluen, fenol, kwas benzoesowy, anilina (wzory niektórych
z tych zwi
ązków zostały pokazane).
Dipodstawione pochodne benzenu
Poło
żenia podstawników oznacza się dwojako: za pomocą liczb lub przedrostków: orto (o),
meta (m), para (p).
OH
hydroksybenzen (fenol)
Br
bromobenzen
NH
2
aminobenzen
(anilina)
Cl
Cl
Cl
CH
3
I
Br
1,2-dichlorobenzen
o-dichlorobenzen
1-bromo-4-jodobenzen
p-bromojodobenzen
1-chloro-3-metylobenzen
m-chlorometylobenzen
lub
3-chlorotoluen
m-chlorotoluen
Zasady nazewnictwa związków organicznych
8
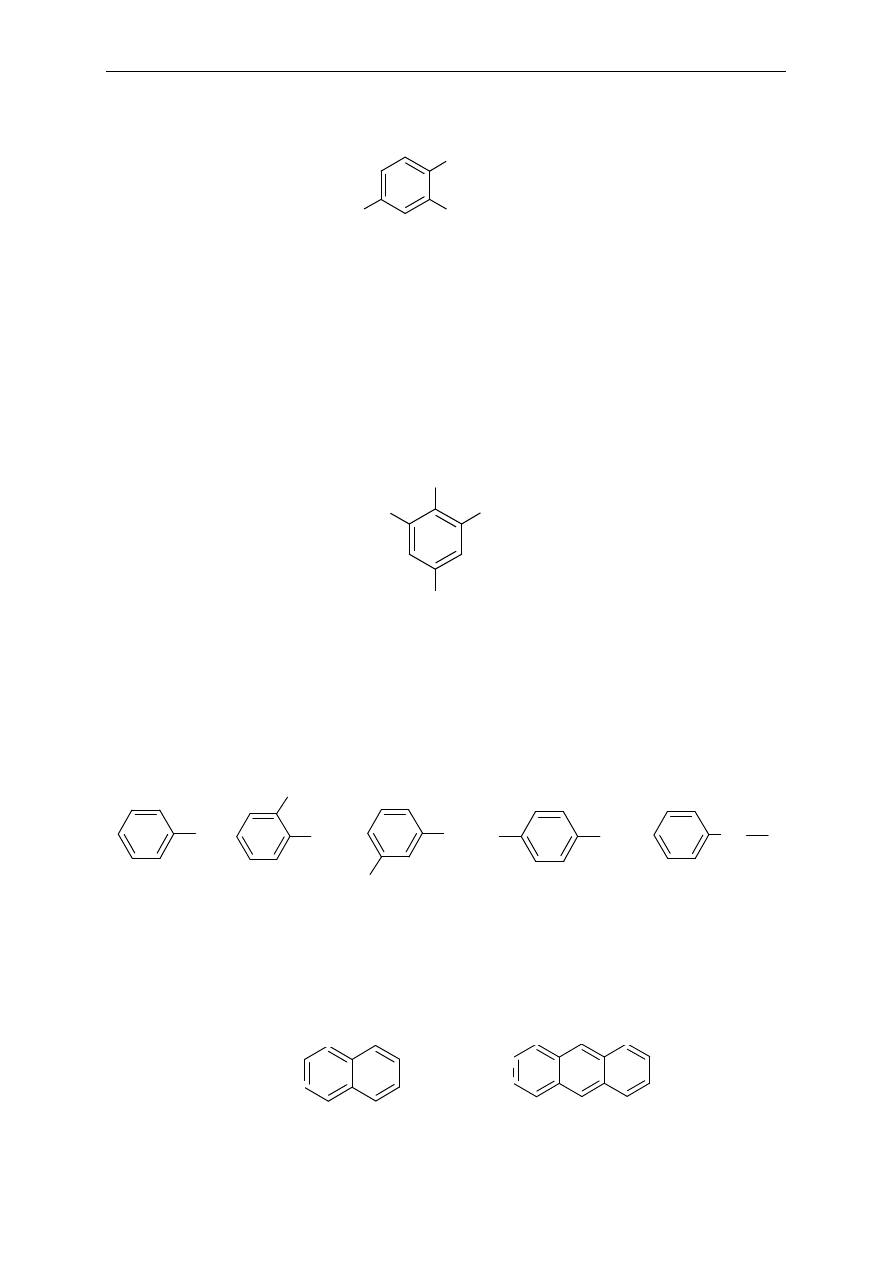
Pochodne benzenu podstawione wi
ęcej niż dwoma podstawnikami
Podstawniki wymienia si
ę w porządku alfabetycznym, poprzedzając ich nazwy liczbami
wskazuj
ącymi pozycje podstawienia. Ważne jest, aby indeksy liczbowe węgli, przy których
s
ą podstawniki, były jak najniższe. W niektórych przypadkach jednopodstawiona pochodna
benzenu mo
że służyć jako nazwa podstawowa (por. przykład 3-chlorotoluenu przedstawiony
wcze
śniej). W wielopodstawionych pochodnych benzenu, gdzie istnieje konieczność
podawania poło
żenia podstawników, atom węgla, przy którym znajduje się charakterystyczna
grupa zwi
ązku stanowiącego podstawę nazwy, oznacza się numerem 1, np.:
Nazwy podstawników zawierających pierścienie benzenowe
Podstawniki powstaj
ące z benzenu to fenyl i fenyleny. Njważniejszym podstawnikiem
powstaj
ącym z metylobenzenu (toluenu) jest benzyl.
Węglowodory zawierające w cząsteczkach skondensowane pierścienie benzenowe –
naftalen, antracen i ich pochodne:
Cl
NO
2
O
2
N
2-chloro-1,4-dinitrobenzen
NH
2
Br
Br
Br
2,4,6-tribromoanilina
1
2
3
4
5
6
7
8
9
10
antracen
2
3
4
5
6
7
8
1
naftalen
p-fenylen
m-fenylen
o-fenylen
fenyl
CH
2
benzyl

Zasady nazewnictwa związków organicznych
9
Numeracja atomów w
ęgla w cząsteczkach zawierających skondensowane pierścienie
benzenowe, takich jak naftalen i antracen, jest
ściśle określona i stała. Numerację tę należy
stosowa
ć tworząc nazwy pochodnych tych węglowodorów.
8. Alkohole (R-OH), diole, triole
(charakterystyczna grupa –OH - jedna lub wi
ęcej -
przył
ączona jest do nasyconego atomu węgla w łańcuchu alkilowym)
Tworz
ąc nazwę alkoholu za podstawową strukturę wybiera się najdłuższy łańcuch węglowy
z grup
ą hydroksylową. Do nazwy macierzystej dodaje się przyrostek –ol poprzedzony
numerem atomu w
ęgla, do którego przyłączona jest grupa –OH. Określając położenie tej
grupy istotne jest, aby indeks zwi
ązanego z nią atomu węgla był jak najniższy.
W przypadku niektórych prostych alkoholi stosuje si
ę nazwy zwyczajowe. Do słowa alkohol
dodaje si
ę nazwę grupy alkilowej lub arylowej połączonej z grupą hydroksylową, np.: alkohol
metylowy, alkohol etylowy, alkohol izopropylowy, alkohol benzylowy.
Nazwy zwi
ązków z dwiema grupami hydroksylowymi (dioli) mają końcówkę –diol, z trzema
(trioli) –triol z okre
śleniem położenia, przy czym do podstawy nazwy pochodzącej od nazwy
w
ęglowodoru dodaje się łączącą literę „o”.
CH
3
CHCH
2
CH
3
OH
butan-2-ol
CH
3
CH
2
CHCH
2
OH
CH
3
2-metylobutan-1-ol
CH
3
CHCH
3
OH
alkohol izopropylowy
CH
2
OH
alkohol benzylowy
CH
2
-CH
2
-CH
2
-CH
2
-CH
3
OH
OH
CH
2
-CH-CH
2
OH
CH
3
OH
CH
2
-CH-CH
2
OH
OH
OH
pentano-1,3-diol
2-metylopropano-1,3-diol
propano-1,2,3-triol
CH
3
Br
OH
CH
3
CH
3
6-bromo-2-metylonaftalen
10-hydroksyantracen
1,2-dimetylonaftalen
CH
3
-CH-CH
2
-CH-CH
2
-CH
3
CH
3
OH
5-metylopentan-3-ol
Zasady nazewnictwa związków organicznych
10
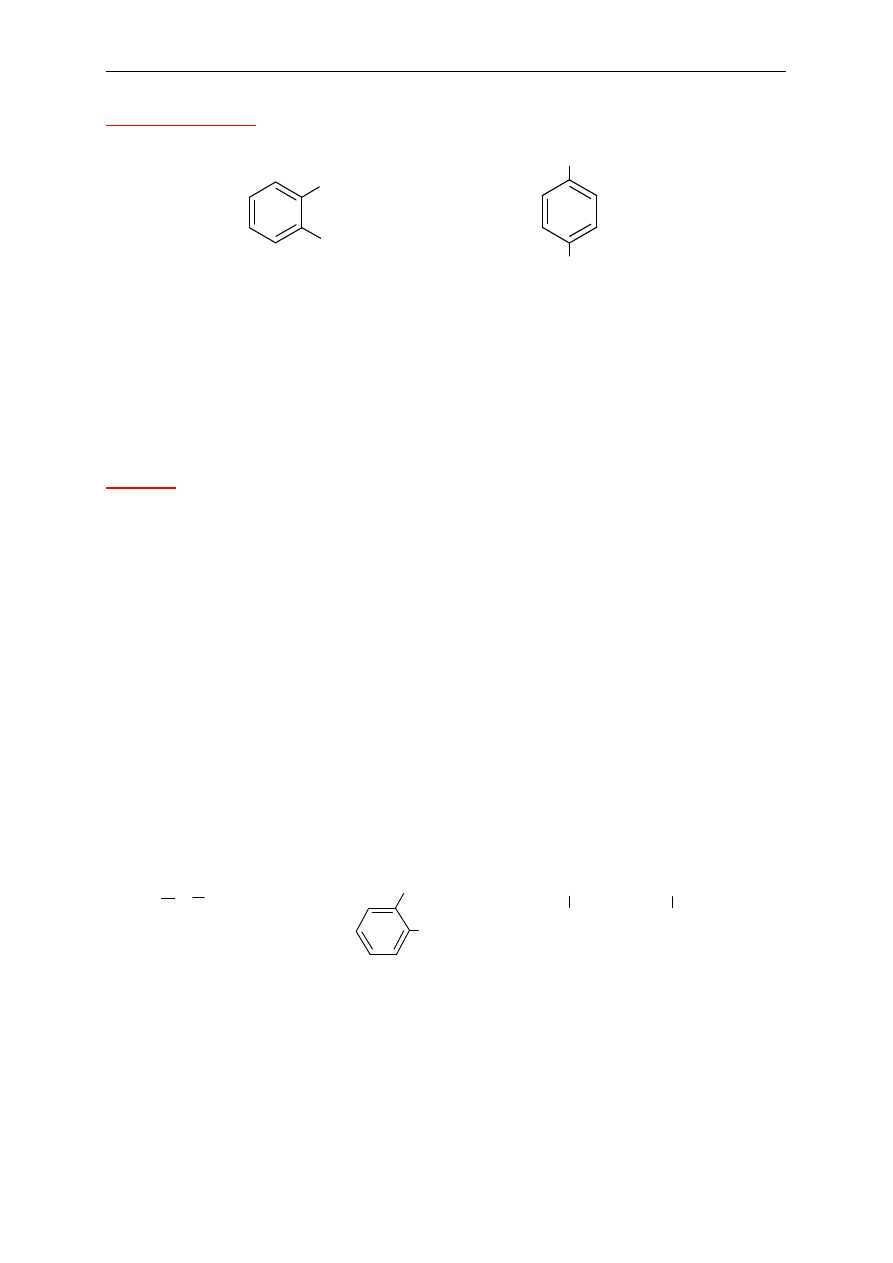
9. Fenole, ArOH
(charakterystyczna grupa –OH przył
ączona jest do pierścienia
aromatycznego)
Nazwy systematyczne fenoli tworzy si
ę dodając przedrostek hydroksy- do nazwy
w
ęglowodoru. Często używane są, w przypadku tej grupy związków, nazwy zwyczajowe.
10. Etery
(charakterystyczne wi
ązanie –C–O–C– w cząsteczce)
Etery proste, nie zawieraj
ące żadnych innych grup funkcyjnych – po słowie eter wymienia się
w kolejno
ści alfabetycznej nazwy grup węglowodorowych połączonych z atomem tlenu.
Mo
żna też etery proste nazywać podstawnikowo, w sposób opisany dla eterów złożonych
(por. podane przykłady). Etery symetryczne, w których z atomem tlenu poł
ączone są takie
same grupy w
ęglowodorowe, nazywa się podając po słowie eter nazwę grupy
w
ęglowodorowej z przedrostkiem –di.
Etery o bardziej zło
żonej budowie – nazwę tworzy się jako pochodną macierzystego
w
ęglowodoru i dodaje nazwę grupy węglowodorowej przyłączonej do atomu tlenu
z ko
ńcówką –oksy. Grupę węglowodorową związaną z atomem tlenu traktuje się więc w tym
przypadku jak podstawnik w cz
ąsteczce węglowodoru stanowiącego podstawę nazwy.
Grupy alkilowe poł
ączone z atomem tlenu nazywa się grupami alkoksylowymi. Przykłady
podstawników alkoksylowych oraz ich nazwy podano w Tabeli 1.
OH
Cl
o-chlorohydroksybenzen
(o-chlorofenol)
NH
2
OH
p-aminohydroksybenzen
(p-aminofenol)
CH
3
-O-CH
2
-CH
2
-CH
3
eter metylowo-propylowy
lub metoksypropan
CH
3
-CH
2
-O-CH
2
-CH
2
-CH
2
-CH
3
CH
3
-O-CH
3
eter butylowo-etylowy
lub etoksybutan
eter dimetylowy
lub metoksymetan
CH
3
O CH
2
CH
2
Cl
1-chloro-2-metoksyetan
OCH
2
CH
3
CH
3
1-etoksy-2-metylobenzen
CH
3
-CH-CH
2
-CH
2
-CH-CH
2
-CH
3
OCH
2
CH
2
CH
3
CH
3
2-metylo-5-propoksyheptan

Zasady nazewnictwa związków organicznych
11
Tabela 1. Przykładowe podstawniki alkoksylowe i ich nazwy.
Podstawnik
Nazwa
CH
3
O-
metoksy
CH
3
CH
2
O-
etoksy
CH
3
CH
2
CH
2
CH
2
O-
butoksy
CH
3
CH
2
CH
2
CH
2
CH
2
O-
pentoksy
2-metylopropoksy
11. Aldehydy
(charakterystyczna grupa aldehydowa, tj. –CHO w cz
ąsteczce)
Nazw
ę aldehydu tworzy się dodając do nazwy macierzystego alkanu przyrostek –al.
Najdłu
ższy łańcuch z grupą –CHO stanowi strukturę podstawową, a atom węgla tej grupy
(gdy aldehyd zawiera podstawniki w cz
ąsteczce) oznacza się jako C1. W przypadku
niepodstawionych aldehydów numeracja atomów w
ęgla w cząsteczce nie jest konieczna.
Niektóre proste aldehydy maj
ą nazwy zwyczajowe, np.: formaldehyd, benzaldehyd.
CHO
benzaldehyd
HCH
O
formaldehyd
CH
3
CH
2
CH
O
propanal
CH
3
CH
3
CH
2
CHCH
2
CH
O
3-metylopentanal
CH
3
-CH-CH
2
O
CH
3

Zasady nazewnictwa związków organicznych
12
12. Ketony
(charakterystyczna grupa karbonylowa, tj. >C=O w cz
ąsteczce)
Nazw
ę ketonu tworzy się od nazwy macierzystego alkanu dodając przyrostek –on,
poprzedzony numerem atomu w
ęgla z grupą karbonylową. Najdłuższy łańcuch z grupą
ketonow
ą uznaje się za strukturę podstawową, a numerowanie atomów węgla rozpoczyna się
od ko
ńca bliższego karbonylowego atomu węgla.
W przypadku niektórych prostszych zwi
ązków z tej grupy nazwy tworzy się wymieniając
w kolejno
ści alfabetycznej nazwy grup połączonych z grupą karbonylową, poprzedzając je
słowem „keton”.
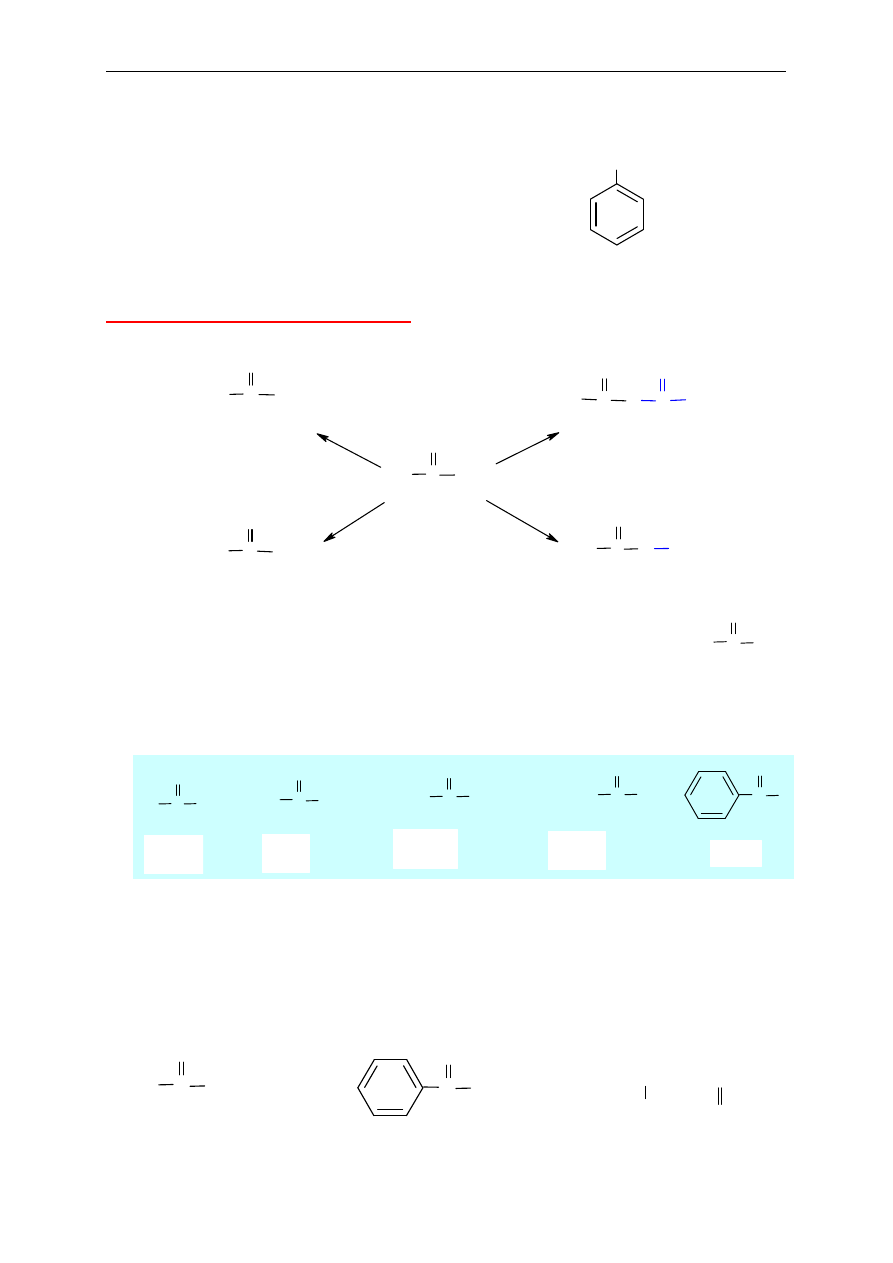
13. Kwasy karboksylowe
(charakterystyczna grupa karboksylowa, tj. –COOH w cz
ąsteczce)
Nazwy systematyczne kwasów karboksylowych tworzy si
ę dwojako:
1
o
sposób
Do nazwy macierzystego alkanu z ko
ńcówką –owy dodaje się słowo kwas, a atom węgla
w grupie karboksylowej jest oznaczany jako C1.
2
o
sposób
Nazwa ła
ńcucha głównego nie obejmuje grupy karboksylowej, a atom węgla, z którym
poł
ączona jest grupa karboksylowa, jest oznaczany jako C1. Do nazwy macierzystego alkanu
dodaje si
ę wówczas słowo kwas i końcówkę -karboksylowy.
CH
3
CH
2
CH
2
CCH
3
O
pentan-2-on
CH
3
CH
2
CCH
3
O
butan-2-on
(keton etylowo-metylowy)
CH
3
CHCCH
3
O
CH
3
3-metylobutan-2-on
CH
3
CCH
3
O
propanon
(keton dimetylowy,
aceton)
CH
3
CH
3
CHCH
2
COOH
kwas 3-metylobutanowy
kwas 2-metylopropanokarboksylowy
CH
3
-CH
2
-COOH
kwas propanowy
lub kwas etanokarboksylowy
Zasady nazewnictwa związków organicznych
13
W przypadku tej grupy zwi
ązków stosowane są często nazwy zwyczajowe, np.: kwas
mrówkowy, octowy, propionowy, benzoesowy.
14. Pochodne kwasów karboksylowych
(halogenki kwasowe, bezwodniki kwasowe, estry,
amidy)
Pochodne kwasów karboksylowych zawieraj
ą charakterystyczną grupę acylową
Nazw
ę tej grupy tworzy się od nazwy macierzystego alkanu dodając końcówkę –oil lub
stosuj
ąc nazwy zwyczajowe.
Przykłady grup acylowych:
Halogenki kwasowe
Nazwy halogenków kwasowych tworzy si
ę podając nazwę odpowiedniego halogenku i grupy
acylowej (systematyczn
ą lub zwyczajową). Gdy halogenek kwasu łańcuchowego zawiera
w cz
ąsteczce podstawniki, podaje się ich położenie, oznaczając atom węgla grupy acylowej
numerem 1.
COOH
kwas benzoesowy
HCOOH
kwas mrówkowy
CH
3
COOH
kwas octowy
R C
O
OH
R C
O
X
R C
O
O
O
R
C
R C
O
O R'
R C
O
NH
2
Kwas
Halogenek
kwasowy
Bezwodnik
kwasowy
Ester
Amid
R C
O
CH
3
C
O
O
C
Cl
Br
Chlorek etanoilu
Chlorek acetylu
Bromek benzoilu
CH
3
CH
2
C
O
CH
3
C
O
H C
O
CH
3
CH
2
CH
2
C
O
O
C
Metanoil
Formyl
Etanoil
Acetyl
Propanoil
Propionyl
Butanoil
Butyryl
Benzoil
CH
3
-CH-CH
2
-C-Cl
CH
3
O
Chlorek 3-metylobutanoilu
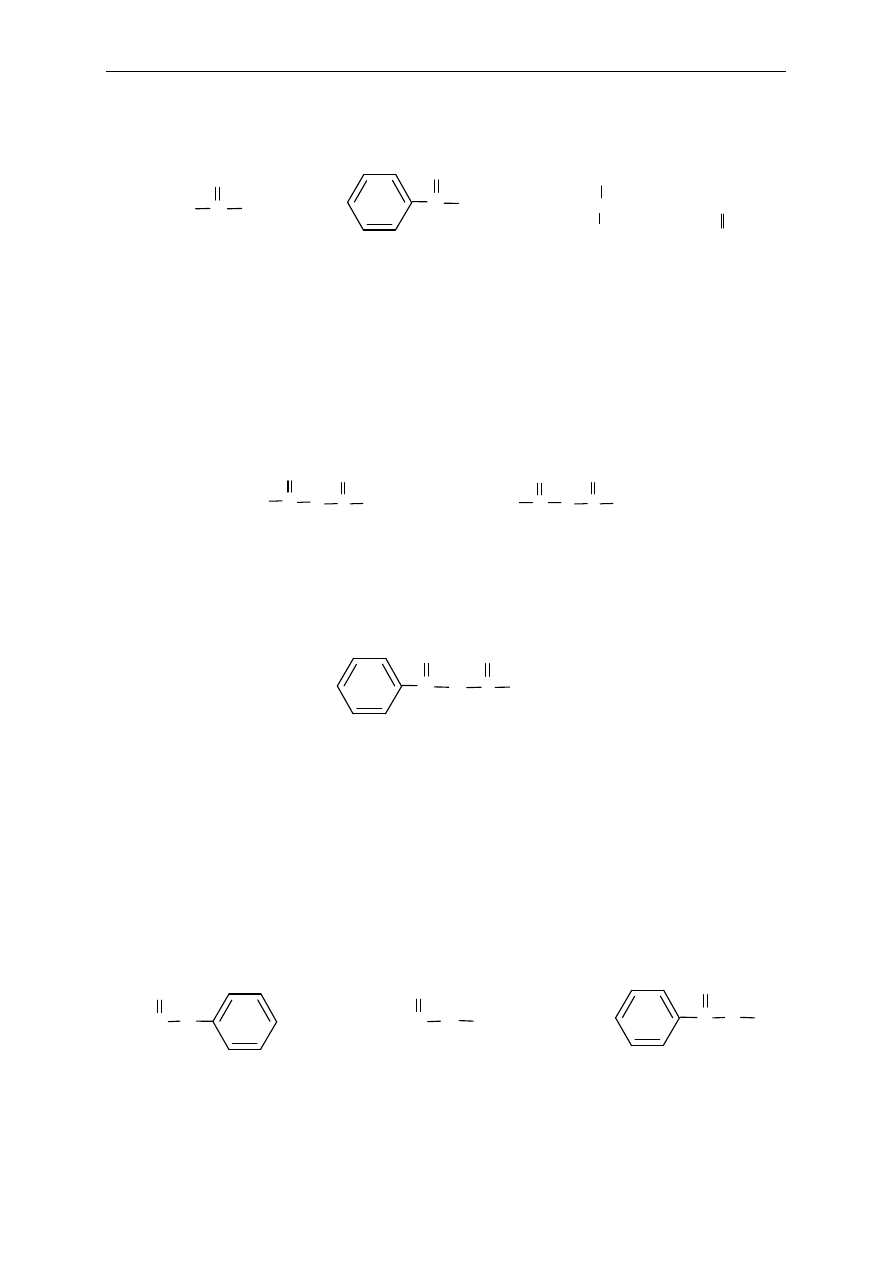
Zasady nazewnictwa związków organicznych
14
Zwi
ązki te można również nazywać w oparciu o nazwę kwasu macierzystego, poprzedzając ją
nazw
ą odpowiedniego halogenku.
Bezwodniki kwasowe
W przypadku bezwodników symetrycznych (otrzymywanych z takiego samego kwasu
karboksylowego) nazwy tworzy si
ę, zastępując słowo kwas słowem bezwodnik lub dodając
słowo bezwodnik do nazwy macierzystego kwasu.
Bezwodniki niesymetryczne (otrzymywane z ró
żnych kwasów karboksylowych) nazywa się
podobnie, przy czym nazwy kwasów podaje si
ę w porządku alfabetycznym.
Estry
W nazwie estru okre
śla się część kwasową i węglowodorową, najczęściej alkilową
(wprowadzon
ą w miejsce atomu wodoru w grupie karboksylowej). Część kwasowa ma
ko
ńcówkę –an lub –ian zamiast końcówki –owy występującej w nazwie kwasu
macierzystego, cz
ęść alkilowa (lub inna węglowodorowa) natomiast podawana jest
w dopełniaczu.
CH
3
CH
2
C
O
Br
O
C Cl
Bromek kwasu
propanowego
Chlorek kwasu
benzoesowego
CH
3
CH
2
C
O
O C CH
2
CH
3
O
CH
3
C
O
O C CH
3
O
Bezwodnik kwasu propanowego
Bezwodnik octowy
O
C
O C CH
3
O
Bezwodnik benzoesowo-octowy
CH
3
CH
2
C
O
O
CH
2
CH
3
O
C
CH
3
O
CH
3
C
O
O
Propanian etylu
Benzoesan metylu
Octan fenylu
CH
3
-C-CH
2
-CH
2
-CH
2
--C-Br
CH
3
O
CH
3
Bromek kwasu
5,5-dimetyloheksanowego
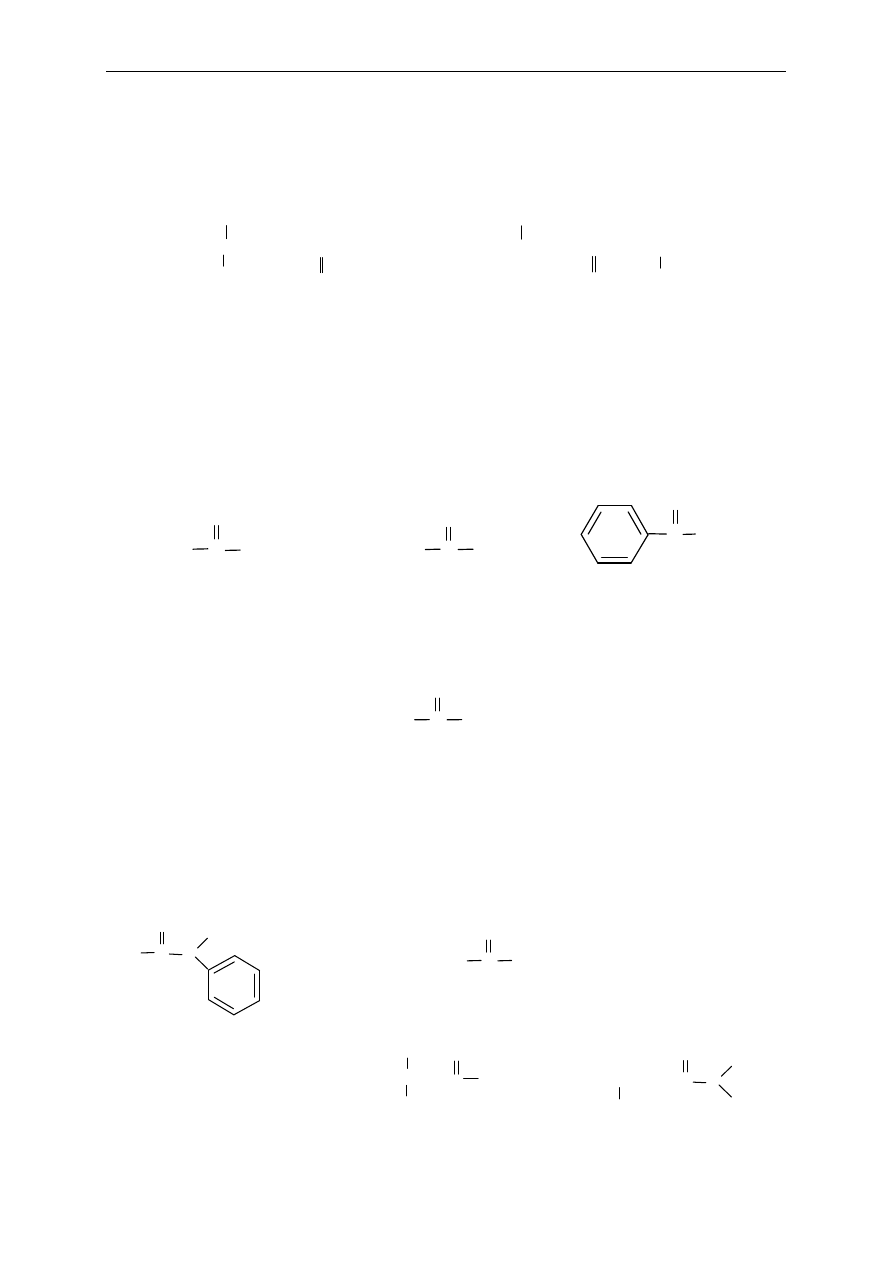
Zasady nazewnictwa związków organicznych
15
W przypadku estrów kwasów ła
ńcuchowych zawierających podstawniki w części kwasowej
podaje si
ę ich położenie w nazwie, oznaczając atom węgla grupy acylowej numerem 1. Gdy
podstawniki znajduj
ą się w części alkilowej (lub ogólnie: węglowodorowej) numeruje się
atomy w
ęgla tej części tak, że atom węgla łączący się z atomem tlenu ma numer 1.
Amidy
Nazwy amidów tworzy si
ę, dodając do nazwy macierzystego alkanu końcówkę –oamid
lub zamieniaj
ąc końcówkę –yl (-oil) w nazwie grupy acylowej na przyrostek –amid.
Zwi
ązki te można także określać, poprzedzając nazwę macierzystego kwasu karboksylowego
słowem amid.
W przypadku amidów podstawionych przy atomie azotu najpierw okre
śla się podstawniki,
a nast
ępnie podaje nazwę amidu macierzystego. Nazwę podstawników poprzedza się
lokantem „N”, co oznacza bezpo
średnie podstawienie przy atomie azotu. Nazwy amidów
kwasów ła
ńcuchowych zawierających podstawniki w części kwasowej tworzy się oznaczając
atom w
ęgla grupy acylowej numerem 1.
CH
3
CH
2
CH
2
C
O
CH
3
C
O
NH
2
NH
2
O
C NH
2
Acetamid
Butanoamid
Benzamid
CH
3
CH
2
C
O
NH
2
Amid kwasu propanowego
CH
3
-C-CH
2
-CH
2
--C-OCH
3
CH
3
O
CH
3
CH
3
-CH-CH
2
--C-OCH
2
-CH-CH
3
CH
3
O
CH
3
4,4-dimetylopentanian metylu
3-metylobutanian 2-metylopropylu
CH
3
-CH-CH
2
-C
O
N
H
CH
3
Br
N-metylo-3-bromobutanoamid
CH
3
C
O
N
H
N-fenyloacetamid
H C
O
N(CH
3
)
2
N,N-dimetyloformamid (DMF)
CH
3
-CH
2
-C-CH
2
-C
O
NH
2
CH
3
CH
3
3,3-dimetylopentanoamid

Zasady nazewnictwa związków organicznych
16
14. Nitrozwiązki
(charakterystyczna grupa –NO
2
w cz
ąsteczce)
Do nazwy macierzystego w
ęglowodoru dodaje się przedrostek nitro-. Grupę nitrową traktuje
si
ę jako podstawnik, a jej pozycję podaje się wymieniając numer atomu węgla,
z którym jest ona zwi
ązana.
15. Aminy
Aminy alifatyczne
Aminy pierwszorz
ędowe (charakterystyczna grupa —NH
2
w cz
ąsteczce)
Nazwy tworzy si
ę przez dodanie przyrostka –amina do nazwy podstawnika alkilowego.
Amin
ę można potraktować również jako pochodną węglowodoru, zwłaszcza
w przypadku amin zawieraj
ących inne grupy funkcyjne. Wówczas grupę -NH
2
mo
żna
wymieni
ć jako podstawnik aminowy oraz określić jego pozycję w związku macierzystym.
Aminy drugorz
ędowe i trzeciorzędowe (charakterystyczne grupy w cząsteczce,
odpowiednio: —NH— lub —N— )
│
W przypadku symetrycznych amin do nazwy dodaje si
ę przedrostek di- lub tri-, np.:
difenyloamina, trietyloamina.
Aminy niesymetryczne drugorz
ędowe i trzeciorzędowe nazywa się jako N-podstawione
aminy pierwszorz
ędowe. Nazwę największej grupy alkilowej wybiera się za nazwę
macierzyst
ą, a pozostałe grupy traktuje jako N-podstawniki (dołączone do atomu azotu),
wymieniaj
ąc je w kolejności alfabetycznej.
CH
3
CH
2
CH
2
NO
2
1-nitropropan
CH
2
CH
2
NH
2
etyloamina
CH
3
CH
2
CHCOOH
NH
2
kwas 2-aminobutanowy
CH
3
CH
2
CH
2
CHCH
3
NH
2
2-aminopentan
CH
2
CH
3
N
CH
2
CH
3
CH
3
CH
2
trietyloamin
trietyloamina
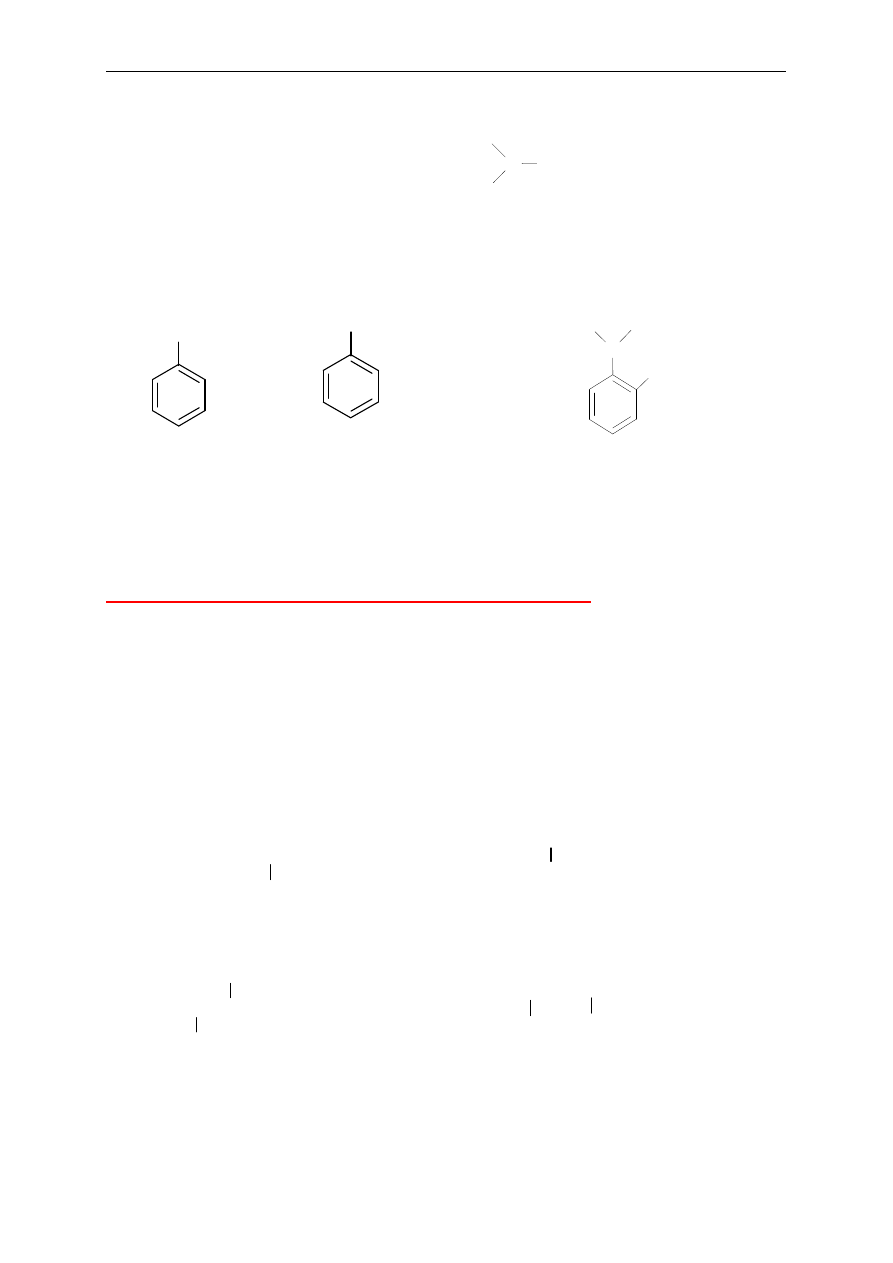
Zasady nazewnictwa związków organicznych
17
Aminy aromatyczne
Aminy aromatyczne traktuje si
ę jako pochodne aniliny (aminobenzenu), a pozostałe grupy
jako N-podstawniki.
16. Związki zawierające w cząsteczkach różne grupy funkcyjne
Je
żeli w cząsteczce związku organicznego znajduje się kilka różnych grup funkcyjnych, to
nazw
ę systematyczną tworzy się w oparciu o zasady obowiązujące dla grupy związków o
grupie funkcyjnej maj
ącej pierwszeństwo, a inne grupy funkcyjne traktuje się jak
podstawniki.
Wybrane grupy funkcyjne, wyst
ępujące w cząsteczkach związków organicznych ułożone
według pierwsze
ństwa przedstawiono w Tabeli 2. Tabela zawiera również nazwy tych grup,
traktowanych jako podstawniki.
Przykłady:
CH
3
CH
2
CH
2
NHCH
3
N-metylopropyloamina
CH
3
CH
N
CHCH
2
CH
2
CH
3
CH
3
N-etylo-N-metylobutyloamina
N
Br
CH
3
CHCH
3
2-bromo-N-etylo-N-metyloanilina
NH
2
anilina
NHCH
3
N-metyloanilina
CH
3
CH
2
CHCOOH
NH
2
kwas 2-aminobutanowy
CH
3
CHCOOH
OH
kwas 2-hydroksypropanowy
(nazwa zwyczajowa: kwas mlekowy)
CH
2
CHCOOH
OH
NH
2
kwas 2-amino-3-hydroksypropanowy
CH
3
CHCH
2
CHCOOH
OH
OH
kwas 2,4-dihydroksypentanowy

Zasady nazewnictwa związków organicznych
18
Tabela 2. Wybrane grupy funkcyjne wyst
ępujące w związkach organicznych uszeregowane
według ich pierwsze
ństwa oraz nazwy tych grup traktowanych jako podstawniki.
Grupa funkcyjna
Klasa zwi
ązku
Nazwa podstawnika
-COOH
kwasy karboksylowe
karboksy
-COOR
estry
R-oksykarbonylo
np.
metoksykarbonylo
(R=CH
3
), etoksykarbonylo (R=C
2
H
5
) itd.
-CONH
2
amidy
karbamoilo
-CHO
aldehydy
formylo
>C=O
ketony
okso
-OH
alkohole, fenole
hydroksy
-NH
2
aminy
amino
-OR
etery
R-oksy, np. metoksy (R=CH
3
), etoksy
(R=C
2
H
5
) itd.

Seminarium, część I
19
2.
Seminarium, część I:
BUDOWA I NAZEWNICTWO ZWIĄZKÓW ORGANICZNYCH
Zagadnienia
1.
Klasyfikacja zwi
ązków organicznych, charakterystyczne grupy funkcyjne
2.
Ogólne zasady nazewnictwa wybranych grup zwi
ązków organicznych
-
W
ęglowodory alifatyczne nasycone i nienasycone: alkany, alkeny, alkiny,
cykloalkany, cykloalkeny
-
W
ęglowodory aromatyczne (areny)
-
Halogenopochodne alkilowe i arylowe
-
Alkohole, fenole, etery
-
Aldehydy i ketony
-
Kwasy karboksylowe i ich pochodne
-
Zwi
ązki zawierające azot: związki nitrowe, aminy
3.
Rz
ędowość atomów węgla, rzędowość alkoholi i amin
4.
Izomeria
-
izomeria konstytucyjna (ła
ńcuchowa, położeniowa, grup funkcyjnych)
-
izomeria geometryczna (izomery cis-trans, konfiguracja podstawników Z-E)
5.
Hybrydyzacja orbitali atomowych w zwi
ązkach organicznych
6.
Polaryzacja wi
ązań w związkach organicznych
Seminarium, część I
20
BUDOWA I NAZEWNICTWO ZWIĄZKÓW ORGANICZNYCH
Zadania
1
. Klasyfikacja związków organicznych
1.
Przyporz
ądkuj poniższe związki do odpowiedniej grupy:
- w
ęglowodory alifatyczne lub węglowodory aromatyczne
- w
ęglowodory nasycone lub węglowodory nienasycone
- alkany, alkeny, alkiny, cykloalkany, cykloalkeny
CH
3
CH
3
CH
3
-CH=CH-CH
3
CH
3
CH
3
-C-CH
3
CH C-CH-CH
2
-CH
3
CH
3
CH
3
CH
3
-C
CH
2
=CH-CH=CH
2
CH
3
CH
3
CH
3
CH
3
C-CH
3
CH
2
CH
3
-CH
2
-C-CH
2
-CH
3
CH
3
CH-CH-CH
3
CH
3
C-CH
2
-C-CH
3
CH
3
CH
3
-CH
2
-CH
2
-C
C
H
2
C
H
2
CH
2
CH
CH
C
H
2
C
H
2
C
H
2
C
H
2
C
H
2
C
H
2
CH
2
CH
2
C
H
2
C
H
2
CH
2
C
H
2
C
H
2
C
H
2
C
H
2
CH
3
H
3
C
CH
3
CH
3
CH
3
C
H
2
C
H
2
CH
2
CH-CH
3
C
H
2
CH-CH
3
CH
3
-CH
2
-CH
2
-CH
2
-CH
2
-CH
3
CH
3
CH-CH
2
-CH-CH
3
CH
3
CH
3
-CH-CH
2
-CH
a)
b)
c)
d)
e)
f)
g)
h)
u)
v)
k)
i)
j)
l)
m)
n)
o)
p)
q)
r)
s)
t)
w)
x)
Seminarium, część I
21
2.
Które z poni
ższych związków to związki heterocykliczne, a które homocykliczne
(karbocykliczne)? W
śród homocyklicznych wskaż te, które są związkami alicyklicznymi
lub aromatycznymi.
NH
2
NO
2
NO
2
N
H
N
N
O
N
N
H
N
N
H
O
N
Cl
NH
2
Cl
CH
3
NO
2
CH
3
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
p)
q)
r)
s)
t)
CH
CH
3
-CH=CH-C
CH
3
C-C-C
CH
3
CH
3
-C
CH
C
H
2
C
H
2
C
H
2
CH
2
CH
2
C
H
C
H
CH
CH
C
H
2
C
H
2
CH
3
CH
3
CH
3
CH
3
y)
z)
aa)
bb)
cc)
dd)
ee)
ff)
Seminarium, część I
22
3.
Na podstawie charakterystycznych grup funkcyjnych przyporz
ądkuj poniższe związki do
odpowiedniej klasy zwi
ązków organicznych:
Zestaw 3.1
CH
Br
Br
H
3
C
CH
3
S
S
N
N
H
Br
CHCl
C
H
2
C
H
2
C
H
2
C
H
2
OH
CH
3
u)
v)
w)
x)
y)
z)
aa)
bb)
cc)
NO
2
CH
3
C
O
NH
2
H
3
C
CH
3
CH
3
CH
3
-CH
2
-NO
2
NH
2
C
NH
2
Cl
H
3
C
CH
3
NH
2
CH
CH
3
CH
2
COOH
CH
3
CH
2
CH
2
OH
H
3
C
CH
3
OH
CH
CH
3
CHCH
2
OH
CH
3
CH
3
OH
H
3
C
CH
3
CH
3
OH
C
H
3
C
O
C
2
H
5
CH
3
H
C
O
CH
3
C
O
CH
3
H
C
O
a)
k)
b)
c)
d)
e)
g)
h)
j)
f)
l)
m)
n)
o)
p)
i)
Seminarium, część I
23
Zestaw 3.2
CH
3
NH
2
NH
2
Br
CH
3
(CH
2
)
4
NH
2
C
5
H
11
COOH
CH
3
COOH
CH
3
OH
CH
3
H
3
C
C
CH
2
H
C
O
CH
3
C
O
H
3
C
CH
2
CH
3
CH
3
CH
2
CH
2
NO
2
NHCH
3
H
3
C
CH
3
CH
3
C
COOH
CH
3
CH
3
CH
3
C
H
3
C
O
t)
q)
r)
s)
u)
v)
w)
x)
y)
z)
aa)
bb)
CH
3
(CH
2
)
4
-C
O
NH
2
N
H
CH
3
CH
3
CH
2
CH
2
NH
2
CH
3
CH
2
CH
2
COOH
CH
3
OH
O
CH
3
CH
COOH
CH
3
CH
3
CH
C
CH
2
COOH
Br
OH
OH
H
3
C
CH
2
CH
OH
H
3
C
O
CH
C
O
CH
3
C
CH
3
CH
3
C
O
CH
3
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
Seminarium, część I
24
Zestaw 3.3
Cl
NO
2
NO
2
C
2
H
5
N
CH
3
COOH
NO
2
NO
2
OH
OH
O
C
Cl
CH
2
CH
2
CHCOOH
CH
3
NO
2
CH
3
N
C
3
H
7
C
2
H
5
CH
3
N
H
CH
3
(CH
2
)
3
CH
2
OH
OH
OH
OH
CH
2
OH
CH
C
CH
3
OH
CH
H
3
C
O
CH
2
CH
HC
O
CH
2
CH
2
CH
3
CH
2
CH
2
C
O
CH
3
m)
n)
o)
p)
q)
r)
u)
v)
s)
t)
w)
x)
z)
y)
aa)
bb)
COOH
NH
2
COOH
OH
COOH
Cl
CH
3
NO
2
NO
2
NO
2
C
O
NH
2
CH
3
NO
2
N(CH
3
)
2
CH
3
H
3
C
CH
2
CH
CH
2
OH
b)
a)
d)
e)
f)
g)
h)
c)
Seminarium, część I
25
OH
COOH
CH
2
CH
2
COOH
CH
3
CH=CHCOOH
CH
3
CHCOOH
COOH
CH
3
O
H-C-N
CH
3
CH
3
-CH
2
-C-CH
3
CH
3
NO
2
NH
C
2
H
5
C
2
H
5
NH
2
Br
Br
Br
N
CHCH
2
CH
3
CH
3
CH
3
CH
3
NH
2
CH
2
CH
2
NH
2
NH
2
NO
2
N
H
CH
2
CH(CH
3
)
2
OH
CH
2
CH
2
OH
CH
2
OH
CH
2
OH
CH
2
OH
CH
2
OH
CH
OH
H
3
C
CH
2
CH
2
H
C
O
CH
3
CH
2
C
O
CH
2
CH
3
H
C
O
CH
2
C
O
O
H
CH
C
O
CH
CH
C
CH
3
CH
3
(CH)
2
CH
H
CH
C
O
i)
j)
k)
l)
m)
n)
o)
p)
q)
r)
s)
t)
u)
v)
w)
x)
y)
z)
aa)
bb)
cc)
dd)
ee)

Seminarium, część I
26
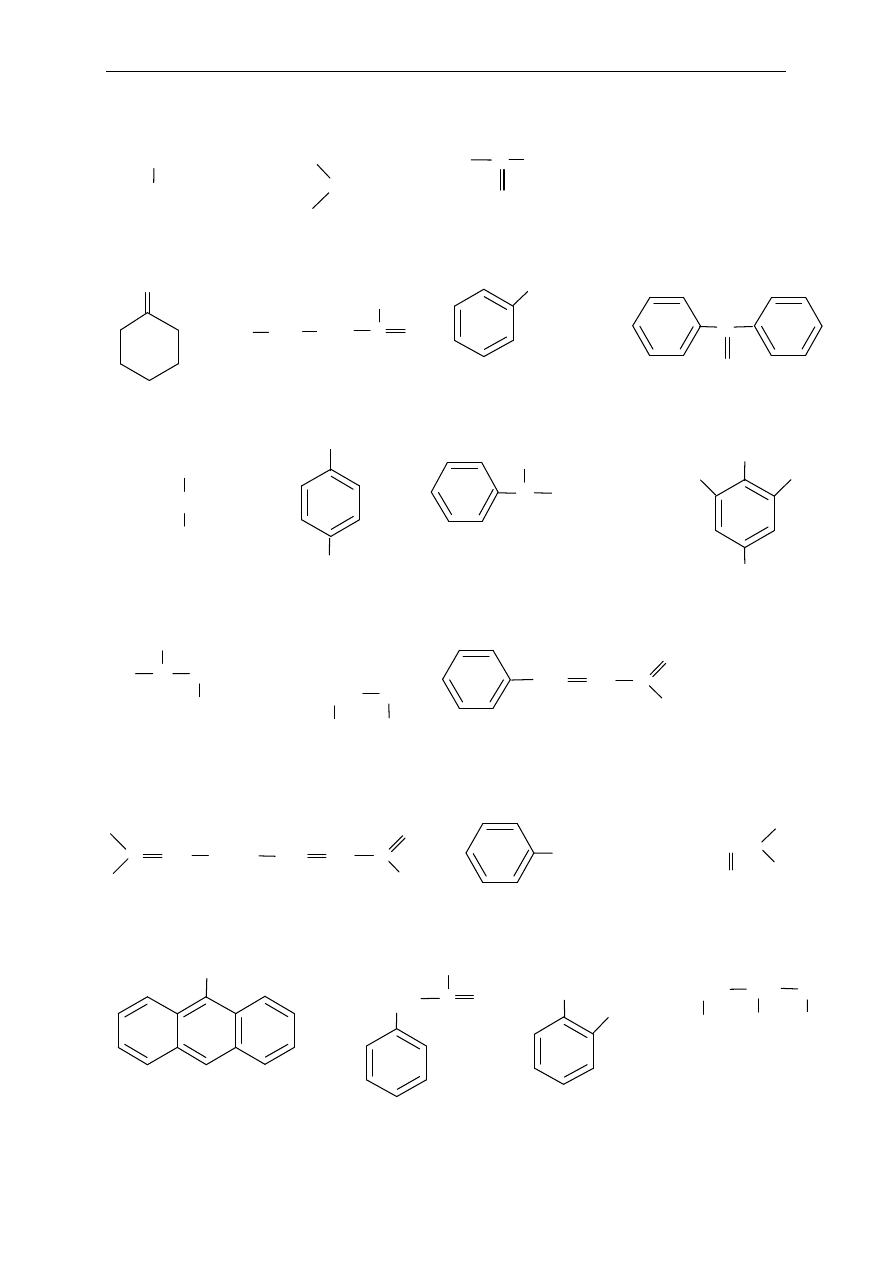
2. Nazewnictwo: Węglowodory
4.
Narysuj zwi
ązki zgodnie z nazwą:
a.
3-etylo-4,4-dimetyloheptan
b.
2,2,3,3–tetrametylopentan
c.
2,3,5-trimetylo-4-propyloheptan
d.
4–etylo–3,4,7,8–tetrametylodekan
e.
3-izopropylo-2-metylooktan
f.
1-etylo-2-metylocyklopentan
g.
2,3–dimetylobut-2-en
h.
pent-2-yn
i.
2,4,4-trimetylopent-2-en
j.
3,6-dimetylookt-1-en
k.
hept-3-yn
l.
5-(1,2-dimetylobutylo)-2,3,3,9-tetrametylodek-1-en
m.
3-metylocykloheksen
n.
3,4-dimetylocyklopenten
o.
1,3,5–trimetylobenzen
p.
1,3-dietylobenzen
q.
p-ksylen
5.
Przedstaw wzory szkieletowe oraz podaj nazwy systematyczne nast
ępujących
w
ęglowodorów:
a.
(CH
3
)
2
CHCH
2
CH
2
CH(C
2
H
5
)
2
b.
(C
2
H
5
)
2
C(CH
3
)CH
2
CH
3
c.
CH
3
CH
2
CH(CH
3
)CH(CH
3
)CH(CH
3
)
2
d.
CH
3
CH
2
CH(CH
3
)CH
2
C(CH
2
CH
2
CH
3
)(CH
2
CH
3
)
2
e.
CH
3
CH
2
C(CH
3
)
2
(CH
2
)
4
CH
3
f.
(CH
3
)
3
CCH
2
CH
3
g.
(CH
3
CH
2
)
2
C=CH
2
h.
CH
3
CH
2
CH=CHCH
2
CH
3
i.
(CH
3
)
3
CCH=CH
2
j.
(CH
3
)
2
CHCH=CHCH(CH
3
)
2
k.
(CH
3
)
2
CHCH
2
CH=C(CH
3
)
2
l.
CH
3
CH(CH
3
)C
≡
CCH(CH
3
)CH
3
m.
HC
≡
CC(CH
3
)
3

Seminarium, część I
27
6.
Poni
ższe nazwy nie są prawidłowe. Narysuj wzory strukturalne związków
odpowiadaj
ące każdej z tych nazw i podaj nazwy właściwe.
a.
2,2-dimetylo-6-etyloheptan
b.
3-etylo-4,4-dimetyloheksan
c.
2-izopropylo-4-metyloheptan
d.
5,5,6-trimetylooktan
e.
2-metylopent-3-en
f.
2-etyloheks-4-en
g.
3-etylo-2-metylocyklopenten
7.
Nazwij nast
ępujące związki i podaj rzędowość atomów węgla:
a.
C(CH
3
)
4
b.
(CH
3
)
2
CHCH
2
CH
2
CH
3
c.
(CH
3
)
2
CHCH(CH
2
CH
3
)
2
d.
(CH
3
)
2
CHC(CH
3
)
2
CH
2
CH
3
e.
(CH
3
)
3
CCH
2
CH
2
CH(CH
3
)
2
f.
CH
3
CH
2
CH
2
CH(CH
3
)CH
2
C(CH
3
)
2
CH
2
CH
3
g.
CH
3
CH
2
CH(CH
3
)CH
2
C(CH
3
)(CH
2
CH
3
)CH
2
CH
2
CH
3
h.
CH
3
CH
2
CH
2
C(CH
3
)(CH(CH
3
)
2
)CH(CH
3
)CH
2
CH
3
8.
Podaj przykład alkanu, który:
a.
ma tylko pierwszorz
ędowe atomy węgla
b.
ma jedynie pierwszorz
ędowe i trzeciorzędowe atomy węgla
c.
ma jeden czwartorz
ędowy i jeden drugorzędowy atom węgla
d.
ma dwa trzeciorz
ędowe atomy węgla, a nie ma w ogóle drugorzędowych
9.
Okre
śl rzędowość atomów węgla w następujących związkach:
.
c.
a.
CH
3
H
3
C
CHCH
2
CH
3
CHCH
3
CH
2
H
2
C
H
2
C
C
b.
CH
3
C(CH
3
)
3
Seminarium, część I
28
10.
Narysuj wzory strukturalne cykloalkanów o podanym wzorze sumarycznym spełniaj
ących
poni
ższe kryteria:
a.
w
ęglowodór C
6
H
12
, który ma jeden pierwszorz
ędowy i jeden trzeciorzędowy atom
w
ęgla
b.
w
ęglowodór C
6
H
12
, który ma dwa pierwszorz
ędowe i jeden czwartorzędowy atom
w
ęgla
c.
w
ęglowodór C
6
H
12
, który ma dwa pierwszorz
ędowe i dwa drugorzędowe atomy
w
ęgla
3. Nazewnictwo: Halogenopochodne węglowodorów
11.
Narysuj zwi
ązki zgodnie z nazwą:
a.
chloroetan
b.
2-bromopropan
c.
2-bromo-2-metylopentan
d.
3-bromo-2,3-dimetylopentan
e.
2,3,3,4–tetrachloroheksan
f.
1–bromo–3–chloro–2,2–dimetylobutan
g.
3,3,5,5–tetrachloro-2,6–dimetyloheptan
h.
1,6–dichloro–3,4,4,5,6–pentametylooktan
i.
5-(1-chloroetylo)-5-chloro-3,4-dimetylooktan
j.
1-bromo-2-metylocyklobutan
k.
3-chloroprop-1-en
l.
3-bromobut-1-en
m.
2-chloroheks-3-yn
n.
5-chloro-4,7-dietylo-3,3,8-trimetylodek-1-en
o.
p-bromotoluen (1-bromo-4-metylobenzen)
p.
chlorobenzen
q.
o-dibromobenzen
r.
m-dichlorobenzen
s.
3,5-dibromotoluen
g.
f.
e.
d.

Seminarium, część I
29
12.
Podaj nazwy systematyczne poni
ższych związków:
a.
(CH
3
)
2
CHCH
2
CH
2
CH(Br)CH
3
b.
CH
3
CH(Br)CH
2
CH
2
CH(Cl)CH
3
c.
CH
3
CH(Br)CH
2
CH
2
C(Cl)
2
CH
3
d.
CH
3
CH=CHCH
2
Br
e.
CH
2
(Br)CH=CHCH
2
I
f.
CH(Cl)
2
C
≡
CCH
2
CH
3
g.
(CH
3
)
2
C=CHCCl
3
h.
CH
3
CH=C(Cl)CH(CH
2
CCl
3
)CH
2
CH
3
4. Nazewnictwo: Inne grupy związków organicznych
13.
Narysuj zwi
ązki zgodnie z nazwą:
a.
propan-2-ol
b.
3-metylobutan-1-ol
c.
2,2-dimetylopropan-1-ol
d.
m–jodofenol (1-hydroksy-3-jodobenzen)
e.
2,4,6–trinitrofenol (1-hydroksy-2,4,6-trinitrobenzen)
f.
3-chloropentan-2-ol
g.
p-metoksyfenol
h.
eter dimetylowy (metoksymetan)
i.
eter etylowo-metylowy (metoksyetan)
j.
eter butylowo-propylowy (propoksybutan)
k.
eter fenylowo-metylowy (metoksybenzen)
l.
2-metylobutanal
m.
pentan-3-on (keton dietylowy)
n.
2,2-dimetylocyklopentanon
o.
2-hydroksybenzenokarboaldehyd (aldehyd o-hydroksybenzoesowy)
p.
fenyloetanal
q.
1-fenylopropan-2-on (keton benzylowo-metylowy)
r.
kwas propionowy (kwas propanowy)
s.
kwas 3-chloro-2,2-dimetylopropanowy
t.
chlorek butanoilu,
u.
bromek formylu
v.
bezwodnik propanowy
w.
kwas o-aminobenzoesowy
Seminarium, część I
30
x.
kwas o–chlorobenzoesowy
y.
kwas p–hydroksybenzoesowy
z.
bezwodnik benzoesowy
aa.
bezwodnik mrówkowo-pentanowy
bb.
benzoesan fenylu
cc.
mrówczan butylu
dd.
heksanoamid
ee.
kwas 2–amino–5–bromo–3–nitrobenzoesowy
ff.
kwas 3,5–dinitrobenzenosulfonowy
gg.
N-etylo-N-metylopropanoamid
hh.
N-metylo-3-chlorobutanoamid
ii.
nitrometan
jj.
2-chloro-1-nitropropan
kk.
2-(N-metylo-N-propyloamino)butan
ll.
trietyloamina
mm.
difenyloamina
nn.
2-metylopropyloamina (izobutyloamina)
oo.
N,N-dimetylopropyloamina
pp.
p-dinitrobenzen
qq.
m–bromonitrobenzen
rr.
m–nitrotoluen (1-metylo-3-nitrobenzen)
ss.
p–bromoanilina
14.
Nazwij poni
ższe związki:
a.
CH
3
CH
2
CH
2
C
H
O
e.
O
g.
O
c.
CH
3
CH
2
C
CH
3
CH
3
O
2
N
f.
CH
3
CH
2
CH
2
CHNH
2
CH
2
CH
3
i.
Br
COOH
h.
O
2
N
b.
COOH
d.
CH
3
C
O
O
CH
2
CH
3
Seminarium, część I
31
15.
Podaj nazwy alkoholi i okre
śl ich rzędowość:
a.
CH
3
CH
2
CH
2
OH
b.
CH
3
CH(OH)CH
2
CH
3
c.
(CH
3
)
2
C(OH)CH
3
d.
CH
3
CHClCH(OH)CH(CH
3
)
2
e.
CH
3
CHClCH(CH3)CH(CH
3
)CH
2
OH
16.
Podaj nazwy amin i okre
śl ich rzędowość:
a.
C
6
H
5
NHCH
3
b.
CH
3
CH
2
CH
2
N(CH
3
)
2
j.
OH
COOH
n.
(CH
3
)
2
CHCH
2
CHC
6
H
5
OH
l.
C
H
O
Cl
v.
SO
3
H
NO
2
x.
N
CH
3
C
H
3
q.
CH
3
N
CH
3
CH
3
k.
SO
3
H
CH
3
r.
OH
NO
2
NO
2
O
2
N
o.
N
H
t
NO
2
CH
3
p.
O
C
CH
2
CH
2
CH
3
O
u.
CH
3
CH
2
C
O
Br
m.
H C
O
N
H
w.
CH
3
(CH
2
)
3
C
O
N(CH
3
)
2
s.
CH
3
CH
2
C
O
O
C CH
2
CH
2
CH
3
O

Seminarium, część I
32
c.
CH
3
CH
2
CH
2
CH(CH
2
CH
3
)NH
2
d.
(CH
3
)
3
CNH
2
e.
C
6
H
5
CH
2
NHCH
3
5. Izomeria związków organicznych
17.
Narysuj wzory strukturalne oraz podaj nazwy pi
ęciu izomerów związku o wzorze
sumarycznym C
6
H
14
.
18.
Narysuj i nazwij wszystkie monobromopochodne pentanu, C
5
H
11
Br (3).
19.
Narysuj i nazwij wszystkie mo
żliwe izomery:
a.
dichloro n-butanu (5)
b.
dichlorocyklobutanu (3)
20.
Które z podanych zwi
ązków mogą występować w postaci izomerów cis-trans? Narysuj
ka
żdą parę izomerów.
a.
but-2-en
b.
2–metylobut-1-en
c.
pent-1-en
d.
1,1-dichloroeten
e.
but-1-en
f.
2–metylobut-2-en
g.
pent-2-en
h.
1,2-dichloroeten
21.
Które z podanych zwi
ązków wykazują izomerię geometryczną (cis-trans lub Z-E)?
Narysuj wzory strukturalne izomerów i przypisz ka
żdej strukturze konfigurację Z lub E.
a.
prop-1-en
b.
1-chloroprop-1-en
c.
1,2-dibromoprop-1-en
d.
1-bromo-2-chloroeten
e.
2,3-dichlorobut-2-en
f.
3–metylopent-2-en
g.
1-chloro-2-metylobut-2-en
h.
2,3-dimetylopent-2-en
i.
pent-2-yn
j.
4-etylo-3-metyloheks-3-en
22.
Narysuj zwi
ązki zgodnie z nazwą:
a.
trans-4-metyloheks-2-en
b.
cis–2,5–dimetyloheks-3-en
c.
trans–2–metylohept-3-en
Seminarium, część I
33
d.
trans-3,4-dimetyloheks-3-en
e.
(Z)-3-chloro-4-metyloheks-2-en
f.
(E)-2-bromobut-2-en
g.
(E)-2,5-dibromo-3-etylopent-2-en
h.
(Z)-3-bromo-2,2- dimetyloheks-3-en
23.
Przypisz konfiguracj
ę E lub Z następującym związkom:
H
C
C
H
3
C
CN
CH
2
NH
2
CH
3
H
COOH
Cl
C
C
C
C
CH
3
CH
2
Cl
CH
2
OH
H
3
C
H
3
C
Br
COOH
CH
2
Br
C
C
a.
b.
c.
d.
24.
Narysuj wzory strukturalne i podaj nazwy wszystkich mo
żliwych izomerów:
a.
ksylenu (dimetylobenzenu)
b.
trimetylobenzenu
c.
kwasu aminobenzoesowego
d.
dibromonitrobenzenu
e.
trinitrofenolu
25.
Zaproponuj wzory strukturalne zwi
ązków spełniających następujące opisy:
a.
alkohole o wzorze C
3
H
8
O
b.
alkohole o wzorze C
4
H
10
O
c.
ketony o wzorze C
5
H
10
O
d.
aldehydy o wzorze C
5
H
10
O
26.
Dla ka
żdego z poniższych związków narysuj wzór izomeru posiadającego takie same
grupy funkcyjne:
c.
OH
d.
O
OH
b.
O
CH
3
a.
CH
3
CH
2
CH
2
C
≡
N

Seminarium, część I
34
27.
Zaproponuj wzory strukturalne cz
ąsteczek o podanych wzorach sumarycznych:
a. C
3
H
8
b. C
2
H
4
O (trzy zwi
ązki)
c. C
2
H
6
O (dwa zwi
ązki)
d. CH
5
N
e. C
3
H
7
Br (dwa zwi
ązki)
f. C
3
H
9
N (cztery zwi
ązki)
6. Hybrydyzacja orbitali atomowych w związkach organicznych
28.
Narysuj wzory kreskowe etanu CH
3
CH
3
, propenu CH
3
CH=CH
2
, propynu CH
3
C
≡
CH
i buta-1,3-dienu CH
2
=CH-CH=CH
2
. Jaka hybrydyzacj
ę mają poszczególne atomy węgla.
Naszkicuj wzory przestrzenne tych zwi
ązków i podaj wartości wszystkich kątów między
wi
ązaniami.
29.
Zaproponuj wzory strukturalne cz
ąsteczek, które zawierają:
a) dwa atomy w
ęgla o hybrydyzacji sp
2
i jeden o hybrydyzacji sp
3
b) dwa atomy w
ęgla o hybrydyzacji sp
2
i dwa o hybrydyzacji sp
3
c) dwa atomy w
ęgla o hybrydyzacji sp
2
i trzy o hybrydyzacji sp
3
d) cztery atomy w
ęgla o hybrydyzacji sp
2
e) cztery atomy w
ęgla o hybrydyzacji sp
2
i dwa o hybrydyzacji sp
3
f) dwa atomy w
ęgla o hybrydyzacji sp i dwa o hybrydyzacji sp
2
g) dwa atomy w
ęgla o hybrydyzacji sp, dwa o hybrydyzacji sp
2
i jeden o hybrydyzacji sp
3
30.
Jak
ą hybrydyzację ma atom:
a) tlenu w metoksymetanie CH
3
OCH
3
b) boru w trimetyloborze (CH
3
)
3
B
c) azotu w dimetyloaminie CH
3
NHCH
3
d) azotu w anilinie (aminobenzenie)
f) azotu w pirydynie
Seminarium, część I
35
N
C
H
C
H
N
CH
CH
C
H
C
H
C
H
C
H
CH
CH
C
NH
2
NH
2
aminobenzen (anilina)
pirydyna
e) berylu w dimetyloberylu CH
3
BeCH
3
g) fosforu w trimetylofosfinie (CH
3
)
3
P
31.
Okre
śl rodzaj hybrydyzacji poszczególnych atomów węgla w następujących cząsteczkach:
a) kwas etanowy (octowy) CH
3
-COOH
b) akrylonitryl CH
2
=CH-C
≡N
c) but-3-en-2-on
CH
2
CH
C
CH
3
O
d) pentan CH
3
CH
2
CH
2
CH
2
CH
3
e) but-1-en-3-yn CH
2
=CHC
≡
CH
f) etoksyetan (eter dietylowy) CH
3
CH
2
OCH
2
CH
3
g) 2-metylopropen (CH
3
)
2
C=CH
2
h) 2-metylopropanal
i) cyklobuten
j) cyklopentan
C
H
2
C
H
2
CH
CH
CH
3
CHC
CH
3
O
H
Seminarium, część I
36
k) fenol
l) kwas benzenokarboksylowy (benzoesowy)
OH
COOH
ł) aspiryna (kwas acetylosalicylowy)
m) witamina C
COOH
O
O
O
O
OH
O
H
OH
O
H
7. Polaryzacja wiązań w związkach organicznych
32.
W poni
ższych związkach wskaż wiązania spolaryzowane zaznaczając atomy obdarzone
cz
ąstkowym ładunkiem ujemnym i atomy obdarzone cząstkowym ładunkiem dodatnim:
N
CH
2
CH
3
O
Cl
H
C
CH
3
CH
3
C
O
C
O
H
3
C
H
3
C
O
CH
CH
3
C
O
H
3
C
O
H
C
O
H
3
C
N
H
H
3
C
H
3
C
CH
2
CH
3
O
CH
2
CH
3
H
CH
3
CH
3
a)
b)
c)
d)
e)
f)
g)
h)
Seminarium, część I
37
O
C
O
NH
2
O
H
3
C
H
3
C
CH
2
O
O
CH
3
O
H
O
C
O
O
CH
3
C
N
i)
j)
k)
l)
m)
n)

Seminarium, część II
38
3.
Seminarium, część II:
REAKCJE ZWIĄZKÓW ORGANICZNYCH
Zagadnienia
1.
Cz
ąstki reaktywne; rodniki, czynniki elektrofilowe, czynniki nukleofilowe
2.
Rodnikowe reakcje halogenowania alkanów (substytucja rodnikowa, S
R
)
3.
Rozszczepianie wi
ązania podwójnego w alkenach – ozonoliza
4.
Reakcje przył
ączania elektrofilowego (addycja elektrofilowa, A
E
); addycja HX oraz
halogenów
do
alkenów,
reguła
Markownikowa,
trwało
ść karbokationów,
przegrupowanie karbokationów, addycja HX oraz halogenów do alkinów
5.
Reakcje przył
ączania rodnikowego w alkenach (addycja rodnikowa, A
R
)
6.
Dieny; elektrofilowa addycja do alkadienów sprz
ężonych, addycja 1,4 i addycja 1,2
7.
Aromatyczno
ść, reguła Hückla
8.
Reakcje podstawienia elektrofilowego; substytucja elektrofilowa w zwi
ązkach
aromatycznych - S
E
Ar, struktury rezonansowe produktów po
średnich
9.
Efekty kieruj
ące w reakcjach elektrofilowego podstawienia aromatycznego; wpływ
skierowuj
ący oraz aktywujący i dezaktywujący podstawników przy pierścieniu
benzenowym, efekty indukcyjne i rezonansowe
10.
Izomeria optyczna (enancjomeria); chiralno
ść cząsteczek, enancjomery, mieszanina
racemiczna, czynno
ść optyczna
11.
Reakcje podstawienia nukleofilowego; substytucja nukleofilowa dwuetapowa
jednocz
ąsteczkowa - S
N
1, substytucja nukleofilowa jednoetapowa dwucz
ąsteczkowa -
S
N
2, substytucja nukleofilowa w halogenkach alkilów i alkoholach
12.
Reakcje eliminacji; mechanizm jednocz
ąsteczkowy, dwuetapowy – E1, mechanizm
dwucz
ąsteczkowy, jednoetapowy – E2, reguła Zajcewa
13.
Efekty indukcyjne i rezonansowe a kwasowo
ść i zasadowość związków organicznych
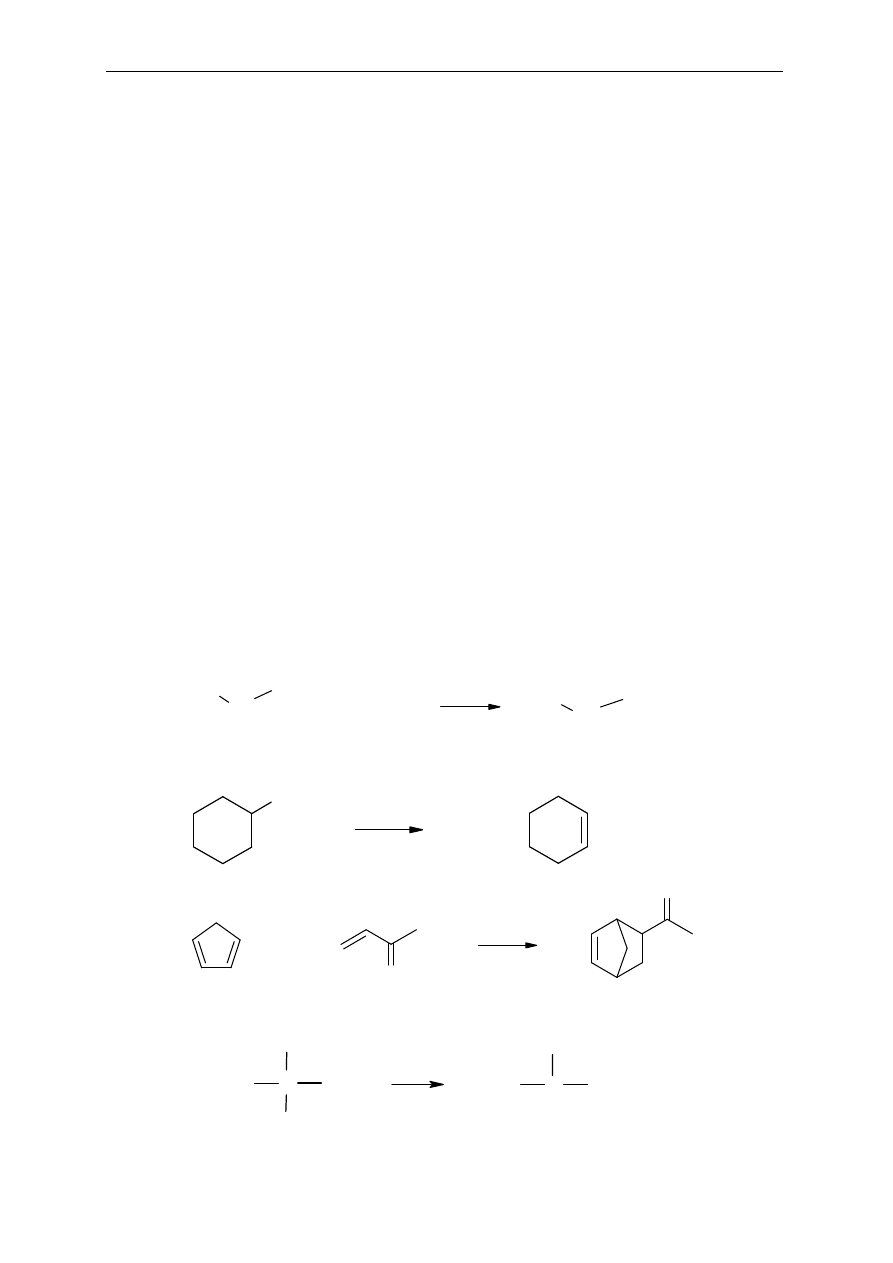
Seminarium, część II
39
REAKCJE ZWIĄZKÓW ORGANICZNYCH
Zadania
1. Typy reakcji i reagenty
1.
Okre
śl poniższe reakcje jako reakcje addycji, eliminacji, substytucji, przegrupowania:
a) CH
3
OH + HBr
→
CH
3
Br + H
2
O
b) H
2
C=CH
2
+ H
2
→
CH
3
CH
3
c) CH
3
CH
3
+ I
2
→
CH
3
CH
2
I + HI
d) CH
3
Br + KOH
→
CH
3
OH + KBr
e) CH
3
CH
2
OH
→
H
2
C=CH
2
+ H
2
O
f) H
2
C=CH
2
+ HCl
→
CH
3
CH
2
Cl
2.
Zaszereguj poni
ższe reakcje do podstawowych grup: addycji, substytucji, eliminacji,
przegrupowania:
a)
b)
c)
d)
C
H
3
CH
2
Br
NaCN
C
H
3
CH
2
CN
NaBr
+
+
OH
P
2
O
5
H
2
O
+
O
O
+
temp.
CH
3
C
CH
2
H
3
C
H
CH
3
C
H
3
C
CH
3
+
+

Seminarium, część II
40
e)
3.
Okre
śl, czy poniższe indywidua molekularne to nukleofil, czy elektrofil?
a) OH
¯
d) H
+
g) NO
2
+
b) Cl
¯
e) NH
3
h) CH
3
CO
+
c) Mg
2+
f) CH
3
NH
2
i) H
2
S
2. Reakcje alkanów
4.
Zaproponuj wzory strukturalne wszystkich oczekiwanych produktów procesu
monochlorowania w temperaturze pokojowej nast
ępujących alkanów:
a) n-pentanu
b) 2-metylopentanu
c) n-heksanu
d) 2,2-dimetylopropanu
e) 2,2-dimetylobutanu
f) 2,2-dimetylopentanu
g) 2,2,3-trimetylopentanu
h) 2,2,4-trimetylopentanu
5.
Podaj wszystkie etapy reakcji:
a) chlorowania etanu
b) bromowania 2-metylopropanu
3. Reakcje alkenów
6.
Narysuj i nazwij zwi
ązki, które otrzyma się w wyniku ozonolizy podanych alkenów, po
której nast
ępuje hydroliza produktu.
CH
3
CH=CHCH
2
CH
3
O
3
Zn, H
3
O+
a)
1.
2.
N
2
O
4
NO
2
HNO
2
+
h
ν
+

Seminarium, część II
41
7.
Narysuj wzór strukturalny alkenu, z którego po procesie ozonolizy, a nast
ępnie hydrolizy
wobec Zn powstaj
ą:
a) aldehyd mrówkowy i propanal
b) keton dimetylowy
c) keton dimetylowy i etanal
d) 2-metylopropanal i butan-2-on
8.
Podaj struktury po
średnich karbokationów oraz produkty końcowe, jakie mogą powstać
w nast
ępujących reakcjach:
a)
b)
c)
CH
3
CHCH=CH
2
CH
3
CH
3
CH=CH
2
CH
3
C=CHCH
2
CH
3
CH
3
CH
3
CH
2
C=CHCH
3
CH
3
O
3
Zn, H
3
O+
O
3
Zn, H
3
O+
O
3
Zn, H
3
O+
O
3
Zn, H
3
O+
b)
c)
d)
e)
1.
2.
1.
2.
1.
2.
1.
2.
C
H
3
CH
2
C
CH
CH
CH
3
CH
3
CH
3
+
HBr
CH
3
CH
2
C=CHC(CH
3
)
3
CH
3
+
HI
Br
H
+
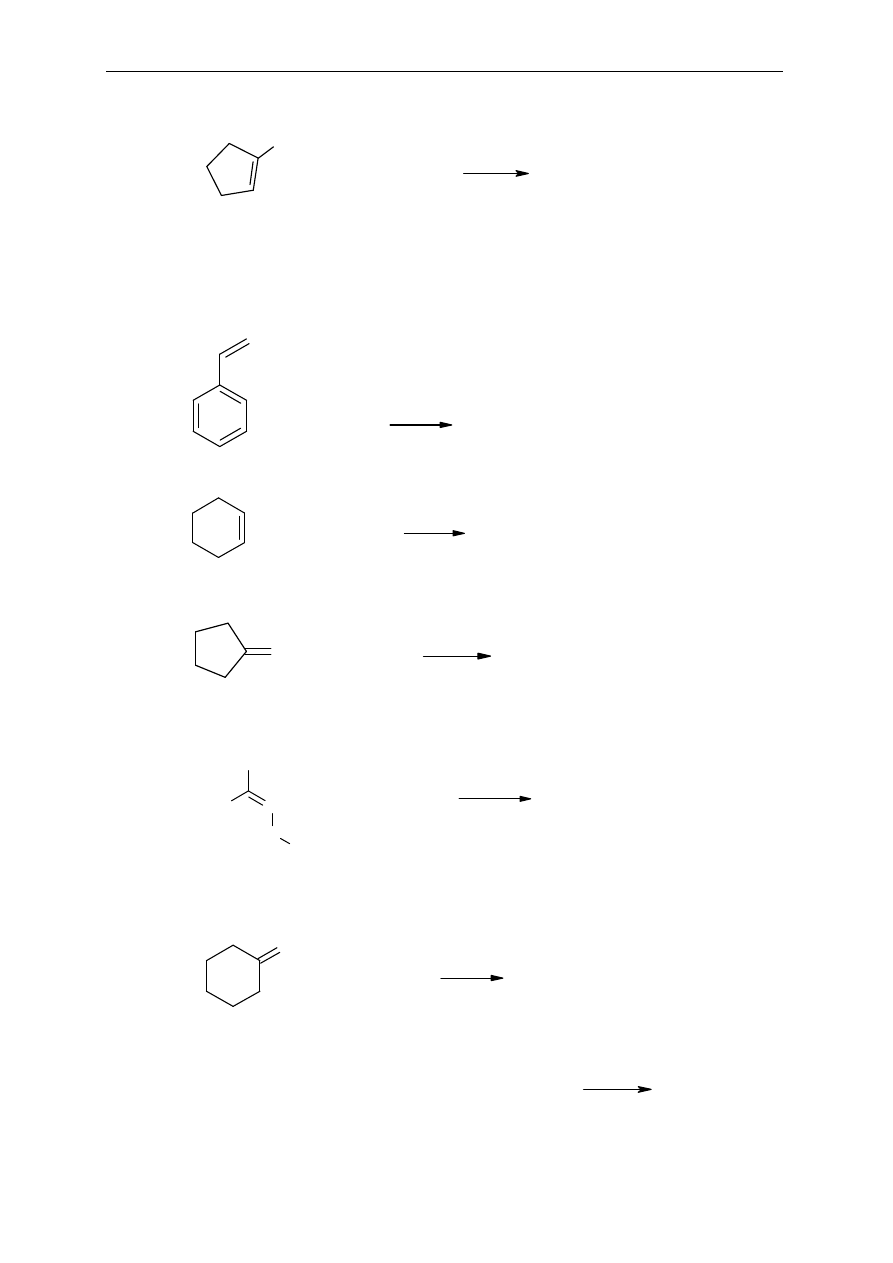
Seminarium, część II
42
d)
9.
Jakie s
ą spodziewane produkty następujących reakcji:
a)
b)
c)
d)
e)
f)
CH
2
CH
3
+
HBr
Br
2
+
Cl
H
+
CH
2
Cl
2
+
C
H
3
CH
CH
3
C
H
2
CH
3
Br
H
+
CH
2
Br
H
+
CH
2
=CHCH
2
CH
2
CH
2
CH=CH
2
+
2HCl

Seminarium, część II
43
g)
W przypadkach: d), e), g) podaj mechanizm reakcji.
10.
Z jakich alkenów w reakcji addycji mo
żna otrzymać następujące halogenki alkilowe?
a) bromocyklopentan
b) 3-bromoheksan
c) 1-chloro-1-etylo-cykloheksan
d)
11.
Addycja HCl do poni
ższych alkenów prowadzi do utworzenia mieszaniny produktów.
Podaj jakie to produkty i wyja
śnij ich powstawanie rozpisując szczegółowo mechanizm
obu reakcji.
12.
Podaj produkty nast
ępujących reakcji zachodzących w środowisku nadtlenków:
CH
3
CCH=CH
2
CH
3
CH
3
CH
3
CH
2
CHCH=CH
2
CH
3
a)
b)
CH
3
CH
2
CH=CH
2
+ HBr
ROOR
a)
CH
3
CH
2
C=CHC(CH
3
)
3
CH
3
+
HBr
ROOR
b)
CH
3
CH=CHCHCH
3
CH
3
+
HBr
Cl

Seminarium, część II
44
Dla wybranych przykładów podaj mechanizm reakcji.
4. Dieny sprzężone
13.
Które z podanych cz
ąsteczek są dienami sprzężonymi:
14.
Podaj wzory oraz nazwy głównych produktów reakcji:
a) 1,3-butadienu (1mol) z Br
2
(1 mol)
b) 1,3-butadienu (1 mol) z HBr (1 mol)
c) 2,4-heksadienu (1 mol) z HCl (1 mol)
d) 2-metylo-1,3-butadienu (1 mol) z Br
2
(1 mol)
e) 2-metylo-1,3-butadienu (1 mol) z HCl (1 mol)
CH
3
-CH=CH-CH
2
-CH=CH-CH
2
-CH
3
CH
3
CH
3
C=CH-CH
2
-CH=CH-CH
3
CH
3
CH
3
-C=CH-CH=CH-CH
3
CH
3
CH
3
-CH=C=CH-CH
3
CH
3
-CH=CH-CH=CH-CH
3
CH
3
-C=CH-C=CH-CH
3
CH
3
a)
b)
c)
d)
e)
f)
CH
3
C=CHCH
2
CH
3
CH
3
+
ROOR
HBr
c)
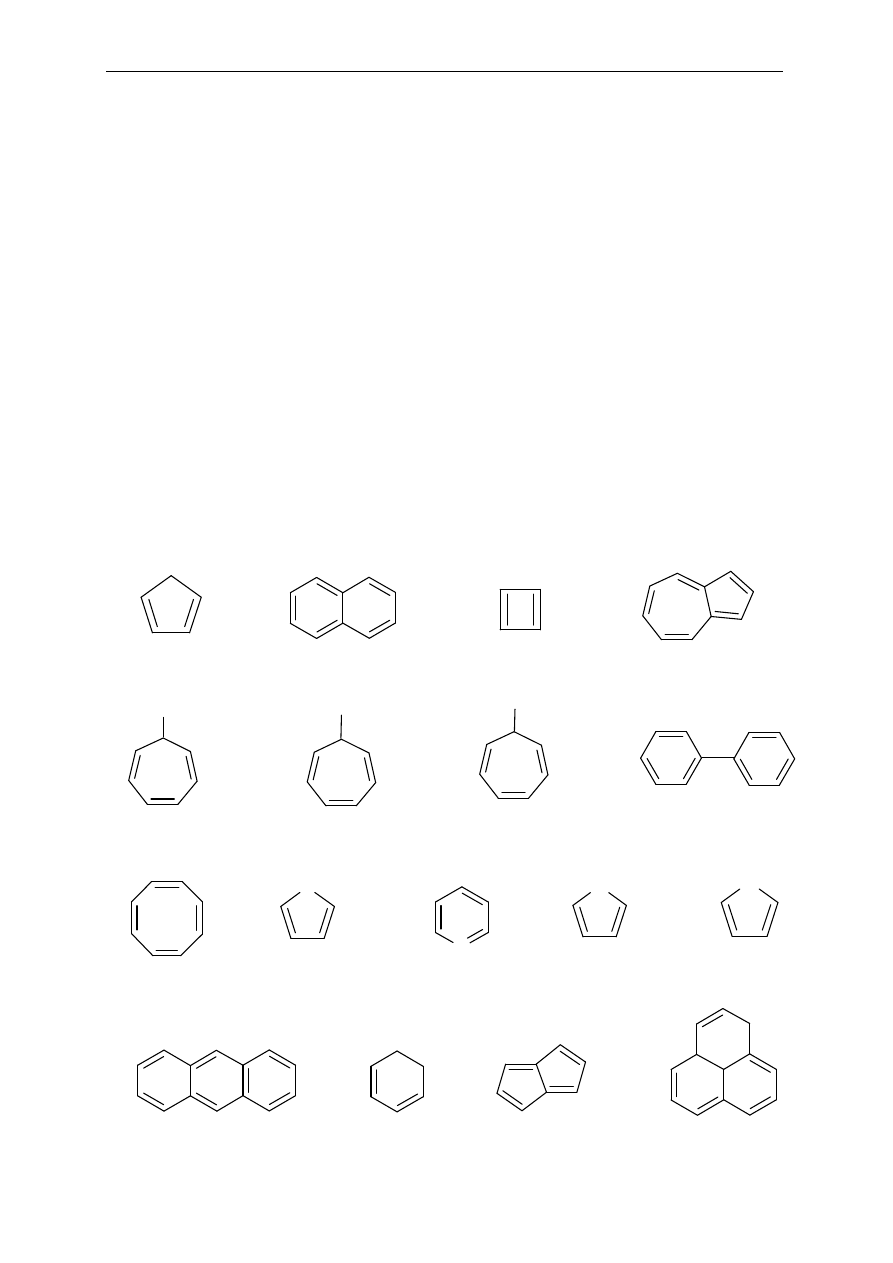
Seminarium, część II
45
5. Reakcje alkinów
15.
Podaj wzory produktów reakcji:
a) but-1-ynu z HBr (1 mol); but-1-ynu z HBr (2 mol)
b) but-2-ynu z HBr (1 mol); but-2-ynu z HBr (2 mol)
c) but-2-ynu z Br
2
(1 mol); but-2-ynu z Br
2
(2 mol)
d)
pent-2-ynu z HBr (1 mol); pent-2-ynu z HBr (2 mol)
6. Aromatyczność
16.
Który z poni
ższych związków ma charakter aromatyczny. Wyjaśnij dlaczego.
H
H
H
O
S
N
C
+
..
.
_
..
_
a)
b)
c)
e)
d)
h)
g)
f)
i)
k)
l)
m)
j)
n)
o)
p)
q)
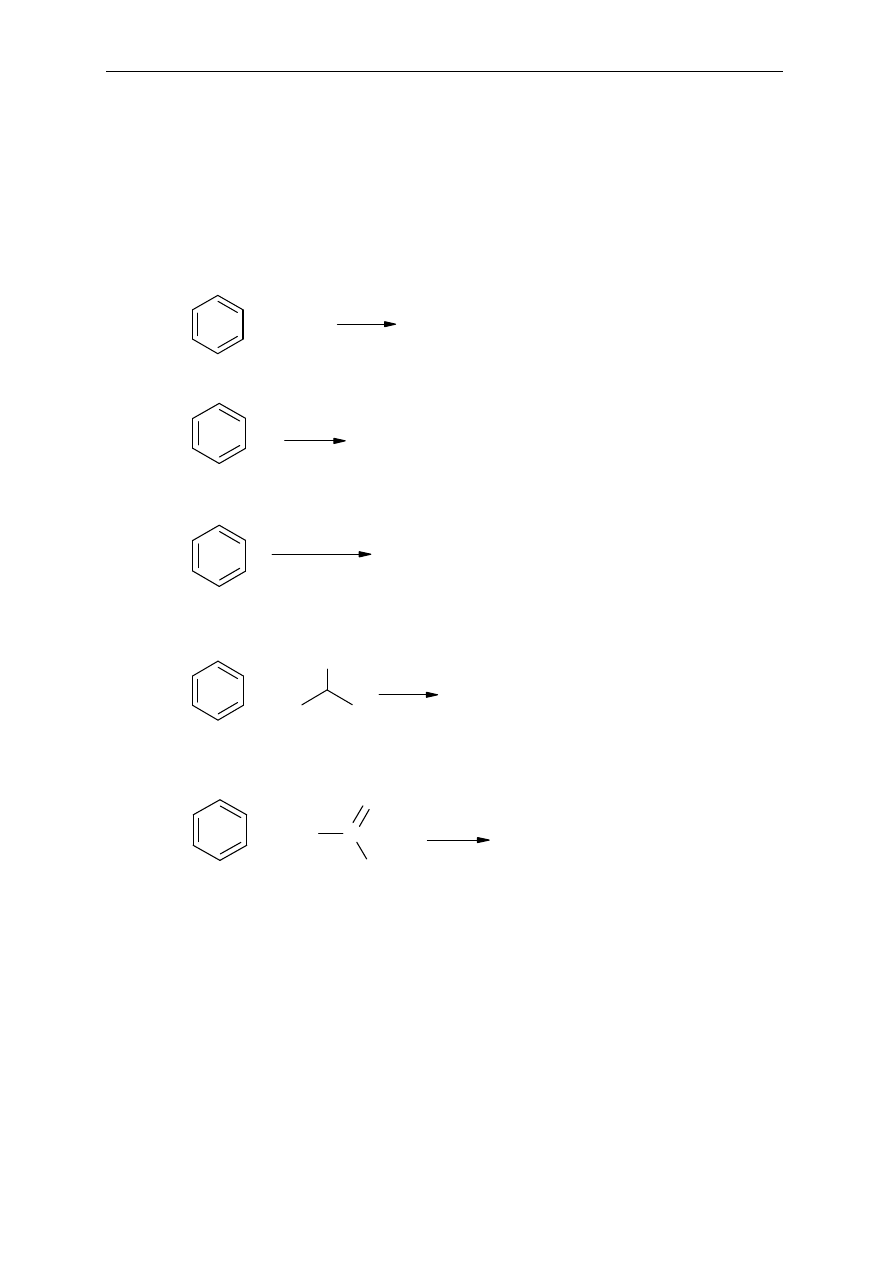
Seminarium, część II
46
7.
Reakcje
związków
aromatycznych.
Efekty
indukcyjne
i rezonansowe
17.
Narysuj wszystkie struktury rezonansowe produktów po
średnich poniższych reakcji.
Podaj produkty ko
ńcowe i nazwij je.
a)
b)
c)
d)
e)
18.
Wska
ż związki, w których grupy przyłączone do pierścienia aromatycznego:
- s
ą grupami indukcyjnie wyciągającymi elektrony (wskaż kierunek polaryzacji wiązań)
- s
ą grupami indukcyjnie dostarczającymi elektronów
- dostarczaj
ą elektronów do pierścienia aromatycznego w wyniku rezonansu
- wyci
ągają elektrony z pierścienia aromatycznego na skutek rezonansu
Cl
2
FeCl
3
+
HNO
3
/H
2
SO
4
H
2
SO
4
/SO
3
Cl
AlCl
3
+
C
H
3
C
Cl
O
AlCl
3
+
Seminarium, część II
47
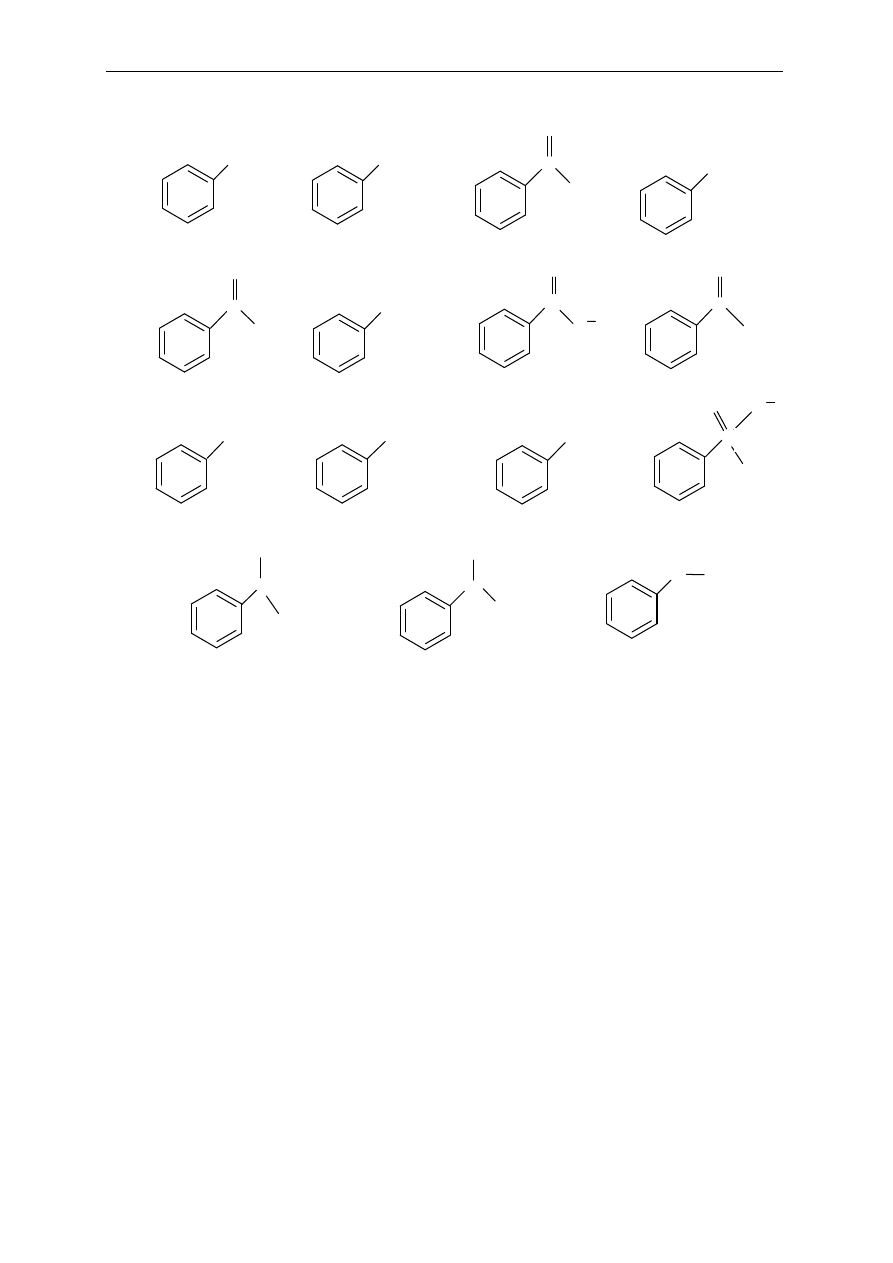
19.
Przedstaw struktury rezonansowe aniliny ukazuj
ące efekt rezonansowy grupy aminowej,
powoduj
ący dostarczanie elektronów do pierścienia aromatycznego.
20.
Przedstaw struktury rezonansowe nitrobenzenu ukazuj
ące efekt rezonansowy grupy
nitrowej, powoduj
ący wyciąganie elektronów z pierścienia aromatycznego.
21.
Ni
żej wymienione podstawniki podziel na:
a) aktywuj
ące i dezaktywujące pierścień aromatyczny w reakcjach substytucji
elektrofilowej
b) kieruj
ące w pozycje orto/para i kierujące w meta
-NO
2
, -CH
3
, -CHO, -COOH, -OCH
3
, -COOCH
3
, -OCOCH
3
, -Cl, -CCl
3
, -OH,
-NHCOCH
3
, -Br, -C
≡
N, -SO
3
H, -F, -N(CH
3
)
3
+
, -NH
2
, -CH
2
CH
3
, COCH
3
, -N(CH
3
)
2
.
OH
CH
2
CH
3
NH
2
CH
3
N
S
C
O
CH
3
C
O
OH
C
O
H
Cl
CH
CH
3
CH
3
I
Br
O
CH
3
N
H
CH
3
O
O
O
OH
O
+
+
a)
b)
c)
d)
e)
f)
g)
h)
i)
j)
k)
l)
m)
n)
o)
Seminarium, część II
48
22.
Zaproponuj produkty mononitrowania zwi
ązków otrzymanych w zad. 17 oraz podaj ich
nazwy.
23.
Zaproponuj główne produkty monoalkilowania ni
żej podanych związków w reakcji
z chlorometanem w obeno
ści AlCl
3
:
a) bromobenzen
b) 2,4-dichlorofenol (1-hydroksy-2,4-dichlorobenzen)
c) m-bromofenol (1-bromo-3-hydroksybenzen)
d) 2,5-dibromotoluen
24.
Nazwij oraz narysuj wzory głównych produktów reakcji:
- elektrofilowego chlorowania: a) m-nitrofenolu, b) kwasu p-nitrobenzoesowego
- sulfonowania: a) m-bromofenolu, b) 2,4-dibromofenolu
25.
Zaznacz najbardziej prawdopodobn
ą pozycję w pierścieniu aromatycznym, którą zajmie
nast
ępny podstawnik, jeśli poniższe związki poddamy substytucji elektrofilowej:
a)
b)
c)
d)
e)
f)
g)
h)
COOH
COOH
Br
NO
2
NH
2
Br
COCH
3
CH
3
OCH
3
OCH
3
O
NO
2
CH
3
CH
3
CH
3
CF
3
COOH

Seminarium, część II
49
26.
Uporz
ądkuj związki w każdej z grup w szeregu ich reaktywności w reakcji substytucji
elektrofilowej. Uzasadnij tak
ą kolejność.
a) benzen, nitrobenzen, fenol
b) anilina, chlorobenzen, kwas benzoesowy
c) benzaldehyd, benzen, bromobenzen
d) toluen, p-ksylen, benzen
27.
Który z trzech izomerycznych trimetylobenzenów powinien najłatwiej ulega
ć reakcji
substytucji
elektrofilowej?
Uzasadnij
odpowied
ź. Podaj produkt (produkty)
mononitrowania tego trimetylobenzenu.
28.
Zaproponuj schematy syntez poni
ższych związków z benzenu i odpowiednich reagentów
organicznych lub nieorganicznych:
a) p-bromonitrobenzenu
b) m-bromonitrobenzenu
c) p-etyloacetofenonu
d) kwasu m-chlorobenzenosulfonowego
8. Izomeria optyczna i reakcje substytucji nukleofilowej
29.
We wzorach poni
ższych związków oznacz gwiazdką * centra chiralności (asymetryczne
atomy w
ęgla):
a) CH
3
CH(NH
2
)CH
2
CH
3
b) (CH
3
)
2
CHCH(OH)CH(CH
3
)
2
c) CH
3
CH(OH)CH
2
COOH
e) HO
2
CCH(OH)CH
2
COOH
f) CH
3
CH
2
CH(OCH
3
)OH
g) ClCH
2
CH
2
OH
h) CH
3
CH(Cl)CH
2
Cl
i) CH
3
CH
2
CH(OH)CH
2
CH
3

Seminarium, część II
50
30.
Które z alkoholi C
4
H
9
OH i C
5
H
11
OH wykazuj
ą izomerię optyczną? Narysuj wzory
przestrzenne enancjomerów.
31.
Na przykładzie reakcji 1-chloro-3-metylobutanu z wodorosiarczkiem sodowym (NaSH)
wyja
śnij na czym polega mechanizm reakcji S
N
2. Czy chloropochodna (substrat) i tiol
(produkt) s
ą związkami optycznie czynnymi?
32.
Co to jest reakcja S
N
1? Wyja
śnij mechanizm reakcji. Dlaczego produkt reakcji
chlorowcopochodnej czynnej optycznie jest optycznie nieczynny?
33.
Jaki wpływ na szybko
ść przebiegającej reakcji S
N
2 pomi
ędzy 1-jodo-2-metylobutanem
a anionem cyjankowym CN
−
miałoby zmniejszenie o połow
ę stężenia anionów
cyjankowych i dwukrotne zwi
ększenie stężenia 1-jodo-2-metylobutanu? Jak wpłynęłoby
natomiast trzykrotne zwi
ększenie stężenia obu reagentów?
34.
Jaki wpływ na szybko
ść przebiegającej reakcji chemicznej pomiędzy etanolem a 2-jodo-2-
metylobutanem b
ędzie miało trzykrotne zwiększenie stężenia halogenku?
35.
W reakcji 1-chlorobutanu z rozcie
ńczonym roztworem NaOH otrzymano butan-1-ol.
Z bada
ń kinetycznych reakcji wynika, że dodatek zasady powoduje przyspieszenie reakcji
podstawiania. Jaki jest mechanizm tej reakcji?
36.
W ka
żdej z podanych par wskaż związek, który szybciej ulega reakcji z NaI w acetonie
(reakcja S
N
2):
a) 1-chloro-2-metylopropan czy 1-chloro-2,2-dimetylopropan
b) 1-chloro-3-metylobutan czy 1-chloropropan
c) 1-bromopentan czy 3-bromopentan
d) 2-bromo-3-metyloheksan czy 2-bromo-5-metyloheksan
e) 1-jodopropan czy jodek metylu
f) 1-bromopropan czy 1-bromo-2-metylopropan
37.
Jakiego produktu (produktów) mo
żna oczekiwać w reakcji 3-chloro-3-metylooktanu
z kwasem octowym? Przedstaw mechanizm reakcji oraz stereochemi
ę zarówno substratu
jak i produktu.
38.
W reakcji optycznie czynnego 3-bromo-3-metyloheksanu z amoniakiem otrzymano
odpowiedni
ą aminę. Otrzymany produkt był optycznie nieczynny. Uzasadnij dlaczego.
Seminarium, część II
51
39.
Przedstaw mechanizm reakcji substytucji nukleofilowej:
a) 1-chloropropanu z wodorotlenkiem sodowym,
b) 1-bromobutanu z wodorotlenkiem sodowym
c) 2-bromo-2-metylopropanu z wodorosiarczkiem sodowym (NaSH)
d) 2-bromobutanu z wodorotlenkiem sodowym
e) 1-chloro-3-fenylobutanu z wodorotlenkiem sodowym
f) 2-chloro-2-fenylobutanu z wod
ą
W przypadku chiralnych substratów podaj budow
ę steryczną produktów reakcji.
40.
W ka
żdej z poniższych par wskaż związek, który łatwiej ulega reakcji z HCl i uzasadnij
wybór. Narysuj i nazwij produkt(y) tej reakcji dla wszystkich podanych alkoholi.
41.
Na przykładzie metanolu, który poddano działaniu HBr przedstaw mechanizm reakcji
S
N
2. Podaj równanie kinetyczne tej reakcji oraz okre
śl jaki wpływ na szybkość
przebiegaj
ącej reakcji miałoby dwukrotne zwiększenie lub dwukrotne zmniejszenie
st
ężenia anionów bromkowych?
42.
Zaproponuj mechanizm reakcji 2-metylobutan-2-olu z HCl. Rozpisz poszczególne etapy
tej reakcji i wska
ż etap najwolniejszy. Czy substrat i produkt główny są optycznie
czynne?
CH
3
-C-CH
3
OH
CH
3
CH
3
OH
OH
CH
3
-CH-CH
2
-CH
3
OH
CH
3
CH
3
-CH
2
-CH-CH
2
-C-CH
3
OH
CH
3
CH
3
CH
3
-CH
2
-CH-CH
2
-CH
2
OH
czy
czy
czy
a)
b)
c)
Seminarium, część II
52
43.
Działaj
ąc chlorowodorem na 3-metylobutan-2-ol otrzymano mieszaninę produktów: 2-
chloro-3-metylobutan i 2-chloro-2-metylobutan. Przedstaw mechanizm reakcji oraz
wytłumacz powstawanie mieszaniny produktów wskazuj
ąc produkt główny.
9. Reakcje eliminacji
44.
Jakich produktów mo
żna oczekiwać po reakcjach eliminacji następujących halogenków
alkilowych? Jakie produkty b
ędą produktami głównymi?
a)
b)
c)
d)
e)
CH
3
CH
2
CCH
3
Br
CH
3
r.eliminacji
CH
3
CH
2
CHCHCH
3
Br CH
3
r.eliminacji
CH
3
CHCH
2
CHCH
3
CH
3
CH
3
CH
3
Cl
C
r.eliminacji
CH
3
Cl
r.eliminacji
CHCH
3
Br
r.eliminacji
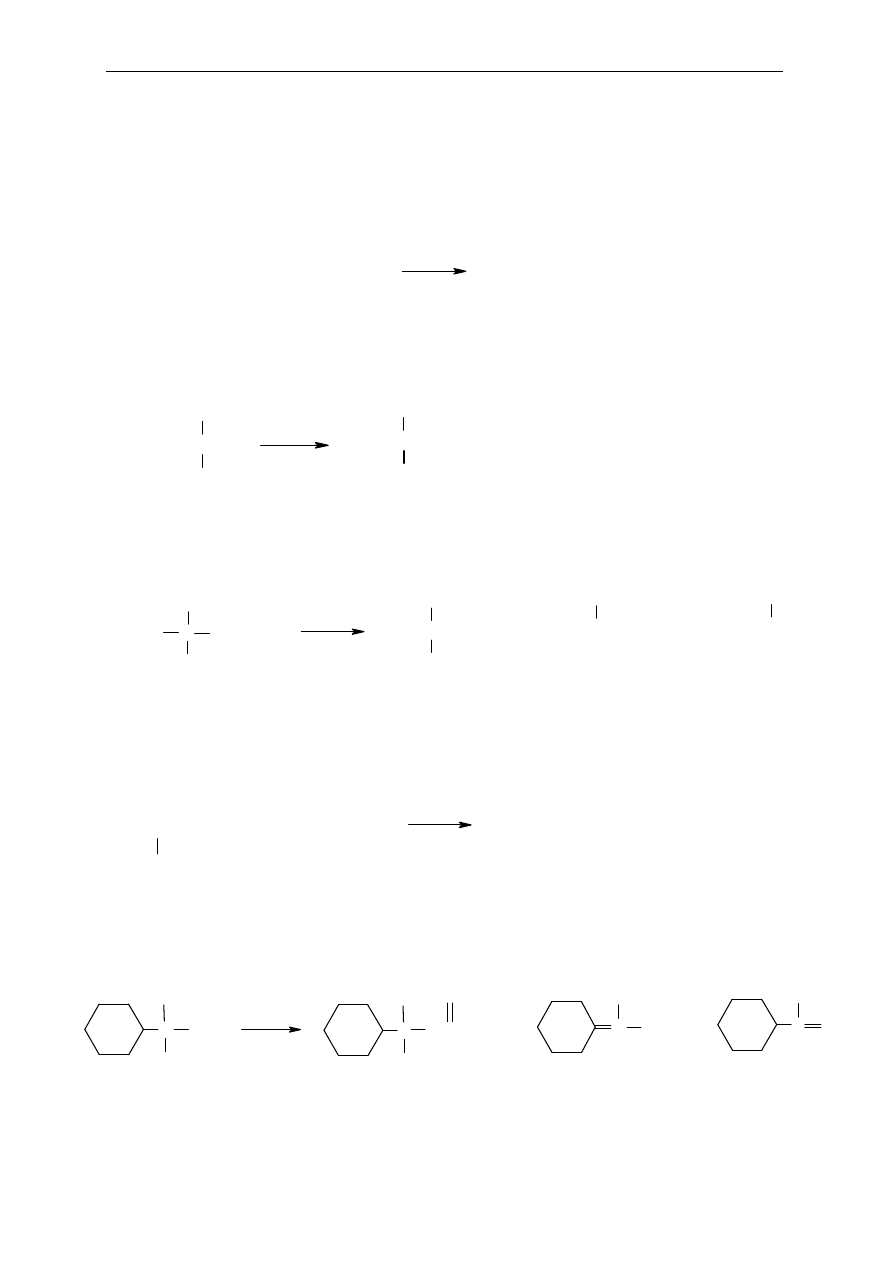
Seminarium, część II
53
45.
W poni
ższych schematach reakcji wskaż produkty eliminacji oraz określ mechanizm
reakcji (E1 lub E2) prowadz
ący do utworzenia tych związków.
a)
b)
c)
d)
e)
C
Br
CH
3
CH
3
CH
3
CO
2
H
C
CH
3
CH
3
C
CH
3
CH
3
C
CH
3
CH
2
+
+
OCCH
3
O
CH
3
CHCH
2
CH
2
CH
3
Cl
C
2
H
5
ONa
+
C
2
H
5
OH
CH
3
CH=CHCH
2
CH
3
+ CH
2
=CHCH
2
CH
2
CH
3
CH
3
CH
2
CH
3
CH
3
Br
C
H O
CH
3
CCH
2
CH
3
CH
3
OH
+
CH
3
CH
3
C=CHCH
3
+
CH
3
CH
2
=CCH
2
CH
3
2
CH
3
CBr
CH
3
CH
3
CH
3
OH
CH
3
COC
2
H
5
CH
3
CH
3
+
(CH
3
)
2
C=CH
2
CH
3
CH
2
CH
2
CH
2
Cl
C
2
H
5
ONa
+
C
2
H
5
OH
CH
3
CH
2
CH
2
CH
2
OC
2
H
5
+ CH
3
CH
2
CH=CH
2

Seminarium, część II
54
46.
Podaj główne produkty eliminacji oraz okre
śl mechanizm reakcji (E1 lub E2).
a)
b)
c)
d)
e)
47.
Na przykładzie 2-bromobutanu, który poddano działaniu silnej zasady (OH
−
) przedstaw
mechanizm reakcji eliminacji E2. Podaj wzór i nazw
ę produktu głównego.
H
3
C
OH
ogrzew.
H
2
SO
4
THF
,
CH
3
CBr + CH
3
ONa
CH
3
CH
3
CH
3
OH
CH
3
CH
2
CH
3
CH
3
OH
C
ogrzew.
H
2
SO
4
THF
,
CH
3
CHBr + C
2
H
5
ONa
CH
3
C
2
H
5
OH
CH
3
CH
2
CH
2
Br + (CH
3
)
3
COK
(CH
3
)
3
COH
Seminarium, część II
55
10. Efekty indukcyjne i rezonansowe a kwasowość i zasadowość
związków organicznych
48.
Który ze zwi
ązków w poszczególnych parach jest mocniejszym kwasem i dlaczego?
a) CF
3
CH
2
OH, CH
3
CH
2
OH
b) FCH
2
CH
2
OH, F
2
CHCH
2
OH
c) CF
3
CH
2
CH
2
CH
2
OH, CF
3
CH
2
OH
d) CCl
3
COOH, ClCH
2
COOH
e) ClCH
2
COOH, CH
3
COOH
f) CH
3
COOH, CH
3
CH
2
OH
g) CH
3
COOH,
h) CH
3
CH
2
OH,
49.
W poni
ższych parach wskaż mocniejszą zasadę. Uzasadnij wybór.
a) Cl
3
CCOO
-
, ClCH
2
COO
-
b) Cl
3
CCOO
-
, CH
3
COO
-
c) ClCH
2
COO
-
, CH
3
COO
-
d) CH
3
NH
2
, CH
3
CH
2
CH
2
NH
2
e)
f)
OH
OH
O
C
O
H
3
C
O
CH
2
H
3
C
NH
2
N
H
H
3
C
H
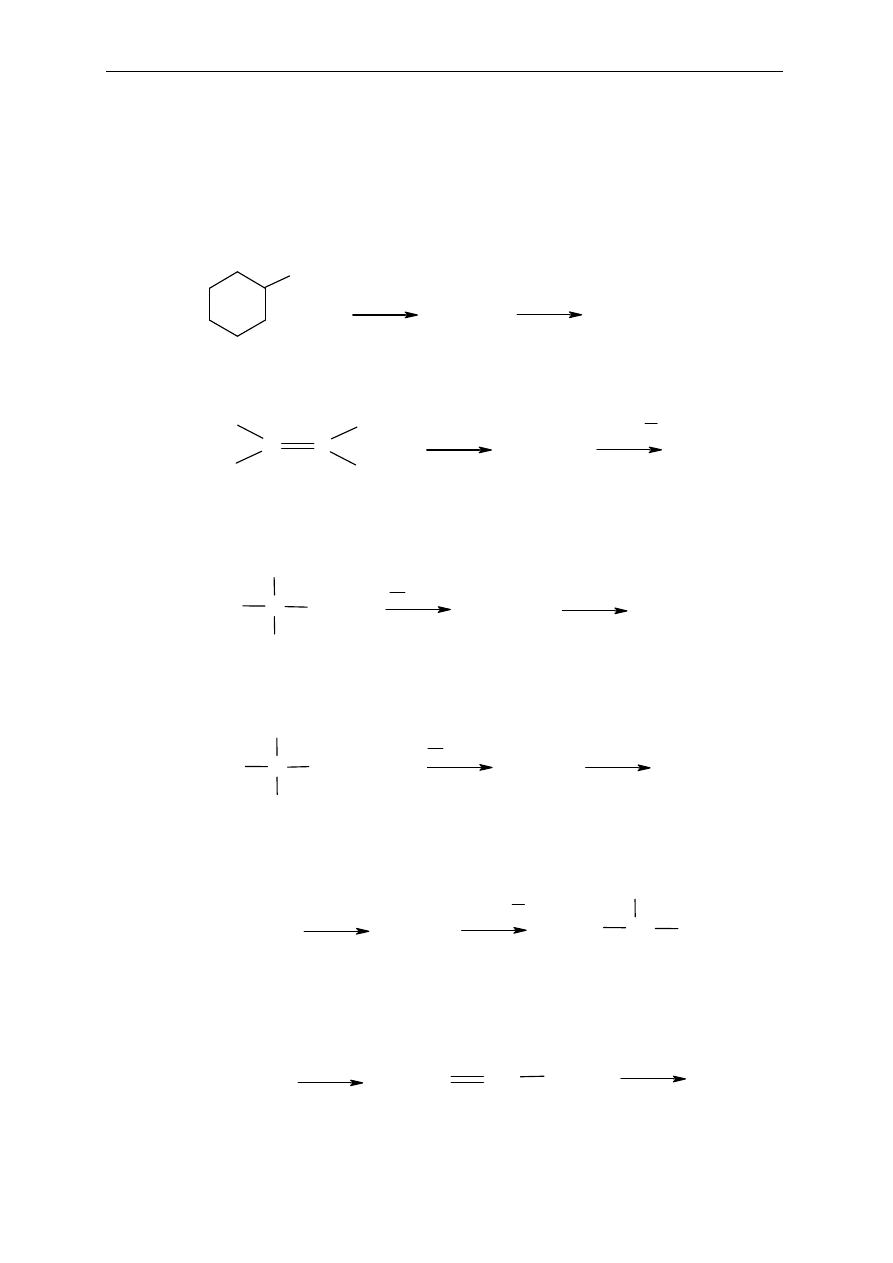
Seminarium, część II
56
11. Podsumowanie
50.
Podaj wzory zwi
ązków od A do F na podstawie następujących schematów:
OH
H
3
PO
4
H
Cl
C
C
H
3
C
H
3
C
H
3
C
CH
3
CH
3
CH
3
H
H
I
OH
C
Cl
H
Cl
H
Br
H
3
C
CH
2
CH
3
CH
3
C
OH
H
O
H
Br
Cl
2
OH
H
3
C
CH
2
CH
3
CH
OH
CBr
CH
2
H
Br
CH
3
H
Br
A
B
a)
A
B
b)
A
B
światło
c)
A
d)
2
B
A
B
światło
e)
A
B
f)
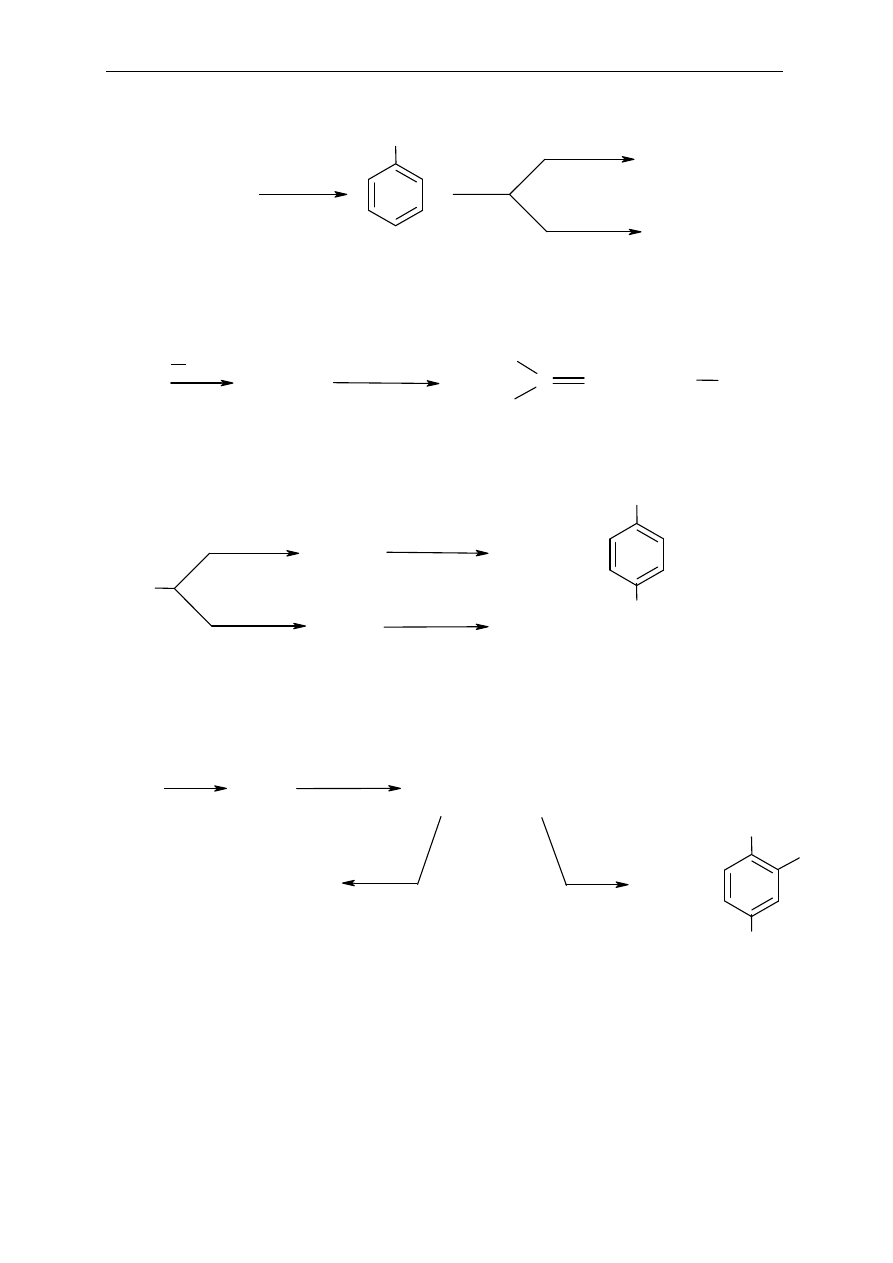
Seminarium, część II
57
CH
3
Cl
2
,
światło
Cl
2
, Fe
C
D
alkilowanie
A
B
+
g)
C
CH
3
Cl
H
3
C
CHO
H
O
O
3
Zn, H
3
O+
O
H
3
C
CH
3
chlorowanie
sulfonowanie
sulfonowanie
chlorowanie
Cl
SO
3
H
CH
3
CH
3
AlCl
3
HNO
3
H
2
SO
4
CH
3
Cl
AlCl
3
CH
3
Cl
AlCl
3
NO
2
E
F
C
A
h)
2
B
1.
2.
+
A
i)
B
+
D
E
A
j)
B
C
D
+
+
Wyszukiwarka
Podobne podstrony:
Materialy do seminarium inz mat 09 10 czesc III
4 konta ksiegowe cwiczenia, Semestr V, Finanse i Rachunkowosc, Wyklady i materialy do seminarium
materialy do zajec Karta pracy GLONY I SINICE id 768215
Cwiczenia nr 13 (z 14) id 98681 Nieznany
cwiczenie9b am 13 14 id 125935 Nieznany
Materialy do Wykladu 22 11 13 i Nieznany
Materialy do seminarium inz mat Nieznany
cwiczenie10a am 13 14 id 125803 Nieznany
cwiczenie8a am 13 14 id 125925 Nieznany
Ćwiczenia utrwalające w stosowaniu funkcji, do uczenia, materialy do nauczania, rok2009 2010, semII,
cwiczenie2c am 13 14 id 125856 Nieznany
serer aplkcji, do uczenia, materialy do nauczania, rok2009 2010, semII, 14.02.2010, II lp sem gromad
cwiczenie10b am 13 14 id 125804 Nieznany
Materialy do seminarium IM 2009 10 czesc I
cwiczenie7a am 13 14 id 125918 Nieznany
Sprawdzian Tech 3 2 sem 1 13 14 pytania
Sprawdzian Tech 1 2 sem 1 13 14 pytania
więcej podobnych podstron