
GRAS – Generally Recognized As Safe, szczep uznany za niepatogenny, bezpieczny dodatek do żywności
Farmakopea – kodeks apteczny, zbiór podstawowych wymagań dot. składu i jakości środków farmaceutycznych oraz metod
badania surowców farmaceutycznych i leków
1.
Wymień grupy bakterii poznane w trakcie ćwiczeń.
o Firmicutes G+: bakterie kwasu mlekowego LAB (Lactobacillus, Lactococcus, Pediococcus), bakterie
przetrwalnikujące: Bacillaceae (Bacillus) i klostridia (Clostridium)
o Actinobacteria G+: tworzą pseudogrzybnię dwóch typów: 1) grzybnia substratowa – wrastająca w podłoże,
2) grzybnia powietrzna – nad ziemią, tworzą się konidiofory
* Bifidobacterium (wyjątkowa bakteria mlekowa),
* Streptomyces,
* Corynebacterium glutamicum
* Amycolatopsis rifamycinica (biosynteza ryfamycyn)
o Proteobacteria G-: Escherichia coli (Gammapr.), bakterie octowe (Acetobacter)
2.
Opisać gatunki mikroorganizmów stosowane na ćwiczeniach i krótko scharakteryzować, w jakich procesach
biotechnologicznych uczestniczą.
Bacillus pumilus
szczep wskaźnikowy, badanie wytwarzania antybiotyków
Lactobacillus delbrueckii
bakteria kwasu mlekowego, homofermentacja: produkcja kwasu mlekowego,
składnik szczepionek do jogurtów (subsp. bulgaricus)
Aspergillus niger
produkcja kwasu cytrynowego
Saccharomyces cerevisiae
fermentacja alkoholowa, piwowarstwo
Streptomyces
produkcja antybiotyków
Saccharopolyspora erythrea
erytromycyna
Amycolatopsis rifamycinica
biosynteza ryfamycyn
3.
Wymień etapy opracowania procesu biotechnologicznego.
1. Screening – selekcja szczepów ze środowiska, które mogą być potencjalnie użyteczne, tzn. wysiewamy szczepy,
porównujemy ich wzrost i wydajność
2. Wstępne ustalenie warunków ich hodowli – jak najlepszy wzrost na jak najtańszym podłożu
3. Doskonalenie cech produkcyjnych – ukierunkowana mutagenizacja lub fuzja protoplastów:
* zmiany wymagań pokarmowych -> pożądane prototrofy
* ograniczenie wytwarzania produktów ubocznych -> ograniczenie strat energii
* zwiększenie oporności na substancje toksyczne (np. produkt w wysokim stężeniu może być dla producenta
toksyczny)
* zwiększenie oporności na bakteriofagi
4. Optymalizacja warunków bioprocesu – ustalenie najlepszych parametrów:
* skład pożywki
* natlenienie -> napowietrzanie, mieszanie
* uwodnienie, ciśnienie osmotyczne
* temperatura, pH, potencjał redox
5. Powiększenie skali – przejście ze skali laboratoryjnej do przemysłowej
6. Uruchomienie produkcji
4.
Schemat procesu biotechnologicznego
1) etap przygotowawczy (sterylizacja aparatury)
2) namnożenie materiału posiewowego:

3) prowadzenie procesu biosyntezy (np. erytromycyna 200h w 34 stopniach)
4) wydzielenie i oczyszczenie produktu: oddzielenie biomasy, izolacja produktu (filtracja, ekstrakcja, zatężanie,
krystalizacja…), zagospodarowanie odpadów
5) otrzymanie formy handlowej produktu
5.
Różnica pomiędzy rolą laboratoryjną a przemysłową procesów biosyntezy.
Szczepiąc podłoże w małej objętości upewniamy się, czy nasz szczep jest nadal aktywny lub czy jest to szczep
rzeczywiście zamówiony przez nas z kolekcji, w skali laboratoryjnej doskonalimy również szczepy i dobieramy
dobre warunki hodowli. W skali przemysłowej (tanki fermentacyjne) następuje uruchomienie produkcji.
6.
4 metody immobilizacji enzymów. Którą z nich wykorzystywaliśmy na ćwiczeniach?
1. Absorpcja na powierzchni nośnika - adhezja do nośnika lub wiązanie kowalencyjne
2. Pułapkowanie w matrycy – immobilizacja enzymu wewnątrz alginianowych kuleczek
3. Zamykanie wewnątrz membran półprzepuszczalnych
4. Kopolimeryzacja – sieciowanie przestrzenne
7.
Metoda immobilizacji komórek superszczepów - zalety, przykład.
Np. zamknięcie komórek w żelowych kuleczkach. W kuleczce tworzą się strefy, np. przy produkcji EtOH – w środku
kuleczki wyższe nagromadzenie EtOH, komórek nie obserwuje się, gromadzą się one przy powierzchni kuleczki,
gdzie dyfuzja jest najwydajniejsza.
8.
Metody przechowywania szczepu produkcyjnego.
o przechowywanie na skosach
o liofilizacja (wysuszenie w niskiej temperaturze pod obniżonym ciśnieniem)
o zamrożenie w ciekłym azocie (temp. -80 stopni)
9.
Jak wyizolować promieniowce z gleby.
Pobrać glebę pozakorzeniową, oczyścić z zanieczyszczeń i ściółki; 1g wytrząsać w 9ml RF przez 10 minut –
otrzymujemy rozcieńczenie 10^-1; rozcieńczenia 10^-2 i 10^-3 wysiewamy (0,1ml) na podłoże stałe z wyciągu
glebowego (1 kg gleby zawiesić w wodzie, zwirować, przesączyć, wysterylizować, dodać agaru i antybiotyków
przeciwgrzybicznych, pH obojętne), inkubacja przez 10 dni w 26-30 stopniach.
10.
Przystosowanie szczepu do wykorzystania w hodowli na skale przemysłową.
o Metody: modyfikacja genotypu: mutageneza indukowana in vivo, fuzja protoplastów komórek szczepów
(także pomiędzy gatunkami albo nawet rodzajami).
o zmiana wymagań pokarmowych -> pożądane są prototrofy zdolne do wzrostu na tanich, łatwo dostępnych
podłożach,
o nadprodukcja pożądanego związku -> zmiany w systemach regulacyjnych biosyntezy
o szybki wzrost, duża wydajność biosyntezy przy ograniczonym wzroście biomasy
o stabilność genetyczna
o szczep o dużych komórkach -> łatwe rozdzielenie biomasy i pożywki pohodowlanej
11.
Problemy, z jakimi stykają się hodowle biotechnologiczne prowadzone na skale przemysłową.
o uniknięcie zakażenia bakteriofagami – zachowanie aseptyczności hodowli
o efektywne napowietrzanie i mieszanie
wysianie liofilizatu
na skos, zebranie
zarodników po 7
dniach inkubacji
zaszczepienie
hodowli
płynnej,
inkubacja 24h
mały fermentor
PETKA
inkubacja 48 h
duży fermentor
MATKA
inkubacja 24 h
przeniesienie do
TANKU FERMEN-
TACYJNEGO
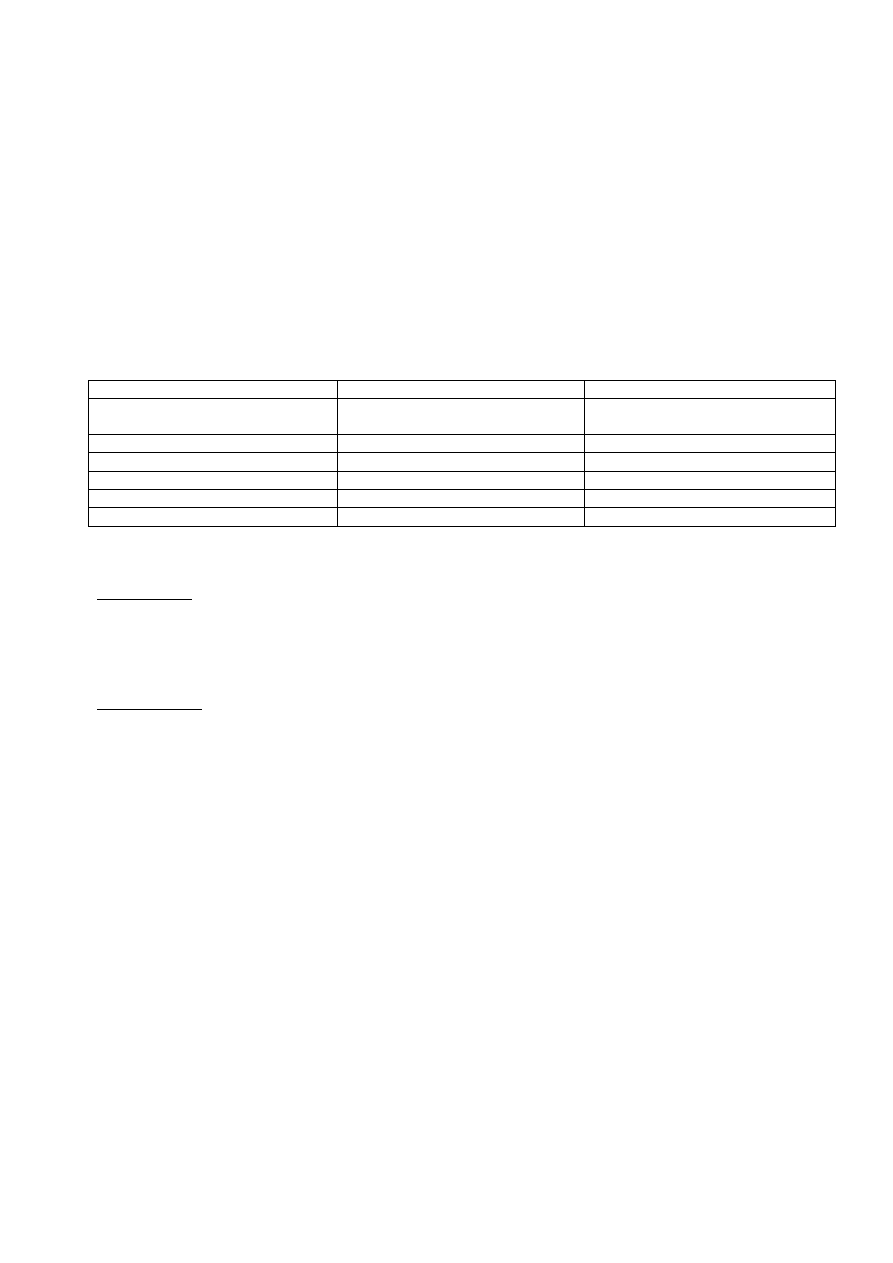
o powstawanie piany -> koniecznie stosowanie środków przeciwpiennych (oleje i tłuszczem wyższe
alkohole, środki silikonowe), które hamują powstawanie piany z mąk zbóż i soi oraz hydrolizatów i
ekstraktów
12.
Narysuj wykres biosyntezy kwasu octowego, etanolu, kwasu mlekowego i ryfampicyny, uwzględniając
stężenia źródła węgla i azotu (zużycie) oraz liczebność (wzrost) biomasy.
metabolity pierwotne: Etanol, kwas mlekowy, kwas cytrynowy;
produkcja wraz ze wzrostem hodowli, równolegle – TROFOFAZA
metabolity wtórne: antybiotyki, np. Ryfampicyna;
produkcja pod koniec fazy wzrostu, metabolit nie jest konieczny do wzrostu – IDIOFAZA
13.
Jakie są prekursory/induktory dla: erytromycyny, ryfamycyny, acylazy penicylinowej?
Prekursor/induktor
Produkt
Drobnoustrój
propanol, propionian
erytromycyna
Saccharopolyspora erythrea
(dawniej Streptomyces erythreus)
glicyna
L-seryna
Corynebacterium glicinophilum
jon fenylooctanowy
penicylina benzylowa
Penicillum chrysogenum
fenylooctan
acylaza penicyliny G (PGA)
fenoksyoctan
acylaza penicyliny V (PVA)
barbital
ryfamycyna B
Amycolatopsis rifamycinica
14.
Podaj po 3 zastosowania w różnych gałęziach przemysłu kwasów mlekowego i cytrynowe
kwas mlekowy
o przemysł spożywczy: produkcja napojów mlecznych, jogurtów, serów
o otrzymywanie dekstranu – tworzywo sztuczne
o otrzymywanie nizyny – bakeriocyna, antybiotyk na bakterie G+
kwas cytrynowy
o przemysł spożywczy: walory organoleptyczne, dobry smak i ładny zapach
o przemysł kosmetyczny i farmaceutyczny: składnik szamponów i kremów, dodatek do tabletek, preparat
zapobiegający krzepnięciu krwi w stacjach krwiodawstwa, stosowany przy zatruciach ołowiem
o przemysł chemiczny: produkcja detergentów pralniczych,
o przemysł tekstylny: wyrób tkanin
15.
Sole erytromycyny:
stearynian erytromycyny, etylobursztynian erytromycyny
sole nierozpuszczalne, podawane doustnie
laktobionian erytromycyny, glukoheptonian erytromycyny
sole rozpuszczalne, stosowane do iniekcji
16.
Estry erytromycyny – maskują gorzki smak, powstają w wyniku estryfikacji grup –OH erytromycyny:
Ermycin – laurylosiarczan propionianu erytromycyny
Davercin – cykliczny węglan erytromycyny o poszerzonym zakresie działania – stosowany przeciwko Helicobacter i
Campylobacter;
17.
Półsyntetyczne pochodne erytromycyny - wymienić, scharakteryzować, dlaczego są lepsze?
Roksytromycyna, Klarytromycyna, Dirytromycyna

o poszerzony zakres działania
o dłuższy czas półtrwania
o lepsze właściwości farmakokinetyczne
o pochodne stabilniejsze w żołądku niż erytromycyna, lepiej się wchłaniają, lepsza penetracja tkanek
o mniejsza toksyczność
o mniejsze dolegliwości ze strony przewodu pokarmowego (mdłości etc.)
18.
Wyjaśnij, na czym polega specyfika mutanta Corynebacterium glutamicum nadprodukującego lizynę.
Nie posiada dehydrogenazy homoserynowej, dzięki czemu nie wytwarza L-treoniny, która hamuje syntezę L-lizyny –
synteza L-lizyny może więc przebiegać bez ograniczeń.
19.
Wyjaśnij role enzymów hydrolizujących wiązania w antybiotykach beta-laktamowych w kontekście
fizjologii bakterii i przemysłu farmaceutycznego.
o Przemysł: acylaza penicylinowa jest stosowana do otrzymywania kwasu 6-AP (aminopenicylanowego),
który jest produktem wyjściowym do otrzymywania półsyntetycznych pochodnych penicyliny
o Fizjologia: acylaza może być zaangażowana w degradację związków fenylooctowych, beta-laktamaza
rozkłada antybiotyki beta-laktamowe
20.
Metody fizykochemiczne badania jakości piwa.
o Pomiar gęstości brzeczki aerometrem ze skalą Ballinga
o Pomiar potencjalnej zawartości alkoholu aerometrem ze skalą Ballinga
o Spektrofotometryczny pomiar zawartości żelaza w piwie
o Badanie stabilności piany – piana powinna utrzymywać się 220 sekund (piana powstaje z polipeptydów z
rozkładu białek jęczmienia, stabilność jest powiązana z liczbą Kolbacha)
21.
Ustalić warunki hodowli i skład podłoża dla acylazy produkowanej przez E. coli i kwasu cytrynowego
produkowanego przez A. niger w metodzie wgłębnej i powierzchniowej.
Dla acylazy:
E. coli produkuje acylazę benzylopenicylinową, czyli acylazę PGA.
pH 7,5 – 8,5
temp. 20-30
podłoże na bazie peptydów i peptonów, dodatek jonu fenylooctanowego
Produkcja kwasu cytrynowego:
o intensywne napowietrzanie -> aktywacja jałowej energetycznie alternatywnej oksydazy
o wysoka kwasowość (pH 2-3) ogranicza udział innych kwasów w produktach końcowych,.
o dodatek żelazocyjanku potasu wytrąca niepożądane jony metali oraz działa jako promotor wytwarzania
kwasu i inhibitor wzrostu
o niskie stężenie soli fosforowych i amonowych (źródło azotu) limituje wzrost grzybni
Hodowla powierzchniowa LSF Aspergillus niger:
podłoże kompleksowe: melasa buraczana jest rozlewana do tac ze stali kwasoodpornej, po ochłodzeniu szczepiona
konidiami pleśni zmieszanymi z węglem aktywnym (porowaty nośnik)
1) intensywny rozwój grzybni
2) intensywne wytwarzanie kwasu cytrynowego
Po zakończeniu procesu (7-9 dni w 30 stopniach) podłoże można zlać spod grzybni, a grzybnię użyć raz jeszcze.
Hodowla wgłębna SmF Aspergillus niger:
hodowla w bioreaktorach, źródło węgla: sacharoza, intensywne mieszanie powoduje rozwój grzybni w całej
objętości podłoża, proces trwa 5-7 dni w 30-32 stopniach.
Zalety:
krótszy czas trwania procesu, mniejsze zagrożenie zakażeniem, mniej ścieków, możliwe wydzielenie kwasu na
drodze krystalizacji.

22.
Co może wpłynąć na obniżenie wydajności A. niger w produkcji kwasu cytrynowego?
obecność soli metali (żelaza, manganu, cynku) – aktywują dehydrogenazy
niedostateczne napowietrzanie podłoża
za duże stężenie soli fosforowych i amonowych – niedostatek N i P limituje wzrost grzybni
za mała kwasowość pożywki – konieczne pH 2-3, w wyższym pH wzrasta udział produktów ubocznych
23.
Prowadzono dwie hodowle L. casei. W obu początkowe stężenie Scc wynosiło 10% , pozostało 0,5 %. W I
hodowli stężenie kwasu mlekowego strąconego jonami wapnia wynosiło 15 %, w II 3 %. Co na tej podstawie
możesz powiedzieć o wydajności i samym procesie fermentacji?
W drugiej hodowli wydajność była niższa, niż w pierwszym – choć zużyto tyle samo sacharozy, ilość
wyprodukowanego kwasu mlekowego była różna. Jeśli zastosowany szczep był ten sam, to przyczyn różnic należy
szukać w warunkach hodowli. Obniżenie wydajności mogło być spowodowane brakiem całkowicie beztlenowych
warunków.
24.
Wyjaśnić pojęcie fermentacji w kontekście fizjologii bakterii i w kontekście przemysłowym.
Fermentacja (fizjologia bakterii) – beztlenowy proces zdobywania energii w procesie utleniania związków
organicznych z wykorzystaniem endogennego akceptora elektronów; fermentacja zachodzi bez udziału łańcucha
transportu elektronów; jest to proces mało wydajny, ilość uzyskiwanej energii jest dużo mniejsza od energii
wytwarzanej w oddychaniu tlenowym i beztlenowym.
Fermentacja (przemysł) – proces biotechnologiczny zachodzący z wykorzystaniem mikroorganizmów, także
tlenowy, np. fermentacja octowa (wytwarzanie octu z etanolu) zachodzi w warunkach tlenowych.
25.
Wymień metody identyfikacji oraz oceny aktywności antybiotyków.
Identyfikacja szczepu produkującego antybiotyk
Na płytkę z koloniami bakterii wylewamy agar półpłynny z zarodnikami szczepu wskaźnikowego Bacillus pumilus,
aby powstała jednolita murawa – jeśli bakterie w kolonii produkują antybiotyk, powstanie strefa przejaśnienia –
Bacillus w tym miejscu nie wyrośnie.
Metody rozcieńczeniowe
Przygotowujemy szereg rozcieńczeń antybiotyku, następnie badamy wzrost szczepu przy coraz mniejszych
stężeniach. Największe rozcieńczenie antybiotyku, przy którym nie wystąpił wzrost, przyjmujemy za wartość MIC.
Metodę rozcieńczeniową można stosować w wersji probówkowej i płytkowej. Jej wadą jest pracochłonność,
niedokładność i wymagana duża ilość szkła.
Metoda dyfuzyjna krążkowa
Na płytkę z wysianym szczepem nanosimy bibułowe krążki, na które nakraplamy pipetą antybiotyk. Związek
dyfunduje do podłoża, tworząc strefy zahamowania wzrostu (przejaśnienia), których średnicę mierzymy w
milimetrach. Konieczne oznaczenie wrażliwości szczepu wzorcowego.
Metoda dyfuzyjna cylinderkowa
Na płytkach z wylanym podłożem ze szczepem wzorcowym stawia się pęsetą jałowe cylinderki bez dna, wykonane z
metalu, porcelany lub szkła. Do cylinderków nakrapla się roztwory antybiotyków. Jeśli do części nakroplimy
roztwory wzorcowe o znanym stężeniu, a do innych próbki badane, porównując średnicę strefy zahamowania
wzrostu będziemy mogli obliczyć zawartość antybiotyku w próbce posługując się nomogramem.
Metoda turbidymetryczna
Wykorzystuje zjawisko rozproszenia światła widzialnego przez cząstki i zależność między stężeniem antybiotyku a
strefą zahamowania wzrostu. Zaletą jest krótszy czas oznaczania – brak konieczności oczekiwania na dyfuzję
antybiotyku do podłoża.
MIC (Minimal Inhhibitory Concentration) minimalne stężenie hamujące (uniemożliwiające wzrost) antybiotyku,
minimalne stężenie bakteriostatyczne

MBC (Minimal Bactericidal Concentration) odpowiada najmniejszemu stężeniu antybiotyku działającemu
bakteriobójczo
Moc antybiotyku – mikrogramy czystej substancji antybiotycznej zawartej w 1 mg preparatu
26.
Badanie leku, który nie musi być jałowy.
Badanie czystości mikrobiologicznej leku musi uwzględnić:
o badanie ogólnej liczby bakterii i grzybów
o określenie obecności bakterii chorobotwórczych i oportunistycznych (Clostridium, S. aureus, Ps. aeruginosa,
rodzina Enterobacteriaceae i in.)
W tym celu pobieramy próbki preparatu, wykonujemy rozcieńczenia i wysiewamy 0,1 ml na płytki namnażające dla
grzybów i bakterii, a następnie na podłoża wybiórcze (dla drobnoustrojów chorobotwórczych),
27.
Jaki jest tok postępowania w badaniu jałowości preparatu erytromycyny?
Badanie jałowości stawia pewne wymagania:
o używane materiały muszą być jałowe,
o warunki testu muszą być aseptyczne,
o zapewnienie optymalnych warunków rozwoju dla szerokiego spektrum mikroorganizmów
(tlenowe/beztlenowe, długi czas na wzrost, bogate podłoża, różne temperatury, w tym 37 stopni dla
patogenów)
o inaktywacja lub usunięcie czynników bakterio- i grzybostatycznych.
Metoda sączków membranowych - gdy badamy antybiotyk lub inny preparat bakteriobójczy lub
bakteriostatyczny, konieczne jest usunięcie tego związku, aby nie wpływał na wynik testu jałowości. Próbkę
preparatu przesączamy przez jałowy sączek o wielkości porów 0,45 um, przepłukujemy kilkakrotnie roztworem soli
fizjologicznej.
Sączki przenosimy aseptycznie na różne płytki i inkubujemy w różnych warunkach, przykładowo:
o podłoże TSA dla bakterii (trypton, produkt trawienia kazeiny, agar), 5 dni w 30-35 stopni
o podłoże Sabouraud dla grzybów (niższe pH, gentamycyna hamuje rozwój G-), inkubacja 5 dni w 20-25
stopni
Jeśli po inkubacji nie stwierdza się na żadnej z płytek obecności mikroorganizmów, produkt uznajemy za jałowy.
28.
Podać przykład mikrobów stosowanych w fermentacji mlekowej i alkoholowej.
Fermentacja mlekowa:
o Homo: Lactobacillus delbrueckii, Pediococcus , Lactococcus lactis, Streptococcus thermophilus,
o Hetero: Leuconostoc mesenteroides Lactobacillus brevis
Fermentacja alkoholowa: Saccharomyces cerevisiae, Zymomonas mobilis (pulque)
Wyszukiwarka
Podobne podstrony:
Egzamin mp opracowane pytania
Kolokwium chemia opracowane pytania
GFIG 14 15 Kolokwium zaliczeniowe Opracowane pytania v 1
OPRACOWANE PYTANIA NA KOLOKWIUM
Opracowane pytania na kolokwium 1
STENU kolokwium 1 opracowane pytania
Kolokwium opracowane pytania
opracowane pytania kolokwium polityka spoleczna, Ekonomia, 1ROK, Polityka społeczna
Opracowane pytania na kolokwium Nieznany
Kolokwium opracowane pytanie cz 2
Zawalski, Opracowane pytania na kolokwium
ściąga z fiz. współczesnej, Politechnika, Fizyka współczesna, Opracowane pytania do kolokwiów I i II
Dendrologia opracowane pytania na kolokwium 1, Ogrodnictwo, Semestr II, Dendrologia
hotelarstwo kolokwium opracowane pytania (2)
więcej podobnych podstron