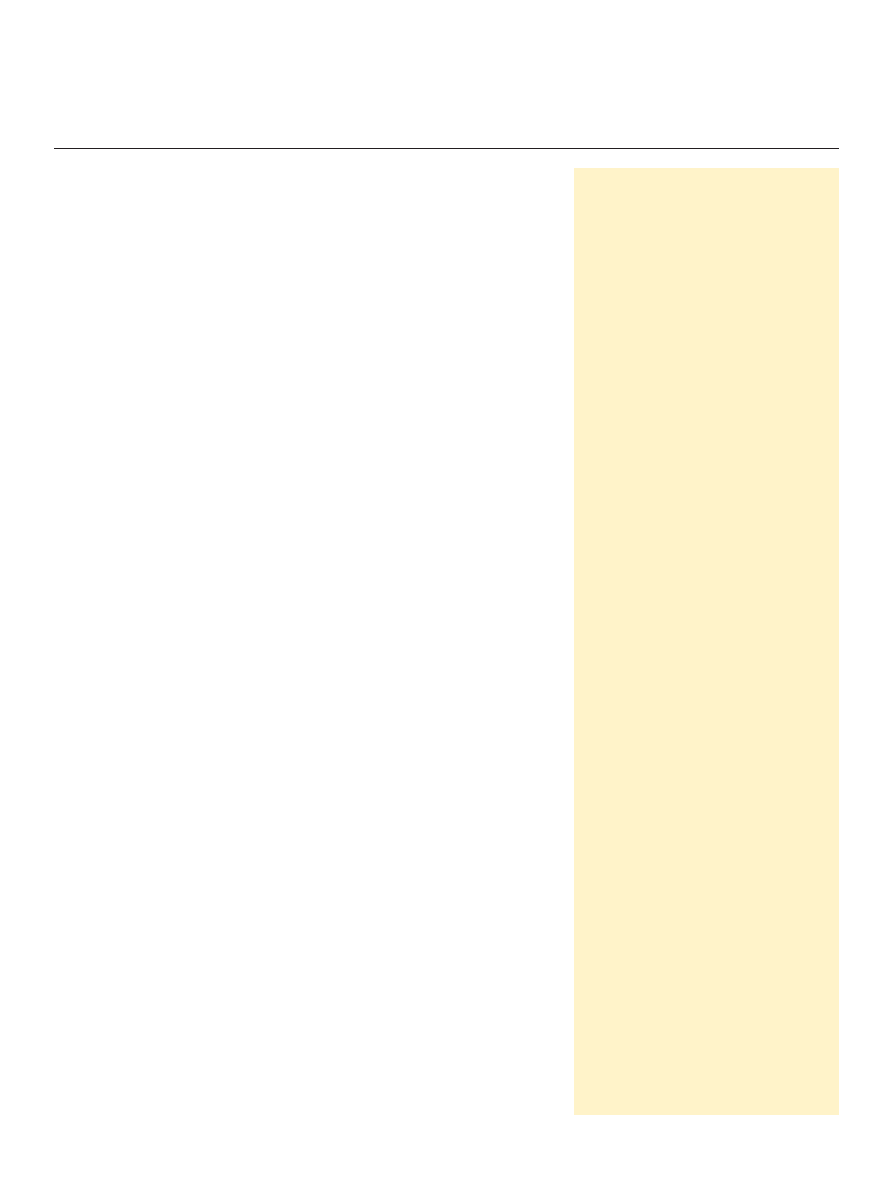
Postępy Biochemii 58 (4) 2012
387
Krzysztof Zabłocki
*
Joanna Bandorowicz-Pikuła
Instytut Biologii Doświadczalnej im. Marcele-
go Nenckiego Polskiej Akademii Nauk, War-
szawa
*
Zakład
Biochemii,
Instytut
Biologii
Doświadczalnej im. Marcelego Nenckiego
PAN, ul. Pasteura 3, 02-093 Warszawa; tel.: (22)
589 21 46, e-mail: k.zablocki@nencki.gov.pl
Artykuł otrzymano 21 listopada 2012 r.
Artykuł zaakceptowano 26 listopada 2012 r.
Słowa kluczowe: jony wapnia, homeostaza
wapniowa, komórka zwierzęca, regulacja
Wykaz skrótów: CICR (ang. calcium-induced
calcium release) — zjawisko polegające na uwal-
nianiu Ca
2+
z siateczki śródplazmatycznej w
odpowiedzi na zwiększone stężenia Ca
2+
w
cytosolu; ER (ang. endoplasmic reticulum) — sia-
teczka śródplazmatyczna; NCX (ang. sodium-
-calcium exchanger) — wymiennik sodowo-
-wapniowy; PMCA (ang. plasma membrane cal-
cium ATPase) — pompa wapniowa błony pla-
zmatycznej; SERCA (ang. sarco/endo reticular
calcium ATPase) — pompa wapniowa siateczki
śródplazmatycznej; SOC (ang. store-operated
calcium channel) — kanał wapniowy aktywo-
wany w wyniku opróżnienia wewnątrzkomór-
kowych magazynów wapnia
Homeostaza wapnia w komórce zwierzęcej — w zarysie
StreSzczenie
J
ony wapnia są wszechstronnym i uniwersalnym przekaźnikiem sygnału uczestniczą-
cym w regulacji niemal wszystkich procesów życiowych komórki. Z drugiej strony
nadmierny wzrost ich stężenia w komórce może być przyczyną jej nieodwracalnych
uszkodzeń. Dlatego zmiany stężenia jonów wapnia w różnych przedziałach komórko-
wych muszą podlegać precyzyjnej kontroli. Odbywa się to przy udziale białek umoż-
liwiających przemieszczanie się Ca
2+
przez błony biologiczne, zarówno zgodnie, jak i
wbrew gradientowi stężenia oraz ich przejściowe wiązanie i magazynowanie, a także
„dekodujących” sygnał wapniowy. Celem niniejszego artykułu jest zwięzłe przedsta-
wienie podstawowych mechanizmów komórkowych umożliwiających zachowanie pra-
widłowej wewnątrzkomórkowej homeostazy wapnia.
WPROWADZENIE
Jony wapnia są kluczowym przekaźnikiem sygnału w komórce uczest-
niczącym w regulacji niemal wszystkich procesów życiowych na każdym
szczeblu drzewa filogenetycznego. Innymi słowy, są przekaźnikiem uniwer-
salnym i wszechstronnym [1]. Takie lub podobne stwierdzenia spotyka się
w wielu opracowaniach dotyczących homeostazy wapniowej w komórce i
są one tak oczywiste, że mogą wydawać się nie warte omawiania w kolejnej
pracy przeglądowej. Z drugiej strony, badania naukowe ciągle dostarczają
nowych informacji i ukazują nowe aspekty „metabolizmu” wapniowego, za-
równo w warunkach normy, jak i patologii. Pojawiają się nowe dowody na
to, że rozregulowanie homeostazy wapniowej w komórce może prowadzić
do poważnych zaburzeń, nie tylko dotyczących metabolizmu energetyczne-
go, uszkodzenia mitochondriów i ostatecznie do śmierci komórki na drodze
apoptozy lub nekrozy, ale także może być przyczyną poważnych patologii,
np. związanych z układem odpornościowym. Odkrycia te dodatkowo pod-
kreślają to, że stężenie jonów wapnia w różnych przedziałach komórkowych
oraz jego zmiany pod wpływem różnych czynników modulujących funkcjo-
nowanie komórki muszą podlegać precyzyjnej kontroli. Wymaga to udziału
wielu „narzędzi molekularnych”, umożliwiających przemieszczanie się Ca
2+
przez błony biologiczne. Także wiązanie jonów wapnia przez odpowiednie
białka i magazynowanie ich w wyspecjalizowanych strukturach komórko-
wych należy do repertuaru komórkowych metod utrzymywania homeostazy
i regulacji sygnalizacji wapniowej.
W tym wstępnym, dla cyklu prac przeglądowych opublikowanych w ni-
niejszym zeszycie Postępów Biochemii, artykule zebrane są podstawowe in-
formacje i pojęcia dotyczące homeostazy wapnia w komórce zwierzęcej. Jego
celem jest wprowadzenie w tę skomplikowaną tematykę i przez to ułatwienie
czytania następnych, bardziej szczegółowych artykułów, dotyczących wy-
branych zagadnień biologii komórki i przedstawiających najnowsze poglądy
dotyczące sygnalizacji wapniowej. Wydaje się, że pierwszym pytaniem, jakie
należy postawić analizując wewnątrzkomórkową homeostazę wapnia, jest
to, dlaczego właśnie jony wapnia, a nie inne jony pozornie podobnego pier-
wiastka, np. magnezu, mają tak wielkie znaczenie w komórce?
DlACZEgO WAPń?
Niezwykłe znaczenie jonów wapnia w komórce jest, co oczywiste, związa-
ne z jego szczególnymi właściwościami. Wśród nich jest większa niż innych
jonów reaktywność w stosunku do składników komórki. Wynika to z dużej
liczby koordynacyjnej Ca
2+
i większej elastyczności tworzenia wiązań koor-
dynacyjnych czyli często nieregularnej geometrii tworzenia oddziaływań
koordynacyjnych. Powodem jest też tendencja Ca
2+
do reagowania z różny-
mi związkami wielkocząsteczkowymi, głównie z białkami (zwłaszcza z ato-

388
www.postepybiochemii.pl
mami tlenu reszt karboksylowych reszt kwaśnych ami-
nokwasów), a także szybka kinetyka tych oddziaływań.
Inne jony dwuwartościowe nie spełniają tych warunków
albo ze względu na ich wysoką toksyczność (jak Pb
2+
lub
Cd
2+
), albo ze względu na występowanie w dużo mniej-
szych stężeniach (np. Sr
2+
i Mn
2+
), co stawia je na przegra-
nej pozycji we współzawodnictwie z jonami wapnia [2].
Z drugiej jednak strony wysoka reaktywność jonów
wapnia sprawia, że po przekroczeniu krytycznego stę-
żenia są dla komórki niebezpieczne. Jest to związane z
łatwością z jaką Ca
2+
oddziałuje zarówno ze związkami
wielko-, jak i drobnocząsteczkowymi. W warunkach wy-
sokiego stężenia Ca
2+
powoduje to zmniejszenie się roz-
puszczalności białek i kwasów nukleinowych prowadząc
do ich wypadania z roztworu. Co więcej, jony wapnia
reagują z jonami fosforanowymi, czego skutkiem jest
powstawanie trudno rozpuszczalnych kryształów hy-
droksyapatytu. W świecie, w którym stężenie fosforanów
jest wysokie, a metabolizm komórek jest w znacznej mie-
rze oparty o reakcje fosforylacji i tworzenie fosforanów
związków organicznych, powstawanie nierozpuszczal-
nych soli będące nieuchronnym skutkiem pojawienia się
Ca
2+
w stężeniu przekraczającym dopuszczalną granicę
wyznaczoną iloczynem rozpuszczalności soli miałoby
wysoce niekorzystne następstwa [2]. Właśnie ta chemicz-
na właściwość jonów wapnia wydaje się mieć kluczowe
znaczenie ewolucyjne, a komórki, na wszystkich etapach
rozwoju filogenetycznego, muszą sobie radzić z nadmia-
rem wapnia, jako substancji szkodliwej. Jednocześnie
precyzyjne wykorzystywanie Ca
2+
w tym zakresie stężeń,
które nie wywołuje ujemnych skutków jest podstawą
wielu procesów regulacyjnych, i w pewnym sensie jest
dodatkową korzyścią wynikającą z obrony przed Ca
2+
jako substancją toksyczną. Kontrola stężenia jonów wap-
nia w komórce jest w ogólnym bilansie procesem ener-
giochłonnym, więc jej rozchwianie z reguły prowadzi do
nadmiernego wzrostu stężenia Ca
2+
i uszkodzeń komórki
często prowadzących do jej unicestwienia.
W początkowym okresie w historii życia na Ziemi
wapń był uwięziony w skałach wulkanicznych i niedo-
stępny dla pierwotnych organizmów. Po ostygnięciu
planety, w następstwie szeregu procesów geofizycznych
doszło do stopniowego uwalniania wapnia do środowi-
ska wodnego, w którym rozwijało się życie. Skład jono-
wy wnętrza komórki jest w dużej mierze uzależniony od
składu jonowego tego środowiska, zawierającego przede
wszystkim jony sodu, jony chlorkowe oraz jony potasu,
magnezu i wapnia. Ale proporcje stężeń pomiędzy po-
szczególnymi jonami we wnętrzu komórki i jej otoczeniu
znacząco się różnią. Pojawienie się pierwszej komórki
wiązało się z powstaniem pierwotnych mechanizmów se-
gregujących jony, sprawiających, że roztwór zawarty w
przestrzeni oddzielonej od środowiska błoną stanowią-
ca barierę przepuszczalności miał inny skład nie tylko w
odniesieniu do substancji organicznych, ale także jonów
nieorganicznych. Utrzymywanie takich różnic stężeń wy-
magało stałego wydatku energetycznego. Ze względu na
wspomniane wcześniej niekorzystne dla komórek właści-
wości jonów wapnia, panujące w pierwotnym środowi-
sku życia warunki stwarzały silną presję ewolucyjną w
kierunku rozwoju mechanizmów jego usuwania z komó-
rek i organizmów. Powstawaniu życia musiał towarzy-
szyć rozwój zdolności do obrony przed napływającymi
do komórek jonami wapnia [3]. W efekcie stężenie jonów
wapnia w cytosolu
1
przeciętnej, niepobudzonej komórki
zwierzęcej osiąga bezpieczną wartość wynoszącą ok. 100
nM, co w warunkach 1–2 mM stężenia Ca
2+
panującego
w przestrzeni pozakomórkowej oznacza różnicę czterech
rzędów wielkości. Utworzony potencjał elektrochemicz-
ny przeciwstawia się wypompowywaniu Ca
2+
z komórki
i w istocie stanowi siłę „wpychającą” jony wapniowe z
powrotem do wnętrza komórki. Jedynie duża wydajność
systemów usuwających Ca
2+
, ograniczona przepuszczal-
ność błon plazmatycznych dla jonów i przede wszystkim
obecność innych jonów, głównie Na
+
, K
+
i Cl
-
, których
także nierównocenny rozkład w poprzek błony sprawia,
że różnica potencjału elektrycznego na błonie plazma-
tycznej komórki wynosi 40–60 mV (ujemny wewnątrz
komórki), pozwalają na utrzymanie właściwej różnicy
stężeń Ca
2+
.
Wydatek energetyczny komórki przeznaczony na
utrzymanie równowagi jonowej jest bardzo wysoki, ale
część tej energii, zmagazynowanej w postaci potencjału
elektrochemicznego jonów, może być wykorzystana przez
komórkę. Dotyczy to nie tylko jonów wapnia. Dzięki po-
tencjałowi elektrochemicznemu jonów sodu oraz obecno-
ści jonoselektywnych kanałów błonowych możliwy jest
szybki napływ Na
+
do wnętrza komórki. Jest to podstawą
pobudliwości komórki opartej o depolaryzację błony pla-
zmatycznej. W przypadku jonów wapnia ich szybki na-
pływ do komórki ma kluczowe znaczenie sygnalizacyjne.
Ze względu na to, że spoczynkowe stężenie Ca
2+
w cyto-
solu jest tak małe jego kilku- czy nawet kilkunastokrotne
zwiększenie wymaga tylko niewielkiego napływu jonów
wapnia do komórki i jest związane z nieznaczną zmia-
ną osmotyczności środowiska wewnątrzkomórkowego.
Uzyskanie takiej samej względnej zmiany stężenia jonów
magnezu, których stężenie w cytosolu wynosi 0,5–0,7
mM jest niemożliwe, po pierwsze ze względu na prze-
ciwny rozkład różnicy stężeń, co czyniło by ten proces
energiochłonnym i powolnym. Ponadto ponad 10-krot-
ny wzrost stężenia Mg
2+
(jak to ma miejsce w przypadku
Ca
2+
) wymagałby masywnego napływu tych jonów do
komórki, co mogłoby powodować zburzenia osmotycz-
ności i pęcznienie komórki [2,4]. Co więcej, duże stężenie
jonów magnezu w stosunku do wartości stałych wiąza-
nia sprawia, że miejsca jego oddziaływania z białkami
i innymi składnikami komórki są w znacznym stopniu
wysycone, co istotnie ogranicza jego zastosowanie jako
przekaźnika sygnału [2]. W przypadku jonów wapnia tak
nie jest i zmiany stężenia Ca
2+
w cytosolu o jeden lub dwa
rzędy wielkości powodują znaczące zmiany stopnia wy-
sycenia białek tymi jonami, co ma ogromne znaczenie w
sygnalizacji wewnątrzkomórkowej, polegającej w dużym
stopniu na odwracalnym przyłączaniu Ca
2+
do wyspecja-
lizowanych białek.
1
W niniejszej pracy termin „cytosol” znaczy tyle co „cytoplazma
podstawowa”, czyli cytoplazma pozbawiona wszelkich organelli
obłonionych. W ścisłym znaczeniu terminem „cytosol” określa się
frakcję rozpuszczalną komórki, po odwirowaniu jądra i organelli.

Postępy Biochemii 58 (4) 2012
389
Podsumowując tę część rozważań, szczególne wła-
ściwości jonów wapnia, które z jednej strony wymusiły
stworzenie mechanizmów ochronnych, a z drugiej po-
zwoliły na ich wykorzystanie w bezpiecznym zakresie
stężeń, tłumaczą dlaczego właśnie Ca
2+
a nie inne jony
znajdujące się w środowisku mają tak wielkie znacze-
nie w życiu komórki. Utrzymanie właściwej homeostazy
wapniowej i regulacja sygnałów opartych o zmiany stęże-
nia Ca
2+
w cytosolu i w innych przedziałach komórki wy-
maga szerokiego spektrum narzędzi molekularnych [1].
NARZęDZIA mOlEKulARNE
W SygNAlIZACJI WAPNIOWEJ
W warunkach normy w komórce eukariotycznej zmiany
stężenia Ca
2+
są precyzyjnie regulowane w ściśle ustalonym
zakresie, którego przekroczenie grozi poważnymi następ-
stwami. W regulacji tej bierze udział szereg białek, których
współdziałanie pozwala nie tylko na ochronę komórki
przed toksycznością jonów wapnia, ale także na efektywne
wykorzystywanie tych jonów jako regulatorów wielora-
kich procesów komórkowych począwszy od aktywacji en-
zymów i kontroli procesów metabolicznych, a skończyw-
szy na przebudowie komórki, jej ruchu, podziałach i wielu
innych [1]. Te molekularne narzędzia są bardzo zróżnico-
wane zarówno pod względem fizyko-chemicznego mecha-
nizmu działania jak i pełnionej funkcji. Z punktu widzenia
ochrony komórki przed nadmierną akumulacją wapnia w
cytosolu szczególne znaczenie mają przede wszystkim te z
nich, które usuwają Ca
2+
do przestrzeni pozakomórkowej.
Jak już wcześniej wspomniano, przemieszczanie się jonu
wbrew różnicy jego stężeń wymaga nakładu energii. W
najprostszej sytuacji odbywa się to kosztem ATP, którego
hydroliza katalizowana przez odpowiednie ATPazy jest
sprzężona z transportem jonu. ATPazy te nazywane są
pompami wapniowymi PMCA (ang. plasma membrane cal-
cium ATPase). Nieco bardziej złożoną jest sytuacja, w której
usuwanie jonów wapnia odbywa się kosztem potencjału
elektrochemicznego innego jonu np. Na
+
. W warunkach
normy stężenie Na
+
jest znacznie większe w środowisku
pozakomórkowym niż wewnątrz komórki, a zatem jon
sodowy ma naturalną tendencję do wnikania do cytoso-
lu, czemu dodatkowo sprzyja różnica potencjałów elek-
trycznych w poprzek błony plazmatycznej komórki. Taką
samą tendencję mają jony wapnia, ale budowa cząstecz-
kowa i mechanizm działania białka zwanego wymienni-
kiem sodowo-potasowym (NCX) jest taka, że przenoszone
jednocześnie Na
+
i Ca
2+
mogą się przemieszczać tylko w
przeciwnym kierunku. Decyduje o nim względna wartość
potencjałów elektrochemicznych obu jonów oraz ładunek
elektryczny na błonie, będący wypadkową niejednorodnej
dystrybucji wszystkich rodzajów jonów znajdujących się
w komórce i poza nią. Zaburzenie tego ładunku i wzrost
stężenia Na
+
w cytosolu, co jest podstawą depolaryzacji
np. komórki nerwowej sprawia, że kierunek transportu
Ca
2+
zachodzącego z udziałem NCX może się zmienić. Po-
wstawanie sygnału wapniowego polega na przejściowym
wzroście stężenia jonów wapnia w cytosolu, a zatem pom-
py i wymienniki jonowe usuwające Ca
2+
do przestrzeni
pozakomórkowej uczestniczą raczej w wyciszaniu tego
sygnału niż jego wzbudzaniu.
Usuwanie jonów wapnia do środowiska nie jest jedy-
nym sposobem zmniejszania jego stężenia w cytosolu.
Cechą komórek eukariotycznych jest występowanie róż-
nych obłonionych organelli, w tym siateczki śródplazma-
tycznej wyspecjalizowanej w magazynowaniu wapnia.
Funkcja wewnątrzkomórkowych magazynów wapnio-
wych w siateczce plazmatycznej, jako ważnych elemen-
tów regulacji homeostazy i sygnalizacji wapniowej we
współczesnych komórkach wyewoluowała zapewne z
pierwotnych struktur zapobiegających „przeładowaniu”
komórek toksycznym wapniem i w efekcie ich destruk-
cji [2]. W prawidłowej komórce stężenie jonów wapnia w
siateczce śródplazmatycznej jest o około trzy rzędy wiel-
kości większe niż w cytosolu, przy czym Ca
2+
(nie zwią-
zany np. z białkami) stanowią jedynie niewielki ułamek
całej zmagazynowanej puli wapnia. Różnica stężeń Ca
2+
w poprzek błon siateczki śródplazmatycznej jest utrzy-
mywana przez pompę wapniową zwaną SERCA (ang.
sarco/endo reticular calcium ATPase).
Z punktu widzenia homeostazy wapniowej, pobudze-
nie komórki lub innymi słowy jej odpowiedź wapniowa
polega w pewnym uproszczeniu na szybkim zwiększe-
niu stężenia Ca
2+
w cytosolu. Wapń ten pochodzi z dwóch
źródeł: ze środowiska pozakomórkowego oraz z siateczki
śródplazmatycznej. Jego przemieszczanie się do cytosolu
jest możliwe dzięki różnym kanałom jonowym o regulo-
wanym przewodnictwie. Proces ten jest tzw. dyfuzją uła-
twioną, a jego znaczna szybkość i wypadkowy kierunek
są wynikiem dużych różnic stężeń w poprzek błon utrzy-
mywanych przez pompy i wymienniki jonowe.
Wolne jony wapnia, to tylko niewielka część całej puli
wapnia zmagazynowanego w komórce. Znakomita więk-
szość jest związana przede wszystkim z białkami wiążą-
cymi wapń występującymi zarówno w siateczce śródpla-
zmatycznej (np. kalsekwestryna i kalretikulina) jak i w
cytosolu (np. parwalbumina). Cechą charakterystyczną
tych białek jest ich duża pojemność buforowa, co ozna-
cza, że jedna cząsteczka białka może przyłączyć wiele
jonów wapnia. Ze względu na stosunkowo małe powi-
nowactwo, stopień wysycenia tych białek wapniem zmie-
nia się szybko w zależności od zmian stężenia Ca
2+
(w
zakresie fizjologicznym) w danym przedziale komórko-
wym. Ma to istotne znaczenie w kształtowaniu sygnału
wapniowego.
Przejściowe magazynowanie jonów wapnia, bardziej
precyzyjnie określane terminem „buforowanie” jest tak-
że funkcją mitochondriów. Mitochondria pobierają Ca
2+
kosztem potencjału błonowego (siły protonomotorycz-
nej), a zatem ich działanie jako buforów wapniowych jest
skorelowane ze stanem energetycznym komórek [5]. Co
więcej, ze względu na stosunkowo małe powinowactwo
białka transportującego Ca
2+
do macierzy mitochondrial-
nej w stosunku do tego jonu oraz obecność w błonie mi-
tochondrialnej wymienników NCX stale i szybko usu-
wających Ca
2+
z mitochondriów sprawiają, że mitochon-
dria mogą efektywnie akumulować jony wapnia w tych
miejscach komórki, w których dochodzi do chwilowego
wzrostu ich stężenia, powodując jego lokalne obniżenie.
390
www.postepybiochemii.pl
Jony wapnia są w mitochondriach wiązane przez biał-
ka buforujące lub wraz z jonami fosforanowym tworzą
amorficzne fosforany [6].
Współistnienie wielu mechanizmów wpływających
na stężenie jonów wapnia w cytosolu i w innych prze-
działach komórkowych, różniących się powinowactwem
do Ca
2+
oraz szybkością działania, sposobem aktywacji i
mechanizmami regulacji swojej aktywności pozwala na
kształtowanie odpowiedzi wapniowej komórki w sposób
wysoce swoisty, zależny od rodzaju komórki oraz pobu-
dzającego ją bodźca. Powstające sygnały wapniowe, róż-
niące się intensywnością, lokalizacją, stopniem rozprze-
strzeniania w komórce i częstotliwością występowania
są „dekodowane” przez efektorowe białka wiążące jony
wapnia, których sztandarowym, ale tylko jednym z bar-
dzo wielu, przykładem jest kalmodulina.
Współistnienie mechanizmów wzbudzania, wzmac-
niania, dekodowania i wreszcie wyciszania sygnałów
wapniowych jest schematycznie przedstawione na ryci-
nie 1. Zależny od jonów wapnia sposób regulacji aktyw-
ności tych procesów, a także regulacji ekspresji genów
kodujących białka zaangażowane w utrzymywanie ho-
meostazy wapniowej komórki sprawia, że sygnalizacja
wapniowa podlega autoregulacji. Współzależności po-
między poszczególnymi elementami regulacji sygna-
łów wapniowych stanowią kolejny,
wyższy stopień organizacji systemu
powiązań nie tylko funkcjonalnych,
ale także strukturalnych. Chociaż
ogólna zasada wydaje się wspólna
dla wszystkich komórek, istnieją
znaczne różnice dotyczące udziału
każdego z nich w czasie wzbudza-
nia, wzmacniania, rozprzestrzenia-
nia się i wygaszania sygnału wap-
niowego. Dokładne omówienie tych
zagadnień nie jest tematem tego
wstępnego artykułu, natomiast na
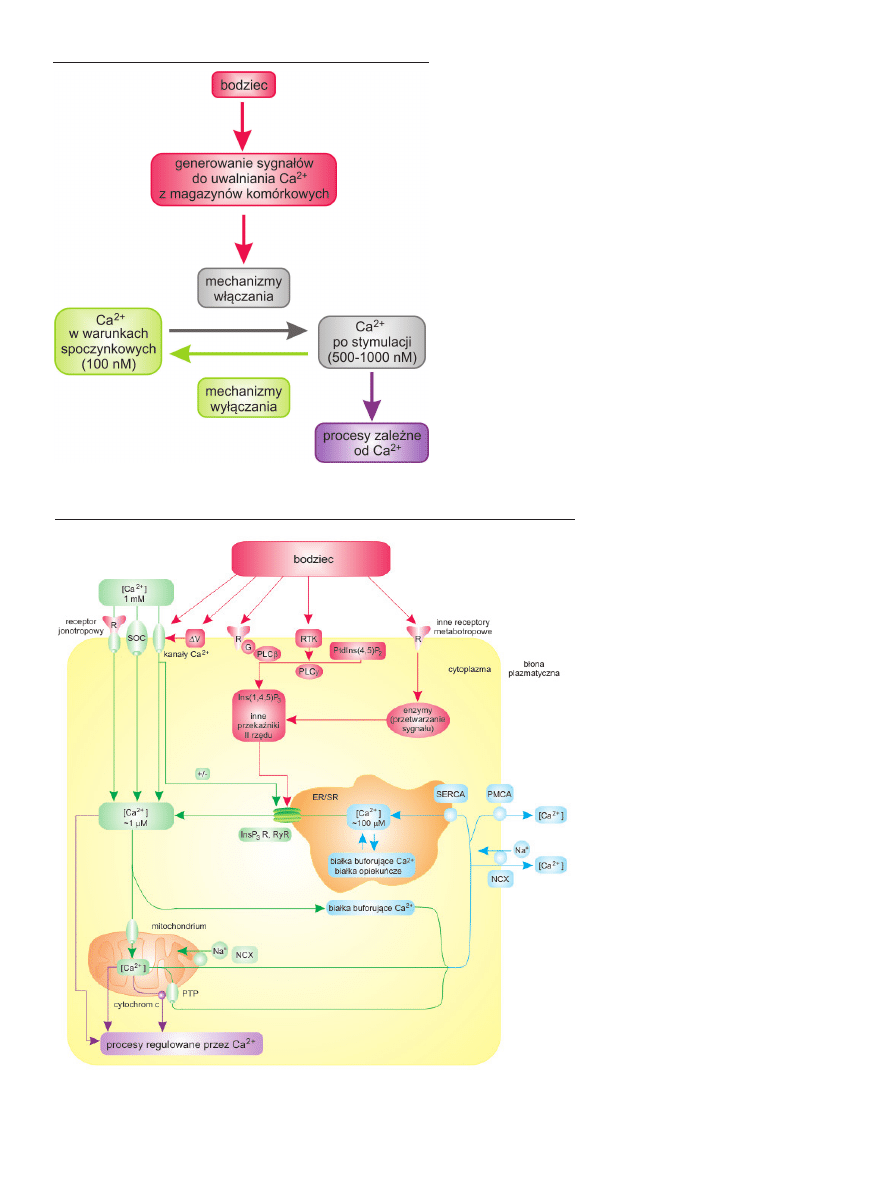
rycinie 2 przedstawiono schema-
tycznie takie zależności. W błonie
komórkowej zaznaczono różne ro-
dzaje kanałów wapniowych, w tym
jako DV niektórych gruczołów wy-
dzielania dokrewnego, kanały wap-
niowe, które są aktywowane wsku-
tek depolaryzacji tej błony. Są one
typowe dla komórek pobudliwych
elektrycznie (np. komórek mięśni
gładkich, mięśnia sercowego, neuro-
nów, niektórych gruczołów wydzie-
lania dokrewnego). Nieco inaczej
jest w przypadku komórek mięśni
szkieletowych, w których depolary-
zacja błony plazmatycznej i aktywa-
cja kanału zależnego od potencjału
błonowego powoduje uwalnianie
Ca
2+
z siateczki sarkoplazmatycznej,
co umożliwia (przynajmniej przez
kilka minut) kurczenie się komórki
bez napływu Ca
2+
z zewnątrz. Inną
Rycina 1. Funkcjonalna organizacja sygnalizacji wapniowej w komórce zwierzę-
cej. Wyjaśnienia w tekście pracy. Rycinę przygotowano na podstawie [1], zmie-
niono.
Rycina 2. Schemat sygnalizacji wapniowej w komórce zwierzęcej. Wyjaśnienia w tekście pracy. Rycinę przygo-
towano na podstawie [1], zmieniono.

Postępy Biochemii 58 (4) 2012
391
grupę stanowią kanały aktywowane ligandem, związane
z tzw. receptorami jonotropowymi. Ich przykładami są
kanały aktywowane glutaminianem (receptory NMDA)
w ośrodkowym układzie nerwowym, albo występujące
w wielu narządach kanały/receptory nukleotydowe P2X.
Przyłączenie agonisty do takiego receptora powoduje
otwarcie kanału jonowego w błonie plazmatycznej. Jesz-
cze inny rodzaj to kanały zależne od stymulacji recepto-
rów metabotropowych znajdujących się na powierzchni
komórki. Tworzą one bardzo liczną grupę, a ich otwarcie
poprzedzają procesy metaboliczne prowadzące wytwo-
rzenia tzw. wtórnych przekaźników sygnału. Przykładem
jest stymulowany agonistą szlak przemian prowadzący
do aktywacji fosfolipazy C i powstania inozytolotrisfos-
foranu (IP
3
) jako wtórnego przekaźnika sygnału powo-
dującego uwolnienie Ca
2+
z siateczki śródplazmatycznej
przez kanały wapniowe związane z receptorami aktywo-
wanymi przez IP
3
(IP
3
R) [7]. W odpowiedzi tej uczestni-
czą często białka G, albo związane z receptorem kinazy
białkowe katalizujące fosforylację reszt tyrozynowych
(na schemacie RTK). Do tej kategorii należy na przykład
kanał aktywowany pojemnościowo tzw. SOC (ang. sto-
re-operated calcium channel), którego otwarcie wymaga
wcześniejszego opróżnienia magazynów wapniowych
w siateczce śródplazmatycznej oraz kanały aktywowane
kwasem arachidonowym uwalnianym z fosfolipidów, a
także innymi ligandami powstającymi wewnątrz pobu-
dzonej komórki. Aktywacja SOC i innych kanałów wap-
niowych w błonie plazmatycznej, poprzedzana uwol-
nieniem Ca
2+
z siateczki śródplazmatycznej, pozwala na
wzmocnienie i przedłużenie tej pierwotnej odpowiedzi
wapniowej [8].
Sam wzrost stężenia Ca
2+
w cytosolu może być czyn-
nikiem aktywującym inne, występujące obok kanałów/
receptorów IP
3
, receptory znajdujące się w siateczce
śródplazmatycznej, zwane receptorami rianodynowymi.
Ich nazwa pochodzi od rianodyny, alkaloidu roślinnego
hamującego ich aktywność i uwalnianie jonów wapnia z
siateczki śródplazmatycznej. Czynnikiem aktywującym
receptory rianodynowe jest Ca
2+
zazwyczaj wnikający
do komórek przez kanały zależne od potencjału błony
plazmatycznej. Jest to mechanizm wzmacniający sygnał
wapniowy, zwany jako CICR (ang. calcium-induced cal-
cium release). Zarówno kanały/receptory IP
3
jak i kanały
rianodynowe występują powszechnie w różnych typach
komórek, przy czym na ogół w komórkach pobudliwych
elektrycznie dominuje RyR, a w niepobudliwych IP
3
R.
Mechanizmy prowadzące do wzrostu stężenia Ca
2+
w cy-
tosolu ulegają zazwyczaj zwrotnej regulacji. Na przykład
SOC jest hamowany wtedy, gdy stężenie jonów wapnia
wzrasta w pobliżu błony plazmatycznej. Podobnie jony
wapnia mogą aktywować lub zmieszać aktywność IP
3
R,
w zależności od ich stężenia [9-11].
Na rycinie 2 oprócz mechanizmów zwiększających
stężenia Ca
2+
w cytosolu pokazane są także narzędzia
zmniejszania lub modulowania. Przede wszystkim są to
pompy wapniowe SERCA i PMCA oraz wymiennik sodo-
wo wapniowy NCX. Aktywność tych białek jest precyzyj-
nie regulowana między innymi przez jony wapnia; wzrost
ich stężenia w cytosolu aktywuje systemy usuwające Ca
2+
z komórki lub do cystern siateczki śródplazmatycznej.
W obu przypadkach ważnym czynnikiem decydującym
o możliwości usuwania Ca
2+
z cytosolu jest dostępność
ATP. Zaburzenie metabolizmu energetycznego komórki
prowadzi do zaburzenia równowagi między wnikaniem
Ca
2+
do komórek a jego energiochłonnym usuwaniem,
co jest przyczyną nadmiernego wzrostu stężenia Ca
2+
w
cytosolu i w efekcie uszkodzenia komórek, apoptozy lub
nekrozy [12].
W mitochondriach, które, jak wspomniano wcześniej,
spełniają funkcję buforującą w stosunku do Ca
2+
, jony te
aktywują oksydacyjną fosforylację. Umożliwiają zatem
wydajne wytwarzanie ATP, którego duża część jest wy-
korzystywana do utrzymywania homeostazy jonowej,
w tym do aktywnego transportu Ca
2+
przez błony [5]. Z
drugiej strony, nadmierne zwiększenie stężenia Ca
2+
w
cytosolu i w efekcie zbyt intensywne pobieranie jonów
wapnia przez mitochondria może aktywować tzw. mito-
chondrialną ścieżkę apoptozy. Uważa się, że w procesie
tym uczestniczą białka mitochondrialnego megakanału
oraz cytochrom c i inne białka wydostające się z prze-
strzeni międzybłonowej mitochondriów [6,13].
Podobnie jak mitochondria także siateczka śródpla-
zmatyczna nie jest jedynie biernym magazynem wapnia.
Jego niedobór w ER może powodować tzw. stres retiku-
larny związany z niewłaściwie przebiegającym dojrze-
waniem białek i nadmiernym nagromadzaniem się białek
niewłaściwie sfałdowanych. Natomiast nadmiar wapnia
w siateczce śródplazmatycznej prowadzi do zbyt dużych
wzrostów stężenia Ca
2+
w cytosolu w chwili pobudzenia
komórki. W obu przypadkach może dojść do aktywacji
apoptozy. Co więcej, istnieją przekonujące dane o bezpo-
średnim strukturalnym oddziaływaniu siateczki śródpla-
zmatycznej z mitochondriami. Ma to kluczowe znaczenie
dla regulacji opróżniania i uzupełniania zasobów maga-
zynów wapniowych oraz ścisłej synchronizacji sygnaliza-
cji wapniowej z metabolizmem energetycznym komórek.
Podkreśla to spójność i całościowy charakter gospodarki
wapniowej w komórce [14,15].
PODSumOWANIE
Jest oczywiste, że schematy przedstawione na rycinach
ilustrują ogólny zarys zależności związanych z utrzymy-
waniem homeostazy i sygnalizacji wapniowej w sposób
bardzo uproszczony i nie uwzględnia wszystkich aspek-
tów omawianych zjawisk. Ich zadaniem, podobnie jak
celem niniejszego krótkiego artykułu, jest wskazanie naj-
ważniejszych „narzędzi komórkowych” i ich funkcji w
kontekście całościowej odpowiedzi wapniowej komórki.
Jest to wstęp do bardziej szczegółowych rozważań.
PIśmIENNICtWO
1. Berridge MJ, Lipp P, Bootman MD (2000) The versality and universali-
ty of calcium signaling. Nat Rev Mol Cell Biol 1: 11-21
2. Jaiswal JK (2001) Calcium — how and why? J Biosci 26: 357-363
3. Case RM, Eisner D, Gurney A, Jones O, Muallem A, Verkhratsky A
(2007) Evolution of valcium homeostasis: from birth of the first cell to
an omniprescent signalling system. Cell Calcium 42: 345-350

392
www.postepybiochemii.pl
Calcium homeostasis in the animal cell — an outline
Krzysztof Zabłocki
*
, Joanna Bandorowicz-Pikuła
Department of Biochemistry, Nencki Institute of Experimental Biology, 3 Pasteur St., 02-093 Warsaw, Poland
*
e-mail: k.zablocki@nencki.gov.pl
Key words: calcium ions, calcium homeostasis, animal cell, regulatory mechanisms
ABStRACt
Calcium ions are universal and versatile intracellular signalling molecule which is involved in regulation of many cellular functions in all
living cells throughout all animal species. It results from unique properties of Ca
2+
in comparison to other two- and monovalent cations
commonly present inside and outside cells. On the other hand an excessive increase of intracellular Ca
2+
accumulation may exert toxic effect
leading to cell death. therefore calcium content in particular cellular compartment must be precisely regulated. All cells have a complex set
of proteins which allow them to remove, store or take up Ca
2+
in very controlled manner. this article gives a concise survey of mechanisms
involved cellular calcium homeostasis and signalling.
4. Romani A (2007) Regulation of magnesium homeostasis and transport
in mammalian cells. Arch Biochem Biophys 458: 90-102
5. Poburko D, Demaurex N (2012) Regulation of the mitochondrial pro-
ton gradient by cytosolic Ca²
+
signals. Pflugers Arch 464: 19-26
6. Rizzuto R, De Stefani D, Raffaello A, Mammucari C (2012) Mitochon-
dria as sensors and regulators of calcium signalling. Nat Rev Mol Cell
Biol 13: 566-578
7. Berridge MJ (2009) Inositol trisphosphate and calcium signalling me-
chanisms. Biochim Biophys Acta 1793: 933-940
8. Parekh AB, Putney JW Jr (2005) Store-operated calcium channels. Phy-
siol Rev 85: 757-810
9. Parekh AB (2003) Store-operated Ca
2+
influx: dynamic interplay be-
tween endoplasmic reticulum, mitochondria and plasma membrane.
J Physiol 547: 333-348
10. Taylor CW, Tovey SC (2010) IP
3
receptors: toward understanding their
activation. Cold Spring Harb Perspect Biol 2: a004010
11. Lanner JT, Georgiou DK, Joshi AD, Hamilton SL (2010) Ryanodine
receptors: structure, expression, molecular details, and function in cal-
cium release. Cold Spring Harb Perspect Biol 2: a00399613
12. Brini M, Carafoli E (2009) Calcium pumps in health and disease. Phy-
siol Rev 89: 1341-1378
13. Giorgi C, Baldassari F, Bononi A, Bonora M, De Marchi E, Marchi S,
Missiroli S, Patergnani S, Rimessi A, Suski JM, Wieckowski MR, Pin-
ton P (2012) Mitochondrial Ca
2+
and apoptosis. Cell Calcium 52: 36-43
14. Bononi A, Missiroli S, Poletti F, Suski JM, Agnoletto C, Bonora M, De
Marchi E, Giorgi C, Marchi S, Patergnani S, Rimessi A, Wieckowski
MR, Pinton P (2012) Mitochondria-associated membranes (MAMs) as
hotspot Ca
2+
signaling units. Adv Exp Med Biol 740: 411-437
15. Grimm S (2012) The ER-mitochondria interface: the social network of
cell death. Biochim Biophys Acta 1823: 327-334
Wyszukiwarka
Podobne podstrony:
Abolicja podatkowa id 50334 Nieznany (2)
4 LIDER MENEDZER id 37733 Nieznany (2)
katechezy MB id 233498 Nieznany
metro sciaga id 296943 Nieznany
perf id 354744 Nieznany
interbase id 92028 Nieznany
Mbaku id 289860 Nieznany
Probiotyki antybiotyki id 66316 Nieznany
miedziowanie cz 2 id 113259 Nieznany
LTC1729 id 273494 Nieznany
D11B7AOver0400 id 130434 Nieznany
analiza ryzyka bio id 61320 Nieznany
pedagogika ogolna id 353595 Nieznany
Misc3 id 302777 Nieznany
cw med 5 id 122239 Nieznany
D20031152Lj id 130579 Nieznany
mechanika 3 id 290735 Nieznany
więcej podobnych podstron