
Outlook
PODSTAWY TECHNOLOGII CHEMICZNEJ
NOWOCZESNE PROCESY UTLENIANIA – OZONOWANIE, UTLENIANIE
FOTOKATALITYCZNE, REAKCJA FENTONA
INSTRUKCJA DO ĆWICZEŃ LABORATORYJNYCH
INSTRUKCJE PRZYGOTOWALI:
DR INŻ. ADRIANA ZALESKA
MGR INŻ. EWELINA GRABOWSKA
GDAŃSK 2008
POLITECHNIKA GDAŃSKA
WYDZIAŁ CHEMICZNY
KATEDRA TECHNOLOGII CHEMICZNEJ

2
1. WPROWADZENIE................................................................................................................................................3
2. PRZEGLĄD METOD UTLENIAJĄCYCH...........................................................................................................3
2.1. Mokre utlenianie powietrzem...........................................................................................................................5
2.2.Utlenianie w stanie nadkrytycznym...................................................................................................................6
2.3.Utlenianie elektrochemiczne .............................................................................................................................8
2.4. Utlenianie przy pomocy ozonu i nadtlenku wodoru. ........................................................................................8
2.5. Reakcja Fentona ..............................................................................................................................................9
2.6. Fotoliza UV....................................................................................................................................................11
2.7 Proces z zastosowaniem H
2
O
2
/UV ..................................................................................................................11
2.8. Procesy z zastosowaniem ozonu.....................................................................................................................12
2.9. Procesy z zastosowaniem O
3
/UV....................................................................................................................13
2.10.Utlenianie w układzie O
3
/H
2
O
2
/UV...............................................................................................................13
2.11.Degradacja fotokatalityczna w wodnych zawiesinach półprzewodników. ....................................................13
3. LITERATURA .....................................................................................................................................................17
4. UTLENIANIE WODNEGO ROZTWORU FENOLU METODĄ FENTONA ...................................................18
4.1. Cel ćwiczenia .............................................................................................................................................18
4.2. Aparatura i sprzęt .......................................................................................................................................18
4.3. Budowa i działanie aparatury do utleniania metodą Fentona.....................................................................18
4.4. Sposób przeprowadzenia pomiarów...........................................................................................................18
4.5. Analityczna kontrola procesu.....................................................................................................................20
5. FOTOKATALITYCZNA DEGRADACJIA FENOLU W WODNEJ ZAWIESINIE TiO
2
.................................22
5.1. Cel ćwiczenia .............................................................................................................................................22
5.2. Aparatura i sprzęt .......................................................................................................................................22
5.3. Budowa i działanie aparatury do utleniania fotokatalitycznego.................................................................22
5.4. Sposób prowadzenia pomiarów .................................................................................................................22
5.5. Analityczna kontrola procesu.....................................................................................................................23
6. OZONOWANIE FENOLU - PODSTAWY TEORETYCZNE............................................................................25
6.1. Cel ćwiczenia .............................................................................................................................................25
6.2. Aparatura i sprzęt .......................................................................................................................................25
6.3. Budowa i działanie aparatury do ozonowania............................................................................................25
6.4. Sposób przeprowadzenia pomiarów...........................................................................................................25
6.5. Analityczna kontrola procesu.....................................................................................................................28

1. WPROWADZENIE
Odcieki można zdefiniować jako wody przesiąkowe ze składowisk odpadów komunalnych.
Charakteryzują się one właściwościami redukcyjnymi i znacznie podwyższonymi parametrami
biologicznego i chemicznego zapotrzebowania na tlen (BZT5 i ChZT), wysokimi stężeniami
substancji rozpuszczonych, chlorków, siarczanów i związków azotu amonowego.
W przeciwieństwie do ścieków komunalnych, odcieki ze składowisk odpadów trudno poddają
się oczyszczaniu metodami biologicznymi.
W ostatnim dziesięcioleciu podejmuje się intensywne badania nad znalezieniem skutecznych
metod usuwania toksycznych zanieczyszczeń, które występują w wodzie, ściekach oraz
odciekach zarówno w ilościach śladowych, jak i w stężeniach relatywnie wysokich. Jedną z
dostępnych obecnie technologii są Nowoczesne Procesy Utleniania (NPU, ang. AOP –
Advanced Oxidation Processes), opierające się na reakcjach z udziałem rodników
hydroksylowych OH
•
. Rodniki hydroksylowe są najsilniejszym utleniaczem, który można
zastosować do oczyszczania wody i ścieków (potencjał utleniający wynosi 2,80 V). Powstają
one między innymi podczas rozkładu ozonu w środowisku wodnym w łańcuchowych reakcjach
rodnikowych, jak również podczas fotolizy nadtlenku wodoru, chloru w środowisku wodnym,
wodnego roztworu Fe(III), podczas reakcji Fentona, lub pod wpływem promieniowania
jonizującego. Rodniki hydroksylowe są mało selektywne i reagują z większością
rozpuszczonych związków organicznych i wieloma nieorganicznymi, przy wysokiej stałej
szybkości reakcji. Celem podwyższenia efektywności w wielu procesach utleniania stosuje się
kilka różnych utleniaczy a reakcje z zastosowaniem rodników OH
•
są tylko jednym z etapów
procesu oczyszczania ścieków [Hoigne 1996]. NPU są istotne dla oczyszczania ścieków,
odcieków, zanieczyszczonych wód powierzchniowych i gruntowych oraz do produkcji wody
ultraczystej [Braun, 1996].
2. PRZEGLĄD METOD UTLENIAJĄCYCH
Wśród nowoczesnych technologii utleniania wyróżnia się następujące procesy chemiczne i
fotochemiczne (procesy utleniania indukowane światłem).
Chemiczne metody degradacji:
• mokre utlenianie powietrzem (wet air oxidation - WAO),
• utlenianie w warunkach nadkrytycznych (supercritical water oxidation - SCWO),
• utlenianie elektrochemiczne,
• utlenianie przy pomocy ozonu i nadtlenku wodoru,
• reakcja Fentona
Procesy fotochemiczne wykorzystywane do oczyszczania wody i ścieków:
• fotoliza UV,
• procesy z zastosowaniem UV/H
2
O
2
,
• procesy z zastosowaniem UV/O
3
,
• procesy z zastosowaniem UV/H
2
O
2
/O
3
,
• degradacja fotokatalityczna w wodnych zawiesinach półprzewodników,
• reakcja foto-Fentona,
• procesy z zastosowaniem ultradźwięków [Prousek 1996].
Do wspólnych cech metod NPU zaliczamy:
• zanieczyszczenia organiczne ulegają rozkładowi do dwutlenku węgla, wody i
amoniaku (lub azotu) oraz do prostych związków takich jak niskocząsteczkowe
kwasy organiczne (kwas octowy i mrówkowy),
• w układach reakcyjnych generowany jest utleniacz o wysokim potencjale
utleniającym. Dominuje mechanizm wolnorodnikowy, a jednym z najistotniejszych

4
reagentów jest rodnik hydroksylowy OH
•
posiadający jeden z najwyższych
potencjałów utleniająco-redukujących co pozwala na utlenianie nawet bardzo
trwałych związków chemicznych,
• wysokie potencjały utleniające powodują, że NPU należą do metod nieselektywnych
– utlenieniu ulegają praktycznie wszystkie grupy związków organicznych i
nieutlenione formy związków nieorganicznych.
Poszczególne metody NPU różnią się przede wszystkim sposobem generowania rodnika
hydroksylowego. Utleniają związków organicznych zachodzi według jeden z trzech
mechanizmów:
• rodnik hydroksylowy pobiera elektron od substancji organicznej tworząc nowy
rodnik, sam redukując się jednocześnie do jonu hydroksylowego - jest to reakcja
przeniesienia elektronu,
• odszczepienie od cząsteczki atomu wodoru. W trakcie tego procesu powstaje rodnik
organiczny i woda - jest to reakcja przeniesienia atomu wodoru,
• addycja rodnika hydroksylowego do podwójnego wiązania w alkenach i w związkach
aromatycznych, co prowadzi do powstania rodnika na atomie węgla - jest to reakcja
addycji rodnika hydroksylowego.
Pomimo wspólnego mechanizmu, techniki zaawansowanego utleniania można podzielić na
dwie zasadnicze grupy:
• technologie przebiegające pod ciśnieniem atmosferycznym i w temperaturze
otoczenia (min. ozonoliza i fotoutlenianie),
• technologie wymagające zastosowania podwyższonych temperatur i ciśnienia (mokre
utlenianie i utlenianie z zastosowaniem wody w stanie nadkrytycznym).

5
2.1. Mokre utlenianie powietrzem
Mokre utlenianie to proces wykorzystywany w technologii ochrony środowiska do usuwania
zanieczyszczeń zawartych w ściekach, prowadzony w fazie ciekłej, w podwyższonej
temperaturze (od 100 do 300°C ) i pod zwiększonym ciśnieniem ( od 0,5 do 20MPa), przy
pomocy powietrza lub tlenu tłoczonego do środowiska reakcji. W tych warunkach w układzie
reakcyjnym zapoczątkowany zostaje cykl przemian chemicznych, który polega na
destruktywnym, wolnorodnikowym utlenianiu substratów i produktów przejściowych,
prowadzący do degradacji związków organicznych na związki o mniejszej masie
cząsteczkowej.
W trakcie procesu węgiel organiczny utleniany jest do CO
2
, azot organiczny do amoniaku lub
wolnego azotu, a chlorki organiczne i siarczki są przekształcane w nieorganiczne chlorki i
siarczany. Skuteczność metody opiera się na dwóch korzystnych cechach tego systemu
reakcyjnego:
• wraz ze wzrostem temperatury powyżej 393K rośnie w znaczący sposób rozpuszczalność tlenu
w roztworach wodnych,
• podwyższanie temperatury zwiększa szybkość reakcji chemicznych i poprawia efektywność
wytwarzania wolnych rodników w układzie.
Te cechy mokrego utleniania powodują, że jest to proces wysoce nieselektywny (reakcjom
utleniania ulegają praktycznie wszystkie grupy związków organicznych obecne w roztworze), a
wysoka temperatura procesu pozwala osiągnąć znaczące stopnie przereagowania substratów i
produktów przejściowych sięgające od 70 aż do 100%.
Mokre utlenianie powietrzem prowadzi się w układzie heterogenicznym gaz-ciecz w
następujących etapach:
a) przenoszenie tlenu z fazy gazowej na granicę fazy gaz-ciecz,
b) przenoszenie tlenu rozpuszczonego z granicy faz gaz-ciecz do masy cieczy
c)
reakcja chemiczna pomiędzy tlenem rozpuszczonym a substratami
.
Proces mokrego utleniania jest efektywny, gdy:
• unieszkodliwia się tą metodą zanieczyszczenia toksyczne i niedegradowalne konwencjonalnymi
metodami, w tym biologicznymi,
• stężenie zanieczyszczeń w odpadach ciekłych lub półpłynnych zawiera się w granicach 1,5%-
20% wagowych,
• ilość oczyszczanych ścieków nie jest mniejsza niż 15-20 m
3
/dobę.
Na przestrzeni lat proces mokrego utleniania znalazł zastosowanie min.:
• do usuwaniu ze ścieków glikoli, detergentów, fenoli, naftoli i ich pochodnych, pestycydów oraz
olejów i żywic syntetycznych,
• do oczyszczania strumieni ścieków, które są zbyt rozcieńczone do spalania i zbyt stężone do
oczyszczania biologicznego,
• do oczyszczaniu ścieków pochodzących z przemysłu spirytusowego (głównie z procesu destylacji
brzeczki fermentacyjnej),
• do utleniania ścieków zawierających cyjanki i nitryle pochodzące z procesów galwanizerskich, z
pieców koksowniczych i z procesów syntezy farmaceutycznej,
• do utleniania glikoli polietylenowych i środków powierzchniowo czynnych,
• do regeneracji węgli aktywnych wykorzystywanych do oczyszczania ścieków zawierających
toksyczne i odpadowe związki organiczne (Zarzycki 2002).
W chwili obecnej na świecie pracuje ok. 400 przemysłowych instalacji mokrego utleniania. Do
najbardziej popularnych należy instalacja ZIMPRO® (USA) działająca w oparciu o
przepływowy reaktor wieżowy, który składa się z pionowego zbiornika zasilanego od dołu
cieczą i gazem. Przepływ w reaktorze ma charakter laminarny, a produkty są odprowadzane z
wierzchołka reaktora. Schemat instalacji ZIMPRO® przedstawiono na Rys. 1.
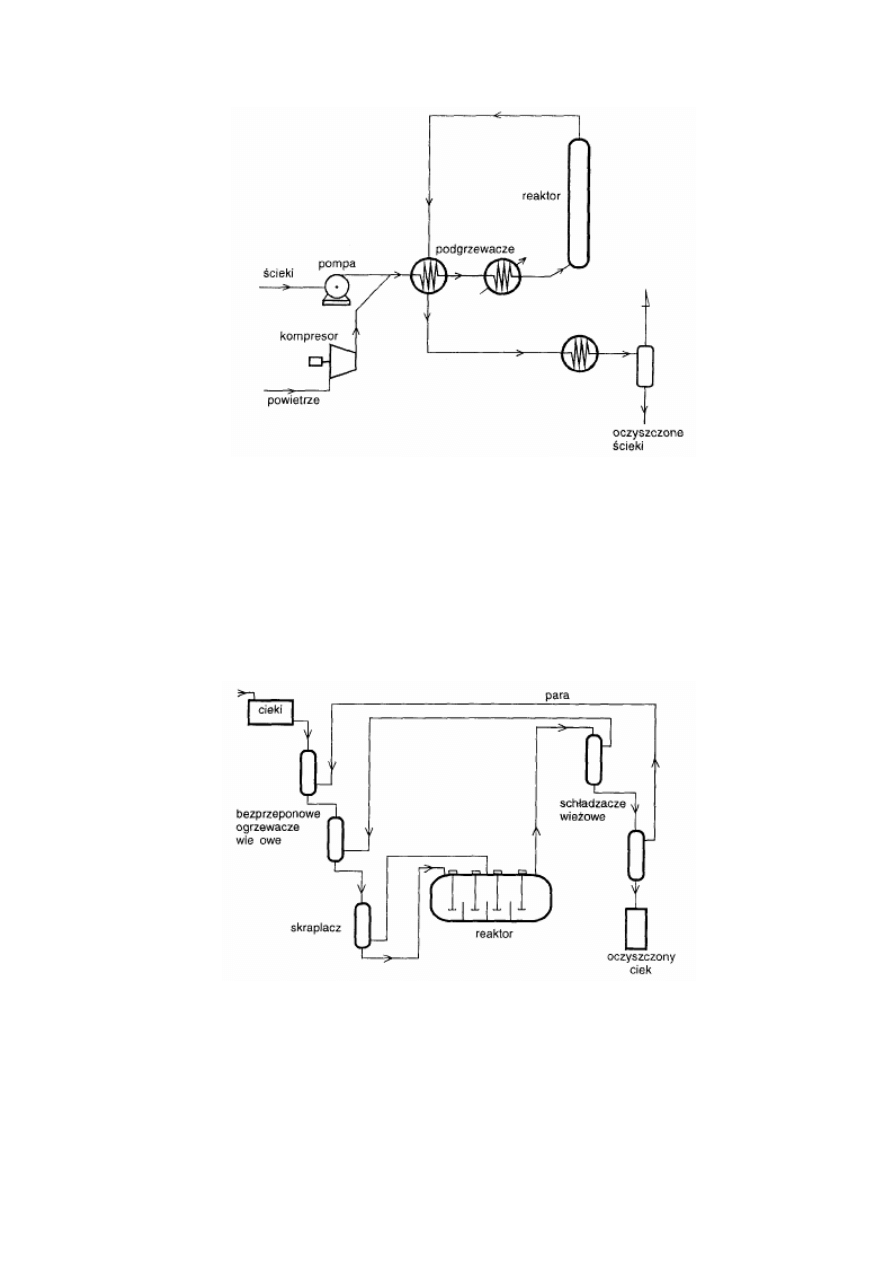
6
Rysunek 1 Schemat instalacji ZIMPRO®.
Ścieki zawierające łatwo osadzające się zawiesiny można oczyszczać metodą WETOX®.
Proces utleniania biegnie w wysokociśnieniowym reaktorze składającym się z poziomego
zbiornika, podzielonego na sekcje, z których każda posiada niezależne zasilanie w powietrze
oraz mieszadło. Urządzenie pracuje w oparciu o ideę kaskady reaktorów z idealnym
wymieszaniem. Zaletą reaktora jest możliwość oczyszczania ścieków zawierających łatwo
sedymentujące zawiesiny, a wadą – zastosowanie mieszadeł, których wały napędowe
wyprowadzone są przez ścianę reaktora na zewnątrz, co wymaga kosztownych uszczelnień i
specjalnego łożyskowania. Schemat instalacji przedstawiono na Rys. 2.
Rysunek 2 Schemat instalacji typu WETOX®.
2.2.Utlenianie w stanie nadkrytycznym
W ostatnich latach odkryto szereg zastosowań dla znanego od dawna stanu termodynamicznego
substancji jakim jest płyn nadkrytyczny. Szczególne miejsce jako medium obok dwutlenku
węgla zajęła woda, zwłaszcza w obszarze zorientowanym na ochronę środowiska, gdyż okazała
się ona niezwykle obiecującym środowiskiem reakcji utleniania zanieczyszczeń i odpadów
organicznych. Utlenianie w wodzie w stanie nadkrytycznym prowadzi się powyżej punktu
krytycznego wody (>22 MPa i 374°C).
7
Podobieństwo utleniania w stanie nadkrytycznym do innych procesów utleniania na mokro jest
jednak tylko formalne, ponieważ powyżej punktu krytycznego w mieszaninie reakcyjnej mamy
do czynienia z procesem jednofazowym, a zatem kinetyka procesu leży wyłącznie w obszarze
kinetyki chemicznej. Woda w stanie nadkrytycznym zmienia swoje własności jako
rozpuszczalnik - z jonowych na niejonowe. Utleniania w wodzie nadkrytycznej w stosunku do
klasycznych metod termicznych zapewnia praktycznie całkowitą mineralizację, stwarza
możliwość prowadzenia procesu w obiegu zamkniętym, w środowisku bardziej
skoncentrowanym, w niższej temperaturze, a w szczególności eliminuje efekt wtórnych emisji
gazowych. W punkcie nadkrytycznym objętość wody jest 3-krotnie większa niż w warunkach
normalnych (d=0.322 g٠cm
3
), a stała dielektryczna ε wynosi tylko 5,3. W efekcie, w
warunkach prowadzenia procesu utleniania, w temperaturze około 400°C i dla ciśnienia
pomiędzy 23-26 MPa, woda występuje w postaci gęstego gazu. Substancje organiczne, w tym
również węglowodory, oraz tlen cząsteczkowy stają się wzajemnie rozpuszczalne z wodą,
podczas gdy sole nieorganiczne ulegają wytrąceniu z roztworu. Te unikalne właściwości wody
w stanie nadkrytycznym pozwalają na kontakt tlenu i związków organicznych w jednej fazie, w
której następuje gwałtowne i kompletne utlenianie substancji organicznych w temperaturach
550-650°C. W tych warunkach stopień konwersji może wynosić ponad 99.99% dla
jednominutowego czasu zatrzymania w aparacie.
Utlenianie w stanie nadkrytycznym znalazło zastosowanie min.:
• do utleniania substancji uznanych za szczególnie niebezpieczne lub uciążliwe dla środowiska z
powodu swojej toksyczności przy jednoczesnej odporności na utlenianie (nitrofenole,
chlorowcopochodne alifatyczne i aromatyczne, polichlorowane bifenyle i dioksyny),
• do utylizacji substancji toksycznych i niebezpiecznych związanych z obroną narodową,
• w procesach utleniania np. tlenku węgla, wodoru, amoniaku, metanu czy kwasu octowego,
•
do utleniania odpadów, ścieków z przemysłu papierniczego oraz nadmiarowych osadów czynnych
z oczyszczalni komunalnych i przemysłowych
.
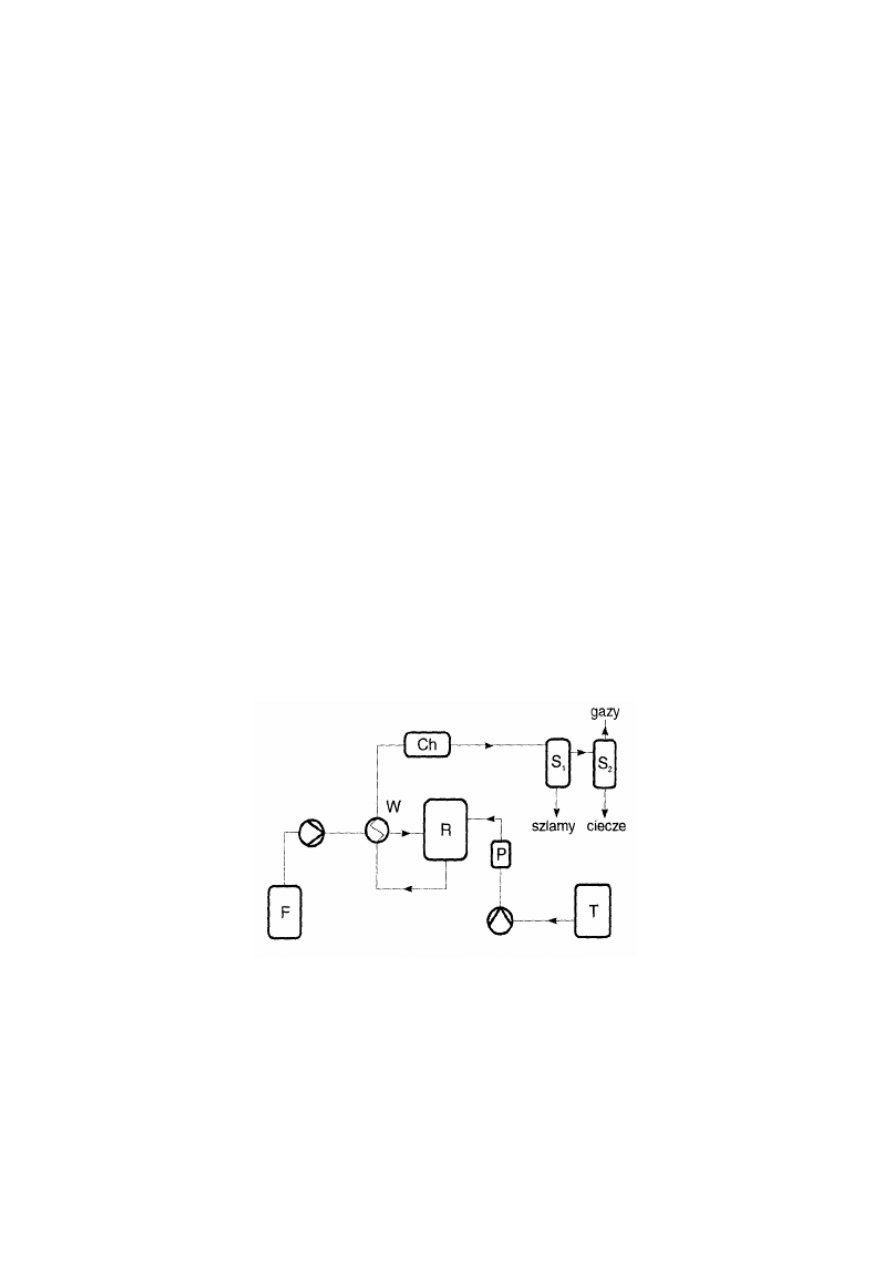
Schemat instalacji procesu utleniania w wodzie nadkrytycznej (metoda MODEC®)
przedstawiono na Rys. 3.
Rysunek 3 Schemat procesu utleniania w wodzie nadkrytycznej.
W ogólnym zarysie proces przebiega następująco: surówkę przygotowaną w zbiorniku (F)
stanowi roztwór lub drobna zawiesina substancji organicznej. Jako utleniacz stosuje się ciekły
tlen, który ze zbiornika (T) pompowany jest wysokociśnieniowa pompą przez parownik (P).
Surówka i utleniacz spotykają się w reaktorze (R). Reaktor jako najważniejsza cześć instalacji,
musi spełniać cztery podstawowe warunki:
• czas przebywania musi gwarantować dostatecznie głębokie utlenienie,
• odporność na korozyjne środowiska reakcji,
• warunki hydrodynamiczne uwzględniające wytrącanie się części produktów reakcji,
•
zdolność zagospodarowania ciepła reakcji.

8
Strumień poreakcyjny, po opuszczeniu reaktora, oddaje ciepło strumieniowi w układzie
wymiany ciepła (W). Elementy instalacji stanowi również układ końcowego chłodzenia (Ch) i
rozdziału produktów reakcji S
1
, S
2
.
2.3.Utlenianie elektrochemiczne
Jedną z większych zalet elektrochemii jest to, że na powierzchni elektrod wytwarzane są i
zużywane tylko elektrony, zapewniając tym samym "czyste reagenty" i nie przyczyniając się do
dalszego wzrostu ilości i liczby związków chemicznych w środowisku, co często ma miejsce w
innych procesach. Wadą procesu jest z kolei konieczność rozcieńczania ścieków oraz wymóg
znacznego przewodnictwa właściwego roztworu. Większość badań laboratoryjnych prowadzi
się w roztworach soli o stężeniu powyżej 0,l mol/dm
3
. W praktyce ścieki są mieszane z wodą
morską (lub roztworem solanki) i poddawane elektrolizie z wydzielaniem chloru. Sole
magnezowe obecne w wodach morskich oraz jony hydroksylowe powstające na katodzie
prowadzą do powstawania wodorotlenku magnezu. Wodorotlenek magnezu jest ważnym
czynnikiem w procesie flokulacji oraz sedymentacji rozproszonych cząstek, adsorpcji
rozpuszczonych fosforanów i tworzenia nierozpuszczalnych związków fosforu.
Oczyszczanie ścieków metodą elektrochemiczna stosuje się min.:
• do oczyszczania ścieków z przemysłu celulozowo-papierniczego i tekstylnego
• w celu konwersji radioaktywnych organicznych odpadów w substancje akceptowane z punktu
widzenia ochrony środowiska
• do unieszkodliwienia substancji organicznych o różnym stanie skupienia i różnej
rozpuszczalności jak również różnej zawartości wody.
Mechanizm utleniania elektrochemicznego w roztworach wodnych jest bardzo złożony.
Przyjmuje się, że istnieją trzy możliwe mechanizmy przebiegu procesu:
• elektrokoagulacja,
• elektroflotacja,
• elektroutlenianie.
2.4. Utlenianie przy pomocy ozonu i nadtlenku wodoru.
W wielu krajach ozon jest najszerzej stosowaną substancją wykorzystywaną do oczyszczania
wody pitnej. Stosuje się go także do utleniania zanieczyszczeń w przypadku ścieków
przemysłowych. Jedną z głównych zalet stosowania ozonu jest jego korzystny wpływ na
środowisko. Produkty reakcji ozonu ze związkami chemicznymi stanowiącymi
zanieczyszczenia wody są najczęściej nietoksyczne oraz biodegradowalne, a sam ozon rozpada
się tworząc tlen.
Ozon znany jest jako najbardziej selektywny utleniacz. Reakcje utleniania zapoczątkowane
przez ozon w roztworach wodnych są głównie reakcjami złożonymi. Ozon może reagować z
substancjami organicznymi na dwa sposoby: bezpośrednio lub poprzez rodniki (utleniacz
wtórny). Obecność substancji rozpuszczonych ma wpływ na sposób utleniania i tym samym na
otrzymywane produkty końcowe.
Powszechnie wiadomo, że ozon może reagować z substancjami organicznymi różnymi
mechanizmami. Najprostszym z nich jest podstawowa reakcja ozonu z cząsteczką organiczną.
Jednak większość reakcji zachodzi prawdopodobnie pomiędzy substancją organiczną a
rodnikami hydroksylowymi.

9
RH + HO
.
-H
2
O
R ROO
.
.
O
2
RH R
.
.
+
-OH -
HOR H
.
-H
+
Potencjał utleniania ozonu wynosi 2,07 V, natomiast potencjał utleniania nadtlenku wodoru
wynosi 1,77 V. W związku z tym nadtlenek wodoru jest również stosowany jako utleniacz w
procesach uzdatniania ścieków. Często stosuje się obydwa utleniacze razem. Zastosowanie
nadtlenku wodoru znacznie obniża koszty uzdatniania ścieków w porównaniu z zastosowaniem
samego ozonu. Prawdopodobny mechanizm reakcji przedstawiono poniżej:
+
−
+
⇔
H
HOO
O
H
2
2
−
•
•
−
+
→
+
3
3
O
HOO
O
HOO
Ozonowanie stosuje się min.:
• do uzdatniania wody pitnej ( utlenianie i wytracanie związków żelaza i manganu, poprawa smaku,
utlenienie związków organicznych itp.),
• do uzdatniania wody w basenach ,
• do uzdatniania wody technologicznej (w obiegach chłodniczych, wody procesowej w przemyśle
materiałów półprzewodnikowych, w zakładach pralniczych)
• do oczyszczania ścieków komunalnych , przemysłowych oraz odcieków (dezynfekcja ścieków
komunalnych, utlenienie związków organicznych, poprawa pracy biofiltrów)
2.5. Reakcja Fentona
Ponad sto lat temu, J.H. Fenton (1884) odkrył, że jony Fe
2+
silnie katalizują reakcję utleniania
nadtlenkiem wodoru niektórych kwasów organicznych. Późniejsze badania wykazały, że
mieszanina H
2
O
2
i Fe
2+
jest w stanie utlenić wiele innych substancji organicznych w
umiarkowanych temperaturach i pod normalnym ciśnieniem. Reakcja stała się jedną z
najbardziej skutecznych technik utleniania NPU. Obecnie do procesów NPU wykorzystujących
nadtlenek wodoru, oprócz klasycznej reakcji Fentona, zalicza się również reakcje w układach
H
2
O
2
/Fe
2+
, H
2
O
2
/Fe
2+
/UV oraz H
2
O
2
/Fe
3+
/UV. Badania nad mechanizmem utleniania wykazały
powstawanie rodników hydroksylowych poprzez katalityczny rozkład nadtlenku wodoru w
roztworze kwaśnym. W wyniku reakcji Fentona powstaje jon żelazowy, rodnik hydroksylowy
(OH
•
) oraz jon hydroksylowy (OH
-
).
•
−
+
+
+
+
→
+
HO
OH
Fe
O
H
Fe
3
2
2
2
RH
R
Fe
Fe
R
H
⎯→
⎯
+
→
+
+
−
+
+
•
3
2
Efekt utleniający reagentów Fentona silnie zależy od:
• pH roztworu,
• stosunku stężeń H
2
O
2
i Fe
2+
,
• temperatury,
• ilości nadtlenku wodoru w stosunku do ładunku zanieczyszczeń,
•
początkowego stężenia jonów żelaza.
Wraz ze wzrostem stężenia jonów żelaza oraz nadtlenku wodoru wydajność reakcji utleniania
rośnie, jednakże zbyt wysoki stężenie obu reagentów mogą spowodować spadek szybkości
reakcji. Proces utleniania fenolu przebiegał z najwyższą wydajnością przy stosunku molowym
fenol : katalizator : H
2
O
2
równym 1:1:3.
Zakres pH, w którym następuje utlenianie, wynosi od 3 do 5, ale optymalna wartość pH dla
10
reakcji Fentona zawiera się pomiędzy wartością 3 a 4. Natomiast wagowy stosunek ilości
katalizatora do nadtlenku wodoru wynosi 1:5 [Bigda 1995].
Odczynnik Fentona jest efektywnym utleniaczem wielu substancji organicznych i prawie
wszystkie związki organiczne zawierające wodór mogą być utleniane przez rodniki
hydroksylowe, wytwarzane w reakcji Fentona. Do grupy związków chemicznych, dla których
reakcja Fentona nie może być skutecznie stosowana należą np. kwas octowy, aceton,
chloroform, chlorem metylenu, n-parafiny.
Główną zaletą procesu Fentona, w porównaniu z innymi metodami oczyszczania ścieków, jest
brak pozostałości H
2
O
2
w układzie poreakcyjnym oraz katalityczne tylko ilości Fe
2+
stosowane
w reakcji. Ponadto reakcję Fentona prowadzi się w temperaturze otoczenia lub trochę wyższej
(293-303K) wykorzystując do ogrzania mieszaniny ciepło reakcji. Stanowi to istotną zaletę tego
procesu, ponieważ nie wymaga instalowania wymiennika ciepła w reaktorze, a energia jest
wykorzystywana na mieszanie i dozowanie reagentów. Reakcja Fentona jest stosowana
zarówno do oczyszczania wstępnego, jak też do obniżenia ChZT przed dalszym biologicznym
oczyszczaniem ścieków, lub w celu mineralizacji toksycznych i trudno biodegradowalnych
zanieczyszczeń.
Proces Fentona zastosowano do kilku rodzajów ścieków:
• wód procesowych powstających podczas syntezy chemikaliów, leków, insektycydów,
barwników, materiałów wybuchowych (TNT, RDX);
• ścieków z rafinerii;
• ścieków z produkcji polimerów zawierających fenol czy formaldehyd;
• ścieków powstających w przemyśle drzewnym zawierających m.in. krezotole i związki miedzi;
•
ścieków powstających w wyniku oczyszczania gleby [Bigda 1995].
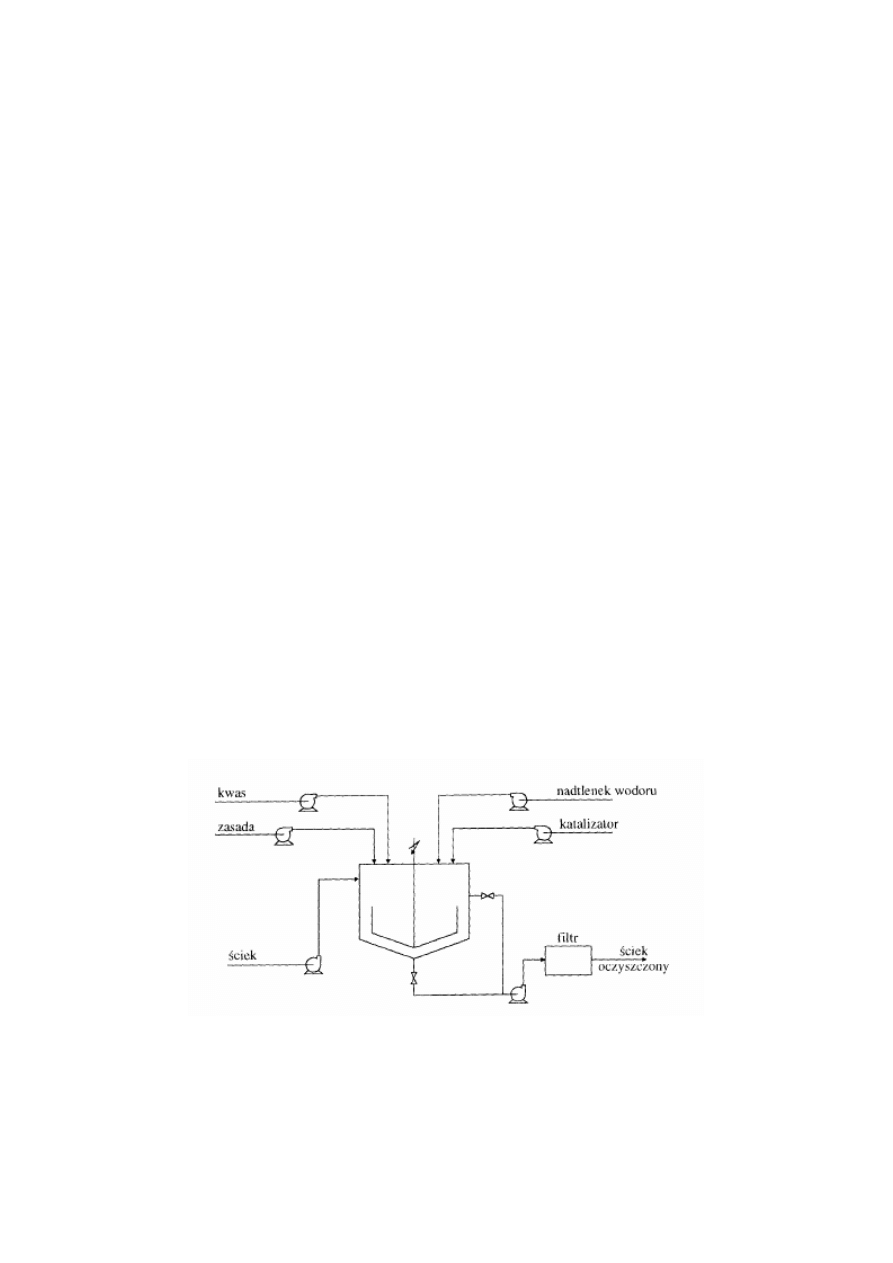
Utlenianie ścieków w warunkach przemysłowych prowadzi się w bezciśnieniowych reaktorach
o działaniu okresowym. Typowym reaktorem jest bezciśnieniowy zbiornik z mieszadłem.
Sterowanie procesem odbywa się na podstawie wskazań czujników, które mierzą w sposób
ciągły temperaturę, pH oraz potencjał utleniająco-redukujący. Schemat reaktora do utleniania
ścieków przy użyciu odczynnika Fentona przedstawia Rys. 4.
Rysunek 4 Schemat reaktora do prowadzenia reakcji Fentona.
Dozowanie reagentów odbywa się za pomocą pomp dozujących. Zbiornik napełnia się najpierw
ściekiem, a następnie koryguje pH (przed dodanie katalizatora) za pomocą rozcieńczonego
kwasu siarkowego.
Podsumowując, reakcja Fentona umożliwia:
• rozkład związków organicznych,
• redukcję toksyczności,

11
• poprawę biodegradowlaności,
• zmniejszenie BZT/ChZT,
• redukcje OWO,
• odbarwienie, usuwanie zapachu.
2.6. Fotoliza UV
Fotoliza UV jest pierwszą fotochemiczną metodą zastosowaną do degradacji zanieczyszczeń.
Bezpośrednia fotoliza polega na wzbudzeniu cząsteczki przez absorpcję fotonu, czego efektem
jest reakcja chemiczna. Bezpośrednim efektem działania promieniowania UV może być:
• przekształcenie związków organicznych w inne,
• zerwanie wiązań chemicznych,
•
całkowita degradacja związków organicznych
.
Promieniowanie UV powoduje dysocjację związków utleniających i tworzenia się wysoce
reaktywnych rodników zdolnych do degradacji zanieczyszczeń organicznych. Bezpośrednia
degradacja fotochemiczna za pomocą promieniowania UV następuje tylko w przypadku, kiedy
światło padające jest absorbowane przez zanieczyszczenie. Wysoko fluorowane lub chlorowane
nasycone związki alifatyczne mogą być efektywnie eliminowane poprzez homolizę wiązań
węgiel-halogen. Odpowiednie energie wzbudzenia wynoszą < 190 nm dla wiązań C-F i 210-
230 nm dla wiązań C-C1.
Fotoliza UV jest wykorzystywana do eliminacji:
• chlorowanych i nitrowanych związków aromatycznych,
• fenoli,
•
halogenowanych związków alifatycznych
.
2.7 Proces z zastosowaniem H
2
O
2
/UV
W procesie pogłębionego utleniania z udziałem nadtlenku wodoru i promieniowania UV
rodniki hydroksylowe są generowane w wyniki fotolizy nadtlenku wodoru. Powszechnie
akceptowany mechanizm fotolizy H
2
O
2
to homoliza wiązania tlen-tlen z utworzeniem dwóch
rodników hydroksylowych.
Zaletą zastosowania H
2
O
2
jako utleniacza, w porównaniu z innymi metodami chemicznego lub
fotochemicznego oczyszczania ścieków, jest jego powszechna dostępność, stabilność
termiczna, całkowita rozpuszczalność w wodzie, oraz znacznie niższy koszt niż w przypadku
zastosowania np. ozonu. Główną wadą wszystkich procesów utleniania degradacyjnego,
opartych na reaktywności rodników hydroksylowych, jest efektywne wychwytywanie rodników
HO
•
przez jony HCO
3
-
i CO
3
2-
, obecne w wodach i ściekach. W efekcie powstają anionorodniki
karboksylowe, również o właściwościach utleniających, ale ich potencjał utleniający jest niższy
od potencjału rodników hydroksylowych. W procesach degradacji w układzie H
2
O
2
/UV
najczęściej stosowanym źródłem światła jest niskociśnieniowa lampa rtęciowa. Emituje ona
głównie promieniowanie o długości fali 253,7nm, co stanowi ok. 70% energii świetlnej
emitowanej przez lampę. Jeżeli do roztworu wodnego nadtlenku wodór, naświetlanego
promieniowaniem UV, zostaną wprowadzone substancje organiczne, to zostaną one włączone
w cykl reakcji łańcuchowych rozkładu H
2
O
2
.(Rys.5).

12
Rysunek 5 Mechanizm utleniania w układzie H
2
O
2
/UV.
2.8. Procesy z zastosowaniem ozonu
Ozon może reagować z fenolem na dwa sposoby [Langlais 1991]:
• w środowisku kwaśnym lub obojętnym - podczas reakcji zachodzi atak elektrofilowy
utleniacza na fenol, w pozycji orto lub para,
• w środowisku obojętnym lub zasadowym - podczas reakcji następuje atak elektrofilowy
na jon fenolanowy lub reakcja przebiega mechanizmem rodnikowym, inicjowana
zarówno przez grupę hydroksylową, jak i jon fenolanowy.
Fenole łatwo i gwałtownie ulegają utlenianiu przez ozon. Utlenianie fenolu przebiega
wielostopniowo z powstawaniem produktów pośrednich utlenianych do coraz mniej złożonych
związków, niewyczuwalnych organoleptycznie w wodzie. Stopień utleniania fenolu ozonem
jest wprost proporcjonalny do dawki ozonu. W przypadku małych dawek produktami utleniania
fenoli są hydrochinony [Kowal 1996]. Początkowe produkty utleniania wykazują większą
toksyczność od produktu wyjściowego, dlatego musi być dostarczona odpowiednia ilość ozonu
w celu utlenienia pośrednich produktów. Warunki te są bardzo istotne w przypadku
konwencjonalnego ozonowania [Langlais 1991].
Podczas rozpadu ozonu pojawiają się następujące produkty (rysunek l) [Langlais 1991]:
• produkty będące rezultatem hydroksylowania pierścienia, takie jak chinony i difenole,
• produkty pochodzące z rozbicia łańcucha, takie jak kwas mukonowy i pochodne,
• końcowe produkty utleniania, takie jak kwas glioksylowy, kwas szczawiowy, kwas
mrówkowy i glioksal.
Produkty takie jak pirokatechina, hydrochinon, pojawiają się na początku przebiegu reakcji i
ich stężenie osiąga maksymalną wartość po około 7,5 min przebiegu procesu. Po około 40 min
reakcji swoje maksymalne stężenie osiągają kwas maleinowy i mukonowy, produkty te ulegają
rozpadowi po około 2 godzinach trwającego procesu. Stężenie produktów końcowych wzrasta
ze zmniejszeniem się stężenia fenolu, osiągają one maksymalne stężenie po około 1,5 godzinie
ozonowania, a nawet po czasie 3 godzin nie zostają całkowicie rozłożone [Trapido 1995].
Do otwarcia pierścienia fenolanowego potrzeba od 4 do 6 moli ozonu na mol fenolu.
Reakcje zachodzące pomiędzy fenolem i ozonem w wodnym roztworze wyglądają następująco:
C
6
H
5
OH ↔ C
6
H
5
O
-
+ H
+
C
6
H
5
OH + OH
-
↔ C
6
H
5
O
-
+ H
2
O
C
6
H
5
O
-
+ O
3
→
Produkty
Proces całkowitego utleniania fenolu można opisać ogólnym równaniem:
C
6
H
5
OH + 14 O
3
→ 6 CO
2
+ 3 H
2
O + 14 O
2
Istotny jest fakt, że zamiast fenolu reaguje z ozonem jon fenolanowy, co ma duży wpływ
na szybkość reakcji [Kowal 1996].

13
2.9. Procesy z zastosowaniem O
3
/UV
Utlenianie związków za pomocą ozonu wspomaganego przez promieniowanie UV jest jednym
z najczęściej stosowanych procesów utleniania różnego rodzaju zanieczyszczeń. Połączone
działanie ozonu i promieniowania UV należy również do technik najbardziej zaawansowanych
w aspekcie technologicznym. Istotą procesów z zastosowaniem ozonu i UV jest fotoliza ozonu
powodująca powstawanie H
2
O
2
.
W ten sposób połączenie UV z ozonowaniem jest bardziej efektywne niż suma tych dwóch
indywidualnych procesów (efekt synergistyczny). Metoda ta wykorzystywana jest w przypadku
związków odpornych na samo ozonowanie. Jest ona najczęściej stosowaną metodą NPU dla
szerokiej gamy zanieczyszczeń. Proces stosuje się w układzie I lub II-stopniowym. W układzie
jednostopniowym ścieki są jednocześnie poddawane działaniu ozonu i naświetlane
promieniowaniem UV. W układzie II-stopniowym ścieki są poddawane ozonowaniu w I
reaktorze i następnie częściowo już utlenione, wraz z ozonem resztkowym, przechodzą do II
reaktora, gdzie są naświetlane promieniowaniem UV.
Wadą metody, jak we wszystkich metodach wykorzystujących ozon, jest niska rozpuszczalność
ozonu w wodzie i związana z tym słaba wymiana masy, duży koszt generowania ozonu oraz
jego korozyjność. Przeprowadzone badania na rzeczywistych ściekach min. z przemysłu
włókienniczego (zarówno ogólnozakładowego jak i z pralni chemicznych) wykazały, że łączne
stosowanie ozonu i promieniowania UV pozwala osiągnąć lepsze rezultaty rozkładu
zanieczyszczeń. Uzależnione jest to od rodzaju ścieku oraz analizowanego parametru.
Najsilniejszy efekt wspomagający widoczny jest w przypadku ścieków silnie stężonych oraz
gdy analizuje się ich odbarwienie (Kos,1998; Perkowski,200).
2.10.Utlenianie w układzie O
3
/H
2
O
2
/UV
Przebieg procesu przy jednoczesnym działaniu trzech czynników jest taki sam pod względem
chemizmu, jak przy równoczesnym działaniu ozonu i promieniowania UV. W tym przypadku
stężenie nadtlenku wodoru w roztworze jest jednak wyższe. Wynika ono zarówno z ilości
pierwotnie wprowadzonej jak i z reakcji bezpośredniego tworzenia H
2
O
2
. Rodniki
hydroksylowe podczas utleniania zanieczyszczeń za pomocą O
3
/H
2
O
2
/UV powstają zgodnie z
równaniami:
H O
HOO
H
2
2
⇔
+
−
+
2
2
3
O
O
HO
HOO
O
+
+
→
+
−
•
•
−
2
3
2
3
O
O
O
O
+
→
+
−
•
−
•
2
2
3
O
HO
HO
O
H
O
+
+
→
+
−
•
−
•
Dodatkowo rodniki hydroksylowe są generowane w reakcji fotochemicznej. Prowadzone są
pilotowe badania zastosowania tej metody na skalę techniczną.
2.11.Degradacja fotokatalityczna w wodnych zawiesinach półprzewodników.
Metodą cieszącą się coraz większym zainteresowaniem jest fotokataliza heterogeniczna z
wykorzystaniem zawiesin półprzewodników. Na powierzchni drobin półprzewodnika zachodzi
fotokatalityczne utlenianie zaadsorbowanej substancji, prowadzące do jej rozpadu. Na przebieg
procesu degradacji ma wpływ szereg czynników. Najważniejsze to:
• dobór właściwego półprzewodnika,
• odpowiednie przygotowanie jego powierzchni,
14
• natężenie padającego światła,
• rozpuszczalnik,
• temperatura,
• dodatkowe substancje znajdujące się w roztworze,
•
pH roztworu (w przypadku roztworów wodnych), [Zarzycki, 2002].
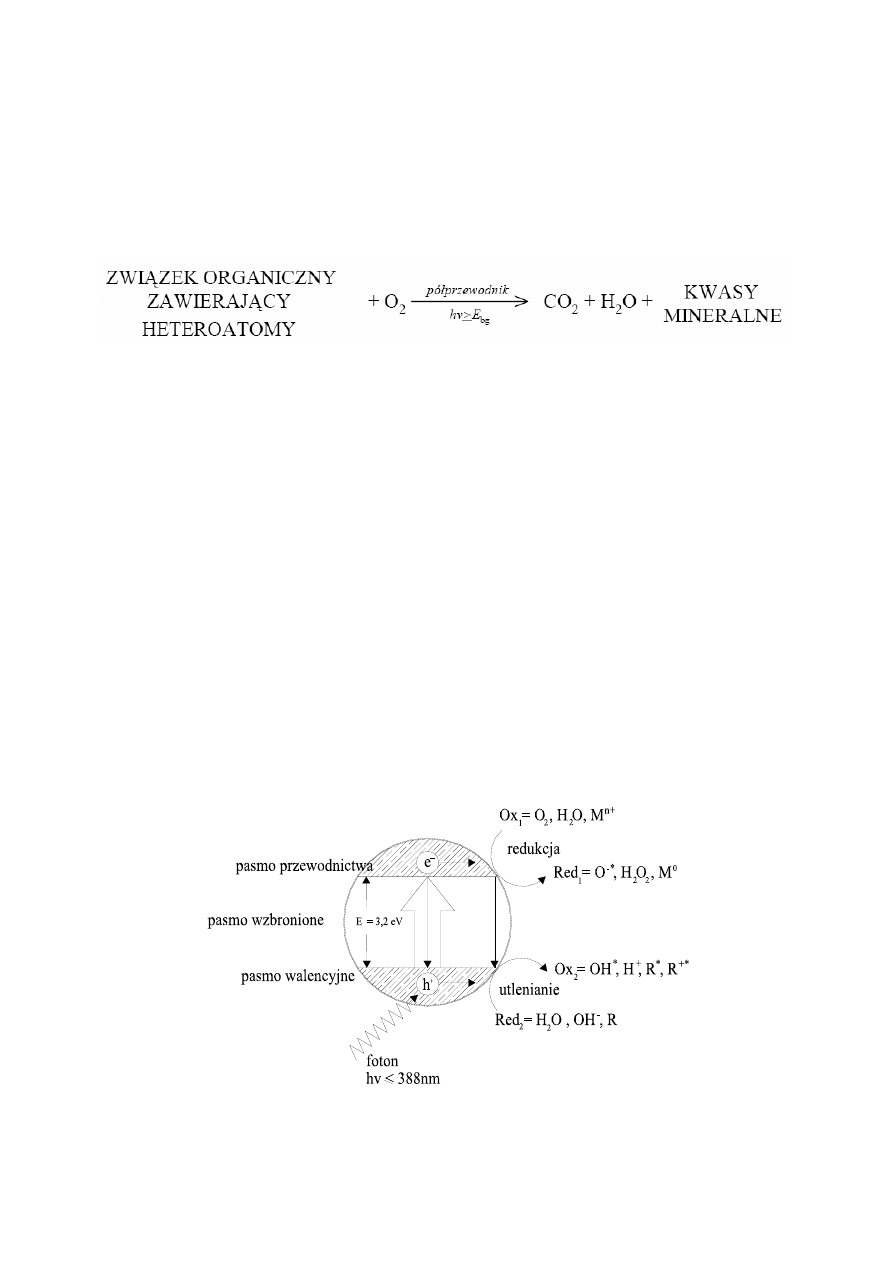
Generalnie reakcję fotokatalizy z zastosowaniem półprzewodników można przedstawić za
pomocą równania:
Większość danych na temat reakcji fotokatalitycznych z zastosowaniem zawiesin
półprzewodników dotyczy tlenków metali (TiO
2
, ZnO, SnO
2
, WO
3
), siarczków (CdS, ZnS),
selenków (CdSe) oraz tellurków (CdTe). Z przebadanych półprzewodników dwutlenek tytanu
wykazał najwyższą aktywność w procesach fotokatalizy. Ponadto TiO
2
, absorbujący tylko
promieniowanie UV (energia pasma wzbronionego E
bg
= 3,2eV) jest tani, nierozpuszczalny w
większości środowisk reakcji, stabilny fotochemicznie i nietoksyczny.
Naświetlanie powierzchni półprzewodnika promieniowaniem o odpowiedniej długości fali
powoduje przeniesienie elektronu z niskoenergetycznego pasma walencyjnego do
wysokoenergetycznego pasma przewodnictwa.
TiO
2
+
2hv→ 2h
+
+ 2e
-
Wygenerowane w ten sposób nośniki ładunków (dziury w paśmie walencyjnym - h
vb
+
, oraz
elektrony w paśmie przewodnictwa e
cb
-
) mogą ulegać rekombinacji w sieci krystalicznej,
powodując fluorescencję lub wydzielenie ciepła, lub mogą migrować na powierzchnię
katalizatora, gdzie biorą udział w reakcjach chemicznych (utleniania lub redukcji). Na granicy
faz elektron – dziura mogą brać udział w reakcji redox z zaadsorbowanymi z roztworu
wodnego cząsteczkami H
2
O, OH
-
, cząsteczkami związków organicznych oraz O
2
. Rodniki
hydroksylowe HO
•
powstają w reakcji utleniania pomiędzy dziurą oraz H
2
O lub OH
-
. Elektron
może brać udział w reakcji redukcji z zaadsorbowanym O
2
(aq) generując O
2
-
, który następnie
może generować dodatkowo H
2
O
2
oraz HO
•
. Schemat mechanizmu fotoaktywacji cząsteczki
tlenku tytanu przedstawiono na Rys. 6.
pw
Rysunek 6 Schemat mechanizmu fotoaktywacji cząsteczki tlenku tytanu (IV).
Fotokatalityczna aktywność TiO
2
pod wpływem promieniowania UV pozwoliła na
wykorzystanie tlenku tytanu do redukcji lub eliminacji zanieczyszczeń w powietrzu (np. NO
x
czy SO
2
), dymu papierosowego oraz lotnych związków emitowanych przez materiały

15
budowlane. Wysoka aktywność fotokatalityczna pozwala ponadto na zastosowanie TiO
2
do
zabezpieczenia przez zabrudzeniami powierzchni ścian (np. w tunelach), szyb okiennych, lamp
oraz tkanin (np. pokryć namiotów). Reaktywność w reakcji fotodestrukcji jest wystarczająca do
niszczenia bakterii, w związku z tym TiO
2
jest dodawany do cementów oraz takich elementów
wyposażenia jak kafelki w pomieszczeniach operacyjnych, celem utrzymania czystości.
Wybrane przykłady zastosowanie TiO
2
przedstawiono w Tab. 1.
Tabela 1 Przykłady produktów, w których wykorzystano fotokatalityczne właściwości TiO
2
Produkt Firma
Systemy zawierające TiO
2
do oczyszczania
powietrza np. eliminacja SO
2
oraz NO
x
Sharp Co, Ltd.
Daikin Ind., Ltd.
Toyota Home, Ltd.,
Furukawa Kikai-Kinzoku, Inc.
Bały papier zawierający TiO
2
Mitsubishi Paper Mills, Inc.
Włókna tekstylne (zawierające TiO
2
) o działaniu
bakteriobójczym
Kurare Inc.
Powierzchnie samoczyszczące (superhydrofilowe)
– szyby samoczyszczące
Pilkington
Tkaniny namiotowe z samoczyszczącą
powierzchnią
Taiyo Ind. Ltd.
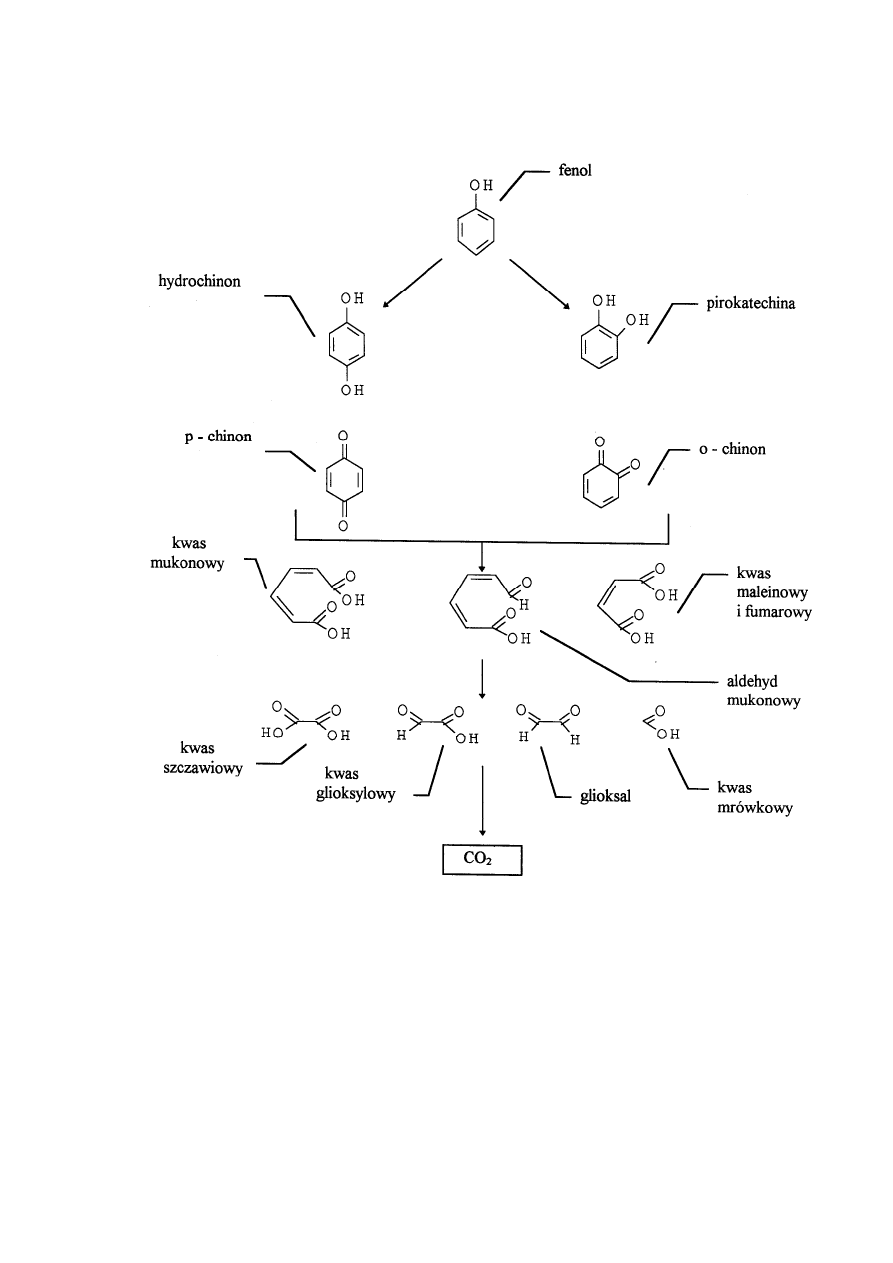
16
Rysunek 7 Schemat rozpadu fenolu uwzględnieniem produktów pośrednich [Langlais 1991].

3. LITERATURA
Barrat P.A., Baumgartl A., Hannay N., Vetter M., Xiong F. (1996), CHEMOX™ Advanced Waste
Water Treatment with the Impinging Zone Reactor, „Oxidation Technologies for Water and
Wastewater Treatment" Goslar, Germany, May 12-15 1996
Bigda R.J., Consider Fenton's chemistry for wastewater treatment, Chemical Engineering Progress
12, 62-66, 1995
Braun A.M., Oliveros E. (1996), How to evaluate photochemical methods for water treatment
Intemational Conference „Oxidation Technologies for Water and Wastewater Treatment" Goslar,
Germany, May 12-15 1996
Fox M.A., Dulay M.T., Heterogeneous photocatalysis, Chem. Rev. 93, 341-357, 1993
Hoigne J., Intercalibration of OH radical sources and water quality parameters. Intemational
Conference „Oxidation Technologies for Water and Wastewater Treatment" Goslar, Germany, May
12-15 J996 Goslar, Germany, May 12-15 1996
Guha AK., Shanbhag P. V., Sirkar K.K., Multiphase ozonołysiis oforganics m wastewater by a novel
membranę reactor, AlChE Joumal 41 (8), (1995)
Kowal AL., Świderska-Bróż M., Oczyszczanie wody, PWN Warszawa (1996)
Langlais B, Reckhow D.A., Brink D.R., Ozone in water treatment. Application and Engineering,
AWWA Research Foundation & Lewis Publisher (1991)
Legrini O., Oliveros E., Braun A. M., Photochemical Processes for Water Treatment, Chem. Rev. 93,
671-698, 1993,
Luck F., A review ofindustrial catałytic wet air Oxidation processes, Catalysis Today 27, 195 -202
(1996)
Prousek J. (1996), Advanced Oxidation process for water treatment. Chemical process, Chem. Listy
90, 229-23
Prousek J. (1996), Advanced Oxidation process for water treatment. Photochemical process, Chem.
Listy 90, 307-315
Roche P., Volk C., Carbonnier F., Paillard H., Ozone Science & Engineering 16, 135-55 (1994)
Trapido M., Yaressinina Y., Munter R., Ozonation of phenols in wastewater from oil shale chemical
treatment, Environmental Technology 16 (30), 233-241 (1995)
Zarzycki R., Imbierowicz M., Rogacki G., Filipiak T., Nowoczesne metody unieszkodliwiania
odpadów. Mat. seminarium naukowego "Ochrona środowiska w przemyśle - techniki i technologie".
Łódź, (1996)
„Zaawansowane techniki utleniania w ochronie środowiska” pod redakcją Romana Zarzyckiego
Łódź, (2002)
18
4.
UTLENIANIE WODNEGO ROZTWORU FENOLU METODĄ FENTONA
4.1. Cel ćwiczenia
Celem ćwiczenia jest zbadanie kinetyki utleniania roztworu wodnego fenolu w zadanych
warunkach procesu Fentona.
4.2. Aparatura i sprzęt
1. Zestaw aparatury do utleniania (Rys. 8)
2. Kolorymetr spektralny "Spekol" z przystawką do pomiaru absorpcji
3. pH-metr z rejestratorem
4. Waga analityczna
5. Zestaw aparatury do oznaczania ChZT
6. Szkło i odczynniki
4.3. Budowa i działanie aparatury do utleniania metodą Fentona
Do badania kinetyki utleniania metodą Fentona stosuje się zestaw aparaturowy
przedstawiony schematycznie na rys. 8. Modelowy roztwór ścieków umieszcza się w szklanym
reaktorze (1). Roztwory katalizatora oraz nadtlenku wodoru umieszczone są w wkraplaczach
(2). Zawartość kolby reakcyjnej jest mieszana mieszadłem magnetycznym (3).
4.4. Sposób przeprowadzenia pomiarów
Utlenienie roztworu fenolu
Pomiar kinetyki utleniania fenolu metodą Fentona przeprowadza się zgodnie z procedurą:
a) napełnić szklany reaktor (1) 1dm
3
modelowego roztworu fenolu o stężeniu ok. 50
mg/dm
3
oraz 0,5dm
3
wody destylowanej. Odczyn roztworu należy uprzednio
doprowadzić do pH = 3-4 za pomocą roztworu kwasu siarkowego. Kwaśny odczyn
roztworu zapobiega wytrącaniu się wodorotlenku żelaza po dodaniu katalizatora,
b) włączyć mieszadło magnetyczne i ustawić żądaną prędkość obrotów,
c) jeden z wkraplaczy (2) napełnić roztworem siarczanu żelazawego do objętości 10 cm
3
.
Roztwór katalizatora sporządza się następująco: 4,6 g FeSO
4
·7H
2
O rozpuścić w wodzie
destylowanej, skorygować pH za pomocą kwasu siarkowego do wartości 3-4 i
rozcieńczyć do objętości 100 cm
3
wodą destylowaną,
d) drugi wkraplacz (2) napełnić 30% roztworem nadtlenku wodoru do objętości 1,5 cm
3
,
e) dodawać równocześnie oba roztwory, intensywnie mieszając,
f) utlenianie prowadzić przez 15 min., pobierając próbki roztworu do kolbek miarowych o
objętości 25 cm
3
co 5 min.(NIE ZAPOMINAJĄC O PRÓBCE „0”), z czego 10 cm
3
przeznaczyć do oznaczania fenolu, 10 cm
3
do wyznaczania ChZT, a pozostałe 5 cm
3
do
ewentualnego powtórzenia któregoś z dwu oznaczeń – uwaga: próbki po pobraniu
zalkalizować (za pomocą roztworu NaOH) w celu zatrzymania reakcji.
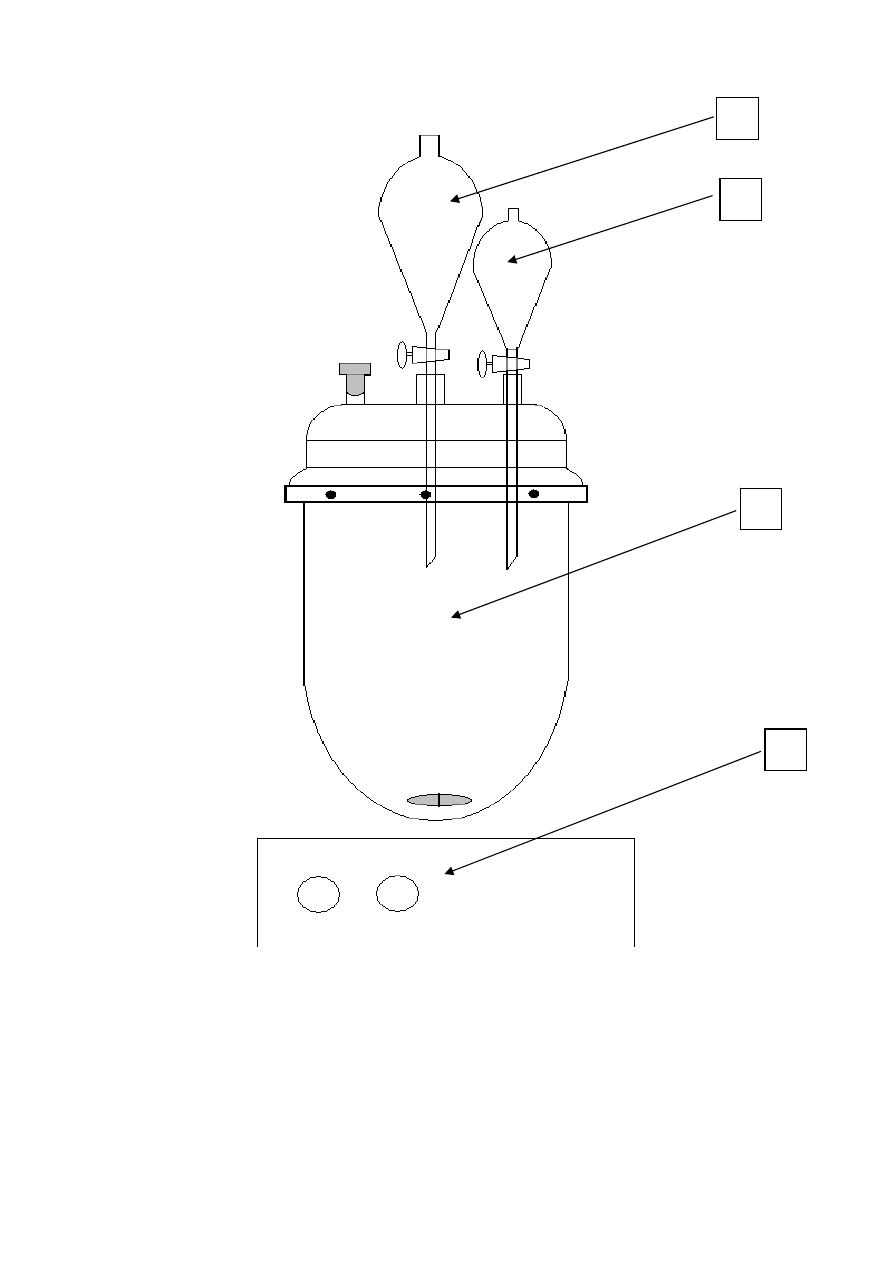
19
Rysunek 8 Schemat aparatury do utleniania metodą Fentona.
1 - kolba reakcyjna
2 – wkraplacze
3 – mieszadło magnetyczne
1
2
2
3
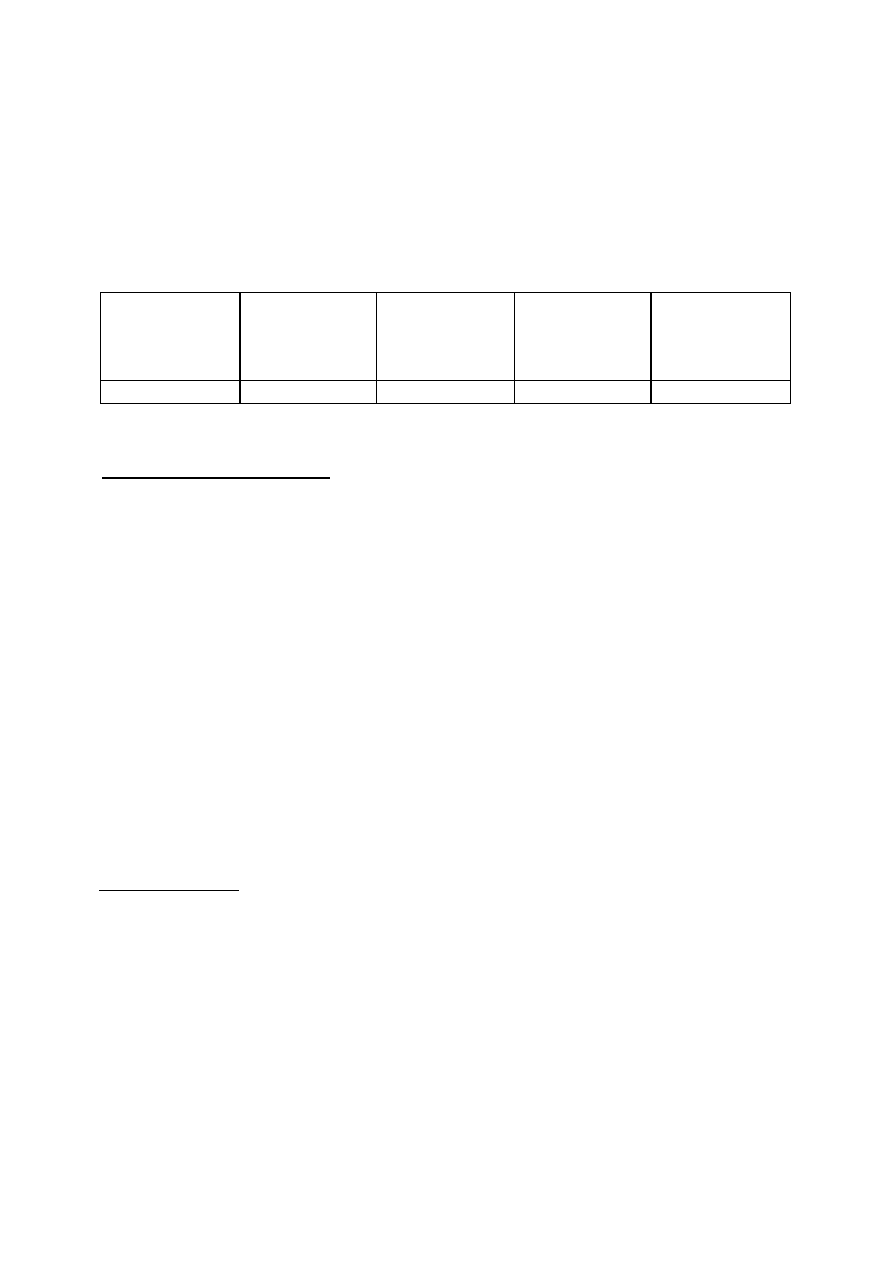
Wyniki pomiarów zebrać w tabeli według wzoru:
Tabela 1.
Wyniki pomiarów i obserwacji utleniania fenolu
ilość Fe(NH
4
)
2
(SO
4
)
2
zużytego do miareczkowania próby kontrolnej ............................cm
3
normalność roztworu siarczanu żelazowo-amonowego .................................................... N
objętość próbki ścieków użytej do oznaczania .................................................................. cm
3
Czas utleniania
[min.]
Absorbancja
Stężenie fenolu
[mg/dm
3
]
Ilość siarczanu
żelazawo-
amonowego
[cm
3
]
ChZT
[mg O
2
/dm
3
]
4.5. Analityczna kontrola procesu
Oznaczanie fenolu w ściekach
Oznaczanie fenolu polega na sprzęganiu fenolu z dwuazowaną p-nitroaniliną w roztworze
alkalicznym. Powstający barwny związek oznacza się kolometrycznie (długość fali 480 nm).
Odczynniki:
1. roztwór p-nitroaniliny – 0,69 g p-nitoaniliny rozpuścić w 6,5 cm
3
stężonego (36%) kwasu
solnego na gorąco i rozcieńczyć do objętości l dm
3
wodą destylowaną,
2. roztwór 1N Na
2
CO
3
- rozpuścić 53,1 g krystalicznej sody w wodzie destylowanej i dopełnić
do kreski w kolbie miarowej o pojemności l dm
3
,
3. 2% roztwór azotynu sodowego.
Wykonanie oznaczenia:
Roztwory do wykonania krzywej wzorcowej w granicach stężeń l - 10 mg fenolu na l dm
3
roztworu sporządza się następująco: do kolby miarowej o objętości 100 cm
3
wlewa się
określoną ilość wzorcowego roztworu fenolu i dodaje kolejno 15 cm
3
PNA i 4 cm
3
roztworu
azotynu sodowego. Po dokładnym wytrząsaniu i ochłodzeniu dodaje się 30 cm
3
roztworu
węglanu sodowego, uzupełnia się do kreski wodą destylowaną, po czym mierzy na Specolu 11
absorbancję. Dla wyeliminowania wpływu substancji mineralnych i organicznych zawartych w
wodzie wodociągowej roztwory z fenolu należy przygotować w wodzie destylowanej. Stężenie
fenolu w próbkach poreakcyjnych oznacza się jak wyżej pobierając 10 cm
3
roztworu.
Oznaczanie ChZT
Chemiczne zapotrzebowanie tlenu oznacza się metodą dwuchromianową. Podstawą
oznaczania są reakcje:
(CHO) + Cr
2
O
7
2-
+ H
+
= 2 Cr
3+
+ CO
2
+ H
2
O
6 Fe
2+
+ Cr
2
O
7
2-
+ 14 H
+
= 6 Fe
3+
+ 2 Cr
3+
+ 7 H
2
O
Odczynniki:
1. Kwas siarkowy z AgSO
4
. Do l dm
3
H
2
SO
4
cz.d.a. (c.wł. 1.84) dodać 11 g AgSO
4
cz.d.a.,
wymieszać, pozostawić odczynnik na 2 dni w celu rozpuszczenia się AgSO
4
,
2. Roztwór wskaźnika ferroiny. Rozpuścić 1,485 g 1,10-fenantrolinyjednowodnej oraz 0,70 g
FeSO
4
· 7 H
2
O w wodzie i rozcieńczyć do 100 cm
3
,
3. Dwuchromian potasowy 0,25 N. Rozpuścić 12,259 g K
2
Cr
2
O
7
ch.cz., wysuszonego
uprzednio w temp. 103°C przez 2 godziny, w wodzie destylowanej i dopełnić do l dm
3
,
4. Roztwór siarczanu żelazawo-amonowego 0,1 N. Rozpuścić 39 g Fe(NH
4
)
2
(SO
4
)
2
·6H
2
O

21
cz.d.a. w wodzie destylowanej. Dodać 20 cm
3
H
2
SO
4
cz.d.a. (c.wł. 1.84), ostudzić i rozcieńczyć
do l dm
3
. Miano tego roztworu musi być sprawdzone dwuchromianem potasowym w. dniu
oznaczenia. W celu ustalenia normalności rozcieńczyć 10 cm
3
0,25 N roztworu K
2
Cr
2
O
7
do
około 100 cm
3
w kolbie stożkowej. Dodać 30 cm
3
stęż. H
2
SO
4
ostudzić. Miareczkować
roztworem siarczanu żelazawo-amonowego, stosując 2-3 krople wskaźnika ferroiny do zmiany
zabarwienia wskaźnika z niebiesko-zielonego na czerwonawo-niebieski. Obliczyć normalność
odczynnika ze wzoru:
2
4
2
4
3
7
2
2
3
)
(
)
(
25
,
0
SO
NH
Fe
cm
O
Cr
K
cm
n
⋅
=
Wykonanie oznaczenia:
W kolbie okrągłodennej umieścić 10 cm
3
próbki rozcieńczonej do 20 cm
3
wodą
destylowaną, wymieszać. Następnie dodać parę kawałków wyprażonego pumeksu i 10 cm
3
0,25 N roztworu K
2
Cr
2
O
7
. Dodać, mieszając, 30 cm
3
odczynnika H
2
SO
4
z AgSO
4
i połączyć
natychmiast kolbę z chłodnicą zwrotną. Ogrzewać kolbę w ciągu 20 min., utrzymując
zawartość w stanie łagodnego wrzenia. Po zakończeniu utleniania kolbę ostudzić i spłukać
wewnętrzną część chłodnicy wodą destylowaną. Dopełnić zawartość kolby do 150 cm
3
wodą
destylowaną, ostudzić do temperatury pokojowej, dodać 2-3 krople wskaźnika ferroiny
i odmiareczkować nadmiar dwuchromianu mianowanym roztworem siarczanu żelazawo-
amonowego. W toku oznaczania należy stale stosować taką samą ilość roztworu ferroiny. Za
końcowy punkt miareczkowania przyjąć ostrą zmianę zabarwienia z niebieskawozielonego na
czerwonawoniebieskawe.
Wykonać równolegle próbę kontrolną, stosując taki sam zestaw odczynników i 20 cm
3
wody
destylowanej. Wartość ChZT obliczyć ze wzoru:
V
n
b
a
X
8000
)
(
⋅
⋅
−
=
[mg/dm
3
ChZTchr.]
gdzie:
a - ilość siarczanu żelazawo-amonowego zużytego do zmiareczkowania próby kontrolnej, cm
3
b - ilość siarczanu żelazawo-amonowego zużytego do zmiareczkowania próbki ścieków, cm
3
n - normalność roztworu siarczanu żelazawo-amonowego
V - objętość próbki ścieków użytej do oznaczania, cm
3

5. FOTOKATALITYCZNA DEGRADACJIA FENOLU W WODNEJ
ZAWIESINIE TiO
2
5.1. Cel ćwiczenia
Celem ćwiczenia jest zbadanie i porównanie aktywności fotokatalitycznej dwóch odmian
dwutlenku tytanu: anatazu i rutylu.
5.2. Aparatura i sprzęt
1. Zestaw aparatury do utleniania (rys. 4)
2. Kolorymetr spektralny "Spekol" z przystawką do pomiaru absorpcji
3. Waga analityczna
4. Wirówka
5. Szkło i odczynniki
5.3. Budowa i działanie aparatury do utleniania fotokatalitycznego
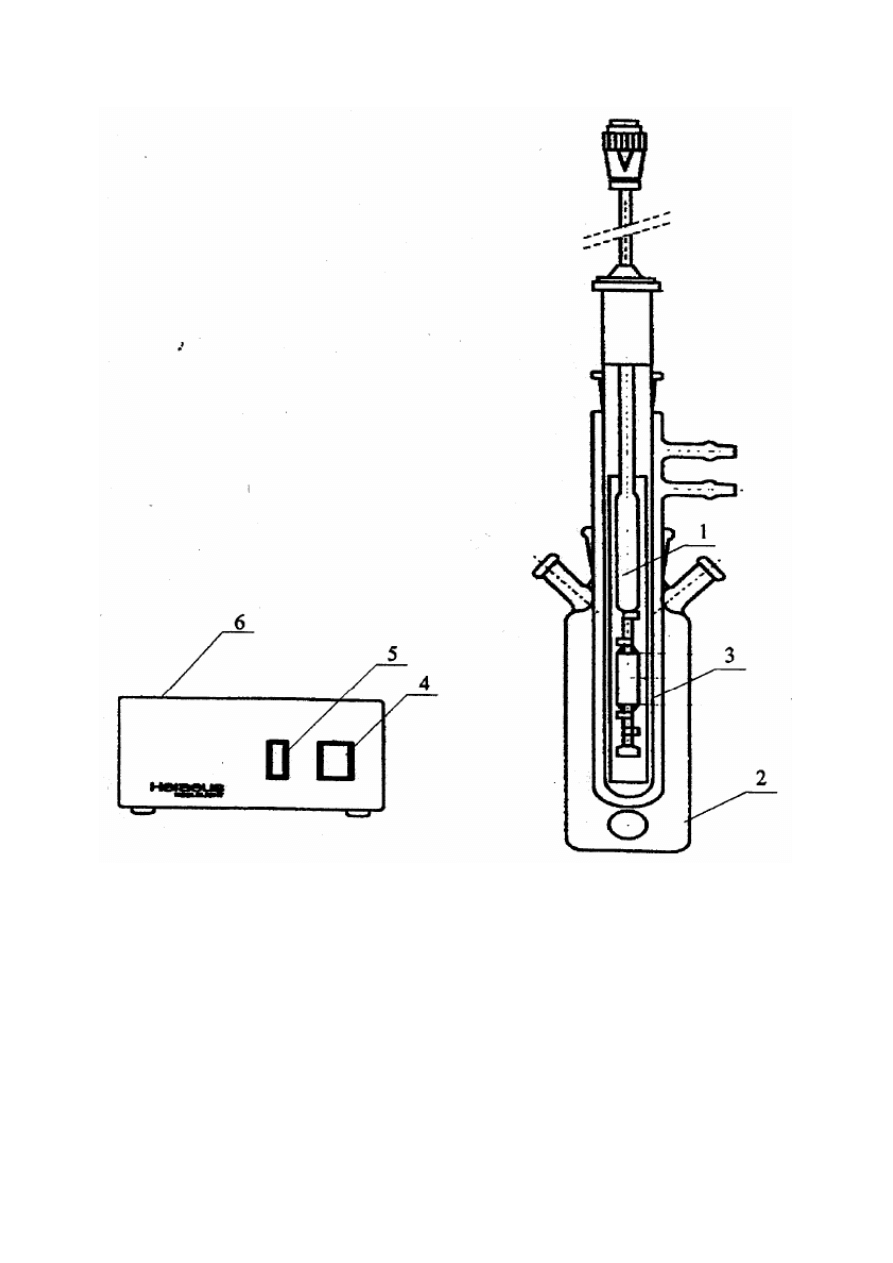
Do badania kinetyki utleniania fenolu stosuje się zestaw aparatury przedstawiony na
rys.3. Źródłem promieniowania UV jest średniociśnieniowa lampa rtęciowa /1/ (150 W) firmy
Heraeus umieszczona centralnie w szklanym reaktorze /2/. Lampa umieszczona jest w osłonie
kwarcowej z płaszczem chłodzącym /3/. Lampę UV uruchamiamy włącznikiem /4/ oraz /5/
umieszczonymi na zasilaczu /6/. Badany roztwór mieszany jest podczas utleniania za pomocą
mieszadła magnetycznego. Próbki badanego roztworu pobieramy przez króćce /7/ za pomocą
specjalnie przygotowanego próbnika.
5.4. Sposób prowadzenia pomiarów
Fotokatalityczna degradacja fenolu w układzie UV/TiO
2
Sposób przeprowadzenie pomiarów jest następujący:
a) napełnić reaktor modelowym roztworem fenolu o stężeniu 50 mg/dm
3
do objętości 1 dm
3
,
b) do roztworu fenolu dodać katalizator (dwutlenek tytanu w formie anatazu lub rutylu) w ilości
1 g/dm
3
,
c) lampę rtęciową wraz z kwarcową obudową umieścić w reaktorze,
d) włączyć mieszadło magnetyczne i ustawić żądaną prędkość obrotów,
e) otworzyć zawór doprowadzający wodę do płaszcza chłodzącego lampy UV,
f) szczelnie osłonić powierzchnię reaktora folią aluminiową,
g) włączyć lampę UV ustawiając włącznik /4/ w pozycji "l" i przytrzymując włącznik 151
pozycji "start" przez 30 s,
h) utlenianie prowadzić przez 30 min. pobierając próbki roztworu o objętości 15 cm
3
co 10min,
(10 cm
3
przeznaczyć do oznaczania fenolu),
i) w celu zakończenia procesu utleniania należy;
• wyłączyć lampę UV ustawiając włącznik /4/ w pozycji "O",
• zamknąć zawór doprowadzający wodę do płaszcza chłodzącego lampy.
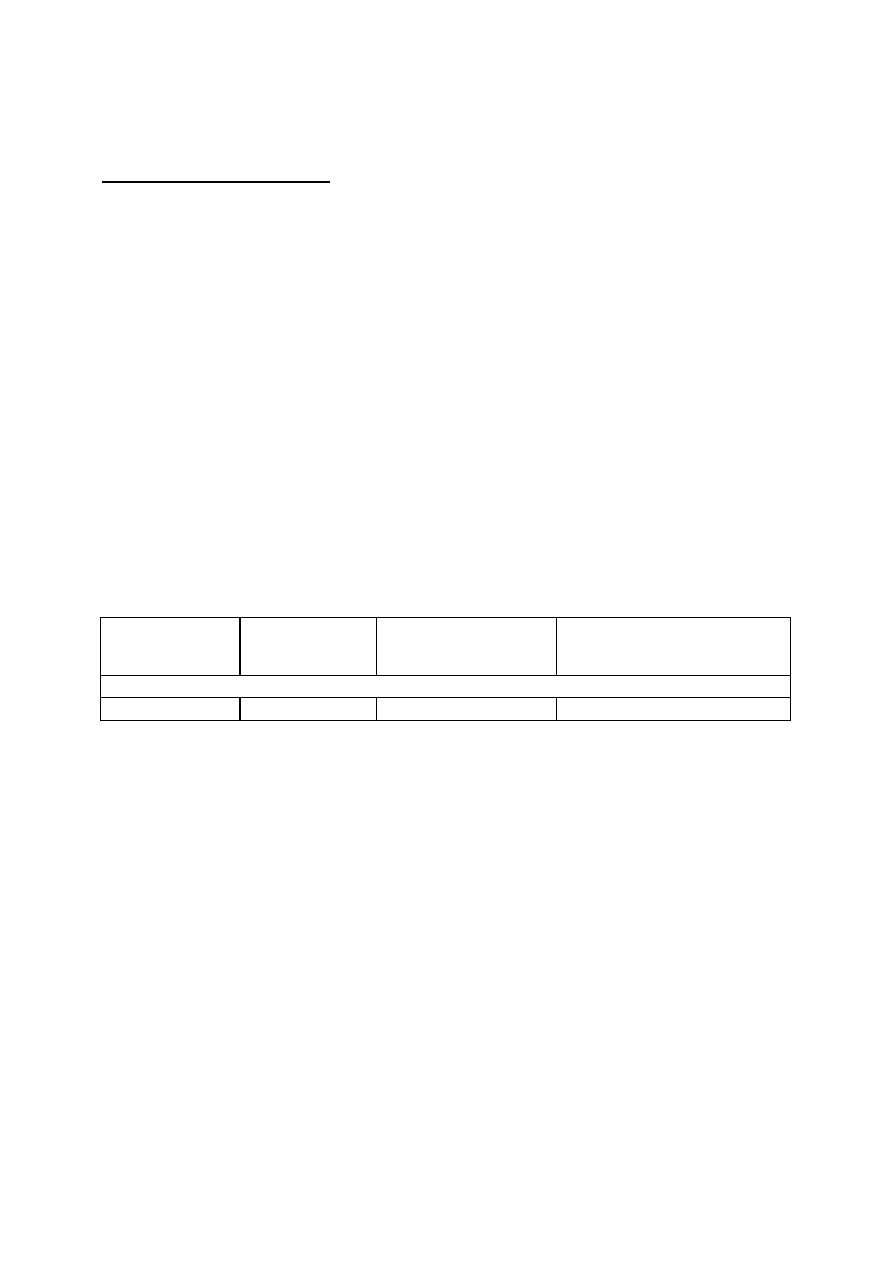
5.5. Analityczna kontrola procesu
Oznaczanie fenolu w ściekach
Oznaczanie fenolu polega na sprzęganiu fenolu z dwuazowaną p-nitroaniliną w roztworze
alkalicznym. Powstający barwny związek oznacza się kolometrycznie (długość fali 480 nm).
Odczynniki:
1. roztwór p-nitroaniliny – 0,69 g p-nitoaniliny rozpuścić w 6,5 cm
3
stężonego (36%) kwasu
solnego na gorąco i rozcieńczyć do objętości l dm
3
wodą destylowaną,
2. roztwór 1N Na
2
CO
3
- rozpuścić 53,1 g krystalicznej sody w wodzie destylowanej i dopełnić
do kreski w kolbie miarowej o pojemności l dm
3
,
3. 2% roztwór azotynu sodowego.
Wykonanie oznaczenia:
Roztwory do wykonania krzywej wzorcowej w granicach stężeń l - 10 mg fenolu na l dm
3
roztworu sporządza się następująco: do kolby miarowej o objętości 100 cm
3
wlewa się
określoną ilość wzorcowego roztworu fenolu i dodaje kolejno 15 cm
3
PNA i 4 cm
3
roztworu
azotynu sodowego. Po dokładnym wytrząsaniu i ochłodzeniu dodaje się 30 cm
3
roztworu
węglanu sodowego, uzupełnia się do kreski wodą destylowaną, po czym mierzy na Specolu 11
absorbancję. Dla wyeliminowania wpływu substancji mineralnych i organicznych zawartych w
wodzie wodociągowej roztwory z fenolu należy przygotować w wodzie destylowanej. Stężenie
fenolu w próbkach poreakcyjnych oznacza się jak wyżej pobierając 10 cm
3
roztworu.
Tabela 2.
Wyniki pomiarów i obserwacji utleniania fenolu
Czas utleniania
[min.]
Absorbancja
Stężenie fenolu
[mg/dm
3
]
Ocena wizualna
roztworu (barwa)
Katalizator:......................................(c
o
=..................................mg/dm
3
)
24
Rysunek 9 Schemat aparatury do utleniania fotokatalitycznego.
1 – lampa rtęciowa średniociśnieniowa
2 – reaktor
3 – kwarcowa osłona z płaszczem chłodzącym
4 – włącznik A
5 – włącznik B
6 – zasilacz

6. OZONOWANIE FENOLU - PODSTAWY TEORETYCZNE
6.1. Cel ćwiczenia
Celem ćwiczenia jest wyznaczenie wydajności generatora ozonu w funkcji napięcia
prądu elektrycznego oraz natężenia przepływu gazu przez reaktor, a następnie zbadanie
kinetyki utleniania roztworu wodnego fenolu w zadanych warunkach procesu.
6.2. Aparatura i sprzęt
1. Zestaw aparatury do ozonowania według rys. 2
2. Kolorymetr spektralny "Spekol" z przystawką do pomiaru absorpcji
3. Waga analityczna
4. Waga techniczna
5. Szkło i odczynniki
6.3. Budowa i działanie aparatury do ozonowania
Do pomiaru wydajności generatora ozonu oraz badania kinetyki utleniania fenolu
stosuje się zestaw aparatury przedstawiony schematycznie na rys.2. Ozon jest wytwarzany w
generatorze /4/ opartym na cichych wyładowaniach elektrycznych. Wydajność generatora
reguluje się przez zmianę natężenia przepływu gazu. Źródłem powietrza lub tlenu
dostarczanego do ozonatora jest butla /1/. Natężenie przepływu gazu reguluje się za pomocą
reduktora umieszczonego na butli. Chwilowe natężenie przepływu gazu odczytuje się z
rotametru /2/ zaś całkowita ilość przepuszczonego gazu z licznika /10/. Nawilgocenia gazu
pozbywa się przepuszczając go przez płuczkę z żelem krzemionkowym. Ozonator podłączony
jest do autotransformatora, a napięcie i natężenie prądu pierwotnego mierzy się za pomocą
woltomierza /6/ i amperomierza /5/. Napięcie wtórne dane jest zależnością (przekładnia
transformatora): U
w
= 36 U
p
. Utlenianie roztworu fenolu prowadzi się w reaktorze /7/.
Opory przepływu gazu przez aparaturę i reaktor pokonywane są dzięki
podwyższonemu ciśnieniu gazu podawanego z butli, należy jednak uważać aby nie
przekraczały one 0.5x10
5
Pa.
6.4. Sposób przeprowadzenia pomiarów
Badanie wydajności generatora ozonu
Podczas badania wydajności generatora ozonu należy zadbać o czystość doprowadzanego
gazu oraz stałość parametrów procesu (natężenie przepływu gazu, zawartość tlenu w gazie,
napięcie i częstotliwość prądu). Zakłada się, że podczas jednego cyklu pomiarów nie zachodzi
wyraźne zużycie się generatora objawiające się stopniowym spadkiem wydajności wytwarzania
ozonu.
Sposób postępowania przy badaniu wydajności generatora ozonu jest następujący:
a) napełnić płuczki /9/ do 1/3 wysokości roztworem KJ i zamontować w aparaturze,
b) zawór odprowadzający ozon do wyciągu ustawić w pozycji otwartej, zawory
odprowadzające ozon do płuczek i do kolumny barbotażowej w pozycji zamkniętej,
c) ustawić żądany strumień objętości powietrza (tlenu) w przedziale od 60 do 200 dm
3
/h,
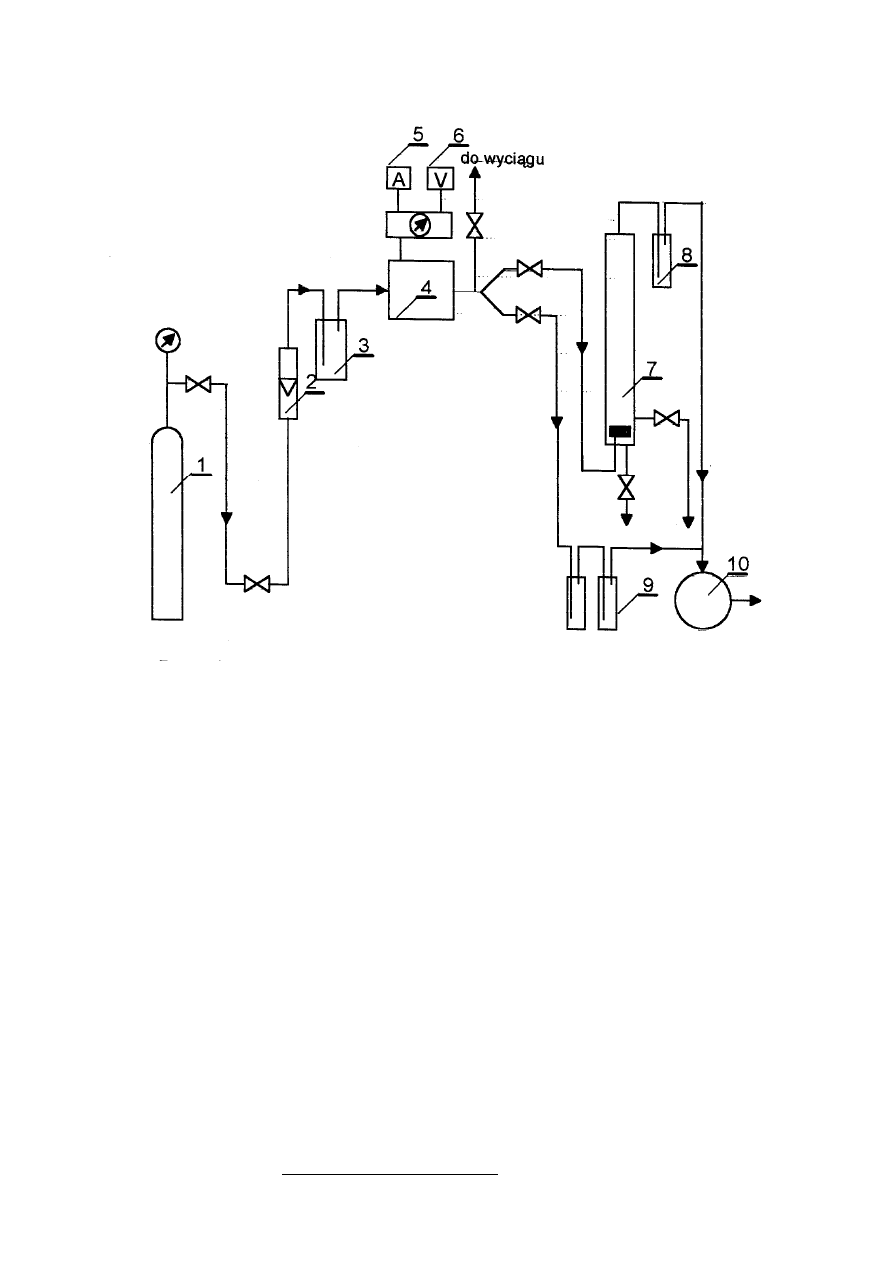
26
Rysunek 10 Schemat zestawu do ozonowania.
1 – butla ze sprężonym powietrzem
2 – rotametr
3 – osuszacz gazu
4 – generator ozonu
5 – amperomierz
6 – woltomierz
7 – reaktor
8 – płuczka do pochłaniania nieprzereagowanego O
3
9 – płuczki z roztworem KI
10 – licznik gazowy
d) nastawić za pomocą autotransformatora napięcie pierwotne, wskazywane przez
woltomierz/6/; od siedmiu do 10 wartości w przedziale 50-240 V, np.: 60, 90, 110, 150,
180, 210, 230 V,
e) przepuszczać gaz przez generator przez 5 min.,
f) otworzyć zawór doprowadzający ozon do płuczek /9/ i jednocześnie zamknąć zawór
prowadzący do wyciągu,
g) zanotować stan licznika /6/ i włączyć zegar. Ozonowanie prowadzić przez 5 lub 10 min.
dla kilku wartości strumienia objętości gazu, np.: 60, 90, 120, 150, 180 dm
3
/h,
UWAGA: w czasie pomiarów należy obserwować rotametr /4/ i woltomierz /8/ czy zachowane
są zadane wartości natężenie przepływu gazu i napięcia prądu elektrycznego. Natężenie prądu
w obwodzie pierwotnym nie powinno przekraczać 2 A.
h) po zakończeniu ozonowania zanotować stan licznika /l0/, otworzyć zawór do wyciągu,
27
zamknąć zawór doprowadzający ozon do płuczek /9/. W przypadku kontynuowania
pomiaru i skierowania gazu z ozonem do reaktora /7/ otworzyć zawór doprowadzający
ozon do reaktora i zamknąć zawór prowadzący do wyciągu,
i) odłączyć płuczki /9/ od aparatury i oznaczyć w nich jod. Wyniki pomiarów przedstawić
w tabeli według wzoru:
Tabela. 3.
Wyniki badania wydajności generatora ozonu
Objętość
przepuszczonego gazu
[dm
3
]
Napięcie
wtórne
[V]
Czas
pomiaru
[min.]
wg licznika
wg
rotametru
Objętość
Na
2
S
2
O
3
............M
[cm
3
]
Zawartość
ozonu w
gazie
[mg/dm
3
]
[% objęt.]
Wydajność
generatora
ozonu
[g/h]
Założony strumień objętości gazu .................... dm
3
/h
Utlenienie roztworu fenolu
Pomiar kinetyki utleniania fenolu w reaktorze poprzedza pomiar wydajności ozonatora
przy zadanych wartościach natężenie przepływu gazu i napięcia prądu zgodnie z procedurą
podaną w poprzednim punkcie.
Sposób przeprowadzania pomiarów jest następujący:
a) napełnić płuczkę /8/ roztworem KJ do 1/3 wysokości,
b) napełnić reaktor III modelowym roztworem fenolu o stężeniu ok. 50 mg/dm
3
do
objętości 2 dm
3
. Roztwór należy uprzednio przygotować z wody destylowanej i
odpowiedniej ilości fenolu dodając kwas borowy do stężenia 0.05 m (3.1 g kwasu na
dm
3
wody) i doprowadzając odczyn do pH = 9 za pomocą NaOH. Uzyskany układ
buforowy zapewnia utrzymanie środowiska reakcji na poziomie pH =9,
c) badania można prowadzić również z modelowym roztworem fenolu bez dodatku kwasu
borowego, przy czym wyjściowe pH powinno znajdować się w przedziale 10-12,
d) wykonać pomiar wydajności generatora ozonu,
e) otworzyć zawór doprowadzający ozon do reaktora /7/ i jednocześnie zamknąć zawór
odprowadzający do wyciągu. Uregulować natężenie przepływu gazu z uwagi na zmianę
oporów przepływu. Zakłada się, że aparatura jest w ruchu po wcześniejszym pomiarze
wydajności ozonatora,
f) ozonowanie prowadzić przez 20 min. pobierając próbki roztworu do kolbek miarowych
o objętości 25 cm
3
co 5 min., z czego 10 cm
3
przeznaczyć do oznaczania fenolu. Co 5
minut - należy zmienić płuczkę /8/ z roztworem KJ,
g) w celu zakończenia procesu ozonowania należy:
- otworzyć zawór do wyciągu i jednocześnie zamknąć zawór doprowadzający
ozon do reaktora,
- wyłączyć zasilanie generatora ozonu w wysokie napięcie,
- po 2 minutach przerwać przepływ powietrza (tlenu),
- odłączyć ostatnią płuczkę z roztworem KJ /8/ od aparatury i oznaczyć jod
- opróżnić reaktor i przemyć go wodą destylowaną.
Wyniki pomiarów zebrać zestawić w tabeli według wzoru:
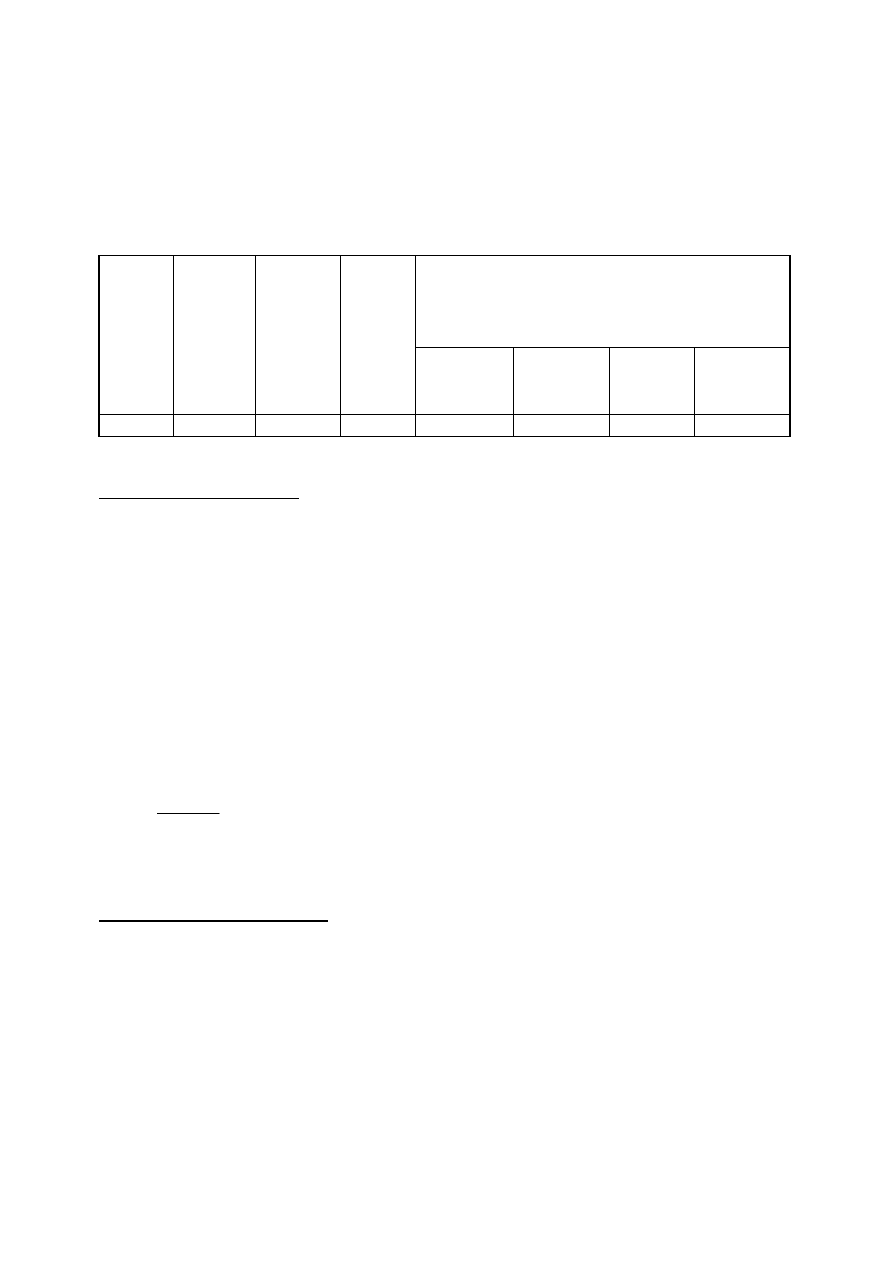
28
Tabela
4. Wyniki pomiarów i obserwacji procesu utleniania fenolu ozonem
natężenie przepływu gazu .......................... dm
3
/h
napięcie ...................................................... V
temperatura ................................................ °C
zawartość O
3
w gazie ................................. mg/dm
3
opory przepływu w gazie ........................... mmHg
Ocena wizualna procesu
Czas
[min.]
Absorba
ncja
Stężenie
fenolu
[mg/dm
3
]
Wykorzy
stanie
ozonu
[%]
barwa
roztworu
wielkość
pęcherzyków
gazu
powstawanie
piany
zmętnienie
roztworu
6.5. Analityczna kontrola procesu
Oznaczanie ozonu w gazie
Stężenie ozonu w gazie oznacza się metodą jodometryczną. Podstawą oznaczania są reakcje:
2 KJ + O
3
+ H
2
O = J
2
+ 2 KOH + O
2
J
2
+ 2 Na
2
S
2
O
3
= 2 NaJ + Na
2
S
4
O
6
Odczynniki:
1. 0,5 N roztwór tiosiarczanu sodowego,
2. kwas siarkowy rozcieńczony 1:4,
3. 1% roztwór skrobi
Wykonanie oznaczenia:
Po przepuszczeniu określonej ilości mieszaniny gazowej, zawartość płuczek zakwasić
rozcieńczonym kwasem siarkowym i odmiareczkować wolny jod roztworem tiosiarczanu
sodowego wobec skrobi jako wskaźnika. Stężenie ozonu w mieszaninie z powietrzem lub
tlenem wyliczyć ze wzoru:
V
f
a
O
⋅
⋅
=
24
]
[
3
[mg O
3
/dm
3
]
Oznaczanie fenolu w ściekach
Oznaczanie fenolu polega na sprzęganiu fenolu z dwuazowaną p-nitroaniliną w roztworze
alkalicznym. Powstający barwny związek oznacza się kolometrycznie (długość fali 480 nm).
Odczynniki:
1. roztwór p-nitroaniliny – 0,69 g p-nitoaniliny rozpuścić w 6,5 cm
3
stężonego (36%) kwasu
solnego na gorąco i rozcieńczyć do objętości l dm
3
wodą destylowaną,
2. roztwór 1 N Na
2
CO
3
- rozpuścić 53,1 g krystalicznej sody w wodzie destylowanej i dopełnić
do kreski w kolbie miarowej o pojemności l dm
3
,
3. 2% roztwór azotynu sodowego.
Wykonanie oznaczenia:
Roztwory do wykonania krzywej wzorcowej w granicach stężeń l - 10 mg fenolu na
l dm
3
roztworu sporządza się następująco: do kolby miarowej o objętości 100 cm
3
wlewa się
określoną ilość wzorcowego roztworu fenolu i dodaje kolejno 15 cm
3
PNA i 4 cm
3
roztworu
gdzie:
a - ilość l N Na
2
S
2
O
3
, cm
3
f - współczynnik przeliczenia miana Na
2
S
2
O
3
V - ilość przepuszczonego powietrza, dm
3

29
azotynu sodowego. Po dokładnym wytrząsaniu i ochłodzeniu dodaje się 30 cm
3
roztworu
węglanu sodowego, uzupełnia się do kreski wodą destylowaną, po czym mierzy na Specolu 11
absorbancję. Dla wyeliminowania wpływu substancji mineralnych i organicznych zawartych w
wodzie wodociągowej roztwory z fenolu należy przygotować w wodzie destylowanej. Stężenie
fenolu w próbkach poreakcyjnych oznacza się jak wyżej pobierając 10 cm
3
roztworu.
Wyszukiwarka
Podobne podstrony:
wilk & steller, technologia chemiczna surowce i procesy przemysłu organicznego,podstawowe surowce n
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznegofizykochemiczne podstawy
Cwiczenie - F OKSYALKILENOWANIE ALKOHOLI, Technologia INZ PWR, Semestr 5, Technologia Chemiczna - su
zadania2 preznosc pary nasyconej oraz gestosc cieczy i gazow, Technologia chemiczna, Podstawy techno
zadania4 lepkosc mieszanin gazow i cieczy pod niskim i umiarkowanym cisnieniem, Technologia chemiczn
zadania5 lepkosc gazow i cieczy pod wysokim cisnieniem, Technologia chemiczna, Podstawy technologii
wilk & steller, technologia chemiczna surowce i procesy przemysłu organicznego,Wykorzystanie propyl
wilk & steller, technologia chemiczna surowce i procesy przemysłu organicznego,koksowaniex
Nowoczesne procesy utleniania
Technologia chemiczna W3, Technologia INZ PWR, Semestr 4, Technologia Chemiczna - surowce i procesy,
Technologia - egzaminy, Technologia ustna zerówka 2012, Tematy pytań na egzaminie z podstaw technolo
,Technologia chemiczna – surowce i procesy przemysłu nieorganicznego S,Czystsze technologie chemiczn
Hoffmann, Technologia chemiczna surowce i procesy przemysłu nieorganicznego S, pigmenty nieorganicz
,Technologia chemiczna surowce i procesy przemysłu organicznego S,Oleje opałowe
technologia, podstawy technologii chemicznej, technologia chemiczna, technologia chemiczna
Technologia chemiczna W5, Politechnika Wrocławska- Wydział Chemiczny (W3), Podstawy technologii chem
zadania7 wspolczynnik przewodzenia ciepla mieszanin + wplyw cisnienia, Technologia chemiczna, Podsta
więcej podobnych podstron