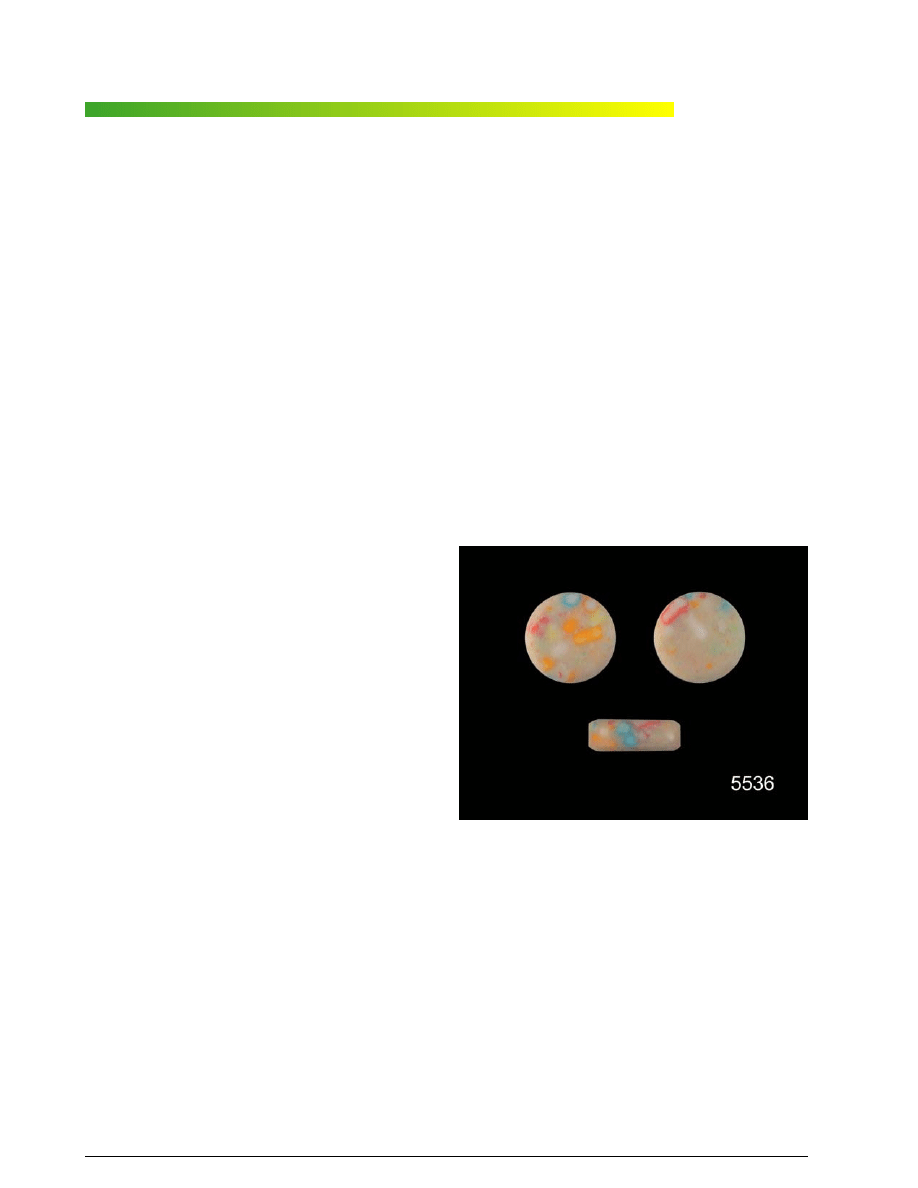
Pojawianie siê na czarnym rynku coraz nowszych
narkotyków syntetycznych (z grupy tzw. designer
drugs), rozpowszechnianych zazwyczaj pod postaci¹
tabletek, jest nie lada wyzwaniem dla chemików anali-
tyków pracuj¹cych w laboratoriach kryminalistycznych.
Zwi¹zki te na ogó³ nie figuruj¹ w komercyjnych bibliote-
kach widm w podczerwieni, widm masowych czy te¿
dyfraktogramów rentgenowskich zainstalowanych na
instrumentalnej aparaturze badawczej, co sprawia, ¿e
ich identyfikacja wymaga od eksperta wiedzy, doœwiad-
czenia, a nieraz równie¿ pomys³owoœci i intuicji. Przy-
k³adem tego typu zwi¹zków mo¿e byæ grupa pochod-
nych fenylopiperazyny – stosunkowo nowych substan-
cji psychotropowych, których w³aœciwoœci zosta³y nie-
dawno opisane na ³amach „Problemów Kryminalistyki”
[1] – wraz z jedn¹ z najwa¿niejszych, czyli N-(m-chlo-
rofenylo)piperazyn¹ (mCPP). Jest to zwi¹zek, który
najczêœciej pojawia siê w tabletkach, rzadziej w posta-
ci proszku lub w kapsu³kach. Tabletki takie mog¹ po-
nadto zawieraæ kombinacje ró¿nych pochodnych pipe-
razyny, takich jak N-(3-trifluorometylofenylo)piperazyna
(TFMPP), 1-(4-metoksyfenylo)piperazyna (MeOPP) lub
benzylopiperazyna (BZP). W ¿argonie ulicznym mCPP
znana jest w ró¿nych krajach europejskich pod nazwa-
mi „Arlequin”, „X4”, „Rolls Royce” czy „smarties” albo
sprzedawana jako tabletki ecstasy. mCPP nie jest sub-
stancj¹ kontrolowan¹ w pañstwach europejskich, w tym
tak¿e w Polsce.
Za¿ywane dawki substancji wahaj¹ siê w szerokim
zakresie, a czas jej dzia³ania mieœci siê w granicach od
2,4 do 6,8 godziny po aplikacji do¿ylnej i od 2,6 do 6,1
godziny po przyjêciu doustnym. mCPP ma w³aœciwoœci
pobudzaj¹ce i halucynogenne, porównywalne do w³a-
œciwoœci MDMA. Wywo³uje euforiê, zmiany w zachowa-
niu i nastroju, niepokój, panikê, dysforiê i inne objawy
depresji. W niektórych doniesieniach mówi siê równie¿
o jego efektach uspokajaj¹cych. Zwi¹zek ten powoduje
podwy¿szenie poziomu hormonów, takich jak ACTH,
kortizol czy prolaktyna, co prawdopodobnie wp³ywa na
czu³oœæ receptorów serotoninowych i mo¿e doprowa-
dziæ do pojawienia siê ww. objawów. mCPP nie pod-
wy¿sza ciœnienia krwi ani nie przyspiesza akcji serca.
Nie zanotowano te¿ przypadków przestêpstw lub aktów
przemocy, jakich dopuszczano by siê pod wp³ywem te-
go œrodka.
mCPP jest równie¿ metabolitem pojawiaj¹cym siê
we krwi pacjentów za¿ywaj¹cych leki uspokajaj¹ce
i antydepresyjne, takie jak Trazodon i Nefrazodon. S¹
to lekarstwa stosowane miêdzy innymi w terapii depre-
sji, paniki, alkoholizmu i antykokainowej. mCPP nie re-
aguje z testami barwnymi, jak Marquis, Scott czy nitro-
prusydek [2–7].
Do Wydzia³u Chemii CLK KGP zaczê³y wp³ywaæ
sprawy, w których materia³em dowodowym by³y tablet-
ki ró¿ni¹ce siê wygl¹dem od tzw. typowych tabletek
ecstasy czy powszechnie stosowanych lekarstw. By³y
bowiem okr¹g³e i obustronnie p³askie, nie mia³y logo
ani litery czy cyfry, jak równie¿ rowka dziel¹cego, który
czêsto pojawia siê na tabletkach farmaceutycznych.
W kremow¹ masê tabletkow¹ wtopiono zaœ ró¿nokolo-
rowe wtrêty przypominaj¹ce posypkê do ciast (ryc. 1).
Podobne tabletki pojawia³y siê w sprawach z ró¿-
nych czêœci kraju. Pierwsz¹ partiê zabezpieczono przy
naszej zachodniej granicy. Tabletki rozprzestrzeni³y siê
nastêpnie w innych rejonach Polski, docieraj¹c nawet
do jej po³udniowo-wschodnich krañców. Zgodnie ze
stosowan¹ praktyk¹, poddano je analizie metod¹ chro-
matografii gazowej ze spektrometri¹ mas (GCMS)
z u¿yciem aparatu HP-6890/MSD-5973 firmy Hewlett
Packard. Zastosowano typow¹ procedurê alkalizacji
próbki wodnym roztworem wodorotlenku sodu, a na-
stêpnie ekstrakcji chloroformem. Uzyskano niespoty-
kany do tej pory wynik – zarejestrowany chromato-
gram oraz widma masowe dwóch ujawnionych sk³ad-
PROBLEMY KRYMINALISTYKI 259 (styczeñ–marzec) 2008
67
Z PRAKTYKI
Z PRAKTYKI
Nitrowanie jako technika derywatyzacji
przy identyfikacji n-(m-chlorofenylo)piperazyny
(m-cpp)
Ryc. 1. Tabletki zawieraj¹ce mCPP
Fig. 1. Tablets containing mCPP
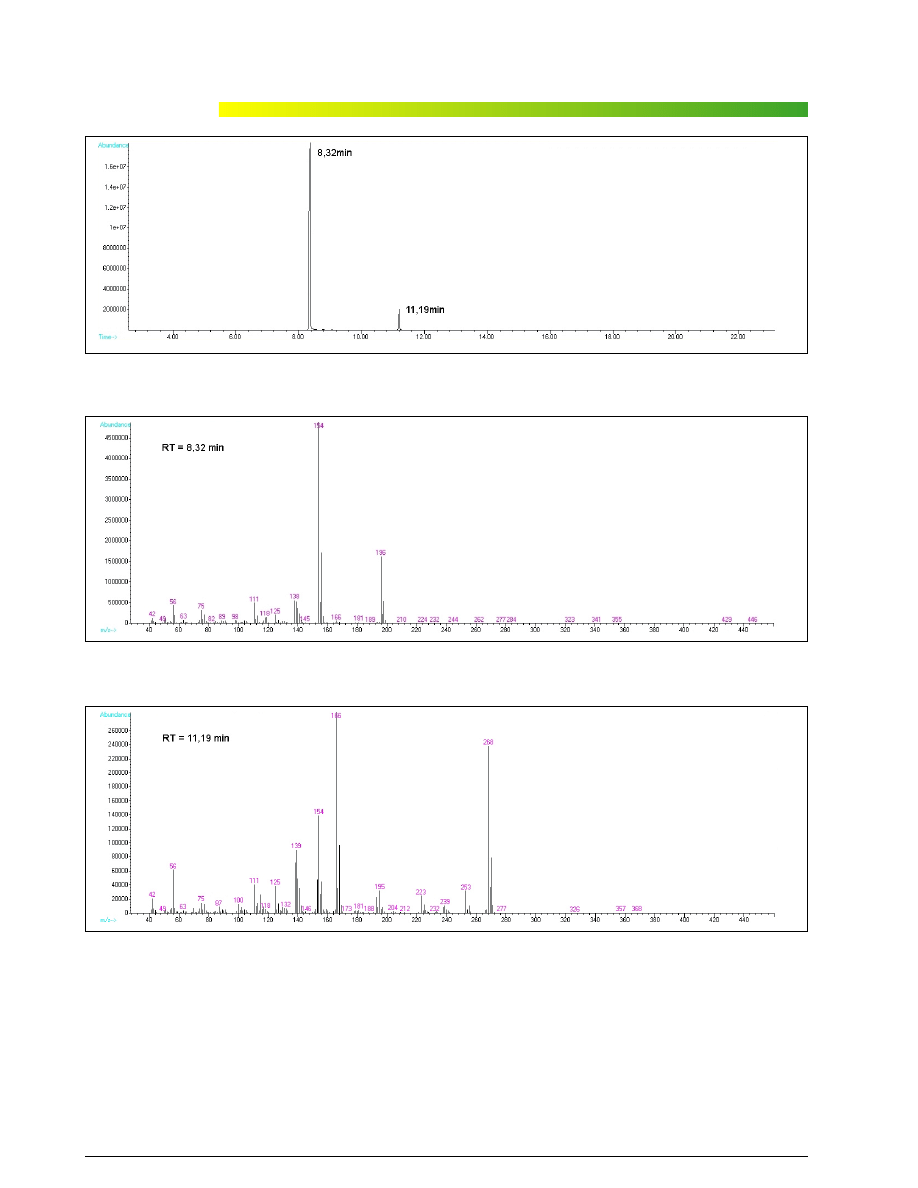
ników próbki (RT = 8,32 i 11,19 min) – przedstawiaj¹
ryciny 2–4.
Przeszukanie biblioteki widm masowych NIST 98
pokaza³o zgodnoœæ zarejestrowanego widma podsta-
wowego sk³adnika (RT = 8,32 min) z widmem
N-(p-chlorofenylo)piperazyny. Okaza³o siê jednak, ¿e
w bibliotece brak jest widm izomerów orto oraz meta te-
go zwi¹zku. Jest rzecz¹ wiadom¹, ¿e odró¿nienie izo-
merów orto, meta i para technik¹ spektrometrii mas
sprawia trudnoœci, zatem na podstawie uzyskanego
wyniku nie mo¿na by³o stwierdziæ, z którym izomerem
tak naprawdê miano do czynienia.
PROBLEMY KRYMINALISTYKI 259 (styczeñ–marzec) 2008
68
Z PRAKTYKI
Z PRAKTYKI
Ryc. 2. Chromatogram próbki zawieraj¹cej CPP
Fig. 2. Chromatogram of sample containing CPP
Ryc. 3. Widmo masowe zarejestrowane przy czasie retencji 8,32 min (CPP)
Fig. 3. Mass spectrum at retention time 8,32 min. (CPP)
Ryc. 4. Widmo masowe zarejestrowane przy czasie retencji 11,19 min
Fig. 4. Mass spectrum at retention time 8,32 min. (CPP)
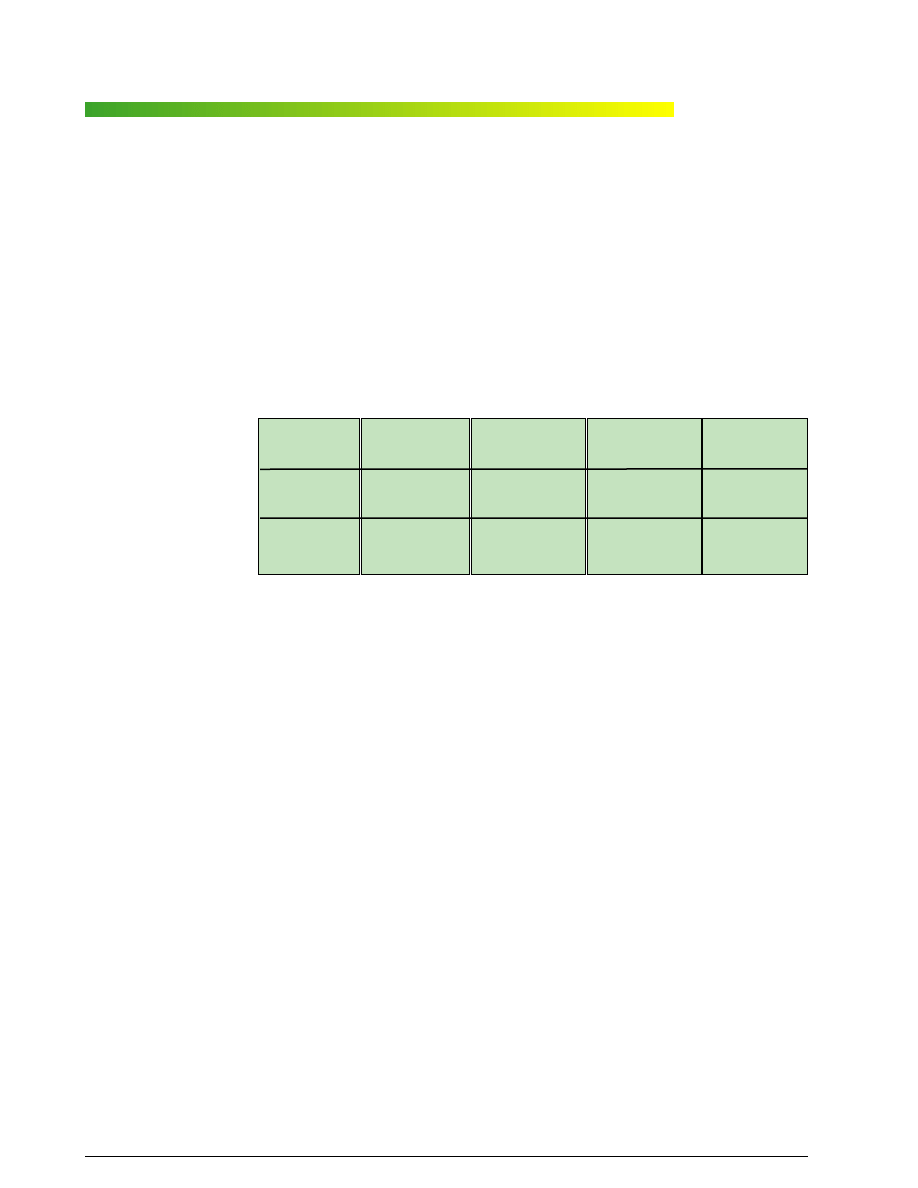
Najprostszym rozwi¹zaniem tego typu problemów
jest porównanie czasu retencji analizowanego zwi¹zku
z czasem retencji wzorca. Niestety CLK KGP nie mia³o
wzorcowych próbek N-(chlorofenylo)piperazyn. Analiza
technik¹ spektrofotometrii w podczerwieni, z powodu
braku odpowiednich widm bibliotecznych, równie¿ nie
da³a rozwi¹zania. Wydawa³o siê, ¿e jedyn¹ pomocn¹
technik¹ mog³aby byæ spektroskopia magnetycznego
rezonansu j¹drowego (NMR). Metoda ta nie jest jednak
dostêpna w polskich laboratoriach kryminalistycznych.
Poszukuj¹c odpowie-
dzi na pytanie, czy w do-
wodowej próbce znajdu-
je siê mCPP, rozwa¿ono
mo¿liwoœæ wykorzysta-
nia technik derywatyza-
cji. Pojêcie „derywatyza-
cja”, spotykane g³ównie
w opisie ró¿nych zasto-
sowañ chromatografii
gazowej, dotyczy wszel-
kich przekszta³ceñ che-
micznych analizowane-
go zwi¹zku, daj¹cych ja-
ko produkt pochodne
o w³aœciwoœciach fizykochemicznych bardziej odpowia-
daj¹cych wymaganiom danej techniki analitycznej. Ty-
powym przyk³adem jest przeprowadzanie amin, alko-
holi i kwasów karboksylowych w pochodne trimetylosi-
lilowe, charakteryzuj¹ce siê wy¿sz¹ lotnoœci¹ i wiêksz¹
odpornoœci¹ termiczn¹ ni¿ zwi¹zki wyjœciowe, a przez
to lepiej dostosowane do warunków chromatografii ga-
zowej. W bardziej zaawansowanych badaniach dery-
watyzacja mo¿e byæ tak¿e pomocna w okreœlaniu struk-
tury nieznanego zwi¹zku chemicznego.
W trakcie rozwa¿añ na temat izomerów N-(chlorofe-
nylo)piperazyny wywnioskowano, ¿e ich odró¿nienie
powinno byæ mo¿liwe z wykorzystaniem reakcji nitro-
wania. Zanim jednak przejdziemy do opisu za³o¿eñ tej
metody, przypomnijmy kilka podstawowych wiadomo-
œci z zakresu teorii nitrowania zwi¹zków aromatycz-
nych.
Reakcja nitrowania zwi¹zków aromatycznych jest
szczególn¹ odmian¹ reakcji substytucji elektrofilowej,
w której cz¹stka z deficytem elektronów (elektrofil) za-
stêpuje atom wodoru pierœcienia zwi¹zku aromatyczne-
go. W przypadku nitrowania cz¹stk¹ t¹ jest zwykle ka-
tion nitroniowy NO
2
+. W praktyce proces nitrowania re-
alizuje siê, stosuj¹c œrodki nitruj¹ce (mieszaniny nitru-
j¹ce) o zró¿nicowanej mocy, poczynaj¹c od wodnych
roztworów kwasu azotowego, a na solach nitroniowych
koñcz¹c. Najpopularniejszym œrodkiem stosowanym
czêsto np. w przemyœle materia³ów wybuchowych s¹
mieszaniny kwasu azotowego z kwasem siarkowym.
Bardzo wa¿nym zagadnieniem jest kwestia wp³ywu
podstawników obecnych przy pierœcieniu aromatycz-
nym na przebieg reakcji nitrowania. Ów wp³yw jest wy-
padkow¹ efektów indukcyjnego i mezomerycznego,
mo¿e polegaæ na zwiêkszeniu lub zmniejszeniu reak-
tywnoœci zwi¹zku, a tak¿e na kierowaniu grupy nitrowej
w pewne uprzywilejowane po³o¿enie wzglêdem dane-
go podstawnika (tabela).
Jak widaæ, wprowadzenie ka¿dej kolejnej grupy ni-
trowej do pierœcienia zmniejsza podatnoœæ zwi¹zku na
dalsze nitrowanie. Wiêcej szczegó³ów dotycz¹cych re-
akcji nitrowania Czytelnik znajdzie w specjalistycznej li-
teraturze [8–11].
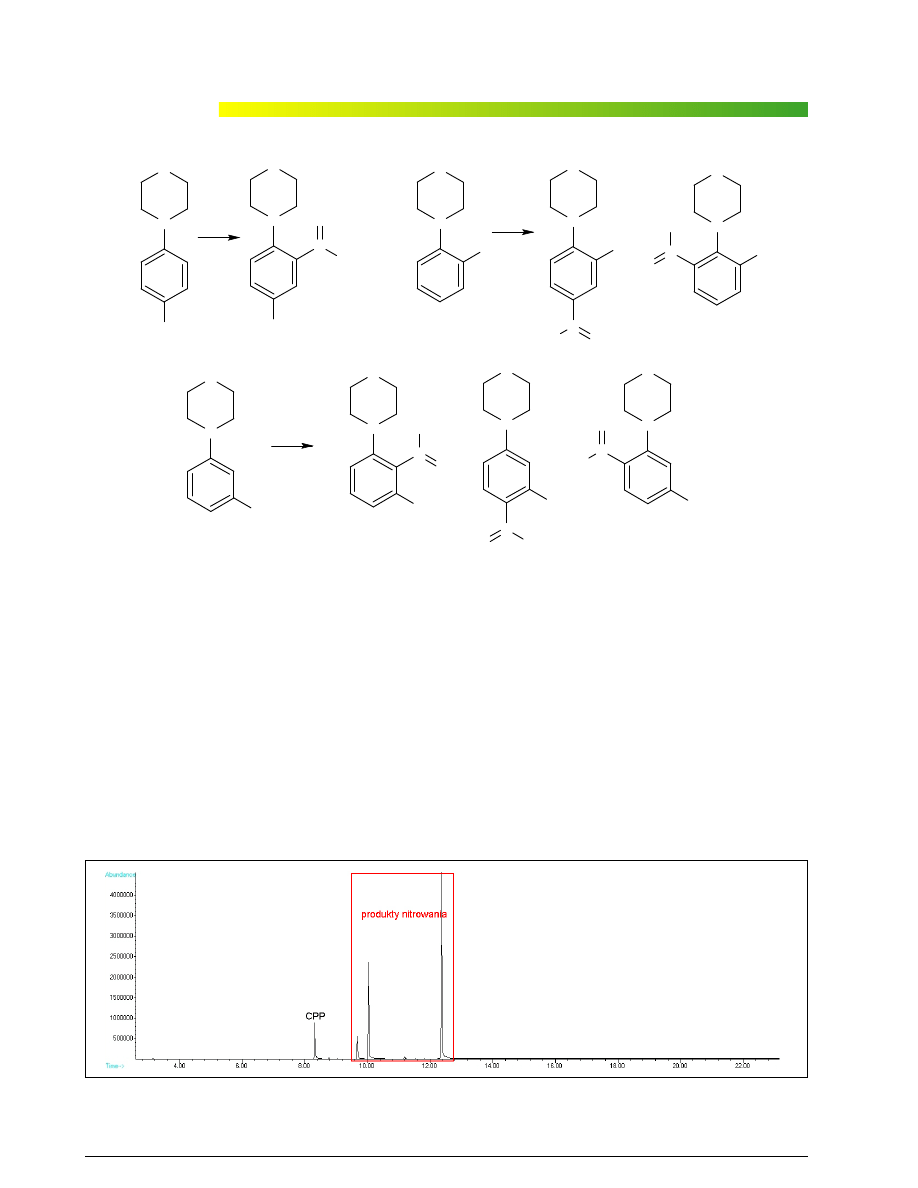
Analizuj¹c przypadki izomerów N-(chlorofenylo)pi-
perazyny, mo¿na zauwa¿yæ, ¿e cz¹steczki tych zwi¹z-
ków zawieraj¹ silnie aktywuj¹c¹ grupê piperazynow¹
(aminow¹), kieruj¹c¹ grupy nitrowe w pozycje orto i pa-
ra. Poniewa¿ moc kieruj¹ca podstawnika maleje rów-
nolegle do spadku jego zdolnoœci aktywuj¹cej, w obec-
noœci silnie dzia³aj¹cej grupy aminowej chlor mo¿na po-
traktowaæ jako podstawnik obojêtny. Podsumowuj¹c,
podstawowymi produktami reakcji mononitrowania po-
winny byæ, w przypadku N-(o-chlorofenylo)piperazyny:
N-(2-chloro-4-nitrofenylo)piperazyna i N-(2-chloro-6-ni-
trofenylo)piperazyna, w przypadku N-(p-chlorofeny-
lo)piperazyny: N-(4-chloro-2-nitrofenylo)piperazyna,
zaœ w przypadku mCPP: N-(3-chloro-2-nitrofenylo)pi-
perazyna, N-(3-chloro-4-nitrofenylo)piperazyna oraz
N-(3-chloro-6-nitrofenylo)piperazyna (ryc. 5). Tym sa-
mym rodzaj izomeru mo¿e zostaæ okreœlony przez licz-
bê powstaj¹cych mononitropochodnych.
Zastosowanie teorii wymaga³o ostro¿nego postêpo-
wania. Nale¿a³o bowiem dobraæ odpowiedni czynnik ni-
truj¹cy i stworzyæ warunki zapewniaj¹ce prawid³owy
przebieg reakcji. Nie mo¿na by³o dopuœciæ do powsta-
nia pochodnych wielonitrowych (nie chodzi³o o prze-
kszta³cenie œrodka psychotropowego w materia³ wybu-
chowy) ani te¿ do utlenienia wyjœciowej aminy wskutek
zbyt gwa³townej reakcji. Wykorzystano wiêc nastêpuj¹-
PROBLEMY KRYMINALISTYKI 259 (styczeñ–marzec) 2008
69
Z PRAKTYKI
Z PRAKTYKI
Tabela
Wp³yw podstawników na po³o¿enie grupy nitrowej w pierœcieniu aromatycznym
Influence of substituents upon location of nitro group in aromatic ring
Efekt kieruj¹cy
orto, para
meta
Podstawniki silnie
aktywuj¹ce
-NH
2
-NHR
-NR
2
-OH
–
Podstawniki
œrednio aktywuj¹ce
-OR
-NHCOCH
3
–
Podstawniki s³abo
aktywuj¹ce
-C
6
H
5
-R
–
Podstawniki
dezaktywuj¹ce
-F -Cl -Br -I
-NO
2
-CN
-COOH -SO
3
H
-CHO -COR
c¹ procedurê: chloroformowy ekstrakt z alkalicznego
roztworu dowodowej próbki odparowano do sucha
w probówce, uzyskuj¹c kilka miligramów bezbarwnej
sta³ej substancji. Nastêpnie do probówki ch³odzonej na
³aŸni z lodem wprowadzono 1 ml 65% kwasu azotowe-
go, sch³odzonego uprzednio do temperatury ok. 0
o
C.
Uzyskany jasno¿ó³ty roztwór po kilku minutach zalkali-
zowano, dodaj¹c ostro¿nie 25% roztwór amoniaku,
a nastêpnie ekstrahowano 2 ml chloroformu. W trakcie
alkalizacji powsta³o jasnopomarañczowe zabarwienie
mieszaniny reakcyjnej, które przenios³o siê na fazê
chloroformow¹ podczas ekstrakcji. Ekstrakt, który
powsta³ w wyniku przprowadzenia procedury derywaty-
zacji, poddano analizie technik¹ GCMS. Otrzymany
chromatogram oraz widma masowe produktów reakcji
przedstawiono na rycinach 6–9.
Jak mo¿na zauwa¿yæ, derywatyzacja próbki dopro-
wadzi³a do powstania trzech nowych zwi¹zków uwi-
docznionych w postaci pików przy czasach retencji
RT = 9,68, 10,04 i 12,38 minuty. Widoczny jest tak¿e
PROBLEMY KRYMINALISTYKI 259 (styczeñ–marzec) 2008
70
Z PRAKTYKI
Z PRAKTYKI
N
N
H
Cl
N
N
H
Cl
N
+
O
-
O
N
N
H
Cl
N
+
O
-
O
N
N
H
Cl
N
+
O
-
O
N
N
H
Cl
N
N
H
Cl
N
N
H
Cl
N
+
O
-
O
N
N
H
Cl
N
+
O
-
O
N
N
H
Cl
N
+
O
-
O
Ryc. 5. G³ówne produkty nitrowania poszczególnych chlorofenylopiperazyn
Fig. 5. Main products of nitration of individual chlorpiperazines
Ryc. 6. Chromatogram mieszaniny zwi¹zków po nitrowaniu próbki
Fig. 6. Chromatogram of mixuter of compounds upon nitration of sample
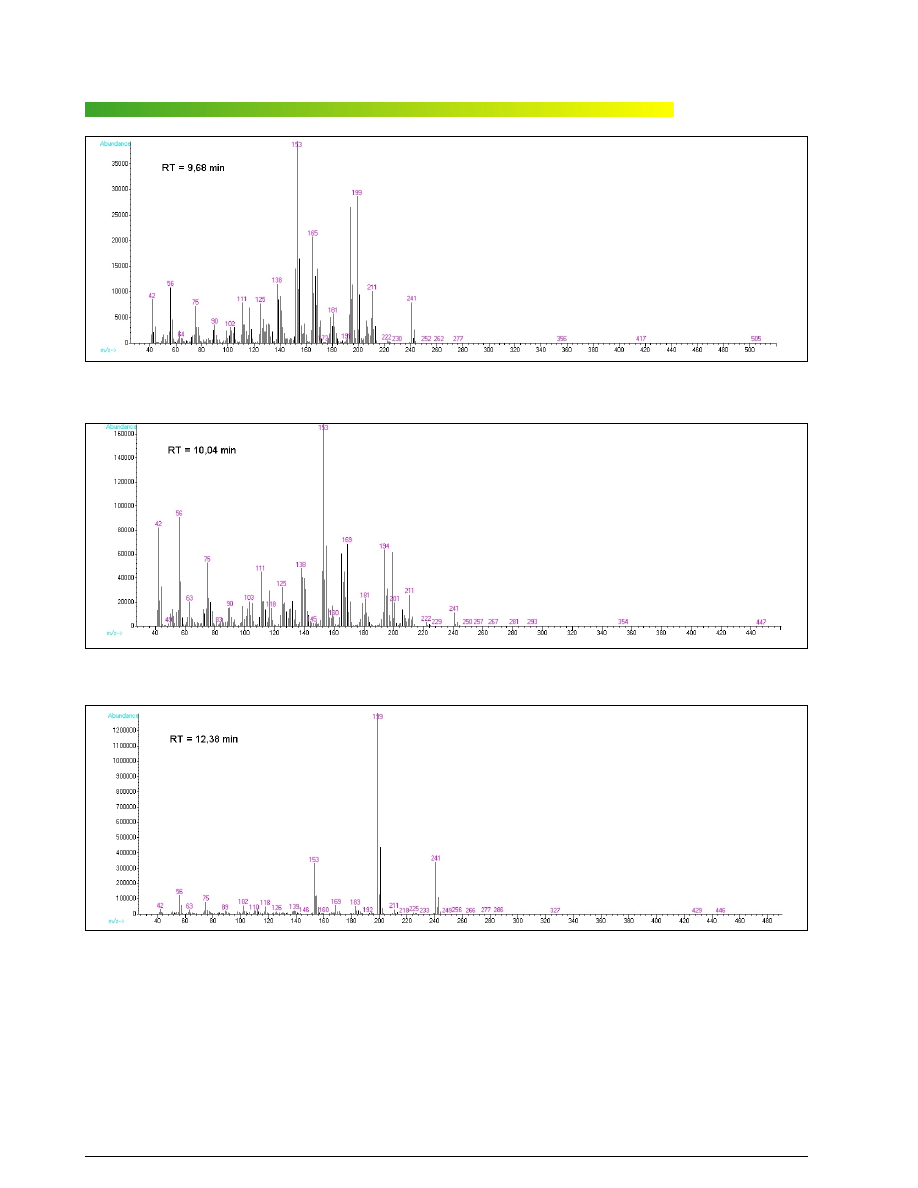
pik pochodz¹cy od pozosta³oœci nieprzereagowanej
N-(chlorofenylo)piperazyny. Na wszystkich trzech wid-
mach widaæ klastry pików w zakresie m/z 241–244,
z rozk³adem charakterystycznym dla efektu izotopowe-
go, wywo³anego obecnoœci¹ jednego atomu chloru
w cz¹steczce. NajwyraŸniej pochodz¹ one od izotopo-
wych jonów molekularnych. Pamiêtaj¹c, ¿e nominalna
masa cz¹steczkowa N-(chloronitrofenylo)piperazyny
wynosi 241 i dostrzegaj¹c podobieñstwa miêdzy wid-
mami, mo¿emy uznaæ, ¿e mamy do czynienia z jej izo-
merami. Z kolei ich liczba (3) dowodzi, ¿e wyjœciowym
zwi¹zkiem w próbce by³a mCPP.
Ró¿nice widoczne miêdzy pierwszymi dwoma wid-
mami ukazanymi na rycinach 7 i 8 a ostatnim, widocz-
PROBLEMY KRYMINALISTYKI 259 (styczeñ–marzec) 2008
71
Z PRAKTYKI
Z PRAKTYKI
Ryc. 7. Widmo masowe zarejestrowane dla zwi¹zku przy RT = 9,68 min
Fig. 7. Mass spectrum for a compund at RT = 9,68 min.
Ryc. 8. Widmo masowe zarejestrowane dla zwi¹zku przy RT = 10,04 min
Fig. 8. Mass spectrum for a compund at ET = 10,04
Ryc. 9. Widmo masowe zarejestrowane dla zwi¹zku przy RT = 12,38 min
Fig. 9. Mass spectrum for a compund at RT = 12,38 min.

nym na rycinie 9, mo¿na t³umaczyæ tzw. efektem orto.
Efekt ten, znany z ró¿nych dziedzin chemii, w spektro-
metrii mas przejawia siê odmiennoœci¹ widm izomerów
orto od widm izomerów meta i para, spowodowan¹
wzajemnym oddzia³ywaniem dwóch blisko po³o¿onych
podstawników, co wp³ywa na proces fragmentacji jonu
molekularnego. W opisywanym przypadku dotyczy³by
on pochodnych zawieraj¹cych s¹siaduj¹ce grupy – ni-
trow¹ i piperazynow¹.
Uwzglêdniaj¹c efekt orto, przesuniêcia czasów re-
tencji (jako skutek ró¿nic w polarnoœci, zwi¹zanych
z ró¿nym u³o¿eniem podstawników) oraz stosunki pól
powierzchni pików (jako skutek wp³ywu czynników
przestrzennych na wydajnoœæ syntezy poszczególnych
nitropochodnych), mo¿na przypisaæ poszczególne izo-
mery konkretnym pikom: N-(3-chloro-2-nitrofenylo)pi-
perazyna przy 9,68 min, N-(3-chloro-4-nitrofenylo)pipe-
razyna przy 12,38 min oraz N-(3-chloro-6-nitro-
fenylo)piperazyna przy 10,04 min. Nale¿a³oby to po-
twierdziæ dalszymi badaniami, jednak cel pracy – pozy-
tywna identyfikacja mCPP – zosta³ ju¿ osi¹gniêty.
Komentarza wymaga jeszcze zwi¹zek zarejestrowa-
ny przy czasie retencji 11,19 min na chromatogramie
widocznym na rycinie 2. Mo¿na go równie¿ zaobserwo-
waæ w niezmienionej postaci po reakcji nitrowania. Nie
figuruje on w bibliotece NIST 98, jednak na podstawie
widma masowego mo¿na wnioskowaæ, ¿e zawiera je-
den atom chloru i prawdopodobnie krótk¹ grupê alkilo-
w¹, zaœ jego masa cz¹steczkowa wynosi 268. Zwi¹zek
ten, wykryty we wszystkich próbkach mCPP badanych
dotychczas w CLK KGP, mo¿e stanowiæ bli¿ej nieokre-
œlony produkt uboczny syntezy.
Zaprezentowana nietypowa technika okreœlania po-
³o¿enia podstawników w cz¹steczce zwi¹zku aroma-
tycznego, wykorzystuj¹ca reakcjê nitrowania, mo¿e
okazaæ siê przydatna w przysz³oœci w trakcie badañ in-
nych, nowych narkotyków syntetycznych.
Ma³gorzata Czajkowska
£ukasz Matyjasek
ryc. i tab.: M. Czajkowska
BIBLIOGRAFIA
1. Szukalski B.: Pochodne piperazyny, pirolidyny, benzi-
midazolu i tryptaminy – nowe narkotyki zmodyfikowane, „Pro-
blemy Kryminalistyki” 2005, nr 249.
2. Aunan J.E., Ely R.A.: The Forensic Examination of
Benzylpiperazine and Phenylpiperazine Homologs, 9
th
Annu-
al CLIC Technical Training Seminar, 1999.
3. The EMCDDA’s European Database on New Drugs.
4. http://mdma.net/.
5. http://www.erowid.org/.
6. http://www.eve-rave.ch/drugs/.
7. http://www.hyperreal.pl/.
8. Morrison R.T., Boyd R.N.: Chemia organiczna, t. 1,
PWN, 1990.
9. Urbañski T.: Chemia i Technologia Materia³ów Wybu-
chowych, t. 1–3, wyd. MON, Warszawa 1954.
10. Urbañski T.: Chemistry and Technology of Explosive,
t. 4, Pergamon Press, 1984.
11. Hogget J.G., Moddie R.B.: Nitration and aromatic re-
activity, Cambridge University Press, 1971.
PROBLEMY KRYMINALISTYKI 259 (styczeñ–marzec) 2008
72
Z PRAKTYKI
Z PRAKTYKI
Czytelniku,
informujemy, ¿e jest do nabycia
„Przewodnik po metodach wizualizacji œladów
daktyloskopijnych”
w dwóch oprawach – broszurowej i segregatorowej,
obie wersje w tej samej cenie – 54 z³.
Zamówienia mo¿na sk³adaæ na adres:
Biuro Logistyki Policji KGP
ul. Domaniewska 36/38, 02-672 Warszawa
tel. (022) 60-129-45; faks (022) 60-130-59
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron