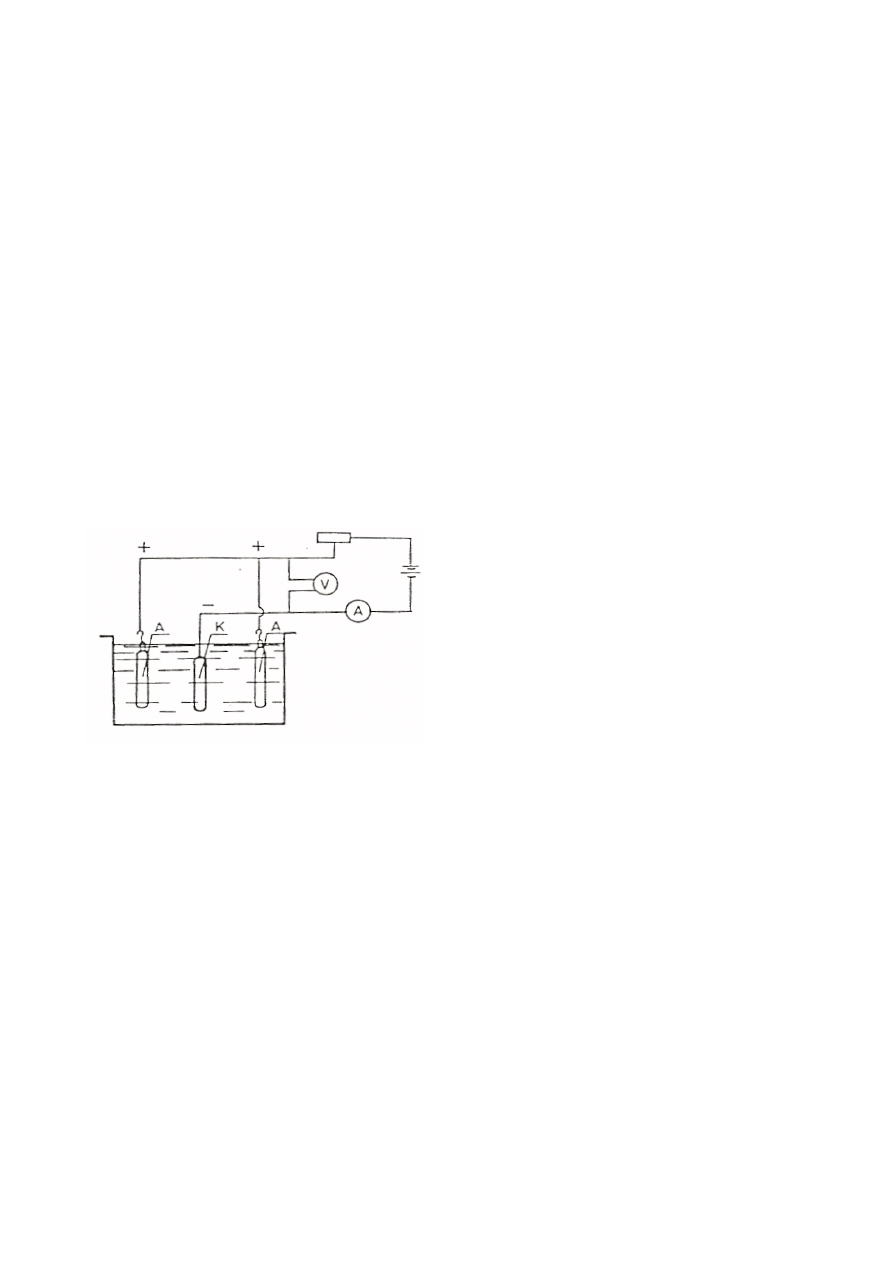
2. Powłoki elektrolityczne (galwaniczne)
2.1. Zarys procesu tworzenia powłoki metodą elektrolizy
Powłoki elektrolityczne nakłada się w procesach elektrolizy na podłoże przewodzące prąd
elektryczny. Odpowiednio oczyszczone, odtłuszczone i pozbawione warstwy tlenków wyroby
metalowe przeznaczone do nakładania powłok zanurzane są w roztworze elektrolitu
zawierającego jony metalu powłokowego. W czasie przepływu prądu stałego przez elektrolit
jony metalu przemieszczają się w kierunku pokrywanego podłoża (katody) i wydzielają na nim
tworząc powłokę, rys. 2.1.
Na katodzie osadzanie metalu zachodzi zgodnie z równaniem:
M
z+
+ z · e
-
→ M
0
Jednocześnie anoda, która zwykle jest z tego samego metalu, co wytwarzana powłoka,
rozpuszcza się według równania:
M
0
→ M
z+
+ z · e
-
.
Powstające jony metalu zasilają elektrolit, co pozwala utrzymywać ich określone stężenie
podczas elektrolizy.
Przemieszczanie się jonów podczas elektrolizy jest skutkiem nie tylko przepływu prądu, ale
także dyfuzji i konwekcji.
Rys. 2.1. Schemat elektrolizera do
nakładania powłok galwanicznych;
A (anoda) – metal powłokowy,
K (katoda) – pokrywany przedmiot
Proces elektrolizy można prowadzić w roztworach elektrolitów zawierających proste jony
osadzanych metali, jak i w roztworach zawierających związki kompleksowe (zespolone), przy
czym wydzielanie powłok z kąpieli jonów kompleksowych zachodzi przy znacznie obniżonych
potencjałach katod.
Podczas elektrolizy możliwe jest jednoczesne wydzielanie na katodzie dwóch lub więcej metali,
które tworzą powłoki stopowe, np. przez jednoczesne osadzanie miedzi i cynku wytwarza się
powłokę mosiężną.
Na elektrodach poza procesami podstawowymi wydzielania i rozpuszczania metalu mogą
zachodzić niepożądane procesy uboczne, na katodzie np. wydzielanie gazowego wodoru,
zgodnie z reakcjami: H
2
O
→ H
+
+ OH
-
i z H
+
+ z e
-
→ H
2
,
a na anodzie – tlenu: 2H
2
O
→ O
2
+ 4 H
+
+ 4 e
-
,
co nie tylko powoduje zużycie części prądu i zmniejszenie wydajności procesu, ale inne
szkodliwe skutki, jak np. kruchość wodorową pokrywanego metalu.
W elektrolicie, który jest zazwyczaj roztworem wodnym, każdy kation metalu otoczony jest
określoną liczbą cząsteczek (dipoli) wody. W pobliżu katody w tzw. warstwie dyfuzyjnej
elektrolitu rozmieszczenie cząsteczek wody wokół kationów ulega deformacji. Przy samej
powierzchni metalu istnieje tzw. warstwa podwójna, gdzie jony metalu uwalniają się od
otaczających je cząsteczek wody, a następnie adsorbują się na katodzie i zobojętniają swe
ładunki elektronami pobieranymi z katody. Powstające atomy metalu dyfundują po powierzchni
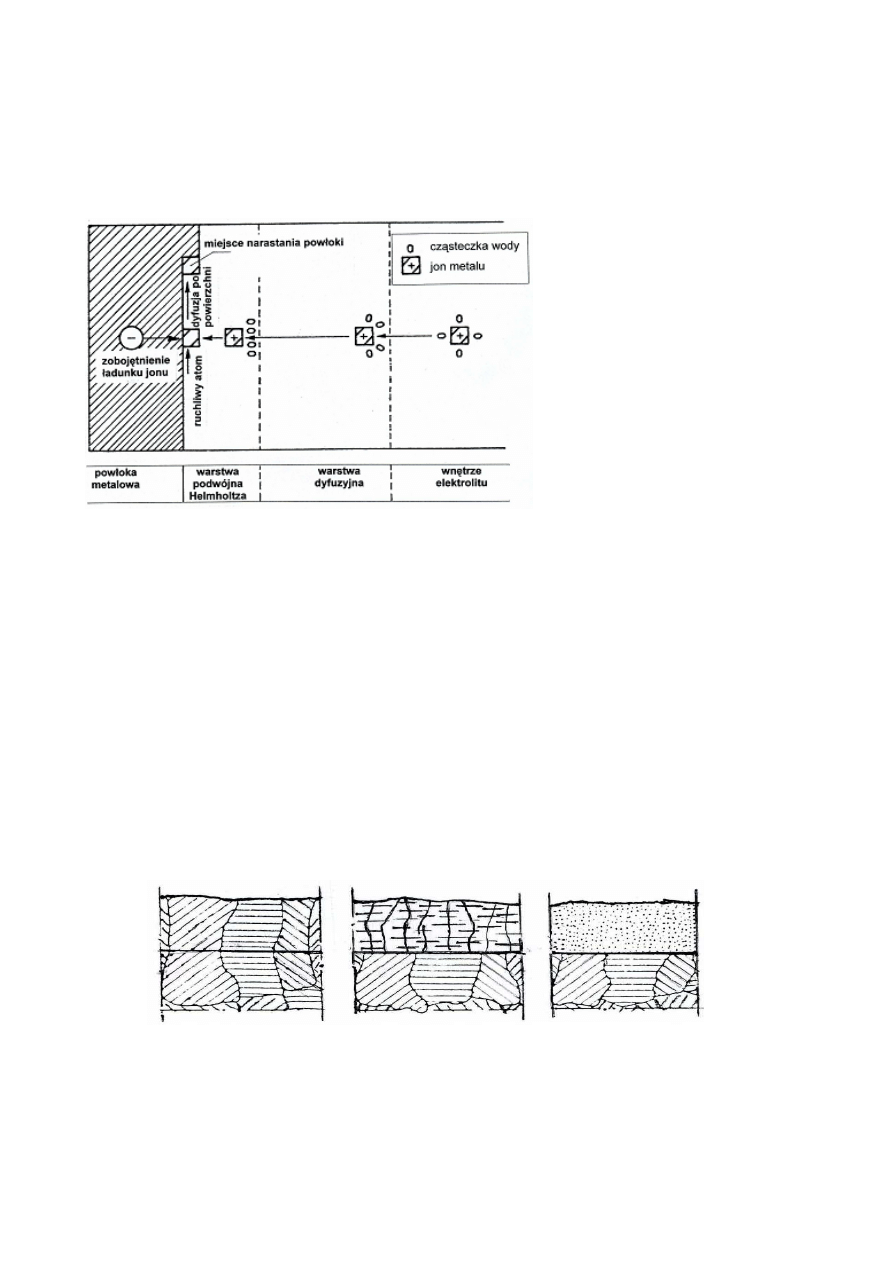
katody do miejsca pozwalającego na wbudowanie ich do sieci krystalicznej, co schematycznie
przedstawiono na rys. 2.2. Miejscem wbudowywania się atomów są obszary, które wymagają
najmniejszego wkładu energii tworzenia i rozrostu zarodków krystalizacji. Nagromadzone
zaadsorbowane jony mogą utworzyć trwałe zarodki krystalizacji, po osiągnięciu określonej
wielkości.
Rys. 2.2. Schemat
elektrokrystalizacji;
- we wnętrzu elektrolitu
uwodniony jon metalu,
- w warstwie dyfuzyjnej
deformacja rozmieszczenia
cząsteczek wody,
- w warstwie podwójnej
Helmholtza utrata cząsteczek
wody przez jon metalu
Proces elektrokrystalizacji przebiega w dwóch etapach:
- tworzenie zarodków krystalizacji,
- rozrost zarodków i formowanie powłoki.
Szybkość tworzenia zarodków i szybkość wzrostu kryształów decydują o budowie powłoki
galwanicznej. Pożądane powłoki drobnoziarniste otrzymuje się przy względnie większej
szybkości tworzenia zarodków niż szybkości wzrostu kryształów.
Wielkość kryształów osadzanego metalu, ich orientacja i kształt wpływają na niektóre własności
powłok. Wyróżnia się trzy zasadnicze typy struktur elektrolitycznie osadzanych powłok
metalowych, rys. 2.3:
a) struktura zorientowana podłożem, tzn. reprodukująca strukturę metalu podłoża. Tworzy się
ona przy stosowaniu niskich gęstości prądu osadzania metalu i niewielkim udziale substancji
inhibitujących, posiada wprawdzie zwartą, ale grubokrystaliczną budowę,
b) struktura uwarunkowana polem elektrycznym. Tworzy się przy wyższych gęstościach prądu i
zwiększeniu roli inhibitorów,
c) struktura anizotropowa. Tworzy się przy bardzo silnym inhibitowaniu procesów osadzania
metali. Struktura powłoki ma postać dyspersyjną bez uprzywilejowanej orientacji.
Rys. 2.3. Podstawowe typy struktur powłok metalowych osadzanych elektrolitycznie;
a – zorientowana podłożem, b – uwarunkowana polem elektrycznym, c - anizotropowa
Pomiędzy wymienionymi typami struktur istnieją różne formy przejściowe, a także inne
uzyskane w wyniku specyficznych warunków elektrolizy.
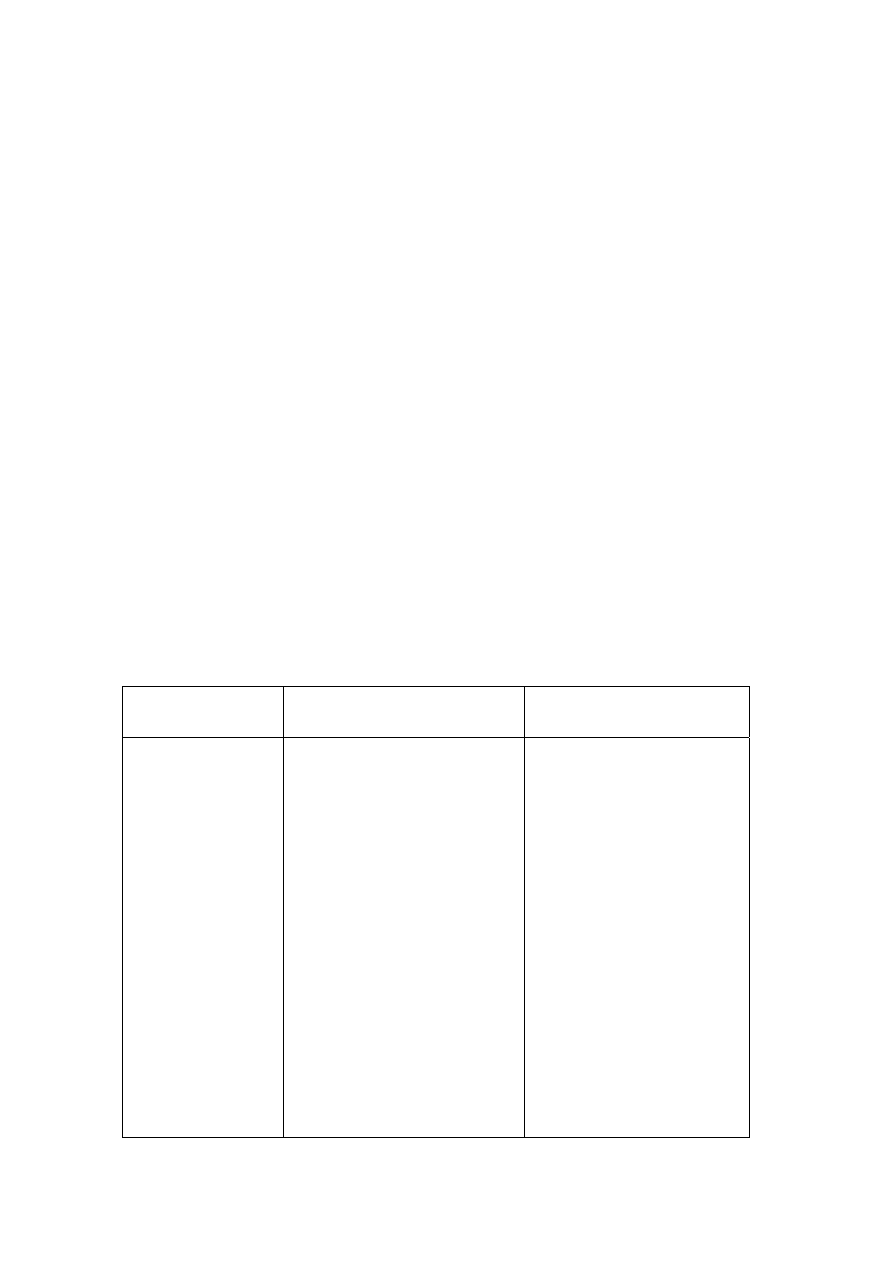
Zgodnie z prawem Faradaya masa metalu wydzielonego na katodzie m jest proporcjonalna do
wielkości ładunku Q przeniesionego przez elektrolit:
m = k · Q,
przy czym współczynnik proporcjonalności k = M/n
.
F i Q = I
.
t , więc
m = k · I · t
gdzie: I – natężenie prądu, t – czas, n – liczba ładunków jonu metalu (wartościowość), M- masa
atomowa lub cząsteczkowa, F – stała Faradaya.
Jeżeli pożądanej reakcji osadzania metalu na katodzie towarzyszą procesy uboczne, np.
wydzielanie wodoru, to występują pozorne odstępstwa od prawa Faradaya, ponieważ część
ładunku zostaje zużyta w reakcji ubocznej, obniżając efekt reakcji pożądanej. Dlatego w
zagadnieniach elektrolizy technicznej stosowane jest pojęcie wydajności prądowej, jako
stosunek ilości substancji wydzielanej do jej ilości obliczonej z prawa Faradaya.
Wydzielenie z elektrolitu jonu metalu na elektrodzie (elektrokrystalizacja) wymaga
zwiększonego potencjału w stosunku do potencjału standardowego elektrody (tabl. 2.1) o pewną
wartość, wyrażającą wielkość pracy niezbędnej dla utworzenia kryształu. Ten wzrost potencjału
nazywa się nadnapięciem lub polaryzacją elektrody i wyraża się wzorem:
E = E
0
+ RT ln a , gdzie E – potencjał wydzielania,
E
0
- potencjał standardowy,
R – stała gazowa,
T – temperatura w skali bezwzględnej.
a – aktywność jonów metalu.
W zależności od rodzaju metalu, składu elektrolitu i warunków elektrolizy, mierzalny wzrost
kryształu wymaga odpowiedniego wzrostu potencjału ponad potencjał standardowy elektrody.
Stwierdzono, że im większa wartość polaryzacji, tym mniejsze wymiary zarodka krystalicznego.
Tablica 2.1
Szereg napięciowy metali
Pierwiastek
chemiczny
Reakcja elektrodowa
Standardowy potencjał
elektrodowy w temp. 25
o
C
Lit
sód
magnez
aluminium
tytan
wanad
cynk
chrom
żelazo
nikiel
cyna
ołów
wodór
miedź
srebro
platyna
złoto
Li → Li
+
+ e
-
Na → Na
+
+ e
-
Mg → Mg
2+
+ 2e
-
Al → Al
3+
+ 3e
-
Ti → Ti
2+
+ 2e
-
V → V
2+
+ 2e
-
Zn → Zn
2+
+ 2e
-
Cr → Cr
3+
+ 3e
-
Fe → Fe
2+
+ 2e
-
Ni → Ni
2+
+ 2e
-
Sn → Sn
2+
+ 2e
-
Pb → Pb
2+
+ 2e
-
H
2
→ 2H
+
+ 2e
-
Cu → Cu
2+
+ 2e
-
Ag → Ag
+
+ e
-
Pt → Pt
2+
+ 2e
-
Au → Au
3
+ + 3e
-
-3,045
-2,714
-2,363
-1,667
-1,662
-1,18
-0,763
-0,744
-0,440
-0,250
-0,136
-0,126
0
+0,337
+0,987
+ 1,20
+1,498

2.2. Rodzaje powłok i stawiane im wymagania
Metodą galwaniczną można osadzać większość metali zarówno elektrododatnich, np. Au, Ag,
Cu, jak i elektroujemnych, jak Zn, Sn, Ni, Cd, Fe w stanie czystym lub w postaci stopów
galwanicznych, np. Cu-Zn.
W zależności od przeznaczenia wyróżnia się powłoki:
- ochronne, zabezpieczające metal przed korozją, np. Zn na stali,
- dekoracyjne lub ochronno-dekoracyjne, poprawiające wygląd przedmiotu, bądź jednocześnie
chroniące przed korozją, np. Ni na stali, czy wielowarstwowe Cu-Ni-Cr na stali,
- techniczne, wytwarzane w celu nadania powierzchni metalu określonych własności
fizycznych lub technologicznych; zwiększonej odporności na ścieranie, zmniejszonego
współczynnika tarcia, podwyższonego przewodnictwa elektrycznego, poprawy zdolności
łączenia przez lutowanie, zwiększenie stopnia odbicia i połysku powierzchni, bądź zmiany
wymiarów pokrywanych części, regeneracji zużytych części, zabezpieczenia określonych
powierzchni w czasie wykonywania procesów obróbki powierzchniowej.
Mechanizm działania ochronnego powłok galwanicznych jest związany z rodzajem metalu
podłoża i powłoki. Wyróżnia się powłoki anodowe i katodowe.
Powłoki anodowe w określonych środowiskach korozyjnych mają niższy potencjał
elektrochemiczny od potencjału chronionego podłoża. W przypadku uszkodzenia powłoki lub
występowania w niej porów niszczeniu ulega powłoka, tak jak np. Zn lub Cd na stali, rys. 1.3a z
rozdz. 1.
Powłoki katodowe w określonych środowiskach korozyjnych wykazują wyższy potencjał
elektrochemiczny (bardziej dodatni) od potencjału chronionego podłoża. Pęknięcia, odpryski,
pory, odsłonięcie podłoża wzbudza ogniwo galwaniczne, w którym anodą jest podłoże, ulegające
korozji pod powłoką. Powłoki katodowe chronią więc podłoże wyłącznie przez mechaniczne
odizolowanie od środowiska korozyjnego. Efektywność działania powłok katodowych zwiększa
się ze wzrostem ich grubości.
Do ważniejszych wymagań stawianych powłokom galwanicznym należą:
- dobra przyczepność (adhezja) powłoki do podłoża,
- szczelność, czyli jak najmniejsza porowatość, co ma szczególne znaczenie dla powłok
katodowych,
- drobnokrystaliczna struktura,
- odpowiednia, minimalna grubość dla danych warunków użytkowania,
- wygląd zewnętrzny; barwa, gładkość.
2.3. Czynniki wpływające na budowę powłoki galwanicznej
Głównymi czynnikami wpływającymi na wygląd powłoki są: gęstość prądu katodowego,
stężenie i intensywność mieszania elektrolitu, temperatura, obecność substancji powierzchniowo
czynnych, rodzaj elektrolitu, własności metalu, na którym osadza się powłokę.
Gęstość prądu. Jest to stosunek natężenia prądu, do całkowitej powierzchni katody A/dm
2
. Przy
małych gęstościach prądu wyładowanie jonów na katodzie następuje powoli i szybkość wzrostu
powstałych już zarodków przekracza szybkość powstawania nowych zarodków. Warunki te
sprzyjają powstawaniu powłok grubokrystalicznych. W miarę wzrostu gęstości prądu zwiększa
się również szybkość powstawania zarodków i powłoka staje się dzięki temu bardziej
drobnoziarnista. Przy bardzo dużych gęstościach prądu stężenie rozładowujących się jonów w
pobliżu katody bardzo maleje, wskutek czego kryształy wykazują tendencję wzrostu w kierunku
warstw roztworu o większym stężeniu osadzanych jonów. Na powłoce powstają w takim
przypadku narosty (dendryty). Przy zwiększaniu gęstości prądu może dojść do wydzielania
wodoru, wskutek czego powłoki mogą być porowate i gąbczaste.

Stężenie elektrolitu. Elektrolity stosowane do galwanicznej obróbki powierzchni, czyli kąpiele
galwaniczne mogą być roztworami prostych soli wydzielanych metali, bądź roztworami ich
związków kompleksowych*. Zwiększając stężenie jonów powłokotwórczych albo mieszając
elektrolit można stosować większe gęstości prądu bez obawy tworzenia struktury
grubokrystalicznej lub wydzielania wodoru. Wpływ stężenia elektrolitu na szybkość
powstawania zarodków nie został ostatecznie wyjaśniony. Z kąpieli o dużym stężeniu elektrolitu
otrzymuje się wprawdzie powłoki bardziej zwarte i dobrze przyczepne stwierdzono jednak, że
szybkość powstawania zarodków maleje ze wzrostem stężenia, a polepszenie własności powłok
związane jest ze zwiększeniem szybkości wzrostu kryształów wzdłuż powierzchni katody i ze
spadkiem szybkości ich wzrostu w kierunku prostopadłym do tej powierzchni. Wzrost stężenia
elektrolitu powoduje również wzrost przewodnictwa kąpieli, a więc zmniejszenie spadku
napięcia.
Temperatura. Wzrost temperatury ma dwojaki wpływ. Z jednej strony sprzyja dyfuzji, co
zapobiega – w pewnym stopniu powstawaniu struktury gruboziarnistej lub powłok gąbczastych
przy dużych gęstościach prądu, z drugiej zaś strony zwiększa szybkość wzrostu kryształów, co
sprzyja tworzeniu powłok gruboziarnistych. Ponadto wzrost temperatury m.in. ułatwia
niepożądane wydzielanie wodoru gazowego na katodzie. W temperaturach niezbyt wysokich
jakość powłok jest lepsza niż wytworzonych w wyższych temperaturach
Mieszanie kąpieli wpływa na obniżenie grubości warstwy dyfuzyjnej, a więc umożliwia
podwyższenie gęstości prądu i w rezultacie wzrost szybkości osadzania metalu.
Substancje powierzchniowo czynne. Dodatek do elektrolitu bardzo małych ilości substancji
powierzchniowo czynnych lub koloidalnych powoduje powstawanie powłok drobno--
krystalicznych, bez ich udziału powłoka osadzana w tych samych warunkach miałaby budowę
grubokrystaliczną.
Elektrolit. Rodzaj elektrolitu wywiera istotny wpływ na budowę powłoki – drobno lub
grubokrystaliczną. Być może, zachodzi to wskutek możliwości powstawania substancji
koloidalnych, które sprzyjają tworzeniu powłok drobnoziarnistych
Jakość powłok galwanicznych jest ściśle związana z własnościami kąpieli galwanicznych:
wgłębnością, zdolnością krycia i mikrowygładzania.
Wgłębność kąpieli to tendencja do osadzania powłoki o jednakowej grubości na całej
powierzchni pokrywanego wyrobu. Wgłębność kąpieli można poprawić zwiększając jej
przewodność np. przez podwyższenie stężenia soli przewodzących i podwyższenie temperatury.
Podwyższenie temperatury może jednak obniżyć polaryzację, w wyniku czego czynnik ten może
ostatecznie pozostać bez wpływu.
Zdolność krycia kąpieli jest definiowana jako minimalna gęstość prądu, przy której rozpoczyna
się osadzanie powłoki galwanicznej.
Mikrowygładzanie jest bardzo ważną własnością nowoczesnych kąpieli galwanicznych do
osadzania powłok błyszczących. Umożliwia uzyskiwanie powłok o gładkości wyższej niż
gładkość pokrywanego podłoża.
2.4. Procesy nakładania wybranych powłok galwanicznych
Technologia nakładania powłok galwanicznych obejmuje:
- przygotowanie powierzchni podłoża,
- elektrolityczne nakładanie powłoki,
- obróbkę wykańczającą.
Powłoki galwaniczne wymagają bardzo starannego przygotowania powierzchni metalu podłoża
do elektrolizy, tj.: oczyszczenia mechanicznego, odtłuszczenia, trawienia oraz dotrawiania,
przeprowadzonego bezpośrednio przed nałożeniem powłoki w celu usunięcia warstwy tlenków.
Pomiędzy kolejnymi operacjami przygotowania przedmiotu należy stosować płukanie, aby
uniknąć przenoszenia składników poszczególnych kąpieli.

Przedmioty do pokrywania galwanicznego powinny być całkowicie wykończone pod względem
obróbki mechanicznej, posiadać odpowiednie wymiary i wymagany stopień gładkości
powierzchni i krawędzi.
2.4.1. Powłoki cynkowe
Rozpowszechnienie powłok cynkowych wynika z dostępności, niskiej ceny, dobrych własności
ochronnych i dekoracyjnych tego metalu.
Cynk jako metal bardziej elektroujemny niż żelazo, tworzy na stali i żeliwie powłoki anodowe.
W wilgotnym powietrzu powstające na powierzchni produkty korozji tworzą dość szczelną
warstwę izolującą podłoże od środowiska. Jako dodatkowe zabezpieczenie antykorozyjne
powłok cynkowych stosuje się wytwarzanie na nich warstewek chromianowych lub
fosforanowych, a ostatnio zalecanych chromitowych.
Do cynkowania stosuje się kilka typów kąpieli galwanicznych, zależnie od wymaganych
własności i zastosowania powłoki. Są to kąpiele kwaśne, słabokwaśne oraz alkaliczne –
cyjankowe i bezcyjankowe. Cynkowanie nowej generacji jest oparte na elektrolitach
alkalicznych bezcyjankowych.
Szerokie zastosowanie znalazły kąpiele kwaśne do ciągłego pokrywania taśm, blach, drutów i
rur stalowych. Przykładowy skład kąpieli i warunki procesu:
• ZnSO
4
· 7H
2
O 500g/l,
• Na
2
SO
4
· 10H
2
O 50g/l,
• Al.
2
(SO
4
)
3
· 18H
2
O 30g/l,
• przy pH 3,8 ÷ 4,4, gęstości prądu 3-10 A/dm
2
i temperaturze 18 ÷ 25
o
C, z anodą w
postaci metalicznego cynku.
W procesie cynkowania ciągłego osadzona powłoka o grubości 3÷12 µm stanowi zabezpieczenie
przed korozją, a wartość ochronna jest proporcjonalna do grubości.
Istotną zaletą galwanicznych powłok cynkowych jest ich dobra przyczepność do podłoża, a
jednocześnie większa plastyczność niż otrzymywanych innymi metodami. Szczególnie duże
ilości cynku zużywa się w przemyśle maszynowym i samochodowym do pokrywania taśm,
blach, drutów stalowych i drobnych elementów. Cynkowane są też elementy wyposażenia
samochodów, rowerów, urządzeń domowych, sprzętu elektrycznego. Blachy cynkowane
galwanicznie używane są do wytwarzania wytłoczek nadwozi samochodowych i zbiorników
paliwa. Przemysł samochodowy stosuje głównie blachy cynkowane jednostronnie, bowiem
powlekane dwustronnie sprawiają trudności przy zgrzewaniu. Blachy powlekane jednostronnie
są dobrze zgrzewalne i jednocześnie malowanie ich nie pokrytej powierzchni, pozwala uzyskać
lepszy efekt.
W przemyśle samochodowym jednakże, zgodnie z wytycznymi U.E., będą dozwolone pokrycia
ochronne nie zawierające chromu sześciowartościowego (chromiany), który jest toksyczny i
rakotwórczy. Poszukuje się nowych zabezpieczeń, a jedną z propozycji jest pasywowanie
powłok cynkowych lub cynkowo-żelazowych solami chromu trój-wartościowego tworzącymi
warstwy chromitowe. Dodatkowo są one odporne na oddziaływanie temperatur do 200
o
C i mogą
być utrwalane przez zabezpieczenia organiczne, bądź nieorganiczne.
Powierzchnie gwintowane pokrywa się powłokami cynkowymi o grubości uwzględniającej
pracę złączy. Ponieważ cynk jest bardziej plastyczny niż stal, przenoszenie naprężeń statycznych
i dynamicznych przez powierzchnie ocynkowanych gwintów jest ograniczona współpracującymi
powierzchniami złącza gwintowanego odpowiadającymi metalowi podłoża stalowego. Stąd
grubości powłoki cynku na złączach jest kompromisem między wymogami ochrony
antykorozyjnej i wymogami przenoszenia naprężeń. Zwykle na częściach gwintowanych o skoku
gwintu do 0,8 mm nakłada się powłoki cynku grubości 3-6 µm, gdy skok gwintu przekracza 0,8
mm, powłoka cynku posiada grubość 9-12 µm. Wyroby gwintowane cynkowane nie wymagają
ponownego przegwintowania i należą do najskuteczniejszych zabezpieczeń złączy
gwintowanych, a także wkrętów przed korozją.

Większą odporność korozyjną galwanicznych powłok cynkowych można uzyskać przez
wprowadzenie do kąpieli galwanicznej np. soli chromu i kobaltu, które wbudowują metaliczny
kobalt i tlenek chromu do powłoki, podczas jej osadzania. Ponadto zwiększenie odporności
blach cynkowanych można uzyskać przez nakładanie powłok stopowych cynk-nikiel (13%
Ni),czy cynk-żelazo (10 ÷ 20% Fe).
2.4.2. Powłoki chromowe
Chrom jest metalem powszechnie stosowanym w galwanotechnice do pokryć dekoracyjno-
ochronnych z uwagi na nadawanie powierzchniom atrakcyjnego wyglądu – trwałego
lustrzanego połysku w warunkach atmosferycznych i znacznej odporności korozyjnej,
wynikającej z własności pasywnych chromu. Jednocześnie bardzo wysoka twardość warstw
chromu otrzymanego w odpowiednich warunkach (większa od twardości zahartowanych stali)
jest wykorzystywana do pokryć technicznych.
Powłoki ochronno-dekoracyjne są cienkie, poniżej 1 µm, osadzane na podwarstwie miedzi i
niklu lub niklu. Powłoki techniczne nakłada się bezpośrednio na podłoże stalowe lub inne, a ich
grubość wynosi 5 ÷ 200 µm, niekiedy do 1 mm.
Podstawowym składnikiem kąpieli do chromowania jest bezwodnik kwasu chromowego, CrO
3
,
którego roztwory wodne z dodatkiem ok. 1% kwasu siarkowego są najczęściej stosowane przy
temperaturze od 40 ÷ 60°C i katodowej gęstości prądu 35 ÷ 50 A/dm
2
. Przy chromowaniu
stosuje się anody nierozpuszczalne, zazwyczaj ze stopu ołowiu z antymonem lub cyną. Anody
chromowe są nieprzydatne, ponieważ wydajność ich rozpuszczania jest wielokrotnie wyższa niż
wydajność procesu osadzania chromu na katodzie, co powodowałoby szybki, nadmierny wzrost
stężenia jonów chromu w elektrolicie.
Wydzielony elektrolitycznie chrom posiada wyjątkowo drobnokrystaliczną budowę.
Powłoki ochronno-dekoracyjne stosuje się do przedmiotów codziennego użytku, elementów
aparatury, akcesoriów samochodowych.
Powłoki techniczne o grubości większej niż 25 µm, z uwagi na wysoką twardość, ok.1000 HV,
określa się też jako „chrom twardy”, są one jednak kruche. Zaletą ich jest obniżenie
współczynnika tarcia względem stali, wysoka odporność na zużycie, dobra przewodność cieplna
i trwałość w wysokich temperaturach. Taki zespół właściwości pozwala na zastosowanie chromu
wszędzie tam, gdzie wymagana jest odporność na ścieranie, erozję i korozję
wysokotemperaturową. Rozpowszechnione jest chromowanie cylindrów silników spalinowych,
pierścieni tłokowych, tłoczysk podnośników hydraulicznych. Doskonałe wyniki daje
chromowanie matryc i tłoczników, zwłaszcza do wykonywania przedmiotów z tworzyw
sztucznych, gumy i skóry. Duża gładkość i mały współczynnik tarcia tych narzędzi zapewnia
doskonały wygląd wytwarzanych produktów. Chromowaniu poddaje się narzędzia skrawające,
wykorzystując małą adhezję obrabianych materiałów, chromuje się przyrządy pomiarowe i
sprawdziany, łożyska dla lotnictwa.
Przedmioty podlegające ścieraniu i pracujące w warunkach niedostatecznego smarowania, jak
cylindry silników spalinowych, pierścienie tłokowe, sworznie zaworów poddaje się
chromowaniu porowatemu. Na powierzchni powłoki chromowej występują pory, w których
zbiera się smar ułatwiający poślizg współpracujących części. Wytworzenie warstwy chromu
porowatego polega na dodatkowej obróbce anodowej przedmiotów chromowanych. Chrom
rozpuszcza się w porach i szczelinach, które zwykle występują w warstwach chromowanych –
poszerza i pogłębia te pory.
Jednym z ważnych zastosowań jest regeneracyjne uzupełnianie ubytków powierzchni
eksploatowanych wałów, a także powlekanie wszelkiego rodzaju nowych wałów.
Przykłady zastosowania chromowych powłok galwanicznych w motoryzacji przedstawiono w
tabl. 2.2.

2.4.3. Powłoki niklowe
Galwaniczne powłoki niklowe należą do najszerzej stosowanych. Atrakcyjny wygląd powłok,
duża odporność korozyjna, korzystne własności mechaniczne pozwalają na zastosowanie powłok
w celach dekoracyjno-ochronnych oraz technicznych.
Nikiel osadzony bezpośrednio na stali ma charakter powłoki katodowej, a więc chroni podłoże
tylko mechanicznie. Odporność niklu na działanie wielu środowisk korozyjnych wynika z jego
własności pasywnych.
Do niklowania stosuje się wiele kąpieli. Najszersze zastosowanie przemysłowe znalazły kąpiele
typu Wattsa, oparte na trzech podstawowych składnikach: siarczanie niklawym, chlorku
niklawym i kwasie borowym. Przykładowe proporcje składników: 200 ÷300 g/l, 20 ÷ 60 g/l i 35
÷ 45 g/l, przy parametrach pracy: gęstość prądu 1 ÷ 4 A/dm
2
, temperatura 40 ÷ 55°C i
zastosowaniu anody niklowej.
Grubość ochronnych powłok niklowych osadzanych na stali wynosi 5 ÷ 40 µm, a powłok
technicznych przekracza 50 µm, sięgając nawet 500 µm.
Powłoki niklowe są podstawą wielowarstwowych powłok dekoracyjno-ochronnych łącznie z
chromem i miedzią. Służą do pokrywania akcesoriów samochodowych, armatury, rys. 2.4.
Dzięki korzystnym własnościom mechanicznym niklowanie stosuje się do regeneracji zużytych
części maszyn, galwanoplastycznego wytrawiania form wtryskowych. W przemyśle
chemicznym grubymi powłokami niklowymi pokrywa się aparaturę chemiczną narażoną na
działanie silnych zasad.
Rys. 2.4. Mikrostruktura mosiądzu pokrytego
ochronno-dekoracyjną powłoką niklu; jasna
równomierna warstwa powłoki nie
wytrawiona na podłożu mosiądzu
dwufazowego (α + β’). Traw. FeCl
3
2.4.4. Powłoki żelazne
Elektrolityczne powłoki żelazne są powłokami technicznymi nakładanymi w celach
regeneracyjnych lub w celu wykorzystania ich zdolności pochłaniania i utrzymywania środków
smarujących – większych niż posiada np. chrom. Tę cechę powłok żelaznych wykorzystano
m.in. do pokrywania aluminiowych tłoków silników spalinowych.
Elektrolityczne żelazowanie znalazło zastosowanie do celów specjalnych w galwanoplastyce,
przy regeneracji części stalowych, do pokrywania miedzianych grotów lutowia, aby zapobiec
wzajemnej dyfuzji lutowia i miedzi. Regeneracyjne powłoki żelaza (rys.2.5) powinny pracować
w środowisku, które zwiększa ich małą odporność korozyjną, np. w olejach i smarach.
Przykładem najczęściej stosowanej kąpieli do żelazowania jest następujący zestaw:
• FeCl
3
.
2H
2
O - 300 ÷ 450 g,
• CaCl
2
– 150 ÷ 190 g, o temperaturze co najmniej 88°C, przy gęstości prądu
do 20 A/dm
2
i stosowaniu anod z czystego żelaza Armco.

Rys. 2.5. Regeneracyjna trzywarstwowa
powłoka żelazna na stali konstrukcyjnej.
Traw. nital
2.4.5. Powłoki stopowe
Elektrolityczne powłoki stopowe posiadają bardzo specyficzne własności i są stosowane przy
szczególnych wymaganiach, których nie mogą spełniać pojedyncze metale, jak np. duża
twardość i żaroodporność lub specyficzne własności przeciwcierne czy mały opór przejścia,
bądź duża odporność na ścieranie.
Stopy galwaniczne są zazwyczaj podobne do metalurgicznych, przede wszystkim w zakresie
budowy fazowej, własności.
Powłoki mosiężne i brązowe. Najczęściej stosowane są mosiądze o zawartości powyżej 65% Cu,
co oznacza, że są to powłoki jednofazowe – bardziej odporne na korozję niż dwufazowe.
Powłoki mosiężne są powłokami katodowymi, stosowanymi jako ochronne, dekoracyjne i
techniczne. Pokrywa się nimi wnętrza zbiorników stalowych, wanien przed wyłożeniem ich
gumą, co przyczynia się do wytworzenia trwałego mechanicznego połączenia wykładziny
gumowej z podłożem. W górnictwie stosuje się mosiądzowanie elementów obudów ścianowych,
elementy hydrauliki siłowej, zabezpieczające przed agresywnością korozyjną środowiska
kopalnianego.
Powłoki brązowe, najczęściej jednofazowe stosuje się w celach technicznych i dekoracyjnych.
Znajdują zastosowanie w produkcji łożysk ślizgowych, jako ochrona przy azotowaniu, jako
warstwa pośrednia przy osadzaniu innych metali, np.: Ni, Cr, Au.
Powłoki wolfram-kobalt i wolfram-nikiel charakteryzują się dużą twardością, która nie obniża
się do temperatury około 600°C (twardość na gorąco). Stosuje się do pokrywania styków w
przekaźnikach i przełącznikach na dość duże moce.
Powłoki niklowo-żelazowe stosowane są w przemyśle elektronicznym na pokrycia magnetyczne.
Błyszczące powłoki stosuje się do pokrywania sprzętu sportowego, okuć meblowych, narzędzi,
armatury łazienkowej, często z dodatkowym zabezpieczeniem powłoką chromową.
2.4.6. Powłoki kompozytowe
Do regeneracji stalowych części maszyn stosuje się elektrochemiczne powłoki kompozytowe,
które są konkurencyjne w porównaniu do klasycznych powłok regeneracyjnych chromowych,
żelaznych lub niklowych.
Elektrochemiczne powłoki kompozytowe otrzymuje się z elektrolitów stosowanych do
wydzielania metali, w których rozproszono cząstki proszków niemetalicznych: tlenków,
azotków, węglików, siarczków bądź tworzyw sztucznych. Podczas elektrolitycznego osadzania
metalu cząstki proszku wbudowują się w warstwę osadzanego na katodzie metalu. Obecność
zawieszonych cząstek w roztworze pozwala na stosowanie większych gęstości prądu, przez co
szybsze jest osadzanie powłok o żądanej grubości. Wynika to z faktu, że proszek oczyszcza
powierzchnię katody i miesza warstwę elektrolitu przy katodzie, co powoduje zmniejszenie jego
oporu elektrycznego.

W celu zwiększenia odporności na ścieranie stosuje się powłoki kompozytowe z wtrąceniami
twardych cząstek – tlenków i węglików – Ni-Al
2
O
3
, Ni-SiC, Fe-Al
2
O
3
, lub miękkich,
samosmarujących cząstek – siarczków, tworzyw sztucznych (np. fluoropolimerów) - Ni-MoS
2
,
Fe-MoS
2
, Ni-PTFE. Powłoki te mają unikalne walory techniczne, łączą w sobie własności
samosmarne i antyprzyczepne.
Tabl. 2.2
Przykłady powłok elektrolitycznych i ich grubości na wyrobach przemysłu motoryzacyjnego
wg PN-83//H-97006 i BN-83/3602-01
Oznaczenia: Nib – powłoka niklowa błyszcząca, Nid- podwójna lub potrójna powłoka niklowa,
Cr r - powłoka zwykła o minimalnej grubości 0,3 µm,
Cr mc – powłoka Cr mikrospękana o min grubości 0,3 µm,
Cr mp – powłoka Cr mikrospękana o min. grubości 0,3 µm.
Warunki użytkowania
Rodzaj
powłoki
Lekkie Umiarkowane
Ciężkie Wyjątkowo
ciężkie
Podłoże: Stal nierdzewna
1-warstwowa
chromowa
-
Listwy, części wewnątrz
pojazdu
Cr r
Listwy, części na zewnątrz
pojazdu
Cr r
-
Podłoże: Stal niestopowa
2-warstwowa
Ni-Cr
Drobne części i
złącza ozdobne
wewnątrz pojazdu
łącznie z gwintem
Ni10b Cr r
Listwy ozdobne, części
wewnątrz pojazdu
Ni20b Cr r
Części dekoracyjne na zewnątrz
pojazdu
Ni40b Cr r
Ni30b Cr mc
Ni30b Cr mp
Ni30d Cr r
Ni25d Cr mc
Ni25d Cr mp
Części i listwy
dekoracyjne na
zewnątrz pojazdu
Ni40b Cr mc
Ni40b Cr mp
Ni40b Cr r
Ni30d Cr mc
Ni30d Cr mp
3-warstwowa
Cu-Ni-Cr
Drobne części i
złącza z gwintem
wewn. pojazdu
Cu10 Ni5b Cr r
Drobne dekoracyjne części,
złącza bez gwintu
stosowane
na zewnątrz pojazdu
Sprężyny amortyzatorów
Cu20 Ni10bCr r
Kraty ozdobne wlotu powietrza,
sprężyny amortyzatorów
Cu20Ni20bCr mc
lub Cr mp
Cu15 Ni25d Crr
Cu15 Ni20d Cr mc
lub Cr mp
Kołpaki kół,
nakładki zderzaka,
zderzaki
Cu20 Ni25b Cr
mc lub mp
Cu20 Ni30d Cr r
Cu20 Ni25d Cr
mc lub mp
Cu20 Ni25d Cr
mc lub mp
Cynkowa
chromianowana
Drobne części
silnika i wnętrza
pojazdu, części z
gwintem
Cu10Ni5b Cr r
Części silnika, podwozia
(pręty, blachy, rury) części
pompy wodnej i pompy
wtryskowej, części złączne
z gwintem
Cu20Ni5b Cr r
Części podwozia samochodów
szczególnie narażonych na
działanie korozji
(bez części gwintowanych)
sprężyny
-
Kadmowa
chromianowana
Części silnika i
części z gwintem,
sprężyny w
elektrotechnice
samochodowej
-
-
-

Wybrane normy aktualne na dzień 30.09.2005r.
1. PN-EN 12329:2002 Ochrona metali przed korozją. Elektrolityczne powłoki cynkowe z
dodatkową obróbką na żelazie lub stali.
2. PN-EN 12330:2002 Ochrona metali przed korozją. Elektrolityczne powłoki kadmowe na
żelazie lub stali.
3. PN-EN 12540:2002 Ochrona metali przed korozją. Elektrolityczne powłoki niklowe, nikiel-
chrom, miedź-nikiel-chrom
4. PN-EN ISO 4526:2004 Powłoki metaliczne. Elektrolityczne powłoki niklowe do zastosowań
technicznych.
5. PN-EN ISO 6158:2004 Powłoki metaliczne. Elektrolityczne powłoki chromowe do
zastosowań technicznych.
6. PN-EN 10152: 1997 Stal niskowęglowa. Wyroby płaskie walcowane na zimno, ocynkowane
elektrolitycznie. Techniczne warunki dostawy.
7. PN-97/W-24001 Elektrolityczne powłoki metalowe w okrętownictwie.
8. PN-79/H-04613 Ochrona metali przed korozją. Powłoki chromowe mikroporowate Cr mp
Określenie mikroporowatości.
Document Outline
- Głównymi czynnikami wpływającymi na wygląd powłoki są: gęsto
- Gęstość prądu. Jest to stosunek natężenia prądu, do całkowit
- Stężenie elektrolitu. Elektrolity stosowane do galwanicznej
- Temperatura. Wzrost temperatury ma dwojaki wpływ. Z jednej
- Zdolność krycia kąpieli jest definiowana jako minimalna gęst
- 2.4.1. Powłoki cynkowe
- 2.4.2. Powłoki chromowe
- 2.4.3. Powłoki niklowe
- 2.4.6. Powłoki kompozytowe
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron