
Oporność bakterii na antybiotyki

Związki o działaniu antybiotycznym
Antybiotyk
- substancja przeciwdrobnoustrojowa
- produkowana przez mikroorganizmy
lub uzyskiwana na drodze
półsyntetycznej czy syntetycznej
- posiada naturalny wzorzec
Chemioterapeutyk
- substancja przeciwdrobnoustrojowa
- uzyskiwana na drodze syntezy
chemicznej
- nie posiada naturalnego wzorca

Mechanizmy działania antybiotyków
1.
Hamowanie syntezy ściany komórkowej
2.
Hamowanie syntezy białek
3.
Hamowanie syntezy DNA/RNA
4.
Uszkodzenie błony cytoplazmatycznej
5.
Hamowanie syntezy metabolitów komórkowych
(
sulfonamidy)

Podstawowe cechy antybiotyku
1.
Wybiórcza toksyczność
2.
Działanie bakteriobójcze (MBC) lub bakteriostatyczne (MIC)
3.
Spektrum antybiotyku
MBC - Minimal Bactericidal Concentration
MIC – Minimal Inhibitory Concentration
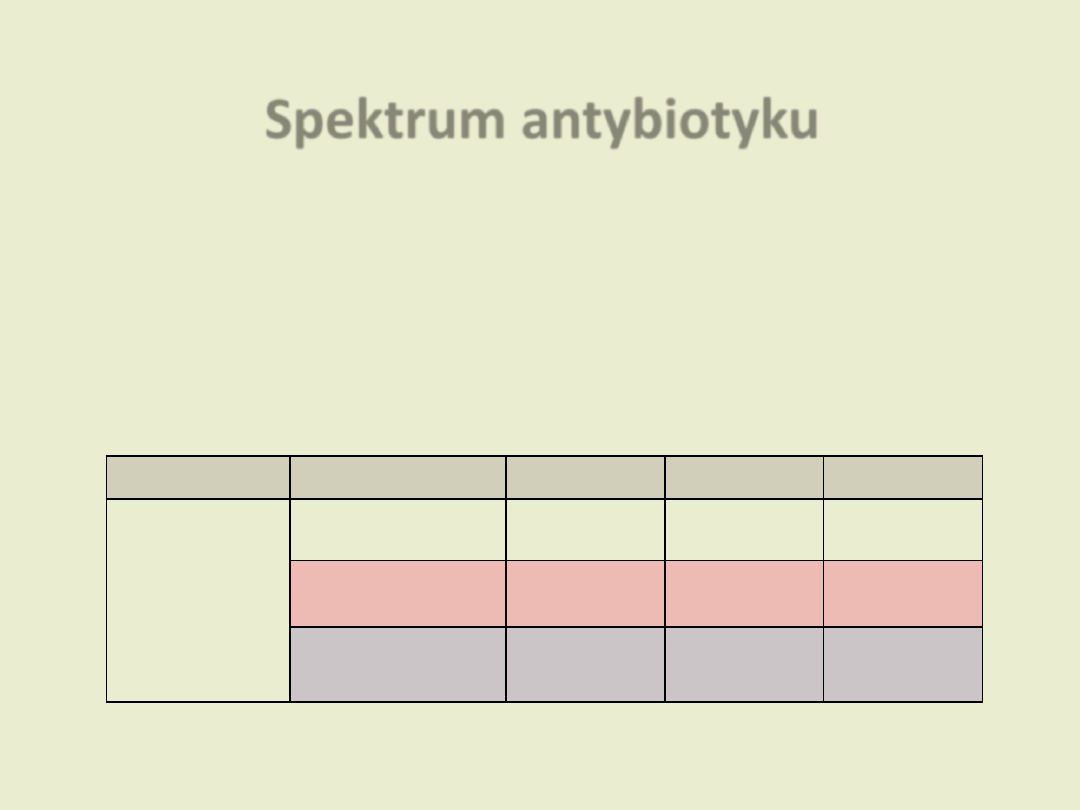
Spektrum antybiotyku
zakres aktywności antybiotyku przeciw bakteriom
(grupy drobnoustrojów, na które działa dany antybiotyk) np.
- antybiotyk o szerokim spektrum
- antybiotyk o wąskim spektrum
Grupa
Podział
Ziarniaki
Pałeczki
Inne
Penicyliny
• naturalne
Gram (+),
Gram (-)
-
Beztlenowce
• półsyntetyczne
oporne na penicylinazy
Gram (+)
-
-
• półsyntetyczne
szerokowachlarzowe
Gram (+),
Gram (-)
Gram (-),
Gram (+)
Beztlenowce
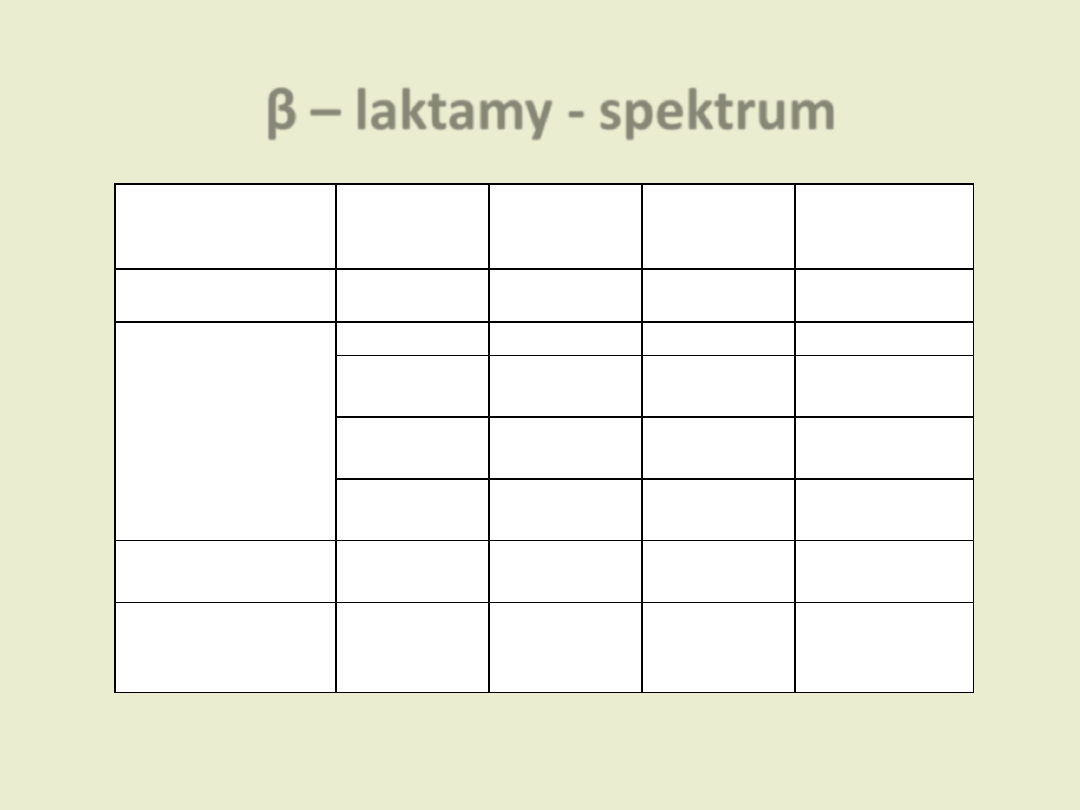
β – laktamy - spektrum
Grupa
Podział
Ziarniaki
Pałeczki
Inne
Penicyliny
jak wyżej
jak wyżej
jak wyżej
jak wyżej
Cefalosporyny
I generacja
Gram (+)
± Gram (-)
II generacja
Gram (+)
Gram (-)
± Gram (-)
Beztlenowce
III generacja
Gram (+)
Gram (-)
Gram (-)
Beztlenowce
IV generacja
Gram (+)
Gram (-)
Gram (-)
Beztlenowce
Monobaktamy
Gram (-)
Gram (-)
Karbapenemy
Gram (+)
Gram (-)
Gram (-)
Gram (+)
Beztlenowce
Dzierżanowska D. „Antybiotykoterapia praktyczna”
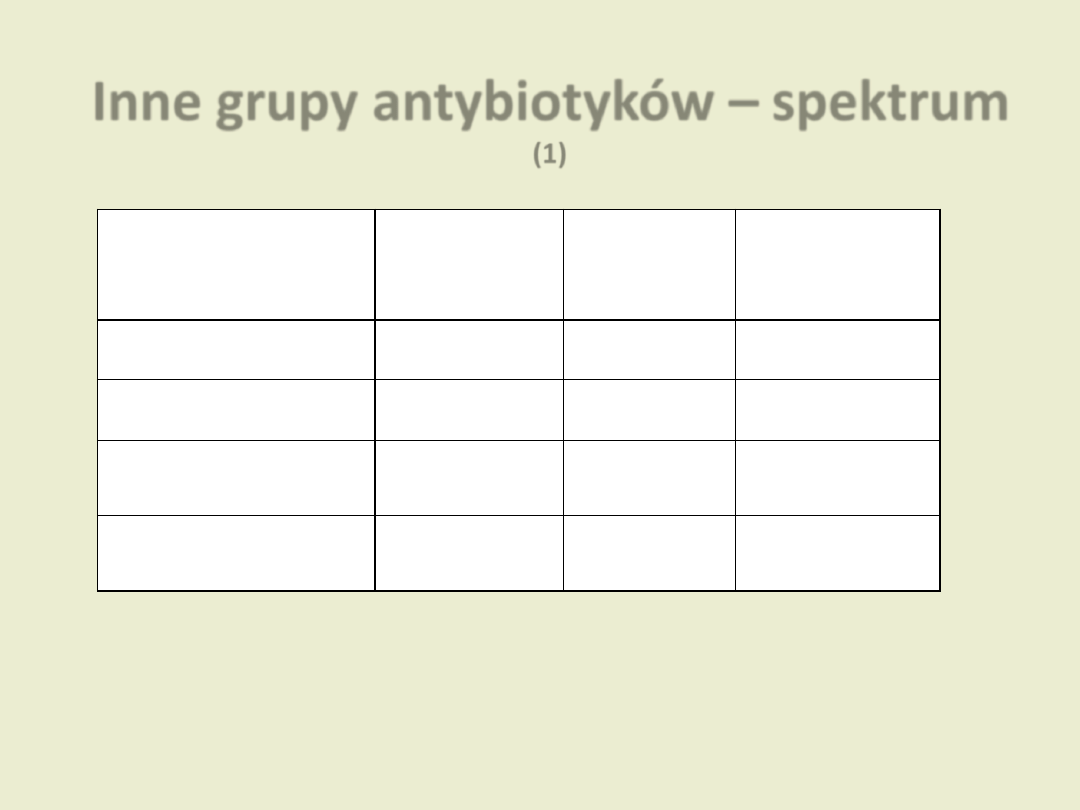
Inne grupy antybiotyków – spektrum
(1)
Grupa
Ziarniaki
Pałeczki
Inne
Aminoglikozydy
± Gram (+)
Gram (-)
Tetracykliny
Gram (+)
Gram (-)
Gram (-)
Beztlenowce
Bakterie atypowe
Makrolidy
Gram (+)
Gram (-)
Bakterie atypowe
Linkozamidy
Gram (+)
Beztlenowce
Dzierżanowska D. „Antybiotykoterapia praktyczna”
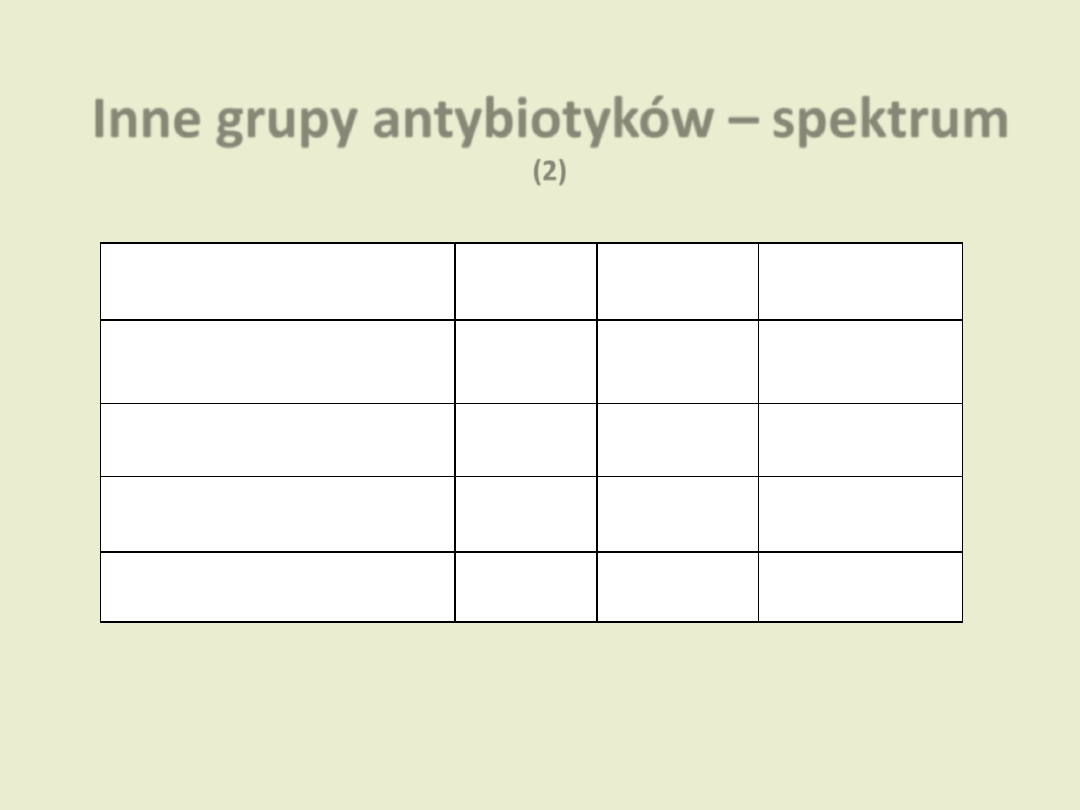
Inne grupy antybiotyków – spektrum
(2)
Grupa
Ziarniaki
Pałeczki
Inne
Glikopeptydy
Gram (+)
Gram (+)
Beztlenowce
(Clostridium difficile)
Nitroimidazole *
Beztlenowce
Chinolony*
Gram (+)
Gram (-)
Gram (-)
Bakterie atypowe
Sulfonamidy*
(Kotrimoksazol–prep. skojarzony)
Gram (+)
Gram (-)
Dzierżanowska D. „Antybiotykoterapia praktyczna”
* chemioterapeutyki

Inne grupy antybiotyków – spektrum
(3)
Grupa
Ziarniaki
Pałeczki
Inne
Polimyksyny
Gram (-)
Nitrofurany *
Gram (+)
Gram (-)
Beztlenowce
Streptograminy
Gram (+)
Gram (-)
Gram (+)
Gram (-)
Beztlenowce
Bakterie atypowe
Oksazolidynony*
Gram (+)
Dzierżanowska D. „Antybiotykoterapia praktyczna”
* chemioterapeutyki
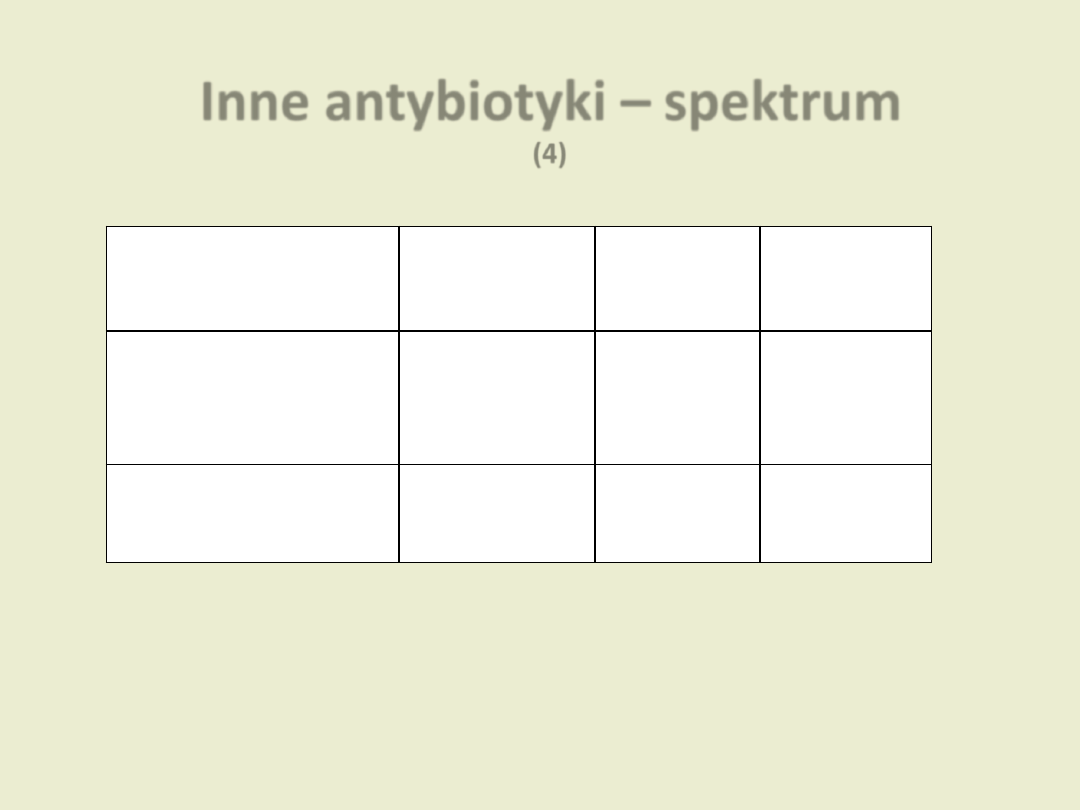
Inne antybiotyki – spektrum
(4)
Grupa
Ziarniaki
Pałeczki
Inne
Chloramfenikol
Gram (+)
Gram (-)
Gram (-)
Beztlenowce
Bakterie atypowe
Ryfampicyna *
Gram (+)
Gram (-)
Gram (+)
Gram (-)
Beztlenowce
Bakterie atypowe
Dzierżanowska D. „Antybiotykoterapia praktyczna”
* chemioterapeutyki
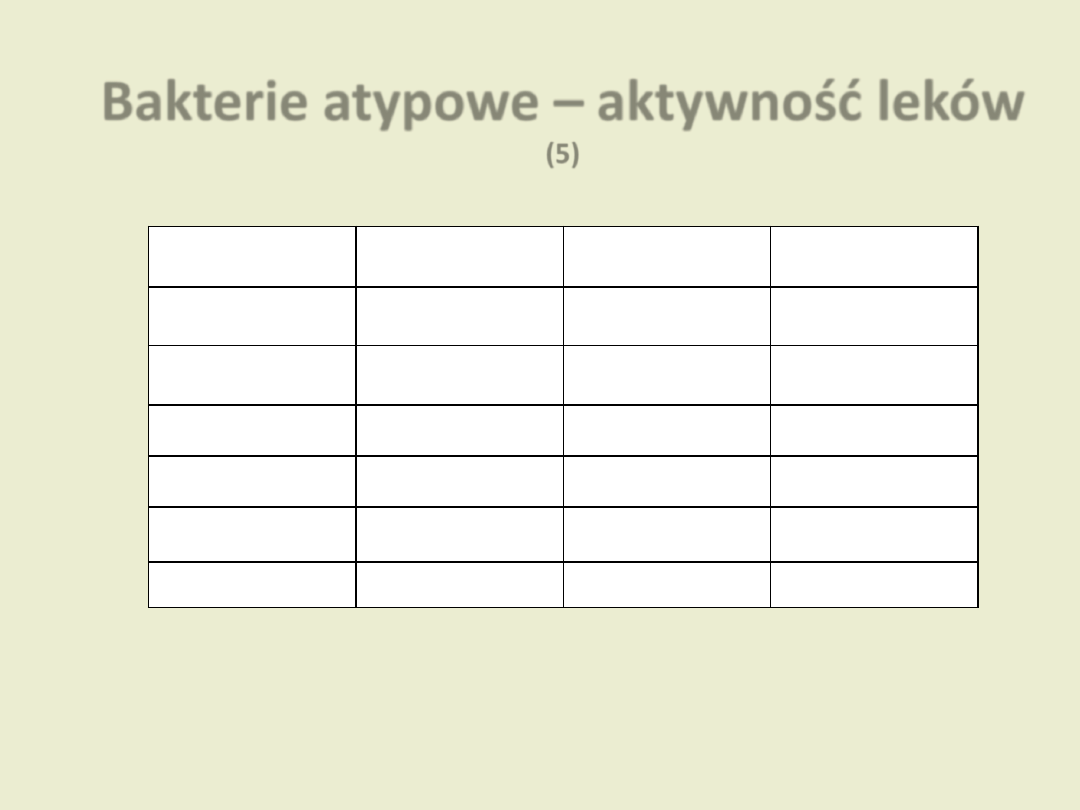
Bakterie atypowe – aktywność leków
(5)
Chlamydia
Mycoplasma
Legionella
Rickettsia
Tetracykliny
Tetracykliny
Tetracykliny
Makrolidy
Makrolidy
Makrolidy
Makrolidy
Chinolony
Chinolony
Chinolony
Streptograminy
Streptograminy
Chloramfenikol
Chloramfenikol
Chloramfenikol
Chloramfenikol
Ryfampicyna
Ryfampicyna
Dzierżanowska D. „Antybiotykoterapia praktyczna”

Uboczne skutki antybiotykoterapii:
eliminacja naturalnej flory bakteryjnej
hypowitaminoza (wit. K i B)
grzybice
biegunki poantybiotykowe
nadkażenia bakteriami opornymi
selekcja szczepów opornych
(mikrobiologiczne)
Rodzaje oporności
Oporność
naturalna
Oporność
nabyta
- występuje u bakterii, które nie miały kontaktu
z antybiotykiem
- stała cecha gatunku, rodzaju, rodziny
- Np.. Mycoplasma i oporność na β-laktamy
- powstaje u bakterii pierwotnie wrażliwych
- nowa cecha szczepu , powstająca w wyniku
procesów genetycznych (mutacje, nabycie genów
oporności od innych bakterii)
- Np.. Staphylococcus aureus i oporność na metycylinę (MRSA)
1.
Bakterie atypowe (Mycoplasma, Chlamydia, Rickettsia,
Legionella) – oporne na antybiotyki β – laktamowe
2.
Enterococcus sp.– oporne na cefalosporyny, niskie stężenia
aminoglikozydów, linkozamidy
3.
Listeria sp. – oporna na cefalosporyny
4.
Pałeczki Gram (-) – oporne na glikopeptydy, makrolidy (wyjątek
Azitromycyna)
5.
Bakterie beztlenowe – oporne na aminoglikozydy
Oporność naturalna

Procesy genetyczne a lekooporność
• Mutacje
• Horyzontalny transfer genów:
A – transformacja
B – transdukcja
C – koniugacja

Mechanizmy lekooporności bakterii
1.
Produkcja enzymu
2.
Modyfikacja receptora
3.
Czynne wypompowanie leku
4.
Zaburzenie barier przepuszczalności
5.
Wzmożona synteza PABA
(oporność na sulfonamidy
)

Mechanizmy lekooporności bakterii
– produkcja enzymów
β-laktamazy
- inaktywacja antybiotyków β-laktamowych
- główny mechanizm oporności na antybiotyki β-laktamowe
- różny profil substratowy
- geny β-laktamaz na chromosomie lub plazmidzie
- produkowane konstytutywnie lub indukcyjnie

β-laktamazy ESBL
β –laktamazy o poszerzonym spektrum substratowym
(ang. Extended Spectrum β – Lactamase)
hydrolizują: - penicyliny,
- cefalosporyny (z wyjątkiem cefamycyn),
- monobaktamy
Szczepy ESBL + zazwyczaj są wrażliwe jedynie na karbapenemy
u pałeczek z rodziny Enterobacteriaceae
(Klebsiella pneumoniae ESBL +, Escherichia coli ESBL +)
wrażliwe „ in vitro” na cefalosporyny III i IV generacji*
hamowane przez inhibitory β-laktamaz*
* ryzyko niepowodzenia terapeutycznego!

Metalo-β-laktamazy (MBL)
Występują:
u pałeczek niefermentujących (Pseudomonas aeruginosa),
u pałeczek fermentujących (Enterobacteriaceae)
Wg EUCAST:
„Szczepy MBL+ należy traktować z definicji jako niewrażliwe na
karbapenemy i inne β-laktamy z wyjątkiem monobaktamów”

Karbapenemazy
Klebsiella pneumoniae (KPC+)
1.
Oporne na wszystkie grupy antybiotyków β-laktamowych!!!!
2.
Często oporne na inne grupy leków
3.
Kodowane przez geny plazmidowe
4.
Wymagają najostrzejszych działań w kontroli zakażeń

Mechanizmy lekooporności bakterii
– produkcja enzymów
Transferazy
(modyfikacja cząsteczki antybiotyku)
-
Np.. u niektórych szczepów Enterococcus sp.
-
enzymy modyfikujące aminoglikozydy (wysoki stopień oporności)
tzw. szczepy Enterococcus HLAR*
-
geny zlokalizowane na plazmidach
-
możliwy międzygatunkowy transfer genów
*High Level Aminoglikoside Resistant
Leczenie zakażeń HLAR
- brak możliwości stosowania terapii skojarzonej
aminoglikozydów z β-laktamami!

Mechanizmy lekooporności bakterii
- modyfikacja receptora
Zmiany w białkach PBP
(Penicillin Binding Protein)
- różna liczba białek PBP u bakterii (PBP1 - PBP8)
- aktywność enzymatyczna (transpeptydazy)
Przykład:
PRSP (Penicillin Resistant Streptococcus pneumoniae)
-
geny kodujące zmienione PBP przekazane od Streptococcus mitis
- „geny mozaikowe”
Penicylino-oporność w szczepach PRSP nie jest wynikiem
wytwarzania β-laktamaz !

Mechanizmy lekooporności bakterii
- modyfikacja receptora
Nowe białko PBP
- Np.. w szczepach MRSA (Methicillin Resistant Staphylococcus aureus)
-
Obecność nowego białka PBP 2a o zmniejszonym powinowactwie do
antybiotyków β-laktamowych (gen mecA na chromosomie bakterii)
Szczepy MRSA są z definicji oporne na wszystkie antybiotyki β-laktamowe
oraz preparaty z inhibitorami β-laktamaz!
Metycylina – pierwsza półsyntetyczna penicylina oporna na działanie β-laktamaz gronkowcowych

MRSA – grupy szczepów
1.
HA-MRSA - hospital acquired MRSA
- Oporne na ogół na różne grupy antybiotyków
(w tym na antybiotyki β-laktamowe)
- Grupy ryzyka:
- pacjenci długo hospitalizowani
- pacjenci w wieku podeszłym
- pacjenci poważnie chorzy (z chorobami przewlekłymi)
- pacjenci z ranami pooperacyjnymi, z posocznicą

MRSA – grupy szczepów
2.
CA-MRSA - community acquired MRSA
- Wrażliwe na ogół na różne grupy antybiotyków, z wyjątkiem
antybiotyków β-laktamowych !
- Występowanie:
- pacjenci pozaszpitalni
- pacjenci młodzi (dzieci, młodzież)
- pacjenci bez czynników ryzyka
- Zakażenia:
- ciężkie, martwicze zapalenia skóry, tkanki podskórnej,
- ropnie
- martwicze zapalenie płuc (leukocydyna PVL)

MRSA – antybiotyki
stosowane w terapii zakażeń
1.
Makrolidy (zwykle oporne)
2.
Linkozamidy (zwykle oporne)
3.
Fluorochinolony (mogą być oporne)
4.
Kotrimoksazol
5.
Tetracykliny
6.
Gentamycyna (zwykle oporne)
7.
Glikopeptydy (aktywne)
8.
Daptomycyna (aktywna)
9.
Linezolid (aktywny)
10. Chinupristina/dalfopristina (aktywne)
11. Mupirocyna (zwykle aktywna)
D. Dzierżanowska „Antybiotykoterapia praktyczna” α-medica press, 2009

Oporność na glikopeptydy
- Staphyloccus aureus
(
VRSA)
• VRSA – Vancomycin Resisrant Staphylococcus aureus (MIC>32 μg/ml)
• Mechanizm oporności:
- zmiany strukturalne w ścianie komórkowej
(pogrubienie peptydoglikanu , wzrost liczby prekursorów ściany
komórkowej i wiązanie przez nie wankomycyny na zewnątrz
komórki bakteryjnej)
• VRSA są głównie szczepami MRSA wielolekoopornymi!

Oporność na glikopeptydy
– Enterococcus sp.
Naturalna – szczepy z pentapeptydowym końcem:
D-Ala-D-Lac (Leuconostoc, Lactobacillus, Pediococcus )
D-Ala-D-Ser (E. gallinarum, E. casseliflavus)
Nabyta – modyfikacja końca peptydoglikanu z D-Ala-D-Ala do
D-Ala-D-Lac (Enterococcus)
VRE - Vancomycin Resistant Enterococcus (E. faecium, E. faecalis)

Stosowanie antybiotyków do leczenia
- terapia empiryczna
1.
Oparta o domniemanie najbardziej prawdopodobnego czynnika
etiologicznego (na podstawie objawów klinicznych,
danych epidemiologicznych).
2.
Wyboru dokonuje lekarz spośród leków, które są aktywne wobec
przypuszczalnego czynnika etiologicznego.
3.
Inna jest w zakażeniach szpitalnych i pozaszpitalnych.

Terapia empiryczna - wskazania
1.
Można przewidzieć co jest przyczyną zakażenia i jaka jest
wrażliwość drobnoustroju na dany antybiotyk na danym
terenie
2.
Drobnoustroju nie można wyhodować (np..Treponema,
Chlamydia, Rickettsia, Borelia)
3.
Pacjent jest w ciężkim stanie (należy potwierdzić badaniem)
Nie powinna:
• indukować oporności
• selekcjonować szczepów opornych

Terapia skojarzona - stosowanie
1.
Spotęgowanie efektu bakteriobójczego
2.
Poszerzenie spektrum
3.
Zmniejszenie ryzyka selekcji szczepów opornych
Terapia skojarzona często jest stosowana w terapii empirycznej:
- u pacjentów z ciężkimi zakażeniami o etiologii mieszanej
- u chorych z upośledzonym układem odpornościowym

Stosowanie antybiotyków
do leczenia - terapia celowana
Wyboru antybiotyku dokonuje lekarz spośród leków, które
w wyniku badania mikrobiologicznego okazały się aktywne
wobec wyizolowanego czynnika etiologicznego zakażenia

Terapia celowana - wskazania
1.
W zakażeniach u pacjentów przebywających w szpitalu
2.
W przypadku trudności w ustaleniu prawdopodobnego czynnika
etiologicznego choroby na podstawie objawów klinicznych
3.
W przypadku braku poprawy po leczeniu empirycznym

Etapy terapii celowanej
1.
Identyfikacja czynnika etiologicznego
2.
Antybiogram - badanie wrażliwości jakościowo (S-I-R)
3.
Antybiogram – badanie wrażliwości ilościowo (MIC)
4.
Właściwa interpretacja

Wykrywanie oporności bakterii
1.
Metoda dyfuzyjno- krążkowa (metoda jakościowa)
2.
Metoda E-testów (metoda ilościowa)
3.
Metoda rozcieńczeń antybiotyku w podłożu stałym lub
płynnym (metoda ilościowa)

MRSA
1.
Wykrywanie mechanizmu oporności krążkiem z cefoksytyną (FOX)
Problemy diagnostyczne:
– różny poziom fenotypowej ekspresji oporności na metycylinę
u szczepów MRSA (HoMRSA, HeMRSA)
2.
Wykrywanie genu mecA, białka PBP2a
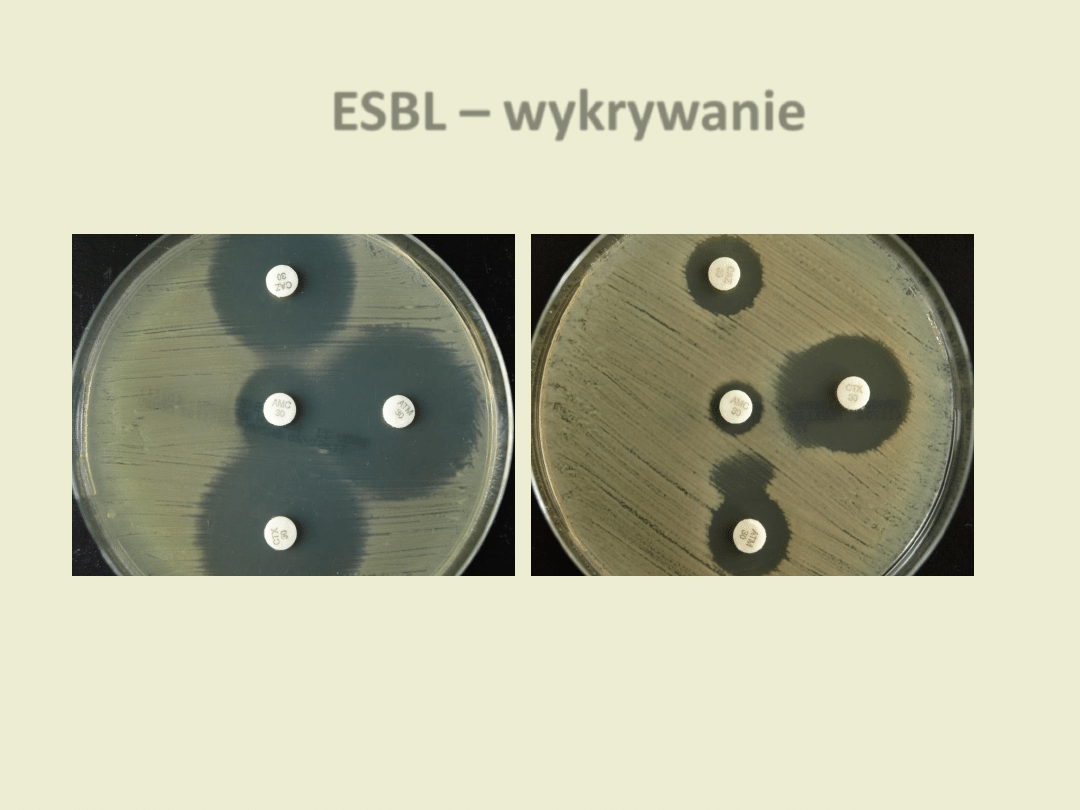
ESBL – wykrywanie
ESBL (-) ESBL (+)
Klebsiella pneumoniae
CAZ
AMC
ATM
CTX
Test dwóch krążków

Lekooporność bakterii
1.
Oporność mikrobiologiczna a kliniczna oporność
2.
Oporność krzyżowa a wielolekooporność
Oporność krzyżowa – jeden mechanizm oporności na
antybiotyki określonej grupy (ten sam mechanizm działania)
Wielolekooporność – wiele mechanizmów oporności na
antybiotyki z różnych grup.

Antybiogram – wyniki
S - sukces kliniczny jest bardzo prawdopodobny
I - przy zwiększeniu dawki lub częstości podawania istnieje szansa
na wyleczenie, ale sukcesu klinicznego nie możemy przewidzieć
R - sukces kliniczny jest mało realny
J Antimicrob Chemother, 2001; 48, 17

Antybiogram
• Ceftazydym - S
• Imipenem - S
• Piperacylina/tazobaktam - S
• Tobramycyna - S
• Ciprofloksacyna - S
• Kolistyna - S
Który lek wybrać?

„
S” nie zawsze oznacza „sukces”….
1.
Upośledzona funkcja układu immunologicznego:
- stan biologiczny, wiek, odżywienie, schorzenia współistniejące,
2.
Niedostępność antybiotyku w odpowiednim stężeniu w
miejscu zakażenia:
- zła penetracja wynikająca z właściwości antybiotyku,
- zagęszczenie patogenów w miejscu zakażenia – inoculum;
3.
Stężenia subterapeutyczne :
- niewłaściwa dawka „trafionego” antybiotyku
4.
Dawkowanie leku
- niesystematyczne, zbyt krótka terapia

Przyczyny niepowodzeń
w terapii cd. ……
5.
Zbyt późne podjęcie leczenia
6.
Inny czynnik etiologiczny
7.
Wtórne zakażenie drobnoustrojem opornym
8.
Zakażenie mieszane
9.
Selekcja szczepów opornych (długa terapia)

Antybiogram- metody ilościowe
MIC - Minimal Inhibitory Concentration (μg/ml)
- najmniejsze stężenie hamujące wzrost i procesy życiowe bakterii
MBC - Minimal Bactericidal Concentration (μg/ml)
- najmniejsze stężenie bakteriobójcze (potrzebne do zabicia bakterii)
4-5 x MIC = MBC
Pea F et al. Clin Pharmacokinet 2005; 44: 1009-1034

Oznaczanie MIC - wskazania
1.
Leczenie zakażeń inwazyjnych takich jak:
- zapalenie opon mózgowo-rdzeniowych
- zapalenie wsierdzia
- zapalenie płuc
- posocznica
- zapalenie kości i stawów
2.
Prowadzenie terapii u pacjentów z obniżoną odpornością
(oddziały hematologiczne, onkologiczne)
3.
Monitorowanie leczenia zakażeń u pacjentów poddanych
immunosupresji

Antybiogram MIC
• ceftazydym - 1
• imipenem - 4
• piperacylina/tazobaktam - 4
• tobramycyna - 1
• ciprofloksacyna - 0,5
• kolistyna - 2
Który lek wybrać?

MIC
- narzędzie diagnostyczne,
terapeutyczne i ekonomiczne
Odpowiedni ANTYBIOTYK dla danego PACJENTA
w odpowiednim CZASIE i DAWCE !

Patogeny alarmowe ze względu
na oporność na antybiotyki
Staphyloccus aureus (MRSA, VRSA)
Streptococcus pneumoniae (PRSP)
Enterococcus spp (HLAR, VRE)
Enterobacteriaceae (ESBL, MBL, KPC)
Pałeczki niefermentujące (ESBL, MBL)
Główna ich cecha to wielolekooporność
tj. oporność na co najmniej 3 grupy terapeutyczne (MDR)*
*Multidrug Resistance

Problemy
współczesnej antybiotykoterapii
Pojawianie się nowych mechanizmów oporności
Rozprzestrzenianie się znanych już mechanizmów oporności
Coraz krótszy czas od pojawienia się oporności do jej
globalnego rozprzestrzenienia się
Coraz mniej skutecznych leków o dobrych parametrach
efektywności i bezpieczeństwa

Przyczyny powstania i szerzenia się
lekooporności
1.
Niewłaściwe i nadmierne stosowanie antybiotyków w medycynie
zbyt niska dawka leku
przerywanie przyjmowania leku
leczenie infekcji wirusowych
2.
Niewłaściwe i nadmierne stosowanie antybiotyków w rolnictwie
w hodowli zwierząt (terapia, profilaktyka, przyspieszenie wzrostu)
w sadownictwie (opryskiwanie drzew owocowych)
Przenoszenie szczepów opornych poprzez odchody zwierząt, wodę,
warzywa, mięso itp.

Jak ograniczyć narastanie oporności?
1.
Ograniczyć konsumpcję zarówno szpitalną jak i pozaszpitalną
stosowanych leków
2.
Używanie antybiotyków o raczej wąskim spektrum
3.
Wdrażać odpowiednie procedury kontroli zakażeń
4.
Wprowadzać szczepienia (S. pneumoniae)
5.
Poszukiwać i badać nowe substancje

Grupy antybiotyków
Przykłady antybiotyków
Penicyliny
penicylina, metycylina, kloksacylina, piperacylina
Cefalosporyny
cefoksytyna, cefuroksym, cefotaksym, ceftriakson
Monobaktamy
aztreonam
Karbapenemy
imipenem
Penicyliny z inhibitorem
augmentin
Aminoglikozydy
gentamycyna, streptomycyna
Tetracykliny
doksycyklina
Makrolidy
erytromycyna, azytromycyna
Polimyksyny
kolistyna
Glikopeptydy
wankomycyna
Sulfonamidy
kotrimoksazol (prep. skojarzony)
Chinolony
ciprofloksacyna, norfloksacyna
Nitrofurany
nitrofurantoina
Oksazolidynony
linezolid
Nitroimidazole
metronidazol
Linkozamidy
klindamycyna
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron