
154
Mięśnie szkieletowe unerwiane są przez włókna neuronów ruchowych rogów przednich
rdzenia kręgowego. Po wyjściu z rdzenia nerwy ruchowe docierają do mięśni prążko-
wanych, tworząc odgałęzienia, a każde z tych odgałęzień dociera do włókna mięśniowe-
go. Takie złącze nerwowo-mięśniowe (synapsa), określane też jako płytka motoryczna,
warunkuje przekazywanie impulsów ruchowych z nerwu na mięsień.
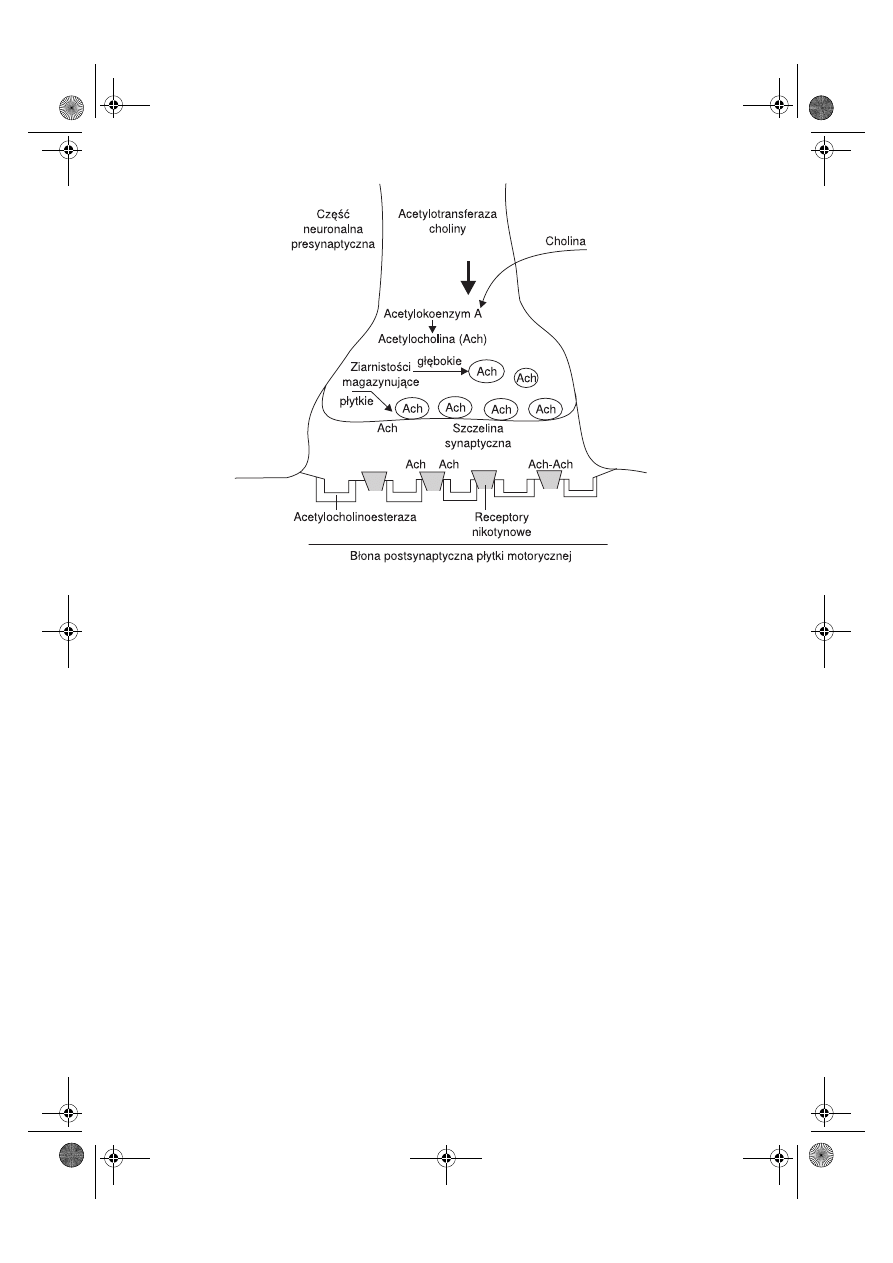
Płytka motoryczna
znajduje się na powierzchni włókna mięśniowego i jest lekko
wgłębiona do sarkolemy. Składa się z części presynaptycznej, która jest zakończeniem
neuronu, i części postsynaptycznej, znajdującej się na błonie komórkowej włókna mię-
śniowego. Błona postsynaptyczna jest pofałdowana, na jej powierzchni znajdują się re-
ceptory nikotynowe dla acetylocholiny (N-cholinergiczne) oraz acetylocholinoesteraza
(ryc. 7.1).
Pomiędzy częścią presynaptyczną i postsynaptyczną znajduje się szczelina synap-
tyczna o szerokości około 60 μm, która jest wypełniona amorficzną siecią komórek.
Przekazywanie bodźców z presynaptycznej części neuronalnej na część postsynap-
tyczną odbywa się za pomocą acetylocholiny (Ach). Acetylocholina syntetyzowana
w części presynaptycznej (przy udziale acetylotransferazy choliny przez połączenie ace-
tylokoenzymu A z choliną), następnie jest tam magazynowana w pęcherzyku synap-
tycznym (jeden pęcherzyk zawiera około 5–10 000 jej cząsteczek). Acetylocholina
zgromadzona w pęcherzyku synaptycznym nie wykazuje aktywności biologicznej. Pę-
cherzyki są wiązane z błoną presynaptyczną poprzez białko synapsynę. Samoistnie, na
skutek egzocytozy, co 0,5–1 s uwalniana jest do szczeliny synaptycznej zawartość jed-
nego pęcherzyka, tj. około 5–10 000 cząsteczek acetylocholiny. Ilość ta powoduje obni-
żenie potencjału błonowego w błonie postsynaptycznej o około 1 mV oraz generuje po-
wstanie miniaturowego potencjału MEPP (ang. Miniature Endplate Potentials) – w sta-
nie spoczynku w płytce motorycznej wytwarza się około 2–4 MEPP w ciągu 1 s.
Miniaturowe potencjały MEPP wytwarzane w płytce motorycznej pobudzają procesy
troficzne (odżywcze) w mięśniu, nie są natomiast generowane, jeśli nerw dochodzący
do płytki jest uszkodzony. Brak MEPP powoduje zanik mięśnia i nawet wykonywanie
ćwiczeń rehabilitacyjnych po uszkodzeniu nerwu nie zapobiega jego zanikowi.
Płytka motoryczna jest pobudzana przez bodźce doprowadzane przez nerw ruchowy.
Po dojściu bodźca do płytki następuje depolaryzacja części presynaptycznej. Na skutek
depolaryzacji otwierane są kanały dla jonów Ca
2+
, następuje fosforylacja synapsyny
oraz uwalnianie acetylocholiny do przestrzeni synaptycznej. Następnie cząsteczki ace-
tylocholiny łączą się z receptorami nikotynowymi znajdującymi się na błonie postsy-
Farmakodynamika leków wpływających
na przekaźnictwo nerwowo-mięśniowe
i mięśnie szkieletowe
Danuta Malec, Waldemar Janiec
7
Farmakodyn-Janiec-07-10.fm Page 154 Wednesday, September 17, 2008 8:19 AM
155
naptycznej, powodując depolaryzację tej błony i pobudzenie włókna mięśniowego.
Działanie acetylocholiny jest krótkie, ponieważ jest ona rozkładana przez acetylocholi-
noesterazę.
Wielkość depolaryzacji błony postsynaptycznej w płytce motorycznej zależy od licz-
by cząsteczek acetylocholiny uwalnianych do przestrzeni synaptycznej i przyłączonych
do receptorów nikotynowych w błonie postsynaptycznej (znajduje się tu około 2,1 × 10
7
receptorów dla acetylocholiny, średnio 22 000 receptorów/μm
2
). Do jednego receptora
nikotynowego przyłączają się dwie cząsteczki acetylocholiny i powodują zmniejszenie
potencjału w błonie postsynaptycznej o kilka μV. W celu wywołania depolaryzacji bło-
ny postsynaptycznej płytki motorycznej niezbędne jest uwolnienie do przestrzeni sy-
naptycznej około 3 mln cząsteczek acetylocholiny (= opróżnieniu około 300 pęcherzy-
ków synaptycznych). Uwolniona acetylocholina dociera do receptorów na błonie post-
synaptycznej z prędkością 0,15 m/s, a depolaryzacja tej błony zapoczątkowuje proces
pobudzenia włókna mięśniowego.
Wywołana przez acetylocholinę depolaryzacja błony postsynaptycznej powoduje
otwarcie kanałów przepuszczalnych dla jonów Na
+
i K
+
oraz przemieszczenie tych jo-
nów zgodnie z gradientem stężeń, tj. wnikanie jonów Na
+
do komórek i przechodzenie
jonów K
+
na zewnątrz. Na skutek przemieszczeń jonowych następuje obniżenie poten-
cjału błonowego z –80 mV do około 15 mV, a potencjał wytworzony w płytce moto-
rycznej określany jest jako potencjał końcowy płytki EPP (ang. Endplate Potentials).
Potencjał końcowy płytki EPP przechodzi z płytki motorycznej na powierzchnię włó-
kien mięśniowych, powodując depolaryzację błony komórkowej tych włókien i wyzwa-
lając potencjał czynnościowy przez otwarcie zależnych od potencjału kanałów dla jo-
nów Na
+
i K
+
znajdujących się na powierzchni włókien mięśniowych. Potencjał czyn-
nościowy rozprzestrzenia się wzdłuż błony komórkowej i uruchamia mechanizmy
Ryc. 7.1.
Schemat płytki motorycznej.
Farmakodyn-Janiec-07-10.fm Page 155 Wednesday, September 17, 2008 8:19 AM
156
skurczu mięśni. Po okresie pobudzenia następuje okres repolaryzacji (okres pobudzenia
trwa około 1 ms, a repolaryzacji około 8–9 μs). Do utrzymania skurczu mięśni niezbęd-
ne są seryjne pobudzenia płytki motorycznej.
Na przewodnictwo nerwowo-mięśniowe wpływa stężenie jonów Ca
2+
i Mg
2+
w pły-
nie zewnątrzkomórkowym – zmniejszenie stężenia jonów Ca
2+
w płynie zewnątrzko-
mórkowym przy jednoczesnym wzroście stężenia jonów Mg
2+
zmniejsza potencjały
MEPP i EPP oraz pobudliwość płytki motorycznej i mięśni. Zmniejszenie stężenia jo-
nów Ca
2+
bez wzrostu stężenia jonów Mg
2+
może spowodować wystąpienie tężyczki na
skutek zwiększonej pobudliwości włókien mięśniowych.
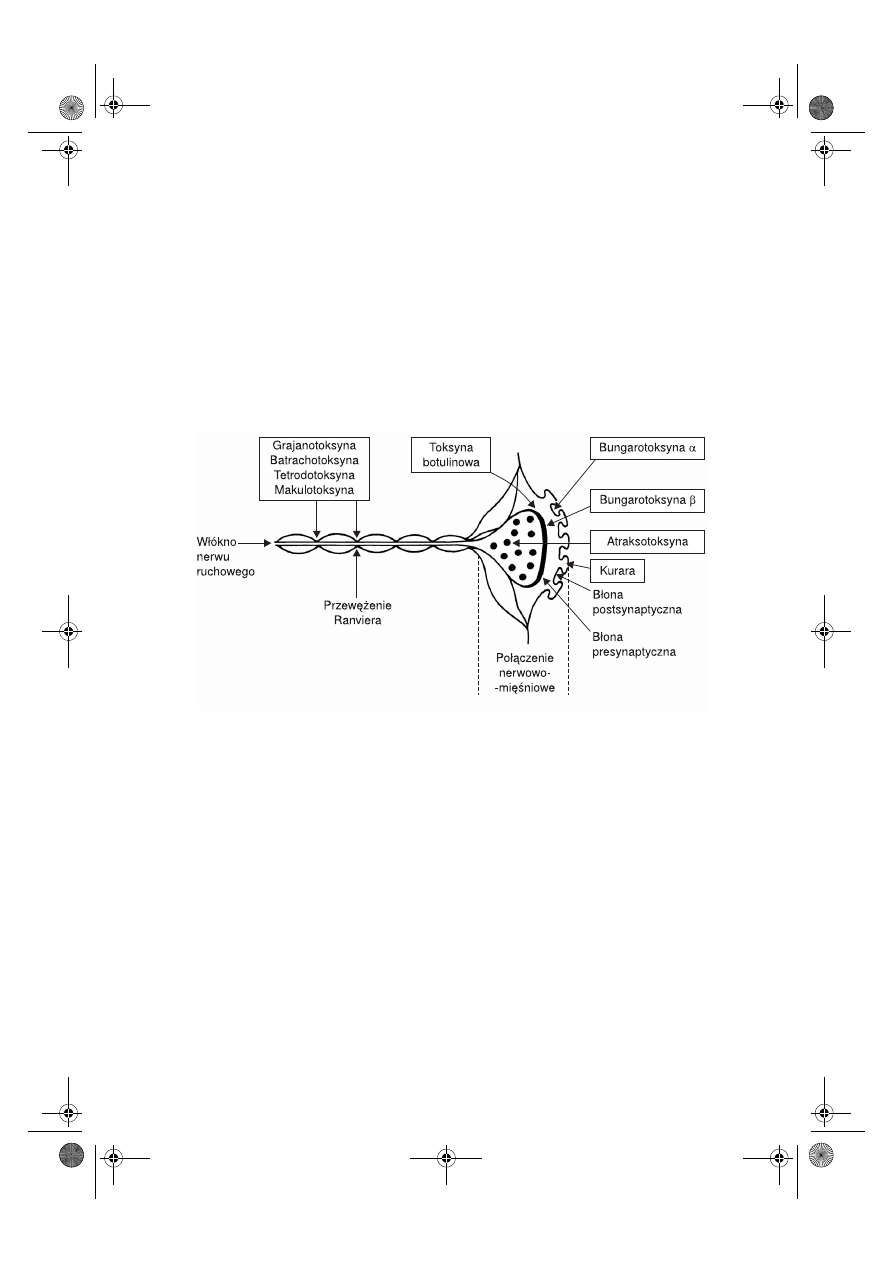
Proces przekazywania impulsów z nerwu na mięśnie przy udziale płytki motorycznej
może być hamowany przez różne toksyny wytwarzane przez bakterie, rośliny i zwierzę-
ta (ryc. 7.2).
W roślinach z rodzaju Chondrodendron i kulczyba (Strychnos) stwierdzono występo-
wanie kurary, a z rodzaju różanecznik (Rhododendron) – grajanotoksyny (nazywanej
też radotoksyną). Kurara poraża receptory acetylocholinowe w błonie postsynaptycznej,
natomiast grajanotoksyna depolaryzuje przewężenia Ranviera w neuronie i hamuje
przewodnictwo nerwowe. Porażenie przewężeń Ranviera powodują również: batracho-
toksyna wytwarzana przez południowoamerykańskie żaby, głównie z rodzaju Phylloba-
tes, tetrodotoksyna – przez jeden z gatunków ryb najeżkokształtnych z rodziny rozdym-
kowatych, oraz makulotoksyna – przez niektóre ośmiornice. Z kolei australijskie pająki
z gatunku Atrax robustus wytwarzają atraksotoksynę, powodującą uwalnianie acetylo-
choliny z pęcherzyków synaptycznych, zaś jad pochodzącego z Azji Południo-
wo-Wschodniej węża z rodzaju Bungarus zawiera bungarotoksynę α i β – bungarotok-
syna α łączy się z błoną postsynaptyczną płytki motorycznej i blokuje receptory dla
acetylocholiny, natomiast bungarotoksyna β łączy się z neuronalną częścią presynap-
tyczną i blokuje uwalnianie neuroprzekaźnika do przestrzeni synaptycznej. Z kolei
toksyna tężcowa wytwarzana przez laseczki tężca (Clostridium tetani) poraża w OUN
neurony hamujące i powoduje napady drgawek tężcowych, natomiast laseczki jadu kieł-
Ryc. 7.2.
Działanie toksyn na przewodnictwo nerwowo-mięśniowe.
Farmakodyn-Janiec-07-10.fm Page 156 Wednesday, September 17, 2008 8:19 AM

157
basianego (Clostridium botulinum) wytwarzają toksynę botulinową, która jest najsil-
niejszą znaną toksyną i powoduje hamowanie uwalniania acetylocholiny w części pre-
synaptycznej płytki motorycznej. Niektóre z tych toksyn służą do wytwarzania leków.
Leki hamujące płytkę nerwowo-mięśniową
Leki hamujące przewodnictwo w płytce mięśniowo-nerwowej nazywane są również le-
kami zwiotczającymi, ponieważ znoszą napięcie mięśni szkieletowych i uniemożliwiają
wykonanie ruchu. Wśród leków należących do tej grupy wyróżnia się leki działające
presynaptycznie na część neuronalną oraz leki działające na błonę postsynaptyczną.
Leki porażające presynaptyczną część
zakończeń nerwowo-mięśniowych
Leki działające presynaptycznie hamują uwalnianie acetylocholiny z neuronu do szcze-
liny synaptycznej – należą do nich: botulina i siarczan magnezu (MgSO
4
).
Toksyna botulinowa typu A.
Jest wytwarzana przez laseczki jadu kiełbasianego
(Clostridium botulinum). Przy zastosowaniu swoistych przeciwciał stwierdzono, że tok-
syna ta jest mieszaniną różnych toksyn, wśród których można wyróżnić toksyny A, B,
C
α
, C
β
, D, E i F. Poszczególne toksyny działają prawdopodobnie jednakowo i charakte-
ryzują się dwiema podstawowymi właściwościami: a) hamują uwalnianie acetylocholi-
ny z zakończeń presynaptycznych oraz b) wywołują aglutynację krwinek czerwonych
przez aglutyniny.
Zatrucie toksyną jadu kiełbasianego nosi nazwę botulizmu. Mechanizm toksycznego
działania toksyny botulinowej typu A polega na jej trwałym wiązaniu z kwasem sialo-
wym, który występuje w dużych ilościach w błonie presynaptycznej zakończeń nerwo-
wo-mięśniowych i błonie erytrocytów. Toksyna po połączeniu się z błoną presynaptycz-
ną zakończeń nerwowo-mięśniowych hamuje uwalnianie acetylocholiny z pęcherzyków
synaptycznych i powoduje porażenie przewodzenia bodźców z neuronu na komórki
mięśniowe. Na skutek zahamowania uwalniania neuroprzekaźnika w płytce motorycz-
nej nie są wytwarzane miniaturowe potencjały MEPP, co prowadzi do zaniku mięśnio-
wego. Zwykle zaniki nie są wielkie, ponieważ po 2–4 miesiącach dochodzi do regene-
racji błony presynaptycznej i powrotu czynności połączeń nerwowo-mięśniowych.
Botulina A znalazła zastosowanie w lecznictwie. Jest ona otrzymywana in vitro z ho-
dowli bakterii Clostridium botulinum, przez wykrystalizowanie i liofilizację, a jej daw-
ka śmiertelna dla człowieka wynosi mniej niż 1 μg.
Siłę działania botuliny określa się w jednostkach (j.) – jedna jednostka odpowiada
średniej wartości LD
50
uzyskanej u myszy po dootrzewnowym podaniu toksyny botuli-
nowej A. Przy stosowaniu bardzo małych dawek działanie toksyny może być ograni-
czone do strefy bezpośrednio sąsiadującej z miejscem podania.
Toksynę botulinową A podaje się domięśniowo w celu wywołania porażenia określo-
nego mięśnia lub grupy mięśni. Zakres porażenia zależy od ilości i objętości toksyny
wstrzykniętej do mięśnia (do uzyskania porażeń miejscowych należy stosować małe
dawki w możliwie najmniejszej objętości). Po jednorazowym podaniu działanie leku
może się utrzymać przez około 12 tygodni.
7.1
7.1.1
Farmakodyn-Janiec-07-10.fm Page 157 Wednesday, September 17, 2008 8:19 AM

158
Toksynę botulinową A stosuje się w przykurczach powieki, leczeniu zeza (nie jest
jednak skuteczna w zezie spowodowanym porażeniem mięśni oka), połowicznym kur-
czu twarzy, kręczu karku, przykurczach związanych z deformacją stopy końsko-szpo-
tawej u dzieci z mózgowym porażeniem dziecięcym, a także w leczeniu zmarszczek
czoła spowodowanych nadmiernym kurczeniem się mięśnia marszczącego brwi i mię-
śnia podłużnego nosa. Lek ten, szczególnie w okulistyce, należy stosować pod kontrolą
miografu. Działanie rozpoczyna się zwykle 1–2 dni po podaniu, zaś maksymalne rozwi-
ja się stopniowo w okresie 1 tygodnia. Można powtarzać stosowanie toksyny botulino-
wej po ustąpieniu porażenia.
Długotrwałe podawanie leku może spowodować powstawanie przeciwciał. Nie zale-
ca się stosowania go w okresie ciąży i karmienia piersią oraz u dzieci poniżej 12 lat.
Działanie leku może być nasilone przez antybiotyki aminoglikozydowe i inne leki ha-
mujące przewodnictwo nerwowo-mięśniowe.
Działania niepożądane są spowodowane głównie niewłaściwym sposobem podania
– może wtedy wystąpić opadnięcie powieki, nasilenie zeza, podwójne widzenie, zabu-
rzenia orientacji przestrzennej. Może również dojść do uszkodzenia rogówki. Niekiedy
może powstać silne swędzenie w miejscu podania leku.
Wielkość dawki dobiera się indywidualnie w zakresie planowanego do uzyskania po-
rażenia. Zwykle stosuje się 1,25–2,5 jednostki w objętości 0,05–0,1 mL (w ciągu jedne-
go miesiąca nie należy przekraczać łącznej dawki 200 j.). Lek po rozpuszczeniu w 0,9%
roztworze NaCl zachowuje trwałość przez 4 godziny, jeżeli jest przechowywany w tem-
peraturze 2–8°C.
P
RODUKT
LECZNICZY
Botox – fiolka 100 j.
Leki hamujące postsynaptyczną część zakończeń
nerwowo-mięśniowych
Leki działające na postsynaptyczną część zakończeń nerwowo-mięśniowych hamują
czynność receptorów nikotynowych zlokalizowanych w błonie postsynaptycznej płytki
motorycznej.
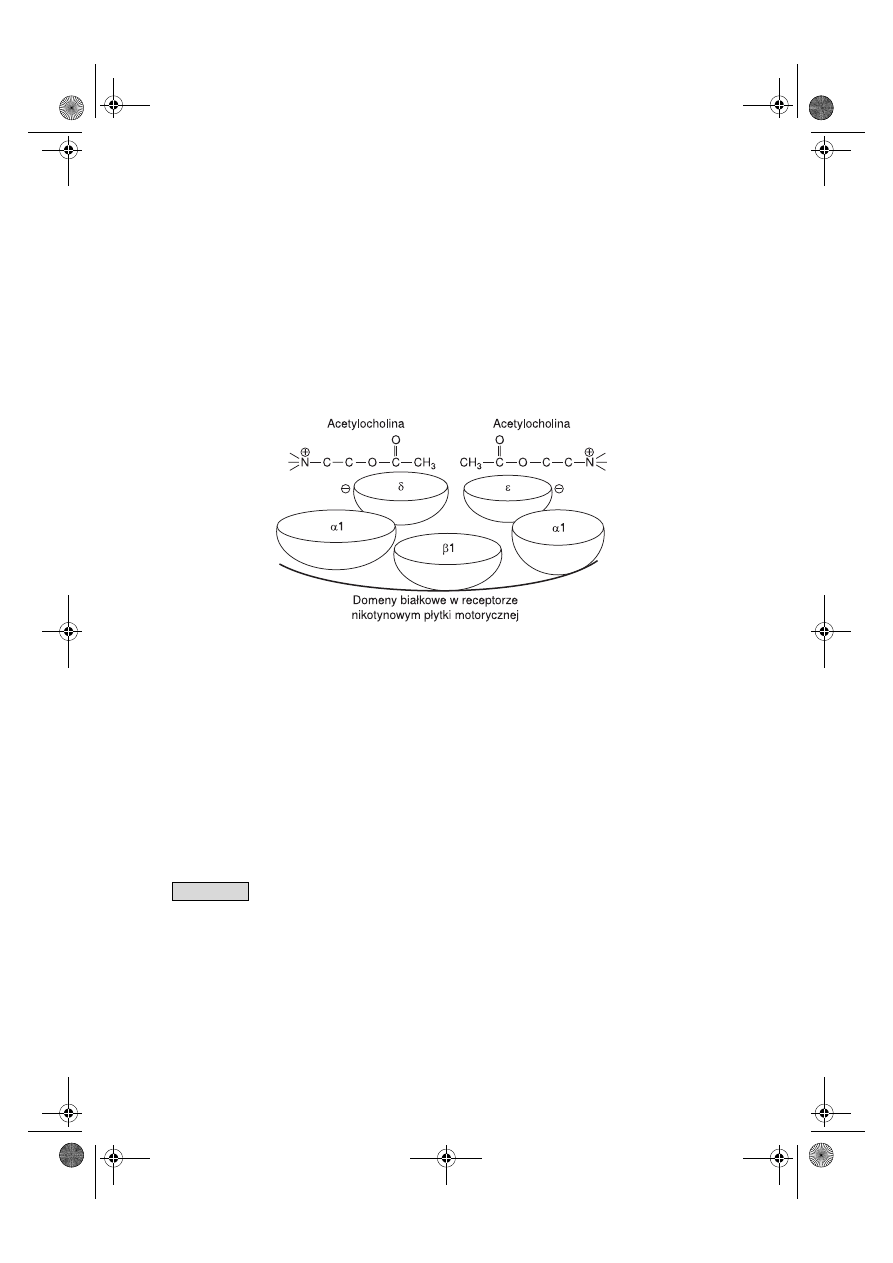
Receptory nikotynowe są zbudowane z różnych grup podjednostek białkowych –
podstawowymi podjednostkami są białka grupy α1–α9, β1–β4 oraz białka γ, δ i ε. Po-
szczególne białka wchodzące w skład receptorów nikotynowych są kodowane przez
geny zlokalizowane w różnych chromosomach. Poszczególne elementy białkowe two-
rzące receptor nikotynowy czterokrotnie przechodzą przez błonę komórkową i tworzą
cztery domeny błonowe oznaczone od M1 do M4.
W zależności od budowy wśród receptorów nikotynowych można wyróżnić m.in. re-
ceptory nikotynowe zlokalizowane w błonie postsynaptycznej płytki motorycznej, re-
ceptory nikotynowe występujące w zwojach nerwowych układu wegetatywnego oraz
receptory nikotynowe w komórkach nerwowych OUN.
Naturalnym neuromediatorem dla receptorów nikotynowych jest acetylocholina. Spo-
sób pobudzania receptorów nikotynowych występujących w komórkach poszczególnych
tkanek jest zróżnicowany, stąd leki wpływające na receptory nikotynowe w płytce moto-
rycznej tylko w minimalnym stopniu mogą wpływać na receptory nikotynowe w zwo-
jach nerwowych, zaś leki działające na receptory nikotynowe w zwojach dopiero w bar-
dzo dużych stężeniach wpływają na receptory nikotynowe płytki motorycznej.
7.1.2
Farmakodyn-Janiec-07-10.fm Page 158 Wednesday, September 17, 2008 8:19 AM
159
Receptory nikotynowe w błonie postsynaptycznej płytki motorycznej osoby dorosłej
składają się z białek (α1)
2
,β1,δ,ε, natomiast w okresie płodowym receptory nikotynowe
płytki motorycznej składają się z białek (α1)
2
,β1,δ,γ. By wywołać pobudzenie, do jed-
nego receptora nikotynowego płytki motorycznej muszą się jednocześnie przyłączyć
dwie cząsteczki acetylocholiny – jedna przyłącza się między N-końcowymi hydrofobo-
wymi domenami α–δ, natomiast druga między domenami α–ε lub α–γ. Pobudzenie re-
ceptorów nikotynowych w płytce motorycznej powoduje otwarcie kanałów dla jonów
Na
+
i jonów Ca
2+
oraz wystąpienie skurczu mięśni szkieletowych. Po wystąpieniu po-
budzenia cząsteczki acetylocholiny odłączają się od receptora nikotynowego i są szybko
rozkładane przez acetylocholinoesterazę zlokalizowaną w błonie postsynaptycznej płyt-
ki motorycznej. W receptorze nikotynowym płytki motorycznej odległość między
N-końcowymi hydrofobowymi domenami α–δ, i α–ε wynosi około 1,35 nm.
Czwartorzędowe zasady amoniowe mające dwie grupy amoniowe w odległości około
1,35 nm mogą przyłączać się do receptorów nikotynowych w płytce motorycznej i blo-
kować działanie acetylocholiny – związki o takiej budowie są wykorzystywane do ha-
mowania receptorów nikotynowych występujących w postsynaptycznej części płytki
motorycznej.
Leki hamujące postsynaptyczną część zakończeń nerwowych dzieli się w zależności
od mechanizmu działania na:
1) leki powodujące blok polaryzacyjny (niedepolaryzacyjny);
2) leki powodujące blok depolaryzacyjny.
Leki powodujące blok polaryzacyjny
(niedepolaryzacyjny)
Leki wywołujące blok polaryzacyjny zakończeń nerwowo-mięśniowych hamują prze-
wodzenie impulsu nerwowego poprzez uniemożliwienie dostępu acetylocholiny do re-
ceptorów w błonie postsynaptycznej na skutek blokowania receptorów nikotynowych.
Działanie tej grupy leków podlega zjawisku sumacji. Znajomość tego zjawiska ma
duże znaczenie praktyczne. Podanie pierwszej dawki leku powodującego blok polaryza-
Ryc. 7.3.
Łączenie się dwóch cząsteczek acetylocholiny z receptorem nikotynowym w płytce mo-
torycznej.
7.1.2.1
Farmakodyn-Janiec-07-10.fm Page 159 Wednesday, September 17, 2008 8:19 AM
160
cyjny przykrywa powierzchnię receptorową błony postsynaptycznej w 90–100%, wy-
wołując blok polaryzacyjny i wystąpienie zwiotczenia mięśni. Eliminowanie leku z po-
wierzchni błony postsynaptycznej powoduje stopniowe ustępowanie zwiotczenia mię-
śni. Ustąpi ono całkowicie, jeżeli zostanie odsłonięte (odblokowane) około 50%
receptorów na błonie postsynaptycznej. Jeżeli istnieje potrzeba ponownego podania
leku w krótkim czasie po podaniu pierwszej dawki, należy pamiętać, że trzeba podać
mniejszą dawkę, ponieważ część pola receptorowego dla acetylocholiny jest już zablo-
kowana, mimo braku objawów klinicznych zwiotczenia mięśni.
W badaniach oznacza się stopień zablokowania płytki motorycznej przez określenie
efektywnej dawki (ED) powodującej blokadę płytki w 30, 50 lub 95%. Podawana przy
opisie leków dawka porażająca płytkę motoryczną ED
95
oznacza efektywną dawkę po-
wodującą w 95% porażenie mięśnia odwodziciela kciuka przy stymulacji nerwu łokcio-
wego. Oznaczenie stopnia porażenia tego mięśnia pozwala ocenić podczas zabiegu chi-
rurgicznego stopień blokady płytek motorycznych. Zwykle stosuje się dawkę równą po-
dwójnej wartości ED
95
.
Działanie leków powodujących blok polaryzacyjny jest nasilane przez środki znie-
czulające ogólnie oraz niektóre antybiotyki.
Osłabienie działania leków wywołujących blok polaryzacyjny występuje przy obni-
żeniu temperatury ciała, zwiększonym stężeniu potasu, a także po podaniu leków powo-
dujących depolaryzację błony postsynaptycznej (suksametonium) lub leków powodują-
cych uwalnianie acetylocholiny z zakończeń nerwowych (4-aminopirydyna), natomiast
znoszą je związki hamujące aktywność acetylocholinoesterazy (zwiększa się wówczas
ilość acetylocholiny w obrębie płytki nerwowo-mięśniowej i na zasadzie konkurencji
środek zwiotczający uwalnia się z połączeń receptorowych). Dla odwrócenia bloku po-
laryzacyjnego oraz w przypadku przedawkowania środków zwiotczających najczęściej
stosuje się takie inhibitory acetylocholinoesterazy, jak: neostigmina, edrofonium i ga-
lantamina (leki te szybko przywracają przewodnictwo nerwowo-mięśniowe).
Leki powodujące blok polaryzacyjny nie są wchłaniane z przewodu pokarmowego,
trudno rozpuszczają się w lipidach, nie przenikają do OUN. Stosuje się je dożylnie
i niekiedy domięśniowo. Wykazują silne działanie zwiotczające mięśnie i mogą powo-
dować porażenie mięśni oddechowych klatki piersiowej i przepony. Porażenie mięśni
oddechowych stwarza zagrożenie dla życia i dlatego przy stosowaniu tych leków należy
dysponować sprzętem do sztucznego oddychania. Leki powodujące zwiotczenie mięśni
nie wykazują działania przeciwbólowego (trzeba o tym pamiętać, ponieważ po zastoso-
waniu leków zwiotczających chory w narkozie nie może powiedzieć lekarzowi o odczu-
wanym bólu).
Niezwykle ważne jest też dobre rozpoznanie odnośnie do czasu rozpoczęcia i czasu
trwania działania leku w celu zaplanowania odpowiedniego postępowania leczniczego.
Wiele leków wywołujących blok polaryzacyjny nie ulega biotransformacji, są wydalane
w postaci niezmienionej. Dlatego bardzo istotna jest również znajomość sposobu meta-
bolizmu i wydalania tych leków – zastosowanie leku powodującego blok polaryzacyjny
wydzielanego przez nerki u osoby z niewydolnością nerek spowoduje bardzo silne
i długotrwałe działanie leku.
Ze względów praktycznych w grupie leków powodujących blok polaryzacyjny wy-
różnia się leki działające krótko – 12–18 minut (miwakurium i rapakuronium; początek
działania po 1–1,5 minuty), leki o średnim czasie działania – 30–40 minut (rokuronium,
wekuronium, atrakurium; początek działania po 2–4 minutach) i leki działające długo –
40–120 minut (pankuronium, pipekuronium; początek działania po 4–6 minutach). Do-
datkową grupę stanowią leki działające ultrakrótko, do których zalicza się suksameto-
nium (lek ten powoduje działanie depolaryzacyjne, początek działania po podaniu iv.
występuje po 30 s, czas trwania działania 5–8 minut).
Farmakodyn-Janiec-07-10.fm Page 160 Wednesday, September 17, 2008 8:19 AM

161
Z kolei w zależności od budowy chemicznej leki wywołujące blok polaryzacyjny
można podzielić na:
1) pochodne izochinoliny: alkuronium, miwakurium, atrakurium, cisatrakurium;
2) pochodne steroidowe: pankuronium, rokuronium, wekuronium, pipekuronium.
Pochodne izochinoliny
Do leków wywołujących blok polaryzacyjny należały alkaloidy kurary. Kurara jest
wyciągiem otrzymanym z różnych roślin z rodzaju kulczyba (Strychnos), np. Strychnos
toxifera, oraz z suszonych korzeni niewielkiej trującej rośliny stepowej Chondroden-
dron tomentosum, używanym przez południowoamerykańskich Indian do zatruwania
strzał.
W lecznictwie przez wiele lat była stosowana
D
-tubokuraryna – wielkocząsteczkowy
związek krystaliczny zawierający 2 atomu azotu IV-rzędowego odległe od siebie
o 1,2–1,4 nm.
D
-Tubokuraryna łączy się z cząsteczką białka receptora dla acetylocholiny w błonie
postsynaptycznej płytki mięśniowej, wskutek czego nie pozwala cząsteczkom uwolnio-
nej acetylocholiny wywołać depolaryzacji tej błony. Proces depolaryzacji nie przecho-
dzi więc na błonę postsynaptyczną, która pozostaje spolaryzowana.
D
-Tubokuraryna działa hamująco na przewodnictwo nerwowo-mięśniowe przez kon-
kurencję z acetylocholiną w stosunku do receptora nikotynowego. Powoduje to zwiot-
czenie mięśni prążkowanych. Działanie tubokuraryny znosi nadmiar acetylocholiny.
Działanie tubokuraryny rozpoczyna się od porażenia kolejno mięśni twarzy, szyi,
brzucha, kończyn, a wreszcie mięśni międzyżebrowych i przepony. Przy ustępowaniu
działania leku objawy porażenia znikają w odwrotnej kolejności. Po podaniu większych
dawek niż te, które są potrzebne do zablokowania przewodnictwa nerwowo-mięśnio-
wego, środek ten blokuje przewodnictwo w zwojach układu autonomicznego, co obja-
wia się u niektórych chorych obniżeniem ciśnienia tętniczego. Ponadto
D
-tubokuraryna
uwalnia znaczne ilości histaminy, powodując szereg niepożądanych efektów, takich jak:
skurcz oskrzeli, niedociśnienie, bradykardia, arytmia, świąd, pokrzywki skórne i inne
odczyny uczuleniowe. Z tego względu nie jest już stosowana w lecznictwie.
Wśród leków o podobnej budowie chemicznej do
D
-tubokuraryny obecnie stosuje
się: alkuronium, atrakurium, cisatrakurium i miwakurium. Wszystkie one wykazują
znacznie mniej efektów niepożądanych.
Alkuronium.
Jest syntetyczną pochodną toksyferyny (alkaloidu uzyskiwanego z ku-
rary). Wywołuje długo działające niedepolaryzacyjne zwiotczenie mięśni. Wiąże się
z albuminami krwi. Zmniejszenie stężenia albumin we krwi nasila działanie leku. Jest
stosowany dożylnie do zwiotczenia mięśni podczas dłużej trwających zabiegów opera-
cyjnych. Po podaniu dawki 0,3 mg/kg mc. zwiotczenie występuje po około 3–4 minu-
7.1.2.1.1
Farmakodyn-Janiec-07-10.fm Page 161 Wednesday, September 17, 2008 8:19 AM
162
tach, a działanie utrzymuje się przez około 40 minut. Półokres eliminacji wynosi około
3,3 godziny. Lek nie jest metabolizowany i w ciągu 24 godzin jest wydalany w 80–85%
w postaci niezmienionej przez nerki. Pozostała ilość jest wydzielana z żółcią i następnie
wydalana z kałem. Przy niewydolności nerek występuje nasilenie działania leku, zaś
okres półtrwania może się zwiększyć około 5-krotnie. Działanie leku może być również
nasilone przez antybiotyki aminoglikozydowe, a także halotan.
D z i a ł a n i a n i e p o ż ą d a n e. Może powodować uwalnianie histaminy, słabiej
jednak niż
D
-tubokuraryna.
P
RODUKT
LECZNICZY
I
DAWKOWANIE
Alcuronium (chlorek)
Alloferin – ampułki 5 mL i 10 mL (roztwór 1 mg/mL)
U osób dorosłych stosuje się 0,3 mg/kg mc. dożylnie, a dawki dodatkowe (mniejsze) odpo-
wiednio do stanu klinicznego
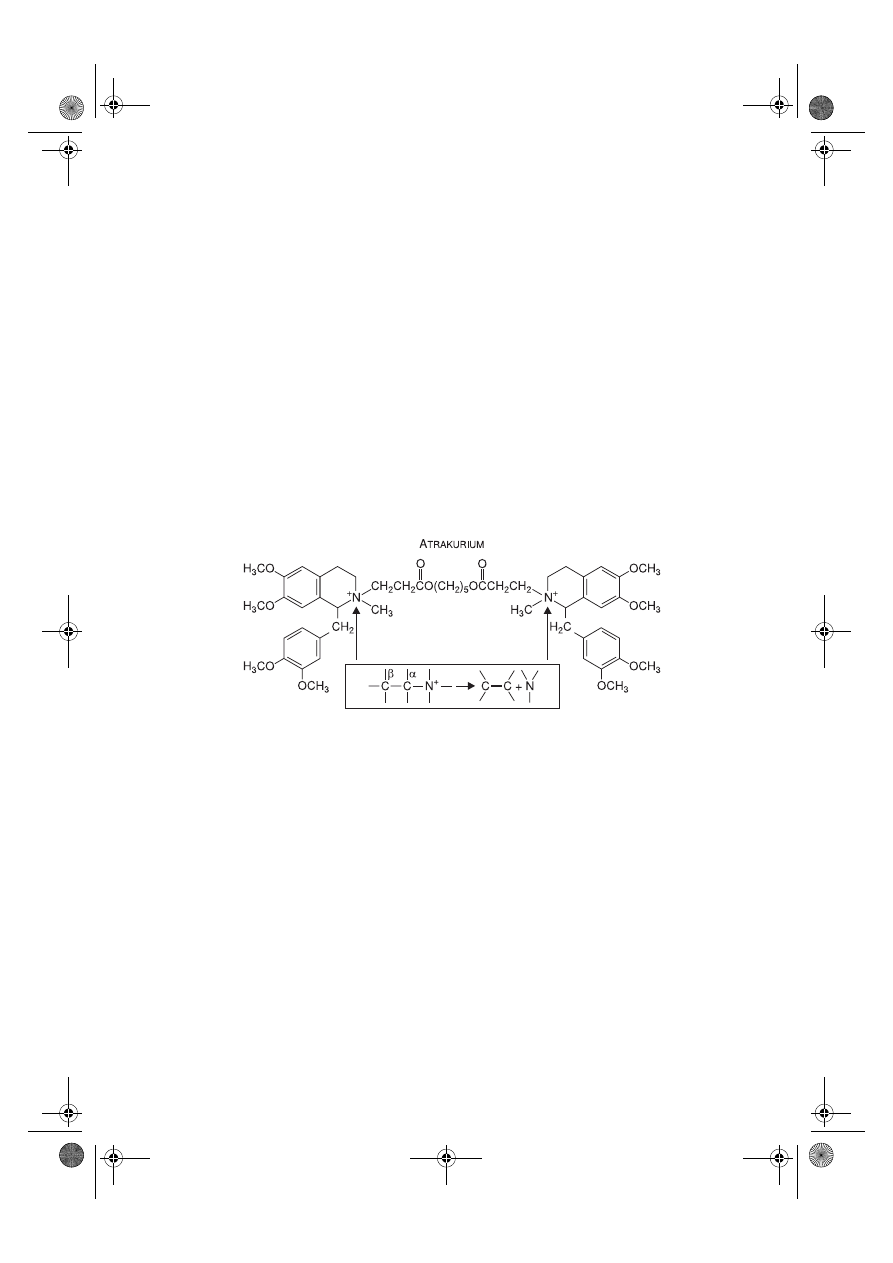
Atrakurium.
Jest niedepolaryzacyjnym lekiem porażającym płytkę motoryczną sto-
sowanym dożylnie. ED
95
wynosi około 0,23 mg/kg mc.
Działanie zwykle rozpoczyna się już po 2 minutach. Utrzymuje się przez 20–30
minut i ustępuje w 95% po 60–70 minutach. Okres półtrwania wynosi około 20 minut.
Atrakurium ulega samoistnej hydrolizie w reakcji Hofmanna lub jest metabolizowany
przez nieswoiste esterazy – obie drogi biotransformacji nie zależą od czynności wątroby
i nerek i dlatego środek ten jest zalecany pacjentom z niewydolnością tych narządów.
Głównym metabolitem powstającym w reakcji Hofmanna jest laudanozyna (nie poraża
ona zakończeń nerwowo-mięśniowych, ma długi okres eliminacji – około 150 minut,
przechodzi do OUN i działa pobudzająco). Działanie atrakurium jest znoszone przez
podanie neostigminy, edrofonium lub galantaminy.
Nie wykazuje działania kumulacyjnego, nie wpływa na układ krążenia i w niewiel-
kim stopniu powoduje uwalnianie histaminy. Benzenosulfonian atrakurium znajduje za-
stosowanie do zwiotczenia mięśni podczas krótkotrwałych zabiegów chirurgicznych,
u pacjentów leczonych ambulatoryjnie, a także u noworodków i niemowląt.
P
RODUKTY
LECZNICZE
Atracurium (benzenosulfonian)
Abbocurium – ampułki 10 mg/mL
Tracrium – ampułki 25 mg w 2,5 mL, 50 mg w 5 mL, 250 mg w 25 mL
Ryc. 7.4.
Reakcja hydrolizy Hofmanna.
Farmakodyn-Janiec-07-10.fm Page 162 Wednesday, September 17, 2008 8:19 AM

163
Cisatrakurium.
Jest to nowa pochodna atrakurium, podobna w działaniu i metaboli-
zmie do związku macierzystego. Dawki tego środka kilkakrotnie przewyższające ED
95
nie powodują uwalniania histaminy. Okres półtrwania w osoczu u zdrowych dorosłych
wynosi 22–29 minut. Benzenosulfonian cisatrakurium stosuje się u dorosłych i dzieci
powyżej 2. roku życia w celu zwiotczenia mięśni szkieletowych w trakcie średnio-
i długotrwających zabiegów chirurgicznych i diagnostyczno-terapeutycznych.
P
RODUKT
LECZNICZY
Cisatracurium (benzenosulfonian)
Nimbex – ampułki 2,5 mL, 5 mL i 10 mL (2 mg/mL)
Miwakurium.
Powoduje szybkie zwiotczenie (do 2 minut) i szybkie ustąpienie
bloku. Należy więc do najkrócej działających środków, nie kumuluje się i tylko słabo
uwalnia histaminę. Jest mieszaniną trzech stereoizomerów – izomery trans-trans i ci-
s-trans są głównymi izomerami wykazującymi działanie porażające płytkę motorycz-
ną, natomiast izomer cis-cis jest 10-krotnie słabszy. ED
95
to 0,07 mg/kg mc. Działanie
porażające płytkę motoryczną wywołane przez stereoizomery miwakurium jest zno-
szone przez inhibitory acetylocholinoesterazy. U dzieci ED
95
wynosi 0,1 mg, działa-
nie u nich jest szybsze i krótsze. Półokres eliminacji dla izomeru trans-trans wynosi
2,3 minuty, dla izomeru cis-trans 2,1 minuty, a dla izomeru cis-cis około 55 minut.
Izomery są hydrolizowane przez cholinoesterazę w osoczu i częściowo w wątrobie.
U pacjentów ze znacznym uszkodzeniem tego narządu działanie leku jest około 3 razy
dłuższe, zaś u pacjentów z uszkodzeniem nerek zwiększa się 1,5 raza. Należy zacho-
wać ostrożność u osób z genetycznie uwarunkowanym defektem cholinoesterazy.
Chlorek miwakurium stosuje się u dorosłych oraz dzieci od 2. roku życia do krótko-
trwałych zabiegów.
P
RODUKT
LECZNICZY
Mivacurium (chlorek)
Mivacron – ampułki 10 mg w 5 mL, 20 mg w 10 mL (roztwór do wstrzyknięć iv.)
Pochodne steroidowe
Pankuronium.
Lek ten w postaci bromku został wprowadzony do lecznictwa w 1967
roku. Jest on syntetyczną pochodną aminosteroidową, zawierającą dwa IV-rzędowe ato-
my azotu. Działa na styk nerwowo-mięśniowy podobnie jak
D
-tubokuraryna, nie wyka-
zując przy tym działania steroidowego. Siła działania pankuronium jest 5-krotnie wyż-
sza niż
D
-tubokuraryny, a czas działania pojedynczej dawki wynosi około 45 minut.
Słabo wpływa na układ sercowo-naczyniowy, nie obniża ciśnienia tętniczego i nie
zmienia szybkości tętna. Szczególną zaletą leku jest brak działania uwalniającego hista-
7.1.2.1.2
Farmakodyn-Janiec-07-10.fm Page 163 Wednesday, September 17, 2008 8:19 AM
164
minę oraz brak wpływu na zwoje. Podaje się go często dożylnie w dawkach 0,06–0,08
mg/kg mc. Inne środki znieczulające ogólnie wzmagają działanie pankuronium.
P
RODUKTY
LECZNICZE
Pancuronium (bromek)
Pancuronium – ampułki 4 mg/2 mL
Pavulon – ampułki 4 mg/2 mL
Pipekuronium.
Jest to długo działający lek porażający płytkę nerwowo-mięśniową.
ED
95
wynosi około 41 μg/kg mc. Po podaniu dawki 70–85 μg/kg mc. maksymalna blo-
kada występuje po około 5 minutach. Działanie ustępuje po około 80–124 minutach.
Przy wcześniejszym zastosowaniu suksametonium działanie jest przedłużone. Lek nie-
znacznie wpływa na układ krążenia i powoduje obniżenie ciśnienia krwi oraz pojemno-
ści wyrzutowej serca. Wydalany jest w 75% przez nerki. Półokres eliminacji (t
0,5
) wy-
nosi około 1,7 godziny, przy transplantacji nerek około 4 godzin. Działanie preparatu
u dzieci może być osłabione.
P
RODUKT
LECZNICZY
Pipecuronium (bromek)
Arduan – fiolki 4 mg (liofilizat)
Rokuronium.
Wykazuje szybkie polaryzacyjne blokowanie płytki motorycznej. Jest
stosowane dożylnie. ED
95
wynosi 0,3 mg/kg mc. Po podaniu dożylnym dawki 0,45–0,6
mg/kg mc. intubację można wykonać w ciągu 60–70 s od zastosowania. Maksymalne
działanie występuje po około 1,8–3 minutach i utrzymuje się przez 22–31 minut. Po po-
daniu dożylnym eliminacja przebiega początkowo w fazie szybkiej (t
0,5
= 14 minut),
a następnie w fazie powolnej (t
0,5
= 14–18 minut). Lek wiąże się w około 30% z białka-
mi krwi.
Rokuronium jest metabolizowane głównie w wątrobie, jej uszkodzenie wydłuża
t
0,5
fazy szybkiej o 4–5 minut. U niektórych pacjentów obserwowano wystąpienie tachy-
kardii i wzrost ciśnienia krwi. Lek na ogół jest dobrze znoszony. Działanie rokuronium
jest wydłużone i nasilone w kwasicy, zaś skrócone i osłabione w zasadowicy. Zwykle
stosuje się je w dawce 0,6 mg/kg mc. do zwiotczenia mięśni przed intubacją tchawicy.
P
RODUKT
LECZNICZY
Rocuronium (bromek)
Esmeron – fiolki 5 i 10 mL (10 mg/mL)
Wekuronium.
Wykazuje działanie hamujące przekaźnictwo w płytce motorycznej
w zależności od dawki. ED
95
wynosi około 0,057 mg/kg mc. Po podaniu dawki
0,08–0,1 mg/kg mc. działanie rozpoczyna się już po 1 minucie, a intubację można wy-
konać po 2–3 minutach. Pełne działanie zwiotczające występuje po 3–5 minutach. Jeżeli
wekuronium stosuje się po rozpoczęciu znieczulenia halotanem, izofluranem lub enflu-
ranem, dawkę należy zmniejszyć około 15%. Jeżeli wcześniej stosowano suksameto-
nium, zaleca się odczekać z podaniem wekuronium do ustąpienia jego działania.
Wekuronium nie ulega kumulacji. Po podaniu dawek 0,04–0,1 mg/kg mc. dożylnie
60–80% leku wiąże się z białkami krwi. Półokres eliminacji z krwi wynosi 65–75 mi-
nut. Około 3–35% jest wydalane z moczem w ciągu 24 godzin, a 25–50% z żółcią
w ciągu 42 godzin. Lek wydala się głównie w postaci niezmienionej, natomiast około
10% jako 3-desacetylowekuronium (aktywność metabolitu jest o połowę mniejsza). Nie
powoduje zmian ciśnienia krwi i częstości pracy serca, a także nie uwalnia histaminy.
Farmakodyn-Janiec-07-10.fm Page 164 Wednesday, September 17, 2008 8:19 AM

165
Zwykle początkowa dawka wynosi 0,08–0,1 mg/kg mc. Przy infuzji ciągłej stosuje się
0,1 μg/min. Wekoronium stosowane jest do dłużej trwających zabiegów, szczególnie
u pacjentów z chorobami układu krążenia.
P
RODUKT
LECZNICZY
Vecuronium (bromek)
Norcuron – ampułki 4 mg i fiolki 10 mg (proszek)
Rapakuronium.
Jest syntetycznym związkiem sterolowym o IV-rzędowej struktu-
rze. Po podaniu w dawce 1,5 mg/kg mc. hamuje czynność płytki motorycznej. Maksy-
malne działanie występuje po około 88 s, a efektywne blokowanie płytki motorycznej
utrzymuje się przez około 15 minut. Ulega przemianie do kilku metabolitów, z których
metabolit 3-hydroksy także blokuje płytkę motoryczną, jednak słabiej od związku ma-
cierzystego.
P
RODUKT
LECZNICZY
Rapakuronium (bromek)
Raplon – ampułki 100 mg (5mL) i 200 mg (10 mL)
Leki powodujące blok depolaryzacyjny
Leki powodujące blok depolaryzacyjny łączą się z receptorami nikotynowymi w części
postsynaptycznej zakończeń nerwowo-mięśniowych i powodują depolaryzację. Nie są
rozkładane przez acetylocholinoesterazę. Na skutek pobudzenia receptorów nikotyno-
wych w płytce motorycznej powodują pobudzenie włókien mięśniowych. Pobudzenie
mięśniowe wywoływane przez tę grupę leków nie jest skoordynowane i dlatego wystę-
puje drżenie mięśniowe.
Zastosowanie leków depolaryzacyjnych do wywołania zwiotczenia mięśni u chorych
w powikłanych złamaniach kości, ze względu na występujące drżenie mięśniowe, może
nasilić uraz, jest także przyczyną występowania bólów mięśniowych po operacji.
Leki powodujące blok depolaryzacyjny działają szybko i krótko. Są więc dobrymi le-
kami do wywoływania krótko trwającego zwiotczenia mięśni w celu wykonania nie-
zbędnego zabiegu, np. intubacji. Powtarzanie w krótkim czasie stosowania leków depo-
laryzacyjnych lub podawanie dużych ich dawek początkowo powoduje blok depolary-
zacyjny (blok I stopnia), który następnie może przejść w blok polaryzacyjny (blok II
stopnia). Wystąpienie bloku polaryzacyjnego to wynik głębokiego wnikania leku
w struktury błony postsynaptycznej. Wadą tej grupy leków jest brak leków znoszących
ich działanie.
Zastosowanie inhibitorów acetylocholinoesterazy (neostigminy, edrofonium) nasila
działanie leków wywołujących blok depolaryzacyjny, szczególnie w bloku I stopnia, ale
niekiedy może też łagodzić blok depolaryzacyjny II stopnia.
Blok depolaryzacyjny jest wywoływany przez suksametonium, dekametonium i kar-
bolonium – z tej grupy stosuje się suksametonium.
Suksametonium.
Jest połączeniem dwóch cząsteczek acetylocholiny. Wywołuje
blok depolaryzacyjny w zakończeniach nerwowo-mięśniowych. Po podaniu dożylnym
działa już po 30 s i działanie utrzymuje się około 5 minut. Jest rozkładane przez nieswo-
iste esterazy we krwi. U osób z genetycznie uwarunkowanym niedoborem esterazy lub
u zatrutych pestycydami działanie leku jest nasilone.
7.1.2.2
Farmakodyn-Janiec-07-10.fm Page 165 Wednesday, September 17, 2008 8:19 AM

166
Suksametonium bezpośrednio po podaniu powoduje wzrost ciśnienia śródocznego,
które utrzymuje się po ustąpieniu działania zwiotczającego. Może również powodować
wzrost ciśnienia śródczaszkowego, a niekiedy też uwalnianie histaminy, którego obja-
wem jest zaczerwienienie twarzy, skurcz oskrzeli i obniżenie ciśnienia krwi. Nie może
być stosowane u osób ze stwierdzonym w wywiadzie występowaniem w rodzinie zło-
śliwej hipertermii oraz z rozległymi uszkodzeniami ciała, powstałymi w wyniku opa-
rzeń lub urazów. Podanie w takich przypadkach suksametonium powoduje wystąpienie
hiperkaliemii, która może spowodować zatrzymanie pracy serca.
Lek powoduje również pobudzenie nerwu błędnego i może na tej drodze zwalniać
częstość pracy serca lub wywoływać tachykardię.
Przy zastosowaniu suksametonium do zwiotczenia mięśni w czasie porodu należy
uwzględnić ryzyko przenikania leku do płodu i wystąpienia u noworodka bezdechu.
Działanie to może wystąpić przy stosowaniu u rodzącej dawki większej niż 1 mg/kg
mc.
Przez kilka dni po porodzie w surowicy występuje obniżenie aktywności esterazy
o około 24%, w takich przypadkach działanie suksametonium jest nasilone. Aktywność
esterazy w osoczu może być również zmniejszona przy długotrwałym stosowaniu gliko-
kortykosteroidów, doustnych leków antykoncepcyjnych, niektórych leków przeciwno-
wotworowych oraz inhibitorów MAO. Działanie suksametonium nasilają też: prokaina-
mid, lidokaina, prokaina, neostigmina, chinidyna, sole magnezu, antybiotyki aminogli-
kozydowe, amfoterycyna B, na skutek wpływu tych leków na hamowanie procesów
repolaryzacji.
P
RODUKT
LECZNICZY
I
DAWKOWANIE
Suxamethonium (chlorek)
Chlorsuccillin – fiolki 200 mg
Dawkę dobiera się indywidualnie, zwykle stosuje się dożylnie 0,1–1 mg/kg mc.; u dzieci dożyl-
nie 1 mg/kg mc., domięśniowo do 4 mg/kg mc.; lek może być również stosowany we wlewie
kroplowym
Leki stosowane w stanach spastycznych
mięśni szkieletowych
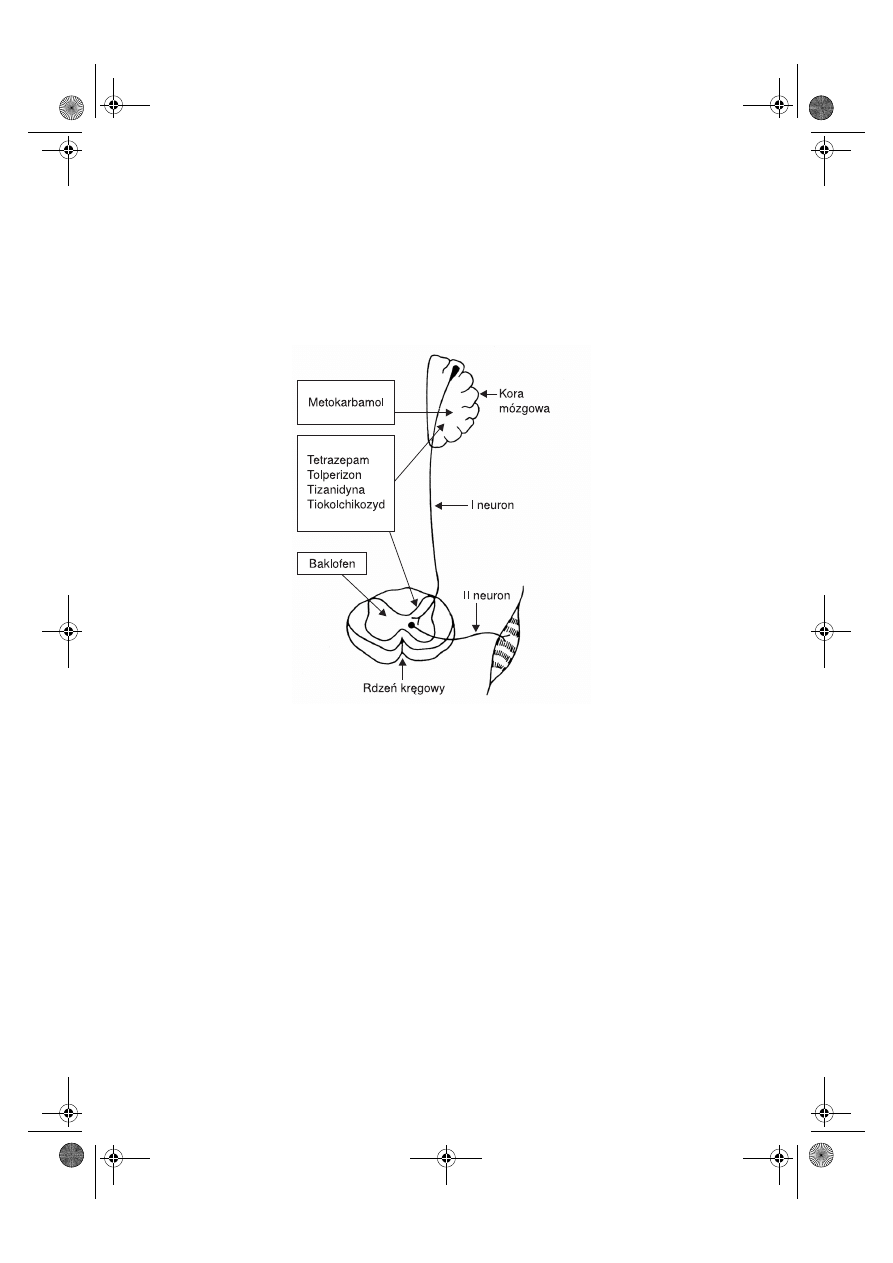
Stany spastyczne mięśni szkieletowych występują przy uszkodzeniu przewodzenia
bodźców ruchowych na odcinku od kory mózgowej do komórek rogów przednich sub-
stancji szarej rdzenia kręgowego. Bodźce ruchowe z OUN do komórek rogów przed-
nich substancji szarej rdzenia kręgowego przewodzone są za pomocą dróg piramido-
wych i pozapiramidowych.
Bodźce ruchowe przewodzone przy udziale dróg piramidowych biegną przez dwa
neurony. Pierwszy neuron biegnie od komórek piramidalnych kory mózgowej bezpo-
średnio do komórek α rogów przednich rdzenia kręgowego. Drugi neuron biegnie od
komórek α rogów przednich bezpośrednio do zakończeń nerwowo-mięśniowych mięśni
7.2
Farmakodyn-Janiec-07-10.fm Page 166 Wednesday, September 17, 2008 8:19 AM
167
szkieletowych. Z kolei bodźce ruchowe przewodzone przy udziale dróg pozapiramido-
wych są wieloneuronalne: pierwszy neuron biegnie od kory lub móżdżku do ośrodków
podkorowych, w tym do tworu siatkowatego, drugi od ośrodków podkorowych do ko-
mórek γ rogów przednich, a trzeci od komórek nerwowych rogów przednich do połą-
czeń nerwowo-mięśniowych mięśni szkieletowych.
Stany spastyczne powstają przy uszkodzeniu przewodzenia bodźców ruchowych na
odcinku pierwszego neuronu w drogach piramidowych lub na poziomie pierwszego
i drugiego neuronu w drogach pozapiramidowych (ryc. 7.5).
Z kolei przy porażeniu neuronu na odcinku od komórek rdzenia kręgowego do za-
kończeń nerwowo-mięśniowych rozwija się porażenie wiotkie z zanikiem mięśni szkie-
letowych. W tego typu porażeniu może wystąpić faza drżenia mięśniowego spowodo-
wanego zanikiem płytek zakończeń nerwowo-mięśniowych (płytki motorycznej) oraz
rozprzestrzenieniem się receptorów wrażliwych na acetylocholinę na całą powierzchnię
włókien mięśniowych.
W zależności od rozwoju uszkodzenia neuronów ruchowych porażenie spastyczne
może być poprzedzone porażeniem wiotkim.
Przy uszkodzeniu pnia mózgu i tworu siatkowatego na wysokości wzgórków blaszki
pokrywy (tegmentum) dochodzi do bardzo wzmożonego napięcia mięśni. Przy takim
uszkodzeniu może wystąpić sztywność odmóżdżeniowa, charakteryzująca się wzmożo-
nym napięciem wszystkich prostowników kończyn górnych i dolnych, lub sztywność
z odkorowania, ze wzmożonym napięciem i zgięciem kończyn górnych.
Porażenia spastyczne są bardzo uciążliwym stanem chorobowym, unieruchamiają
pacjenta, uniemożliwiają zmiany ułożenia ciała, karmienie oraz stwarzają niebezpie-
czeństwo powstawania odleżyn. Do leczenia stanów spastycznych stosuje się leki mo-
gące je osłabić i umożliwić lepszą pielęgnację chorego.
Ryc. 7.5.
Miejsca uchwytu działania leków stosowanych w stanach spastycznych.
Farmakodyn-Janiec-07-10.fm Page 167 Wednesday, September 17, 2008 8:19 AM

168
Zakres i asortyment tej grupy leków jest jednak ograniczony – należą do nich:
1) leki hamujące stany spastyczne mięśni szkieletowych na poziomie OUN (metokar-
bamol);
2) leki hamujące stany spastyczne mięśni szkieletowych na poziomie OUN i rdzenia
kręgowego łącznie (tetrazepam, tolperizon, tizanidyna i tiokolchikozyd);
3) leki hamujące stany spastyczne mięśni szkieletowych na poziomie rdzenia kręgo-
wego (baklofen).
Leki hamujące stany spastyczne mięśni
szkieletowych na poziomie OUN
Metokarbamol.
Działa ośrodkowo zwiotczająco na mięśnie szkieletowe i jednocześnie
uspokajająco. Stosowany jest w stanach spastycznych kończyn, pomocniczo też w le-
czeniu tężca. Dobrze wchłania się z przewodu pokarmowego. Nasila działanie innych
leków hamujących czynność OUN.
P
RODUKT
LECZNICZY
Methocarbamolum
Methocarbamol – tabletki 500 mg
Leki hamujące stany spastyczne mięśni
szkieletowych na poziomie OUN
i rdzenia kręgowego łącznie
Tetrazepam.
Pochodna benzodiazepinowa o silnym działaniu zwiotczającym mięśnie
szkieletowe. Jednocześnie działa sedatywnie, anksjolitycznie i przeciwdrgawkowo. Sto-
sowany jest w przykurczach pourazowych oraz w stanach spastycznych kończyn. Nasila
działanie leków działających depresyjnie na OUN.
P
RODUKTY
LECZNICZE
Tetrazepamum
Miozepam – tabletki powlekane 50 mg
Myolastan – tabletki powlekane 50 mg
Myopam – tabletki 25 mg, 50 mg i 100 mg
Tetraratio – tabletki powlekane 50 mg
Tolperizon.
Działa ośrodkowo na układ siatkowaty i podwzgórze, hamuje odruchy
polisynaptyczne, zmniejszając napięcie mięśni prążkowanych. Jest lekiem mało tok-
sycznym, czasami powoduje senność i ogólne osłabienie. Stosowany doustnie lub pa-
renteralnie w nadmiernym napięciu mięśni, niedowładach, schorzeniach pourazowych,
szczękościsku, a także w zaburzeniach krążenia obwodowego.
7.2.1
7.2.2
Farmakodyn-Janiec-07-10.fm Page 168 Wednesday, September 17, 2008 8:19 AM

169
P
RODUKTY
LECZNICZE
Tolperisonum
Mydocalm – tabletki powlekane 50 mg
Mydocalm forte – tabletki powlekane 150 mg
Tolperis – tabletki powlekane 50 mg
Tizanidyna.
Stosuje się ją doustnie w leczeniu spastyczności mięśni na różnym tle.
Nasila działanie leków uspokajających, etanolu i innych leków zmniejszających napię-
cie mięśni.
P
RODUKTY
LECZNICZE
Tizanidine (chlorowodorek)
Sirdalud – tabletki 4 mg
Sirdalud MR – kapsułki 6 mg, o zmodyfikowanym uwalnianiu
Tiokolchikozyd.
Syntetyczna pochodna kolchicyny, glikozydu otrzymywanego z zi-
mowitu. Zmniejsza napięcie mięśni, działając agonistycznie na receptory GABA i gli-
cynowe w ośrodkowym układzie nerwowym (działa więc hamująco na różnych pozio-
mach OUN). Nie wpływa na płytkę nerwowo-mięśniową, nie zaburza też układu krąże-
nia. Powtarzane dawki mogą się kumulować. Tiokolchikozyd podaje się w bolesnych
przykurczach mięśni na tle zwyrodnieniowych zmian w kręgosłupie, a także po urazach
i w schorzeniach neurologicznych.
P
RODUKT
LECZNICZY
Thiocolchicosidum
Muscoril – kapsułki 4 mg, roztwór do wstrzykiwań domięśniowych 4 mg/2 mL (ampułki)
Leki hamujące stany spastyczne mięśni
szkieletowych na poziomie rdzenia kręgowego
Baklofen.
Hamuje monosynaptyczne i polisynaptyczne odruchy na poziomie rdzenia
kręgowego. Jest analogiem kwasu γ-aminomasłowego (GABA) i pobudza receptory
GABA
B
. Wykazuje również depresyjne działanie na OUN, powoduje uspokojenie, sen-
ność, zaburzenie ruchów, hamuje częstość i amplitudę oddechów, obniża ciśnienie krwi
i zmniejsza częstość pracy serca. Na poziomie płytki motorycznej nie zmniejsza prze-
wodnictwa.
Dobrze wchłania się z przewodu pokarmowego. W około 15% jest metabolizowany
w wątrobie. W 85% wydala się z moczem w postaci niezmienionej.
7.2.3
Farmakodyn-Janiec-07-10.fm Page 169 Wednesday, September 17, 2008 8:19 AM
Wyszukiwarka
Podobne podstrony:
więcej podobnych podstron