
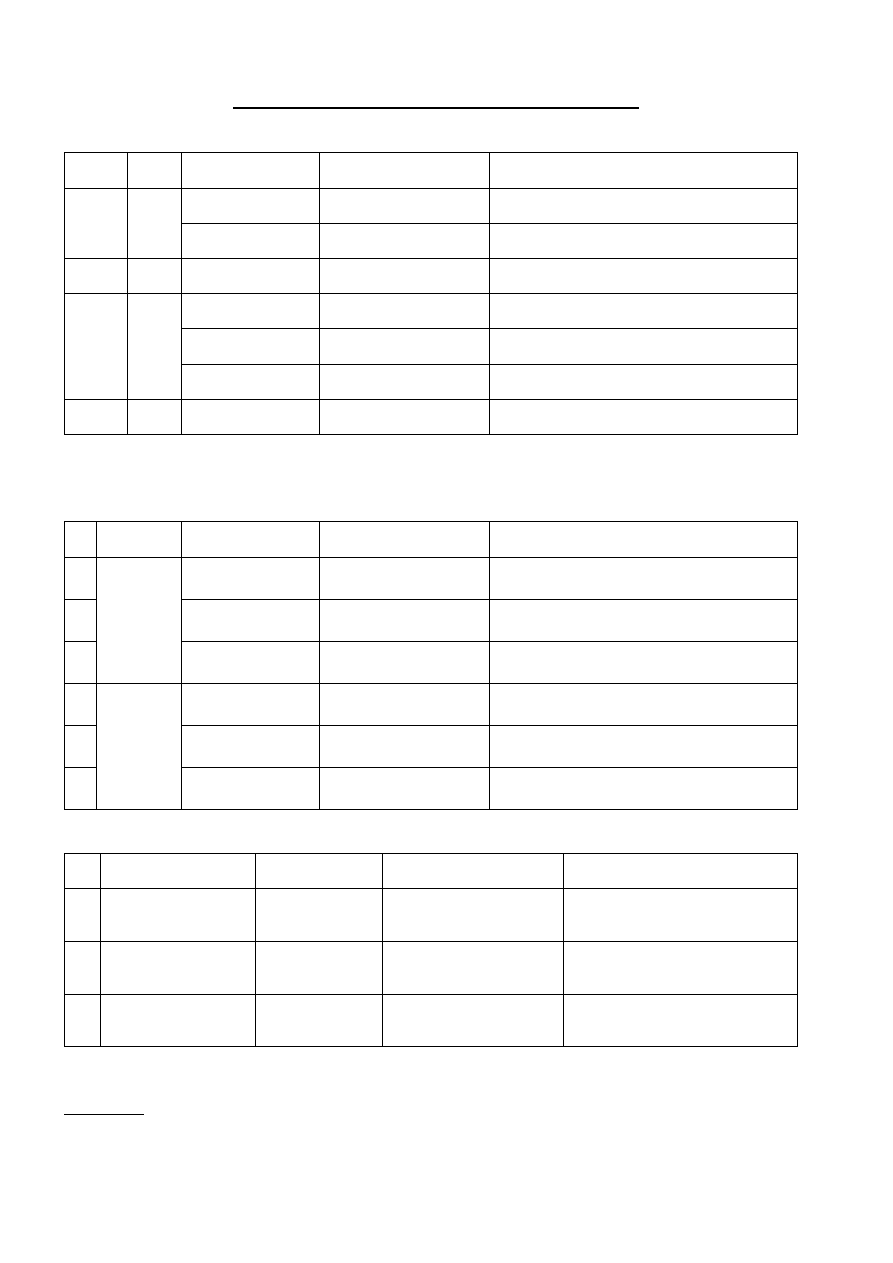
Harmonogram Laboratorium z Chemii Ogólnej, Nieorganicznej i Analitycznej sem. II, 2013/2014
Kierunek:
Technologia Żywności i Żywienie Człowieka
Ilość godzin w semestrze: 75
Pracownia
Tematyka pracowni
Zadania
Chemia analityczna jakościowa
Zajęcia organizacyjne
1
- Zapoznanie z przepisami BHP i regulaminem pracowni.
- Zapoznanie z podstawowymi technikami pracy i sposobami analizowania
próbek zawierających związki nieorganiczne.
Elektrolity słabe i mocne.
2
- Dysocjacja kwasów i zasad, hydroliza soli.
- Wyznaczanie teoretycznej i rzeczywistej wartości pH roztworów kwasów
zasad i soli.
- Wyznaczanie stałej i stopnia dysocjacji.
Roztwory buforowe
- Przygotowanie roztworów buforowych.
- Wykorzystanie roztworów buforowych w chemii analitycznej.
3
Identyfikacja kationów.
-
Podział kationów na grupy analityczne.
Osady
- Warunki wytrącania i rozpuszczania
- Analiza wpływu warunków wytrącania (stężenie, temperatura, pH roztworu).
- Warunki rozpuszczania osadów (amfoteryczność).
- Frakcjonowane strącanie.
4
Analiza kationów należących do poszczególnych grup analitycznych
Zadanie 1.
Identyfikacja 3 pojedynczych kationów
należących do I lub II grupy analitycznej
Procesy utleniania i redukcji
5
- Zapis reakcji redoks.
- Wpływ warunków prowadzenia reakcji redoks na jej przebieg.
Zadanie 2.
Identyfikacja 3 pojedynczych kationów
należących III grupy analitycznej.
Związki kompleksowe
6
- Powstawanie związków kompleksowych.
- Wykorzystanie związków kompleksowych w chemii analitycznej.
Zadanie 3.
Identyfikacja 3 pojedynczych kationów
należących do IV lub V grupy analitycznej.
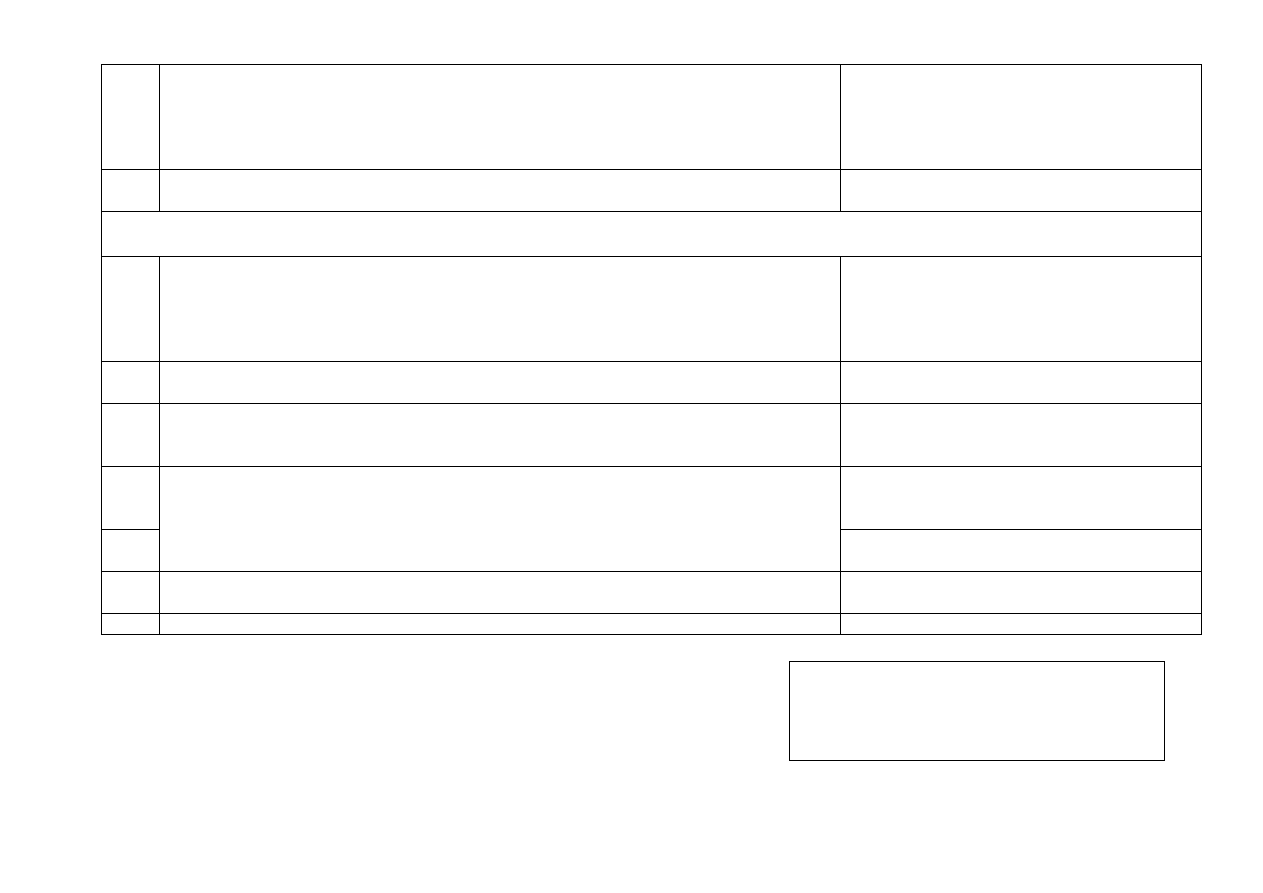
Aniony – identyfikacja pojedynczych jonów i mieszanin.
7
- Wytrącanie osadów.
- Wypieranie z roztworów przez mocniejsze kwasy.
- Właściwości redukująco-utleniające.
Reakcje charakterystyczne dla poszczególnych anionów.
Zadanie 4.
Identyfikacja 3 pojedynczych anionów.
8
Sole, wodorotlenki, tlenki – sposoby identyfikacji
Zadanie 5.
Analiza soli oraz tlenku.
Chemia analityczna ilościowa
Wprowadzenie do analizy ilościowej
9
- Zapoznanie z podstawowymi technikami pracy i naczyniami kalibrowanymi
- Przygotowanie roztworów
a) 0,1 M HCl b) 0,05 M edta
c) 0,02 M KMnO
4
d) 0,1 M Na
2
S
2
O
3
10
Alkacymetria.
Zadanie 6.
Oznaczenie zawartości NaOH.
11
Kompleksometria
Zadanie 7.
Oznaczanie twardości wody (sumy jonów
wapnia i magnezu)
12
Zadanie 8.
Oznaczanie jonów wapnia po oddzieleniu
szczawianu wapnia od jonów magnezu.
13
Redoksymetria
Zadanie 9.
Oznaczanie jonów miedzi(II)
14
Kolorymetria.
Zadanie 10.
Oznaczanie jonów żelaza(III).
15
Test zaliczeniowy obejmujący materiał ze wszystkich kolokwiów.
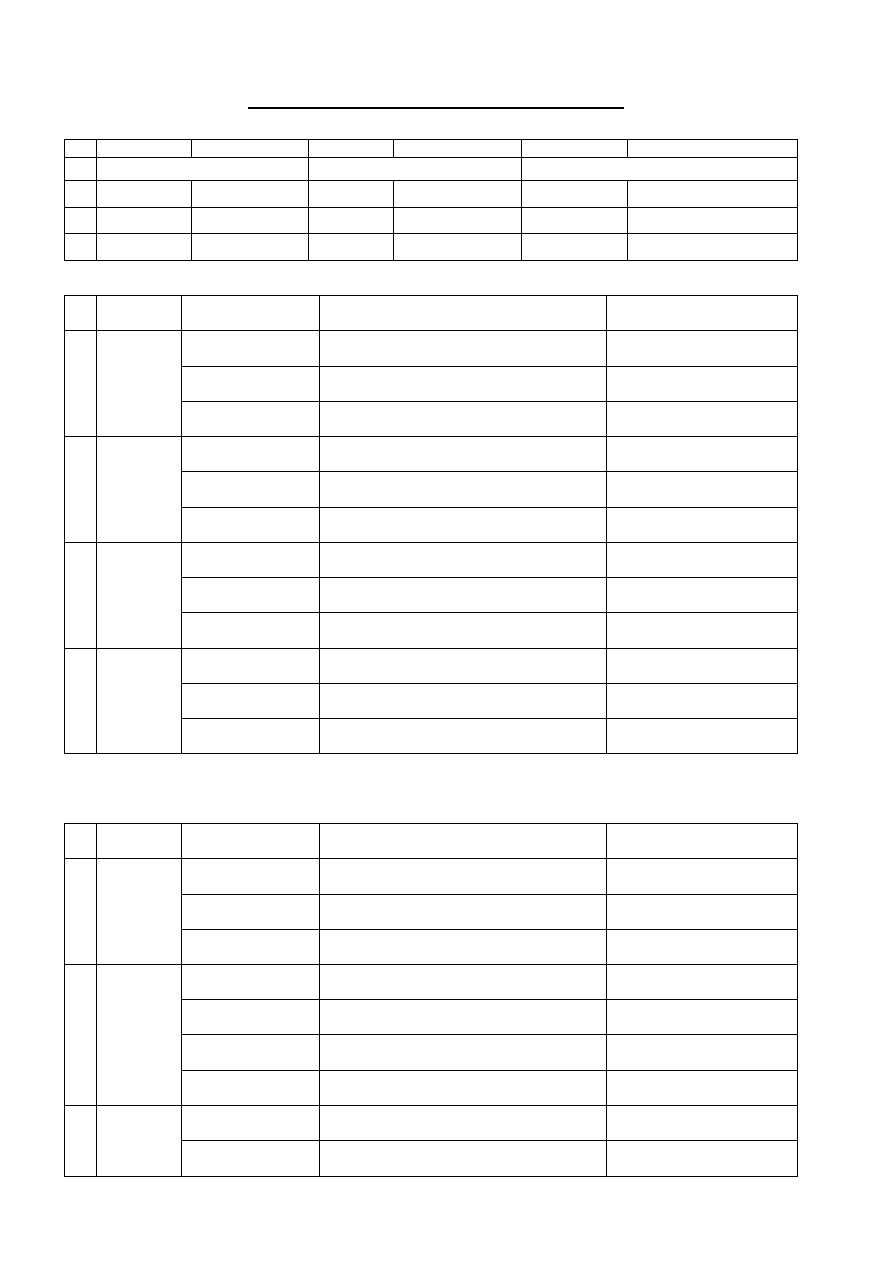
Organizacja zajęć w semestrze letnim
okres zajęć
03.03.2014.r. – 17.04.2014 r.
24.04.2014 r. – 25.06.2014 r.
Ferie wiosenne
18.04.2014 r. – 23.04.2014 r. (piątek – środa)
02.05.2014 r. (piątek) dzień wolny od zajęć
20.06.2014 r. (piątek) dzień wolny od zajęć
05.05.2014 r. (poniedziałek) zajęcia wg planu czwartkowego
06.05.2014 r. (wtorek) zajęcia wg planu piątkowego
25.06.2014 r. (środa) zajęcia wg planu piątkowego
Kierownik przedmiotu: Laboratorium z Chemii ogólnej,
nieorganicznej i analitycznej
Dr Anna Sykuła

KRYTERIA ZALICZENIA LABORATORIUM
Ocena zaliczenia końcowego zajęć laboratoryjnych zależy w 50% od średniej ocen kolokwiów
cząstkowych oraz w 50% od średniej ocen wykonywanych zadań.
KOLOKWIA
W ramach laboratorium studenci zdają 11 kolokwiów cząstkowych (7 z zakresu chemii ogólnej i
analizy jakościowej, 3 analizy ilościowej oraz kolokwium wyjściowe z całości materiału). Kolokwia podczas
zajęć są zdawane w postaci testu pisemnego z 10 pytaniami. Jeżeli student nie uzyskał zaliczenia kolokwium na
zajęciach lub nie był obecny, istnieje możliwość zaliczenia kolokwium, jednakże wyłącznie poza zajęciami
laboratoryjnymi, podczas konsultacji nauczyciela prowadzącego zajęcia. W takim przypadku kolokwium ma
charakter pisemny lub ustny, zgodnie z decyzją prowadzącego.
Student, który trzykrotnie uzyska z tego samego kolokwium ocenę 2 (nzal), nie będzie dopuszczony do
zajęć laboratoryjnych.
Student, który uzyska z trzech dowolnych kolokwiów ocenę 2 (nzal), nie będzie dopuszczony do zajęć
laboratoryjnych.
Warunkiem zaliczenia zajęć laboratoryjnych jest zaliczenie każdego kolokwium cząstkowego na ocenę
co najmniej 3.
ZADANIA
W trakcie pracowni studenci wykonują 10 zadań (5 z zakresu analizy jakościowej, 5 z analizy
ilościowej). Zadania oceniane są na podstawie sprawozdań napisanych przez studentów w oparciu o wykonane
eksperymenty. Sprawozdania winny być oddawane w formie pokazanej w „Materiałach dla studentów”.
Sprawozdania należy zapisać w dzienniku laboratoryjnym (zeszycie zszywanym), z ponumerowanymi stronami.
Nie wolno wyrywać kartek, sklejać ich, naklejać innych kartek na sprawozdania, zamalowywać korektorem lub
zamazywać. Przypadkowe błędy należy przekreślić pojedynczą kreską. Sprawozdania winny być napisane
czytelnie, studenci piszący nieczytelnie proszeni są o pisanie sprawozdań pismem technicznym.
W sprawozdaniach z analizy jakościowej należy zapisać wszystkie wykonywane reakcje i dodawane
odczynniki do analizowanej próbki, niezależnie od wyniku eksperymentu, w celu uniknięcia wielokrotnego
powtarzania tej samej reakcji lub błędnego wyciągania wniosków. W sprawozdaniach z analizy ilościowej
należy umieścić także te wyniki pomiarów, które w toku analizy mogły być obarczone zbyt dużymi błędami i nie
uwzględnione w końcowych obliczeniach (z odpowiednią adnotacją).
Studenci wykonują zadania zgodnie z harmonogramem pracy laboratoryjnej. Jeżeli student nie wykona
zadania na wyznaczonej pracowni, dokończenie zadania pozostawia na wolny czas podczas kolejnych pracowni.
Studenci nieobecni na pracowni nie będą mogli odpracować jej w innym terminie ze względów organizacyjnych.
Student, który uzyska z dwóch dowolnych kolokwiów cząstkowych ocenę 2 (nzal), nie dostanie
żadnego następnego zadania do wykonania.
Warunkiem zaliczenia zajęć laboratoryjnych jest zaliczenie każdego zadania na ocenę co najmniej 3.
Jeżeli student nie zdąży wykonać i zaliczyć wszystkich przewidzianych zadań, uzupełnienie pracowni
planowane jest w następnym roku akademickim.
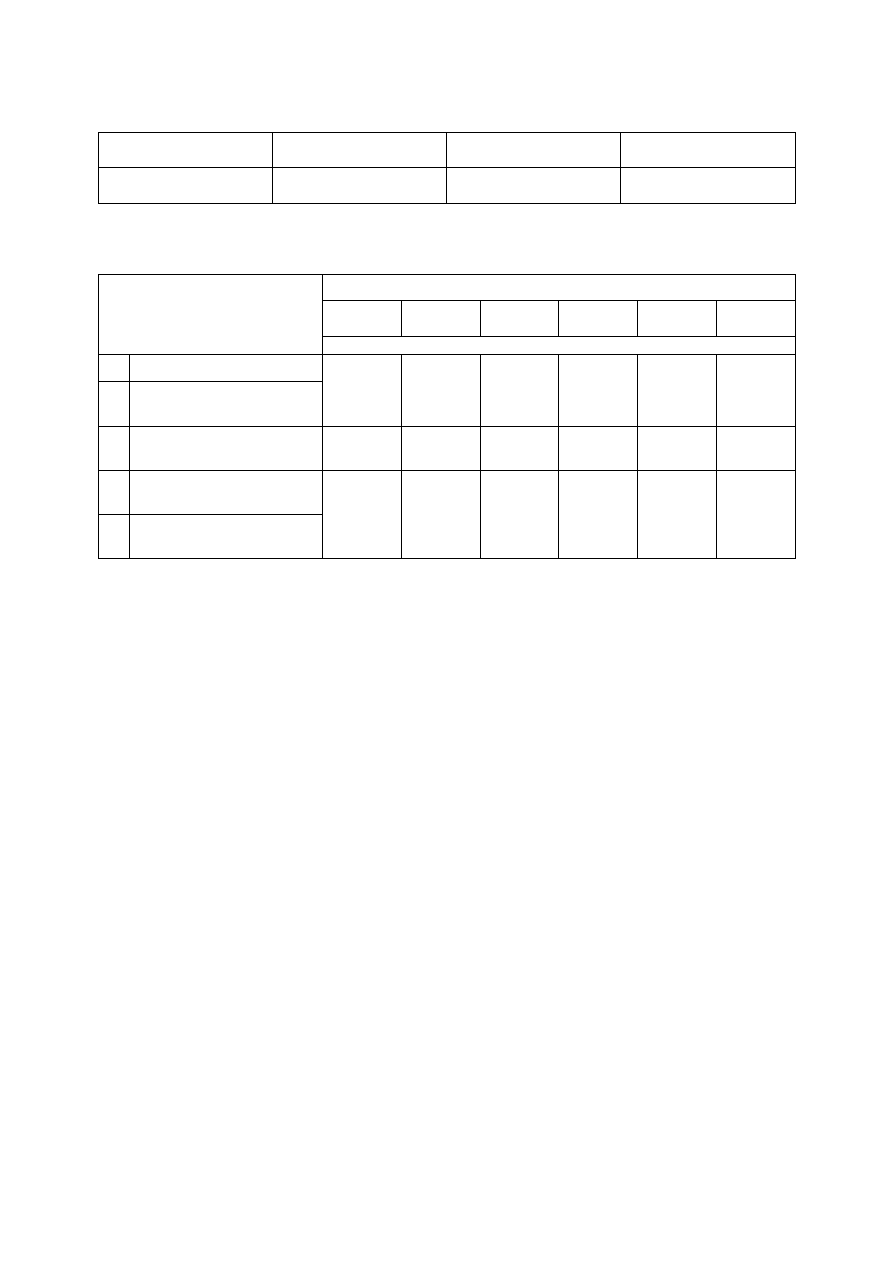
Zadania z analizy jakościowej oceniane są następująco:
Pierwsze oddanie
sprawozdania z zadania
Oddanie sprawozdania po
1 poprawce
Oddanie sprawozdania po
2 poprawce
Sprawozdanie po 2
poprawce jest błędne
Ocena: 5
Ocena: 4
Ocena: 3
Ocena: nzal
Zadania z analizy ilościowej są oceniane na podstawie błędu oznaczenia:
Ocena
5
4,5
4
3,5
3
nzal
Zadanie
% błędu
6
Oznaczenie NaOH
9
Oznaczanie Cu(II) metodą
jodometryczną
< 2,0 %
2,0 – 3,0
%
3,1 – 4,0
%
4,1 – 5,0
%
5,1 – 6,0
%
> 6,0 %
7
Oznaczanie twardości wody
(suma Ca i Mg)
< 4,0 %
4,1 – 5,0
%
5,1 – 6,0
%
6,1 – 7,0
%
7,1 – 10,0
%
>10,0 %
8
Oznaczanie Ca metodą
manganometryczną
10 Oznaczanie Fe(III) metodą
kolorymetryczną
< 5,0 %
5,0 – 7,5
%
7,6 – 10,0
%
10,1 –
12,5 %
12,6 –
16,0 %
>16,0 %

5
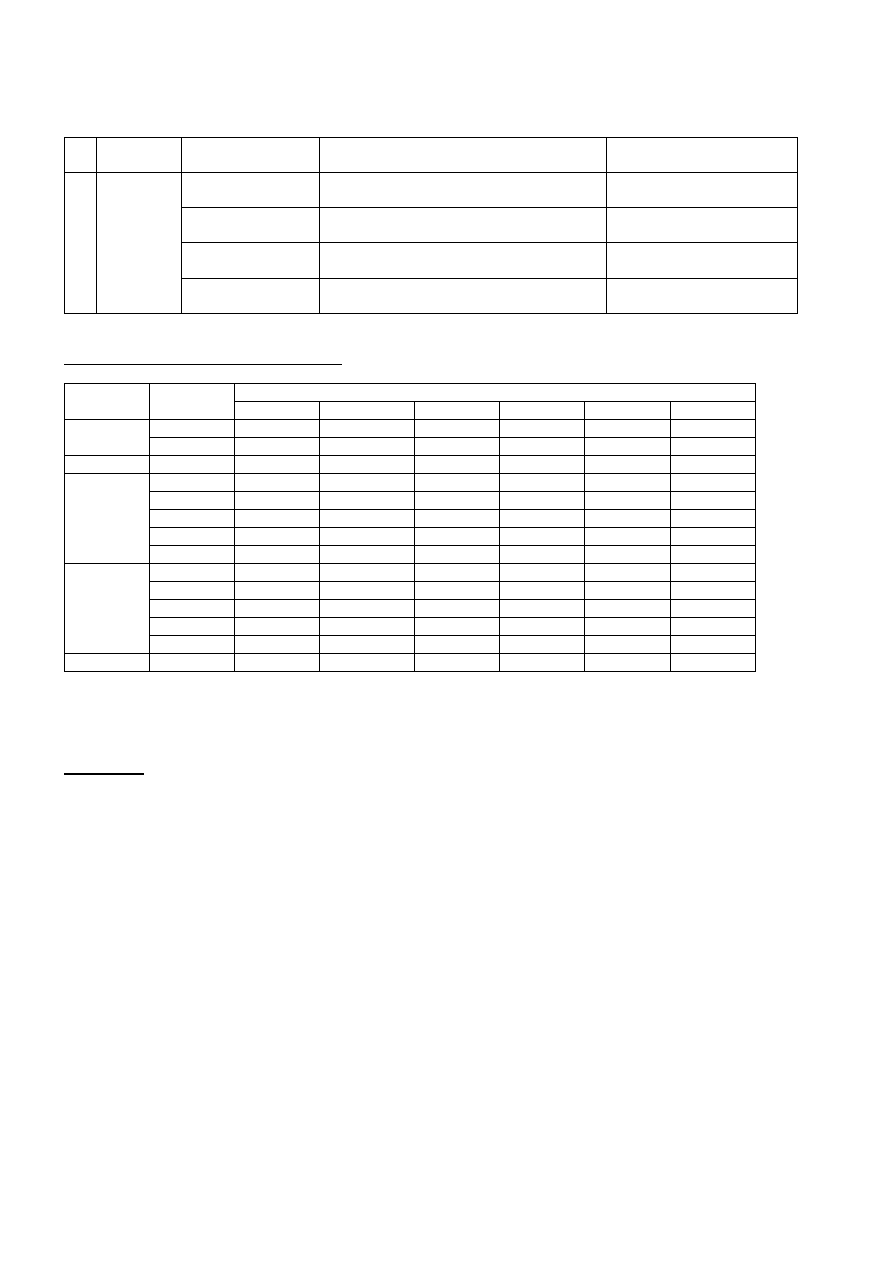
REGULAMIN PRACOWNI CHEMII ANALITYCZNEJ JAKOŚCIOWEJ
NA KIERUNKU TECHNOLOGIA ŻYWNOŚCI i ŻYWIENIE CZŁOWIEKA
1.
Każdy student zobowiązany jest przystąpić do kolokwium przed rozpoczęciem danej pracowni zgodnie z programem
ćwiczeń.
2.
Każdy student zobowiązany jest nosić w pracowni czysty płaszcz laboratoryjny (fartuch) oraz okulary ochronne.
3.
Każdy student zobowiązany jest do zachowania czystości swego miejsca pracy oraz poszanowania sprzętu i mienia
Uczelni.
4.
Na każdych ćwiczeniach wyznacza się dwóch dyżurnych, którzy są zobowiązani do:
a. dopilnowania studentów w grupie aby zostawili porządek na swoich miejscach pracy
b. uporządkowania całej sali po ćwiczeniach
c. sprawdzenie zamknięcia kurków od wody i gazu,
d. dyżurni po zakończeniu ćwiczeń i wypełnieniu regulaminowych obowiązków zgłaszają się do dyżurującego
asystenta, powiadamiając o wykonaniu zadania.
5.
Podczas ćwiczeń zabrania się na sali głośnych rozmów oraz nieuzasadnionego opuszczania miejsca pracy.
6.
Każdy student winien prowadzić bieżące notatki laboratoryjne z wykonywanych analiz.
7.
Każda nieobecność na ćwiczeniach musi być usprawiedliwiona.
8.
W laboratorium należy pracować zgodnie z przepisami bezpieczeństwa i higieny pracy.
PRZEPISY BHP
1. Studenci są odpowiedzialni za zachowanie czystości sali ćwiczeń.
2. Kwasy i alkalia /szczególnie stężone/ należy zlewać do specjalnie na ten cel przeznaczonych naczyń.
3. Do zlewów nie wolno wrzucać ciał stałych /bibuła, sączki, osady, stłuczone szkło itp./.
4. Prace z substancjami lotnymi i łatwopalnymi należy przeprowadzać bardzo ostrożnie i ściśle wg przepisów
wykonywania analiz.
5. W przypadku pożaru w Pracowni należy zastosować odpowiednie środki gaszące (gaśnice), a tylko w niektórych
przypadkach dopuszczalne jest użycie wody.
6. W przypadku doznanych w czasie pracy obrażeń ciała należy zastosować się do instrukcji „Pierwsza pomoc w nagłych
wypadkach”.
7. Wszelkie prace z substancjami wydzielającymi trujące lub żrące pary /cyjanki, brom, stęż. kwas solny, kwas
azotowy(V) lub siarkowy(VI)/ należy wykonać pod wyciągiem.
8. Studentów odrabiających ćwiczenia obowiązuje oszczędność użycia chemikaliów, gazu, elektryczności i wody.
PIERWSZA POMOC W NAGŁYCH WYPADKACH
1. Przy każdym wypadku, nawet najdrobniejszym, należy natychmiast powiadomić nauczyciela prowadzącego zajęcia.
2. Po zaistnieniu poważnego wypadku należy natychmiast zawiadomić Pogotowie Ratunkowe tel. 999, równocześnie
przystępując do udzielenia pierwszej pomocy.
3. Przy oparzeniach termicznych miejsce oparzone schłodzić wodą wodociągową (do ustąpienia uczucia pieczenia), a
następnie nakryć suchym, jałowym opatrunkiem.
4. Przy ranach powstałych od szkła należy usunąć z miejsca zranionego odłamki i założyć suchy, jałowy opatrunek.
5. Przy oparzeniach kwasami i zasadami, miejsce oparzone jak najszybciej zmyć dużą ilością wody, a następnie nakryć
suchym, jałowym opatrunkiem. Procedura nie dotyczy oparzeń stężonym roztworem kwasu siarkowego(VI).
6. Przy oparzeniach stężonym roztworem kwasu siarkowego(VI) należy zetrzeć NA SUCHO kwas, a następnie
postępować jak w przypadku innych kwasów.
7. Przy oparzeniach oczu kwasem lub ługiem natychmiast przemyć oczy roztworem soli fizjologicznej, w razie braku –
dużą ilością wody. W przypadku dostania się do oczu jakiegokolwiek ciała obcego, należy natychmiast przemyć oczy
dużą ilością wody. W obu przypadkach należy zaprowadzić osobę poszkodowaną do lekarza okulisty.
8. Osobę zatrutą gazami trującymi jak np. gaz z sieci miejskiej oraz gazy toksyczne, tj. AsH
3
, NO
2
, CO, H
2
S, SO
2
, NH
3
,
Cl
2
, HCl, Br
2
należy osoby poszkodowane wyprowadzić lub wynieść do innego, dobrze wywietrzonego
pomieszczenia.
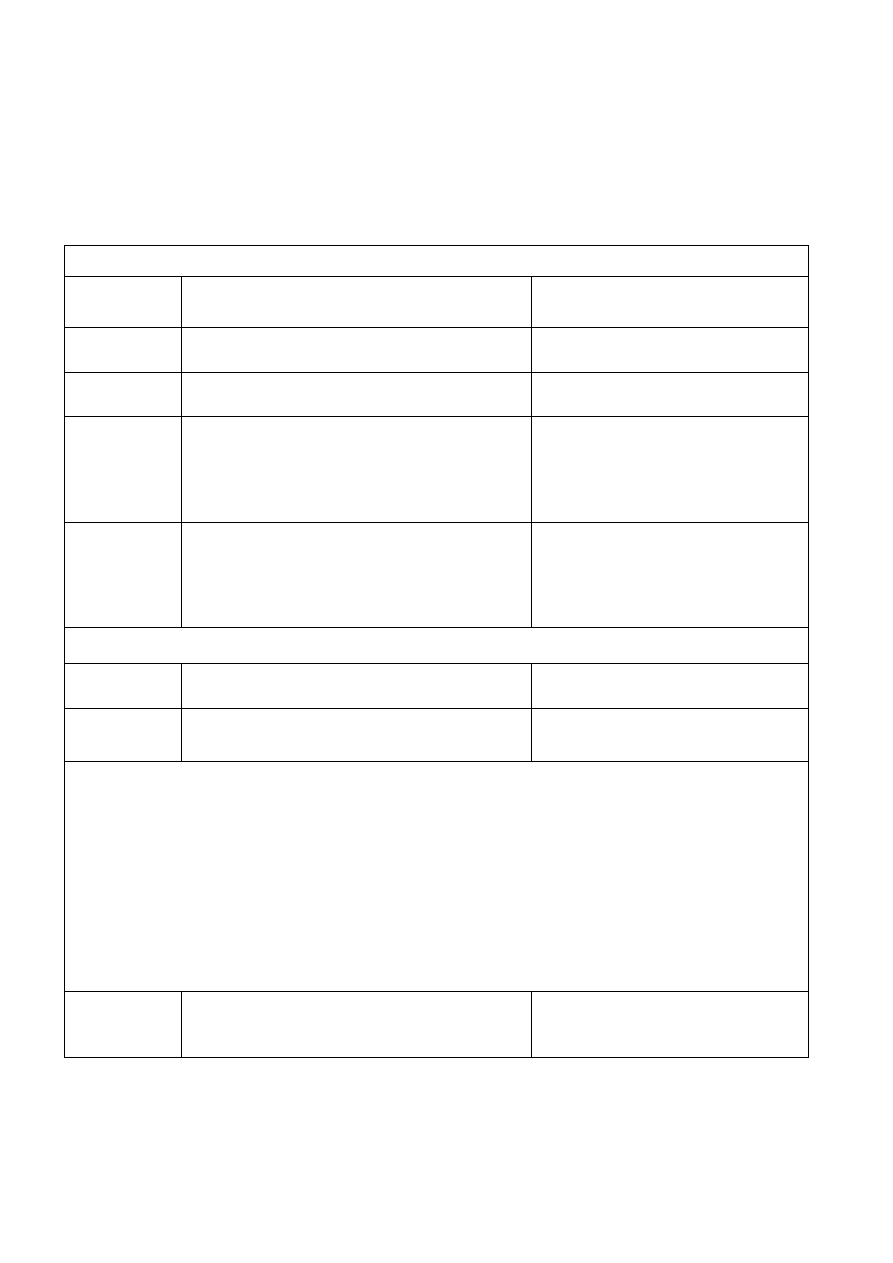
6
PRZYKŁADOWE OPRACOWANIE PROTOKOŁU ANALIZY
Z CHEMII ANALITYCZNEJ JAKOŚCIOWEJ
I.
Analiza pojedyncza kationów
ZADANIE NR ..... Probówka nr 1.
Rodzaj substancji analizowanej: bezbarwny roztwór o odczynie obojętnym
Dodany
odczynnik
Obserwacje i reakcje
Uwagi
HCl
Brak reakcji
Kation nie należy do I grupy analitycznej
KI
Brak reakcji
Wykluczam Cu
2+
, Hg
2+
, Bi
3+
, Fe
3+
NaOH
Bladobrązowy osad nierozpuszczalny w nadmiarze
odczynnika
Wykluczam kationy strącające białe osady
(Cd
2+
, Zn
2+
, Al
3+
, Mn
2+
, Mg
2+
) i osady
amfoteryczne (Zn
2+
, Al
3+
, Cr
3+
)
Prawdopodobnie obecny Fe
3+
NH
3
.
H
2
O
Bladobrązowy osad nierozpuszczalny w nadmiarze
odczynnika
Wykluczam kationy tworzące
aminakompleksy (Co
2+
, Ni
2+
) oraz kationy
grup IV i V
Prawdopodobnie obecny Fe
3+
Na drodze eliminacji prawdopodobnie poszukiwanym kationem jest: Fe
2+
, Fe
3+
NH
4
SCN
Brak reakcji
To na pewno nie jest Fe
3+
K
3
[Fe(CN)
6
]
Brunatny osad
To na pewno nie jest Fe
2+
. Brak kationów
do eliminacji
Na podstawie tabeli rozpuszczalności osadów: brunatny osad z K
3
[Fe(CN)
6
] dają kationy:
1. Pb
2+
- prawdopodobnie nieobecny (nie strąciły się osady z HCl, KI, wytrącił się wodorotlenek bez właściwości
amfoterycznych)
2. Bi
3+
- prawdopodobnie nieobecny (nie strącił się osad z KI)
3. Fe
3+
- prawdopodobnie nieobecny (brak reakcji z NH
4
SCN)
4. Co
2+
- prawdopodobnie nieobecny (wodorotlenek nie rozpuszcza się z wytworzeniem aminakompleksu)
5. Mn
2+
- nie zgadza się barwa strącanego wodorotlenku, potrzebne potwierdzenie (nie)obecności inną reakcją
PbO
2
, st.HNO
3
Różowe zabarwienie roztworu
2Mn
2+
+5PbO
2
+4H
+
→2MnO
4
-
+5Pb
2+
+ H
2
O
Reakcja charakterystyczna Mn
2+
Wykryto kation: Mn
2
+
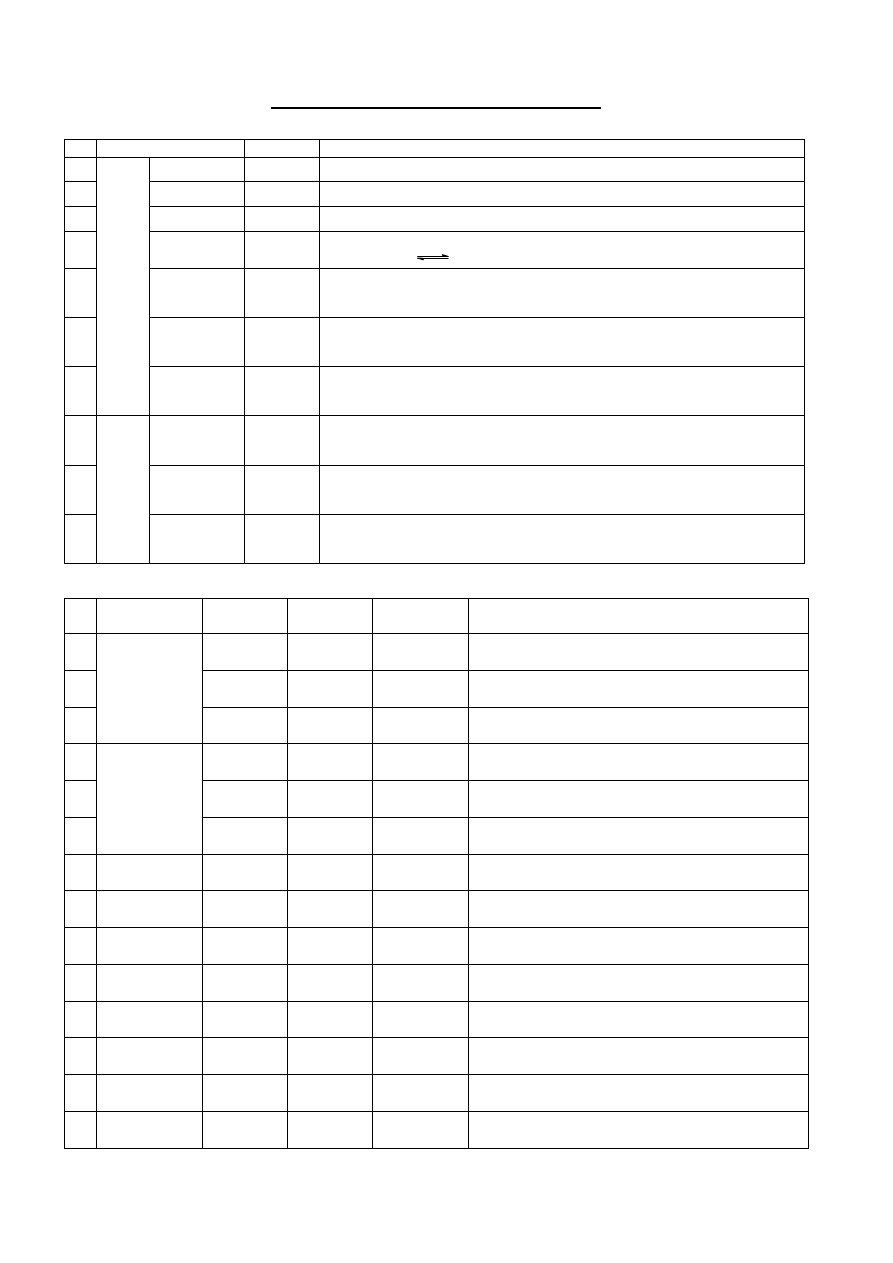
7
Pracownia 2 i 3. Roztwory buforowe
2/3 .1 Ocena odczynu wybranych roztworów elektrolitów przy użyciu papierków wskaźnikowych
Lp.
Roztwór
pH
Odpowiednie równanie reakcji
1
NaCl
2
NaNO
3
3
NH
4
Cl
4
NH
4
NO
3
NH
4
NO
3
+ H
2
O
NH
4
+
+ NO
3
-
NH
4
+
+ 2H
2
O
NH
3
.
H
2
O + H
3
O
+
5
CH
3
COONa
6
Na
2
CO
3
7
1 M
NaHCO
3
8
NaH
2
PO
4
9
Na
2
HPO
4
10
0,5 M
Na
3
PO
4
2/3 .2 Pomiar pH roztworów (porównanie wartości teoretycznej i rzeczywistej)
Lp.
Roztwór
Stężenie
[mol/dm
3
]
pH
(zmierzone)
pH
(obliczone)
Odpowiednie równanie reakcji i wzór do obliczenia
[H
3
O
+
]
1
0,1
2
0,01
3
HCl
0,001
4
0,1
5
0,01
6
NaOH
0,001
7
CH
3
COONH
4
0,1
8
CH
3
COONa
0,1
9
NH
4
Cl
0,1
10 Na
2
CO
3
0,1
11 NaHCO
3
0,1
12 NaH
2
PO
4
0,1
13 Na
2
HPO
4
0,1
14 Na
3
PO
4
0,1
Stałe dysocjacji kwasów i zasad: CH
3
COOH K = 1,8
.
10
-5
;
H
2
CO
3
:
K
1
=
4,3
.
10
-7
; K
2
=
4,4
.
10
-11
;
8
H
3
PO
4
: K
1
=
7,5
.
10
-3
; K
2
=
6,2
.
10
-8
; K
3
=
4,8
.
10
-13
; NH
3
.
H
2
O: K = 1,8
.
10
-5
2/3 .3 Wskaźniki pH-metryczne
Barwa formy
Lp
Wskaźnik
kwaśnej
zasadowej
Obszar pH
0,1-0,5
1,0-1,5
1
Fiolet metylowy
2,0-3,2
2
Oranż metylowy
3,1-4,4
3
Lakmus
4,5-8,3
4
Błękit bromotymolowy
6,0-7,6
5
Fenoloftaleina
8,0-9,8
6
1,3,5-trinitrobenzen
12,0-14,0
2/3 .4 Wyznaczenie stałej i stopnia dysocjacji kwasu octowego i amoniaku
pH
Lp.
Roztwór
Stężenie
[mol/dm
3
]
Stała dysocjacji
Stopień dysocjacji
obliczone
zmierzone
1
CH
3
COOH
0,1
2
CH
3
COOH
0,01
3
CH
3
COOH
0,001
4
NH
3
.
H
2
O
0,1
5
NH
3
.
H
2
O
0,01
6
NH
3
.
H
2
O
0,001
2/3 .5 Roztwory buforowe
pH roztworów
Lp.
Objętość
[cm
3
]
Roztwór
Obliczone
Zmierzone
1
10
0,1 M CH
3
COOH
2
10
0,1 M CH
3
COONa
1
0,1 M CH
3
COOH
3
9
0,1 M CH
3
COONa
5
0,1 M CH
3
COOH
4
5
0,1 M CH
3
COONa
9
0,1 M CH
3
COOH
5
1
0,1 M CH
3
COONa
9
2/3 .6 Stabilizujące pH działanie buforów.
pH
Lp.
Roztwór
(10 cm
3
)
Roztwór dodany
(5 kropli)
Obliczone
Zmierzone
1
woda
0,1 M HCl
2
woda
0,1 M NaOH
3
Bufor 3 (pkt. 2.5)
0,1 M HCl
4
Bufor 3 (pkt. 2.5)
0,1 M NaOH
5
Bufor 4 (pkt. 2.5)
0,1 M HCl
6
Bufor 4 (pkt. 2.5)
0,1 M NaOH
7
Bufor 5 (pkt. 2.5)
0,1 M HCl
8
Bufor 5 (pkt. 2.5)
0,1 M NaOH
Do wyliczeń przyjąć, że 1 kropla roztworu kwasu lub zasady (z pipetki Pasteurowskiej) zajmuje 0,035 cm
3
2/3 .7 Zastosowanie roztworów buforowych w chemii analitycznej.
Lp
Mg
2+
Odczynnik
Objętość
Obserwacje
Równanie reakcji
1
1 M NH
3
.
H
2
O
2 cm
3
2
bufor amonowy
10 cm
3
3
1 M Na
2
CO
3
2 cm
3
4
1 M Na
2
CO
3
+ bufor amonowy
2 cm
3
+ 10 cm
3
5
0,5 M Na
2
HPO
4
2 cm
3
6
2 cm
3
0,5 M Na
2
HPO
4
+ bufor amonowy
2 cm
3
+ 10 cm
3
0,5 molowy roztwór Mg(NO
3
)
2
10
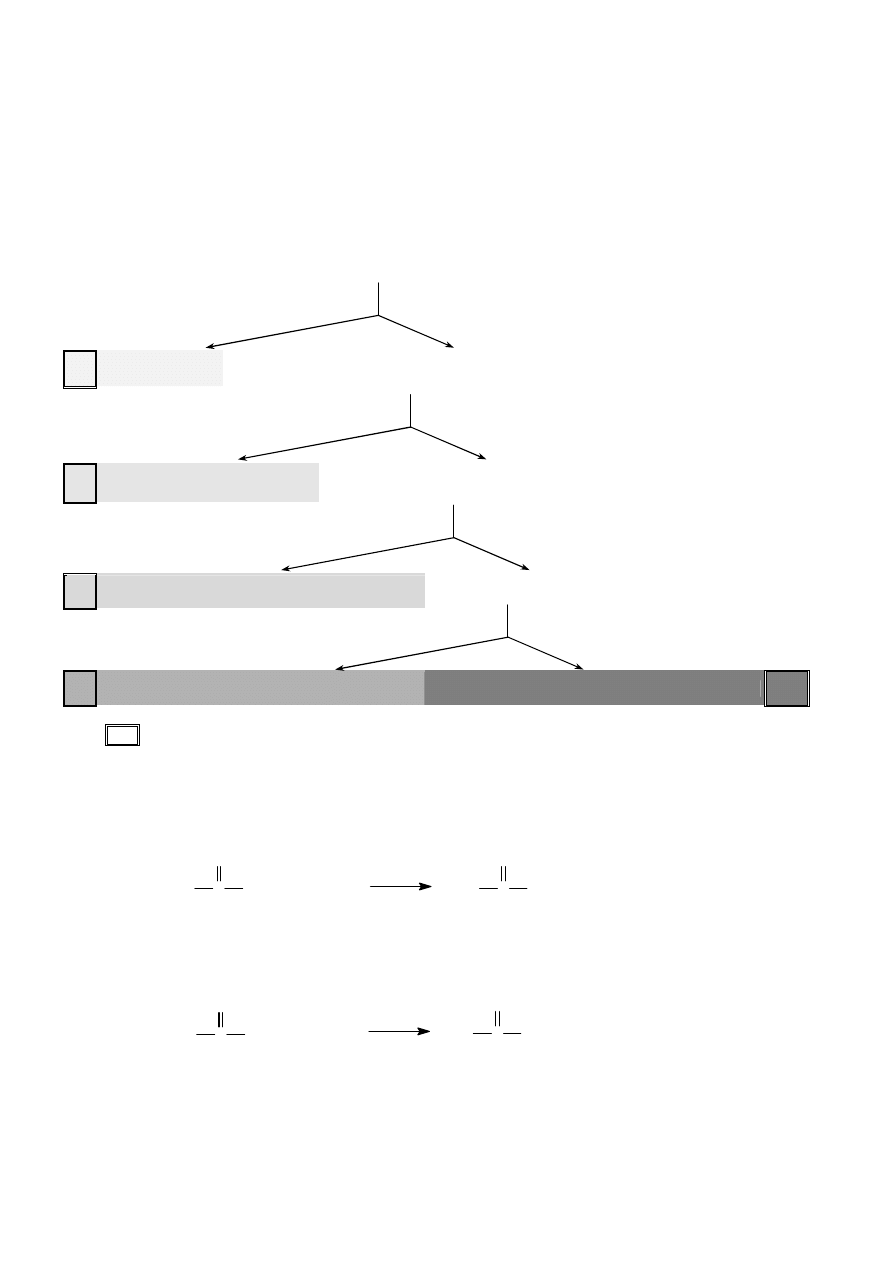
2/3 .8 Podział kationów na grupy analityczne wg Freseniusa
Mieszanina kationów wszystkich grup
NH
4
+
, Na
+
, K
+
, Mg
2+
, Ca
2+
, Ba
2+
, Sr
2+
, Al
3+
, Fe
2+
, Fe
3+
, Mn
2+
, Cr
3+
, Zn
2+
, Ni
2+
, Co
2+
, Cu
2+
, Cd
2+
, Bi
3+
, Ag
+
, Pb
2+
, Hg
2
2+
, Hg
2+
+ HCl
I
AgCl, PbCl
2
,
Hg
2
Cl
2
NH
4
+
, Na
+
, K
+
, Mg
2+
, Ca
2+
, Ba
2+
, Sr
2+
, Al
3+
, Fe
2+
, Fe
3+
, Mn
2+
, Cr
3+
, Zn
2+
, Ni
2+
, Co
2+
, Cu
2+
, Cd
2+
, Bi
3+
,
Hg
2+
, Pb
2+
+ tiomocznik lub AKT lub Na
2
S
(S
2-
w środowisku kwaśnym)
II
CuS, CdS, HgS, PbS, Bi
2
S
3
NH
4
+
, Na
+
, K
+
, Mg
2+
, Ca
2+
, Ba
2+
, Sr
2+
, Al
3+
, Fe
2+
, Fe
3+
, Mn
2+
, Cr
3+
, Zn
2+
, Ni
2+
Co
2+
,
+ amid kwasu tiooctowego (AKT) + bufor amonowy
(S
2-
w środowisku zasadowym)
III Al(OH)
3
, Cr(OH)
3
, FeS, Fe
2
S
3
, MnS, ZnS, NiS, CoS
NH
4
+
, Na
+
, K
+
, Mg
2+
, Ca
2+
, Ba
2+
, Sr
2+
+ (NH
4
)
2
CO
3
+ bufor amonowy
IV
CaCO
3
, BaCO
3
, SrCO
3
NH
4
+
, Na
+
, K
+
, Mg
2+
V
Grupa analityczna
Hydroliza tioacetamidu (amidu kwasu tiooctowego) (AKT):
- w środowisku kwaśnym
NH
3
- w środowisku zasadowym
H
3
C C
S
NH
2
H
3
C C
O
O
-
OH
-
NH
3
H
2
O +
+
+
+ 3
S
2-
H
3
C C
S
NH
2
H
3
C C OH
O
H
2
O
H
2
S
NH
4
+
+
+
+ 2
11
Pracownia 4. Osady - warunki ich wytrącania i rozpuszczania
4.1. Siarczki kationów II i III grupy analitycznej strącane w zależności od wartości pH
Iloczyny rozpuszczalności
II grupa analityczna
III grupa analityczna
CdS
7
.
10
-27
CuS
4
.
10
-35
CoS
8
.
10
-23
FeS
5
.
10
-18
HgS
3
.
10
-52
Bi
2
S
3
1
.
10
-97
MnS
2,5
.
10
-13
NiS
2
.
10
-21
PbS
1
.
10
-28
ZnS
3
.
10
-22
4.2. Wpływ temperatury na strącanie i rozpuszczanie osadów (omówienie na przykładzie PbCl
2
i PbI
2
)
Lp.
Roztwory
Obserwacje
Równanie reakcji
0,5 cm
3
0,05 M Pb(NO
3
)
2
+ 0,5 cm
3
2 M HCl
1
Wyliczenie iloczynu stężeń:
0,5 cm
3
0,05 M Pb(NO
3
)
2
+ 0,5 cm
3
2 M KI
2
Wyliczenie iloczynu stężeń:
Obserwacje
Ogrzewanie roztworów
Schłodzenie uprzednio ogrzanego roztworu
4.3. Wpływ pH na wytrącanie i rozpuszczanie osadów – amfoteryczność
Obserwacje
Pb
2+
+ Cl
-
PbCl
2
+ OH
-
PbCl
2
+ OH
-
........................................... + OH
-
.......................................... + OH
-
........................................

12
4.4 Frakcjonowane strącanie
Odczynniki
Obserwacje
1
0,1 M AgNO
3
2 cm
3
+ 0,1 M HCl 2 cm
3
2
0,1 M AgNO
3
2 cm
3
+ 0,1 M KI 2 cm
3
3
0,1 M AgNO
3
2 cm
3
+ 0,05 M K
2
CrO
4
2 cm
3
4
0,1 M HCl 2 cm
3
+ 0,1 M KI 2 cm
3
+ woda 5 cm
3
dokładnie wymieszać
+ 0,1 M AgNO
3
– dodawać
kroplami, nie mieszać
5
0,1 M HCl 2 cm
3
+ 0,05 M K
2
CrO
4
2 cm
3
+ woda 5 cm
3
dokładnie wymieszać
+ 0,1 M AgNO
3
– dodawać
kroplami, nie mieszać
Iloczyny rozpuszczalności:
AgCl
1,56
.
10
-10
AgI
8
.
10
-17
Ag
2
CrO
4
9
.
10
-12
ZADANIE 1. Identyfikacja 3 pojedynczych kationów należących do I lub II grupy analitycznej.
13
Pracownia 5. Procesy utleniania i redukcji
5.1 Własności redukujące wybranych metali
Lp.
Metal
Reagent
(około 2,5 cm
3
)
Obserwacje
Równanie reakcji
1 M HCl
1
Cu
HNO
3 st.
2
Fe
1 M HCl
1 M HCl
1 M CH
3
COOH
3
Zn
1 M NaOH
4
Al
1 M NaOH
5.2 Wpływ pH na właściwości utleniające KMnO
4
(0,05-molowy roztwór, około 2 krople). Przed przystąpieniem do
doświadczenia skorygować pH roztworu za pomocą H
2
SO
4
do uzyskania pH 6 i pH 1.
Lp. Środowisko
reakcji
Reagent
(1 cm
3
)
Obserwacje
Równanie reakcji
1
0,1 M NaCl
2
0,1 M KBr
3
pH 1
0,1 M KI
4
0,1 M NaCl
5
0,1 M KBr
6
pH 6
0,1 M KI
5.4. Wpływ pH na reakcję redoks
Lp.
Odczynnik
Dodawany
odczynnik (2 cm
3
)
Obserwacje
Równanie reakcji
1
0,5 ml 0,05 M KMnO
4
+ 2 ml 6 M H
2
SO
4
Na
2
SO
3
2
0,5 ml 0,05 M KMnO
4
+ 2 ml H
2
O
Na
2
SO
3
3
0,5 ml 0,05 M KMnO
4
+ 2 ml 6 M NaOH
Na
2
SO
3
ZADANIE 2. Identyfikacja 3 pojedynczych kationów należących do III grupy analitycznej
14
Pracownia 6.
Związki kompleksowe
6.1 Akwakompleksy
Lp.
Odczynnik
Barwa
Odczynnik
Barwa
Odczynnik
Barwa
Sole bezwodne
Roztwór soli bezwodnych
Sole uwodnione
1
CuSO
4
CuSO
4
CuSO
4
.
5H
2
O
2
CoSO
4
CoSO
4
CoSO
4
.
7H
2
O
3
NiSO
4
NiSO
4
NiSO
4
.
7H
2
O
6.2 Aminakompleksy
Lp. Odczynnik
(1 cm
3
)
Reagenty
dodawane kolejno
Obserwacje
Równanie reakcji
1
2 M NH
3
.
H
2
O
2
6 M NH
3
.
H
2
O
1 0,5 molowy
Zn(NO
3
)
2
3
6 M HNO
3
1
2 M NH
3
.
H
2
O
2
6 M NH
3
.
H
2
O
2 0,5 M
Ni(NO
3
)
2
3A
0,05 M edta
1
2 M NH
3
.
H
2
O
2
6 M NH
3
.
H
2
O
3 0,5 M
Co(NO
3
)
2
3A
0,05 M edta
1
2 M NH
3
.
H
2
O
2
6 M NH
3
.
H
2
O
4 0,5 M
Cu(NO
3
)
2
3A
0,05 M edta
1
dodawać aż do uzyskania słaboalkalicznego odczynu roztworu,
2
dodawać stale mieszając bagietką do zaniku zmian
3
początkowo do uzyskania odczynu obojętnego i następnie do uzyskania rozpuszczenia osadów
3A
do zaniku zmian
6.3 Porównanie trwałości kompleksów
Lp. Odczynnik
(1 cm
3
)
Reagenty
dodawane kolejno
Obserwacje
Równanie reakcji
1
NH
4
SCN
2
Na
2
F
2
nadmiar
1 0,5 M
Fe(NO
3
)
3
3
0,05 M edta
1
NH
4
SCN
2
alkohol
izoamylowy
3
HCl stęż.
2 0,5 M
Co(NO
3
)
2
4
0,05 M edta
1
KI nadmiar
3 0,5 M
Bi(NO
3
)
3
2
0,05 M edta
15
6.4 Równowagi reakcji kompleksowania
Lp. Odczynnik
(1 cm
3
)
Reagenty dodawane
kolejno
Obserwacje
Równanie reakcji
1
HCl stęż.
2
H
2
O
do zaniku zmian
3
ogrzanie
1 0,5 M
Co(NO
3
)
2
4
ochłodzenie
Tablica: Stałe trwałości kompleksów metali
Logarytmy stałych trwałości
Ligand
Jon
metalu
log β
1
log β
2
log β
3
log β
4
log β
5
log β
6
Fe
3+
2,3
4,2
5,6
6,4
6,4
4,0
SCN
-
Co
2+
3,0
3,0
2,3
2,0
F
-
Fe
3+
5,2
9,2
11,9
Fe
3+
25,1
Co
2+
16,3
Bi
3+
26
Ni
2+
18,69
edta
Cu
2+
18,89
Zn
2+
2,3
4,6
7,0
9,1
Ni
2+
2,8
5,0
6,6
7,8
8,5
8,5
Co
2+
2,1
3,6
4,6
5,3
5,4
4,8
Co
3+
7,3
14,0
20,1
25,7
30,8
35,2
NH
3
Cu
2+
4,1
7,6
10,5
12,6
I
-
Bi
3+
15,0
16,8
18,8
Źródło:
Galus Z., Ćwiczenia rachunkowe z chemii analitycznej. PWN. Warszawa, 2005.
Mizerski W., Małe tablice chemiczne. Adamantan. Warszawa, 2002.
ZADANIE 3. Identyfikacja 3 pojedynczych kationów należących do IV lub V grupy analitycznej
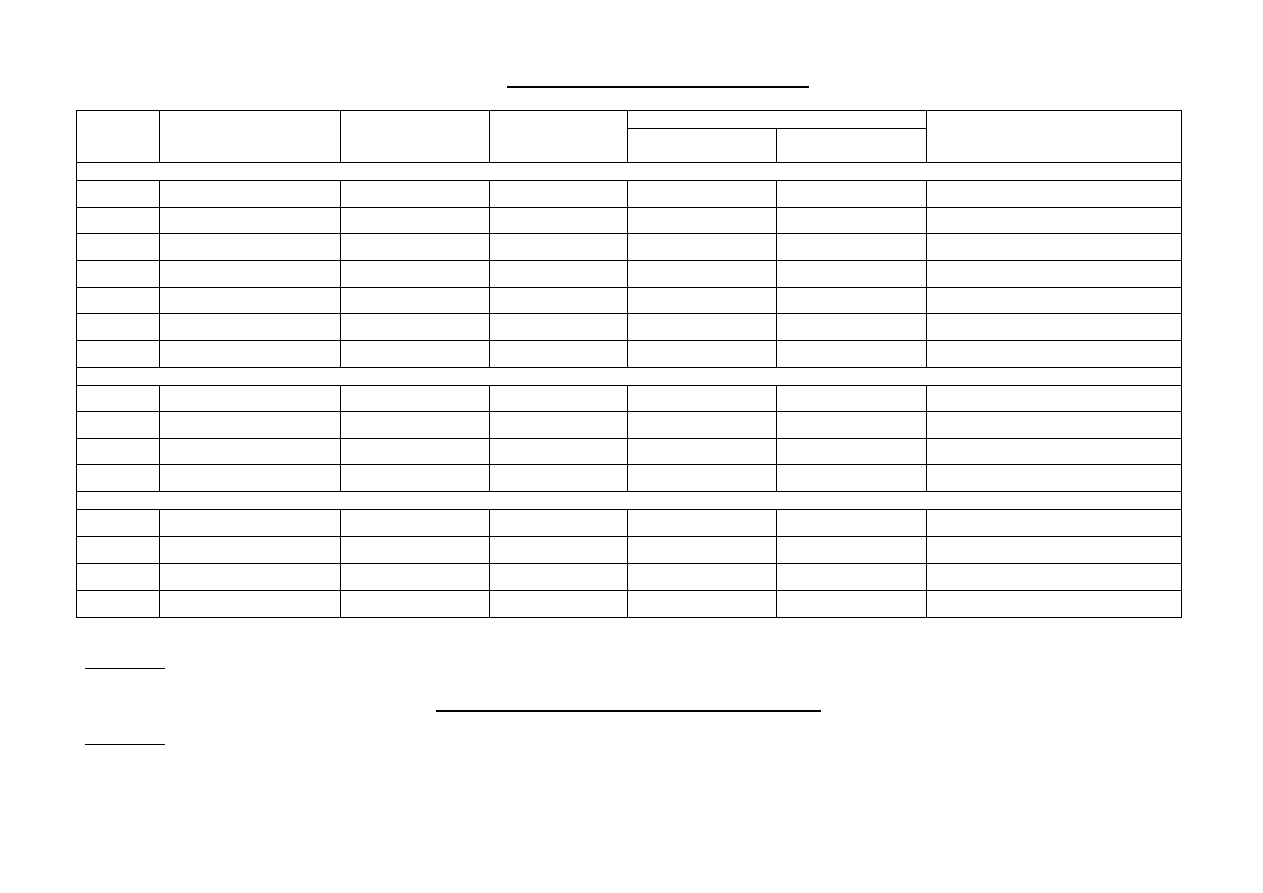
16
Pracownia 7. Analiza anionów
Wytrącanie osadów
Anion
Wydzielanie gazu
w obecności H
2
SO
4 (rozc.)
Odbarwienia
roztworu
KMnO
4
(rozc H
2
SO
4
)
Utlenianie KI w
obecności skrobi
(rozc H
2
SO
4
)
BaCl
2
AgNO
3
Reakcje charakterystyczne
I grupa anionów wg Aleksiejewa
C
2
O
4
2-
CO
3
2-
CrO
4
2-
PO
4
3-
S
2
O
3
2-
SO
3
2-
SO
4
2-
II grupa anionów wg Aleksiejewa
Br
-
Cl
-
I
-
SCN
-
III grupa anionów wg Aleksiejewa
CH
3
COO
-
MnO
4
-
NO
2
-
NO
3
-
Do analizy soli rozpuszczalnych w kwasach: BaCl
2
(w 2 M HCl), AgNO
3
(w 2M HNO
3
)
ZADANIE 4. Identyfikacja 3 pojedynczych anionów
Pracownia 8.
Analiza substancji stałych.
ZADANIE 5. Analiza soli i tlenku.
a) Analiza soli rozpuszczalnej w wodzie. W skład analizowanej soli mogą wchodzić poznane kationy i aniony;
b) Analiza tlenku. W skład analizowanej próbki mogą wchodzić: Al
2
O
3
, CaO, CdO, CuO, MgO, NiO, PbO, SrO lub ZnO

17
IDENTYFIKACJA SOLI
1. Obserwacja próbki
Identyfikacja pojedynczej soli polega na wykryciu kationu i anionu, wchodzących w jej skład. Analizę rozpoczyna
się od określenia barwy, zapachu oraz zachowania się soli podczas ogrzewania. Do wstępnych badań należy także
próba barwienia płomienia palnika gazowego przez badaną sól, wprowadzoną do płomienia na druciku platynowym.
Pierwiastki alkaliczne i ziem alkalicznych barwią płomień na charakterystyczny kolor, co ułatwia ich późniejszą
identyfikację. Na podstawie zebranych obserwacji można zawęzić analizę do kilku lub jednego kationu.
2. Rozpuszczenie soli w wodzie
Analizę soli przeprowadza się przede wszystkim na drodze mokrej, należy rozpuścić badaną sól. W tym celu
dobiera się odpowiedni rozpuszczalnik pamiętając o tym, że rozpuszczalnik należy dodać w kilkukrotnym nadmiarze w
stosunku do objętości osadu.
Na wstępie należy sprawdzić rozpuszczalność w wodzie (na zimno i po ogrzaniu do wrzenia). Do probówki
zawierającej niewielką ilość soli (ok. 0,5 g) dodaje się 15 cm
3
wody destylowanej, wytrząsa i w razie potrzeby
ogrzewa. Uzyskane zabarwienie roztworu może sugerować obecność barwnych jonów, np. chromu(III). Następnie
należy zbadać papierkiem uniwersalnym odczyn roztworu. Uzyskany odczyn zasadowy wskazuje na obecność soli
pochodzącej od mocnej zasady, kwaśny – od mocnego kwasu, obojętny – od mocnej zasady i mocnego kwasu lub
słabej zasady i słabego kwasu.
3. Rozpuszczenie soli nierozpuszczalnej w wodzie
Jeżeli sól nie rozpuszcza się w wodzie, należy sprawdzić jej rozpuszczalność w kwasach: HCl i HNO
3
(rozcieńczonych i/lub stężonych, na zimno i po podgrzaniu). Niekiedy warto równolegle rozpuścić część osadu w
jednym i w drugim kwasie, porównując otrzymane roztwory. Rozpuszczanie w kwasie solnym (stężonym) może
prowadzić do utworzenia rozpuszczalnych chlorokompleksów, natomiast kwas azotowy(V) może wchodzić w reakcje
redoks ze składnikami osadu. Niektóre reakcje (np. wydzielanie się gazów pochodzących z anionów lotnych) zachodzą
równocześnie z rozpuszczaniem osadów, należy zatem bardzo uważnie obserwować proces rozpuszczania. Jeżeli sól
rozpuszcza się zarówno w HCl oraz w HNO
3
korzystniej jest stosować kwas azotowy(V), ponieważ azotany są mniej
lotne od chlorków. Po rozpuszczeniu soli w kwasach usuwa się nadmiar użytego kwasu przez odparowanie roztworu do
małej objętości. Roztwór po odparowaniu kwasu rozcieńcza się wodą destylowaną.
W sytuacji, gdy osad nie rozpuszcza się w wymienionych kwasach, można zastosować ich mieszaninę – wodę
królewską (HNO
3
i HCl w stosunku 1 : 3) lub odczynniki tworzące trwałe rozpuszczalne kompleksy w kationami, np.
roztwór amoniaku (m.in. rozpuszcza AgCl), jodków itp. oraz roztwory mocnych zasad przy rozpuszczaniu soli
kationów tworzących amfoteryczne wodorotlenki. Niektóre osady nierozpuszczalne w kwasach można przeprowadzić
do roztworu za pomocą mocnych zasad. Sole nierozpuszczalne w wodzie i kwasach (np.BaSO
4
) można poddać
stapianiu się z nadmiarem sody (węglanu sodu) na drodze suchej. Otrzymuje się wówczas związki nierozpuszczalne w
wodzie, lecz rozpuszczalne w rozcieńczonych kwasach.
Biorąc pod uwagę wnioski wynikające z prób wstępnych, przeprowadza się w otrzymanym roztworze analizę
anionów i kationów.
4. Analiza anionów (próby wstępne i reakcje charakterystyczne)
a. Próba na wydzielanie gazów
Do oddzielnej porcji roztworu (lub soli w postaci stałej) dodaje się kwasu solnego (lub rozc. H
2
SO
4
) i lekko wstrząsa
zawartość probówki. Wydzielanie się pęcherzyków gazu wskazuje na obecność lotnych anionów. Niekiedy o obecności
gazu świadczy wydzielający się charakterystyczny zapach lub zabarwienie przestrzeni nad roztworem (brak
‘bąbelków”).
b. Reakcja grupowa z KMnO
4
– wykrywanie reduktorów
Ok. 1 cm
3
roztworu badanej soli zakwasza się kilkoma kroplami rozc. H
2
SO
4
i dodaje 1-2 krople rozcieńczonego
roztworu KMnO
4
. Jeżeli na zimno nie następuje odbarwienie, roztwór ogrzewa się do wrzenia. Odbarwienie roztworu
KMnO
4
jest spowodowane obecnością anionów reduktorów (jeżeli zabarwienie manganianu(VII) potasu utrzymuje się
– jony te są nieobecne). Także niektóre kationy odbarwiają KMnO
4
, np. jony żelaza(II).
c. Reakcja grupowa z roztworem KI – wykrywanie utleniaczy
Ok. 1 cm
3
otrzymanego roztworu soli zakwasza się rozc. H
2
SO
4
, dodaje 1-2 cm
3
roztworu KI i ok. 0,5 cm
3
roztworu
skrobi. Otrzymane niebieskie zabarwienie roztworu świadczy o obecności anionów utleniaczy. Należy pamiętać, że
także niektóre kationy mają właściwości utleniające, potwierdzane w tej reakcji, np. jony żelaza(III). Obecność
anionów utleniaczy można wykryć także w reakcji z difenyloaminą – pojawi się granatowe zabarwienie roztworu.

18
d. Reakcja grupowa z roztworem AgNO
3
Analizowany roztwór zakwasza się rozc. HNO
3
i dodaje nadmiaru AgNO
3
. Wytrąci się osad nierozpuszczalny w
kwasach np. AgCl. Aby sprawdzić tworzenie się osadów jonów srebra rozpuszczalnych w kwasach, należy przed
dodaniem AgNO
3
analizowany roztwór zalkalizować (np. przy strącaniu fosforanu(V) srebra). Należy pamiętać o
dodatku nadmiar jonów Ag
+
, ponieważ niektóre aniony tworzą obok osadów także rozpuszczalne kompleksy z jonami
srebra(I).
e. Reakcja grupowa z roztworem BaCl
2
Analizowany roztwór zakwasza się rozc. HCl i dodaje nadmiaru BaCl
2
. Wytrąci się osad nierozpuszczalny w kwasach
np. BaSO
4
. Aby sprawdzić tworzenie się osadów jonów baru rozpuszczalnych w kwasach, należy przed dodaniem
chlorku baru analizowany roztwór zalkalizować
Wyniki powyższych prób pozwalają na sformułowanie wniosków odnośnie występowania niektórych anionów
w roztworze. Po stwierdzeniu nieobecności niektórych anionów, przystępuje się do wykrywania pozostałych,
wykonując reakcje charakterystyczne, podane przy identyfikacji poszczególnych jonów.
5. Analiza kationów
Po przeprowadzeniu analizy anionów znana jest rozpuszczalność soli i anion wchodzący w jej skład.
Przystępując do analizy kationów należy zapoznać się z tablicą rozpuszczalności soli i wyciągnąć odpowiednie wnioski
odnośnie obecności kationu, np. jeżeli sól rozpuszcza się w wodzie i zawiera anion SO
4
2–
, to próby na obecność jonów
Ba
2+
i Pb
2+
są zbyteczne. Kationy te nie mogą być obecne, ponieważ tworzą z tym anionem trudno rozpuszczalne w
wodzie związki. Obecność anionów Cl
–
, Br
–
lub I
–
w soli łatwo rozpuszczalnej w wodzie wyklucza obecność kationu
Ag
+
.

19
ANALIZA ILOŚCIOWA
Tytuły ćwiczeń laboratoryjnych z zakresu analizy ilościowej:
6.
Alkacymetryczne oznaczenie zawartości NaOH.
7.
Oznaczenie twardości wody (sumy jonów wapnia i magnezu) metodą kompleksometryczną.
8.
Oznaczanie jonów wapnia metodą manganometryczną po oddzieleniu szczawianu wapnia od jonów magnezu.
9.
Oznaczanie jonów miedzi(II) metodą jodometryczną..
10. Oznaczanie jonów żelaza(III) metodą kolorymetryczną.
PRZYKŁADOWE OPRACOWANIE PROTOKOŁU ANALIZY
Z CHEMII ANALITYCZNEJ ILOŚCIOWEJ
ZADANIE 6. Oznaczenie zawartości NaOH
1. Reakcje przebiegające w trakcie analizy
HCl + NaOH → NaCl + H
2
O
2. Wykonanie oznaczenia
a. Oznaczenie miana roztworu HCl
naważki sody Na
2
CO
3
objętość roztworu HCl
m
1
= ……………….. [g]
V
1
= ………. [cm
3
]
m
2
= ……………….. [g]
V
2
= ………. [cm
3
]
m
3
= ……………….. [g]
V
3
= ………. [cm
3
]
Obliczenie stężenia roztworu HCl
3
1
CO
Na
1
1
dm
mol
.........
..........
V
M
2
1000
m
c
3
2
3
2
CO
Na
2
2
dm
mol
.........
..........
V
M
2
1000
m
c
3
2
3
3
2
1
HCl
dm
mol
.
..........
3
c
c
c
c
3
3
CO
Na
3
3
dm
mol
.........
..........
V
M
2
1000
m
c
3
2
b. Wykonanie miareczkowań próbki NaOH
V
a
= ………. [cm
3
]
V
b
= ………. [cm
3
]
3
c
b
a
HCl
cm
.
..........
3
V
V
V
V
V
c
= ………. [cm
3
]
3. Obliczanie wyników – wynik końcowy (podany z dokładnością do czwartego miejsca po przecinku)
]
g
....[
..........
1000
M
W
V
c
m
NaOH
HCl
HCl
NaOH
gdzie
m
NaOH
– masa NaOH w kolbie [g]
c
HCl
– miano (stężenie molowe) roztworu HCl
V
HCl
– objętość roztworu HCl zużyta na zmiareczkowanie próbki [cm
3
]
W – współmierność kolby z pipetą
Literatura
1.
T. Lipiec, Z.S. Szmal, „Chemia analityczna z elementami analizy instrumentalnej.” PZWL,
2.
B. Jankiewicz, I. Lubomirska, A. Korczyński, „Analiza jakościowa”, Wydawnictwo PŁ, 1994.
3.
L. Jones, P. Atkins, „Chemia ogólna. Cząsteczki, materia, reakcje” PWN, Warszawa 2004

20
P
RZYGOTOWANIE ROZTWORÓW MIANOWANYCH
Roztwór kwasu solnego (HCl)
Aby przygotować ok. 0,1 M roztwór kwasu solnego należy pobrać ok. 9 cm
3
stężonego roztworu kwasu solnego
(ok. 35%) o gęstości 1,18 g/cm
3
za pomocą cylindra, przelać do ok. 500 ml wody destylowanej i uzupełnić wodą
destylowaną do 1 dm
3
.
W celu ustalenia miana przygotowanego roztworu kwasu należy przygotować odważkę węglanu sodu taką, aby na
jej zmiareczkowanie zużyć objętość roztworu kwasu solnego odpowiadającą od 60% do 80% pojemności biurety. Po
wyznaczeniu masy odważki z dokładnością do czwartego miejsca po przecinku, odważkę przenosi się ilościowo do
kolby stożkowej, rozpuszcza w ok. 100 cm
3
wody destylowanej i dodaje 1 – 3 krople roztworu wskaźnika, do uzyskania
widocznego zabarwienia roztworu. Miareczkowanie prowadzi się wobec oranżu metylowego do uzyskania barwy
cebulkowej (jest to barwa przejściowa między żółtą a czerwoną). Należy wykonać co najmniej trzy miareczkowania.
Roztwór wersenianu sodu (edta)
Aby przygotować 0,05 M roztwór wersenianu sodu należy przygotować odważkę 18,6050 g dwuwodnego
wersenianu sodu, a następnie przenieść ilościowo do kolby miarowej o pojemności 1 dm
3
i rozpuścić w wodzie
destylowanej. Rozpuszczenie soli może przyspieszyć intensywne mieszanie roztworu oraz niewielki dodatek stałego
NaOH. Po rozpuszczeniu odważki należy uzupełnić roztwór wodą destylowaną do kreski. Tak przygotowany roztwór
edta jest roztworem mianowanym.
Roztwór manganianu(VII) potasu KMnO
4
Aby przygotować ok. 0,02 M roztwór manganianu(VII) potasu należy odważyć ok. 3,2 g tej soli i rozpuścić w
wodzie destylowanej uzupełniając do 1 dm
3
. Aby uzyskać stabilność roztworu należy go pozostawić na okres co
najmniej dwóch tygodni przed użyciem lub gotować w czasie 30 – 60 minut. Niezależnie od wybranej metody roztwór
należy następnie przesączyć przez tygiel z dnem porowatym.
W celu wyznaczenia miana roztworu KMnO
4
należy przygotować odważkę szczawianu sodu taką, aby na jej
zmiareczkowanie zużyć objętość roztworu manganianu(VII) potasu odpowiadającą od 60% do 80% pojemności biurety.
Po wyznaczeniu masy odważki z dokładnością do czwartego miejsca po przecinku, odważkę przenosi się ilościowo do
kolby stożkowej o pojemności 300 cm
3
, a następnie rozpuszcza w ok. 200 cm
3
wody destylowanej, dodaje 10 cm
3
roztworu H
2
SO
4
rozcieńczonego 1 : 4 i ogrzewa do 70°C. Tak przygotowany roztwór miareczkuje się roztworem
KMnO
4
aż do wystąpienia trwałego (utrzymującego się 30 s) różowego zabarwienia. Należy wykonać co najmniej trzy
miareczkowania.
Roztwór tiosiarczanu(VI) sodu Na
2
S
2
O
3
Aby przygotować ok. 0,1 M roztwór tiosiarczanu(VI) sodu należy odważyć ok.. 25 g pięciowodnego tiosiarczanu
sodu, rozpuścić w wodzie destylowanej, dodać ok. 0,1 g węglanu sodu i uzupełnić roztwór do 1 dm
3
. Aby uzyskać
stabilność roztworu należy go pozostawić na okres co najmniej dwóch tygodni przed użyciem.
W celu wyznaczenia miana roztworu Na
2
S
2
O
3
należy przygotować odważkę dichromianu(VI) potasu taką, aby po
dodatku jodku potasu i wydzieleniu jodu na zmiareczkowanie jodu zużyć objętość roztworu tiosiarczanu odpowiadającą
od 60% do 80% pojemności biurety. Po wyznaczeniu masy odważki z dokładnością do czwartego miejsca po
przecinku, odważkę przenosi się ilościowo do kolby stożkowej z doszlifowanym korkiem, dodaje ok. 2 g jodku potasu,
ok. 50 cm
3
wody destylowanej, 20 cm
3
1 M H
2
SO
4
, zakrywa szczelnie korkiem i pozostawia na 15 minut w ciemnym
miejscu. Po tym czasie wydzielony jod miareczkuje się roztworem Na
2
S
2
O
3
, dodając pod koniec miareczkowania (gdy
roztwór ma barwę żółtozieloną) wskaźnika skrobiowego. Koniec miareczkowania następuje, gdy barwa niebieska
zamieni się na zieloną lub bladofioletową. Należy wykonać co najmniej trzy miareczkowania.

21
Oznaczanie NaOH
Otrzymane zadanie rozcieńcza się wodą destylowaną do kreski w kolbie miarowej o objętości 250 cm
3
, dokładnie
mieszając. 25 cm
3
tego roztworu odmierza się pipetą do kolbki stożkowej o pojemności 100 cm
3
, dodaje 2 – 3 krople
oranżu metylowego i miareczkuje mianowanym roztworem kwasu solnego do zmiany barwy z żółtej na cebulkową.
Obliczanie wyników:
1000
M
W
V
c
m
NaOH
HCl
HCl
NaOH
gdzie
m
NaOH
– masa NaOH w kolbie [g]
c
HCl
– stężenie molowe HCl
V
HCl
– objętość roztworu HCl zużyta na zmiareczkowanie próbki [cm
3
]
W – współmierność kolby z pipetą
M
NaOH
– masa molowa NaOH [g/mol]
Oznaczanie jonów wapnia i magnezu metodą kompleksometryczną
(oznaczanie twardości wody)
Otrzymane zadanie rozcieńcza się wodą destylowaną do kreski w kolbie miarowej o pojemności 250 cm
3
,
dokładnie mieszając. 25 cm
3
tego roztworu odmierza się pipetą do kolby stożkowej o pojemności 300 cm
3
, a następnie
dodaje się ok. 3 cm
3
buforu amonowego o pH 10 oraz szczyptę czerni eriochromowej T i miareczkuje roztworem edta
aż do zmiany barwy z różowej na niebieską.
Obliczanie wyników:
10
W
4
V
c
M
T
edta
edta
CaO
c
gdzie
T
c
– twardość całkowita w stopniach niemieckich [°N]
c
edta
– stężenie molowe roztworu edta [mol/dm
3
]
V
edta
– objętość roztworu edta zużyta na zmiareczkowanie próbki [cm
3
]
W – współmierność kolby z pipetą
M
CaO
– masa molowa CaO [g/mol]
10 – przeliczenie masy CaO na stopnie niemieckie
4 – przeliczenie objętości na 1 dm
3
Oznaczanie jonów wapnia metodą manganometryczną
po oddzieleniu szczawianu wapnia od jonów magnezu
Otrzymane zadanie rozcieńcza się wodą destylowaną do kreski w kolbie miarowej o pojemności 250 cm
3
,
dokładnie mieszając. 25 cm
3
tego roztworu odmierza się pipetą do zlewki, dodaje 25 cm
3
wody destylowanej i ogrzewa
do wrzenia. Do gorącego roztworu dodaje się po kropli 50 cm
3
gorącego 4 % roztworu szczawianu amonu, cały czas
mieszając. Po całkowitym wytrąceniu osad ogrzewa się na łaźni wodnej w czasie 15 minut, a następnie pozostawia do
wystudzenia.
Roztwór odsącza się przez ścisły sączek (niebieski), a osad przemywa małymi ilościami zimnej wody
destylowanej. Osad z sączka po rozłożeniu spłukuje się do kolby stożkowej silnym strumieniem wody z tryskawki,
następnie dodaje 50 cm
3
1 M H
2
SO
4
. Roztwór w kolbie po ogrzaniu do temperatury ok. 70°C miareczkuje się
mianowanym roztworem KMnO
4
, aż do pojawienia się nieznikającego w ciągu 10 s różowego zabarwienia.
Obliczanie wyników:
2
5
1000
W
M
V
c
m
Ca
m
m
Ca
gdzie
m
Ca
– masa jonów wapnia w kolbie [g]

22
c
m
– stężenie KMnO
4
[mol/dm
3
]
V
m
– objętość roztworu KMnO
4
zużyta na zmiareczkowanie próbki [cm
3
]
W – współmierność kolby z pipetą
M
Ca
– masa molowa jonów wapnia [g/mol]
5/2 – stosunek wynikający ze stechiometrii
Oznaczanie jonów miedzi(II) metodą jodometryczną
Otrzymane zadanie rozcieńcza się wodą destylowaną do kreski w kolbie miarowej o pojemności 250 cm
3
(200
cm
3
), dokładnie mieszając. Do kolby stożkowej o pojemności 200 cm
3
odmierza się pipetą 25 cm
3
(20 cm
3
) roztworu
zadaniowego, dodaje ok. 10 cm
3
1M H
2
SO
4
, a następnie dodaje się 1,5 ÷ 2,0 g jodku potasu (wartość orientacyjna)
rozpuszczonego w niewielkiej ilości wody. Roztwór NATYCHMIAST miareczkuje się mianowanym roztworem
tiosiarczanu(VI) sodu do uzyskania jasnożółtego zabarwienia. Następnie dodaje się roztworu skrobi i miareczkuje się
do zaniku niebieskiego zabarwienia roztworu. Należy wykonać co najmniej trzy miareczkowania.
Obliczanie wyników:
1
1
1000
W
M
V
c
m
Cu
t
t
Cu
gdzie
m
Cu
– masa jonów miedzi(II) w kolbie [g]
c
t
– stężenie Na
2
S
2
O
3
[mol/dm
3
]
V
t
– objętość roztworu Na
2
S
2
O
3
zużyta na zmiareczkowanie próbki [cm
3
]
W – współmierność kolby z pipetą
M
Cu
– masa molowa jonów miedzi [g/mol]
1/1 – stosunek wynikający ze stechiometrii
Oznaczanie jonów żelaza(III) metodą kolorymetryczną
Otrzymane zadanie rozcieńcza się wodą destylowaną do kreski w kolbie miarowej o pojemności 250 cm
3
,
dokładnie mieszając. 25 cm
3
tego roztworu odmierza się pipetą do kolbki miarowej o pojemności 50 cm
3
, dodaje
10 cm
3
20 % roztworu NH
4
SCN, 1 cm
3
stężonego roztworu kwasu azotowego(V), uzupełnia wodą destylowaną do
kreski i dokładnie miesza. Tak przygotowany roztwór przenosi się do kuwety i mierzy kolorymetrycznie absorbancję
roztworu względem próby zerowej przy długości fali λ = 495 nm.
Próbę zerową wykonuje się w sposób następujący: do kolbki miarowej o pojemności 50 cm
3
wprowadza się
10 cm
3
20% roztworu NH
4
SCN, 1 cm
3
stężonego roztworu kwasu azotowego(V) i uzupełnia wodą destylowaną do
kreski. Równolegle wykonuje się roztwory do krzywej wzorcowej. Do serii kolbek miarowych o pojemności 50 cm
3
odmierza się roztwór wzorcowy jonów żelaza(III) o podanym stężeniu w ilościach: 0,5; 1,0; 1,5; 2,0 i 2,5 cm
3
, dodaje
się 10 cm
3
20 % roztworu NH
4
SCN, 1 cm
3
stężonego roztworu kwasu azotowego(V), uzupełnia wodą destylowaną do
kreski i dokładnie miesza. Roztwory przenosi się do kuwety w kolejności od najmniejszego stężenia do największego i
mierzy absorbancję względem próby zerowej. Następnie na podstawie uzyskanych pomiarów wykreśla się krzywą
wzorcową jako zależność A = f(c), gdzie A – absorbancja próbki, c – stężenie jonów Fe(III) wyrażone w jednostkach
[mg/kolbka]. Z równania krzywej wzorcowej oblicza się stężenie odpowiadające zmierzonej absorbancji roztworu
zadaniowego. Obliczanie wyników:
m
Fe
= a
.
W
gdzie
m
Fe
– masa jonów żelaza(III) w kolbie [mg]
a – masa jonów żelaza(III) odczytana z krzywej wzorcowej
W – współmierność kolby z pipetą

23
Analizowane pierwiastki
w kolejności alfabetycznej nazw
Nazwa pierwiastka
Symbol
Analizowane jony
Azot
N
Kation NH
4
+
,
aniony: NO
3
-
, NO
2
-
Bar
Ba
Kation: Ba
2+
Bizmut
Bi
Kation: Bi
3+
Brom
Br
Anion: Br
-
Chlor
Cl
Anion: Cl
-
Chrom
Cr
Kation: Cr
3+
,
aniony: CrO
4
2-
, Cr
2
O
7
2-
Cynk
Zn
Kation: Zn
2+
Fosfor
P
Anion: PO
4
3-
Glin
Al
Kation: Al
3+
Jod
I
Anion: I
-
Kadm
Cd
Kation: Cd
2+
Kobalt
Co
Kation: Co
2+
Magnez
Mg
Kation: Mg
2+
Mangan
Mn
Kation: Mn
2+
,
anion: MnO
4
-
Miedź
Cu
Kation: Cu
2+
Nikiel
Ni
Kation: Ni
2+
Ołów
Pb
Kation: Pb
2+
Potas
K
Kation: K
+
Rtęć
Hg
Kationy: Hg
2
2+
, Hg
2+
Siarka
S
Aniony: SO
4
2-
, SO
3
2-
, S
2
O
3
2-
, SCN
-
Sód
Na
Kation: Na
+
Srebro
Ag
Kation: Ag
+
Stront
Sr
Kation: Sr
2+
Wapń
Ca
Kation: Ca
2+
Węgiel
C
Aniony: CO
3
2-
, CH
3
COO
-
, C
2
O
4
2-
Żelazo
Fe
Kationy: Fe
2+
, Fe
3+

24
Analizowane pierwiastki
w kolejności alfabetycznej nazw
AZOT – NITROGENIUM – N
Z = 7
M = 14,007 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
3
XV grupa układu okresowego.
Główne stopnie utlenienia: -3, +2, +3, +4, +5.
W warunkach normalnych azot jest bezbarwnym, bezwonnym gazem. W roztworach wodnych występuje na
stopniach utlenienia: -III jako jony amonowe NH
4
+
(kation kompleksowy, powstający w wyniku reakcji protonu z
amoniakiem), a także jony azotanowe(III) oraz azotanowe(V).
Azot wchodzi w skład wielu związków organicznych bezwzględnie istotnych do życia, m.in. białek, kwasów
nukleinowych. Niektóre sole amonowe jak np.: NH
4
Cl i (NH
4
)
2
CO
3
stosuje się do przygotowywania leków
wykrztuśnych oraz wywołujących kwasicę ustroju. Jony te w organizmie przekształcają się w amoniak i następnie w
mocznik. Niektóre azotany(V) znalazły zastosowanie w lecznictwie np. nitrogliceryna – bezpośrednio rozszerza
naczynia krwionośne i jest wykorzystywana w leczeniu choroby wieńcowej.
Wykrywanie jonu amonowego – NH
4
+
Jon amonowy należy do V grupy analitycznej kationów wg Freseniusa. W roztworach wodnych jest bezbarwny.
1. Mocne zasady wydzielają gazowy amoniak
O
H
NH
OH
NH
2
3
4
Identyfikacja amoniaku NH
3
:
bezbarwny gaz o charakterystycznym zapachu,
zwilżony wodą papierek wskaźnikowy umieszczony u wylotu probówki zmienia barwę na niebieską,
umieszczona u wylotu probówki bagietka szklana zwilżona stężonym kwasem solnym wydziela
„białe dymy” z drobniutkich kryształów chlorku amonu.
2. Azotynokobaltan sodu (heksaazotano(III)kobaltan(III) sodu) strąca żółty osad azotynokobaltanu amonu i sodu.
Na
2
]
)
NO
(
Co
[
Na
)
NH
(
]
)
NO
(
Co
[
Na
NH
2
6
2
2
4
6
2
3
4
3. Odczynnik Nesslera (mieszanina tetrajodortęcianu(II) potasu i wodorotlenku potasu) strąca czerwonobrunatny
osad jodku
-okso-
-amidodirtęci(II) (reakcja charakterystyczna)
O
H
3
I
7
I
NH
Hg
Hg
O
OH
4
]
HgI
[
2
NH
2
2
2
4
4
Wykrywanie jonu azotanowego(III) – NO
2
-
Jon azotanowy(III) jest anionem słabego kwasu azotowego(III) HNO
2
. Kwas ten jest nietrwały i w stanie wolnym
rozkłada się na NO, NO
2
i wodę. Jon azotanowy(III) jest bezbarwny i posiada właściwości amfoteryczne redox, tzn.
zarówno utleniające, jak i redukujące.
1. Sole baru nie strącają osadu.
2. Sole srebra strącają biały osad azotanu(III) srebra tylko ze stężonych roztworów.
3. Roztwory kwasów rozkładają wszystkie azotany(III) z wydzieleniem brunatnej mieszaniny gazów tlenku
azotu(II) i tlenku azotu(IV). Jako produkt uboczny zachodzących reakcji może tworzyć się także kwas
azotowy(V).
O
H
NO
NO
HNO
2
H
2
NO
2
2
2
2
2
O
H
NO
2
HNO
HNO
3
2
3
2
2
2
NO
2
O
NO
2
4. Właściwości redukujące – odbarwienie manganianu(VII) potasu w środowisku kwaśnym
O
H
3
NO
5
Mn
2
H
6
NO
5
MnO
2
2
3
2
2
4
5. Właściwości utleniające

25
a. utlenianie jonów jodkowych w środowisku kwaśnym z wytworzeniem jodu (granatowe zabarwienie
w reakcji ze skrobią).
O
H
2
I
NO
2
H
4
I
2
NO
2
2
2
2
b. roztwarzanie cynku w środowisku zasadowym
O
H
NH
ZnO
3
OH
5
Zn
3
NO
2
3
2
2
2
c. reakcja z difenyloaminą – pojawia się granatowe zabarwienie roztworu.
Wykrywanie jonu azotanowego(V) – NO
3
-
Jon azotanowy(V) jest anionem mocnego kwasu azotowego(V). Jon jest bezbarwny i posiada właściwości utleniające.
Wszystkie azotany(V), z wyjątkiem niektórych tlenosoli np. BiONO
3
(azotan(V) bizmutylu) są dobrze rozpuszczalne w
wodzie. Ze względu na podobne zachowanie w reakcjach jonu NO
2
-
należy go usunąć z roztworu przed sprawdzaniem
obecności NO
3
-
:
O
H
2
Cl
N
Cl
NH
NO
2
2
)
staly
(
4
2
1. Sole baru nie strącają osadu.
2. Sole srebra nie strącają osadu.
3. Właściwości utleniające
a. utlenianie jonów jodkowych w środowisku kwaśnym z wytworzeniem jodu (granatowe zabarwienie
w reakcji ze skrobią).
O
H
4
I
3
NO
2
H
8
I
6
NO
2
2
2
3
b. roztwarzanie miedzi w obecności stężonego kwasu siarkowego(VI) z wydzieleniem brunatnej
mieszaniny gazów
O
H
NO
Cu
H
Cu
NO
2
2
3
4
2
3
8
3
2
2
2
NO
2
O
NO
2
c. roztwarzanie cynku w środowisku zasadowym
O
H
2
ZnO
4
NH
OH
7
Zn
4
NO
2
2
2
3
3
d. reakcja obrączkowa – z nasyconym roztworem siarczanu(VI) żelaza(II) w obecności stężonego
roztworu kwasu siarkowego(VI)
O
H
2
NO
Fe
3
H
4
Fe
3
NO
2
3
2
3
4
4
SO
)]
NO
(
Fe
[
NO
FeSO
e. reakcja z difenyloaminą – pojawia się granatowe zabarwienie roztworu.
Ba – BARIUM – BAR
Z = 56
M = 137,33 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
5s
2
p
6
6s
2
II grupa układu okresowego.
Główne stopnie utlenienia: +2.
Bar jest srebrzystobiałym metalem, reaguje z tlenem w warunkach normalnych, gwałtownie rozkłada wodę z
wydzieleniem wodoru. Zarówno metal, jak i jego sole, są trujące. Dawka toksyczna 200 mg, dawka śmiertelna 3,7 g.
Wykrywanie jonu baru – Ba
2+
Jony baru należą do IV grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne i nie ulegają
hydrolizie.
1. Jony węglanowe w środowisku buforu amonowego strącają biały osad węglanu baru, rozpuszczalny w
kwasach z wydzieleniem CO
2
.
3
2
3
2
BaCO
CO
Ba
O
H
CO
Ba
H
2
BaCO
2
2
2
3
2. Jony siarczanowe(VI) wytrącają biały osad siarczanu(VI) baru, nierozpuszczalny w mocnych kwasach.
4
2
4
2
BaSO
SO
Ba

26
3. Jony szczawianowe wytrącają biały osad szczawianu baru, rozpuszczalny w kwasach mineralnych oraz kwasie
octowym.
4
2
2
4
2
2
O
BaC
O
C
Ba
4. Jony chromianowe(VI) i dichromianowe(VI) strącają żółty osad chromianu(VI) baru, rozpuszczalny w
mocnych kwasach, ale nierozpuszczalny w kwasie octowym.
4
2
4
2
BaCrO
CrO
Ba
H
2
BaCrO
2
O
H
O
Cr
Ba
2
4
2
2
7
2
2
5. Jony wodorofosforanowe wytrącają biały osad wodorofosforanu baru, rozpuszczalny w kwasach. W
środowisku silnie zasadowym strąca się biały fosforan baru o podobnej rozpuszczalności.
4
2
4
2
BaHPO
HPO
Ba
2
4
3
3
4
2
)
PO
(
Ba
PO
2
Ba
3
BIZMUT – BISMUTUM – Bi
Z = 83
M = 208,98 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
f
14
5s
2
p
6
d
10
6s
2
p
3
XV grupa układu okresowego.
Główne stopnie utlenienia: +3, +5.
Bizmut jest błyszczącym, srebrzystym metalem o różowym zabarwieniu. Nie reaguje z rozcieńczonymi
kwasami, z wyjątkiem kwasu azotowego(V).
Wykrywanie jonu bizmutu(III) – Bi
3+
Jony bizmutu(III) należą do II grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne i
silnie ulegają hydrolizie.
1. Jony siarczkowe w środowisku kwasu solnego wytrącają czarny siarczek bizmutu, rozpuszczalny w kwasie
azotowym(V) na gorąco.
3
2
2
3
S
Bi
S
3
Bi
2
O
H
4
NO
2
S
3
Bi
2
H
8
NO
2
S
Bi
2
3
3
3
2
2. Mocne zasady wytrącają biały osad wodorotlenku bizmutu(III), nierozpuszczalny w nadmiarze odczynnika.
3
3
)
OH
(
Bi
OH
3
Bi
3. Wodny roztwór amoniaku wytrąca biały osad hydroksysoli bizmutu(III) o zmiennym składzie.
4. Jony jodkowe wytrącają ciemnobrunatny osad jodku bizmutu(III), rozpuszczalny w nadmiarze jonów
jodkowych z wytworzeniem pomarańczowego jonu tetrajodobizmutanowego(III).
3
3
BiI
I
3
Bi
]
BiI
[
I
BiI
4
3
5. Tiomocznik tworzy z jonami bizmutu(III) kompleks o intensywnie żółtym zabarwieniu
3+
Bi
x
S
C
NH
2
NH
2
+
S
C
NH
2
NH
2
x
Bi
3+
6. Właściwości utleniające - utlenianie jonów cynianowych(II) w środowisku zasadowym
O
H
3
SnO
3
Bi
2
SnO
3
)
OH
(
Bi
2
2
2
3
2
2
3
BROM – BROMUM – Br
Z = 35
M = 79,904 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
5
XVII grupa układu okresowego.

27
Główne stopnie utlenienia: -1, +1, +3, +5, +7.
Brom w temperaturze pokojowej jest ciemnobrunatną cieczą, o duszącym zapachu. Słabo rozpuszcza się w
wodzie, silnie parzy skórę i działa niszcząco na tkanki organiczne.
Jony bromkowe działają depresyjnie na czynności ośrodkowego układu nerwowego. Po podaniu większych
dawek bromków metali alkalicznych następuje osłabienie i zwolnienie procesów myślowych, zanik pamięci i ogólne
zmęczenie psychiczne. Jony bromkowe nie wywierają działania nasennego, lecz tylko ułatwiają zasypianie. Związki
bromu stosuje się jako środki uspokajające w przypadku niektórych schorzeń nerwowych.
Wykrywanie jonu bromkowego – Br
-
Jon bromkowy jest anionem mocnego kwasu bromowodorowego HBr. Jon jest bezbarwny i wykazuje właściwości
redukujące.
1. Sole srebra wytrącają żółtawy osad bromku srebra, który na świetle czernieje. Osad nie rozpuszcza się w
kwasie azotowym(V), dość trudno - w roztworze amoniaku, łatwo rozpuszcza się roztworach jonów
tiosiarczanowych lub cyjankowych.
AgBr
Br
Ag
Br
]
)
CN
(
Ag
[
CN
2
AgBr
2
2. Stężony roztwór kwasu siarkowego(VI) wydziela z suchych soli gazowy HBr, a także częściowo utlenia go do
bromu.
HBr
H
Br
2
2
2
4
2
SO
O
H
2
Br
SO
H
HBr
2
3. Właściwości redukujące
a. odbarwianie manganianu(VII) potasu w środowisku kwaśnym na gorąco
O
H
8
Br
5
Mn
2
H
16
Br
10
MnO
2
2
2
2
4
b. redukcja chloru (wody chlorowej)
Cl
2
Br
Cl
Br
2
2
2
4. Reakcja z fuksyną - do roztworu wodnego fuksyny (chlorowodorku rozaniliny) dodaje się rozcieńczonego
kwasu siarkowego(VI) do momentu odbarwienia roztworu. Do probówki zawierającej suchą pozostałość po
odparowaniu badanego roztworu dodać stałego dichromianu(VI) potasu oraz kilka kropli stęż. kwasu
siarkowego(VI). Wylot probówki nakryć bibułą zwilżoną odczynnikiem Schaffa (odbarwionej fuksyny).
Całość ostrożnie ogrzać. Pojawienie się fiołkowej barwy bibuły nad wylotem probówki świadczy o obecności
jonów bromkowych.
Cl – CHLORUM – CHLOR
Z = 17
M = 35,453 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
5
XVII grupa układu okresowego.
Główne stopnie utlenienia: -1, +1, +3, +5, +7.
W warunkach normalnych chlor jest zielonkawo-żółtym gazem o duszącym zapachu, cięższym od powietrza,
dobrze rozpuszczalnym w wodzie. Jest toksyczny, działa silnie podrażniająco na błony śluzowe dróg oddechowych.
Chlorki występują w organizmie ludzkim obok jonów sodu, potasu, wapnia i magnezu. Jony chlorkowe są
ważnym składnikiem plazmy krwi oraz płynów ustrojowych. Kwas solny wchodzi w skład soku żołądkowego, tworząc
kwaśne środowisko dla aktywowania enzymów trawiennych. Chlor i jego związki uwalniające w roztworach wodnych
gazowy pierwiastek, wykorzystuje się jako środki odkażające. Chlor gazowy, będący silnym środkiem utleniającym,
działa odkażająco już w stężeniach 2·10
-4
mol/dm
3
. Chlor stosowany jest do odkażania wody. Do dezynfekcji
pomieszczeń stosuje się często sole kwasu chlorowego(I): chloran(I) sodu NaOCl oraz chloran(I) wapnia Ca(OCl)
2
,
tzw. wapno chlorowane.
Wykrywanie jonu chlorkowego – Cl
-
Jon chlorkowy jest anionem mocnego kwasu solnego (chlorowodorowego) HCl. Jony są bezbarwne i wykazują słabe
właściwości redukujące.
1. Sole srebra wytrącają biały, serowaty osad chlorku srebra, który na świetle zmienia barwę na szarofioletową.
Osad nie rozpuszcza się w kwasach, łatwo rozpuszcza się w roztworze amoniaku, roztworach jonów
tiosiarczanowych lub cyjankowych.

28
AgCl
Cl
Ag
O
H
2
Cl
]
)
NH
(
Ag
[
O
H
NH
2
AgCl
2
2
3
2
3
2. Stężony roztwór kwasu siarkowego(VI) wydziela z suchych soli gazowy HCl
HCl
H
Cl
3. Właściwości redukujące – odbarwianie manganianu(VII) potasu w środowisku kwaśnym na gorąco
O
H
8
Cl
5
Mn
2
H
16
Cl
10
MnO
2
2
2
2
4
CHROM – CHROMIUM – Cr
Z = 24
M = 51,996 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
5
4s
1
VI grupa układu okresowego.
Główne stopnie utlenienia: +3, +6.
Chrom jest twardym, błyszczącym metalem o barwie srebrzystobiałej. Roztwarza się w rozcieńczonych
roztworach kwasów nieutleniających, przed działaniem kwasów utleniających chroni go cienka warstwa tlenku
chromu(III) (pasywacja). W roztworach wodnych występuje na dwóch stopniach utlenienia: jony chromu(III) mają
właściwości amfoteryczne, jony chromianowe(VI) i dichromianowe(VI) – kwasowe. Wszystkie związki chromu są
barwne.
Chrom wzmaga działanie insuliny, stymuluje aktywność enzymów wykorzystywanych w procesie
przyswajania glukozy. Związki chromu(VI) są rakotwórcze. Dawka toksyczna 200 mg.
Wykrywanie jonu chromu(III) - Cr
3+
Jon chromu(III) należy do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych jony mają barwę
zieloną lub fioletową.
1. Jony siarczkowe w środowisku buforu amonowego wytrącają szarofioletowy osad wodorotlenku chromu(III)
na skutek hydrolizy soli
S
H
3
)
OH
(
Cr
2
O
H
6
S
3
Cr
2
2
3
2
2
3
2. Mocne zasady wytrącają szarofioletowy osad wodorotlenku chromu(III) o właściwościach amfoterycznych.
3
3
)
OH
(
Cr
OH
3
Cr
O
H
3
Cr
H
3
)
OH
(
Cr
2
3
3
O
H
2
CrO
OH
)
OH
(
Cr
2
2
3
3. Wodny roztwór amoniaku wytrąca szarofioletowy osad wodorotlenku chromu(III), nierozpuszczalny w
nadmiarze odczynnika.
4
3
2
3
3
NH
3
)
OH
(
Cr
O
H
NH
3
Cr
4. Właściwości redukujące
a. utlenianie w środowisku kwaśnym z wytworzeniem jonów dichromianowych(VI) jonami
nadtlenodisiarczanowymi(VI), manganianowymi(VII) lub chloranowymi(V).
b. utlenianie w środowisku zasadowym z utworzeniem jonów chromianowych(VI) nadtlenkiem wodoru
lub chlorem (wodą chlorową)
O
H
4
CrO
2
OH
2
O
H
3
CrO
2
2
2
4
2
2
2
O
H
4
Cl
6
CrO
2
OH
8
Cl
3
CrO
2
2
2
4
2
2
Wykrywanie jonu chromianowego(VI) CrO
4
2-
i dichromianowego(VI) Cr
2
O
7
2-
Jony chromianowe(VI) o barwie żółtej występują w środowisku zasadowym, pomarańczowe jony dichromianowe(VI) –
w środowisku kwaśnym. Oba jony wykazują właściwości utleniające.
H
2
CrO
2
2
4
O
H
O
Cr
2
2
7
2
1. Sole baru wytrącają żółty osad chromianu(VI) baru, rozpuszczalny w mocnych kwasach, ale nierozpuszczalny
w kwasie octowym.

29
4
2
4
2
BaCrO
CrO
Ba
H
2
BaCrO
2
O
H
O
Cr
Ba
2
4
2
2
7
2
2
2. Sole srebra wytrącają ceglastoczerwony osad chromianu(VI) srebra lub brunatnoczerwony osad
dichromianu(VI) srebra, oba rozpuszczalne w kwasach, nierozpuszczalne w kwasie octowym.
4
2
2
4
CrO
Ag
CrO
Ag
2
7
2
2
2
7
2
O
Cr
Ag
O
Cr
Ag
2
3. Powstawanie kwasu nadchromowego – do analizowanej próbki po zakwaszeniu dodajemy kilka kropli
alkoholu amylowego oraz taką samą ilość nadtlenku wodoru; po wymieszaniu warstwa organiczna (górna)
zabarwia się na niebiesko
O
H
3
CrO
H
2
H
2
O
H
4
O
Cr
2
6
2
2
2
2
7
2
4. Właściwości utleniające
a. utlenianie jonów jodkowych w środowisku kwaśnym z wytworzeniem jodu (granatowe zabarwienie
w reakcji ze skrobią);
O
H
7
I
3
Cr
2
H
14
I
6
O
Cr
2
2
3
2
7
2
b. utlenianie jonów żelaza(II)
O
H
7
Fe
6
Cr
2
H
14
Fe
6
O
Cr
2
3
3
2
2
7
2
Zn – ZINCUM – CYNK
Z = 30
M = 65,39 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
XII grupa układu okresowego.
Główne stopnie utlenienia: +2.
Cynk jest srebrzystobiałym metalem o odcieniu niebieskawym. Energicznie roztwarza się w kwasach
mineralnych. We wszystkich związkach występuje na II stopniu utlenienia.
Jony cynku aktywują liczne enzymy, np. fosfofruktokinazę, uczestniczy w replikacji kwasów nukleinowych,
wytwarzaniu mocznika i transporcie fosforanów. Obok jonów wapnia są konieczne do prawidłowego funkcjonowania
układu nerwowego i mięśniowego.
Wykrywanie jonu cynku – Zn
2+
Jony cynku należą do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne i nie
posiadają właściwości redox.
1. Jony siarczkowe w środowisku buforu amonowego wytrącają biały osad siarczku cynku, rozpuszczalny w
mocnych kwasach z wydzieleniem siarkowodoru.
ZnS
S
Zn
2
2
S
H
Zn
H
2
ZnS
2
2
2. Mocne zasady wytrącają biały osad wodorotlenku cynku o właściwościach amfoterycznych.
2
2
)
OH
(
Zn
OH
2
Zn
O
H
2
Zn
H
2
)
OH
(
Zn
2
2
2
O
H
2
ZnO
OH
2
)
OH
(
Zn
2
2
2
2
3. Wodny roztwór amoniaku wytrąca biały osad wodorotlenku cynku, rozpuszczalny w nadmiarze odczynnika z
wytworzeniem aminakompleksów.
O
H
2
NH
2
)
OH
(
Zn
O
H
NH
2
Zn
2
4
2
2
3
2
O
H
6
OH
2
]
)
NH
(
Zn
[
O
H
NH
6
)
OH
(
Zn
2
2
6
3
2
3
2
4. Jony węglanowe wytrącają biały osad o zmiennym składzie, rozpuszczalny w kwasach.
5. Jony rodanortęcianowe (tetra(tiocyjaniano)rtęcianowe(II)) wytrącają biały osad tetra(tiocyjaniano)rtęcianu(II)
cynku, zmieniającego barwę na niebieską w niewielkiej obecności jonów kobaltu(II) lub miedzi(II). Reakcji
przeszkadza nadmiar jonów kobaltu(II) oraz jony niklu(II), żelaza(II) i żelaza(III).
]
)
SCN
(
Hg
[
Zn
]
)
SCN
(
Hg
[
Zn
4
2
4
2

30
FOSFOR – PHOSPHOROS – P
Z = 15
M = 30,974 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
3
XV grupa układu okresowego.
Główne stopnie utlenienia: -3, +3, +5.
Fosfor jest składnikiem organizmów żywych, zwierzęcych i roślinnych, jest konieczny do przebiegu niemal
wszystkich procesów metabolicznych. Wchodzi w skład kwasów nukleinowych, fosfolipidów, związków
makroergicznych (np. ATP) i kości. W kościach występuje fosforan(V) wapnia. Szczególnie bogata w fosfor jest tkanka
mózgowa oraz nerwowa.
Wykrywanie jonu fosforanowego(V) – PO
4
3-
Jon fosforanowy jest anionem średniej mocy kwasu ortofosforowego(V) H
3
PO
4
. Jon jest bezbarwny i nie wykazuje
właściwości redox. Sole rozpuszczalne w wodzie: ortofosforany(V) litowców oraz diwodorofosforany(V) berylowców.
Pozostałe fosforany(V) są nierozpuszczalne w wodzie.
1. Sole baru wytrącają biały osad wodorofosforanu baru, rozpuszczalny w kwasach. W środowisku silnie
zasadowym strąca się biały fosforan baru o podobnej rozpuszczalności.
4
2
4
2
BaHPO
HPO
Ba
2
4
3
3
4
2
)
PO
(
Ba
PO
2
Ba
3
2. Sole srebra wytrącają żółty osad fosforanu srebra. Osad ten jest rozpuszczalny w kwasie azotowym(V) i
roztworze amoniaku.
4
3
3
4
PO
Ag
PO
Ag
3
3. Jony magnezu w środowisku buforu amonowego wytrącają biały osad fosforanu amonu i magnezu (reakcja
charakterystyczna).
4
4
2
4
3
4
PO
MgNH
Mg
NH
PO
4. Molibdenian amonu w środowisku kwasu azotowego(V) wytrąca żółty osad molibdenianofosforanu amonu
(reakcja charakterystyczna). Obecność reduktorów przeszkadza w wykonaniu reakcji.
O
H
10
]
)
O
Mo
(
P
[
H
)
NH
(
H
24
MoO
12
NH
3
PO
2
6
7
2
4
3
4
2
4
4
3
4
GLIN – ALUMINIUM – Al
Z = 13
M = 26,982 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
1
XIII grupa układu okresowego.
Główne stopnie utlenienia: +3.
Glin jest metalem lekkim, miękkim, białym i reaktywnym. Nie ulega korozji, pokrywając się cienką powłoką
tlenku glinu (pasywacja). Roztwarza się w roztworach nieutleniających kwasów, kwasy utleniające zabezpiecza
powłoka pasywacyjna. We wszystkich związkach występuje na III stopniu utlenienia.
Glin dla większości organizmów żywych jest toksyczny. Jego obecność w organizmie wywołuje stany
chorobowe, takie jak encefalopatie, demencje Alzheimera, stany apatii i niedokrwistość.
Wykrywanie jonów glinu – Al
3+
Jon glinu należy do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych występuje w postaci
bezbarwnego jonu.
1. Jony siarczkowe w środowisku buforu amonowego wytrącają biały osad wodorotlenku glinu na skutek
hydrolizy soli
S
H
3
)
OH
(
Al
2
O
H
6
S
3
Al
2
2
3
2
2
3
2. Mocne zasady wytrącają biały osad wodorotlenku glinu o właściwościach amfoterycznych.
3
3
)
OH
(
Al
OH
3
Al
O
H
3
Al
H
3
)
OH
(
Al
2
3
3
31
O
H
2
AlO
OH
)
OH
(
Al
2
2
3
3. Wodny roztwór amoniaku wytrąca biały osad wodorotlenku glinu, nierozpuszczalny w nadmiarze odczynnika.
4
3
2
3
3
NH
3
)
OH
(
Al
O
H
NH
3
Al
4. Sole słabych kwasów (np. Na
2
CO
3
, KNO
2
) - wytrącają biały osad wodorotlenku glinu na skutek hydrolizy soli.
5. Alizaryna tworzy z wodorotlenkiem glinu trudnorozpuszczalny jaskrawoczerwony związek adsorpcyjny, tzw
lak glinowy
6. Aluminon tworzy z wodorotlenkiem glinu związek adsorpcyjny o barwie czerwonej.
OH
OH
O
O
NH
2
OOC
O
C
NH
2
OOC
COONH
2
OH
HO
ALIZARYNA
ALUMINON
I – IODUM – JOD
Z = 53
M = 126,90 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
5s
2
p
5
XVII grupa układu okresowego.
Główne stopnie utlenienia: -1, +1, +3, +5, +7.
Jod w temperaturze pokojowej występuje jako szare kryształki o metalicznym połysku i charakterystycznym
zapachu, łatwo sublimujące do fioletowych par. Jod jest słabo rozpuszczalny w wodzie, rozpuszcza się w roztworze KI.
Jod jest antyseptykiem a jego działanie oparte jest na wyzwalaniu tlenu (in statu nascendi) w reakcji z wodą
I
2
+ H
2
O → HI + HIO
HIO → HI + ↑O
o
W organizmie ludzkim jod występuje w ilościach od 20-25 mg, połowa tej ilości w tarczycy. Brak jodu w tym organie
powoduje powstawanie wola. Schorzenie to leczy się podawaniem jodków. Jodki powodują także zwiększenie
przenikliwości naczyń włosowatych, a tym samym ułatwiają wchłanianie uszkodzonych tkanek – zastosowanie w
leczeniu gruźlicy kostnej i kiły. Oprócz tych właściwości jodki i jodany obniżają lepkość, a tym samym zmniejszają
ciśnienie krwi. W nadciśnieniu, szczególnie połączonym z miażdżycą stosuje się: jodek sodu i potasu oraz jodan(V)
sodu. Jodki podaje się zwykle doustnie, jodany – podskórnie. Dawka toksyczna jodu cząsteczkowego 2 mg.
Wykrywanie jonu jodkowego – I
-
Jon jodkowy jest anionem mocnego kwasu jodowodorowego HI. Jon jest bezbarwny i posiada właściwości redukujące.
1. Sole srebra wytrącają żółty osad jodku srebra, który na świetle czernieje. Osad nie rozpuszcza się w kwasie
azotowym(V) i roztworze amoniaku, rozpuszcza się roztworach jonów tiosiarczanowych lub cyjankowych.
AgI
I
Ag
I
]
)
CN
(
Ag
[
CN
2
AgI
2
2. Stężony roztwór kwasu siarkowego(VI) wydziela z suchych soli gazowy HI, a także utlenia go do jodu.
HI
H
I
S
H
O
H
4
I
4
SO
H
HI
8
2
2
2
4
2
3. Sole rtęci(II) wytrącają pomarańczowoczerwony osad jodku rtęci(II), rozpuszczalny w nadmiarze jonów
jodkowych.
2
2
HgI
I
2
Hg
2
4
2
]
HgI
[
I
2
HgI
4. Właściwości redukujące – produktem reakcji jest jod, którego obecność można wykryć poprzez reakcję
addycji ze skrobią (granatowe zabarwienie).
a. odbarwianie manganianu(VII) potasu w środowisku kwaśnym
O
H
8
I
5
Mn
2
H
16
I
10
MnO
2
2
2
2
4

32
b. redukcja chloru (wody chlorowej)
Cl
2
I
Cl
I
2
2
2
c. redukcja jonów miedzi(II)
CuI
2
I
Cu
2
I
4
2
2
KADM – CADMIUM – Cd
Z = 48
M = 112,41 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
5s
2
XII grupa układu okresowego.
Główne stopnie utlenienia: +2.
Kadm jest pierwiastkiem wysoko toksycznym i rakotwórczym. W postaci metalicznej jest srebrzystym
metalem, wolno rozpuszcza się w rozcieńczonych mocnych kwasach nieutleniających. We wszystkich swoich
związkach występuje na II stopniu utlenienia. Kadm silnie wpływa na aktywność enzymów, kumuluje się w
organizmie, wywołując uszkodzenia wątroby i nerek, zaburzenia układu krążenia i odwapnienie kości. Dawka
toksyczna 3 – 330 mg.
Wykrywanie jonu kadmu – Cd
2+
Jony kadmu należą do II grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne.
1. Jony siarczkowe w środowisku kwasu solnego wytrącają żółty (kanarkowy) siarczek kadmu, rozpuszczalny w
kwasie azotowym(V) na gorąco oraz stężonym kwasie solnym.
CdS
S
Cd
2
2
O
H
4
NO
2
S
3
Cd
3
H
8
NO
2
CdS
3
2
2
3
S
H
]
CdCl
[
H
2
Cl
4
CdS
2
2
4
2. Mocne zasady wytrącają biały osad wodorotlenku kadmu, nierozpuszczalny w nadmiarze odczynnika.
2
2
)
OH
(
Cd
OH
2
Cd
3. Wodny roztwór amoniaku wytrąca biały osad wodorotlenku kadmu, rozpuszczalny w amoniaku z
wytworzeniem aminakompleksów.
4
2
2
3
2
NH
2
)
OH
(
Cd
O
H
NH
2
Cd
O
H
4
OH
2
]
)
NH
(
Cd
[
O
H
NH
4
)
OH
(
Cd
2
2
4
3
2
3
2
4. Jony jodkowe nie wytrącają osadu.
5. Gliceryna nie tworzy związków kompleksowych.
KOBALT – COBALTUM – Co
Z = 27
M = 58,933 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
7
4s
2
IX grupa układu okresowego.
Główne stopnie utlenienia: +2, +3.
Kobalt jest białoszarym metalem, rozpuszczalnym w kwasach mineralnych. Nie ulega korozji w wilgotnym
powietrzu.
Jony kobaltu są składnikiem witaminy B
12
, biorącej udział w procesie tworzenia erytrocytów oraz aktywuje
niektóre enzymy. Nadmiar kobaltu jest rakotwórczy. Dawka toksyczna 500 mg.
Wykrywanie jonu kobaltu(II) – Co
2+
Jony kobaltu(II) należą do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych mają barwę różową i
posiadają słabe właściwości redukujące. Jony tworzą wiele trwałych kompleksów, a najtrwalsze są kompleksy [CoL
4
]
2-
(najczęściej o barwie niebieskiej) i oktaedryczne [CoL
6
]
4-
(o barwie różowej).
1. Jony siarczkowe w środowisku buforu amonowego wytrącają czarny osad siarczku kobaltu(II), rozpuszczalny
w kwasie azotowym(V) na gorąco, wodzie królewskiej lub kwasie solnym z dodatkiem utleniacza: nadtlenku
wodoru lub jonów chloranowych(V).
CoS
S
Co
2
2

33
O
H
4
S
3
NO
2
Co
3
H
8
NO
2
CoS
3
2
2
3
O
H
2
S
Co
H
2
O
H
CoS
2
2
2
2
2. Mocne zasady wytrącają niebieski osad hydroksysoli kobaltu(II). Przy nadmiarze mocnej zasady i po
podgrzaniu osad przechodzi w różowy wodorotlenek kobaltu(II), nierozpuszczalny w nadmiarze odczynnika.
Na powietrzu wodorotlenek kobaltu(II) powoli szarzeje wskutek utleniania do wodorotlenku kobaltu(III).
CoOHCl
Cl
OH
Co
2
Cl
)
OH
(
Co
OH
CoOHCl
2
3
2
2
2
)
OH
(
Co
4
O
H
2
O
)
OH
(
Co
4
3. Wodny roztwór amoniaku wytrąca niebieski osad hydroksysoli kobaltu(II), rozpuszczalny w nadmiarze
odczynnika z wytworzeniem różowych aminakompleksów.
4
2
3
2
NH
CoOHCl
Cl
O
H
NH
Co
O
H
Cl
OH
NH
Co
O
H
NH
CoOHCl
2
2
6
3
2
3
6
]
)
(
[
6
4. Jony węglanowe wytrącają czerwony osad o zmiennym składzie, rozpuszczalny w kwasach.
5. Jony tiocyjanianowe (rodankowe) tworzą związek kompleksowy, który barwi alkohol amylowy lub aceton na
błękitno. Reakcji przeszkadzają jony żelaza(III).
2
4
2
]
)
SCN
(
Co
[
SCN
4
Co
6. Jony rodanortęcianowe (tetra(tiocyjano)rtęcianowe(II)) wytrącają niebieski osad tetra(tiocyjaniano)rtęcianu(II)
kobaltu(II). Strącanie przyspiesza dodanie soli cynku. Reakcji przeszkadzają jony niklu(II), żelaza(II) i
żelaza(III).
]
)
SCN
(
Hg
[
Co
]
)
SCN
(
Hg
[
Co
4
2
4
2
Mg – MAGNESIUM – MAGNEZ
Z = 12
M = 24,305 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
II grupa układu okresowego.
Główne stopnie utlenienia: +2.
Magnez jest lekkim srebrzystobiałym metalem i silnym reduktorem. Na powietrzu w obecności wilgoci
pokrywa się warstwą tlenku magnezu. Z wodą w temperaturze pokojowej reaguje bardzo słabo, natomiast z parą wodną
w temperaturze 100
o
C reaguje bardzo energicznie. We wszystkich związkach występuje na II stopniu utlenienia.
Magnez jest niezbędny w prawidłowym przebiegu procesów metabolicznych dostarczających energii, jak
również w syntezie białek oraz fosforylacji beztlenowej. Największe ilości magnezu znajdują się w szkielecie i mięśniu
sercowym jak również w wątrobie. Bez uzupełniania niedoboru magnezu niemożliwe staje się m.in. wyrównanie
komórkowego niedoboru potasu, co jest jednym z ważniejszych czynników proarytmicznych.
Wykrywanie jonu magnezu - Mg
2+
Jon magnezu należy do V grupy analitycznej kationów wg Freseniusa. W roztworach wodnych jest bezbarwny.
1. Mocne zasady wytrącają biały bezpostaciowy wodorotlenek magnezu. Osad rozpuszcza się w kwasach i solach
amonowych.
2
2
)
OH
(
Mg
OH
2
Mg
2. Jony fosforanowe(V) strącają w środowisku buforu amonowego biały osad fosforanu amonu i magnezu.
4
4
2
4
3
4
PO
MgNH
Mg
NH
PO
3. Jony węglanowe wytrącają biały osad hydroksywęglanu magnezu, rozpuszczalny w kwasach i solach
amonowych.
2
3
2
2
2
3
2
CO
CO
)
MgOH
(
O
H
CO
2
Mg
2
4. Magnezon z roztworów zalkalizowanych wytrąca niebieski osad
N N
O
2
N
OH
HO
MAGNEZON

34
MANGAN – MANGANUM – Mn
Z = 25
M = 54,938 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
5
4s
2
VII grupa układu okresowego.
Główne stopnie utlenienia: +2, +3, +4, +6, +7.
Mangan jest szarym metalem ciężkim, o wysokiej temperaturze topnienia. Łatwo rozpuszcza się w
rozcieńczonych kwasach nieutleniających, a w wysokich temperaturach w parze wodnej, z wydzieleniem wodoru.
Właściwości chemiczne związków manganu zależą od stopnia utlenienia i są: Mn(II) – zasadowe, Mn(III) – słabo
zasadowe, Mn(IV) – amfoteryczne, Mn(VI) i Mn(VII) – charakter kwasowy. Wszystkie związki manganu są barwne:
sole manganu(II) bezwodne są białe, w roztworze bladoróżowe, manganiany(III) są czerwone, manganiany(VI)
bezwodne są fioletowe, w roztworze zielone, natomiast manganiany(VII) zarówno w stanie stałym jak i w roztworze są
ciemnofioletowe. Największe znaczenie mają związki manganu na II i VII stopniu utlenienia
Mangan pełni funkcję czynnika regulującego procesy oksydacyjno-redukcyjne, jest czynnikiem wzrostowym
dla organizmów żywych, a także niezbędny w przebiegu funkcji rozrodczych. Wpływa na przemiany tłuszczów i
cholesterolu oraz hormonów płciowych, reguluje pracę układu nerwowego, wchodzi w skład niektórych enzymów z
grupy fosfataz oraz reguluje proces odkładania wapnia i fosforu w kościach. Jest to pierwiastek nieodzowny dla
normalnego rozwoju organizmu. Zapotrzebowanie dzienne manganu wynosi 4-5 mg, dawka toksyczna (dla szczurów)
10 – 20 mg.
Manganian(VII) potasu stosowany często jako środek odkażający, działa utleniająco w środowisku kwaśnym,
obojętnym i zasadowym w stężeniach 1:1000 do 1:5000. Zewnętrznie stosowane są roztwory od 0,05 do 0,2%. W
niższych stężeniach może być używany do płukania żołądka przy zatruciach cyjankami, fosforem lub alkaloidami.
Wykrywanie jonu manganu(II) – Mn
2+
Jony manganu(II) należą do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych mają barwę
bladoróżową (widoczną dla roztworów słabo rozcieńczonych) oraz posiadają właściwości redukujące.
1. Jony siarczkowe w środowisku buforu amonowego wytrącają cielisty osad siarczku manganu(II),
rozpuszczalny w kwasach z wydzieleniem siarkowodoru.
MnS
S
Mn
2
2
S
H
Mn
H
2
MnS
2
2
2. Mocne zasady oraz wodny roztwór amoniaku wytrącają biały osad wodorotlenku manganu(II),
nierozpuszczalny w nadmiarze odczynnika, ale rozpuszczalny w solach amonowych. Osad szybko utlenia się
na powietrzu, przechodząc do brunatnego tlenku manganu(IV)
2
2
)
OH
(
Mn
OH
2
Mn
4
2
2
3
2
NH
2
)
OH
(
Mn
O
H
NH
2
Mn
O
H
2
MnO
2
O
)
OH
(
Mn
2
2
2
2
2
3. Jony węglanowe wytrącają biały osad węglanu manganu(II), rozpuszczalny w kwasach.
3
2
3
2
MnCO
CO
Mn
4. Właściwości redukujące
a. reakcja Crumma (reakcja charakterystyczna)
O
H
2
Pb
5
MnO
2
H
4
PbO
5
Mn
2
2
2
4
2
2
b. odbarwienie manganianu(VII) potasu
O
H
2
MnO
5
OH
4
MnO
2
Mn
3
2
2
4
2
Wykrywanie jonu manganianowego(VII) – MnO
4
-
Jon manganianowy(VII) jest anionem mocnego, nietrwałego kwasu manganowego(VII) HMnO
4
. Jon ma barwę
fioletową (w roztworach bardzo rozcieńczonych różową) i wykazuje silne właściwości utleniające.
1. Sole baru nie strącają osadu.
2. Sole srebra nie strącają osadu.
3. Właściwości utleniające
a. utlenianie jonów jodkowych w środowisku kwaśnym z wytworzeniem jodu (granatowe zabarwienie
w reakcji ze skrobią).
O
H
8
I
5
Mn
2
H
16
I
10
MnO
2
2
2
2
4

35
b. utlenianie jonów żelaza(II)
O
H
4
Mn
Fe
5
H
8
MnO
Fe
5
2
2
3
4
2
Cu – CUPRUM – MIEDŹ
Z = 29
M = 63,546 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
1
XI grupa układu okresowego.
Główne stopnie utlenienia: +1, +2.
Miedź jest miękkim, czerwonawym metalem, bardzo dobrym przewodnikiem ciepła i elektryczności. Pod
wpływem wilgotnego powietrza pokrywa się zielonkawą powłoką hydroksywęglanu miedzi(II) lub
hydroksysiarczanu(VI) miedzi(II). Nie rozpuszcza się w kwasach nieutleniających, a jedynie w roztworach kwasu
azotowego(V) i stężonym roztworze kwasu siarkowego(VI).
Jony miedzi(II) są składnikiem niektórych enzymów, np. oksydazy cytochromowej, uczestniczą w biosyntezie
hemu i melaniny. Dawka toksyczna > 250 mg.
Wykrywanie jonu miedzi(II) – Cu
2+
Jony miedzi(II) należą do II grupy analitycznej kationów wg Freseniusa. W roztworach wodnych mają barwę niebieską.
1. Jony siarczkowe w środowisku kwasu solnego wytrącają czarny siarczek miedzi(II), rozpuszczalny w kwasie
azotowym(V) na gorąco.
CuS
S
Cu
2
2
O
H
4
NO
2
S
3
Cu
3
H
8
NO
2
CuS
3
2
2
3
2. Mocne zasady wytrącają błękitny osad wodorotlenku miedzi(II), nierozpuszczalny w nadmiarze odczynnika.
2
2
)
OH
(
Cu
OH
2
Cu
3. Wodny roztwór amoniaku wytrąca zielony osad hydroksysoli miedzi(II), rozpuszczalny w amoniaku z
wytworzeniem intensywnie niebieskich aminakompleksów.
4
4
2
2
3
2
4
2
NH
2
SO
)
CuOH
(
O
H
NH
2
SO
Cu
2
O
H
8
OH
2
SO
]
)
NH
(
Cu
[
2
O
H
NH
8
SO
)
CuOH
(
2
2
4
2
4
3
2
3
4
2
4. Jony jodkowe wytrącają biały osad jodku miedzi(I) z wydzieleniem jodu (granatowe zabarwienie w reakcji ze
skrobią).
CuI
2
I
Cu
2
I
4
2
2
5. Jony heksacyjanożelazianowe(II) wytrącają czerwonobrunatny osad heksacyjanożelazianu(II) miedzi(II).
]
)
CN
(
Fe
[
Cu
]
)
CN
(
Fe
[
Cu
2
6
2
4
6
2
6. Gliceryna tworzy trwałe niebieskie związki kompleksowe, niereagujące z mocnymi zasadami.
7. Właściwości utleniające
a. utlenianie jonów jodkowych z wytworzeniem jodu (granatowe zabarwienie w reakcji ze skrobią)
CuI
2
I
Cu
2
I
4
2
2
b. utlenianie metalicznego glinu
3
2
Al
2
Cu
3
Al
2
Cu
3
Ni – NICCOLUM – NIKIEL
Z = 28
M = 58,693 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
8
4s
2
X grupa układu okresowego.
Główne stopnie utlenienia: +2, +3.
Nikiel jest metalem srebrzystobiałym, o właściwościach podobnych do kobaltu. Nadmiar niklu może być
rakotwórczy. Metal ma najsilniejsze właściwości alergizujące wśród metali. Dawka toksyczna (dla szczurów) 50 mg.
Wykrywanie jonu niklu(II) – Ni
2+
Jony niklu(II) należą do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych mają barwę zieloną i
nie posiadają właściwości redox. Jony tworzą wiele trwałych kompleksów, a najtrwalsze są kompleksy oktaedryczne
[NiL
6
]
n-

36
1. Jony siarczkowe w środowisku buforu amonowego wytrącają czarny osad siarczku niklu, rozpuszczalny w
kwasie azotowym(V) na gorąco, wodzie królewskiej lub kwasie solnym z dodatkiem utleniacza: nadtlenku
wodoru lub jonów chloranowych(V).
NiS
S
Ni
2
2
O
H
4
S
3
NO
2
Ni
3
H
8
NO
2
NiS
3
2
2
3
O
H
2
S
Ni
H
2
O
H
NiS
2
2
2
2
2. Mocne zasady wytrącają zielony osad wodorotlenku niklu(II), nierozpuszczalny w nadmiarze odczynnika.
2
2
)
OH
(
Ni
OH
2
Ni
3. Wodny roztwór amoniaku wytrąca zielony osad hydroksysoli niklu(II), rozpuszczalny w nadmiarze
odczynnika z wytworzeniem niebieskich aminakompleksów.
4
2
3
2
NH
NiOHCl
Cl
O
H
NH
Ni
O
6H
Cl
OH
]
)
[Ni(NH
O
H
6NH
NiOHCl
2
2
6
3
2
3
4. Jony węglanowe wytrącają zielony osad węglanu niklu(II), rozpuszczalny w kwasach i roztworze amoniaku
3
2
3
2
NiCO
CO
Ni
5. Dimetyloglioksym (odczynnik Czugajewa) w środowisku amoniakalnym wytrąca różowoczerwony osad
dimetyloglioksymianu niklu(II) (reakcja charakterystyczna).
H
2
)
H
O
N
H
C
(
Ni
H
O
N
H
C
2
Ni
2
2
2
6
4
2
2
2
6
4
2
OŁÓW – PLUMBUM – Pb
Z = 82
M = 207,2 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
f
14
5s
2
p
6
d
10
6s
2
p
2
XIV grupa układu okresowego.
Główne stopnie utlenienia: +2, +4.
Ołów jest metalem miękkim, ciężkim, o barwie szarej lub srebrzystej. Rozpuszcza się łatwo w rozcieńczonym
kwasie azotowym(V). Rozcieńczone roztwory kwasów solnego i siarkowego(VI) nie roztwarzają ołowiu (pasywacja).
W większości swoich związków ołów występuje na II stopniu utlenienia. Azotan(V) i octan ołowiu(II) oraz jego
związki kompleksowe są rozpuszczalne w wodzie.
Ołów wykazuje szerokie działanie biologiczne, blokując aktywność enzymów. Chroniczne zatrucie małymi
dawkami upośledza sprawność umysłową, występują podrażnienia mięśni, znużenie, wychudzenie, zaburzenia
hormonalne. Dawka toksyczna 1 mg.
Wykrywanie jonu ołowiu(II) – Pb
2+
.
Jony ołowiu(II) należą zarówno do I, jak i do II grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są
bezbarwne.
1. Jony chlorkowe wytrącają biały osad chlorku ołowiu(II), rozpuszczalny w wodzie na gorąco. Z powodu
rozpuszczalności tego osadu część jonów ołowiu(II) nie zostaje oddzielona wraz z I grupą kationów, aby
całkowicie ulec strąceniu przez odczynnik grupowy II grupy.
2
2
PbCl
Cl
2
Pb
2. Jony siarczkowe w środowisku kwasu solnego wytrącają czarny siarczek ołowiu(II), rozpuszczalny w kwasie
azotowym(V) na gorąco.
PbS
S
Pb
2
2
O
H
4
NO
2
S
3
Pb
3
H
8
NO
2
PbS
3
2
2
3
3. Mocne zasady oraz wodny roztwór amoniaku wytrącają biały osad wodorotlenku ołowiu(II) o właściwościach
amfoterycznych, nierozpuszczalny w amoniaku.
2
2
)
OH
(
Pb
OH
2
Pb
O
H
2
NH
2
)
OH
(
Pb
O
H
NH
2
Pb
2
4
2
2
3
2
O
H
2
Pb
H
2
)
OH
(
Pb
2
2
2
O
H
2
PbO
OH
2
)
OH
(
Pb
2
2
2
2
4. Jony jodkowe wytrącają żółty osad jodku ołowiu(II). Osad rozpuszcza się w wodzie na gorąco w obecności
kwasu octowego.

37
2
2
PbI
I
2
Pb
5. Jony chromianowe(VI) i dichromianowe(VI) wytrącają żółty osad chromianu(VI) ołowiu(II), rozpuszczalny w
mocnych kwasach i zasadach.
4
2
4
2
PbCrO
CrO
Pb
H
2
PbCrO
2
O
H
O
Cr
Pb
2
4
2
2
7
2
2
6. Jony siarczanowe(VI) wytrącają biały osad siarczanu(VI) ołowiu(II), rozpuszczalny w mocnych zasadach i
octanie amonu.
4
2
4
2
PbSO
SO
Pb
O
H
2
SO
PbO
OH
4
PbSO
2
2
4
2
2
4
2
4
4
3
3
4
4
SO
NH
)]
COO
CH
(
Pb
[
COO
CH
NH
PbSO
POTAS – KALIUM – K
Z = 19
M = 39,098 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
4s
1
I grupa układu okresowego.
Główne stopnie utlenienia: +1.
Potas jest metalem lekkim, bardzo aktywnie rozkładającym wodę w normalnych warunkach. Na powietrzu
ulega bardzo szybko procesowi utleniania. Prawie wszystkie sole potasu są dobrze rozpuszczalne w wodzie, wyjątki są
opisane poniżej.
Jon potasu jest najważniejszym kationem płynu wewnątrzkomórkowego oraz ważnym składnikiem płynu
pozakomórkowego. Ma duży wpływ na aktywność mięśni, zwłaszcza mięśnia sercowego. W komórkach reguluje
równowagę kwasowo-zasadową oraz ciśnienie osmotyczne, a także hamuje wydalanie wody z organizmu. Jony potasu
w ustroju są antagonistami jonów sodu i wapnia. Wewnątrzkomórkowe stężenie jonów potasu ma wpływ na biosyntezę
białek przez rybosomy. Wiele enzymów wymaga obecności tych jonów dla osiągnięcia maksymalnej aktywności.
Aktywuje transfosforylazę ATP – kwas pirogronowy oraz adenilopirofosfatazę i fosfotransacetylazę.
Wykrywanie jonu potasu – K
+
Jon potasu należy do V grupy analitycznej kationów wg Freseniusa. W roztworach wodnych jest bezbarwny i nie ulega
hydrolizie.
1. Jony wodorowinianowe wytrącają biały krystaliczny osad wodorowinianu potasu. Sól ta ma skłonność do
tworzenia roztworów przesyconych (należy pocierać wewnętrzne ścianki probówki bagietką)
6
4
4
6
4
4
O
H
KHC
O
H
HC
K
2. Azotynokobaltan sodu (heksaazotano(III)kobaltan(III) sodu) strąca żółty osad azotynokobaltanu potasu i sodu.
Reakcję uniemożliwia nadmiar mocnych zasad, powodujących rozkład azotynokobaltanu i strącanie
ciemnobrunatnego wodorotlenku kobaltu(III).
Na
2
]
)
NO
(
Co
[
Na
K
]
)
NO
(
Co
[
Na
K
2
6
2
2
6
2
3
3. Jony chloranowe(VII) wytrącają biały osad chloranu(VII) potasu
4
4
KClO
ClO
K
RTĘĆ – HYDRARGYRUM – Hg
Z = 80
M = 200,59 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
f
14
5s
2
p
6
d
10
6s
2
XII grupa układu okresowego.
Główne stopnie utlenienia: +1, +2.
Rtęć jest pierwiastkiem wysoko toksycznym. Pary rtęci są trujące. Dawka toksyczna 0,4 mg, śmiertelna: 150 – 300 mg.
Rtęć należy do metali ciężkich, w szeregu napięciowym znajduje się za wodorem. W temperaturze pokojowej
jest ciężką cieczą, niezwilżającą powierzchni. Nie reaguje z rozcieńczonymi kwasami, z wyjątkiem kwasu
azotowego(V). Tworzy dwa jony: jon rtęci(I) Hg
2
2+
i jon rtęci(II) Hg
2+
.
W lecznictwie wykorzystuje się metaliczną rtęć oraz jej sole. Związki rtęci są truciznami protoplazmy i
wskutek tego dobrymi środkami dezynfekcyjnymi. Rtęć z innymi metalami tworzy stopy zwane amalgamatami,
stosowanymi m.in. w dentystyce.

38
Wykrywanie jonu rtęci(I) – Hg
2
2+
Jony rtęci(I) należą do I grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne.
1. Jony chlorkowe wytrącają biały osad chlorku rtęci(I). Osad pod wpływem roztworu amoniaku czernieje w
wyniku dysproporcjonacji
2
2
2
2
Cl
Hg
Cl
2
Hg
O
H
2
Cl
NH
Hg
Cl
)
Hg
NH
(
O
H
NH
2
Cl
Hg
2
4
2
2
3
2
2
2. Mocne zasady wytrącają czarny osad tlenku rtęci(I).
O
H
O
Hg
OH
2
Hg
2
2
2
2
3. Jony jodkowe wytrącają zielony osad jodku rtęci(I). Osad pod wpływem nadmiaru jonów jodkowych czernieje
w wyniku dysproporcjonacji.
2
2
2
2
I
Hg
I
2
Hg
Hg
]
HgI
[
I
2
I
Hg
2
4
2
2
4. Jony chromianowe(VI) wytrącają czerwony osad chromianu(VI) rtęci(I), rozpuszczalny w kwasie
azotowym(V).
4
2
2
4
2
2
CrO
Hg
CrO
Hg
5. Jony siarczkowe wytrącają czarny osad siarczku rtęci(II) i rtęci metalicznej.
Hg
HgS
S
Hg
2
2
2
6. Właściwości utleniające
a. utlenianie cyny(II)
4
2
2
2
Sn
Hg
2
Sn
Hg
b. utlenianie miedzi metalicznej
2
2
2
Cu
Hg
2
Cu
Hg
Wykrywanie jonu rtęci(II) – Hg
2+
Jony rtęci(II) należą do II grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne.
1. Jony siarczkowe w środowisku kwasu solnego wytrącają czarny siarczek rtęci(II), rozpuszczalny w wodzie
królewskiej (aqua regia – mieszanina stężonych kwasów: solnego i azotowego(V) w stosunku 3:1)
HgS
S
Hg
2
2
O
H
4
NO
2
S
3
]
HgCl
[
3
H
8
Cl
12
NO
2
HgS
3
2
2
4
3
2. Mocne zasady wytrącają żółty osad tlenku rtęci(II)
O
H
HgO
OH
2
Hg
2
2
3. Wodny roztwór amoniaku wytrąca biały osad amidosoli rtęci(II), nierozpuszczalny w amoniaku.
O
H
2
NH
Cl
)
Hg
NH
(
O
H
NH
2
Cl
Hg
2
4
2
2
3
2
4. Jony jodkowe wytrącają pomarańczowoczerwony osad jodku rtęci(II), rozpuszczalny w nadmiarze jonów
jodkowych.
2
2
HgI
I
2
Hg
2
4
2
]
HgI
[
I
2
HgI
5. Jony chromianowe(VI) wytrącają żółty osad chromianu(VI) rtęci(II).
4
2
4
2
HgCrO
CrO
Hg
6. Właściwości utleniające
a. utlenianie jonów cyny(II)
4
2
2
2
2
Sn
Hg
Sn
Hg
b. utlenianie miedzi metalicznej
2
2
Cu
Hg
Cu
Hg

39
S – SULPHUR – SIARKA
Z = 16
M = 32,066 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
4
XVI grupa układu okresowego.
Główne stopnie utlenienia: -2, +2, +4, +6.
Siarka jest składnikiem ważnych aminokwasów (cysteiny i metioniny) obecnych w białkach, jest składnikiem
wielu enzymów i koenzymów, uczestniczy w procesach oddechowych na poziomie komórkowym oraz wchodzi w skład
niektórych wielocukrów.
Wykrywanie jonu siarczanowego(VI) - SO
4
2-
Jon siarczanowy(VI) jest anionem mocnego kwasu siarkowego(VI) – H
2
SO
4
. Jon siarczanowy(VI) jest bezbarwny i w
roztworach rozcieńczonych nie wykazuje właściwości redox.
1. Sole baru wytrącają biały osad siarczanu(VI) baru, nierozpuszczalny w mocnych kwasach (podstawa
identyfikacji jonu)
4
2
4
2
BaSO
SO
Ba
2. Sole srebra wytrącają biały osad siarczanu(VI) srebra tylko z roztworów stężonych. Osad ten jest
rozpuszczalny w wodzie.
3. Sole ołowiu(II) wytrącają biały osad siarczanu(VI) ołowiu(II), rozpuszczalny w mocnych zasadach i octanie
amonu.
4
2
4
2
PbSO
SO
Pb
O
H
2
SO
PbO
OH
4
PbSO
2
2
4
2
2
4
2
4
4
3
3
4
4
SO
NH
)]
COO
CH
(
Pb
[
COO
CH
NH
PbSO
Wykrywanie jonu siarczanowego(IV) – SO
3
2-
Jon siarczanowy(IV) jest anionem kwasu siarkowego(IV) – H
2
SO
3
. Kwas ten jest kwasem średniej mocy, w stanie
wolnym ulega rozpadowi na SO
2
i wodę. Jony siarczanowe(IV) wykazują właściwości redukujące.
1. Sole baru wytrącają biały osad siarczanu(IV) baru, rozpuszczalny w kwasach z wydzieleniem ditlenku siarki.
3
2
3
2
BaSO
SO
Ba
O
H
SO
Ba
H
2
BaSO
2
2
2
3
Identyfikacja ditlenku siarki SO
2
:
- bezbarwny gaz o charakterystycznym zapachu (zwanym zapachem palonej gumy),
- odbarwia roztwory I
2
i KMnO
4
(silny reduktor)
2. Sole srebra wytrącają biały osad siarczanu(IV) srebra, rozpuszczalny w kwasach.
3
2
2
3
SO
Ag
SO
Ag
2
3. Roztwory kwasów rozkładają wszystkie siarczany(IV) (rozpuszczalne i nierozpuszczalne w wodzie) z
wydzieleniem SO
2
.
O
H
SO
H
2
SO
2
2
2
3
4. Właściwości redukujące jonu siarczanowego(IV)
a. odbarwianie manganianu(VII) potasu – następuje utlenienie jonu siarczanowego(IV) częściowo do
jonu siarczanowego(VI) i częściowo do jonu ditionianowego
O
H
3
SO
5
Mn
2
H
6
SO
5
MnO
2
2
2
4
2
2
3
4
O
H
8
O
S
5
Mn
2
H
16
SO
10
MnO
2
2
2
6
2
2
2
3
4
b. odbarwianie jodu
H
2
I
2
SO
O
H
I
SO
2
4
2
2
2
3
5. Odbarwianie fuksyny lub zieleni malachitowej – pod wpływem jonów siarczanowych(IV) zanika barwa
odczynników. Reakcji przeszkadza jon siarczkowy.

40
Wykrywanie jonu tiosiarczanowego – S
2
O
3
2-
Jon tiosiarczanowy jest anionem kwasu tiosiarkowego H
2
S
2
O
3
. Kwas ten w stanie wolnym ulega natychmiastowemu
rozpadowi na SO
2
i siarkę. Jony tiosiarczanowe są bezbarwne i wykazują właściwości redukujące.
1. Sole baru wytrącają biały osad tiosiarczanu baru, rozpuszczalny w kwasach. Sól ta ma dużą skłonność do
tworzenia roztworów przesyconych (należy pocierać wewnętrzne ścianki probówki bagietką)
3
2
2
3
2
2
O
BaS
O
S
Ba
2. Sole srebra wytrącają biały osad tiosiarczanu srebra, rozpuszczalny w kwasach, który szybko żółknie,
brunatnieje, aby stać się czarnym osadem siarczku srebra. Osad tiosiarczanu srebra wytrąca się tylko przy
nadmiarze jonów srebra, gdyż osad ten jest rozpuszczalny w roztworach tiosiarczanów.
3
2
2
2
3
2
O
S
Ag
O
S
Ag
2
4
2
2
2
3
2
2
SO
H
S
Ag
O
H
O
S
Ag
)]
O
S
(
Ag
[
2
O
S
O
S
Ag
3
2
2
3
2
3
2
2
4
3
3
2
2
2
3
2
3
2
2
]
)
O
S
(
Ag
[
O
S
2
O
S
Ag
3. Roztwory kwasów rozkładają wszystkie tiosiarczany z wydzieleniem SO
2
i siarki.
O
H
S
SO
H
2
O
S
2
2
2
3
2
4. Właściwości redukujące jonu tiosiarczanowego
a. odbarwianie manganianu(VII) potasu w środowisku kwaśnym prowadzi do utworzenia jonu
siarczanowego(VI), natomiast w środowisku zasadowym – jonu tetrationianowego
O
H
7
SO
10
Mn
8
H
14
O
S
5
MnO
8
2
2
4
2
2
3
2
4
2
6
4
2
4
2
3
2
4
O
S
MnO
2
O
S
2
MnO
2
b. odbarwianie jodu – jony tiosiarczanowe ulegają utlenieniu do jonów tetrationianowych S
4
O
6
2-
.
I
2
O
S
I
O
S
2
2
6
4
2
2
3
2
Wykrywanie jonu tiocyjanianowego – SCN
-
Jon tiocyjanianowy jest anionem mocnego kwasu tiocyjanowodorowego HSCN. Jon jest bezbarwny i posiada
właściwości redukujące.
1. Sole baru nie strącają osadu.
2. Sole srebra wytrącają biały, serowaty osad tiocyjanianu srebra. Osad nie rozpuszcza się w kwasie
azotowym(V), a rozpuszcza w roztworze amoniaku.
AgSCN
SCN
Ag
O
H
2
SCN
]
)
NH
(
Ag
[
O
H
NH
2
AgSCN
2
2
3
2
3
3. Sole żelaza(III) tworzą szereg czerwonych kompleksów o liczbie jonów tiocyjanianowych od 1 do 6,
powodując zabarwienie roztworu na kolor krwistoczerwony. Reakcji przeszkadzają obecne w roztworze jony
fluorkowe, jodkowe lub szczawianowe (reakcja charakterystyczna).
n
3
n
3
]
)
SCN
(
Fe
[
nSCN
Fe
n = 1 ÷ 6
4. Sole kobaltu(II) tworzą związek kompleksowy, który barwi alkohol amylowy lub aceton na błękitno. Reakcji
przeszkadzają jony żelaza(III).
2
4
2
]
)
SCN
(
Co
[
SCN
4
Co
5. Właściwości redukujące – odbarwianie manganianu(VII) potasu w środowisku kwaśnym
O
H
16
SO
10
)
CN
(
5
Mn
14
H
32
SCN
10
MnO
14
2
2
4
2
2
4
SÓD – NATRIUM – Na
Z = 11
M = 22,990 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
1
I grupa układu okresowego.
Główne stopnie utlenienia: +1.

41
Sód jest metalem lekkim, rozkładającym w warunkach normalnych wodę. Na powietrzu ulega
natychmiastowemu procesowi utleniania. Na ogół wszystkie sole sodu są rozpuszczalne w wodzie, za wyjątkiem np.
heksafluorokrzemianu(IV)sodu Na
2
[SiF
6
].
Jon sodu jest najważniejszym kationem płynu pozakomórkowego. Utrzymuje on odpowiednie ciśnienie
osmotyczne płynu ustrojowego, by w ten sposób chronić przed zbytnią utratą płynów. Ponadto odgrywa również rolę z
zachowaniu prawidłowej pobudliwości mięśni i przepuszczalności błon komórkowych. Jony sodu oddziaływują
również na enzymy (aktywują adenilopirofosfatazę a hamują aktywność transfosforylazy).Większość jonów sodu
występuje w płynach pozakomórkowych i towarzyszą mu aniony chlorkowe i wodorowęglanowe, niezbędne w
regulacji kwasowo-zasadowej (tzw. rezerwa alkaliczną ustroju). Ponad 30 % jonów sodowych występuje w postaci
związków organicznych w kośćcu.
Wykrywanie jonu sodu – Na
+
Jon sodu należy do V grupy analitycznej kationów wg Freseniusa. Jest bezbarwny i nie ulega hydrolizie.
1. Diwodoroantymonian(V) potasu wytrąca biały krystaliczny osad diwodoroantymonianu(V) sodu. Reakcja
przebiega w środowisku obojętnym lub słabo zasadowym.
4
2
4
2
SbO
NaH
SbO
H
Na
2. Octan uranylowo-cynkowy (oktaoctan cynku i tris(dioksouranu(VI)) strąca z obojętnych lub zakwaszonych
roztworów żółty krystaliczny osad octanu cynku, sodu i uranylu.
O
H
6
)
COO
CH
(
)
UO
(
NaZn
O
H
6
COO
CH
)
COO
CH
(
)
UO
(
Zn
Na
2
9
3
3
2
2
3
8
3
3
2
Ag – ARGENTUM – SREBRO
Z = 47
M = 107,87 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
d
10
5s
1
XI grupa układu okresowego.
Główne stopnie utlenienia: +1, +2.
Srebro należy do metali ciężkich. Metaliczne srebro jest najjaśniejszym spośród metali, ale na powierzchni
ciemnieje, wskutek pokrywania się na powierzchni siarczkiem srebra(I). Nie reaguje z rozcieńczonymi kwasami, z
wyjątkiem kwasu azotowego(V) (w szeregu napięciowym znajduje się za wodorem i dlatego nie wypiera go z kwasów).
Srebro i jego związki mają w lecznictwie zastosowanie jako środki o właściwościach ściągających, żrących i
antyseptycznych. Mechanizm działania soli srebra na ustrój polega na tym, że uwolniony jon srebra wytrąca białko,
tworząc osad białczanu srebra. Sole srebra podane do wewnątrz wywołują zatrucie organizmu. Dawka toksyczna 60
mg.
Wykrywanie jonu srebra(I) – Ag
+
Jony srebra(I) należą do I grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne.
1. Jony chlorkowe wytrącają biały, serowaty osad chlorku srebra, który na świetle zmienia barwę na
szarofioletową. Osad nie rozpuszcza się w kwasach, łatwo rozpuszcza się w wodnym roztworze amoniaku,
roztworach jonów tiosiarczanowych lub cyjankowych.
AgCl
Cl
Ag
O
H
2
Cl
]
)
NH
(
Ag
[
OH
NH
2
AgCl
2
2
3
4
2. Mocne zasady wytrącają brunatny osad tlenku srebra(I).
O
H
O
Ag
OH
2
Ag
2
2
2
3. Jony jodkowe wytrącają żółty osad jodku srebra, który na świetle czernieje. Osad nie rozpuszcza się w kwasie
azotowym(V) i wodnym roztworze amoniaku, rozpuszcza się roztworach jonów tiosiarczanowych lub
cyjankowych.
AgI
I
Ag
O
H
2
I
]
)
CN
(
Ag
[
CN
2
AgI
2
2
4. Jony chromianowe(VI) wytrącają ceglastoczerwony osad chromianu(VI) srebra, rozpuszczalny w kwasach.
4
2
2
4
CrO
Ag
CrO
Ag
2
5. Jony siarczkowe wytrącają czarny osad siarczku srebra. Osad rozpuszcza się w kwasie azotowym(V) na
gorąco.

42
S
Ag
S
2Ag
2
2
O
4H
3S
2NO
6Ag
8H
2NO
S
3Ag
2
3
2
6. Jony fosforanowe(V) wytracają żółty osad fosforanu srebra. Osad ten jest rozpuszczalny w kwasie
azotowym(V) i roztworze amoniaku.
4
3
3
4
PO
Ag
PO
Ag
3
STRONT – STRONTIUM – Sr
Z = 38
M = 87,62 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
10
4s
2
p
6
5s
2
II grupa układu okresowego.
Główne stopnie utlenienia: +2.
Stront jest srebrzystobiałym metalem, reaguje z tlenem w warunkach normalnych. Zarówno metal, jak i jego
sole, są toksyczne.
Wykrywanie jonu strontu – Sr
2+
Jony strontu należą do IV grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne i nie
ulegają hydrolizie.
1. Jony węglanowe w środowisku buforu amonowego strącają biały osad węglanu strontu, rozpuszczalny w
kwasach z wydzieleniem CO
2
.
3
2
3
2
SrCO
CO
Sr
O
H
CO
Sr
H
2
SrCO
2
2
2
3
2. Jony siarczanowe(VI) wytrącają biały osad siarczanu(VI) strontu, nierozpuszczalny w mocnych kwasach
4
2
4
2
SrSO
SO
Sr
3. Jony szczawianowe wytrącają biały osad szczawianu strontu, rozpuszczalny w kwasach mineralnych oraz
kwasie octowym na gorąco.
4
2
2
4
2
2
O
SrC
O
C
Sr
4. Jony chromianowe(VI) strącają żółty osad chromianu(VI) strontu, rozpuszczalny w mocnych kwasach oraz
kwasie octowym i jego solach.
4
2
4
2
SrCrO
CrO
Sr
5. Jony wodorofosforanowe wytrącają biały osad wodorofosforanu strontu, rozpuszczalny w kwasach.
4
2
4
2
SrHPO
HPO
Sr
WAPŃ – CALCIUM – Ca
Z = 20
M = 40,078 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
4s
2
II grupa układu okresowego.
Główne stopnie utlenienia: +2.
Wapń jest metalem lekkim, rozkładającym w warunkach normalnych wodę z wydzieleniem wodoru.
Jony wapnia są niezbędne dla normalnej czynności serca jak i konieczne dla zachowania prawidłowej
aktywności układu mięśniowo-nerwowego. Wapń jest składnikiem kości, zębów i jak również błon komórkowych,
wpływając na ich przepuszczalność i utrzymanie integralności. Mając możność odkładania się w tkankach wapń hamuje
patologiczną przepuszczalność naczyń włosowatych i ułatwia leczenie niektórych procesów zapalnych. Jony wapnia
wprowadzone do jelit wpływają hamująco na ich perystaltykę. Nadmiar w ustroju jonów wapnia wpływa na wydalanie
jonów sodowych (wzrost diurezy). Duże znaczenie ma zawartość wapnia we krwi gdzie występuje głównie w osoczu.
Jony wapnia są też nieodzowne dla przemiany protrombiny w trombinę w procesie krzepnięcia krwi.
Wykrywanie jonu wapnia – Ca
2+
Jony wapnia należą do IV grupy analitycznej kationów wg Freseniusa. W roztworach wodnych są bezbarwne i nie
ulegają hydrolizie.

43
1. Jony węglanowe w środowisku buforu amonowego strącają biały osad węglanu wapnia, rozpuszczalny w
kwasach z wydzieleniem CO
2
.
3
2
3
2
CaCO
CO
Ca
O
H
CO
Ca
H
2
CaCO
2
2
2
3
2. Jony siarczanowe(VI) strącają osad siarczanu(VI) wapnia tylko ze stężonych roztworów.
3. Jony szczawianowe wytrącają biały osad szczawianu wapnia, rozpuszczalny w kwasach mineralnych oraz
nierozpuszczalny w kwasie octowym.
4
2
2
4
2
2
O
CaC
O
C
Ca
4. Jony chromianowe(VI) nie strącają osadu.
5. Jony wodorofosforanowe wytrącają biały osad wodorofosforanu wapnia, rozpuszczalny w kwasach.
4
2
4
2
CaHPO
HPO
Ca
6. Jony heksacyjanożelazianowe(II) wytrącają w środowisku buforu amonowego biały osad
heksacyjanożelazianu(II) diamonu i wapnia.
]
)
CN
(
Fe
[
)
NH
(
Ca
]
)
CN
(
Fe
[
NH
2
Ca
6
2
4
4
6
4
2
C – CARBO –WĘGIEL
Z = 6
M = 12,011 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
2
XIV grupa układu okresowego.
Główne stopnie utlenienia: -4, +2, +4.
Węgiel występuje w postaci kilku odmian alotropowych, różniących się zarówno właściwościami fizycznymi
(czarny kruchy grafit – bezbarwny twardy diament), jak i chemicznymi.
Związki węgla są podstawą życia na Ziemi, wchodzą w skład wszystkich związków organicznych. Spośród
związków nieorganicznych węgla najważniejsze są jony węglanowe. Węglany występujące w organizmie ludzkim
wchodzą w skład układów buforowych H
2
CO
3
/NaHCO
3
, których zadaniem jest utrzymanie stałego pH krwi. Niektóre
sole węglanowe są stosowane jako leki np. (NH
4
)
2
CO
3
– działa wykrztuśnie. Węglany mogą być wykorzystywane
również jako leki zobojętniające kwas solny w żołądku np. wodorowęglan sodu NaHCO
3
, CaCO
3
strącony, węglan
magnezu MgCO
3
.
Wykrywanie jonu węglanowego – CO
3
2-
Jon węglanowy jest anionem słabego i nietrwałego kwasu węglowego H
2
CO
3
.Wydzielony kwas rozpada się na CO
2
i
wodę. Jon węglanowy nie wykazuje właściwości redox.
1. Sole baru wytrącają biały osad węglanu baru, rozpuszczalny w kwasach z wydzieleniem CO
2
.
3
2
3
2
BaCO
CO
Ba
O
H
CO
Ba
H
2
BaCO
2
2
2
3
2. Sole srebra wytrącają biały osad węglanu srebra, rozpuszczalny w kwasach.
3
2
2
3
CO
Ag
CO
Ag
2
3. Sole ołowiu(II) wytrącają biały osad węglanu ołowiu(II), rozpuszczalny w kwasach.
4. Roztwory kwasów rozkładają węglany
O
H
CO
H
2
CO
2
2
2
3
Wykrywanie jonu octanowego – CH
3
COO
-
Jon octanowy jest anionem słabego organicznego kwasu octowego CH
3
COOH. Jon jest bezbarwny i nie posiada
właściwości redox.
1. Sole baru nie strącają osadu.
2. Sole srebra nie strącają osadu.
3. Sole żelaza(III) tworzą czerwony octan żelaza(III) (zabarwienie roztworu). Po rozcieńczeniu wodą i ogrzaniu
wytrąca się czerwony dihydroksyoctan żelaza(III).
3
3
3
3
)
COO
CH
(
Fe
COO
CH
3
Fe

44
COOH
CH
2
COO
CH
)
OH
(
Fe
O
H
2
)
COO
CH
(
Fe
3
3
2
2
3
3
4. Roztwory kwasów powodują wydzielanie ulatniającego się kwasu octowego.
COOH
CH
H
COO
CH
3
3
5. Reakcja estryfikacji – do niewielkiej ilości badanej substancji umieszczonej na tygielku dodajemy kroplę
stężonego kwasu siarkowego(VI) i kilka kropel alkoholu, np. amylowego, a następnie mieszaninę ogrzewamy.
Powstały ester charakteryzuje się przyjemnym zapachem (reakcja charakterystyczna).
O
H
COOR
CH
COOH
CH
ROH
2
3
3
Wykrywanie jonu szczawianowego – C
2
O
4
2-
Jon szczawianowy jest anionem organicznego kwasu szczawiowego H
2
C
2
O
4
o średniej mocy. Jon jest bezbarwny i
wykazuje właściwości redukujące.
1. Sole baru wytrącają biały osad szczawianu baru, rozpuszczalny w kwasach mineralnych oraz kwasie octowym.
4
2
2
4
2
2
O
BaC
O
C
Ba
2. Sole srebra wytrącają biały osad szczawianu srebra, rozpuszczalny w kwasie azotowym(V).
4
2
2
2
4
2
O
C
Ag
O
C
Ag
2
3. Sole wapnia wytrącają biały osad szczawianu wapnia, rozpuszczalny w kwasach mineralnych, ale
nierozpuszczalny w kwasie octowym.
4
2
2
4
2
2
O
CaC
O
C
Ca
4. Stężony roztwór kwasu siarkowego(VI) rozkłada szczawiany na gorąco
O
H
CO
CO
H
2
O
C
2
2
2
4
2
5. Właściwości redukujące jonu szczawianowego - odbarwianie manganianu(VII) potasu w środowisku kwaśnym
na gorąco
O
H
8
CO
10
Mn
2
H
16
O
C
5
MnO
2
2
2
2
2
4
2
4
ŻELAZO – FERRUM – Fe
Z = 26
M = 55,845 g/mol
Konfiguracja elektronowa: 1s
2
2s
2
p
6
3s
2
p
6
d
6
4s
2
VIII grupa układu okresowego.
Główne stopnie utlenienia: +2, +3.
Żelazo jest twardym metalem ciężkim, o wysokiej temperaturze topnienia. W postaci czystej jest
srebrzystobiałe, zanieczyszczone innymi pierwiastkami (zwłaszcza niemetalami) szybko koroduje w wilgotnym
powietrzu. W szeregu napięciowym znajduje się przed wodorem, oznacza to, że z kwasów wypiera wodór. Szybko
roztwarza się w mocnych kwasach. W roztworach wodnych żelazo występuje na stopniach utlenienia II i III. Jony
tworzą wiele trwałych kompleksów, a najtrwalsze są kompleksy oktaedryczne [FeL
6
]
n-
.
Żelazo jest pierwiastkiem śladowym niezbędnym do życia wszystkich organizmów. Dla procesów
biochemicznych szczególne znaczenie mają jego kompleksy metaloorganiczne z porfirynami, proteinami i in. Do tej
grupy związków należą: hemoglobina (Fe(II)) i katalaza (Fe(III)). Niedobór żelaza może wywoływać schorzenie zwane
niedokrwistością (anemia). Sole żelaza są resorbowane z przewodu pokarmowego, przy czym sole żelaza(III) nie
ulegają resorpcji. Sole żelaza(II) resorbują się w ilości 20-25%. Wchłanianie zależy od ilości kwasu solnego w żołądku
i poziomu witaminy C w ustroju.
Wykrywanie jonu żelaza(II) – Fe
2+
Jony żelaza(II) należą do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych mają barwę
bladozieloną oraz posiadają właściwości redukujące.
1. Jony siarczkowe w środowisku buforu amonowego wytrącają czarny osad siarczku żelaza(II), rozpuszczalny w
kwasach.
FeS
S
Fe
2
2
S
H
Fe
H
2
FeS
2
2
2. Mocne zasady oraz wodny roztwór amoniaku wytrącają bladozielony osad wodorotlenku żelaza(II),
nierozpuszczalny w nadmiarze odczynnika, ale rozpuszczalny w solach amonowych. Osad szybko utlenia się
na powietrzu, przechodząc do brunatnoczerwonego wodorotlenku żelaza(III)

45
2
2
)
OH
(
Fe
OH
2
Fe
4
2
2
3
2
NH
2
)
OH
(
Fe
O
H
NH
2
Fe
3
2
2
2
)
OH
(
Fe
4
O
H
2
O
)
OH
(
Fe
4
3. Jony węglanowe wytrącają biały osad węglanu żelaza(II), szybko brunatniejący na powietrzu na skutek
utleniania.
3
2
3
2
FeCO
CO
Fe
2
3
2
2
3
CO
4
)
OH
(
Fe
4
O
O
H
6
FeCO
4
4. Jony heksacyjanożelazianowe(III) wytrącają osad błękitu Turnbulla (heksacyjanożelazianu(III) żelaza(II))
(reakcja charakterystyczna)
2
6
3
3
6
2
]
)
CN
(
Fe
[
Fe
]
)
CN
(
Fe
[
2
Fe
3
5. Właściwości redukujące
c. odbarwienie manganianu(VII) potasu
O
H
4
Mn
Fe
5
H
8
MnO
Fe
5
2
2
3
4
2
d. redukcja jonów azotanowych(V)
O
H
2
NO
Fe
3
H
4
Fe
3
NO
2
3
2
3
Wykrywanie jonu żelaza(III) – Fe
3+
Jony żelaza(III) należą do III grupy analitycznej kationów wg Freseniusa. W roztworach wodnych mają barwę żółtą lub
czerwonobrunatną oraz posiadają właściwości utleniające.
1. Jony siarczkowe w środowisku buforu amonowego wytrącają czarny osad siarczku żelaza(III), rozpuszczalny
w kwasach wraz ze zmianą stopnia utlenienia jonu żelaza.
3
2
2
3
S
Fe
S
3
Fe
2
S
H
2
S
Fe
2
H
4
S
Fe
2
2
3
2
2. Mocne zasady oraz wodny roztwór amoniaku wytrącają brunatnoczerwony osad wodorotlenku żelaza(III),
nierozpuszczalny w nadmiarze odczynnika.
3
3
)
OH
(
Fe
OH
3
Fe
4
3
2
3
3
NH
3
)
OH
(
Fe
O
H
NH
3
Fe
3. Jony octanowe tworzą czerwony octan żelaza(III) (zabarwienie roztworu). Po rozcieńczeniu wodą i ogrzaniu
wytrąca się czerwony dihydroksyoctan żelaza(III).
3
3
3
3
)
COO
CH
(
Fe
COO
CH
3
Fe
COOH
CH
2
COO
CH
)
OH
(
Fe
O
H
2
)
COO
CH
(
Fe
3
3
2
2
3
3
4. Jony tiocyjanianowe tworzą szereg czerwonych kompleksów o liczbie jonów tiocyjanianowych od 1 do 6,
powodując zabarwienie roztworu na kolor krwistoczerwony (reakcja charakterystyczna). Reakcji
przeszkadzają obecne w roztworze jony fluorkowe lub szczawianowe, powodujące zanik barwy poprzez
utworzenie trwalszego kompleksu
n
3
n
3
]
)
SCN
(
Fe
[
nSCN
Fe
n = 1 ÷ 6
SCN
6
]
FeF
[
F
6
]
)
SCN
(
Fe
[
3
6
3
6
5. Jony heksacyjanożelazianowe(II) wytrącają osad błękitu pruskiego (heksacyjanożelazianu(II) żelaza(III))
(reakcja charakterystyczna).
3
6
4
4
6
3
]
)
CN
(
Fe
[
Fe
]
)
CN
(
Fe
[
3
Fe
4
6. Właściwości utleniające
a. utlenianie jonów jodkowych z wytworzeniem jodu (granatowe zabarwienie w reakcji ze skrobią)
2
2
3
I
Fe
2
I
2
Fe
2
b. utlenianie jonów cyny(II)
4
2
2
3
Sn
Fe
2
Sn
Fe
2

46
Związki kompleksowe wykorzystywane w analizie jakościowej
Lp.
Jon
metalu
Kompleks metalu
Nazwa kompleksu
Barwa kompleksu w
roztworze wodnym
1
Ag
+
[Ag(NH
3
)
2
]
+
Kation diaminasrebra(I)
bezbarwny
2
Pb
2+
[PbI
4
]
2-
Tetrajodoołowian(II)
bezbarwny
3
[Cu(NH
3
)
4
]
2+
Kation tetraaminamiedzi(II)
granatowy
4
[Cu(OH)]
2
SO
4
↓
Siarczan(VI) dihydroksomiedzi(II)
zielonkawy
5
Cu
2
[Fe(CN)
6
] ↓
Heksacyjanożelazian(II) miedzi(II)
brązowo-wiśniowy
6
Cu
2+
Cu[Hg(SCN)
4
] ↓
Tetra(tiocyjaniano)rtęcian(II)
miedzi(II)
żółto-zielony
7
[BiI
4
]
-
Tetrajodobizmutan(III)
pomarańczowy
8
Bi
3+
[Bi(S=C(NH
2
)
2
)
x
]
3+
Kation mocznikobizmutu(III)
intensywnie żółty
9
[Zn(NH
3
)
4
]
2+
Kation tetraaminacynku(II)
bezbarwny
10
K
2
Zn
3
[Fe(CN)
6
]
2
↓
Heksacyjanożelazian(II) cynku i potasu biały
Zn[Hg(SCN)
4
] ↓
Tetra(tiocyjaniano)rtęcian(II) cynku(II) biały
(Zn, Cu)[Hg(SCN)
4
] ↓
Tetra(tiocyjaniano)rtęcian(II) cynku(II)
i miedzi(II)
fioletowy
11
Zn
2+
(Zn, Co)[Hg(SCN)
4
] ↓
Tetra(tiocyjaniano)rtęcian(II) cynku(II)
i kobaltu(II)
intensywnie niebieski
[Co(NH
3
)
6
]
2+
Kation heksaaminakobaltu(II)
żółto-brunatny
12
2
O
[Co(NH
3
)
6
]
3+
Kation heksaaminakobaltu(III)
brązowo-żółty
13
[Co(SCN)
4
]
2-
Tetra(tiocyjaniano)kobaltan(II)
niebieski (w warstwie
organicznej)
14
Co[Hg(SCN)
4
] ↓
Tetra(tiocyjaniano)rtęcian(II)
kobaltu(II)
niebieski
[CoCl
4
]
2-
Tetrachlorokobaltan(II)
niebieski
15
Co
2+
[CoCl
6
]
4-
Heksachlorokobaltan(II)
niebiesko-zielony
16
[Ni(NH
3
)
6
]
2+
Kation heksaaminaniklu(II)
intensywnie niebieski
17
Ni
2+
[Ni(C
4
H
6
N
2
O
2
H)
2
]
Dimetyloglioksymian niklu(II)
malinowy
18
[Fe(SCN)
6
]
3-
Heksa(tiocyjaniano)żelazian(III)
krwistoczerwony
19
Fe
4
[Fe(CN)
6
]
3
↓
Heksacyjanożelazian(II) żelaza(III)
błękit pruski
20
Fe
3+
[FeF
6
]
3-
Heksafluorożelazian(III)
bezbarwny
21
Fe
2+
Fe
3
[Fe(CN)
6
]
2
↓
Heksacyjanożelazian(III) żelaza(II)
błękit Turnbula
22
K
+
K
2
Na[Co(NO
2
)
6
] ↓
Heksa(nitro-O)kobaltyn(III) dipotasu i
sodu
żółty

47
Podział kationów na grupy analityczne wg Freseniusa
Nr grupy
Odczynnik grupowy
Kationy
I
HCl
Ag
+
, Hg
2
2+
, Pb
2+
II
H
2
S/tioacetamid w środowisku HCl
Hg
2+
, Pb
2+
, Cu
2+
, Cd
2+
, Bi
3+
III
(NH
4
)
2
S/tioacetamid w środowisku buforu amonowego
Mn
2+
, Zn
2+
, Ni
2+
, Co
2+
, Fe
2+
, Fe
3+
, Cr
3+
, Al
3+
IV
(NH
4
)
2
CO
3
w środowisku buforu amonowego
Ca
2+
, Sr
2+
, Ba
2+
V
brak
Na
+
, K
+
, NH
4
+
, Mg
2+
48
Podsumowanie reakcji kationów I grupy analitycznej wg Freseniusa
Kationy
Dodany odczynnik
Ag
+
Hg
2
2+
Pb
2+
AgCl biały osad
Hg
2
Cl
2
biały osad
PbCl
2
biały osad
Odczynnik grupowy (HCl)
rozpuszczalny w NH
3
.
H
2
O
nierozpuszczalny w NH
3
.
H
2
O
rozpuszczalny w H
2
O na gorąco
H
2
SO
4
brak
Hg
2
SO
4
biały osad
PbSO
4
biały osad
KBr
AgBr jasnożółty osad
Hg
2
Br
2
żółtawy osad
PbBr
2
żółtawy osad
KI
AgI żółty osad
Hg
2
I
2
żółtozielony osad
PbI
2
żółty osad
NaOH
AgOH biały osad
Hg
2
O czarny osad
Pb(OH)
2
biały osad
NaOH nadmiar
Ag
2
O brązowy osad
Hg
2
O czarny osad
PbO
2
2-
bezbarwny roztwór
NH
3
.
H
2
O
[Ag(NH
3
)
2
]
+
bezbarwny roztwór
czerniejący osad
Pb(OH)
2
biały osad
NH
3
.
H
2
O nadmiar
[Ag(NH
3
)
2
]
+
bezbarwny roztwór
czerniejący osad
Pb(OH)
2
biały osad
K
2
CrO
4
Ag
2
CrO
4
czerwonobrązowy osad
Hg
2
CrO
4
czerwony osad
PbCrO
4
żółty osad
H
2
S/tioacetamid
Ag
2
S czarny osad
Hg
2
S czarny osad
PbS czarny osad
SnCl
2
Ag czarny osad
Hg czarny osad
PbCl
2
biały osad
49
Podsumowanie reakcji kationów II grupy analitycznej wg Freseniusa
Kationy
Dodany odczynnik
Hg
2+
Pb
2+
Cu
2+
Cd
2+
Bi
3+
HgS czarny osad
PbS czarny osad
CuS czarny osad
CdS kanarkowy osad
Bi
2
S
3
brunatnoczarny osad
Odczynnik grupowy
(H
2
S/tioacetamid w
środowisku HCl)
rozpuszczalny w
HNO
3
+ HCl (1:3)
rozpuszczalny w HNO
3
rozpuszczalny w HNO
3
rozpuszczalny w HNO
3
i st.HCl
rozpuszczalny w HNO
3
H
2
SO
4
brak
PbSO
4
biały osad
brak
brak
brak
KI
HgI
2
czerwony osad
PbI
2
żółty osad
CuI biały osad,
I
2
brunatny roztwór
brak
BiI
3
czarny osad
KI nadmiar
[HgI
4
]
2-
bezbarwny
PbI
2
żółty osad
CuI biały osad,
I
2
brunatny roztwór
brak
[BiI
4
]
-
pomarańczowy
roztwór
SnCl
2
nadmiar
Hg
2
Cl
2
+ Hg czerniejący
osad
PbCl
2
biały osad
brak
brak
brak
NaOH
HgO żółty osad
Pb(OH)
2
biały osad
Cu(OH)
2
niebieski osad
Cd(OH)
2
biały osad
Bi(OH)
3
biały osad
NaOH nadmiar
HgO żółty osad
PbO
2
2-
bezbarwny roztwór
Cu(OH)
2
niebieski osad
Cd(OH)
2
biały osad
Bi(OH)
3
biały osad
NH
3
.
H
2
O
biały osad amidosoli
Pb(OH)
2
biały osad
niebieski osad
hydroksysoli
Cd(OH)
2
biały osad
Bi(OH)
3
biały osad
NH
3
.
H
2
O nadmiar
biały osad amidosoli
Pb(OH)
2
biały osad
[Cu(NH
3
)
4
]
2+
zielony roztwór
[Cd(NH
3
)
4
]
2+
bezbarwny
roztwór
Bi(OH)
3
biały osad
50
Podsumowanie reakcji kationów III grupy analitycznej wg Freseniusa
Kationy
Dodany odczynnik
Fe
2+
Fe
3+
Co
2+
Ni
2+
Cr
3+
Mn
2+
Zn
2+
Al
3+
FeS
czarny osad
Fe
2
S
3
czarny osad
CoS
czarny osad
NiS
czarny osad
Cr(OH)
3
szarozielony
osad
MnS
cielisty osad
ZnS
biały osad
Al(OH)
3
biały osad
Odczynnik grupowy
((NH
4
)
2
S/tioacetamid
w środowisku buforu
amonowego)
rozp. w HCl
rozp. w HCl
rozp. w HCl z
H
2
O
2
rozp. w HCl z
H
2
O
2
rozp. w HCl
rozp. w HCl
rozp. w HCl
rozp. w HCl
NaOH
Fe(OH)
2
zielony osad
Fe(OH)
3
czerwono-
brunatny osad
niebieski osad
hydroksysoli
Ni(OH)
2
zielony
osad
Cr(OH)
3
szarozielony
osad
Mn(OH)
2
biały osad
Zn(OH)
2
biały osad
Al(OH)
3
biały osad
NaOH nadmiar
Fe(OH)
2
zielony osad
Fe(OH)
3
czerwono-
brunatny osad
niebieski osad
hydroksysoli
Ni(OH)
2
zielony
osad
CrO
2
-
zielony
roztwór
Mn(OH)
2
biały osad
ZnO
2
2-
bezbarwny
roztwór
AlO
2
-
bezbarwny
roztwór
NH
3
.
H
2
O
Fe(OH)
2
zielony osad
Fe(OH)
3
czerwono-
brunatny osad
niebieski osad
hydroksysoli
Ni(OH)
2
zielony
osad
Cr(OH)
3
szarozielony
osad
Mn(OH)
2
biały osad
Zn(OH)
2
biały osad
Al(OH)
3
biały osad
NH
3
.
H
2
O nadmiar
Fe(OH)
2
zielony osad
Fe(OH)
3
czerwono-
brunatny osad
[Co(NH
3
)
6
]
2+
różowy roztwór
[Ni(NH
3
)
6
]
2+
niebieski roztwór
Cr(OH)
3
szarozielony
osad
Mn(OH)
2
biały osad
[Zn(NH
3
)
6
]
2+
bezbarwny
roztwór
Al(OH)
3
biały osad
H
2
O
2
, pH>7
Fe(OH)
3
czerwono-
brunatny osad
Fe(OH)
3
czerwono-
brunatny osad
Co(OH)
3
czarny osad
Ni(OH)
3
czarny
osad
CrO
4
2-
żółty
roztwór
MnO
2
czarny osad
brak
brak
KMnO
4
, pH<<7
Fe
3+
żółtobrązowy
roztwór
brak
brak
brak
Cr
2
O
7
2-
pomarańczo
wy roztwór
MnO
2
czarny osad
brak
brak
PbO
2
, st. HNO
3
brak
brak
brak
brak
brak
MnO
4
-
różowy roztwór
brak
brak
KSCN
brak
[Fe(SCN)
n
]
3-n
krwistoczerwony
roztwór
[Co(SCN)
4
]
2-
niebieski roztwór
(aceton)
brak
brak
brak
brak
brak
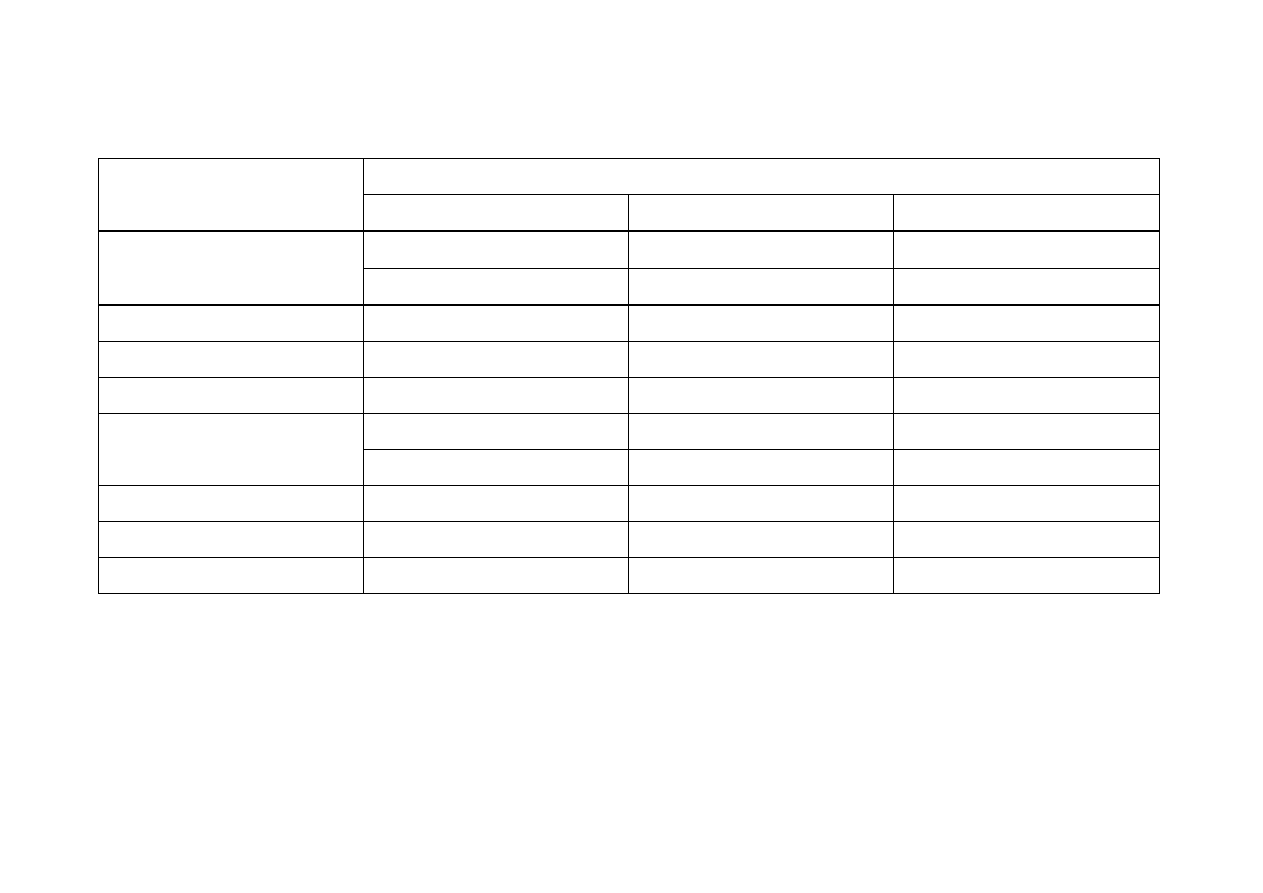
51
Podsumowanie reakcji kationów IV grupy analitycznej wg Freseniusa
Kationy
Dodany odczynnik
Ca
2+
Sr
2+
Ba
2+
CaCO
3
biały osad
SrCO
3
biały osad
BaCO
3
biały osad
Odczynnik grupowy
((NH
4
)
2
CO
3
w środowisku
buforu amonowego)
rozp. w HCl
rozp. w HCl
rozp. w HCl
H
2
SO
4
brak
SrSO
4
biały osad
BaSO
4
biały osad
K
2
CrO
4
pH>7
brak
SrCrO
4
żółty osad
BaCrO
4
żółty osad
K
2
Cr
2
O
7
pH<7
brak
brak
BaCrO
4
żółty osad
CaC
2
O
4
biały osad
SrC
2
O
4
biały osad
BaC
2
O
4
biały osad
(NH
4
)
2
C
2
O
4
nierozp. w CH
3
COOH
rozp. w CH
3
COOH na gorąco
rozp. w CH
3
COOH na gorąco
NaOH
brak
brak
brak
NH
3
.
H
2
O
brak
brak
brak
Analiza płomieniowa
ceglastoczerwony
karminowoczerwony
żółto-zielony
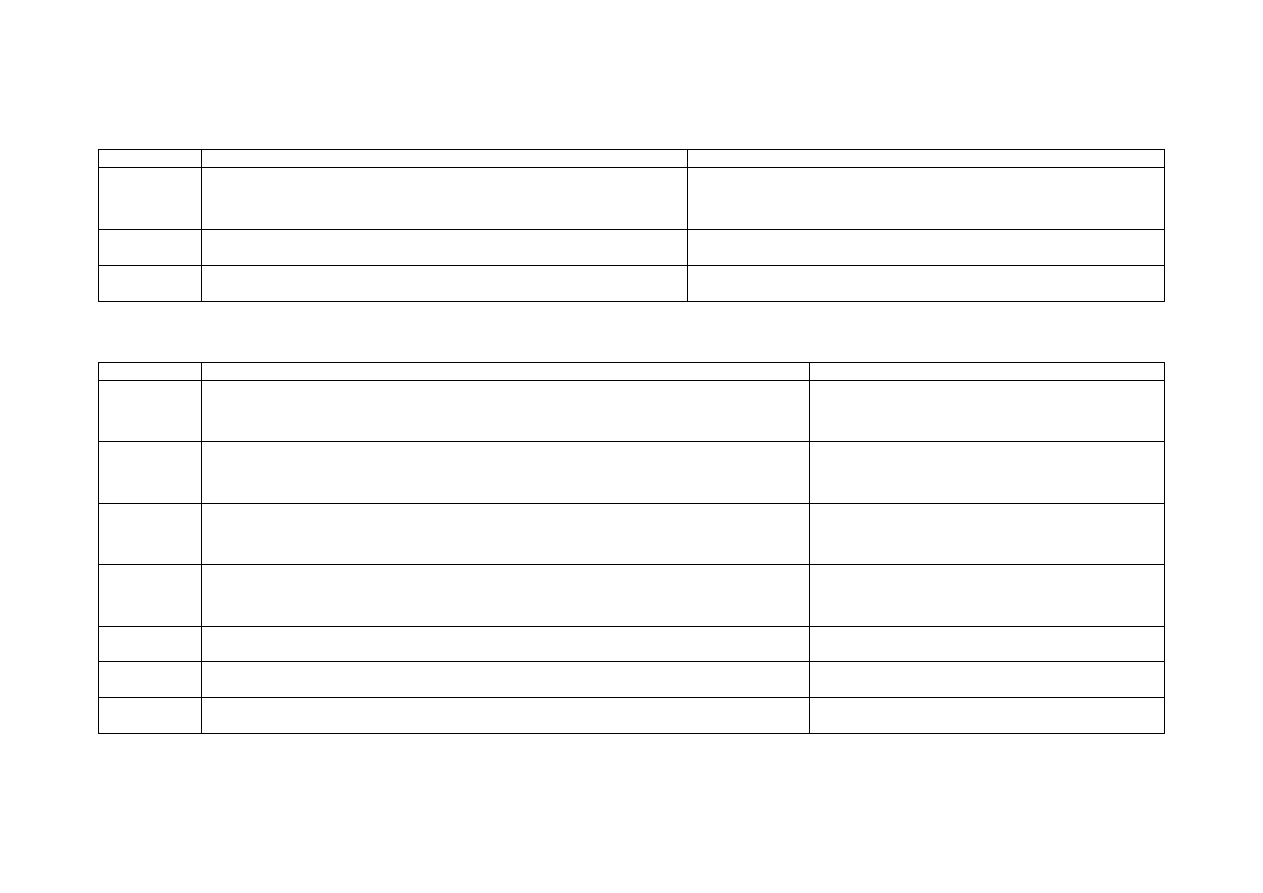
52
Podział anionów na grupy analityczne wg Aleksiejewa
Nr grupy
Odczynniki grupowe: AgNO
3
i BaCl
2
.
Aniony
I
Sole baru trudnorozpuszczalne w wodzie
SO
4
2-
, SO
3
2-
, S
2
O
3
2-
, PO
4
3-
, CO
3
2-
, C
2
O
4
2-
, C
4
H
4
O
6
2-
,
BO
2
-
(B
4
O
7
2-
), CrO
4
2-
, Cr
2
O
7
2-
, F
-
, SiO
3
2-
, AsO
4
3-
, AsO
3
3-
II
Sole srebra(I) trudnorozpuszczalne w wodzie i rozcieńczonym HNO
3
Cl
-
, Br
-
, I
-
, CN
-
, SCN
-
, S
2-
, [Fe(CN)
6
]
4-
, [Fe(CN)
6
]
3-
III
Sole baru i srebra(I) rozpuszczalne w wodzie
NO
3
-
, NO
2
-
, ClO
3
-
, CH
3
COO
-
, MnO
4
-
Podział anionów na grupy analityczne wg Bunsena
Nr grupy
Odczynniki grupowe: AgNO
3
i BaCl
2
.
Aniony
I
Sole srebra(I) nierozpuszczalne w wodzie i kwasie azotowym(V), sole baru rozpuszczalne w
wodzie
Cl
-
, Br
-
, I
-
, CN
-
, SCN
-
,
[Fe(CN)
6
]
4-
, [Fe(CN)
6
]
3-
II
Sole srebra(I) nierozpuszczalne w wodzie, rozpuszczalne w kwasie azotowym(V), sole baru
rozpuszczalne w wodzie
S
2-
, NO
2
-
, CH
3
COO
-
III
Sole srebra(I) białe, rozpuszczalne w kwasie azotowym(V), sole baru trudnorozpuszczalne w
wodzie, rozpuszczalne w kwasie azotowym(V)
SO
3
2-
, CO
3
2-
, C
2
O
4
2-
, C
4
H
4
O
6
2-
, BO
2
-
(B
4
O
7
2-
),
IV
Sole srebra(I) barwne, rozpuszczalne w kwasie azotowym(V), sole baru nierozpuszczalne w
wodzie, rozpuszczalne w kwasie azotowym(V)
S
2
O
3
2-
, PO
4
3-
, CrO
4
2-
, Cr
2
O
7
2-
, AsO
4
3-
, AsO
3
3-
V
Sole srebra(I) i baru rozpuszczalne w wodzie
NO
3
-
, ClO
3
-
, MnO
4
-
VI
Sole srebra(I) rozpuszczalne w wodzie, sole baru nierozpuszczalne w kasie azotowym(V)
SO
4
2-
, F
-
VII
Kwasy nielotne, tworzące sole rozpuszczalne tylko z metalami alkalicznymi
SiO
3
2-
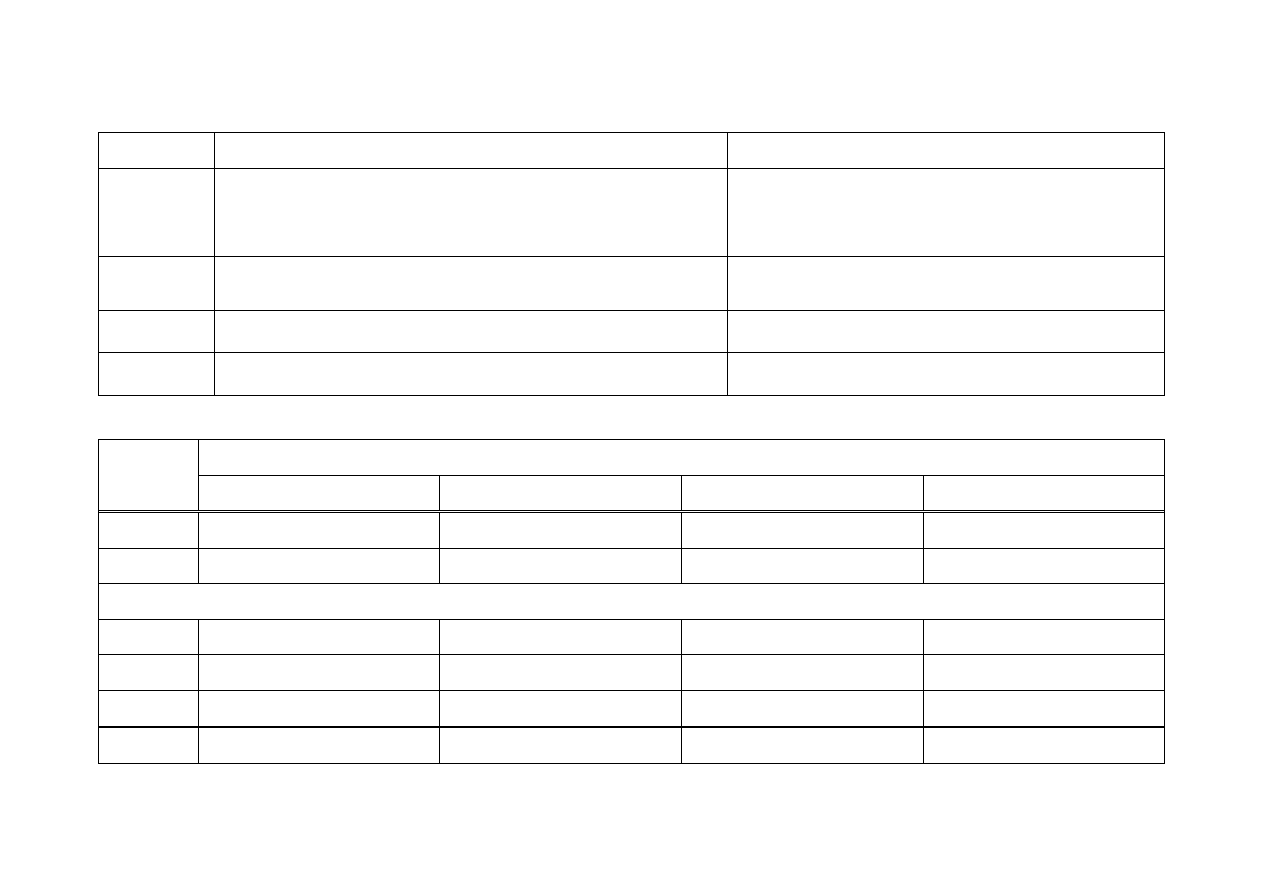
53
Podział anionów na podstawie ich właściwości utleniająco-redukujących (redox)
Grupa
Reakcja
Aniony
utleniacze
z KI w środowisku kwaśnym (rozc.H
2
SO
4
) wydzielają I
2
dający ze skrobią
granatowe zabarwienie
lub z difenyloaminą – granatowe zabarwienie
CrO
4
2-
, Cr
2
O
7
2-
, NO
3
-
, NO
2
-
silne reduktory
z I
2
ze skrobią (granatowe zabarwienie) powodują zanik barwy z utworzeniem
jonów I
-
SO
3
2-
, S
2
O
3
2-
reduktory
odbarwiają KMnO
4
w środowisku kwaśnym (rozc.H
2
SO
4
)
SO
3
2-
, S
2
O
3
2-
, C
2
O
4
2-
, Cl
-
, Br
-
, I
-
, SCN
-
, NO
2
-
obojętne
nie wykazują właściwości redox
SO
4
2-
, PO
4
3-
, CO
3
2-
, CH
3
COO
-
Identyfikacja wydzielonego gazu pod wpływem zakwaszenia roztworu anionu
Wydzielony gaz
Cecha
CO
2
CH
3
COOH
NO
x
SO
2
barwa
brak
brak
brunatna
brak
zapach
brak
octu
duszący
charakterystyczny
Reakcje z papierkiem u wylotu probówki zwilżonym roztworem
Pb
2+
biały
brak
brak
brak
KMnO
4
brak
brak
odbarwienie
odbarwienie
I
2
brak
brak
brak
odbarwienie
WNIOSEK
CO
3
2-
CH
3
COO
-
NO
2
-
SO
3
2-
lub S
2
O
3
2-
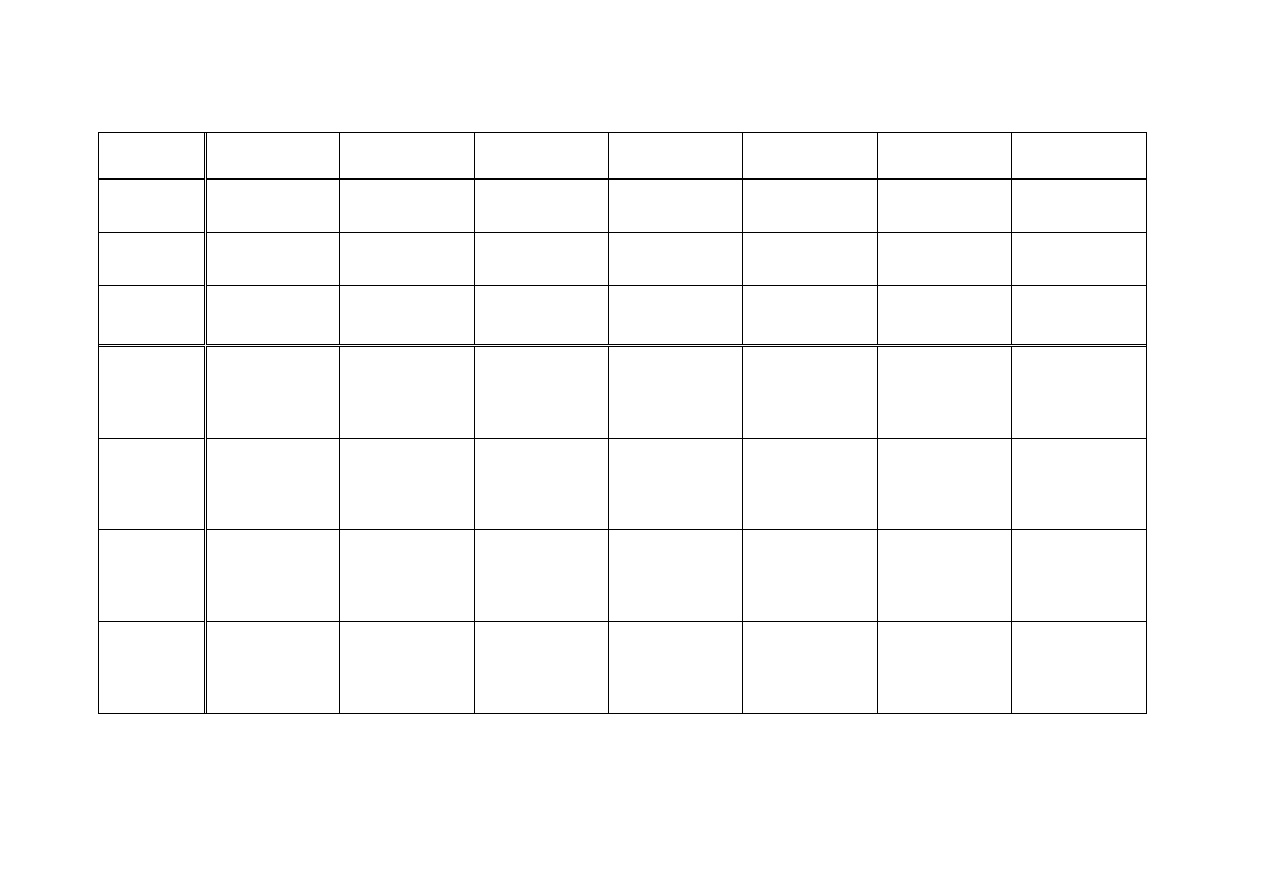
54
Podsumowanie reakcji anionów I grupy wg Aleksiejewa
Odczynnik
SO
4
2-
SO
3
2-
S
2
O
3
2-
PO
4
3-
CO
3
2-
C
2
O
4
2-
CrO
4
2-
/Cr
2
O
7
2-
zakwaszenie
brak
SO
2
↑
SO
2
↑, S↓
brak
CO
2
↑
brak
brak
KMnO
4
/H
+
brak
odbarwienie
odbarwienie
brak
brak
odbarwienie
(na gorąco)
brak
KI/H
+
brak
brak
brak
brak
brak
brak
I
2
Ba
2+
BaSO
4
biały osad
BaSO
3
biały osad
BaS
2
O
3
biały osad
BaHPO
4
biały osad
BaCO
3
biały osad
BaC
2
O
4
biały osad
BaCrO
4
żółty osad
Ag
+
brak (*)
Ag
2
SO
3
biały osad
Ag
2
S
2
O
3
czerniejący osad
Ag
3
PO
4
żółty osad
Ag
2
CO
3
biały osad
Ag
2
C
2
O
4
biały osad
Ag
2
CrO
4
czerwony osad
Ca
2+
brak
CaSO
3
biały osad
brak
CaHPO
4
biały osad
CaCO
3
biały osad
CaC
2
O
4
biały osad
brak
Fe
3+
brak
brak
ciemno-fiołkowa
barwa, zanikająca
[Fe(HPO
4
)]
+
bezbarwny roztwór
Fe(OH)
3
czerwono-brunatny
osad
brak
brak
(*) – osady tworzą się ze stężonych roztworów
55
Podsumowanie reakcji anionów II i III grupy wg Aleksiejewa
Grupa analityczna anionów
II grupa
III grupa
Odczynnik
Cl
-
Br
-
I
-
SCN
-
NO
3
-
NO
2
-
CH
3
COO
-
MnO
4
-
zakwaszenie
brak
brak
brak
brak
brak
NO
x
↑
CH
3
COOH ↑
brak
KMnO
4
/H
+
odbarwienie
(na gorąco)
odbarwienie
odbarwienie
odbarwienie
brak
odbarwienie
brak
brak
KI/H
+
brak
brak
brak
brak
I
2
I
2
brak
I
2
Ba
2+
brak
brak
brak
brak
brak
brak
brak
brak
Ag
+
AgCl
biały osad
AgBr
bladożółty osad
AgI
żółty osad
AgSCN
biały osad
brak
brak (*)
brak (*)
brak
Ca
2+
brak
brak
brak
brak
brak
brak
brak
brak
Fe
3+
brak
brak
I
2
[Fe(SCN)
n
]
3-n
krwisto-
czerwony
roztwór
brak
brak
Fe(CH
3
COO)
3
czerwony
roztwór
brak
(*) – osady tworzą się ze stężonych roztworów
Wyszukiwarka
Podobne podstrony:
Harmonogram laboratorium tzizc 2013
Harmonogram Laboratorium Technologii 2014-2015 (1), SiMR, 2rok, lab technologia, 2014
Harmonogram Laboratorium Technologii 2013 2014
pytania laboratoryjne tzizc 2013
Harmonogram Laboratorium Technologii 2013-2014
Harmonogram ćwiczeń s5 2014 TABL 03 (08 10 14 )
NOM WIMiR harmonogram laboratorium PNM 2010 11
laboratorium terminy 2014 Szk a bio
ELE Harmonogram LabElektronika 2013 2014
Harmonogram laboratorium, Technologia chemiczna, Chemia analityczna, Laboratorium, Meteriały ogólne
Harmonogram egzaminw ZIMA 2014 Nieznany
harmonogram obron 2013-2014, Nauka, budownictwo, żelbet EC przykłądy
harmonogram laboratorium PNM cz II iIII 2012
Harmonogram laboratoriów
Automatyka, Szkoła, Semestr 5, Podstawy Automatyki - laboratoria, zaliczenie 2014
Mechatronika Elektronika Harmonogram Laboratorium
więcej podobnych podstron