
2FI-DI
23.05.2016
grupa L7
Laboratorium: Technologie materiałowe w medycynie
Ćw. nr: 18
Technologia syntezy urotropiny
zespół F
Wiktoria Wojnarowska
Agnieszka Wilczek


1
Cel ćwiczenia
Celem ćwiczenia jest zapoznanie się z technologią otrzymywania urotropiny, substancji
stosowanej w lecznictwie, jako środek bakteriobójczy, w celu odkażania dróg moczowych
oraz zewnętrznie w dermatologii, jako środek przeciwpotowy (stężenie 5 - 25 %), ponieważ
wykazuje działanie hamujące aktywność wydzielniczą gruczołów potowych.
2
Wprowadzenie
Urotropina (heksametylenotetramina, HMTA) – organiczny związek chemiczny, wielo-
pierścieniowa amina trzeciorzędowa. To biały lub żółtawy krystaliczny proszek, ulegający
sublimacji, łatwo rozpuszczalny w wodzie, higroskopijny.
Reakcja otrzymywania urotropiny:
4 NH
3
+ 6 CH
2
O −→ C
6
H
12
N
4
+ 6 H
2
O
Zastosowanie:
w formie tabletek używana jako paliwo do podgrzewania potraw w warunkach po-
lowych (podobnie jak trioksan),
stosowana w przemyśle tworzyw sztucznych jako substrat do produkcji żywic fenolowo-
formaldehydowych (bakelitu),
jest półproduktem do otrzymywania materiałów wybuchowych inicjujących (HMTD
- nadtlenek urotropiny) i kruszących (heksogen, oktogen),
używana również jako inhibitor korozji w kwaśnych kąpielach trawiących i czyszczą-
cych,
urotropina jest stosowana również jako konserwant. Jego numer jako dodatku do
żywności to E 239.
W medycynie:
W lecznictwie stosuje się ją jako środek bakteriobójczy, w celu odkażania dróg moczo-
wych. Urotropina w kwaśnym środowisku moczu hydrolizuje do toksycznego dla drobno-
ustrojów formaldehydu. W celu wzmocnienia działania stosuje się, równocześnie z urotro-
piną, witaminę C (kwas askorbinowy). Działanie przeciwbakteryjne tego leku jest słabe,
ale jego zaletą jest niezdolność bakterii do rozwinięcia oporności. Stosowana obecnie naj-
częściej w postaci tabletek dojelitowych (rozkłada się w żołądku), które zawierają jej sole
z kwasami migdałowym lub hipurowym, gdyż w moczu reszty kwasowe ulegają odłączeniu
i zakwaszają środowisko, co warunkuje działanie urotropiny. Urotropina jest też stosowa-
na zewnętrznie w dermatologii jako środek przeciwpotowy (stężenie 5 - 25%), ponieważ
wykazuje działanie hamujące aktywność wydzielniczą gruczołów potowych.
3
3
Przebieg ćwiczenia
Na początku zmontowałyśmy układ składający się z kolby okrągłodennej trójszyjnej
o pojemności 250 ml, umieszczonej w łaźni chłodzącej (krystalizatorze z lodem i wo-
dą), mieszadła magnetycznego, termometru i wkraplacza. Odmierzyłyśmy 50 ml formali-
ny i wlałyśmy do kolby. Następnie odmierzyłyśmy za pomocą cylindra 43 ml amoniaku,
przelałyśmy do wkraplacza i powoli wkraplałyśmy, utrzymując temperaturę 10 − 15
o
C.
Po zakończeniu wkraplania przeniosłyśmy mieszaninę reakcyjną do kolby okrągłodennej
(jednoszyjnej) o pojemności 250 ml i odparowałyśmy wodę na wyparce obrotowej prawie
do sucha. Do pozostałego w kolbie osadu dodałyśmy odmierzoną wcześniej ilość etanolu
(60 ml). Rozpuściłyśmy to na wyparce nie podłączając pompki wodnej i ponownie za-
tężyłyśmy. Następnie schłodziłyśmy krystalizującą mieszaninę w wodzie z lodem. Osad
odsączyłyśmy na lejku B¨
uchnera i pozostawiłyśmy do wysuszenia. Produkt zważyłyśmy,
4
Opracowanie wyników
Przed wysuszeniem produkt ważył 10, 39 g.
Po wysuszeniu ważył 9, 35 g, czyli tyle produktu otrzymałyśmy.
Licząc wydajność reakcji należy zawsze:
przeliczyć wszystkie ilości związków na gramy lub mole, należy jednak trzymać się
jednej wybranej wybranej jednostki to znaczy abo wszystko przeliczyć na gramy
albo mole, nie wolno mieszać jednostek,
jeżeli w reakcji bierze udział więcej niż jeden substrat należy sprawdzić, który z
substratów występuje w niedomiarze.
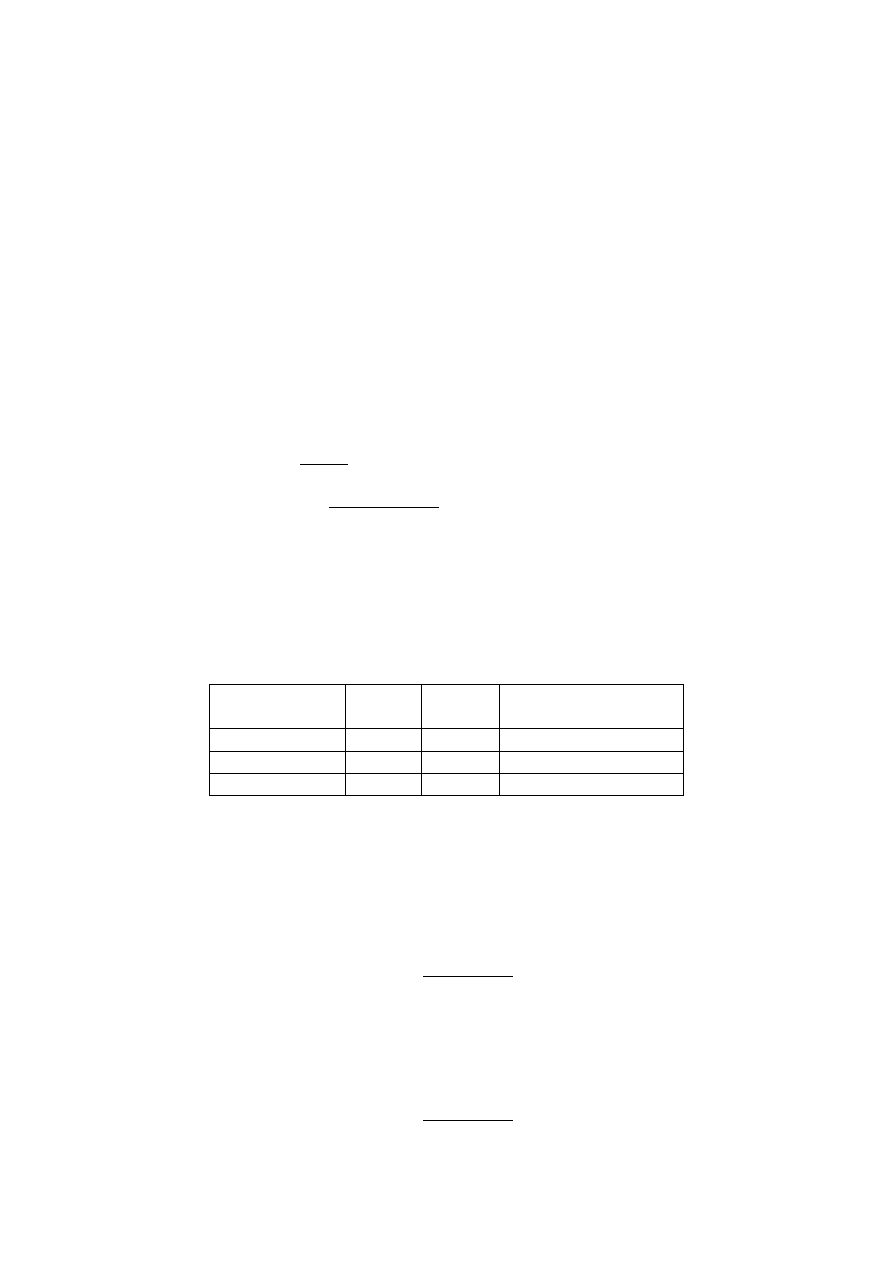
Do obliczeń wykorzystałyśmy poniższe dane:
Nazwa związku
M
Gęstość
Ilość substancji użyta
[g/mol]
[g/cm
3
]
[cm
3
]
formalina
30,031
1,017
50
amoniak
17,03
0,91
43
urotropin
140,186
1,33
-
Najpierw przeliczono wszystkie ilości związków na gramy.
Formalina
1, 017 g − 1 cm
3
x − 50 cm
3
x = 50, 85 g
Amoniak
0, 91 − 1 cm
3
x − 43 cm
3
x = 39, 13 g
Równanie reakcji otrzymywania urotropiny ma postać:
4 NH
3
+ 6 CH
2
O −→ C
6
H
12
N
4
+ 6 H
2
O
4

W reakcji biorą udział dwa substraty, dlatego konieczne jest obliczenie, który z sub-
stratów występuje w niedomiarze, ponieważ ilość tego substratu decyduje o wydajności
reakcji.
Z równania stechiometrycznego reakcji wiadomo, że 6 moli formaliny reaguje z 4 mo-
lami amoniaku.
Także zgodnie z równaniem stechiometrycznym:
6 · 30, 031 g formaliny − 4 · 17, 03 g amoniaku
x g formaliny − 39, 13 g amoniaku
180, 186 g formaliny − 68, 12 g amoniaku
x g formaliny − 39, 13 g amoniaku
x = 103, 50 g formaliny
Wynika z tego, że powinno zostać użyte 103, 50 g formaliny, a użyto tylko 50, 85 g.
Formalina jest substancją, której użyto w niedomiarze wobec tego niecały amoniak uległ
przemianie.
Wydajność reakcji liczy się względem substratu użytego w niedomiarze, czyli w tym
wypadku względem formaliny.
Z równania reakcji wynika, że z 6 moli formaliny powstaje 1 mol urotropiny, czyli:
6 · 30, 031 g formaliny − 140, 186 g urotropiny
50, 85 g formaliny − x g urotropiny
x = 39, 641 g urotropiny
Tyle urotropiny, powinno teoretycznie powstać. Gdyby tyle powstało wydajność pro-
cesu otrzymywania urotropiny wyniosłaby 100%.
Wydajność oblicza się ze wzoru:
W =
m
p
m
t
· 100%
gdzie:
m
p
- masa produktu otrzymana w wyniku przeprowadzenia reakcji,
m
t
- masa tego produktu wynikająca z równania reakcji.
Urotropina
m
p
m
t
[g]
[g]
9,35
39,641
W =
9, 35
39, 461
· 100%
W = 23, 69%
5

5
Wnioski
Wydajność przeprowadzonego procesu wyniosła 23, 69%. Przed obliczaniem wydaj-
ności trzeba zawsze przeliczyć wszystkie ilości związków na gramy lub na mole. Należy
także sprawdzić, który substrat występuje w niedomiarze, jeśli jest więcej niż jeden. W
tym przypadku w niedomiarze została użyta formalina i to względem niej zostało obli-
czone ile urotropiny powinno powstać. Ze względu na to, że użyto zbyt mało formaliny
niecały amoniak uległ przemianie. Gdyby użyto więcej formaliny, przereagowałoby więcej
amoniaku i powstałoby więcej urotropiny. Jednak nie wiadomo czy wzrosłaby wydajność,
bo wzrosłaby także ilość urotropiny, która powinna powstać teoretycznie.
6
Wyszukiwarka
Podobne podstrony:
SPRAWOZDANIE Z CWICZENIA NR 4, Technologia zywnosci, semestr III, chemia zywnosci
Ćwiczenia usprawniające analizę i syntezę wzrokową oraz orientację przestrzenną(1), Ćwiczenia uspraw
ćwiczenie 18 sprawko
FINANSE PRZEDSIĘBIORSTW ĆWICZENIA 4 (18 11 2012)
Ćwiczenie nr 3, Technologia chemiczna, Projekt technologiczny, Projekty, fwd pd , projekt technologi
CWICZENIA USPRAWNIAJĄCE ANALIZĘ I SYNTEZĘ SŁUCHOWĄ
Cwiczenie 18 z 1 2 i
ćwiczenia rachunek prawdopodobieństwa i statystyka, Z Ćwiczenia 18.05.2008
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
Ćwiczenie 18, Wyznaczanie stosunku Cp/Cv dla powietrza metodą Clémenta-Desormesa
BANKOWOŚĆ ĆWICZENIA 2 (18 11 2012)
17 18 Technologie obróbki cieplnej metali
17 18 Technologie obrobki cieplnej metali
Ćwiczenia 18.12.2010 ( sobota) J. Dobrowolski, UJK.Fizjoterapia, - Notatki - Rok I -, Fizjoterapia O
Ćwiczenie1 18, TiR UAM II ROK, Informatyka
ĆWICZENIA USPRAWNIAJĄCE ANALIZĘ I SYNTEZĘ SŁUCHOWĄ, MOWA CZYTANIE LITERY
Ćwiczenie 18 TWN, POLITECHNIKA LUBELSKA
cwiczenie 34, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, chemia fizyczna
Reforma, Studia (europeistyka), nauka o polityce, Teoria polityki, ćwiczenia 18
więcej podobnych podstron