Biochemiczne podłoże chorób - Przewlekła białaczka szpikowa
Opis przypadku klinicznego:
54 letni mężczyzna zgłosił się do przychodni z powodu osłabienia oraz lekkiej duszności
występującej w trakcie wysiłku. Dodatkowo skarżył się na utratę apetytu oraz uczucie
pełności w jamie brzusznej zlokalizowane przede wszystkim w jej górnym lewym
kwadrancie. Powyższe objawy występowały od około 2 miesięcy.
W badaniu fizykalnym stwierdzono powiększoną, bolesną uciskowo śledzionę badalną około
7 cm poniżej lewego łuku żebrowego.
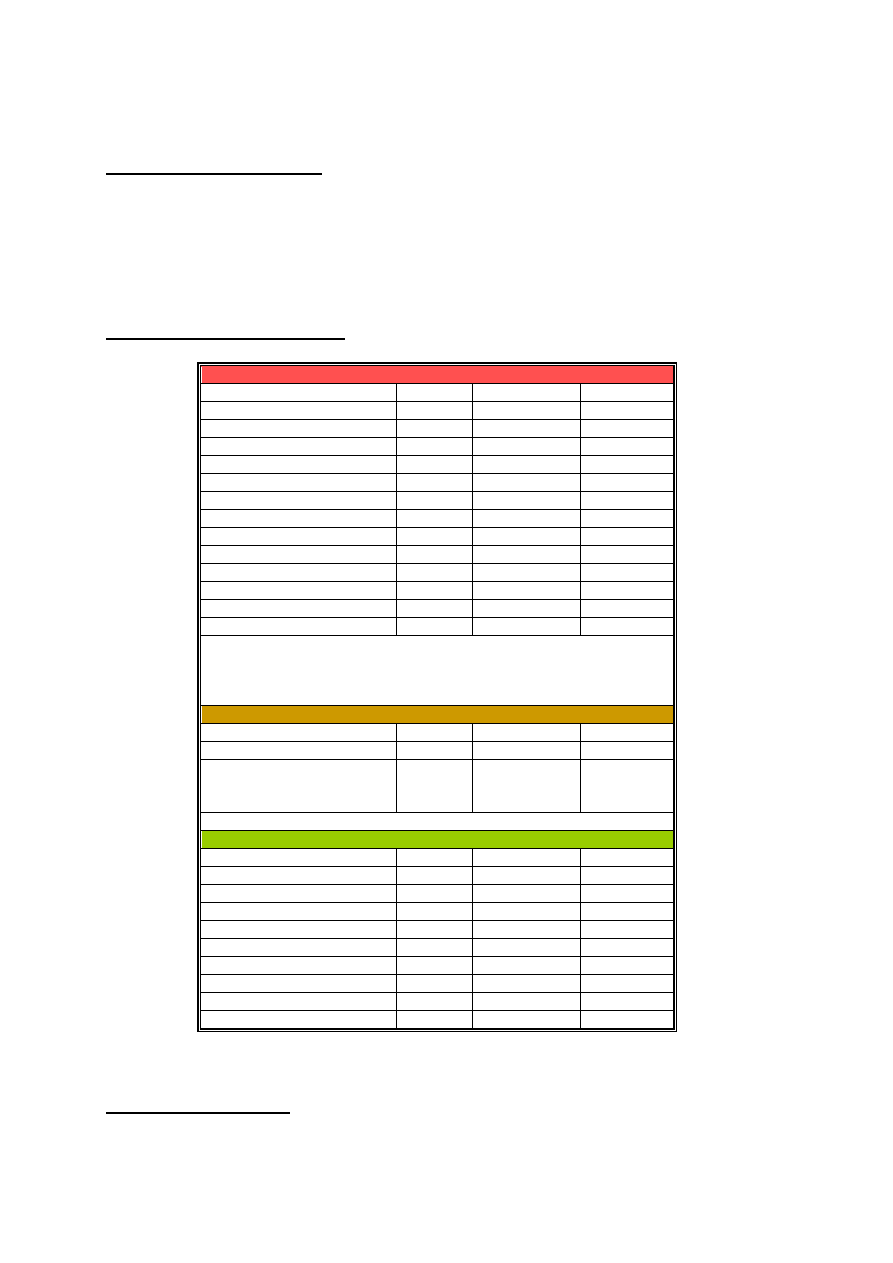
Wyniki badań laboratoryjnych :
Morfologia z rozmazem krwi obwodowej
Parametr
Wartość
Zakres normy Jednostka
Leukocyty (WBC)
60.0
4.0-10.0
10
3
/µl
Erytrocyty (RBC)
5.05
3.5 – 5.4
10
6
/µl
Hemoglobina
14,5
12.0-16.0
g/dl
Hematokryt
40
37 - 47
%
MCV
84.3
80 - 92
fl
Płytki
555 .0
150 - 400
10
3
/µl
Neutrofile
55
60-70
%
- Pałeczki
5
3-5
%
- Segmenty
50
57-65
%
Limfocyty
20
20-40
%
Eozynofile
5
2-4
%
Bazofile
5
0-1
%
Monocyty
4
4-8
%
Inne :
2 Mieloblasty, 4 Promielocyty 4 Mielocyty 1 Metamielocyt,
Norma : Brak komórek prekursorowych (do etapu rozwojowego mielocyta)
w prawidłowym rozmazie krwi
Biopsja aspiracyjna szpiku kostnego (wybrane)
Mieloblasty
5
0.5-3
%
Promielocyty
6
0.5-5
%
Linia
granulopoetyczna/erytropoety
czna
20:1
3:1 – 4:1
Inne : Liczne megakariocyty, Norma - pojedyncze w preparacie
Badania biochemiczne (wybrane)
CRP
5
< 0.5
mg/ml
AlAT
142
< 40
U/l
AspAT
143
< 40
U/l
GGTP*
160
<35
U/l
LDH
800
<480
U/l
Bilirubina całkowita
30
< 18
µmol/l
Białko całkowite
7.7
6.0-8.5
g/dl
Sód
135
135 - 145
mmol/l
Potas
4.3
3.5-5.5
mmol/l
FAG*
10
30-80
Pkt
*GGTP – Gamma-glutamylotranspeptydaza, marker zastoju w drogach żółciowych.
*FAG - fosfataza alkaliczna granulocytów
Badanie cytogenetyczne :
Obecność chromosomu Filadelfia (translokacja fragmentu genu BCR z chromosomu 22 do
locus protoonkogenu c-ABL w chromosomie 9) [Rys 1]
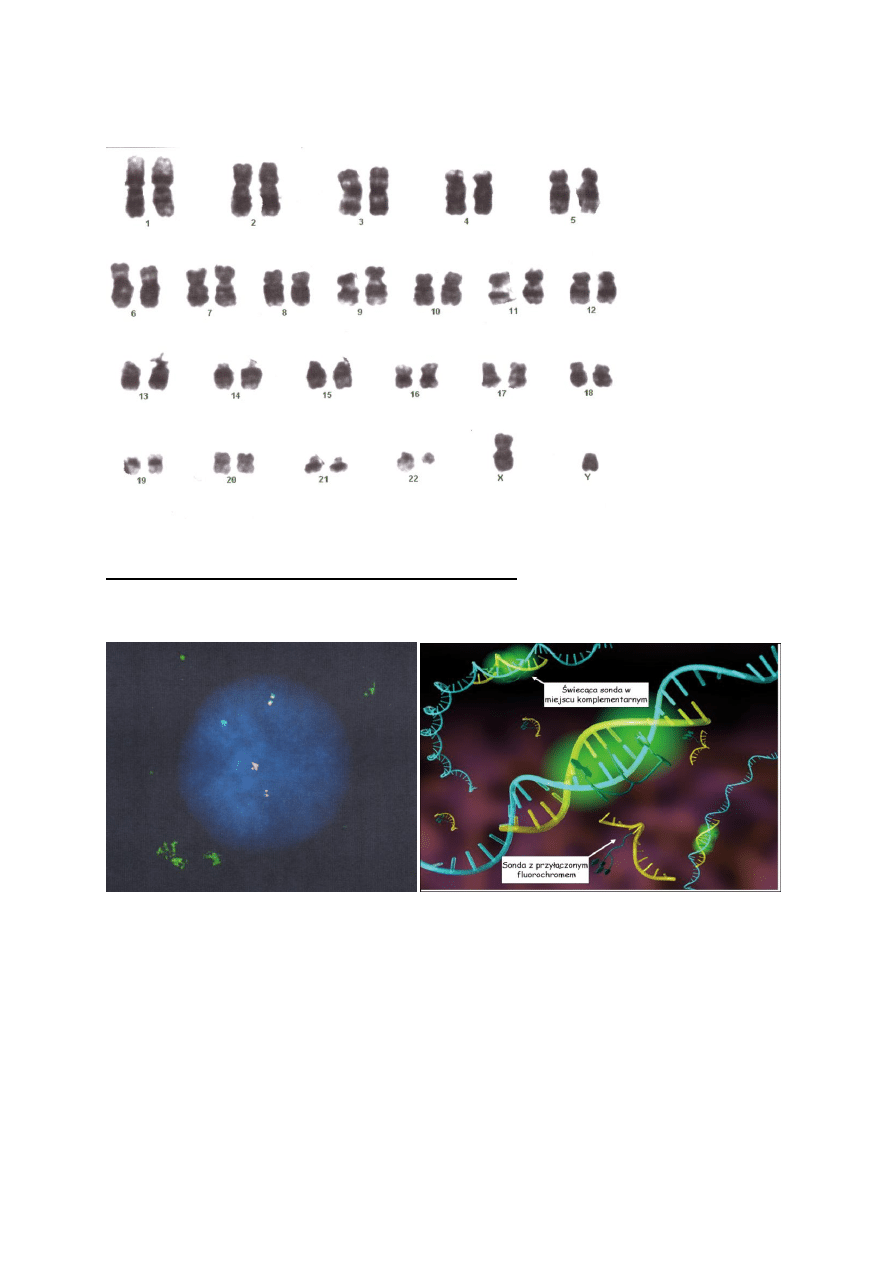
Rys 1. Kariogram pacjenta.
Badania dodatkowe metodami genetyki molekularnej :
Obecność genu fuzyjnego BCR/ABL w reakcji RT-PCR oraz metodą FISH* [Rys 2]
Rys 2. Wynik badania FISH u pacjenta, widoczny dwukolorowy sygnał z miejsca fuzji. Po
prawej stronie schemat obrazujący hybrydyzacje podstawionych fluorochromem sond do
poszukiwanych miejsc DNA.
*Metoda FISH (fluorescent in situ hybridization) czyli fluorescencyjna hybrydyzacja in situ jest alternatywną do
metody PCR techniką wykrywania genów fuzyjnych (w przypadku CML genu BCR/ABL). Polega na łączeniu
komplementarnych (czyli hybrydyzacji) znakowanych fluorescencyjnie (rodamina, fluoresceina) sond DNA do
poszukiwanego/badanego odcinka chromosomu. Zaletą techniki jest możliwość wykorzystania preparatów
chromosomów metafazowych lub w sytuacji trudności w uzyskaniu komórek w metafazie – preparatów jąder
interfazowych, co niekiedy jest łatwiejsze technicznie. Obecnie istnieje wiele komercyjnie dostępnych sond
służących do wykrywania poszukiwanych genów, strategie ich uwidaczniania w preparatach mogą być różne. W
dwukolorowej FISH w oparciu o fuzję sygnałów (dual color-fusion FISH) dwie sondy wybarwione odmiennie
dają wspólny sygnał w miejscu fuzji lub jak w przypadku strategii dwukolorowej FISH z rozszczepieniem

sygnału (dual color-split signal FISH) – sygnał fuzyjny emitowany jest w komórkach prawidłowych, natomiast
jego rozszczepienie pojawia się w wyniku rozdzielenia genu na skutek mutacji. Po utrwaleniu materiału, sonda
nanoszona jest na preparat, następnie próbka poddawana jest denaturacji w podwyższonej temperaturze. Po
ochłodzeniu następuje spontaniczna hybrydyzacja. Preparat ogląda się w mikroskopie fluorescencyjnym.
Badanie histopatologiczne szpiku kostnego (trepanobiopsja)
Wzrost komórkowości szpiku kostnego, spadek ilości komórek prekursorowych linii
erytrocyta, wzrost ilości komórek blastycznych do około 10%, anomalie megakariocytów,
włóknienie zrębu szpiku kostnego
Przebieg leczenia
U chorego rozpoznano przewlekłą białaczkę szpikową i rozpoczęto leczenie mające na celu
zmniejszenie ilości białych krwinek przy użyciu hydroksymocznika
1)
. Jednocześnie w celu
zapobieżenia powikłaniom związanym z rozpadem dużej ilości komórek białaczkowych (tzw.
zespół lizy guza - do którego biochemicznego obrazu należą : zaburzenia elektrolitowe, duże
stężenie produktów degradacji DNA i RNA) jednocześnie podawano allopurinol
2)
.
Następowo wdrożono właściwą terapię lekiem o nazwie imatinib
3)
, który jest
drobnocząsteczkowym inhibitorem onkogennej kinazy tyrozynowej BCR-ABL.
Pacjent pod wpływem tego leczenia poczuł się lepiej. Badania cytogenetyczne wskazywały na
remisję (ustąpienie objawów klinicznych i laboratoryjnych choroby). Niestety po kilku
miesiącach mimo podawania leku nastąpiła wznowa procesu nowotworowego, chorego
przyjęto na oddział hematologiczny i rozpoczęto intensywniejsze leczenie.
Komentarz
Białaczki to choroby układu krwiotwórczego charakteryzujące się akumulacją
nieprawidłowych komórek („klonu komórek białaczkowych”) w szpiku kostnym. Komórki te
wypierają prawidłowe linie krwiotwórcze a także przedostają się do krwi obwodowej i
naciekają narządy. Towarzyszy im na ogół zaawansowana niestabilność genomu. Przejawia
się to występowaniem licznych zaburzeń strukturalnych chromosomów. Są to mutacje
punktowe a także złożone aberracje chromosomalne (delecje, insercje, translokacje). W
efekcie translokacji powstają geny fuzyjne, które po transkrypcji i translacji produkują
nieprawidłowe białka fuzyjne. Wykrywanie takich genów znalazło zastosowanie w
diagnostyce molekularnej białaczek oraz niektórych innych nowotworów. W komórkach, w
których obecne są geny fuzyjne dochodzi do zakłócenia istotnych procesów takich jak
regulacja ekspresji genów, transdukcja sygnałów, apoptoza, naprawa DNA, adhezja.
Zaburzenia tych procesów są molekularnymi podstawami transformacji nowotworowej.
Fosforylacja jest powszechnym sposobem regulacji aktywności białek w ustroju. Około 30%
z nich podlega modyfikacji na tej drodze, a około 2% genomu koduje kinazy białkowe (tzw.
kinom). W zależności od tego, jaka reszta aminokwasowa w białku jest akceptorem fosforanu
wyróżnia się kinazy serynowo-treoninowe (np PKA, PKB, PKC, MAP, CaM-kinazy, kinazy
zależne od cyklin) oraz kinazy tyrozynowe.
W regulacji transdukcji sygnałów komórkowych biorą udział dwa rodzaje kinaz
tyrozynowych [Rys. 3]: receptorowe (np.: receptory dla PDGF, IGF-1) oraz
cytoplazmatyczne (cABL, rodzina kinaz SRC, JAK).
Pierwsze z nich zakotwiczone są w błonie komórkowej dzięki obecności domeny
hydrofobowej. Odbieranie sygnału jest zapoczątkowane połączeniem liganda z domeną
zewnątrzkomórkową co powoduje dimeryzację receptora. Następnymi etapami są aktywacja
domen cytoplazmatycznych i autofosforylacja receptora.
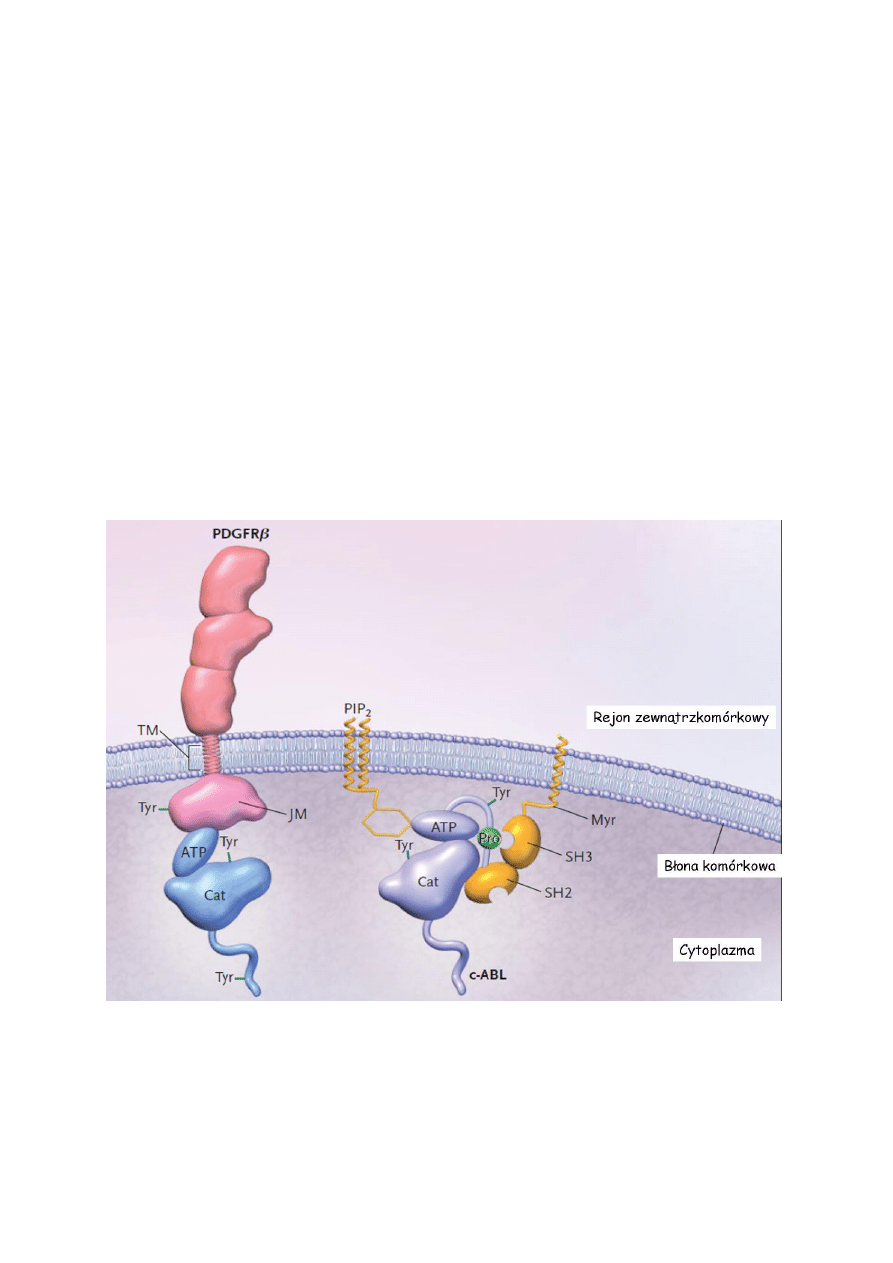
Wśród kinaz cytoplazmatycznych spotyka się białka związane z aktywnością receptorową
oraz kinazy wolne. Cechą wspólną kinaz tyrozynowych jest obecność domeny katalitycznej
wiążącej ATP oraz posiadającej miejsce wiązania substratu. Brak aktywności domeny
kinazowej w nieaktywnych receptorowych kinazach tyrozynowych wynika często z
wepchnięcia reszty tyrozynowej do szczeliny domeny katalitycznej oraz na innych
hamujących
międzydomenowych
oddziaływaniach.
Nieaktywne,
prawidłowe
cytoplazmatyczne białko c-ABL jest połączone z błoną komórkową przez hydrofobowy
łańcuch mirystynianu a brak aktywności kinazy wynika dodatkowo z interakcji domeny
katalitycznej z błonowym 4,5-bisfosforanem fosfatydyloinozytolu oraz proliną własnego
łańcucha polipeptydowego, która wiąże integralną (regulatorową domenę SH3.
Struktura i aktywność kinaz tyrozynowych często związane są z występowaniem domen SH2,
SH3 (Src-homology, homologiczne do domen białek src) (Rys 4). Są to struktury
przypominające konformacją domeny odkryte w białkach nowotworowych (v-Src)
produkowanych przez mięsaki (sarcoma). Ugrupowania te posiadają duże powinowactwo do
fosfotyrozyny. Występują one w wolnych białkach regulatorowych wiążących się z
receptorami o aktywności kinaz tyrozynowych biorąc następnie udział w przekazywaniu
sygnału (białka przekazujące sygnał zawierające domenę SH2, SH2 domain containing signal
proteins np. c-SRC) lub są one (jak w wypadku białka c-ABL) integralnym fragmentem
białek o aktywności kinazy tyrozynowej.
Rys 3. Nieaktywna postać receptorowej (PDGFR – receptor płytkowego czynnika wzrostu)
oraz cytoplazmatycznej (c-ABL) formy kinaz tyrozynowych. Domena katalityczna (Cat) i
wiążąca ATP w formie nieaktywnej. Widoczna centralna reszta tyrozyny blokująca szczelinę
aktywną (Na podstawie D. Krause, N Eng J Med. 2005)
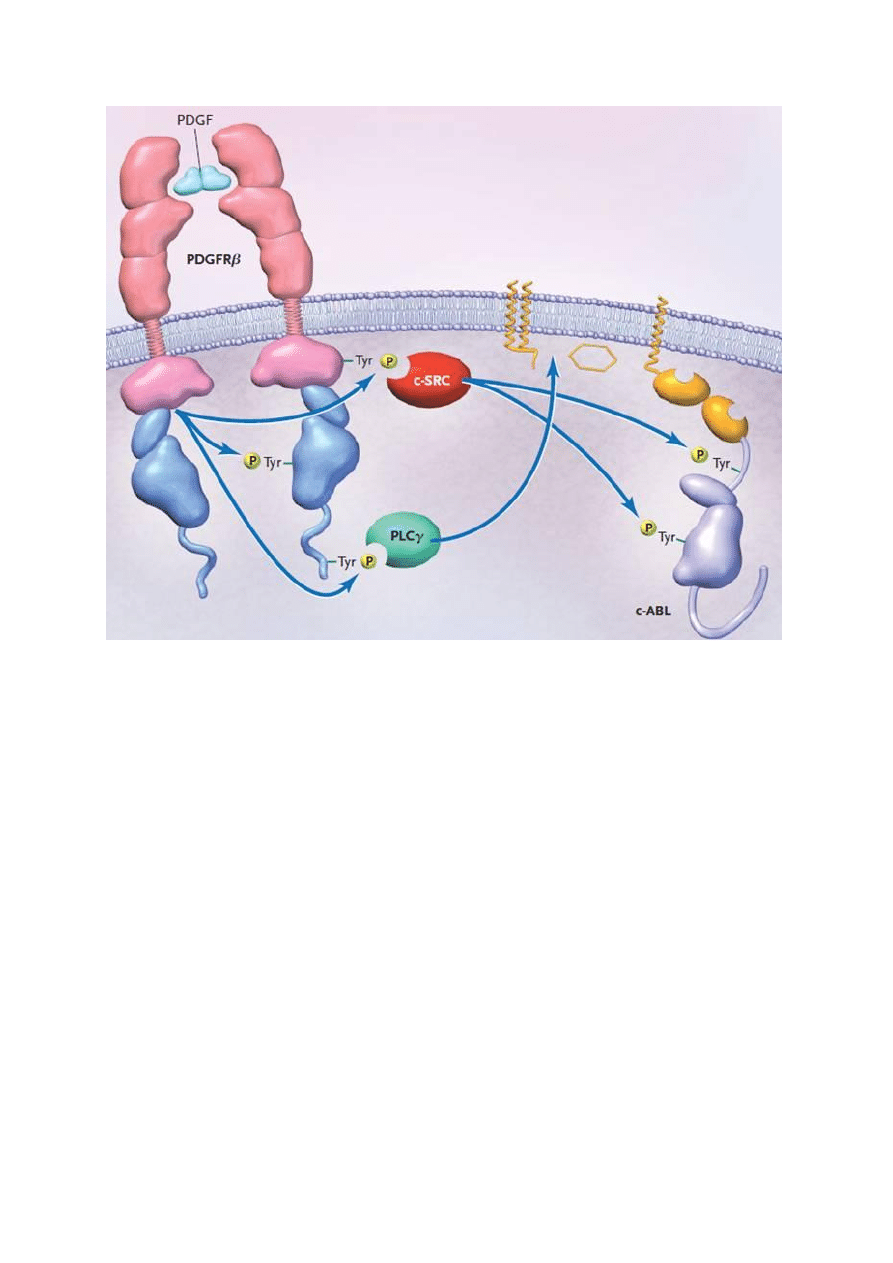
Rys 4. Aktywacja receptorowej oraz cytoplazmatycznej formy kinaz tyrozynowych.
Widoczna zmiana konformacji domeny katalitycznej następująca po pojawieniu się
fosfotyrozyn oraz interakcja z białkami posiadającymi motyw strukturalny SH (c-SRC). (Na
podstawie D. Krause, N Eng J Med. 2005)
Mechanizm onkogenezy przy udziale białka fuzyjnego BCR-ABL jest dość dobrze poznany.
Polega on na konstytutywnej, nie podlegającej regulacji zwrotnej, aktywności kinazy
tyrozynowej. (W prawidłowych komórkach aktywność fosforylacyjna kinaz tyrozynowych
jest kontrolowana przez fosfatazy tyrozynowe.) Nadmierna aktywność tego białka prowadzi
poprzez przedstawione na [rys 5] szlaki do proliferacji, unieśmiertelnienia, zmniejszenia
adhezji do podścieliska i zwiększonej ruchliwości komórek. Są to cechy odpowiedzialne za
rozprzestrzenianie klonu nieprawidłowych komórek w ustroju. Mimo skomplikowania
przekaźnictwa w obrębie kaskady sygnalnej kinazy BCR-ABL, można posługując się
rysunkiem wyodrębnić podrzędnie aktywowane etapy obejmujące znane z kursu biochemii
białka i szlaki : Ras, bcl-2, MAPK, JAK/STAT. W odróżnieniu od naturalnych mechanizmów
regulacji tych ścieżek obecność aktywnego fuzyjnego BCR-ABL może działać na nie
odmiennie. Np. w szlaku JAK/STAT, BCR-ABL może bezpośrednio wpływać na czynniki
STAT1 i STAT5, bez uprzedniej fosforylacji kinaz JAK. W konsekwencji uniezależnia to
komórkę od obecności czynników wzrostu. Dodatkowo tego typu produkt fuzyjny występuje i
jest aktywny w sposób nadmierny w nietypowym dla siebie kompartmencie komórkowym –
cytoplazmie. Ingerencja w przekazywanie sygnału przez kinazy tyrozynowe jest nowym i
często skutecznym celem terapii wielu, nie tylko hematologicznych, chorób nowotworowych.
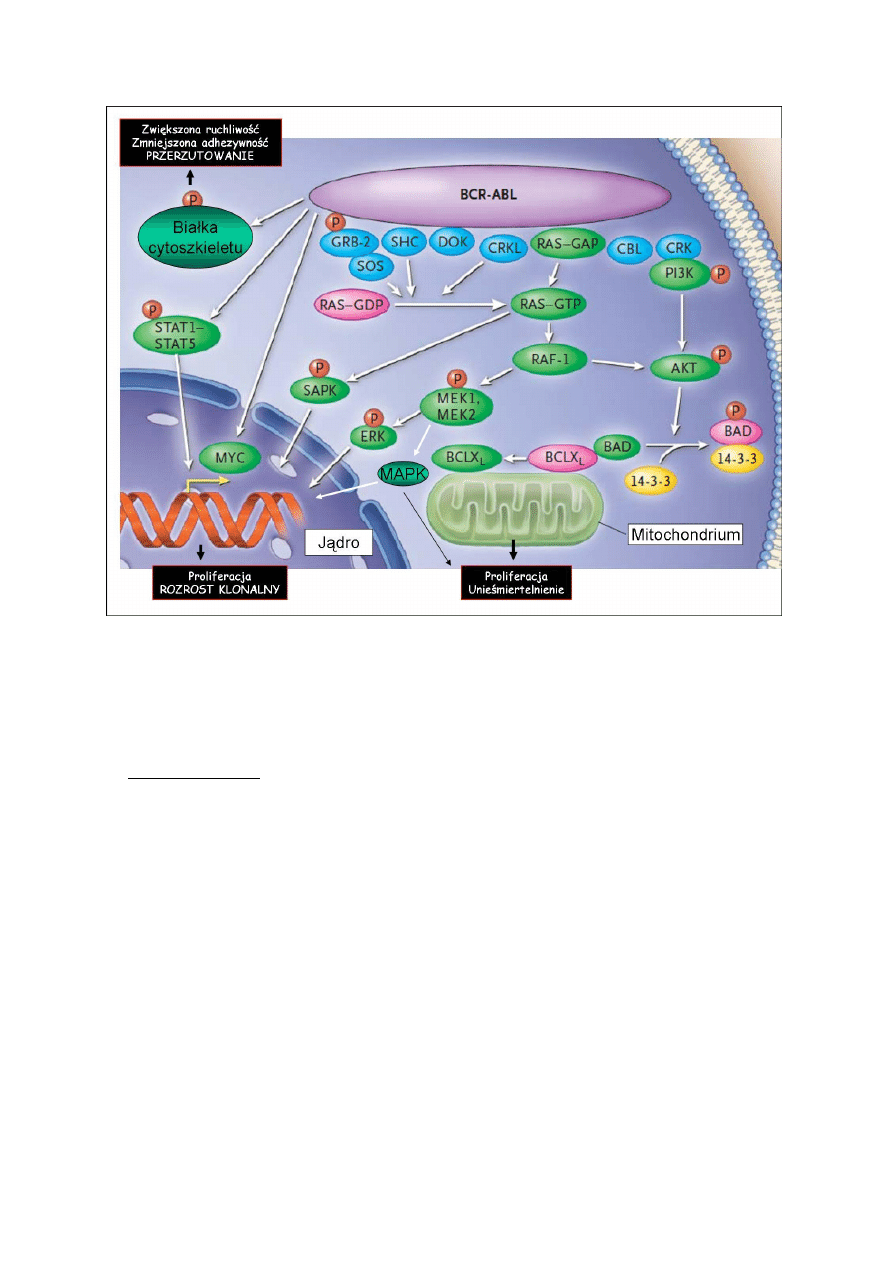
Rys 3. Szlaki wewnątrzkomórkowe aktywowane w wyniku obecności białka fuzyjnego BCR-
ABL. (Wg J. Goldman, N Engl J Med 2003, zmodyfikowano)
Mechanizm działania leków
1)
Hydroksymocznik [Rys 6] jest lekiem przeciwnowotworowym stosowanym od lat
sześćdziesiątych w chemioterapii a od niedawna w leczeniu anemii sierpowatokrwinkowej,
łuszczycy i eksperymentalnie w politerapii zakażenia HIV. Podstawowym mechanizmem jego
działania jest zahamowanie aktywności białkowego enzymatycznego kompleksu reduktazy
rybonukleotydów. W strategii katalitycznej tego enzymu istotną rolę odgrywa wyjątkowy
rodnik tyrozylowy stabilizowany przez dwa niezwiązane z układem hemowym atomy Fe
3+
w
podjednostce R2. Hydroksymocznik tworzy w ustroju rodnik (nitroksylowy), który
wewnątrzkomórkowo bezpośrednio „wygasza/dezaktywuje” rodnik tyrozylowy centrum
aktywnego. Uniemożliwia to prawidłowe działanie tego enzymu. Możliwe jest również
toksyczne działanie innych form wolnorodnikowych powstających na skutek przemian
hydroksymocznika np •NO, na struktury i procesy komórkowe (np naprawę DNA).
Inaktywacja reduktazy rybonukleotydów prowadzi do zahamowania syntezy DNA w wyniku
spadku podaży dNTP i w rezultacie śmierci komórki.
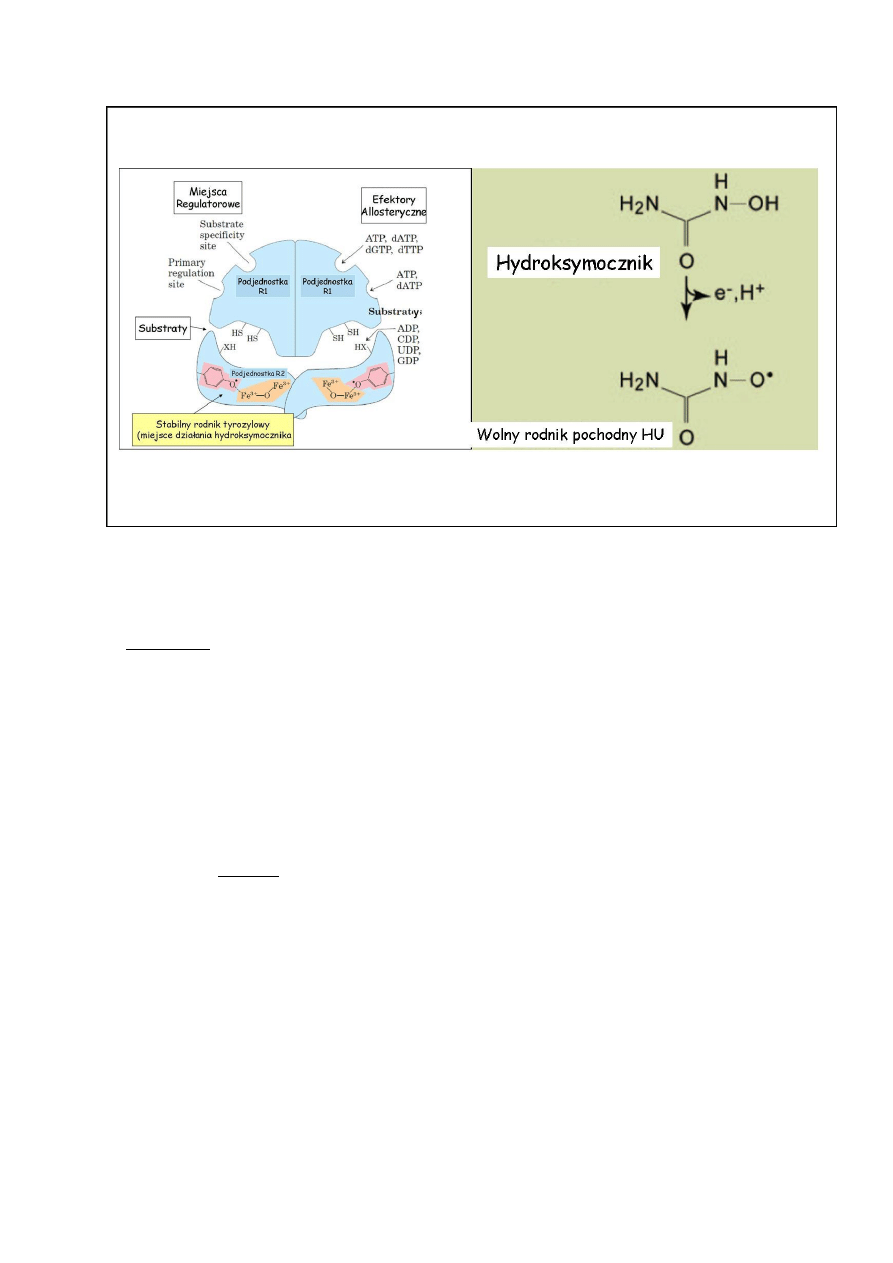
Rys 7. Schemat reduktazy rybonukleotydów (na podstawie podręcznika biochemii
Lehningera), oraz wzór strukturalny mocznika i jego produktu wolnorodnikowego.
2)
Allopurinol jest lekiem obniżającym stężenie kwasu moczowego w surowicy. Jego
mechanizm działania polega na samobójczym hamowaniu oksydazy ksantynowej. Produkt
utleniania allopurinolu (oksypurynol) tworzy trwały kompleks z centrum katalitycznym
enzymu zawierającym układ molibdenowo-siarkowy. W rezultacie dochodzi do wydalania
produktów rozpadu puryn (hipoksantyny i ksantyny), które nawet w podwyższonym stężeniu
nie precypitują i nie tworzą kryształów. Dodatkowo działanie allopurinolu wpływa na spadek
produkcji puryn de novo. Pobudzenie szlaku oszczędzającego (substratami są hipoksantyna i
ksantyna) powoduje obniżenie stężenia PRPP, co prowadzi do zmniejszenia aktywności
amidotransferazy Glutamina:PRPP
3)
Małocząsteczkowy inhibitor kinazy tyrozynowej BCR-ABL (STI Signal transduction
inhibitor 571, Imatinib) przypomina strukturą cząsteczkę ATP. Stwierdzono, że inhibitor
wiąże się preferencyjnie z nieaktywną formą kinazy, zapobiegając przez to jej
autofosforylacji i aktywacji. W efekcie blokuje to przekazywanie sygnałów w komórkach
zależnych od kinazy BCR-ABL. Kinazy w formie aktywnej są podobne strukturalnie, ale
wykazują odmienność konformacji w formie nieaktywnej. Różnice te dotyczą przede
wszystkim lokalizacji pętli aktywacyjnej.
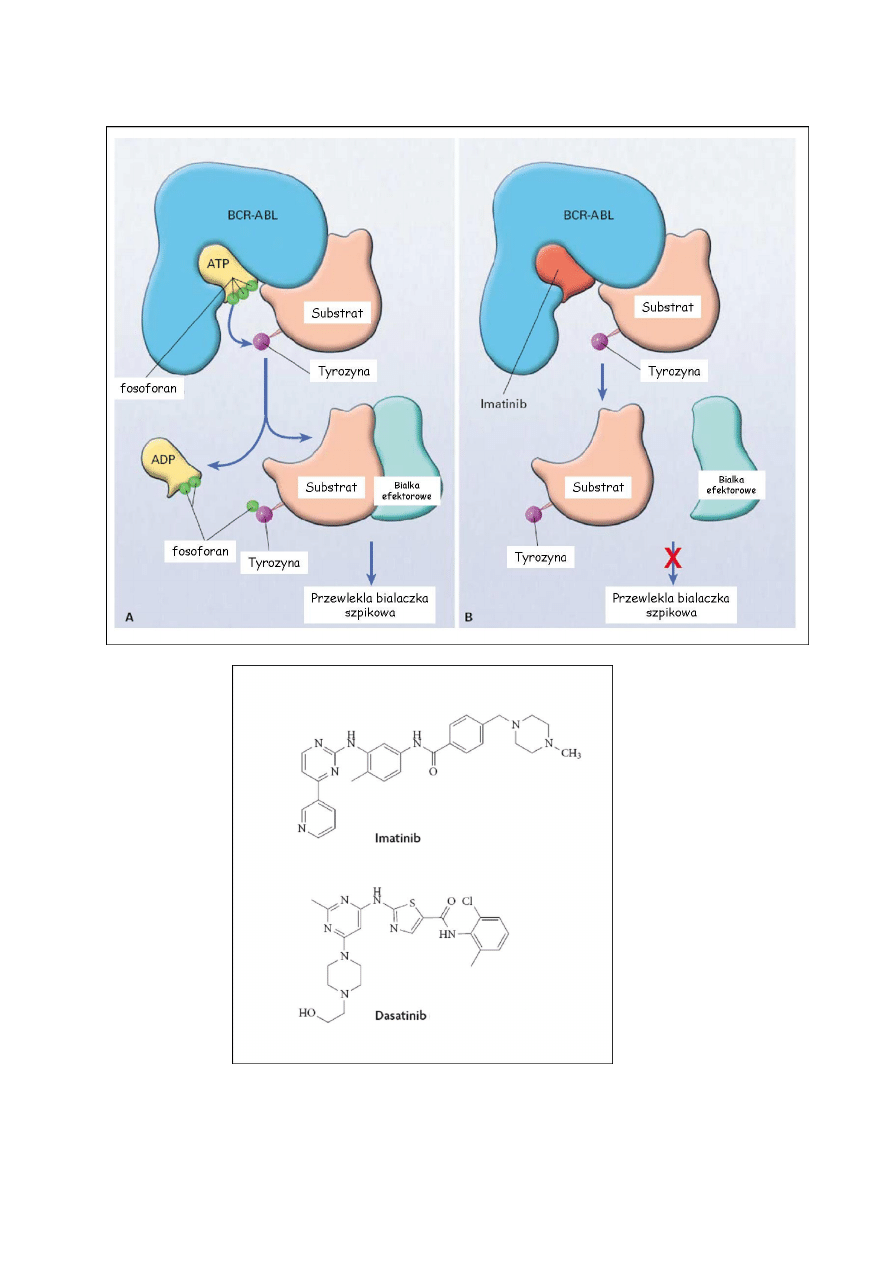
Rys. 8. Schemat mechanizmu fosforylacji przez kinazę BCR-ABL w warunkach aktywności
oraz po zablokowaniu miejsca wiążącego ATP w cząsteczce enzymu. Poniżej struktura leków
hamujących aktywność onkogennej kinazy tyrozynowej.
Pytania/problemy do przypomnienia/przemyślenia :
1. Przypomnij najważniejsze aspekty mechanizmu molekularnego regulacji cyklu
komórkowego.
2. Jakie są biochemiczne cechy nowotworów?
3. Wyjaśnij pojęcia: protoonkogen / onkogen. Jakie funkcje może pełnić onkogen?
4. W jaki sposób może dojść do aktywacji protoonkogenu.
5. Przedstaw fizjologiczny mechanizm przekazywania sygnału przez kinazy tyrozynowe.
6. Omów rolę białek p53 i RAS w normalnym metabolizmie komórki.
7. Zastanów się jak można zablokować namnażanie komórek zależne od nadmiaru
aktywności kinazy tyrozynowej, spróbuj wyjaśnić pojęcie „uzależnienia od onkogenu”
stosowane niekiedy dla komórek przewlekłej białaczki szpikowej.
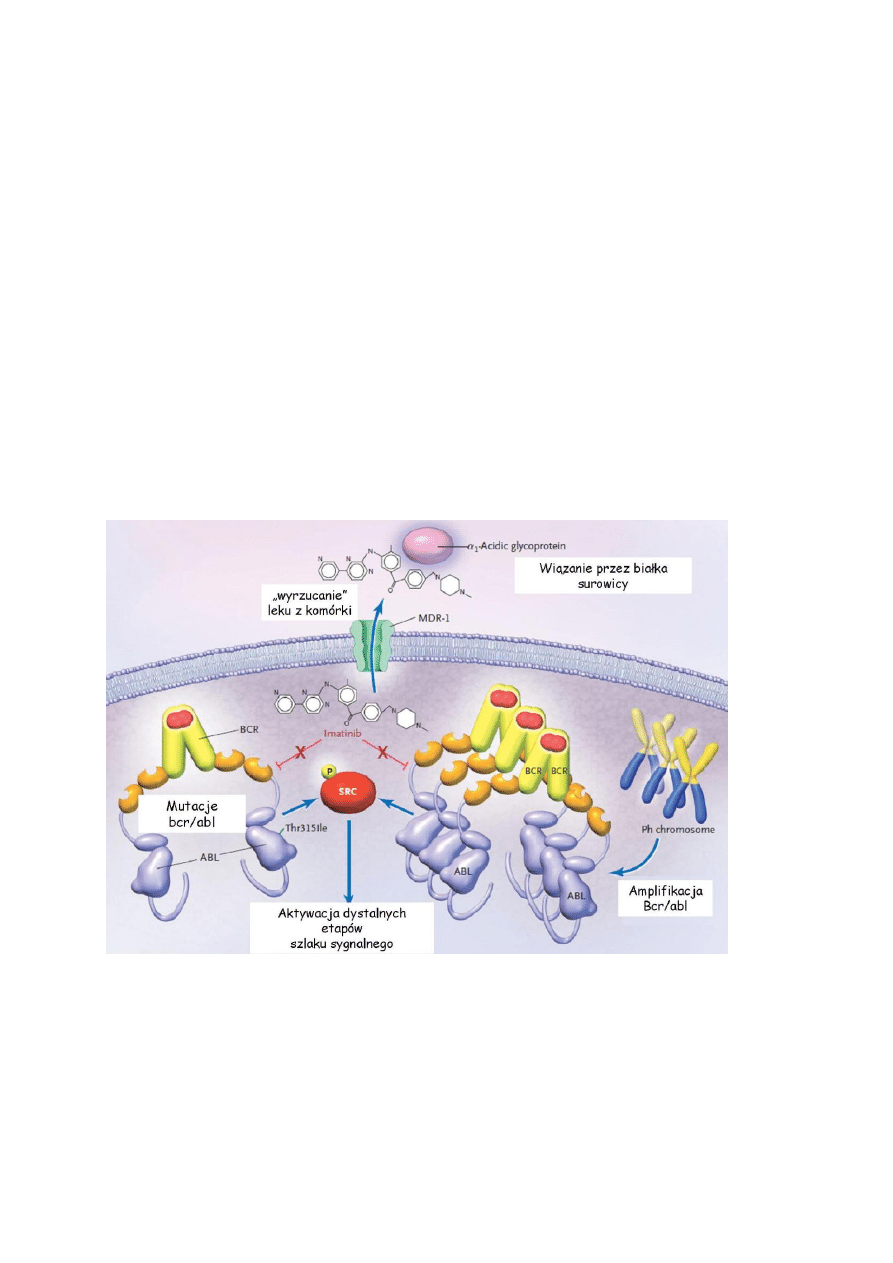
8. Jakie mogą być przyczyny niewrażliwości komórek nowotworowych na leki
przeciwnowotworowe [Rys. 9]?
9. Jaka jest fizjologiczna funkcja i mechanizm regulacyjny reduktazy rybonukleotydów,
jaki efekty może mieć brak aktywności tego enzymu?
10. Jakimi metodami można wykryć w komórkach nowotworowych obecność genu
bcr/abl ?
11. Jaką rolę w leczeniu przedstawionego chorego odgrywa allopurinol?
Rys 6.
Możliwe mechanizmy oporności na Imatinib. (Wg D. Krause, N Engl J Med 2005)
Ważniejsze skróty spotykane w tekście:
BCR
Breakpoint cluster region
Rejon punktów złamań (chromosomu 22)
ABL:
v-ABL
kinaza tyrozynowa, wirusa Abelsona wywołującego białaczkę u świnek morskich
c-ABL
komórkowa kinaza tyrozynowa (produkt protoonkogenu ABL)
SH
Src homology domain
STAT
Signal transducers and activators of transcription
JAK
Janus kinase
PKA(B,C..)
Protein kinase A, kinaza białek A
MAPK
Mitogen-activated protein kinase
Wyszukiwarka
Podobne podstrony:
biochemia skrypt aminokwasy i bia id 86612
Biochemia kliniczna bia, materiały medycyna SUM, biochemia, Kolokwium VIII
Biochemia aminokwasy, peptydy i bia éka
Matka pod krzyżem na chór (opr Stanisław Koszowski)
11 BIOCHEMIA horyzontalny transfer genów
Przewlekła niewydolność nerek (2) 2
Studenci biegunka przewlekła'
Przewlekła NIEWYDOLNOŚĆ NEREK1
Bitwa Pod Grunwaldem
Biochemia z biofizyką Seminarium 2
Dzien 2 Skutki przewlekłegostres
Przewlekłe zapalenie trzustki
p 43 ZASADY PROJEKTOWANIA I KSZTAŁTOWANIA FUNDAMENTÓW POD MASZYNY
Podstawy biochemii
więcej podobnych podstron