
2011
Instrukcja do ćwiczeń laboratoryjnych z enzymologii
Kolorymetryczne oznaczanie stężenia
białka przez reakcję z barwnikiem
Coomassie Brilliant Blue G-250
Michał Jakób
michal.jakob@pwr.wroc.pl
p. C14, bud. F4
godz. konsultacji Pn. 17
00
– 19
00
Wt. 13
00
– 15
00
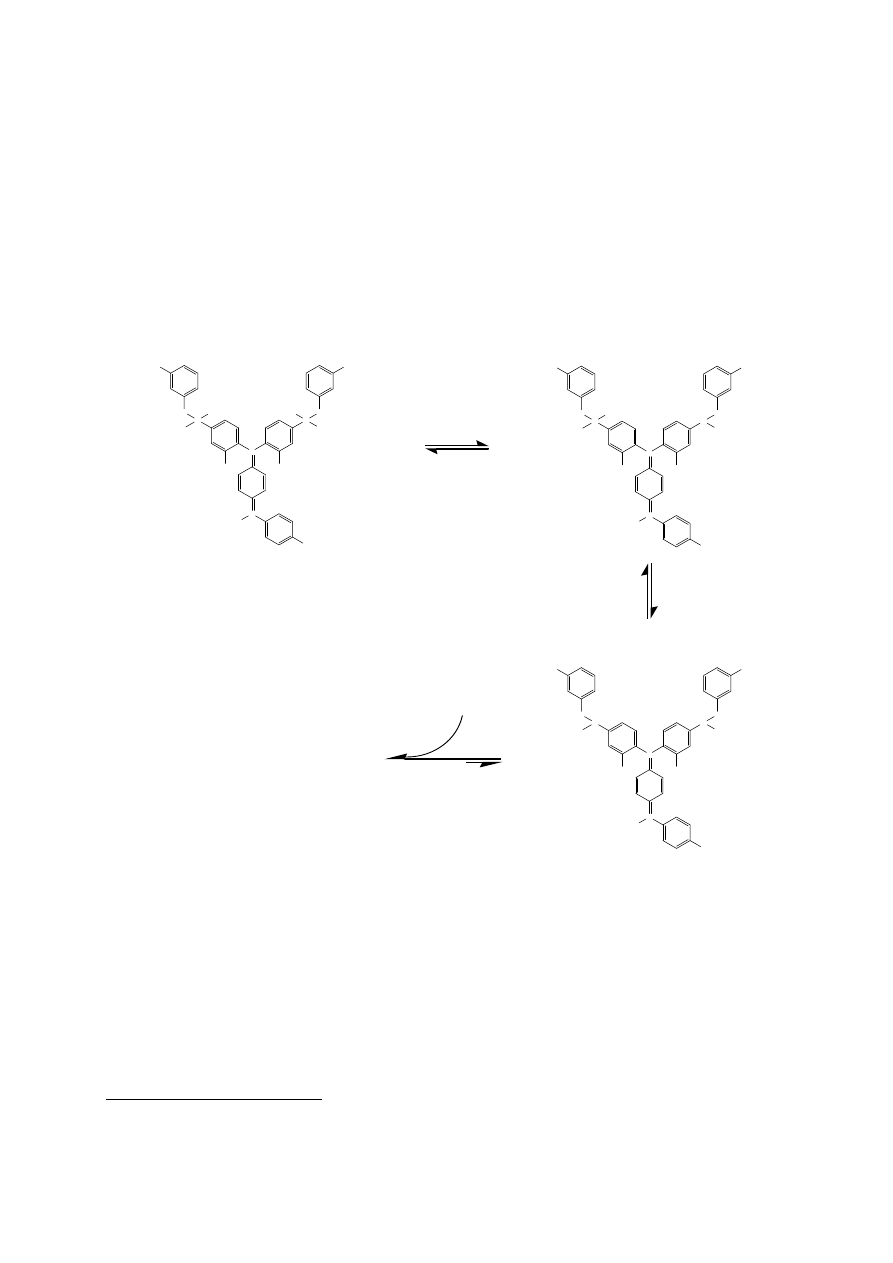
- 2 -
1. Wstęp.
Kolorymetryczna metoda oznaczania stężenia białka w roztworach przez reakcję
z barwnikiem Coomassie
1
Bright Blue G-250 (CBB G-250) została opracowana
i opublikowana przez Marion M. Bradford w 1976 roku, dlatego też potocznie nazywana
jest metodą Bradford.
Barwnik CBB G-250 w kwaśnych roztworach (pH < 0,5) posiada intensywnie
czerwoną barwę i maksimum absorbcji przy 465 nm (Rys. 1).
Rysunek 1. Trzy podstawowe formy CBB G-250 występujące w zależności od pH
roztworu. Forma I, czerwona, dominuje przy pH < 0,5 i posiada maksimum
absorbcji przy 465 nm. Forma II, zielona, dominuje pomiędzy 1 < pH < 2
i posiada maksimum absorbcji przy 650 nm. Forma III, niebieska, dominuje
w 3 < pH < 9 i posiada maksimum absorbcji przy 590 nm. Widmo absorbcji
kompleksu białka z barwnikiem posiada dwa maksima, mniejsze przy 465 nm
i większe przy 595 nm (drugie maksimum leży przy 595 nm, a nie 590 nm
z powodu obecności formy zielonej. Rysunek na podstawie [Chial i inni,
1993].
1
Nazwa Coomassie pochodzi od nazwy stolicy Ghany, Kumasi. Imperial Chemical Industries (ICI), które opatentowało barwnik,
nadało mu tę nazwę aby uczcić zwycięstwa armii brytyjskiej w Ghanie. Oznaczenie G-250 zawiera informację o intensywności
barwnika oraz uwagę, że ma on zielonkawy odcień (G od słowa "green" lub "greenish"). Współcześnie ICI nie posiada już
monopolu na produkcję CBB G-250, jednak z powodu praw patentowych większość pozostałych producentów używa innych
nazw handlowych, np. Serva Bright Blue G-250
.
C
N
H
N
CH
2
N
H
2
C
O
3
S
SO
3
OCH
2
CH
3
CH
3
H
3
C
H
CH
3
CH
2
H
CH
2
CH
3
+
+
+
-
-
C
N
H
N
CH
2
N
H
2
C
O
3
S
SO
3
OCH
2
CH
3
CH
3
H
3
C
H
CH
3
CH
2
CH
2
CH
3
I
II
- H
+
+ H
+
C
N
H
N
CH
2
N
H
2
C
O
3
S
SO
3
OCH
2
CH
3
CH
3
H
3
C
CH
3
CH
2
CH
2
CH
3
+
+
-
-
III
- H
+
+ H
+
+
-
-
Białko
Kompleks Białko:Coomassie Blue
pK
1
= 1.15
pK
2
= 1.82
- 3 -
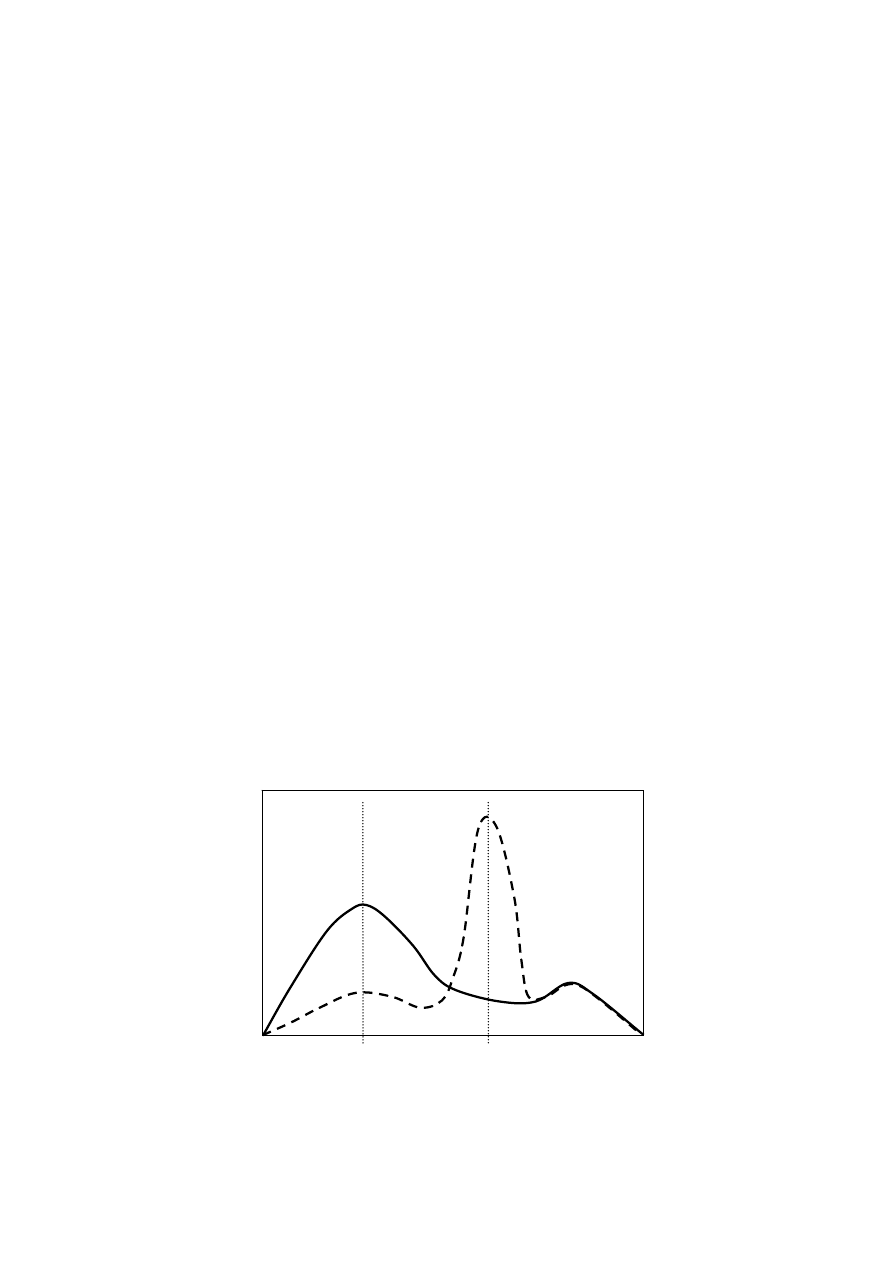
Po związaniu z białkiem barwnik przechodzi w formę niebieską o maksimum
absorbcji przy ~590 nm (Rys. 2) [Chial i Splittberger, 1993; Chial i inni, 1993]. W
praktyce pomiar wygląda następująco: do próbki białka dodaje się roztworu barwnika w
kwasie fosforowym i etanolu, inkubuje się próby przez pięć minut w temperaturze
pokojowej, po czym należy zmierzyć ich ekstynkcję przy 595 nm [Bradford, 1976].
Metoda pozwala na ilościowe oznaczenie od 1 do 50 g białka.
Mechanizm oddziaływania barwnika CBB G-250 z białkiem nie jest dokładnie
poznany. Przypuszcza się, że cząsteczki barwnika oddziaływują z resztami arginylowymi,
aromatycznymi i być może lizylowymi [Bradford, 1976; Compton i Jones, 1985;
Splittberger i Sohl, 1989; Chial i Splittberger, 1993; Chial i inni, 1993]. Reakcja barwnika
z białkiem jest odwracalna. Stwierdzono również, że barwnik nie oddziaływuje
z polipeptydami o masie mniejszej niż około 3000 Da (27 aminokwasów), co znalazło
wykorzystanie w teście aktywności proteolitycznej opartym o metodę Bradford [Buroker-
Kilgore i Wang, 1993].
W porównaniu do innych metod, metoda Bradford jest najmniej wrażliwą na
obecność typowych związków chemicznych, najprostszą i najczulszą z metod
kolorymetrycznych [Stoscheck, 1990]. Jest również czulsza od dowolnej metody opartej
na absorbcji aminokwasów w ultrafiolecie i w odróżnieniu od tych ostatnich na pomiar
nie ma wpływu obecność kwasów nukleinowych lub innych silnie absorbujących
w ultrafiolecie zanieczyszczeń [Stoscheck, 1990]. Czulsze od metody Bradford są jedynie
metody wykorzystujące barwniki fluorescencyjne lub metoda koloidalnego złota,
jednakże są one skomplikowane i czasochłonne [Peterson, 1983; Stoscheck, 1990].
Metoda Bradford wrażliwa jest na obecność surfaktantów, dlatego też gdy mierzy się
stężenia białka w roztworze zawierającym detergenty lepiej jest użyć metody BCA [Smith
i inni, 1985, cytowane za Stoscheck 1990] lub metody Lowry'ego [Lowry i inni, 1947,
cytowane za Peterson, 1983].
Rysunek 2. Spektrum absorbcyjne CBB z lub bez białka.
a) CBB wolne od białka.
b) CBB z dodatkiem białka.
Absorbancja
Długość fali [nm]
350
750
595
a)
b)
465

- 4 -
UWAGI:
Najważniejszym krokiem w prawidłowo wykonanym pomiarze stężenia białka
metodą Bradford jest przygotowanie krzywej standardowej. Zawsze oznaczaj
spektrofotometrycznie stężenia standardu, dokładne naważenie nie wystarczy. Zawsze
przygotowuj standard w identycznym roztworze jak badane próby. Do każdej nowej serii
pomiarów należy ponownie przygotować i zmierzyć standard.
Metoda Bradford nie daje liniowych wyników. Są trzy sposoby na linearyzację
wyników:
1. Mierzyć ekstynkcję przy 465 nm (ubytek barwnika). Powoduje to obniżenie
czułości ale wyniki są prawie idealnie liniowe. Użyteczne, jeśli mierzy się duże
stężenia białka.
2. Mierzyć stężenie białka w funkcji różnicy A
595
– A
465
. Teoretycznie równoważy to
efekt ubytku barwnika, jest to jednak wyłącznie obserwacja empiryczna [Read
i Northcote, 1983].
3. Mierzyć stężenie białka w funkcji ilorazu A
595
/A
465
. To również ma odpowiadać
efektowi ubytku barwnika. Aczkolwiek istnieje teoretyczne uzasadnienie takiej
zależności, brak znajomości mechanizmu oddziaływania CBB G-250 z białkami
uniemożliwia ostateczne potwierdzenie lub obalenie podstaw teoretycznych
takiego pomysłu. Bez względu na niejasności, sposób ten daje najlepsze rezultaty
i wydaje się, że pozwala na podniesienie czułości metody [Zor i Selinger, 1996].
Metoda Bradford daje rozbieżne wyniki z metodą Lowry'ego lub BCA gdy mierzy
się stężenie białek we frakcjach błonowych. Dyskusję i rozwiązanie tego problemu można
znaleźć w materiałach opublikowanych przez Stoscheck’a [Stoscheck, 1990].
Po reakcji z CBB G-250 zabarwienie jest stabilne przez nie więcej niż 90 minut
[Bradford, 1976]!
Różne białka mogą dawać bardzo różne intensywności zabarwienia po reakcji
z CBB G-250. Ekstynkcja dwóch próbek o identycznych stężeniach, odpowiednio
albuminy wołowej i lizozymu może różnić się czterokrotnie!
2. Odczynniki.
Odczynnik Bradford:
rozpuścić 100 mg Serva Brilliant Blue G-250 w 50 ml 95% (v/v) etanolu.
Dodać 100 ml 85% (w/v) H
3
PO
4
, delikatnie ale dokładnie wymieszać,
poczym dopełnić do 1 litra wodą redestylowaną. Przefiltrować przez sączek
karbowany do ciemnej butelki. Przechowywać w temperaturze pokojowej
[Bradford, 1976].
Bufor standardowy:
10 mM Tris, 100 mM NaCl, pH 7.0.

- 5 -
Standard białkowy:
25 ml roztworu immunoglobuliny G (frakcja V) o stężeniu 1 mg/ml
w buforze standardowym.
Dodatkowo:
roztwór o nieznanym stężeniu immuglobuliny w buforze standardowym;
roztwór o nieznanym stężeniu albuminy wołowej;
roztwór o nieznanym stężeniu lizozymu;
10% (w/v) SDS;
3 M NaCl.
3. Doświadczenia.
UWAGA! Zanim zaczniesz wykonywać którekolwiek z doświadczeń, przeczytaj
cały podrozdział 3., wybierz, które z opcjonalnych doświadczeń chcesz wykonać,
przejrzyj podrozdział 4 i upewnij się, że będziesz mógł/mogła wykonać pomiary
spektrofotometryczne w 5 minut po przygotowaniu prób. Pamiętaj, aby mierzyć wszystkie
próby (w tym standard) w jednej serii (a więc do wszystkich 15 dodajesz odczynnik
Bradford jednocześnie).
Przygotowanie standardu: pobierz 0,5 ml standardu do osobnej probówki i dodaj
do niego 2 ml buforu standardowego. Zmierz ekstynkcję tak otrzymanego roztworu przy
280 nm. Na podstawie pomiaru ekstynkcji i odpowiedniego współczynnika ekstynkcji (dla
immuglobuliny A
280
0.1%
= 1,5) będziesz mógł/mogła wyliczyć rzeczywiste stężenie
standardu. Następnie przygotuj serię rozcieńczeń standardu (dopełniając buforem
standardowym), tak aby otrzymać kolejno ok. 0 g, 1 g, 2 g, 5 g, 10 g, 20 g, 40 g
białka w 100 l buforu standardowego. Dokładne masy można obliczyć później,
przygotuj rozcieńczenia tak aby wygodnie pipetować.
Przygotowanie pomiaru stężenia białka próbki o nieznanym stężeniu: rozpipetuj
do czterech probówek kolejno po 10 l, 20 l, 40 l i 60 l roztworu immuglobuliny G
o nieznanym stężeniu (nie standardu!). Dopełnij buforem do 100 l.
UWAGA! Wybierz dowolne jedno z poniższych 4 doświadczeń.
1. Przygotowanie pomiaru stężenia lizozymu: rozpipetuj do czterech probówek kolejno
po 10 l, 20 l, 40 l i 60 l roztworu lizozymu o nieznanym stężeniu. Dopełnij
buforem standardowym do 100 l.
2. Przygotowanie pomiaru stężenia albuminy wołowej: rozpipetuj do czterech
probówek kolejno po 10 l, 20 l, 40 l i 60 l roztworu albuminy wołowej
o nieznanym stężeniu. Dopełnij buforem standardowym do 100 l.
3. Przygotowanie pomiaru stężenia białka w obecności SDS: rozpipetuj do czterech
probówek taką ilość białka standardowego, aby w probówkach znalazło się po 10 g
białka. Dodaj kolejno po 0 l, 10 l, 20 l i 50 l 10% (w/v) SDS. Dopełnij buforem
standardowym do 100 l.

- 6 -
4. Przygotowanie pomiaru stężenia białka w obecności NaCl: rozpipetuj do czterech
probówek taką ilość białka standardowego, aby w probówkach znalazło się po 10 g
białka. Dodaj kolejno 0 l, 10 l, 20 l, 50 l 3 M NaCl. Dopełnij buforem
standardowym do 100 l.
Pomiar stężenia białka metodą Bradford: do każdej z probówek (7+4+4) dodaj
po 1 ml odczynnika Bradford. Bardzo dokładnie, ale delikatnie aby nie wytworzyć piany,
zamieszaj wszystkie próby. Odczekaj 5 minut. Do wszystkich pomiarów ekstynkcji używaj
plastykowych lub szklanych kuwet. W żadnym wypadku nie używaj kwarcowych kuwet!
Wyzeruj spektrofotometr przy 595 nm względem buforu standardowego. Zmierz
ekstynkcję przy 595 nm wszystkich prób względem buforu standardowego. Wyzeruj
spektrofotometr na 465 nm względem buforu standardowego. Wykonaj ponowenie
pomiar całej serii przy 465 nm. Po wykonanych pomiarach dokładnie umyj kuwety.
4. Opracowanie wyników.
Wyniki należy opracować w postaci sprawozdania, które powinno składać się z następujących
części: wstępu teoretycznego, protokołu, wyników z ich opracowaniem i wniosków.
W sprawozdaniu, proszę koniecznie wpisać imię i nazwisko, dzień tygodnia i godzinę zajęć oraz
nazwisko osoby do której są Państwo zapisani na zajęcia.
UWAGI OGÓLNE:
Sprawozdanie nie jest instrukcją do ćwiczenia, dlatego należy napisać je używając czasu przeszłego
dokonanego, a nie trybu rozkazującego (np. zmierzono ekstynkcję, ew. zmierzyłem/am ekstynkcję,
a nie zmierz ekstynkcję);
Przy wszystkich obliczeniach proszę podawać wzory, z których Państwo korzystają, razem
z wyjaśnieniem znaczenia poszczególnych symboli;
Do wykonanego wykresu należy podać równanie funkcji;
Przy wszystkich liczbach wymiarowych proszę podawać jednostki.
PLAN SPRAWOZDANIA:
I. WYKONANIE ĆWICZENIA:
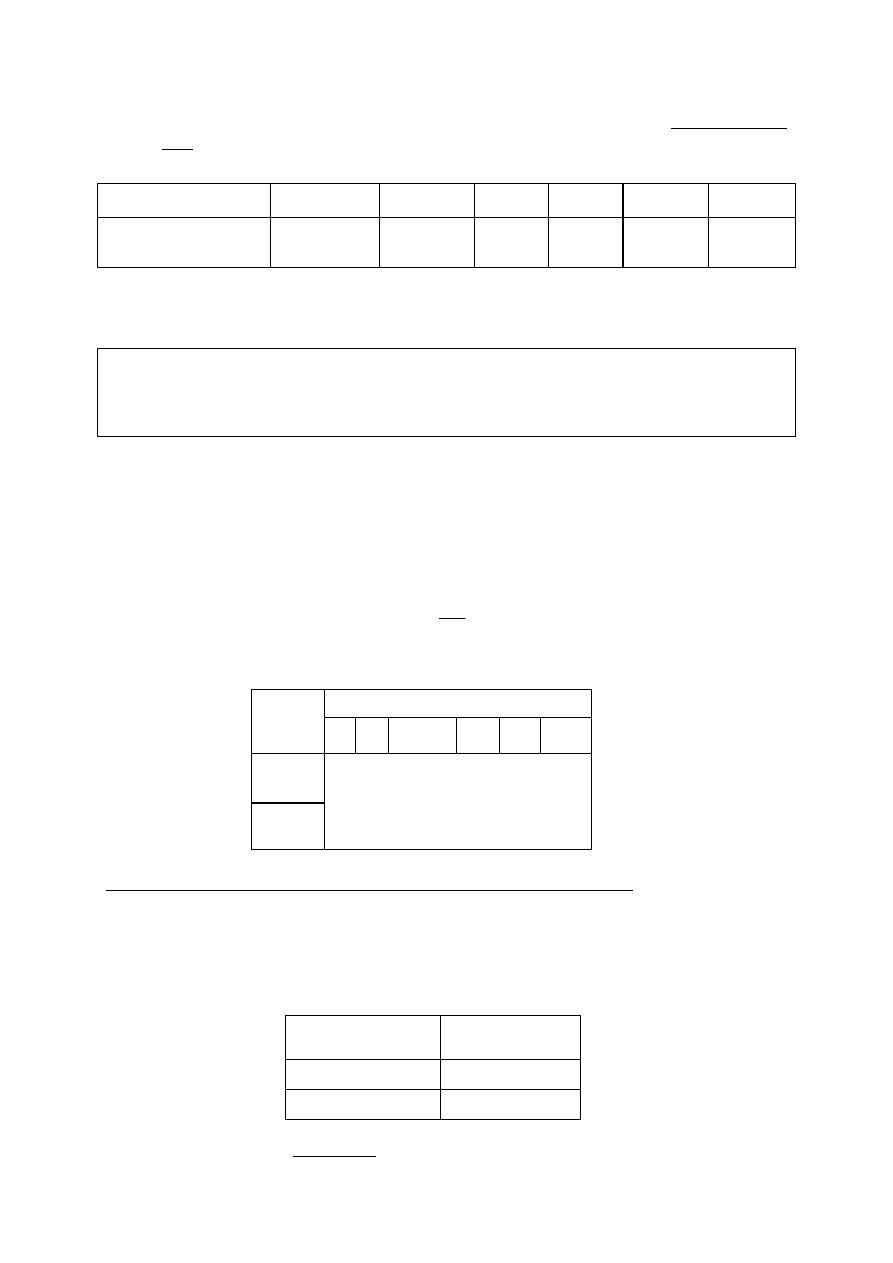
W części pierwszej sprawozdania należy zwięźle opisać tok postępowania, oraz uzupełnić tabele,
których wzór przedstawiono poniżej. Ewentualne odstępstwa od protokołu doświadczenia oraz zauważone
błędy lub nieprawidłowości proszę wyraźnie zaznaczyć.
1. Opis przygotowania standardu. W tym punkcie należy od razu podać wynik pomiaru A
280
i obliczyć stężenie białka standardowego. W kolumnie m
standardu
[g], należy wyliczyć
rzeczywistą ilość standardu w poszczególnych próbkach.
2. Opis przygotowania Immunoglobuliny G o nieznanym stężeniu.
3. Opis trzeciej części ćwiczenia. Tabelę należy wykonać w analogiczny sposób (nr próbek:
12...15). W przypadku gdy pomiary były wykonane w obecności SDS lub NaCl proszę podać
objętość dodanego odczynnika i jego stężenie w 100 l próbki.
- 7 -
II. WYNIKI I ANALIZA WYNIKÓW:
W punkcie drugim należy wypisać wyniki odczytane ze spektrofotometru w formie czytelnych
tabel, podając także dodatkowe informacje, wg poniższych wzorów.
Pierwsza tabela dotyczy tylko standardu:
W opracowaniu wyników, proszę sporządzić wykres zależności A
595
/A
465
od masy standardu
[A
595
/A
465
= f(m[g)]. Koniecznie proszę podać równanie funkcji.
UWAGA! Po naniesieniu punktów pomiarowych na wykres należy wykonać regresję liniową. W tym celu
wykres trzeba wykonać na komputerze w odpowiednim programie, lub na papierze milimetrowym
z wykorzystaniem linearyzacji wyników metodą najmniejszych kwadratów. Wyrzucane punkty powinny być
zaznaczone na wykresie (np. w drugiej serii) a wyrzucenie uzasadnione odp. wartościami statystycznymi.
Należy zwrócić uwagę na wykonanie wykresu (wykres powinien mieć tytuł, zaznaczone jednostki na
opisanych osiach, widoczne punkty pomiarowe; wykres powinien być duży i czytelny).
Z krzywej standardowej należy obliczyć (z równania funkcji) ilość mikrogramów dla wszystkich
oznaczanych białek o nieznanym stężeniu (lub dla białek o znanym stężeniu, ale mierzonych w obecności
SDS, czy NaCl), a następnie ich stężenie ze wzoru:
Odpowiednie dane i obliczenia proszę umieścić w tabeli:
nr próbki
[A
595
/A
465
= f(m[g)]
A
595
A
465
A
595
/A
465
m
X
[
g]
V
X
[
l]
C
X
[
g/l]
8
…
11
12
…
15
Jeśli jakiekolwiek wyniki zostały odrzucone należy to dobrze uzasadnić i zaznaczyć.
III. WNIOSKI:
Proszę wyliczyć średnie stężenie białka otrzymane z wykresu.
Białko
Stężenie białka
[g/l]
IgG
Lizozym/albumina
wolowa
Proszę napisać i UZASADNIĆ powołując się na teorię dla których z wykonywanych
eksperymentów wyznaczone stężenia są właściwie określone.
nr próbki
m
standardu
[g]
V
standardu
[l] V
buforu
[l]
A
595
A
465
A
595
/A
465
1
…
7
X
X
X
V
m
C
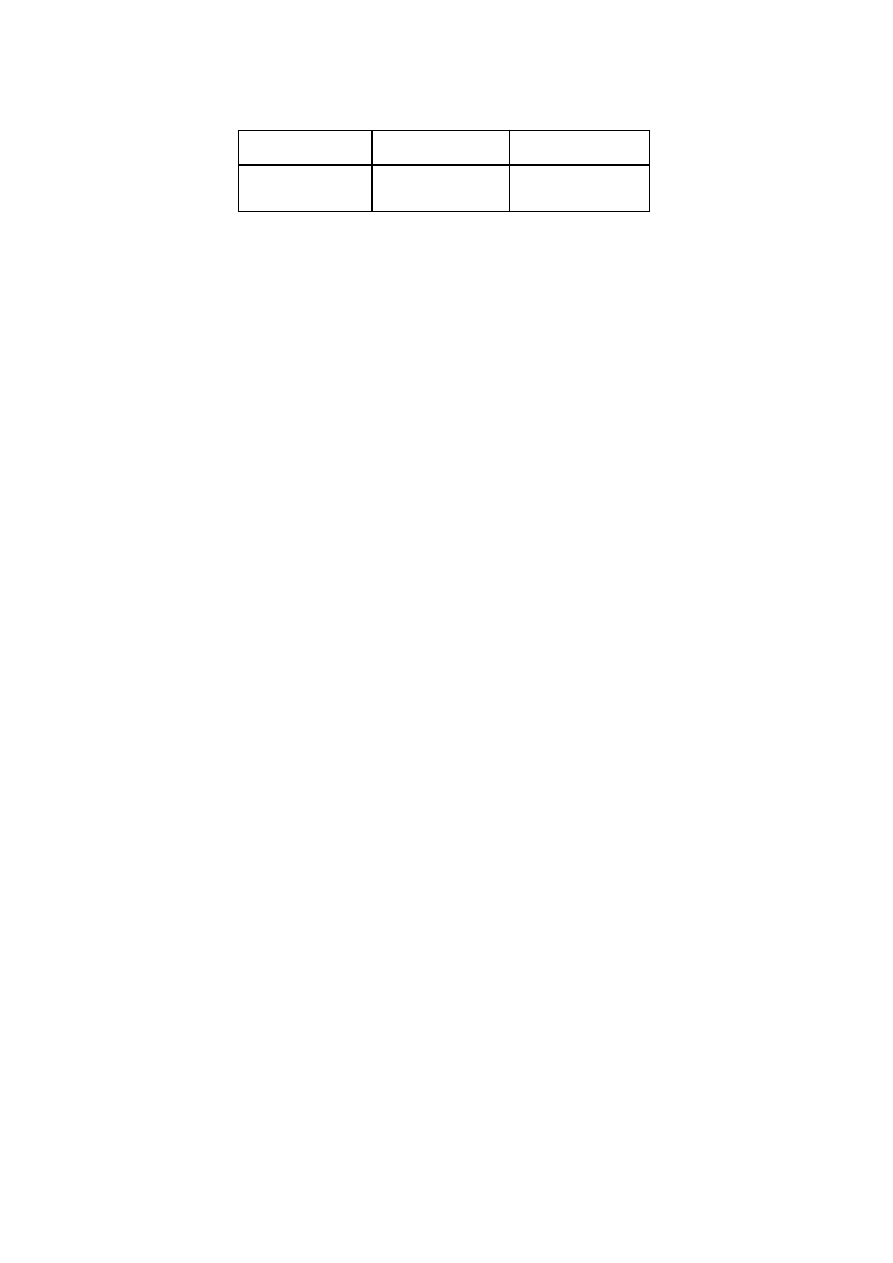
- 8 -
Jeśli wykonywane były wybieralne doświadczenia 3 lub 4 należy postawić do nich wnioski
i uzasadnić je. Proszę wykonać tabelę oznaczonej ilości białka dla różnych stężeń SDS lub NaCl.
Nr próbki
Stężenie SDS/NaCl
Oznaczone stężenie
białka w [
g/l]
12
…
15
Proszę napisać jaki obserwują Państwo wpływ SDS lub NaCl na dokładność oznaczenia stężenia białka.
Proszę napisać czy jest to zgodne z tym, czego Państwo się spodziewali i dlaczego.
Do sprawozdania należy koniecznie dołączyć wyniki spisywane lub wydrukowane bezpośrednio na
ćwiczeniach, podpisane przez prowadzącego zajęcia.
Sprawozdanie w formacie Worda o nazwie
nazwisko_indeks.doc(x) należy podpiąć pod e-portal w ciągu
tygodnia od zajęć.
5. Literatura.
Bradford, M.M. (1976) A rapid and sensitive method for the quantition of microgram quantities of protein
utilizing the principle of protein-dye binding.
Anal. Biochem. 72, 248-251.
Buroker-Kilgore, M. i Wang, K.K.W (1993) A Coomassie Brilliant Blue G-250 based colorimetric assay
for measuring activity of calpain and other proteases.
Anal. Biochem. 208, 387-392.
Chial, H.J. i Splittgerber, A.G. (1993) A comparison of the binding of Coomassie Brilliant Blue to proteins at
Iow and neutral pH.
Anal. Biochem. 213, 362-369.
Compton, S.J. i Jones C.G. (1985) Mechanism of dye response and interference in the Bradford protein
assay.
Anal. Biochem. 151, 369-374.
Congdon, R.W., Muth, G.W. i Splittberger, A.G. (1993) The binding interaction of Coomassie Blue with
proteins.
Anal. Biochem. 213, 407-413.
Peterson, G.L. (1983) Determination of total protein. Zamieszczone w "Methods in Enzymology"
(Hirs,C.H.W. i Timascheff, S.N. Eds.) vol. 91, 95-119, Academic Press, San Diego.
Read, S.M. i Northcote D.H. (1981) Minimization of variation in the response to different proteins
of the Coomassie Blue G dye-binding assay for protein.
Anal. Biochem. 116, 53-64.
Splittberger, A.G. I Sohl, J. (1989) Nonlinearity in protein assays by the Coomassie Blue dye-binding
method.
Anal. Biochem. 179, 198-201.
Stoscheck, CM. (1990) Quantitation of protein. Zamieszczone w "Methods in Enzymology" (Deutscher,
M.P., Ed.) vol. 182, 50-68, Academic Press, San Diego.
Zor, T. i Selinger, Z. (1996) Linearization of the Bradford protein assay increases its sensitivity: theoretical
and experimental studies.
Anal. Biochem. 236, 302-308.
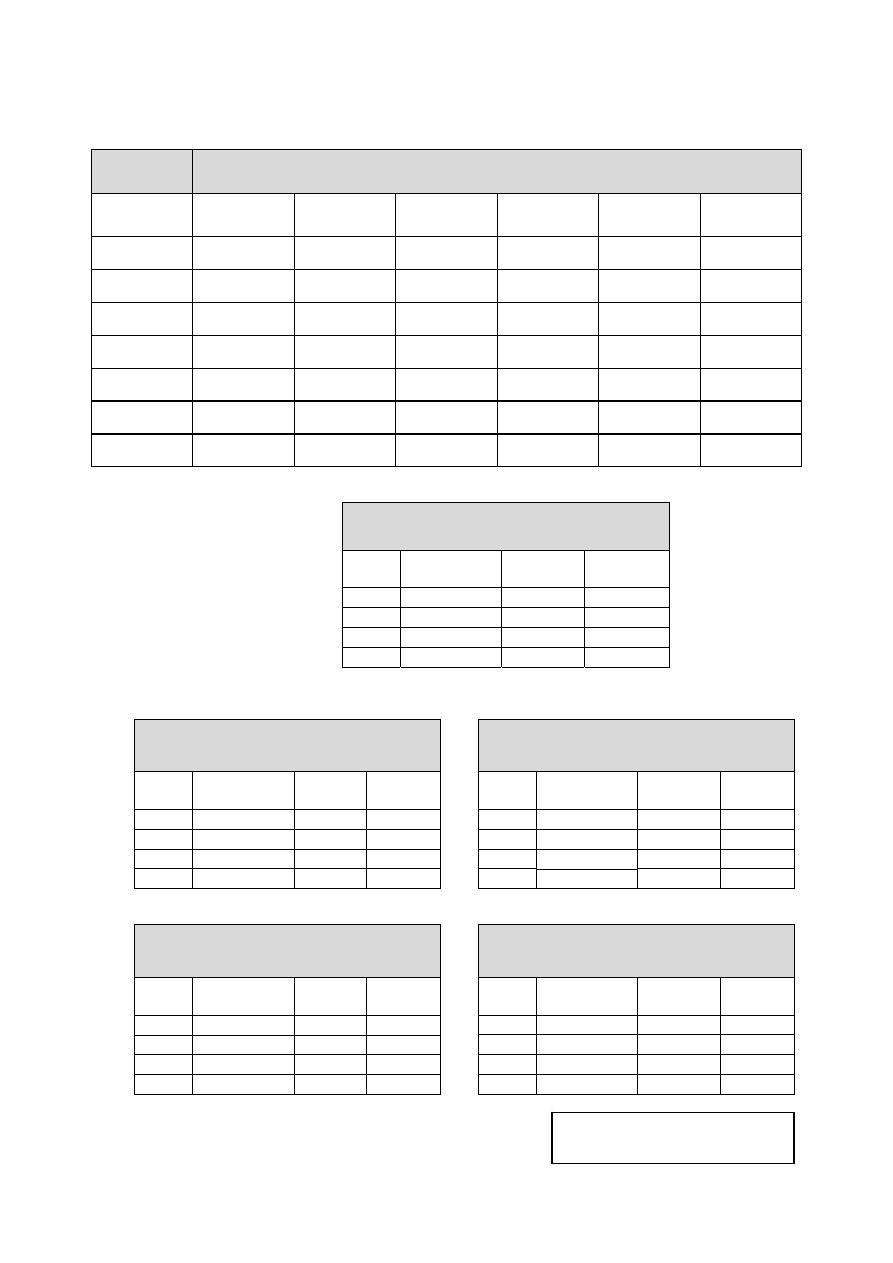
- 9 -
Arkusz wyników
P
RZYGOTOWANIE STANDARDU IMUNOGLOBULINY
G
nr próbki
m
standardu
[g]
teoretyczna
m
standardu
[g]
rzeczywista
V
standardu
[l]
V
buforu
[l]
A
595
A
465
1
ok 0 g
2
ok 1 g
3
ok 2 g
4
ok 5 g
5
ok 10 g
6
ok 20 g
7
ok 40g
I
MMUNOGLOBULINA
G
O
NIEZNANYM
STĘŻENIU
Nr
próbki
V próbki
A
595
A
465
1
10 l
2
l
3
40l
4
60l
L
IZOZYM O
NIEZNANYM
STĘŻENIU
Nr
próbki
V próbki
A
595
A
465
1
10 l
2
20l
3
40l
4
60l
A
LBUMINA WOŁOWA O
NIEZNANYM
STĘŻENIU
Nr
próbki
V próbki
A
595
A
465
1
10 l
2
20l
3
40l
4
60l
S
TĘŻENIE BIAŁKA W OBECNOŚCI
SDS
Nr
próbki
V
SDS
A
595
A
465
1
0 l
2
10l
3
20l
4
50l
S
TĘŻENIE BIAŁKA W OBECNOŚCI
N
A
C
L
Nr
próbki
V
NaCl
A
595
A
465
1
0 l
2
10l
3
20l
4
50l
Podpis asystenta
Wyszukiwarka
Podobne podstrony:
INSTRUKCJE Cwiczenie 1 id 71952 Nieznany
INSTRUKCJE Cwiczenie 2 id 71952 Nieznany
Instrukcja co cwiczenia id 2164 Nieznany
Instrukcja do cwiczenia id 2165 Nieznany
cwiczenie9 id 125928 Nieznany
cwiczenia23 id 124959 Nieznany
cwiczenia 4 2 id 124428 Nieznany
Fizjologia Cwiczenia 3 id 17436 Nieznany
cwiczenie 4 2 id 125411 Nieznany
cwiczenie 9 id 125104 Nieznany
Cwiczenia 5 id 124444 Nieznany
opis cwiczenia id 336864 Nieznany
cwiczenie 5 id 101060 Nieznany
Cwiczenie 3 id 125305 Nieznany
CWICZENIE 6 2 id 99618 Nieznany
cwiczenie 5 id 125447 Nieznany
Instrukcja ESRI id 216707 Nieznany
instrukcja laboratoryjna id 216 Nieznany
Cwiczenie 6 id 125101 Nieznany
więcej podobnych podstron