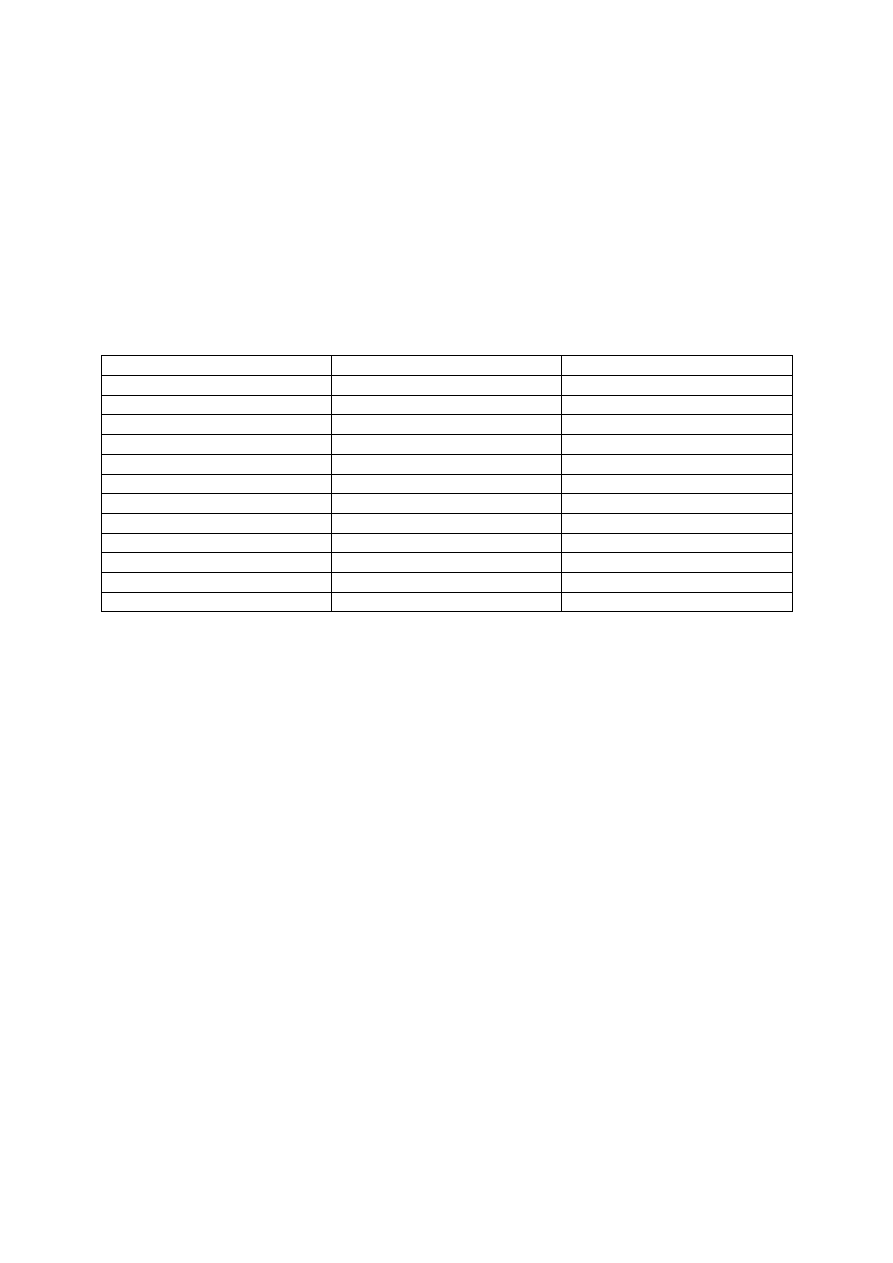
1. Omów anomalne właściwości wód.
Ze wzrostem masy cząsteczkowej rośnie temperatura topnienia i wrzenia
Woda zachowuje się w niezwykly sposób. W przeciwieństwie do innych cieczy kurczy się, gdy jest
ogrzewana od 0-4 stopni C. Natomiast ogrzewana od 4 st. C do wyższej temperatury, tak jak inne ciecze,
rozszerza się. Tzn anomalna rozszerzalność cieplna. Oznacza to, ze w temp. 4st. C woda ma najmniejsza
objetosc i najwieksza gestosc. Dlatego opada na dno jeziora lub innego zbiornika. Dzieki temu, jezeli
nawet powierzchnia wody jeziora pokryje sie lodem, to przy jego dnie woda ma temperature 4st. C, co
pozwala przezyc rybom ciezką zimę. Jest to związane także ze złym przewodnictwem cieplnym lodu.
2. Co to jest bilans jonowy wód, jakie warunki musi spełniać woda do picia
Bilans jonowy wody- jest podstawowym testem poprawności wyników analiz chemicznych wód opadowych,
roztworów glebowych oraz wód podziemnych i powierzchniowych. Opiera się on na zasadzie
elektroobojętności wody, wymagającej by suma anionów była równa sumie kationów.
Woda 1. klasy
ściek
Temperatura °C
Do 22
Pow. 28-35
pH
6,5-8,5
<5,5 lub >9,5
BZT
5
[mgO
2
/dm
3
]
Do 2
Pow.12
Przewodnictwo [µS/cm
3
]
Do 500
Pow.2000
Sub. Rozpuszczone [mg/dm
3
]
Do 250
Pow.1200
Siarczany SO
4
2-
[mgSO
4
2-
/dm
3
]
Do 100
Pow.300
Chlorki [mgCl
-
/dm
3
]
Do 100
Pow.400
Suma metali [mg/dm
3
]
Do 1
Pow.1-2
Fosfor ogólny [mgP/dm
3
]
Do 0,2
Pow. 1
Azot ogólny [mgN/dm
3
]
Do 2,5
Pow. 20
Chlorofil [µg/dm
3
]
Do 10
Pow.100
Zawiesina ogólna [mg/dm
3
]
Do 15
Pow. 100
3. Omów proces samooczyszczania wód i poprzyj reakcjami
Samooczyszczanie jest zjawiskiem fizyczno-biochemicznym, polegającym na samoistnym zmniejszaniu się
stopnia zanieczyszczenia wód (ścieków). Można ten proces rozumieć dwojako:
a) Proces samooczyszczania obejmuje złożony zespół procesów fizycznych, chemicznych i najważniejszych
dla tego procesu zjawisk biologicznych, które prowadzą do zmniejszenia stężenia zanieczyszczeń w
wodach lub w ściekach. Wody powierzchniowe posiadają naturalną zdolność samooczyszczania. Proces
samooczyszczania występuje w wodach płynących i stojących, ale z różną intensywnością. W praktyce
rozważa się samooczyszczanie zachodzące w rzekach.
-rozcieńczanie ścieków wodami odbiornika
-mieszanie ich z wodami dopływów
-oczyszczanie mechaniczne przez osiadanie na dnie lub brzegach zawiesin oraz substancji zawieszonych
pływających po powierzchni
W grupie zjawisk chemicznych mogą występować reakcje zachodzące między składnikami
występującymi w wodach (ściekach) i polegające na zachodzeniu zobojętniania, utleniania, redukcji oraz
kompleksowaniu i hydrolzie, a także innych przemianach chemicznych prowadzących od obniżeniu
szkodliwego charakteru wód. Trzecia grupa procesów obejmuje zjawiska biochemiczne i dotyczy głównie
zanieczyszczeń organicznych. Są to zanieczyszczenia typowe dla ścieków bytowo-spożywczego.
Zanieczyszczenia te po zmieszaniu z wodami odbiornika mogą stanowić bazę przemiany materii
organizmów roślinnych i zwierzęcych rozwijających się w wodzie. Organizmy te stanowią ekologiczny
samoregulujący się łańcuch pokarmowy dla rozwoju ryb i ptactwa wodnego.
b) Samooczyszczanie rozważa się także jako występowanie następujących procesów: biodegradacji,
sedymentacji oraz adsorpcji. Należy brać także pod uwagę procesy
fotolizy i parowanie z powierzchni wody, zwłaszcza gdy w wodach (ściekach) obecna jest zwiększona
ilość związków organicznych.

Proces samooczyszczania może być rozważany także jako zespół zjawisk prowadzących do mineralizacji
zanieczyszczeń. Przy takim podejściu najważniejszym procesem jest biodegradacja związków)
organicznych.
Zespół tych procesów jest zależny od temperatury, nasłonecznienia, rozwinięcia linii brzegowej, prędkości przepływu
wód, rozcieńczenia zanieczyszczonych wód zbiorników (rzek_ czystymi wodami dopływającymi z powierzchni.
Biodegradacja polega na rozkładzie zanieczyszczeń organicznych w obecności rozpuszczonego tlenu i z
udziałem mikroorganizmów:
Zanieczyszczenia organiczne+O2 (z udziałem mikroorganizmów)= związki nieorganiczne )np. Co2, H2O,
NxO, SO4 itp.)
Warunki ograniczonego dostępu tlenu lub warunki beztlenowe świadczą o bardzo dużym zanieczyszczeniu wód
(ścieków)
Procesy zachodzące w tlenowym oczyszczaniu można przedstawić następującymi równaniami typu redoks:
a) Bezpośrednie enzymatyczne utlenianie:
CxHyOz +(x+1/4y+1/2z)O2 + enzymy x CO2 + 1/2y H2O +deltaG1
b) Asymilacja (synteza):
N (CxHyOz) + nNH3 + (x+1/4y-1/2z -5)O2 + enzymy n (C5H7OzN) + n(x-5)CO2 + n/2 (y-4) H2O +
deltaG2
c) Autooksydacja substancji komórkowej:
N (C5H7OzN) + 5nO2 + enzymy 5nCO2 + 2n H2O + nNH3 + delta G3
Drugim ważnym procesem wchodzącym w skład samooczyszczania jest sedymentacji zawiesin. Powoduje ona
zmniejszenie ilości zanieczyszczeń w wyniku osiadania cząstek zawieszonych w wodach, pod wpływem siły
grawitacyjnej. Zachodzi ona w tych miejscach zbiorników lub rzek, gdzie występuje zmniejszona prędkość przepływu
wody, czego przejawem jest obniżona jej mętność. Prędkość przepływu jest różna w rzekach nizinnych, a w rzekach
górskich a typowa prędkość przepływu ścieków w osadnikach wtórnych wynosi od 0,01 do 0,05 m/s.
4. Wymień pod jakimi postaciami występuje azot w wodzie, jakie są jego źródła w wodzie i omów reakcje
w których bierze udział.
Głównymi formami azotu występującymi w ekosystemach wodnych są: N(-III) w NH3 i NH4+ oraz w
połączeniach organicznych: N(+III) w NO2-, N(+V) w NO3-, N(0) w N2, a także azot na innych stopniach
utlenienia w tlenkach tj N2O, NO i NO2.
W warunkach panujących w wodach naturlanych (dla odczyny pH i potencjał erdoks Eh) dominującymi
formami są NH4+, N2 i NO3-.
Źródła związków azotu w wodach powierzchniowych:
Ścieki miejskie lub przemysłowe. W ściekach komunalnych zawartość związków azotu waha się od
kilku do kilkudziesięciu gramów w metrze sześciennym. Natomiast w ściekach przemysłowych
zawartość zaotu to nawet 0,01 kg N/m3
Spływy wód powierzchniowych na terenach rolniczych. W zlewniach rzek na terenach rolniczych
roczny odpływ azotu wynosi od 0,6 do ok. 28 kg N/ha
Kwaśne opady atmosferyczne. Związki siarki i azotu wydziale do atmosfery w czasie spalania paliw
stałych. Do atmosfery przechodzą związki azotu w postaci tlenkow NO, N2O, NO2. W atmosferze
tlenki te łączą się z parą wodną, tworząc kwas azotowy i opadają jako kwaśne deszcze.
Reakcje:
Azot atmosferyczny jest bezpośrednio pobierany przez rośliny motylkowe, a wolny azot
rozpuszczany w wodzie jest pobierany przez niektóre glony i bakterie a następnie przetwarzany
do białka:

N2+ bakterie, glony białko
N2+3H2 2NH3
Proces mineralizacji białka – amonifikacja, dezaminacja:
CH2NH2COOH + 1,5 O2 2CO2 + H2O + NH3 + energia
Nitryfikacja
NH4 + 0,5 O2 + 2e NH2OH + H+
NH2OH + H2O NO2- + 4e + 5H+
5. Dlaczego do uzdatniania wód stosuje się chlor i jego związki (uzasadnij)
Do najbardziej rozpowszechnionych sposobów dezynfekcji wody zalicza się jej chlorowanie. Polega ono na
bezpośrednim wprowadzeniu do wody chloru gazowego lub w postaci roztworu oraz stosowanie związków
zawierających tzw chlor czynny.
Chlor dodany do wody:
- ulega hydrolizie
-ulega rekacji ze składnikami wody, głownie związkami amonowymi, tworząc chloroaminy
- działa bakteriobójczo, głownie przez wolny tlen wydzielony w HClOHCl + 0, który działa utleniająco na
mikroorganizmy,
a
kwas
solny
jest
zobojętniany.
6. Azotany. Skąd się biorą w wodzie i metody ich usuwania
Źródła związków azotu w wodach powierzchniowych:
Ścieki miejskie lub przemysłowe. W ściekach komunalnych zawartość związków azotu waha się od
kilku do kilkudziesięciu gramów w metrze sześciennym. Natomiast w ściekach przemysłowych
zawartość zaotu to nawet 0,01 kg N/m3
Spływy wód powierzchniowych na terenach rolniczych. W zlewniach rzek na terenach rolniczych
roczny odpływ azotu wynosi od 0,6 do ok. 28 kg N/ha
Kwaśne opady atmosferyczne. Związki siarki i azotu wydziale do atmosfery w czasie spalania paliw
stałych. Do atmosfery przechodzą związki azotu w postaci tlenkow NO, N2O, NO2. W atmosferze
tlenki te łączą się z parą wodną, tworząc kwas azotowy i opadają jako kwaśne deszcze.
Metody usuwania azotu:
Biologiczna denitryfikacja
Wykorzystuje się lotne kwasy tłuszczone jak substrat organiczny dla mikroorganizmów osadu
czynnego. Związki organiczne obecne w ściekach i osadach SA przekształcane częściowo w procesie
fermentacji kwaśnej w lotne kwasy tłuszczone LKT
Metoda jonitowa

Membrany
Źródła zanieczyszczeń fosforem:
Procesy rozpuszczania i wietrzenia minerałów fosforanowych
Opady atmosferyczne (zawartość fosforu zależy od pory roku i terenu <przemysłowy czy nie>, max
od lata do jesieni, min od zimy do wiosny)
Ścieki bytowe (na 1 mieszkańca dobowo od 2-8 mg/dobę), środki piorącoeitd
Na terenach rolniczych przy nawożeniu i gospodarce hodowlanej do środowiska dostaje się ok. 0,1g-
2kg/ha, który nie zostaje zużyty w ilościach 0,5-6%
Produkcja nawozów sztucznych, w gorzelniach i przy produkcji mączki rybnej
W trakcie hodowli ryb związki fosforu są celowo wprowadzane do wód jak równie do
kondycjonowania wody w celu zabezpieczenia przez wytrącaniem się węglanu wapnia oraz
zmniejszeniu korozyjności wody
Usuwanie fosforu:
Jest działaniem zapobiegającym eutrofizacji tych środowisk. Odzyskiwanie fosforu ma znaczenie
ekonomiczne i ekologiczne
Chemiczne strącanie fosforu z wód i ścieków
Polega na przekształceniu rozpuszczalnych fosforanów w nierozpuszczlane połączenia za pomoca
jonów metali dwuwartościowych Fe2+ lub trójwartościowych Fe Al. Itp. Ich sole reagują tylko w
środowisku kwaśnym. Strącają się fosfor jako osad trudno rozpuszczalnych fosforanów np.
FeCl3 + PO43- FePO4 <osad> + 3Cl-
Metody biologiczne – metoda osadu czynnego
Opera się na zdolności mikroorganizmów do magazynowania rozpuszczalnych ortofosforanów w
komórkach w postaci nierozpuszczalnych polifosforanów. Miesza się ścieki z osadem czynnym w
komorze anaerobowej. Bakterie pobierają LKT i przekształcają w wyniku hydrolizy i fermentacji
w warunkach beztlenowych w polihydroksyalamiany.
Wymiana jonowa
Wymiana elektrodialna
Odwrócona osmoza
Koagulacja
Adsorpcja w gruncie
Oczyszczalnie hydrobotaniczne
Ostatnie 6 metod jest kosztowne i mało efektywne.
6. Omówić proces koagulacji
Koagulanty- elektrolity nieorganiczne o charakterze produktów odpadowych. Mają za zadanie odbarwienie
tych wód. Są to odpadowe sole żelaza II (chlorki, siarczany), które wprowadzane podlegają utlenianiu do
żelaza III. Wytrącają się w wodzie przy pH 3,5-6 w postaci wodorotlenków. Wodorotlenek (koloid) jest
zarodkiem do tworzenia się dużych aglomeratów cząstek stałych i zawiesiny. Ilość stosowanych koagulantów
to kilkadziesiąt g/m
3
do 2,5 kg/m
3
. Do koagulacji można stosować związki glinu III- tworzą one wodorotlenek
glinu, który ma zdolność absorbowania na swojej powierzchni związków barwiących wodę (humusowych,
kuminowych). Związki glinu pozostałe w wodzie są przyczyną choroby Alzheimera.
Koagulacja to proces polegający na łączeniu się cząstek fazy rozproszonej koloidu w większe agregaty tworzące fazę
ciągłą o nieregularnej strukturze. Istnieje koagulacja odwracalna i nieodwracalna, a także spontaniczna i wymuszona.
Układy koloidalne bywają nietrwałe, bo faza zdyspergowana ma bardzo silnie rozwiniętą powierzchnię, przez co
cząstki zdyspergowane dążą do zmniejszenia swej powierzchni właściwej, więc cząstki koloidalne albo krystalizują,
albo koagulują.
Łączenie się cząstek fazy rozproszonej zachodzić może pod wpływem dodatku elektrolitów, wszelkich wypełniaczy
(bardzo rozdrobnionej fazy stałej), oraz działaniu temperatury lub na skutek reakcji chemicznych zachodzących w
mieszaninie, pod wpływem działania czynników zewnętrznych.
Szybkość koagulacji uwarunkowana jest ruchami Browna, których intensywność jest warunkowana przez stężenie
cząstek fazy rozproszonej i ich szybkością dyfuzji w cieczy, która z kolei jest silnie zależna od temperatury. Na
kinetykę koagulacji wpływ również mają oddziaływania międzycząsteczkowe, które mogą być regulowane składem
elektrolitów w układzie.
7. Klasy czystości wód powierzchniowych
Klasa 1
Wody o bardzo dobrej jakości A
1
. Wykorzystuje się je bezpośrednio (bez oczyszczania) do zaopatrzania
ludności do spożycia. Wskaźniki wszystkich grup dla klasy A
1
nie wskazują na jakiekolwiek oddziaływania
antropogeniczne
Klasa 2
Wody dobrej jakości A
2
. Dla większości wskaźników spełniają wymagania wód pitnych, ale są narażone na
niewielki wpływ czynników przemysłowych i często wymagają uzdatniania metodami mechanicznymi.
Poddaje się je procesom filtracji np. w filtrach piaskowych.
Klasa 3
Wody zadowalającej jakości A
3
. Wody te muszą być poddane uzdatnianiu celem wyeliminowania
zawyżonych wartości parametrów z grupy biogennych (azot, fosfor)
Klasa 4
Wody niezadowalającej jakości A
3
. Przekroczone wskaźniki biologiczne oraz zawyżone wartości zasolenia, w
tym również metali. Wody te ewentualnie mogą być skierowane do picia po poddaniu pełnemu cyklowi
oczyszczania, w skład którego wchodzą metod mechaniczne i biologiczne LUB metody mechaniczne,
fizykochemiczne i biologiczne
Klasa 5
Wody złej jakości- ścieki.
Nie spełniają żadnego z kryteriów wód powierzchniowych poprzednich klas czystości- przekroczone
wszystkie wskaźniki.
8. Jakie parametry musi mieć woda aby uznać ją za ściek a jakie żeby uznać za wodę zdatną do picia
Woda 1. klasy
ściek
Temperatura °C
Do 22
Pow. 28-35
pH
6,5-8,5
<5,5 lub >9,5
BZT
5
[mgO
2
/dm
3
]
Do 2
Pow.12
Przewodnictwo [µS/cm
3
]
Do 500
Pow.2000
Sub. Rozpuszczone [mg/dm
3
]
Do 250
Pow.1200
Siarczany SO
4
2-
[mgSO
4
2-
/dm
3
]
Do 100
Pow.300
Chlorki [mgCl
-
/dm
3
]
Do 100
Pow.400
Suma metali [mg/dm
3
]
Do 1
Pow.1-2
Fosfor ogólny [mgP/dm
3
]
Do 0,2
Pow. 1
Azot ogólny [mgN/dm
3
]
Do 2,5
Pow. 20
Chlorofil [µg/dm
3
]
Do 10
Pow.100
Zawiesina ogólna [mg/dm
3
]
Do 15
Pow. 100
9. Omówić proces sedymentacji.
SEDYMENTACJA-proces polegający na opadaniu pod wpływem siły grawitacyjnej gęstej, zdyspergowanej
fazy stałej. Opadanie odbywa się wtedy, gdy gęstość fazy stałej jest większa od gęstości ośrodka.
Sedymentacja uwarunkowana jest wymiarami, kształtem, powierzchnia właściwą, gęstością cząstek
zawartych w zawiesinie. Wpływa na nią temperatura (lepkość nie może być zbyt duża oraz wydzielające się
substancje gazowe, które mogą hamować proces.
10. napisać reakcję nitryfikacji i co to jest
Nitryfikacja – proces utlenianiaamoniaku i soli amonowych do azotanów(III) i azotanów(V) prowadzony
przez bakterie nitryfikacyjne.
NH4 + 0,5 O2 + 2e NH2OH + H+
NH2OH + H2O NO2- + 4e + 5H+
11. strefy saprobowości
Woda polisaprobowa- taka, w której znajduje się bardzo duża ilość roztoczy- woda pozaklasowa
Woda alfa-mezosaprobowa- ilość zanieczyszczeń jest znacznie mniejsza. Charakteryzuje się szybko
zachodzącymi procesami utleniania, dzięki istnieniu w tych wodach mikroorganizmów- 3 klasa czystości
Woda beta-mezosaprobowa- zanieczyszczona w stopniu umiarkowanym. Bogata w różnorakie organizmy,
ktre przyczyniają się do samooczyszczania- 2 klasa czastości
Woda oligosaprobowa- 1 klasa czystości. Wody zamieszkałe przez florę i faunę. Zdatna do picia i hodowla
ryb łososiowatych.
12. Buforowość
Bufor- mieszanina np. słabego kwasu i soli tego kwasu
CH
3
COOH+CH
3
COONH
4
pH=5,5
Mają zdolność do utrzymywania stałej wartości pH po wprowadzeniu analitycznej ilości mocnego kwasu lub
zasady.
Właściwości buforowe wykazuje czysta woda naturalna, w której znajdują się związki pochodzące od kwasu
węglowego i nie znajdują się niej zanieczyszczenia antropogeniczne. Buforowość wód naturalnych ma
wartość pH ok. 6,4. Może pochodzić od fosforanów lub boranów.
H
2
CO
3
H
+
+CO
3
-
K
1
10
-pH
=
pH=-logK
1
+log[HCO
3
-
]-log[H
2
O·CO
2
]
w 295K K
1
=4,310
-7
to:
pH=6,37+ log[HCO
3
-
]-log[H
2
O·CO
2
]
[HCO
3
-
]- stężenie wodorowęglanów= zasadowość wodorowęglanowa
[H
2
O·CO
2
]- stężenie wolnego CO
2
, czyli kwasowość
Zobojętnianie w wodzie naturalnej:
OH
-
+CO
2
HCO
3
-
OH
-
+H
2
CO
3
HCO
3
-
+H
2
O
2OH
-
+CO
2
CO
3
2-
+H
2
O
2OH
-
+H
2
CO
3
CO
3
2-
+2H
2
O
Zobojętnianie mocnych zasad w wodzie naturalnej powoduje zmniejszenie kwasowości wody naturalnej i
wzrost zasadowości ogólnej
pH wody po zobojętnieniu:
pH=6,37+ log[HCO
3
-
+X]-log[H
2
CO
3
-X]
X- ilość mocnej zasady zobojętnianej przez jednostkę objętości wody naturalnej
Buforowość wód naturalnych pH=6,4- stan równowagi buforowej w wodzie naturalnej
13. Eutrofizacja
Polega na zwiększaniu się w wodzie zawartości substancji pożywkowych, którymi SA głównie di tlenek
węgla, azotany V, rozpuszczalne ortofosforany. Nadmiar związków fosforu i azotu prowadzi do wzrostu
materii organicznej, a ta zanieczyszcza wode. Obecnośc glonów w wodach pogarsza barwę, zapach, smak
wody, obniż zawartość tlenu w wodzie. Glony mogą powodować zakłócenia w obiegach chłodniczych,
powoduja zatykanie urządzeń zwłaszcza tych do uzdatniania wody. Obumarłe czastki glonów mają zdolność
do kumulowania toksycznych substancji np. metali ciężkich. Masowy rozwoj glonów prowadzi do
uniemożliwienia wykorzystania wód dla celów gospodarczych a nawet przemysłowych.
Eutrofizacja – proces wzbogacania zbiorników wodnych w substancje pokarmowe (nutrienty, biogeny), jest to wzrost
trofii, czyli żyzności wód. Dotyczy to nie tylko zbiorników wodnych ale również ścieków.

Biorąc pod uwagę geologiczną historię jezior, najczęściej uważa się, że eutrofizacja jest procesem naturalnym
(według innych autorów naturalnym procesem jest dystrofizacja, a eutrofizacja uważana jest za proces
antropogeniczny, spowodowany zmianami w zlewni). Większość jezior zwłaszcza polodowcowych na początku była
oligotroficzna, jednak ciągły dopływ do nich substancji z zewnątrz (np. ze zlewni i atmosfery), powodował wzrost
koncentracji biogenów, a tym samym zwiększał trofię zbiornika. Jest to tzw. harmoniczna sukcesja jezior. Normalnie
jest to proces powolny, ale został on mocno przyśpieszony w wyniku działań człowieka, takich jak zrzuty ścieków
przemysłowych i komunalnych oraz w wyniku intensyfikacji rolnictwa. W szczególnie drastycznych przypadkach, np.
przy zrzucaniu do jezior surowych ścieków komunalnych czy gnojówki, dochodzi do osiągnięcia przez zbiornik
stanów niespotykanych w naturze: politrofii i hypertrofii (zobacz też jezioro saprotroficzne). Następuje wtedy niemal
całkowity zanik organizmów wyższych poza cienką, kilkudziesięciocentymetrową warstwą wody stykającą się z
atmosferą.
Specyficznie przebiega proces eutrofizacji w wodach torfowiskowych. Dopływające z otaczającego je torfowiska
substancje humusowe, tworzą stałe kompleksy ze związkami fosforu i azotu, czyniąc je niedostępnymi dla roślin i
glonów. W razie jego degradacji, zwykle przez przesuszenie, następuje szczególnie szybka eutrofizacja: do wody
dostają się zarówno biogeny ze zlewni, jak i te uwolnione z torfowiska (i związków humusowych).Spis treści [ukryj]
Przyczyny eutrofizacji
Główną przyczyną eutrofizacji jest wzrastający ładunek pierwiastków (biogenów), przede wszystkim fosforu. Wzrost
dopływu pierwiastków biogennych, w tym wypadku fosforu, obejmuje nie tylko wzrost zrzutów ścieków, ale także
wzrost zawartości środków piorących i innych detergentów zawierających fosfor w ściekach. Większa ilość tego
biogenu związana jest także z intensyfikacją nawożenia oraz wzrostem erozji w zlewni. Wzrost dopływu azotu,
drugiego z biogenów, związany jest z wzrastającą emisją tlenków azotu do atmosfery, a tym samym dużą ich
zawartością w opadach atmosferycznych. Nawożenie ziemi poddanej pod uprawę, również przyczynia się do wzrostu
ładunku azotu, ponieważ fosfor znajdujący sie w glebie nie jest pierwiastkiem silnie mobilnym. Silne opady deszczu
mogą łatwo wypłukiwać azot z powierzchniowej warstwy gleby oraz z nawozów, przy czym do zbiornika mogą być
też wniesione znaczne ilości fosforu.
Następstwa eutrofizacji
Na początku procesu eutrofizacji następuje umiarkowany wzrost produkcji biologicznej, co jest korzystne i przekłada
się na wzrost produkcji ryb, ale po przekroczeniu pewnej granicy obserwuje się już wiele niepożądanych następstw
tego procesu takich jak:
Masowy rozwój organizmów fitoplanktonowych powodujących w powierzchniowej warstwie wody tzw. zakwity i
zmniejszających przezroczystość tej wody. W zbiorniku wzrasta przede wszystkim ilość sinic, które utrzymując się na
powierzchni tworzą często kożuchy. Masowe nagromadzenia tych glonów powodują nie tylko śmiertelność ich
samych, ale również występującej tam fauny. Ponadto niektóre szczepy sinic wydzielają toksyny i nierzadko
powodują uczulenia. Wydzielanie przez glony organicznych substancji psujących smak i zapach wody dyskwalifikuje
takie zbiorniki jako źródła wody pitnej. Do organizmów powodujących takie problemy należą Anabaena sp. oraz
Aphanisomenon sp. wiążące azot, oraz niezdolne do wiązania azotu gatunki z rodzaju Microcystis, Limnotrix i
Planktotrix. Zakwity występują nie tylko w zbiornikach, ale również w rzekach. W przypadku tych ostatnich
powodowane są zwykle przez zielenice lub okrzemki, które są jednak mniej uciążliwe niż sinice, których miejscem
występowania są przeważnie wody stojące.
Ustępowanie roślinności zanurzonej z powodu pogarszających się warunków świetlnych w strefie przybrzeżnej -
litoral. Postępujące zanikanie światła pośrednio prowadzi także do przebudowy fauny tam występującej. Kożuchy
glonów w tej strefie zupełnie uniemożliwiają rekreacyjne użytkowanie wody.
Wyczerpanie zasobów tlenu w warstwie przydennej - hypolimnionie, a zwłaszcza profundalu i w osadach dennych
prowadzi do zaniku fauny głębinowej, w tym także gatunków reliktowych. Również tarło niektórych ryb nie dochodzi
do skutku, co prowadzi do ustępowania cennych gatunków np. łososia. Często zdarza się że ryby giną zimą pod
pokrywą lodową w wyniku braku tlenu. W warunkach anaerobowych dochodzi dodatkowo do różnych procesów
chemicznych (amonifikacja, denitryfikacja) i powstawania metanu.
Występowanie siarkowodoru, który podczas całkowitego braku tlenu może przechodzić do warstw powierzchniowych
wody, ulatniać sie i zatruwać atmosferę w okolicy.
Metody kontroli i zapobiegania eutrofizacji

Prostym sposobem kontroli trofii zbiornika jest badanie widzialności krążka Secchiego: białego krążka o średnicy 30
cm, opuszczanego na wyskalowanej lince. Jego widzialność (ang. Secchidepth) zależy od ilości zawiesiny w wodzie, a
ta z kolei – głównie od ilości glonów. Na podstawie widzialności krążka Secchiego można obliczyć tzw. wskaźnik
Carlsona[1][2], na podstawie którego porównuje się trofię poszczególnych zbiorników lub zmiany trofii danego
zbiornika w czasie. Tenże wskaźnik można też obliczyć, mając do dyspozycji dane o ilości chlorofilu a (pomiary
fotometryczne) lub związków fosforu.
Najskuteczniejszą metodą walki z procesem eutrofizacji jest ograniczenie antropogenicznego dopływu biogenów do
wód - kompostowanie odchodów w miejsce odprowadzania ich do ujścia kanalizacyjnego, redukcja zawartości
fosforanów w środkach piorących używanych w gospodarstwach domowych, ograniczanie stosowania nawozów
sztucznych w rolnictwie.
14. Ścieki - rozumie się przez to wprowadzane do wód lub do ziemi:
a) wody zużyte na cele bytowe lub gospodarcze,
b) ciekłe odchody zwierzęce, z wyjątkiem gnojówki i gnojowicy przeznaczonych do rolniczego wykorzystania w
sposób i na zasadach określonych w przepisach o nawozach i nawożeniu,
c) wody opadowe lub roztopowe, ujęte w systemy kanalizacyjne, pochodzące z powierzchni zanieczyszczonych, w
tym z centrów miast, terenów przemysłowych i składowych, baz transportowych oraz dróg i parkingów o trwałej
nawierzchni,
d) wody odciekowe ze składowisk odpadów, wykorzystane solanki, wody lecznicze i termalne,
e) wody pochodzące z odwodnienia zakładów górniczych, z wyjątkiem wód wprowadzanych do górotworu, jeżeli
rodzaje i ilość substancji zawartych w wodzie wprowadzanej do górotworu są tożsame z rodzajami i ilością zawartymi
w pobranej wodzie,
f) wody wykorzystane, odprowadzane z obiektów gospodarki rybackiej, jeżeli występują w nich nowe substancje lub
zwiększone zostaną ilości substancji w stosunku do zawartych w pobranej wodzie,
15) ściekach bytowych - rozumie się przez to ścieki z budynków przeznaczonych na pobyt ludzi, z osiedli
mieszkaniowych oraz z terenów usługowych, powstające w szczególności w wyniku ludzkiego metabolizmu oraz
funkcjonowania gospodarstw domowych,
16) ściekach komunalnych - rozumie się przez to ścieki bytowe lub mieszaninę ścieków bytowych ze ściekami
przemysłowymi albo wodami opadowymi lub roztopowymi,
17) ściekach przemysłowych - rozumie się przez to ścieki odprowadzane z terenów, na których prowadzi się
działalność handlową lub przemysłową albo składową, niebędące ściekami bytowymi lub wodami opadowymi,
Strefy natlenienia w zbiornikach wodnych:
a) Aerobowa – wykazuje bardzo dobre napowietrzenie, wszystkie zanieczyszczenia znajdujące się w tej wodzie
powinny być na najwyższym stopniu utlenienia
b) Przejściowa – stężenie rozpuszczonego tlenu ulega zmniejszeniu od powierzchni wody do strefy anaerobowej
c) Anaerobowa – brak tlenu, warunki typowo redukcyjne, zanieczyszczenia organiczne są redukowane do
węglowodorów prostych nasyconych, najczęściej do metanu; takie warunki występują na dnie rzek (osad
denny),
a także w komorach fermentacyjnych, w przewodach sieci kanalizacyjnej
15. Związki refrakcyjne – substancje które nie podlegają procesowi mineralizacji, nie zachodzi zmiana tego
związku w mniej szkodliwy pod wpływem naturalnych czynników; mogą ulec rozpadowi pod wpływem
specjalnych parametrów dobranych przez człowieka
16. Monitoring wód powierzchniowych jest konieczny, prowadzony w trzech obszarach:
-
Monitoring diagnostyczny: kontrola wskaźników jakości wody co najmniej raz na miesiąc
jeśli
chodzi
o bilans tlenowy, wskaźnik zasolenia i mikroorganizmy, raz na kwartał – zawartość metali
ciężkich, raz na rok – wskaźnik zanieczyszczeń przemysłowych oraz wytypowanych przez
stację epidemiologiczną wskaźników biologicznych.
-
Monitoring operacyjny: kiedy woda w ściekach zawiera metale ciężkie, są one
diagnozowane
raz
na
miesiąc,
jest
w ścisłej współpracy z m. diagnostycznym.
-
Monitoring badawczy: kontrola zanieczyszczeń jeżeli wystąpi awaria na danym terenie, jest
podejrzenie zanieczyszczenia wód zanieczyszczeniami które na danym terenie są
przypadkowe, niemożliwe do wystąpienia. Monitoringiem powinny być objęte zbiorniki
która znajdują się na granicy, a zlewnie wtedy gdy ich powierzchnia przekracza 2500km
2

Woda mineralna to taka której mineralizacja wynosi od 1500 do 4000mg/dm
3
, zawiera związki wapnia, magnezu,
sodu, siarczany, wodorowęglany, CO
2
, związki jodu.
Wody stołowe (lub źródlane wzbogacone w minerały) mogą być produkowane tylko z wody źródlanej poprzez
dodanie do nich soli mineralnych, które zawierają składniki fizjologicznie czynne (wapń, magnez, sód,
wodorowęglany) lub wody mineralnej.
Wody lecznicze posiadają specyficzne cechy farmakologiczne, spowodowane podwyższoną zawartością składników
mineralnych i są uznane za wody lecznicze, ich mineralizacja jest większa od 4000mg/dm
3
i dochodzi do
25000mg/dm
3
.
17. Systemy obiegu wód:
-
otwarty- jednorazowe użycie wody i zrzut do kanalizacji jako ścieku, musi się zawsze znajdować woda
przeznaczona dla celów higieniczno-sanitarnych i gospodarczych.
-
zamknięty- wielokrotne użycie wody lub ścieków z ewentualnymi uzupełnieniami strat świeżą wodą, muszą
się znajdować w tym obiegu wody chłodnicze i kondensat parowy.
-
półzamknięty (półotwarty)- rozdział wód zużytych nadających się do obiegu zamkniętego i otwartego, można
ograniczyć przelotowość ścieków.
Kanalizacja ogólnoskładna- wszystkie wody zużyte (również deszczowe) odprowadza się wspólną kanalizacją
rurociągową (wady: konieczność rozcieńczania ścieków, system do stosowania w małych oczyszczalniach)
Kanalizacja rozdzielcza- ustalana w zależności od asortymentów produkowanych dla dużych zakładów
przemysłowych
Podział ścieków ze względu na pochodzenie:
-
bytowo-gospodarcze- pochodzą z domów mieszkalnych, garaży, pralni, stołówek;
-
przemysłowe- pochodzą z działalności przemysłowej (organiczne i nieorganiczne, metaliczne, pochodzące z
koksowni, pochodzące z hydrometalicznego otrzymywania cynku, z przemysłu papierniczego itd.),
-
miejskie- mieszanina ścieków bytowo-gospodarczych i przemysłowych,
-
deszczowe- zbierane z pow. dachów, chodników, ulic, parkingów (często kwalifikowane do miejskich)
NZT (natychmiastowe zużycie tlenu) – umowny wskaźnik zanieczyszczenia wód i ścieków, który wyraża ilość tlenu
zużywanego w ciągu 15 minut na utlenienie związków silnie redukujących. Charakteryzuje związki, które po 15
minutach
w wodach i ściekach mogą ulec przekształceniu (np. aldehydy które przechodzą w kwasy tłuszczowe). Im mniejszy
rodnik tym toksyczność w tych wodach jest bardziej prawdopodobna).
ChZT (chemiczne zapotrzebowanie tlenu) – umowne pojęcie oznaczające ilość tlenu (mg/dm³), pobranego z
utleniaczy
(np. dichromiany (Cr
2
O
7
2-
), manganiany (VII) (MnO
4
-
)) na utlenienie związków organicznych i niektórych
nieorganicznych
(np. siarczanów(IV), siarczków, żelaza(II)) do najwyższego stopnia utlenienia. Stosowane jako miara zanieczyszczeń
w
wodzie
i ściekach.
BZT
5
(pięciodniowe biochemiczne zapotrzebowanie tlenu) – wskaźnik który odtwarza proces samooczyszczania wód
i ścieków w jego naturalnych warunkach, wyraża on ilość tlenu jaka jest potrzebna do utlenienia całkowitego
związków organicznych zawartych w dm
3
próbki, która jest przechowywana w ciemni w 20°C przez okres 20 dni.
Proces ten wymaga zaszczepienia próbki za pomocą ścieków bytowo-gosp. które powinny być odstane co najmniej
przez dobę do półtorej, nie dłużej.
OWO (ogólny węgiel organiczny) – jednostka przeliczeniowa stosowana w hydrochemicznej ocenie jakości wód,
określa ilość węgla organicznego w wodzie w związkach organicznych i nieorganicznych(przez całkowite spalenie
próbki, a następnie analizę osadu metodami spektrometrycznymi).
Fotosynteza - proces stanowiący jeden z najważniejszych etapów cyklu obiegu O
2
w przyrodzie. Ditlen jest
zużywany w procesach w których wytwarzana jest niezbędna do życia energia przez utlenianie substancji
organicznych. Ditlenek węgla łączy się z wodą, która spełnia rolę donora wodoru, koniecznego do redukcji CO
2
w
reakcji katalizowanej przez światło powstaje wodorowęglan oraz tlen: CO
2
+ nH
2
O →hV→ (CH
2
O)
n
+nO
2
Zachodzi tylko i wyłącznie z udziałem energii świetlnej, która jest absorbowana przez rośliny zielone (zawierające
chlorofil) i jest przekształcana w energię chemiczną, która jest magazynowana w połączeniach organicznych. Na
wytworzenie 180g (1mol) glukozy (C
6
H
12
O
6
) potrzebna jest energia w ilości ok. 2900kJ w temperaturze 298K (25
o
C)
pod ciśnieniem normalnym. Przy rozkładzie 1 mola glukozy z udziałem tlenu odbywa się proces oddychania
tlenowego: C
6
H
12
O
6
+0
2
CO
2
+O
2
+ energia
Proces ten odbywać się może cały rok (przy dostępie światła słonecznego; im większy dostęp energii słonecznej, tym
proces jest intensywniejszy).
Zanieczyszczenia biologiczne w wodach i ściekach:
1) Strefy saprobowości:
Saprobowość to parametr obrazujący zawartość w wodzie roztoczy, które pobierają pokarm z martwych szczątków
organicznych. Im wyższa saprobowość, tym większe zanieczyszczenie wody. Rozróżnia się 4 strefy saprobowości:
-
Polisaprobowa – charakterystyczna dla wód najsilniej zanieczyszczonych (poza klasowych)
-
Alfa-mezosaprobowa – wody o mniejszym stopniu zanieczyszczenia; w wodach zachodzą
bardzo szybko procesy utleniania na skutek intensywnego rozwoju mikroorganizmów
-
Beta-mezosaprobowa – wody o umiarkowanym zanieczyszczeniu, dobrym natlenieniu
prowadzącym do rozwoju mikroorganizmów i szybkich przemian biochemicznych; są w
niezbyt dużych ilościach zamieszkałe przez niektóre gatunki flory i fauny
-
Oligosaprobowe – najczystsze wody, występuje różnorodność flory i fauny od
jednokomórkowców aż po ryby różnych gatunków
2) Miano Coli – zwane też mianem pałeczek okrężnicy to najmniejsza objętość wody (w cm
3
), z której w hodowli
powstanie przynajmniej jedna kolonia E.coli. Określanie miana coli jest podstawową metodą oceny, czy woda lub
żywność miały kontakt z odchodami.
3) Zawartość bakterii chorobotwórczych
Proces samooczyszczania:
Zespół samoistnych procesów fizyczno-biochemicznych zmniejszający stopień zanieczyszczeń wód i ścieków.
Efektem tego procesu jest zmniejszenie zanieczyszczenia antropogenicznego wód, następuje to poprzez rozkład
substancji zanieczyszczających, ich rozcieńczenie, lub zatrzymanie przez środowisko skalne. Dzięki temu procesowi
niewielkie porcje zanieczyszczeń są w naturalny sposób usuwane nie powodując szkód dla środowiska. Mają na to
wpływ
procesy
fizyczne
i chemiczne.
Zdolność wód do samooczyszczania zależy od temperatury, nasłonecznienia, rodzaju i ilości zanieczyszczeń, ilości
dopływających wód lub ścieków do danego zbiornika lub rzeki, rozwinięcie linii brzegowej rzek, prędkości przepływu
czyli nurtu rzeki, pionowych ruchów wody zwiększających natlenienie, zróżnicowania mikrosiedlisk, roślinności na
brzegach,
dnie
i w nurcie. Zjawiska sprzyjające procesowi samooczyszczania:
- Fizyczne: rozcieńczanie wód innymi wodami dopływającymi (także opadami), proces osadzania się zawiesin w
tych wodach na dnie zbiorników lub na brzegach rzek (zmniejsza mętność wód).
- Chemiczne: reakcje zobojętniania, utleniania, redukcji, wytrącania, które mogą prowadzić do obniżenia
szkodliwego działania wód na florę i faunę (wody płynące) lub prowadzić do szkodliwego działania (w wodach
stojących)
- Biodegradacji: dotyczy to głównie zanieczyszczeń o charakterze organicznym, jest charakterystyczna dla wód
zanieczyszczonych ściekami bytowo-gospodarczymi, z przemysłu rolno-spożywczego, chemicznego itp.
Czynniki hamujące przebieg procesu: metale ciężkie (toksykanty), zwiększone stężenie detergentów i pestycydów,
substancje powierzchniowo czynne powodujące pienienie wód i ścieków, substancje organiczne o małej
rozpuszczalności w wodzie, ponieważ pływają po powierzchni wód lub ścieków, uniemożliwiając rozpuszczanie
tlenu.
Proces eutrofizacji to proces przeciwstawny do procesu samooczyszczania. Prowadzi do zwiększenia w wodach i
rzekach ilości zanieczyszczeń, którymi są głównie nutrienty lub biogeny, a to z kolei prowadzi do zwiększenia ilości
mikroorganizmów, głównie glonów, pleśni i grzybów. Są one znacznie lżejsze od ciężaru własnego wody i wypływają
na powierzchnię wody. Warstwa ta zasłania wówczas powierzchnię wody od atmosfery, czyli zahamowuje dopływ
tlenu i energii słonecznej które warunkują proces samooczyszczania.
Sedymentacja:
W wodach powierzchniowych sedymentacja umożliwia zmniejszenie zagęszczenia cząstek, poprawę barwy i mętności
tych wód. W rzekach sedymentacja jest uzależniona od średniej prędkości wody. Opadanie cząstek zawieszonych w
wodach płynących jest różna w różnych jej miejscach.
Do sedymentacji zawiesin używa się osadników (wstępnych i wtórnych).
W zbiornikach stojących sedymentacja niesie negatywne konsekwencje opadające cząstki stałe tworzą osady denne,
które mają warunki anaerobowe albo ograniczony dostęp tlenu i może następować biochemiczny rozkład osadów na
związki
o mniejszej masie cząsteczkowej, może następować proces gnicia tych osadów i wydzielania się gazów, które mogą

zwierać substancje powodujące nieprzyjemne zapachy i wtórne zanieczyszczenie (odory – H
2
S, NH
3
). W skrajnych
warunkach gazy mogą spulchniać osady i wypłycanie zbiorników i rzek jeśli mają powolny nurt, a jeśli duży do osady
są wyrzucane na brzeg rzeki.
Źródła zanieczyszczeń związkami azotu wód powierzchniowych i gruntowych:
-
ścieki miejskie i przemysłowe (głównie przemysł przetwórstwa ryb)
-
spływy wód powierzchniowych z terenów rolniczych
-
opady atmosferyczne
-
mocz zwierzęcy
-
wiązanie wolnego azotu przez mikroorganizmy w wodzie i glebie
Nitryfikacja:
Proces utleniania amoniaku do azotanów(III) prowadzony przez bakterie nitryfikacyjne. Azotany powstałe w tym
procesie mogą zostać przyswojone przez rośliny. Proces ten zachodzi w warunkach tlenowych gdzie w pierwszym
etapie pierwsza grupa bakterii nitryfikacyjnych utlenia jon amonowy do azotanów(III) a druga grupa bakterii utlenia
powstały azotan(III) do azotanów(V). Bakterie Nitrosomonas zamieniają amoniak w postaci jonu amonowego NH4+
w azotyny (azotany(III)).
Reakcja procesu asymilacji:
N
2
+ bakterie (glony) białka
N
2
+ 3H
2
2NH
3
CO
2
+H
2
O+NH
3
CH
2
NH
2
COOH+O
2
Proces mineralizacji (amonifikacja, dezaminacja) – proces biochemicznego rozkładu materii organicznej pochodzącej
z obumarłych roślin lub zwierząt, w wyniku którego azot organiczny podlega przemianie do azanu (azotu
amonowego) lub amoniaku. W konsekwencji tego procesu wiązania azotu podlegają hydrolizie, redukcji, w wyniku
czego azot przedostaje się do roztworów wodnych. Do fazy ciekłej azot przechodzi w formie jonowej NH
4
(proces
dezaminacji aminokwasów)
Denitryfikacja – proces redukcji azotanów do azotu. Redukcja azotanów do azotynów to denitryfikacja częściowa a
denitryfikacja do azotu atmosferycznego to denitryfikacja całkowita. Proces ten jest przeprowadzany przez różne
bakterie (określane jako bakterie denitryfikacyjne).
Metody pozbywania się związków azotu z wód:
1) biologicznej denitryfikacji – związki organiczne w wodach przekształcane są w lotne kwasy tłuszczowe
(LKT) których głównym składnikiem jest kwas octowy. W zależności od ilości azotanów mogą powstawać
również tolueny, ksyleny- gdy ich małe ilości są obecne to proces denitryfikacji musi być uzupełniony o
proces oczyszczania wód w hydrolizerze w wyniku czego następuje rozkład tych związków do związków
mineralnych
2) Stosowanie jonitów (filtrów które powodują wzbogacenie mieszaniny lub pozbycie się z mieszaniny
określonego jonu)
Źródła zanieczyszczeń wód powierzchniowych fosforem:
-
proces rozpuszczania i wietrzenia minerałów fosforanowych
-
opady atmosferyczne (ilość zależy od rodzaju terenu)
-
ścieki bytowo-gospodarcze (zwłaszcza środki piorące)
-
tereny rolnicze (także hodowle ryb, hodowle pod folią, szklarnie)
-
tereny uprzemysłowione (głównie produkcja nawozów, gorzelnie, produkcja mączki rybnej)
-
mocz i kał ludzki i zwierzęcy
Metody chemicznego usuwania fosforu z wód i ścieków:
- proces flotacji trójfazowej (w procesie oczyszczania wód i ścieków to proces rozdziału cząstek stałych) wydzielanie
części użytecznej w formie gazowej
- proces elektroflotacji (usuwanie części zanieczyszczeń na pęcherzykach gazów, rozdzielanie zanieczyszczeń na
elektrodach)
Metody biologicznego usuwania fosforu z wód i ścieków:
- metoda osadu czynnego (bakterie nitkowate na filtrach piaskowych
- metoda złóż biologicznych.
Inne metody usuwania fosforu z wód i ścieków (kosztowne, ale bardzo skuteczne): metoda wymiany jonowej, metoda
odwróconej osmozy, koagulacja, flokulacja, adsorpcja na naturalnych sorbentach lub chemicznych sorbentach.

Hydrobotaniczne metody – wykorzystuje się aktywność odpowiednich mikroorganizmów, częściowo związki
fosforu są potem wykorzystywane jako nawóz
Schemat wstępnego mechanicznego oczyszczania ścieków miejskich:
1) kraty – piaskowniki – odtłuszczacze – (zbiorniki wstępnego napowietrzania) – ścieki wstępnie mechanicznie
oczyszczone
2) ścieki wstępnie oczyszczone (do odtłuszczaczy) – osadniki – chlorowanie – ścieki mechanicznie oczyszczone
osad – komory fermentacyjne – poletka osuszające – unieszkodliwione osady ściekowe
Schemat pełnego mechanicznego oczyszczania
wstępne mechaniczne oczyszczanie – osadniki wstępne – biologiczne oczyszczanie – osadniki wtórne – (chlorowanie)
– ścieki biologicznie oczyszczone
osad z wstępnego oczyszczania i osadników wtórnych – komory fermentacyjne – poletka osuszające –
unieszkodliwione osady ściekowe
Uzdatnianie wód:
1. fizyczne (cedzenie, sedymentacja w osadnikach, napowietrzanie, filtracja, chłodzenie)
2. fizykochemiczne (odżelazianie, odmanganianie, koagulacja, adsorpcja, wymiana jonowa, elektroliza, odwrócona
osmoza)
3. chemiczne (zmiękczanie, odkrzemianie, odkwaszanie, alkalizacja, zakwaszanie, chlorowanie, ozonowanie)
4. biologiczne (filtracja powolna, denitryfikacja)
5. termiczne (podgrzewanie, destylacja, wymrażanie)
Kwasowość wody – zdolność wody do zobojętniania wprowadzanych do niej silnych zasad nieorganicznych,
wywołana jest obecnością wolnego kwasu węglowego, a także kwasów humusowych oraz produktów hydrolizy soli
zawartych w wodach
Zasadowość wody – zdolność do zobojętniania mocnych kwasów nieorganicznych wobec umownych wskaźników
barwnych, jest powodowana przez wodorowęglany, węglany, wodorotlenki, borany, krzemiany, fosforany
Buforowość wód – dążenie osiągnięcia w wodzie stałego pH, niezależnie od tego jakie zanieczyszczenia do tej wody
dopływają, pod warunkiem, że wszystkie procesy samooczyszczania w tych wodach zachodzą
Flokulacja – proces fizykochemiczny związany z transportem masy i polega na zmniejszaniu stopnia dyspersji w
układzie na skutek zderzeń zdestabilizowanych cząstek stałych. Proces zachodzi pod wpływem niskoenergetycznych
sił adlineacji (oddziaływanie łańcuch-łańcuch) proces ten prowadzi do powstania flokuł (kłaczków) które w stosunku
do osadów skoagulowanych zajmują duże objętości (przez zamkniętą w nich wodę)
Koagulacja:
- perikinetyczna- zderzenia cząstek niemalże pozbawionych ładunku w sposób efektywny, tzn. zderzenia tworzą
trwałe połączenia.
- ortokinetyczna- zachodzi jeśli zderzenia cząstek są ukierunkowane, co jest związane z istnieniem w ośrodku siły
odśrodkowej i ciężkości, warunkiem jest istnienie układów polidyspersyjnych.
Metoda koagulacji jest wykorzystywana do uzdatniania wody jeśli występują w niej drobno zdyspersowane
zawiesiny organiczne jak i nieorganiczne. Jest szeroko wykorzystywana w procesie oczyszczania ścieków miejskich i
przemysłowych. Do prawidłowego przebiegu koagulacji potrzebny jest odpowiedni rodzaj i stężenie zanieczyszczeń,
odpowiednie pH środowiska.
Etapy oczyszczania wód:
- metody mechaniczne,
- metody fizyczne: gotowanie wody, pasteryzacja, naświetlanie promieniami UV, fale ultradźwiękowe,
- metody oligodynamiczne- bakteriobójcze działanie soli srebra, miedzi, rtęci,
- metody chemiczne: związki silnie utleniające (chlor gazowy, tlenek chloru, ozon, chloryn sodu lub wapnia)
Wyszukiwarka
Podobne podstrony:
Opracowania na egzamin z OP id Nieznany
Opracowanie FINAL miniaturka id Nieznany
Notatki na egzamin genetyka id Nieznany
Opracowane Prawo Oswiatowe id 3 Nieznany
Patofizjologia egzamin 2011 id Nieznany
Opracowanie zagadnien IUDG id 3 Nieznany
opracowane zagadnienia mgr id 3 Nieznany
Opracowanie egamin elektro id 3 Nieznany
Opracowanie pytan biomedyka id Nieznany
odpowiedzi egzamin inz (1) id 3 Nieznany
Opracowanie wykladow z SIPu id Nieznany
Opracowania kosztowe wycena id Nieznany
Opracowanie FINAL miniaturka id Nieznany
Notatki na egzamin genetyka id Nieznany
!!!!OPRACOWANIE EGZAMIN!!!!id 4 Nieznany (2)
nom NOM egzamin opracowane id 7 Nieznany
opracowanie 3 egzaminow id 3381 Nieznany
opracowanie II sem egzamin id 2 Nieznany
więcej podobnych podstron