
1
Numer
ćwiczenia:
3
Dział analizy i temat ćwiczenia:
Analiza miareczkowa – alkacymetria.
Sporządzanie i mianowanie roztworu NaOH.
Data wykonania
ćwiczenia:
od 08.04.13 r.
do 15.04.13 r.
Data oddania
sprawozdania:
22.04.13 r.
Grupa:
A3
Imię i nazwisko:
Przemysław Kołoczek
Nazwisko
sprawdzającego:
Uwagi:
Ocena:
2
1. Wstęp.
Celem ćwiczenia było wyznaczenie dokładnego stężenia (miana) przygotowanego
wcześniej roztworu NaOH. Mianowany roztwór NaOH sporządza się ze stężonego
roztworu (50%), nie zawierającego węglanów. Powstający ewentualnie węglan sodu
opada na dno naczynia, ponieważ jest w tych warunkach nierozpuszczalny. Roztwór taki
rozcieńcza się w kolbie miarowej o odpowiedniej pojemności wodą wygotowaną, nie
zawierającą dwutlenku węgla, ponieważ powstający węglan sodu zaniża stężenie
otrzymanego roztworu, a to z kolei generuje dodatkowe błędy oznaczeń wykonywanych
przy użyciu takiego roztworu. Oznaczenie miana roztworu NaOH polega na kilkukrotnym
zmiareczkowaniu odważki wodoroftalanu potasu przygotowanym roztworem, wobec
fenoloftaleiny jako wskaźnika, do lekko różowego zabarwienia roztworu.
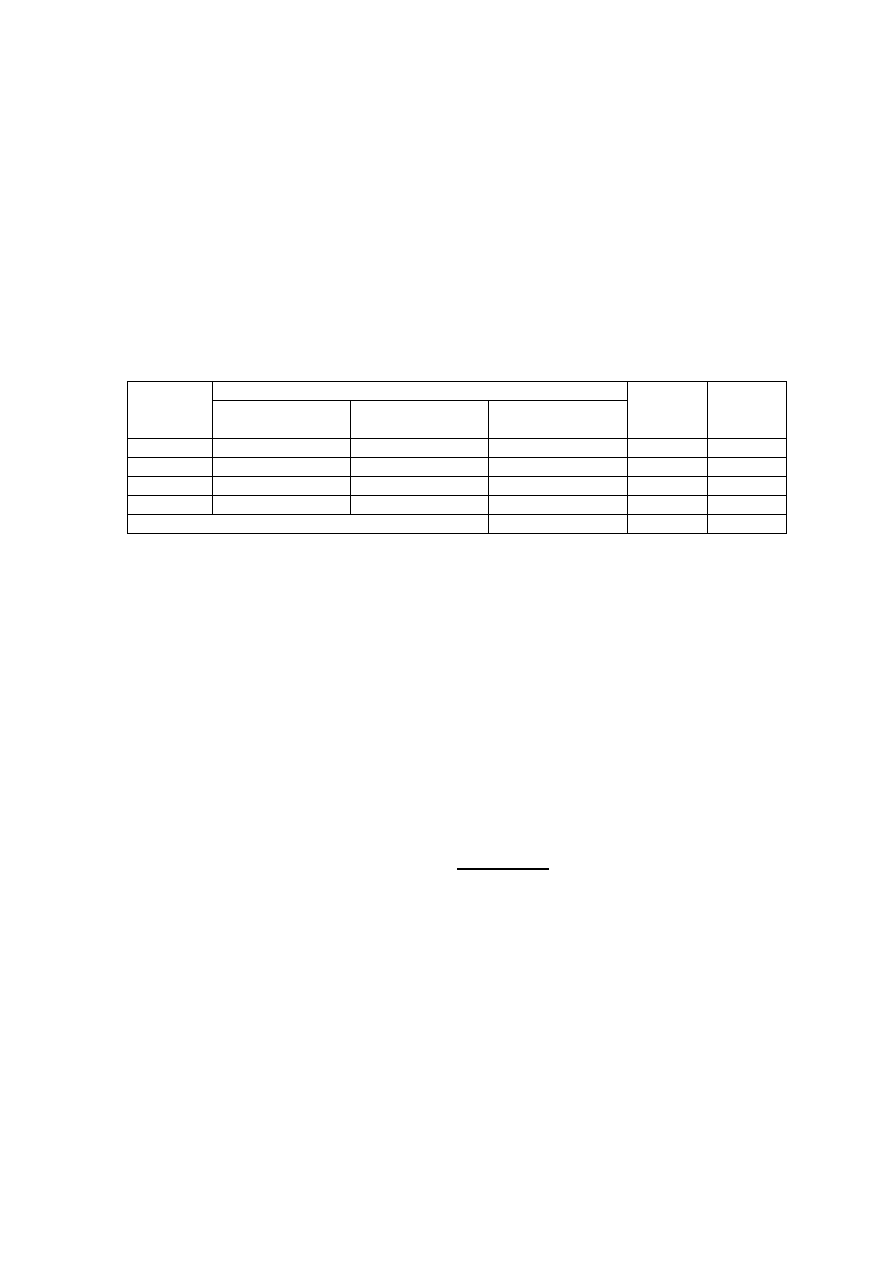
Reakcja zachodząca podczas oznaczenia:
2. Część doświadczalna.
a) Sprzęt i odczynniki.
– Kolba miarowa 1000 cm
3
,
– stężony roztwór NaOH,
– pipeta wielomiarowa 10 cm
3
,
– wodoroftalan potasu,
– biureta 50 cm
3
,
– alkoholowy roztwór
– kolby stożkowe,
fenoloftaleiny,
– naczynka wagowe,
– świeżo wygotowana
– mały lejek,
woda destylowana.
– wkraplacz,
– szkiełka zegarkowe,
– tryskawka,
– łapa metalowa,
– statyw,
– butelka polietylenowa,
– waga analityczna,
– dygestorium,
b) Wykonanie.
Do kolby miarowej 1000 cm
3
, zawierającej trochę wygotowanej wody destylowanej
wlano za pomocą pipety wielomiarowej, około 6 cm
3
stężonego roztworu NaOH, pod
dygestorium, nie mącąc go. Roztwór w kolbie wymieszano i uzupełniono do kreski
wodą wygotowaną. Tak przygotowany roztwór wymieszano, poprzez kilkakrotne
odwrócenie zamkniętej korkiem kolby do góry dnem, a następnie roztwór przelano do
butelki polietylenowej z pomocą lejka, całość szczelnie zamknięto. Zamontowano
biuretę na statywie, a następnie odważono na wadze analitycznej 4 porcje
wodoroftalanu potasu do naczynek wagowych. Każdą odważkę przeniesiono ilościowo
do odpowiedniej kolby stożkowej, rozcieńczono wygotowaną wodą destylowaną i
COOK
COOH
NaOH
O
H
2
COOK
COONa
+
+
3
wymieszano, aż do całkowitego rozpuszczenia soli i przykryto szkiełkiem zegarkowym.
Przepłukano i uzupełniono biuretę przygotowanym roztworem NaOH. Do roztworu
zawierającego najmniejszą odważkę wodoroftalanu dodano 2 krople alkoholowego
roztworu fenoloftaleiny i miareczkowano aż do pojawienia się trwałego, lekko
różowego zabarwienia roztworu. Analogicznie postąpiono w przypadku pozostałych
roztworów wodoroftalanu, przy czym biuretę za każdym razem uzupełniano
roztworem NaOH i miareczkowano roztwory według wzrastającej zawartości
wodoroftalanu.
3. Wyniki.
Tabela 1. Wyniki pomiarów.
Numer
naczynka
Masa [g]
V
NaOH
[cm
3
]
C
NaOH
[mol/dm
3
]
Pustego naczynka
Naczynka z
wodoroftalanem
Wodoroftalanu
4
10,4769
11,2287
0,7518
28,9
0,1274
5
11,0249
11,5922
0,5673
21,8
0,1274
6
6,2682
6,6984
0,4302
16,5
0,1277
10
11,9824
12,5434
0,5610
21,5
0,1278
Wartości średnie:
0,5776
22,2
0,1276
4. Opracowanie wyników.
a) Obliczenia.
Obliczono masy odważek wodoroftalanu potasu na podstawie wzoru:
𝑚
𝑤𝑓
= 𝑚
𝑛𝑤𝑓
− 𝑚
𝑛
gdzie:
𝑚
𝑤𝑓
– masa wodoroftalanu potasu [g],
𝑚
𝑛𝑤𝑓
– masa naczynka z wodoroftalanem potasu [g],
𝑚
𝑛
– masa pustego naczynka [g].
Obliczono stężenia roztworu NaOH dla danych odważek na podstawie wzoru:
𝐶
𝑁𝑎𝑂𝐻
=
𝑚
𝑤𝑓
∙ 1000
𝑉
𝑁𝑎𝑂𝐻
∙ 𝑀
𝑤𝑓
gdzie:
𝐶
𝑁𝑎𝑂𝐻
– stężenie roztworu NaOH [mol/dm
3
],
𝑉
𝑁𝑎𝑂𝐻
– objętość roztworu NaOH zużytego na zmiareczkowanie odważki
wodoroftalanu potasu [cm
3
],
𝑚
𝑤𝑓
– masa wodoroftalanu potasu [g],
𝑀
𝑤𝑓
– masa molowa wodoroftalanu potasu, równa 204,22 [g/mol].
Obliczono średnią masę wodoroftalanu, średnie stężenie roztworu NaOH, i średnią
zużytą objętość roztworu NaOH na podstawie wzoru:
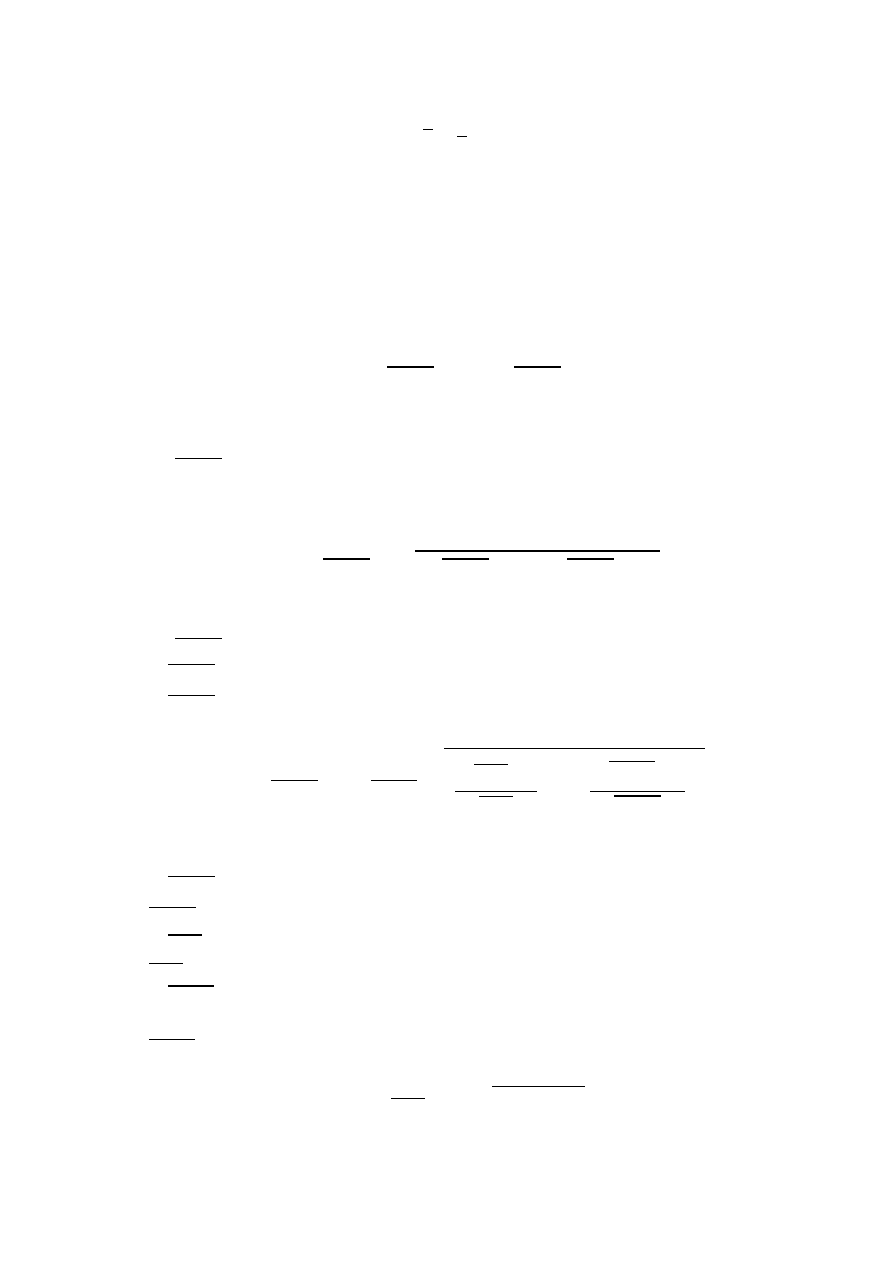
4
𝑥 =
1
𝑛
∑ 𝑥
𝑖
𝑛
𝑖=1
gdzie:
𝑥
𝑛
– n-ty wynik pomiaru,
𝑛 – liczba pomiarów.
Wyniki wszystkich powyższych obliczeń wprowadzono do Tabeli 1.
b) Niepewności pomiarowe.
Niepewność rozszerzoną średniego stężenia roztworu NaOH obliczono według wzoru:
𝑈(𝐶
𝑁𝑎𝑂𝐻
) = 𝑘 ∙ 𝑢
𝑐
(𝐶
𝑁𝑎𝑂𝐻
)
gdzie:
𝑘 – współczynnik rozszerzenia,
𝑢
𝑐
(𝐶
𝑁𝑎𝑂𝐻
) – złożona niepewność standardowa średniego stężenia NaOH [mol/dm
3
].
Ponadto, do powyższego wzoru wstawiono następujące zależności:
1) 𝑢
𝑐
(𝐶
𝑁𝑎𝑂𝐻
) = √𝑢
2
(𝐶
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
+ 𝑢
2
(𝐶
𝑁𝑎𝑂𝐻
)
𝑝𝑟𝑧𝑦𝑝
gdzie:
𝑢
𝑐
(𝐶
𝑁𝑎𝑂𝐻
) – złożona niepewność standardowa średniego stężenia NaOH [mol/dm
3
],
𝑢(𝐶
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
– niepewność systematyczna średniego stężenia NaOH [mol/dm
3
],
𝑢(𝐶
𝑁𝑎𝑂𝐻
)
𝑝𝑟𝑧𝑦𝑝
– niepewność przypadkowa średniego stężenia NaOH [mol/dm
3
].
2) 𝑢(𝐶
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
= 𝐶
𝑁𝑎𝑂𝐻
∙ √(
𝑢(𝑚
𝑤𝑓
)
𝑠𝑦𝑠
𝑚
𝑤𝑓
)
2
+ (
𝑢(𝑉
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
𝑉
𝑁𝑎𝑂𝐻
)
2
gdzie:
𝑢(𝐶
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
– niepewność systematyczna średniego stężenia NaOH [mol/dm
3
],
𝐶
𝑁𝑎𝑂𝐻
– średnie stężenie NaOH [mol/dm
3
],
𝑢(𝑚
𝑤𝑓
)
𝑠𝑦𝑠
– niepewność systematyczna średniej masy wodoroftalanu potasu [g],
𝑚
𝑤𝑓
– średnia masa wodoroftalanu potasu [g],
𝑢(𝑉
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
– niepewność systematyczna średniej objętości zużytego roztworu NaOH
[cm
3
],
𝑉
𝑁𝑎𝑂𝐻
– średnia objętość zużytego roztworu NaOH [cm
3
].
3) 𝑢(𝑚
𝑤𝑓
)
𝑠𝑦𝑠
= √2 ∙ 𝑢
2
(𝑚)
𝑠𝑦𝑠

5
gdzie:
𝑢(𝑚
𝑤𝑓
)
𝑠𝑦𝑠
– niepewność systematyczna średniej masy wodoroftalanu potasu [g],
𝑢(𝑚)
𝑠𝑦𝑠
– niepewność systematyczna pomiaru masy na wadze analitycznej [g].
4) 𝑢(𝑚)
𝑠𝑦𝑠
= √𝑢
1
2
(𝑚) + 𝑢
2
2
(𝑚)
gdzie:
𝑢(𝑚)
𝑠𝑦𝑠
– niepewność systematyczna pomiaru masy na wadze analitycznej [g],
𝑢
1
(𝑚) – standardowa niepewność kalibracji wagi [g],
𝑢
2
(𝑚) – standardowa niepewność rozdzielczości wskazań wagi [g].
5) 𝑢
1
(𝑚) =
𝑢
𝑘𝑤
√3
gdzie:
𝑢
1
(𝑚) – standardowa niepewność kalibracji wagi [g],
𝑢
𝑘𝑤
– niepewność kalibracji wagi [g].
6) 𝑢
2
(𝑚) =
𝑟
𝑤𝑤
√3
gdzie:
𝑢
2
(𝑚) – standardowa niepewność rozdzielczości wskazań wagi [g],
𝑟
𝑤𝑤
– rozdzielczość wskazań wagi [g].
7) 𝑢(𝑉
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
= √𝑢
1
2
(𝑉) + 𝑢
2
2
(𝑉) + 𝑢
3
2
(𝑉) + 𝑢
4
2
(𝑉)
gdzie:
𝑢(𝑉
𝑁𝑎𝑂𝐻
)
𝑠𝑦𝑠
– niepewność systematyczna średniej objętości zużytego roztworu NaOH
[cm
3
],
𝑢
1
(𝑉) – standardowa niepewność kalibracji biurety [cm
3
],
𝑢
2
(𝑉) – standardowa niepewność objętości kropli [cm
3
],
𝑢
3
(𝑉) – standardowa niepewność odczytu na skali biurety [cm
3
],
𝑢
4
(𝑉) – standardowa niepewność poprawki temperaturowej szkła [cm
3
],
8) 𝑢
1
(𝑉) =
𝑢
𝑘𝑏
√3
gdzie:
𝑢
1
(𝑉) – standardowa niepewność kalibracji biurety [cm
3
],
𝑢
𝑘𝑏
– niepewność kalibracji biurety [cm
3
].
9) 𝑢
2
(𝑉) =
𝑉
𝑘𝑟
√3
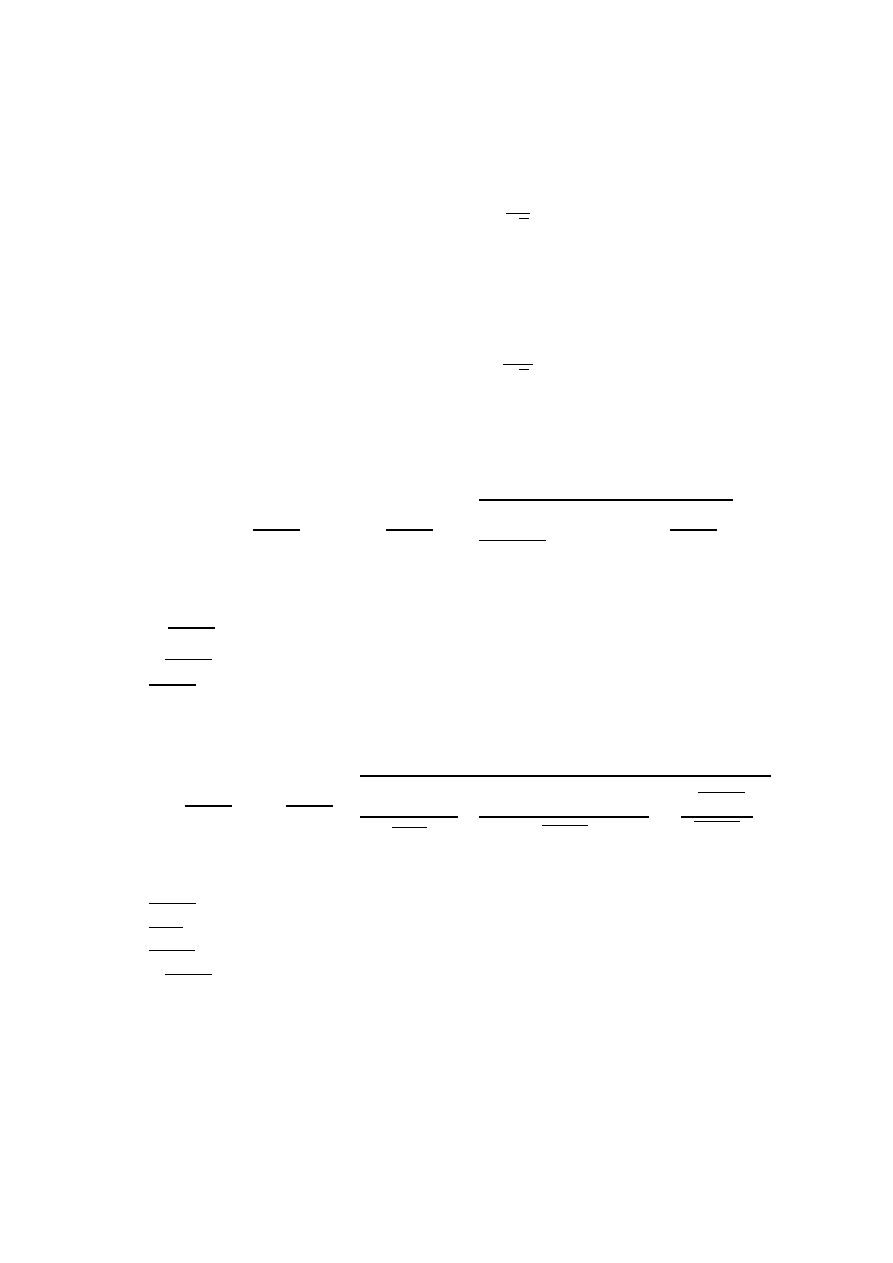
6
gdzie:
𝑢
2
(𝑉) – standardowa niepewność objętości kropli [cm
3
],
𝑉
𝑘𝑟
– objętość kropli [cm
3
].
10) 𝑢
3
(𝑉) =
𝑢
𝑜𝑡
√3
gdzie:
𝑢
3
(𝑉) – standardowa niepewność odczytu na skali biurety [cm
3
],
𝑢
𝑜𝑡
– niepewność odczytu na skali biurety [cm
3
].
11) 𝑢
4
(𝑉) =
𝑝
𝑡𝑜𝑠
√3
gdzie:
𝑢
4
(𝑉) – standardowa niepewność poprawki temperaturowej szkła [cm
3
],
𝑝
𝑡𝑜𝑠
– poprawka temperaturowa objętości szkła [cm
3
].
12) 𝑢(𝐶
𝑁𝑎𝑂𝐻
)
𝑝𝑟𝑧𝑦𝑝
= 𝑠(𝐶
𝑁𝑎𝑂𝐻
) = √
1
𝑛(𝑛 − 1)
∑((𝐶
𝑁𝑎𝑂𝐻
)
𝑖
− 𝐶
𝑁𝑎𝑂𝐻
)
2
𝑛
𝑖=1
gdzie:
𝑢(𝐶
𝑁𝑎𝑂𝐻
)
𝑝𝑟𝑧𝑦𝑝
– niepewność przypadkowa średniego stężenia NaOH [mol/dm
3
],
𝑠(𝐶
𝑁𝑎𝑂𝐻
) – odchylenie standardowe średniego stężenia NaOH [mol/dm
3
],
𝐶
𝑁𝑎𝑂𝐻
– średnie stężenie NaOH [mol/dm
3
].
Po przekształceniach otrzymano wzór:
𝑈(𝐶
𝑁𝑎𝑂𝐻
) = 𝑘 ∙ 𝐶
𝑁𝑎𝑂𝐻
∙ √
2𝑢
𝑘𝑤
2
+ 2𝑟
𝑤𝑤
2
3(𝑚
𝑤𝑓
)
2
+
𝑢
𝑘𝑏
2
+ 𝑉
𝑘𝑟
2
+ 𝑢
𝑜𝑡
2
+ 𝑝
𝑡𝑜𝑠
2
3(𝑉
𝑁𝑎𝑂𝐻
)
2
+ (
𝑠(𝐶
𝑁𝑎𝑂𝐻
)
𝐶
𝑁𝑎𝑂𝐻
)
2
𝑘 = 2
𝐶
𝑁𝑎𝑂𝐻
= 0,1276 𝑚𝑜𝑙/𝑑𝑚
3
𝑚
𝑤𝑓
= 0,5776 𝑔
𝑉
𝑁𝑎𝑂𝐻
= 22,2 𝑐𝑚
3
𝑠(𝐶
𝑁𝑎𝑂𝐻
) = 0,000094 𝑚𝑜𝑙/𝑑𝑚
3
𝑢
𝑘𝑤
= 0,0001 𝑔
𝑟
𝑤𝑤
= 0,0001 𝑔
𝑢
𝑘𝑏
= 0,1 𝑐𝑚
3
𝑉
𝑘𝑟
= 0,044 𝑐𝑚
3
𝑢
𝑜𝑡
= 0,05 𝑐𝑚
3
𝑝
𝑡𝑜𝑠
= 0,0025 𝑐𝑚
3

7
𝑈(𝐶
𝑁𝑎𝑂𝐻
) = 0,0008 𝑚𝑜𝑙/𝑑𝑚
3
⇒ 0,64%
c) Wynik końcowy.
Stężenie mianowanego roztworu NaOH: (0,1276 ± 0,0008) mol/dm
3
.
5. Podsumowanie.
Uzyskane wartości stężeń roztworu NaOH niewiele odbiegają od wartości średniej –
największa różnica między uzyskanymi wynikami, a wartością średnią wynosi tylko 0,0002
mol/dm
3
. Z kolei największa różnica między uzyskanymi wartościami stężeń roztworu
NaOH wynosi zaledwie 0,0004 mol/dm
3
, stąd tak niskie odchylenie standardowe, a tym
samym – rozszerzona niepewność wyznaczania średniego stężenia NaOH, która stanowi
0,64% wyniku. Tak małe odchylenia wskazują na bardzo wysoką precyzję zastosowanej
metody, której użyto do wyznaczenia miana przygotowanego bezwęglanowego roztworu
wodorotlenku sodu. Wyznaczone stężenie różni się od założonego (0,1000 mol/dm
3
)
głównie ze względu na niedokładne odmierzenie porcji stężonego NaOH, a także
niedokładne uzupełnienie powstałego roztworu wodą do kreski w kolbie miarowej o
pojemności 1000 cm
3
. Ćwiczenie wykonano ciągu dwóch tygodni – próbki wodoroftalanu
potasu oznaczone numerami 6 i 10 zmiareczkowano 08.04.13 r., a próbki nr 5 i 4 –
15.04.13 r., przy czym starano się ograniczać kontakt roztworu NaOH z powietrzem. Jak
widać – skutecznie, bowiem wystarczyło szczelnie zakręcić butelkę polietylenową, a
stężenie NaOH w ciągu tygodnia zmniejszyło się tylko o 0,0003 i 0,0004 mol/dm
3
,
w
stosunku do próbek z poprzedniego tygodnia, czyli w granicach wyznaczonej niepewności.
Wyszukiwarka
Podobne podstrony:
Laboratorium sprawozdanie 04 id 261441
Laboratorium sprawozdanie 07 id 261447
Laboratorium sprawozdanie 06 id 261445
Laboratorium sprawozdanie 05 id 261443
Laboratorium sprawozdanie 02 id 261437
Laboratorium sprawozdanie 05 2 id 261444
Laboratorium sprawozdanie 01 id 261435
Laboratorium sprawozdanie 08 id 261449
Laboratorium sprawozdanie 09 id 261450
Laboratorium sprawozdanie 03 2
Laboratorium sprawozdanie 04 id 261441
Laboratorium z PO Zestaw 03 id 261885
Laboratorium elektrotechniki Cwiczenie 03 id 261697
sprawozdanie 03, sem 3, Podstawy elektrotechniki i elektroniki, Laboratoria, sprawodzania 2011 zima
Konserwacja 2014 03 id 245321 Nieznany
Laboratorium sprawozdanie 11
Laboratorium sprawozdania cz. 3, Mechanika III semestr, Fizyka, Laboratoria i sprawozdania
więcej podobnych podstron