http://www.chemia.sos.pl
- 1 -
1.
Z układu okresowego pierwiastków można odczytać, że stront leży w 2 grupie i w 5 okresie,
ma więc 2 ekektrony walencyjne na piątej powłoce. W grupach od 1 do 13 (poza borem)
znajdują się metale. W przypadku metali aktywność wzrasta wraz ze wzrostem nr okresu
(dla niemetali, aktywność wzrasta w górę układu okresowego), stront jest więc bardziej
aktywny od wapnia. Jako metal bardzo aktywny gwałtownie reaguje z kwasami (reaguje
nawet z wodą). Tlenek strontu, tak jak wszystkie tlenku metali 1 i 2 grupy (poza tlenkiem
berylu) reaguje z wodą tworząc wodorotlenek.
1
Atom strontu ma 2 elektrony walencyjne, które w stanie podstawowym
znajdują się na piątek powłoce
P
2
Stront jest niemetalem
F
3
Stront jest aktywniejszy od wapnia
P
4
Stront nie reaguje z kwasem solnym
F
5
Tlenek strontu ma charakter zasadowy
P
2.
Nuklidy opisywane są zawsze dwiema liczbami: A i Z
A
Z
X
. Liczba Z nazywana liczbą porządkową lub atomową określa ilość
protonów w jądrze (jednocześnie ilość elektronów w atomie), natomiast liczba A nazywana liczbą masową wskazuje łączną
liczbę protonów i neutronów w jądrze, czyli liczba neutronów w jądrze może być obliczona z zależności l.n=A-Z.
Izotop rubidu
87
37
Rb
składa się zatem z
37 protonów
oraz 87-37=
40 neutronów
.
3.
W zapisie równań reakcji jądrowych suma liczb Z i A po lewej stronie i prawej równania reakcji musi być równa. Elektron jest
cząsteczką o ładunku -1 i masie 0, można go zapisać jako
0
1
e
−
. Równanie z rozpadu
β
-
dla rubidu można zapisać:
87
A
0
37
Z
1
Rb
X
e
−
⎯⎯→
+
. Dla lewej strony: 37=Z+(-1), czyli
Z=38
, oraz 87=A+0, czyli A=
87
. Z układu okresowego pierwiastków
możemy odczytać, że pierwiastkiem powstałym w wyniku rozpadu
β
-
rubidu jest stront. Równanie reakcji przyjmie zatem
postać:
87
87
37
38
Rb
Sr
−
⎯⎯→
+ β
4.
Sód leży w 1 grupie układu okresowego, jest więc metalem. Tak jak większość metali jest barwy srebrzystobiałej, przewodzi
prąd elektryczny, oraz jest miękki (sód można kroić nożem).
Chlor jest gazem o barwie żółtozielonej o duszącym zapachu. Masa cząsteczkowa chloru M=71g/mol, a więc jest cięższy od
powietrza (średnia masa cząsteczkowa powietrza M=29g/mol).
5.
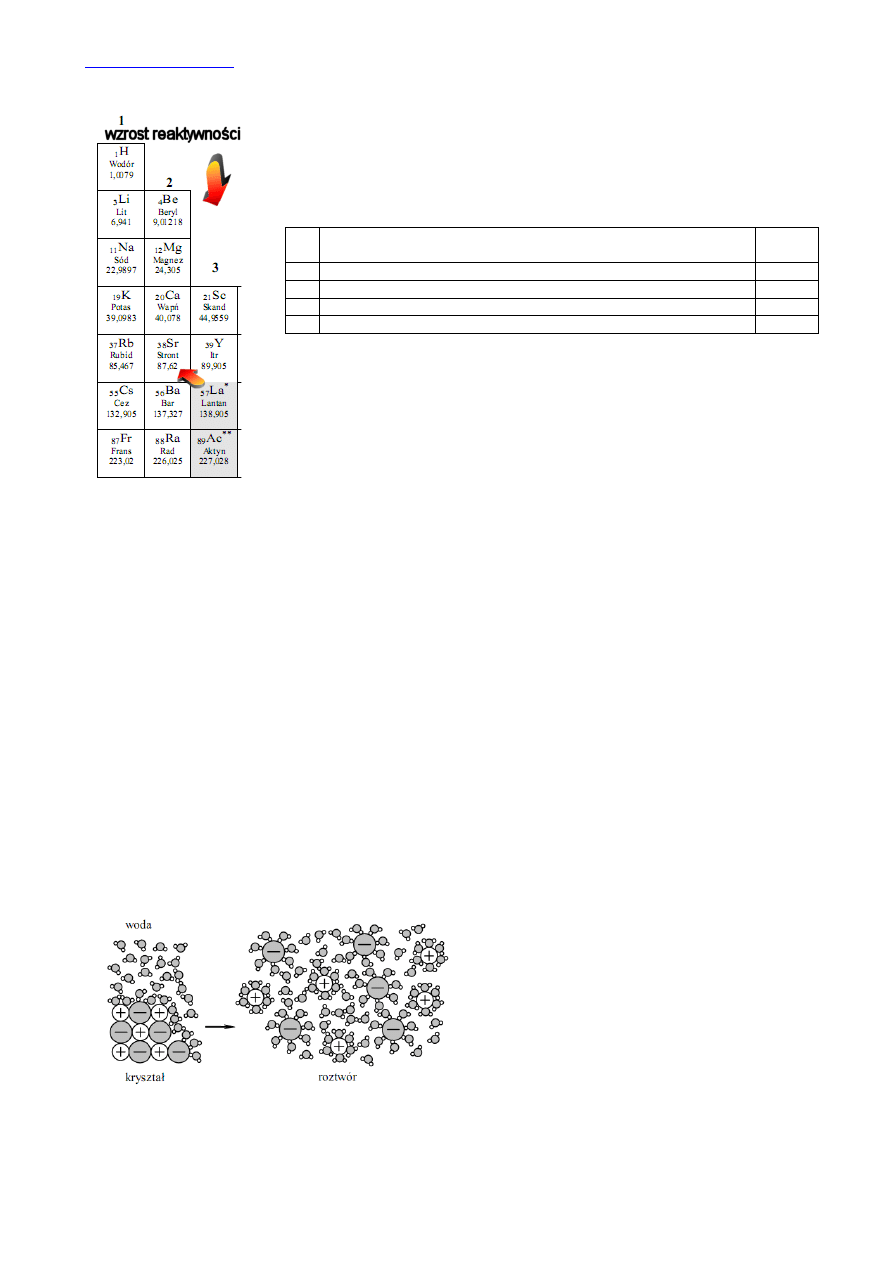
Na rysunku 1 widzimy, że badana substancja składa się z
jonów, ma więc budowę jonową. Z wymienionych substancji
tylko chlorek potasu, KCl, ma budowę jonową.
http://www.chemia.sos.pl
- 2 -
6.
Temperatura topnienia, to temperatura przejścia z fazy stałej w ciekłą, natomiast temperatura wrzenia to temperatura przejścia
fazy ciekłej w gazową. Brom topi się w temperaturze -7,2
o
C, wrze w temperaturze 59,5
o
C. W temperaturze pokojowej jest więc
cieczą (brom i rtęć są jedynymi ciekłymi pierwiastkami w temperaturze pokojowej). Bromometan topi się w temperaturze -
93,7
o
C, wrze natomiast w temperaturze 3,6
o
C. W temperaturze pkojowej jest więc gazem. Bromek sodu – temperatura
topnienia i temperatura wrzenia tej substancji wynosi odpowiednio 743 i 1391
o
C. W temperaturze pokojowej jest to więc ciało
stałe (bromek sodu jest solą, pomiędzy jonem sodowym a jonem bromkowym występują wiązania jonowe. Tak jak wszystkie
substancje o budowie jonowej musi mieć wysoką temperaturę topnienia i wrzenia).
7.
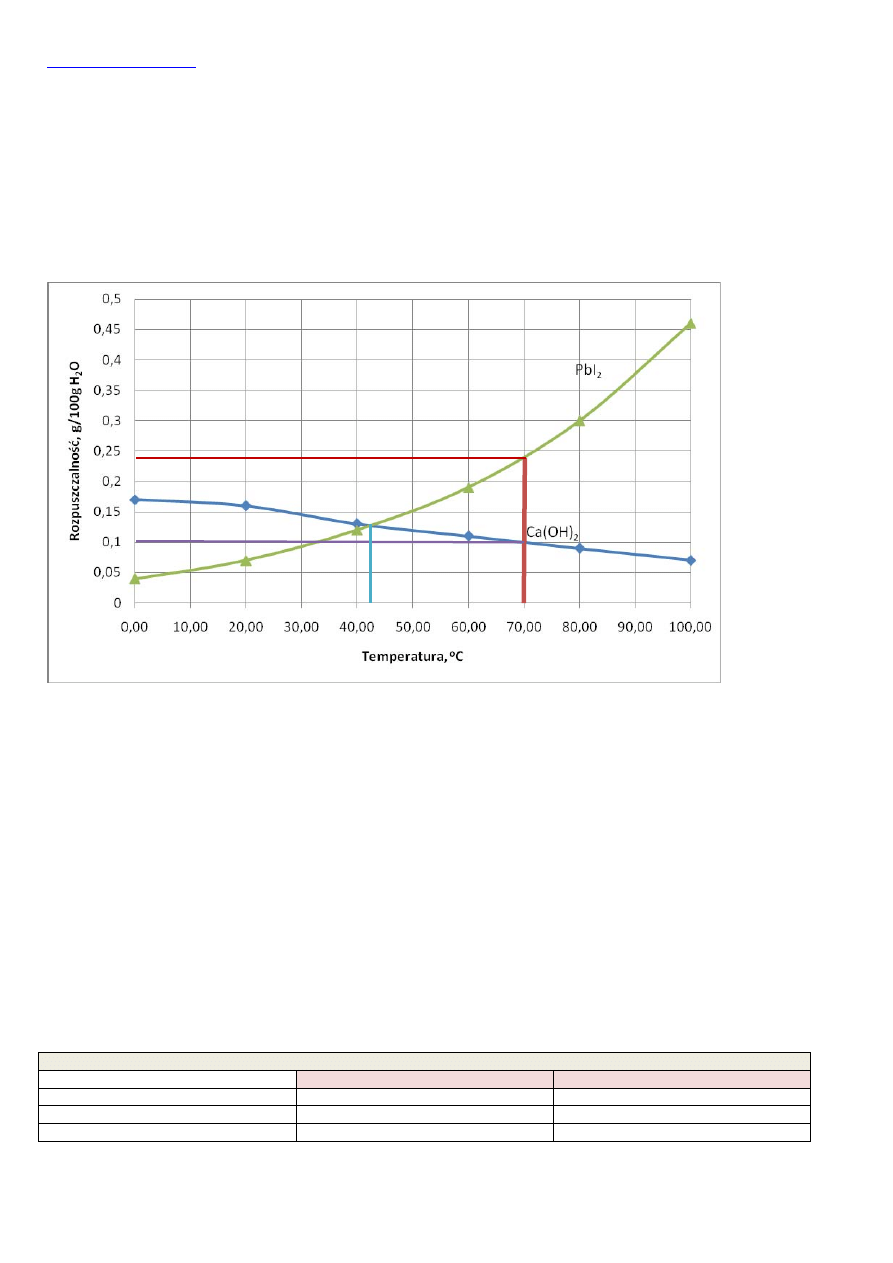
W zadaniu tym należy narysować klasyczny wykres. Na osi 0X oznaczyć temperaturę a na osi 0Y masę soli rozpuszczoną w
100g wody:
8.
Z wykresu można łatwo odczytać, że rozpuszczalność Ca(OH)
2
w 70
o
C wynosi około 0,1g/100g wody, natomiast dla PbI
2
rozpuszczalność w tej temperaturze wynosi około 0,25g/100g wody.
W temperaturze około 42
o
C rozpuszczalność wodorotlenku wapnia i jodku ołowiu jest jednakowa i wynosi około 0,13g/100g
wody.
9.
Z wykresu doskonale widać, że wraz ze wzrostem temperatury rozpuszczalność Ca(OH)
2
maleje, natomiast rozpuszczalność
PbI
2
rośnie ze wzrostem temperatury.
10.
Wodorotlenek sodowy jest zasadą i wodny roztwór tej substancji jest alkaliczny (zasadowy), wodny roztwór kwasu azotowego
jest kwaśny, natomiast azotan sodu jest solą mocnego kwasu i mocnej zasady. Wodny roztwór tej soli ma odczyn obojętny.
Podane wskaźniki zmieniają swoje barwy w zależności od środowiska. Fenoloftaleina barwi się na malinowo (fenoloftaleina jak
dziewczyna, w zasadzie się czerwieni), natomiast jest bezbarwna w środowisku kwaśnym i obojętnym. Za pomocą
fenoloftaleiny nie odróżnimy kwasu azotowego od azotanu amonu.
Oranż metylowy w środowisku kwaśnym barwi się na czerwono, w zasadowym na żółto, natomiast w obojętnym na kolor
cebuowy. Mógłby posłużyć do identyfikacji tych związków.
Papierek uniwersalny w środowisku zasadowym barwi się na niebiesko, w kwaśnym na czerwono, natomiast w obojętnym nie
zmienia barwy – pozostaje żółty.
Barwa wskaźnika w roztworze
Oranż metylowy
Papierek uniwersalny
Wodorotleneku sodu
Żółta Niebieska
Kwasu azotowego(V)
Czerwona
Czerwona
Azotanu(V) sodu
Cebulowa
Żółta

http://www.chemia.sos.pl
- 3 -
11.
Jest regułą, że tlenki pierwiastków 1 i 2 grupy (za wyjątkiem tlenku berylu) reagują z wodą tworząc wodorotlenki (mają
charakter zasadowy), natomiast tlenki pierwiastków 15, 16 i 17 grupy reagują z wodą tworząc kwasy – posiadają charakter
kwasowy.
Wapń leży w 2 grupie układu okresowego pierwiastków, tlenek wapnia ma charakter zasadowy, reaguje z kwasem tworząc
sól:
CaO + 2HCl → CaCl
2
+ 2H
2
O
Siarka leży w 16 grupie układu okresowego pierwiastków, tlenek siarki(VI) (jest bezwodnikiem kwasowym), ma charakter
kwasowy, reaguje więc z wodorotlenkiem sodu:
SO
3
+ 2NaOH → Na
2
SO
4
+ H
2
O
12.
Tleneku siarki(VI) nie można otrzymać w typowych warunkach tlenu z siarką. W tych warunkach otrzymuje się jedynie tlenek
siarki(IV), który należy katalitycznie utlenić. Jako katalizatora używa się tlenku wanadu(V) (pięciotlenku wanadu):
S + O
2
SO
2
2SO
2
+ O
2
V
2
O
5
2SO
3
Węglan wapnia podczas prażenia rozkłada się na tlenek wapnia (wapno palone) i tlenek węgla(IV):
CaCO
3
temp.
CaO + CO
2
13.
Węglan wapnia jest solą słabego kwasu węglowego, który jest wypierany z soli przez mocniejszy kwas. Kwas węglowy jest
nietrwały i natychmiast rozkłada się na wodę i tlenek węgla(IV):
CaCO
3
+ 2H
+
→ Ca
2+
+ CO
2
+ H
2
O
14.
Potas jest metalem 1 grupy układu okresowego pierwiastków, jest bardzo reaktywny i z wodą reaguje gwałtownie (woda w tej
reakcji wykazuje swój kwasowy charakter):
2K + H
2
O → 2K
+
+ 2OH
-
+ H
2
W roztworze znajdują się jony siarczanowe(VI), sodowe, baru i chlorkowe. Z tablicy rozpuszczalności możemy odczytać, że
niemożliwe jest występowanie jonów baru i siarczanu(VI) obok siebie. Jony te łączą się ze sobą dając osad siarczanu(VI) baru.
Ba
2+
+ 2Cl
-
+ 2Na
+
+ SO
4
2-
→ BaSO
4
+ 2Na
+
+ 2Cl
-
W równaniu jonowym powinniśmy zapisać tylko jony biorące udział w reakcji:
Ba
2+
+ SO
4
2-
→ BaSO
4
15.
W celu określenia stopnia utlenienia pierwiastka wychodzimy z następujących zależności:
a. Suma stopni utlenienia pierwiastków wchodzących w skład związku jest równa 0, lub ładunkowi cząsteczki
b. Tlen
w
związkach jest zawsze na –II stopniu utlenienia (za wyjątkiem połączeń nadtlenkowych w których jest
na –I stopniu utlenienia, oraz za wyjątkiem OF
2
, w którym tlen jest na II stopniu utlenienia)
c. Wodór jest na I stopniu utlenienia za wyjątkiem połączeń z metalami w których jest na –I stopniu utlenienia.
NH
4
+
Ładunek cząsteczki +1.
4
.
(1)+x=+1, czyli x=-3.
Azot jest na –III stopniu utlenienia.
HNO
2
Ładunek cząsteczki 0.
1+x+2
.
(-2)=0, czyli x=+3. Azot jest na III stopniu utlenienia
NO
3
-
Ładunek cząsteczki -1.
x+3
.
(-2)=-1, czyli x=+5. Azot jest na V stopniu utlenienia.
16.
Dobór współczynników reakcji najlepiej przeprowadzić poprzez rozpisanie równań połówkowych. W tym celu należy odnaleźć
utleniacz i reduktor w równaniu reakcji:
Cr
2
O
3
+ K
2
CO
3
+ O
2
K
2
CrO
4
+ CO
2
III
VI
0
-II
temp.
W kolejnym kroku bilansujemy równania połówkowe, zapisując je w postaci jonowej. Brakujące atomy tlenu pobieramy zawsze
z wody (mimo, że nie występuje ona w równaniu reakcji). W równaniu połówkowym z tlenkiem chromu(III) musimy dodatkowo
uwzględnić węglan potasu, by móc otrzymać chromian(VI) potasu:
Cr
2
O
3
+2K
2
CO
3
+ 3H
2
O
2K
2
CrO
4
+ 6e + 6H
+
+ 2CO
2
O
2
+ 4H
+
+ 4e
2H
2
O
2
3
2 Cr
2
O
3
+ 4K
2
CO
3
+ 6H
2
O + 3O
2
+12H
+
2K
2
CrO
4
+ 12H
+
+ 4CO
2
+ 6H
2
O
Po redukcji wyrazów podobnych otrzymamy:

http://www.chemia.sos.pl
- 4 -
2Cr
2
O
3
+ 4K
2
CO
3
+ 3O
2
2K
2
CrO
4
+ 4CO
2
temp.
Z równia reakcji widzimy, że chrom w tlenku chromu(III), Cr
2
O
3
utlenia się, jest reduktorem, natomiast tlen, O
2
, redukuje się do
tlenku, czyli pełni rolę utleniacza.
17.
Właściwości fizyczne to barwa, rozpuszczalność, temperatura topnienia i wrzenia, gęstość. Natomiast właściwości chemiczne
to reaktywność, charakter (kwasowość/zasadowość).
18.
Rozjaśnianie włosów polega na utlenieniu barwnika znajdującego się we włosach. Wykorzystywane w tym celu są
silne właściwości utleniające
nadtlenku wodoru.
19.
Stężenie procentowe
s
rozt
m
c% 100%
m
=
. 100cm
3
roztworu perhydrolu o gęstości 1,11g/cm
3
ma masę (d=m/V)
m
rozt
=dV=100cm
3.
1,11g/cm
3
=
111g
. Przekształcając wzór na stężenie procentowe względem m
s
otrzymamy:
rozt
s
c% m
m
100%
⋅
=
, a
po podstawieniu danych do wzoru otrzymamy (z tekstu informacyjnego wynika, że perhydrol to
30%
roztwór nadtlenku wodoru
w wodzie):
s
30% 111g
m
100%
33,3g
⋅
=
=
20.
Z informacji wynika, że nadtlenek wodoru rozkłada się na wodę i tlen: 2H
2
O
2
→ 2H
2
O + O
2
↑. Powstały tlen, jako gaz opuszcza
środowisko reakcji.
Po dodaniu MnO
2
do wody utlenionej obserwujemy pienienie się roztworu i wydzielanie pęcherzyków gazu (w obserwacji
podajemy tylko to co uda się nam zaobserwować, nie wyciągamy żadnych wniosków).
21.
Z równania reakcji : 2H
2
O
2
→ 2H
2
O + O
2
↑.możemy stwierdzić, że:
z 68g nadtlenku wodoru (2 moli) w wyniku rozkładu powstaje 22,4dm
3
(1mol) tlenu, to
z 85g nadtlenku wodoru w wyniku rozkładu powstanie x dm
3
tlenu, czyli
3
3
85g 22,4dm
x
m
68g
28d
⋅
=
=
22.
Etan – C
2
H
6
– węglowodór nasycony, jest bezbarwnym gazem, nierozpuszczalny w wodzie (brak grup hydrofilowych), palny
(składnik gazu ziemnego)
Etanol – CH
3
CH
2
OH – alkohol etylowy, bezbarwna ciecz, bardzo dobrze rozpuszczalna w wodzie (grupa hydroksylowa
powoduje rozpuszczalność w wodzie), palny (składnik paliwa do kuchenek turystycznych)
23.
Jeżeli w wyniku addycji HCl do węglowodoru powstał chloroeten CH
2
=CHCl, to wyjściowy węglowodór otrzymamy poprzez
eliminację chlorowodoru z chloroetanu. Węglowodorem tym jest zatem etyn (acetylen).
C
H
CH
CH
2
CH Cl
+ HCl
W powstałym chloretenie nadal znajduje się wiązanie wielokrotne C=C, do którego możemy przyłączyć chlorowodór, chlor,
brom, czy wodór na katalizatorze:
CH
2
CH Cl
CH
3
CH
2
Cl
+ H
2
Pt
Nadtlenek wodoru, H
2
O
2
, to
bezbarwna ciecz
, której
gęstość w temperaturze 25°C jest równa 1,44 g/cm
3
.
Temperatura
topnienia H
2
O
2
wynosi – 0,4°C
, a
temperatura wrzenia 152°C
.
Nadtlenek wodoru jest silnym
utleniaczem
,
może również działać jako reduktor
.
Jest bardzo słabym kwasem
. Nadtlenek wodoru w postaci
wodnego roztworu o stężeniu 30% masowych nosi nazwę perhydrolu. Wodny roztwór H
2
O
2
o stężeniu 6%
masowych stosuje się do rozjaśniania włosów, zaś wodny roztwór tego związku o stężeniu 3% masowych to
woda utleniona, która jest używana jako środek bakteriobójczy.
Na podstawie: L. Jones, P. Atkins „Chemia ogólna. Cząsteczki, materia, reakcje”, Warszawa 2004
http://www.chemia.sos.pl
- 5 -
24.
Polimeryzacja polega połączeniu wielu cząsteczek alkenu lub alkinu (monomeru) w jedną dużą cząsteczkę, bez wydzielania
substancji ubocznych. Łączenie się cząsteczek monomeru następuje kosztem przekształcenia wiązań
π w wiązania σ.
CH
2
CH
Cl
CH
2
CH
Cl
CH
2
CH
Cl
CH
2
CH
Cl
CH
2
CH
Cl
*
*
n
n
n
cząsteczki łączą się ze sobą
za pomocą tych wiązań
25.
W cząsteczce etenu CH
2
=CH
2
znajduje się podwójne wiązanie C=C, którego nie ma w cząsteczce etanu CH
3
-CH
3
. Wiązanie
podwójne powoduje, że do etenu łatwo ulegają addycji takie związki jak HCl, Cl
2
, Br
2
, H
2
O. Wiązanie podwójne reaguje również
łatwo z wodnym roztworem KMnO
4
.
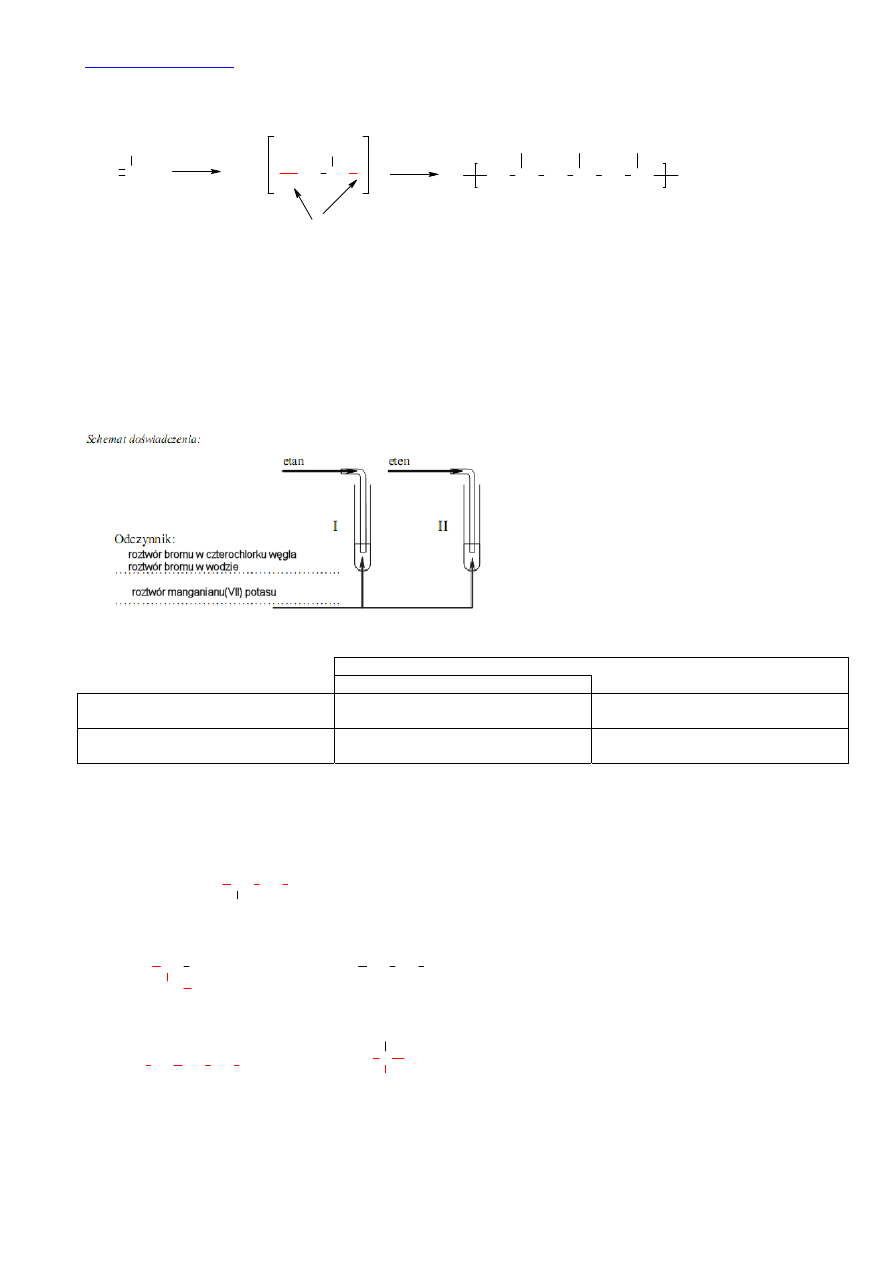
Planując eksperyment musimy wziąć pod uwagę odczynnik, który po addycji do wiązania podwójnego da barwny produkt, lub
który ulegając addycji do wiązania podwójnego zmieni swoją barwę. Takim odczynnikiem może być roztwór bromu w wodzie
lub CCl
4
(czterochlorku węgla), albo roztwór KMnO
4
. W pierwszym przypadku nastąpi odbarwienie roztworu bromu (z żółtego
ewentualnie czerwonego (w zależności od stężenia bromu) do bezbarwnego), w drugim przypadku filetowy roztwór
manganianu(VII) odbarwi się i wytrąci się osad tlenku manganu(IV):
Obserwacje:
Barwa
zawartości probówki
Przed zmieszaniem reagentów
Po zmieszaniu reagentów
Probówka 1
Żóty (czerwony) w przypadku bromu
Filoetowy w przypadku KMnO
4
Żóty (czerwony) w przypadku bromu
Filoetowy w przypadku KMnO
4
Probówka 2
Żóty (czerwony) w przypadku bromu
Filoetowy w przypadku KMnO
4
Bezbarwny
Bezbarwny, wytrąca się osad.
26.
Wyszukując izomeryczne (lub identyczne) związki najlepiej jest:
•
Sprawdzić czy mają identyczny wzór cząsteczkowy. Związki o różnym wzorze cząsteczkowym nie mogą być
izomerami
•
Nazwać związki. Związki o identycznej nazwie są identycznymi związkami, a więc nie mogą być izomerami:
CH
3
CH
CH
3
CH
2
OH
CH
3
CH
2
CH
2
OH
CH
2
CH
2
CH
2
OH
CH
3
C
H
3
C OH
CH
3
CH
3
CH
3
CH
CH
2
CH
3
OH
C
4
H
10
O 2-metylopropan-1-ol
C
4
H
10
O 2-metylopropan-1-ol
C
3
H
8
O propanol
C
4
H
10
O butanol
C
4
H
10
O 2-metylopropan-2-ol
I
II
III
IV
http://www.chemia.sos.pl
- 6 -
Ze wzorów cząsteczkowych wynika, że związek II nie może być izomerem 2-metylopropan-1-olu. Tworząc nazwy dla
pozostałych łatwo zauważyć, że związek I jest również 2-metylopropanolem. Zatem izomerami 2-metylopropanolu mogą być
jedynie związki II i IV.
27.
Zaznaczona grupa pochodzi od metanu, CH
3
-H, od którego oderwano atom wodoru. Nazwy takich grup tworzy się zamieniając
końcówkę –an na –yl. Grupa ta nazywa się więc grupą metylową. Druga grupa nosi nazwę grupy karbonylowej.
28.
W wyniku redukcji butanolu wodorem w obecności katalizatora, tlen w grupie karbonylowej redukuje się do grupy
hydroksylowej. Jest to reakcja odwrotna do utleniania alkoholi. Alkohole II-rzędowe utleniane są do koetonów, więc ketony
redukowane są do alkoholi II-rzędowych:
CH
3
C
O
CH
2
CH
3
CH
3
CH
OH
CH
2
CH
3
H
2
/Ni
butanon
butan-2-ol
29.
Etanal wskazuje, że związek składa się z dwóch atomów węgla (etan) i posiada grupę aldehydową: CH
3
CHO, kwas octowy to
zwyczajowa nazwa kwasu etanowego – czyli kwasu składającego się z 2 atomów węgla. W kolejnej reakcji powstaje octan
etylu, czyli związek zawierający grupę octanową CH
3
COO oraz grupę etylową CH
3
CH
2
. Hydroliza prowadzi do octanu sodu,
czyli związku składającego się z grupy CH
3
COO
-
i jonu sodowego:
+ O
2
2CH
3
CHO
2 CH
3
COOH
CH
3
COOH + CH
3
CH
2
OH
H
2
SO
4
CH
3
COOCH
2
CH
3
+ H
2
O
CH
3
COOCH
2
CH
3
+ NaOH
CH
3
COONa + CH
3
CH
2
OH
I
II
III
30.
Wzór pierścieniowy Howortha glukozy bardzo łatwo zapamiętać ponieważ glukoza tworzy pierścień 6-członowy (pierścień
piranozowy), oraz wszystkie grupy w tym wzorze są na przemian skierowane do góry i do dołu. Fruktoza natomiast tworzy
pierścienie 5-członowe (pierścienie furanozowe). W podanym wzorze obydwa fragmenty, I i II są fragmentami pochodzącymi
od glukozy.
Wyszukiwarka
Podobne podstrony:
2008 MAJ OKE PP ODP
MATEMATYKA (podstawowy)probna 2008 PROBNA MATURA GRU2007 Matematyka PP odp
2008 MAJ OKE PP ODP
listopad 2008 roz PP odp
2008 MAJ OKE PP ODP 3
2012 J POLSKI MATURA PP ODP
mechanik odp 2008 x
2005 MAJ OKE PP ODP
2002 MAJ OKE PP I ODP(1)
PROBNA MATURA GRU2007 Chemia PP odp
2011 MAJ OKE PP ODP
2005 GRUDZIEŃ OKE PP ODP
PP OiZ 2008
lek 2009 pp odp I
2012-pp-odp
2003 STYCZEŃ OKE PP ODP
więcej podobnych podstron