
CHEMIA NIEORGANICZNA
CZ. II CHEMIA PIERWIASTKÓW
WYKŁAD 6

ŻELAZOWCE – GRUPA 8
Fe – żelazo
3500 BC - meteoryty
Ru - ruten
(łac. Ruś - Ruthenium) – 1828 r. – izolacja z platyny G. Osann
– 1844 r., właściwości K. Claus
Os - osm
(grec. zapach) – 1803 r. – S. Tennant, W. H. Wollastone
(z rud platyny)
Hs – has
(nazwa od Hesji – landu Niemiec) – 1984 r. P. Armbruster,
G. Münzenberg

ŻELAZOWCE - WYSTĘPOWANIE
Fe
hematyt – Fe
2
O
3
magnetyt – Fe
3
O
4
syderyt – FeCO
3
limonit – FeO(OH)
piryt – FeS
2
hematyt
magnetyt
syderyt
limonit
piryt

ŻELAZOWCE - WYSTĘPOWANIE
Ru
i
Os
jako domieszki z Cu, Ag i Au, głównie jako rudy siarkowe
Światowa produkcja platynowców ok. 300 – 350 ton
ruten
osm
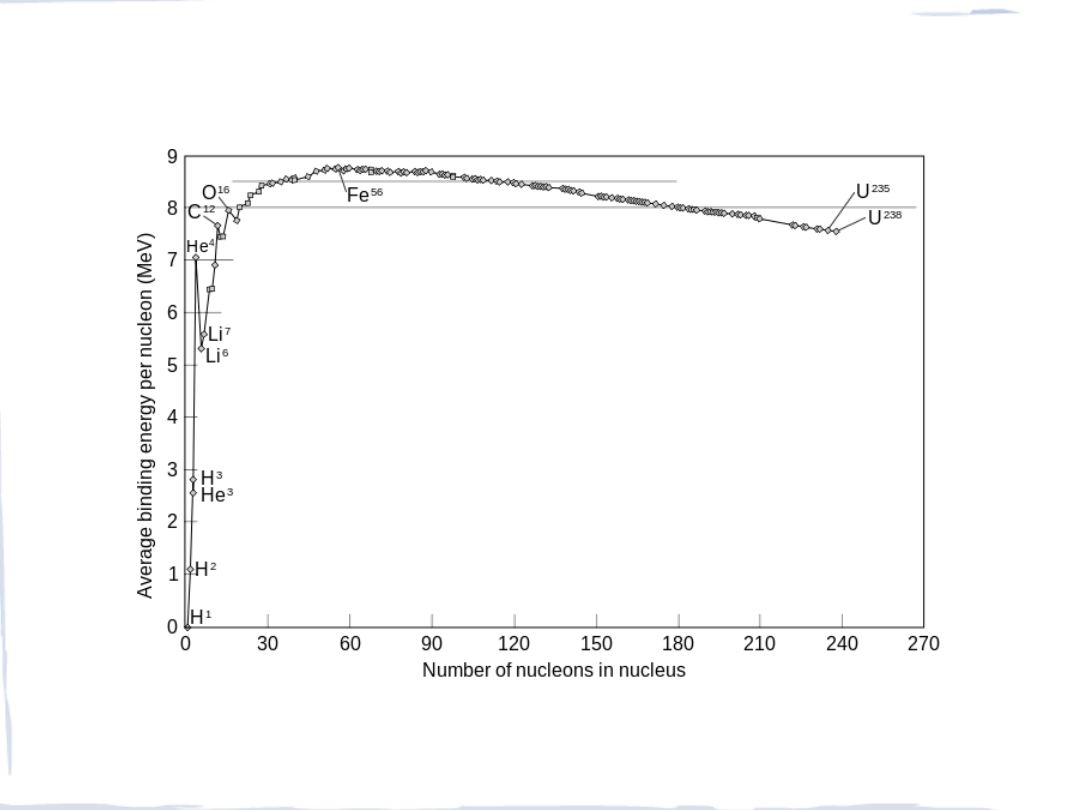
ROZPOWSZECHNIANIE ŻELAZA WE WSZECHŚWIECIE

OTRZYMYWANIE
Fe
wytop surówki w wielkim piecu (40 – 50 m wysokości, średnica 15 m)
do wyprodukowania 1 kg
żelaza
potrzeba 1,75 kg rudy, 0,75 kg koksu, 0,25 kg
kamienia wapiennego
produkcja 800-900 mln ton/rok (statki, samochody, dźwigary – konstrukcje), stopy
Fe
/Si,
Fe
/Cr,
Fe
/Mn,
Fe
/Ni
Ru
i
Os
– ekstrakcja ze szlamu
anodowego (przy otrzymywaniu Cu);
stapianie z alkaliami; elektroliza
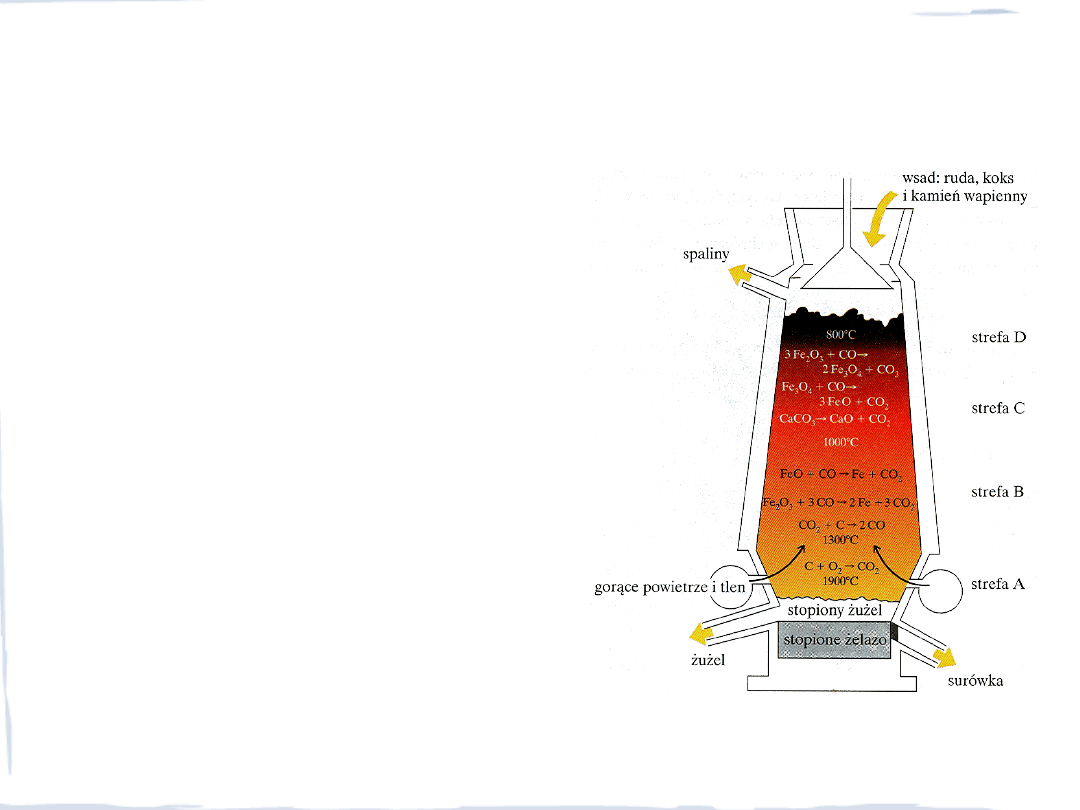
PROCESY W WIELKIM PIECU
2Fe
2
O
3
+ 3C
4Fe + 3CO
2
CaCO
3
+ SiO
2
CaSiO
3
+ CO
2
3Fe
2
O
3
+ CO
2Fe
3
O
4
+ CO
2
Fe
3
O
4
+ CO
3FeO + CO
2
2CO
C + CO
2
FeO + CO
Fe + CO
2
CaCO
3
CaO + CO
2
FeO + CO
Fe + CO
2
CO
2
+ C
2CO
CaO + SiO
2
CaSiO
3
FeS + CaO + C
Fe + CaS + CO
MnO + C
Mn + CO
SiO
2
+ 2C
Si + 2CO
strefa D
strefa C
strefa B
strefa A

SURÓWKA HUTNICZA
Stop żelaza z węglem, krzemem, manganem, fosforem i siarką – półprodukt
redukcji w wielkim piecu
Ze względu na przeznaczenie dzielimy na:
-Bessemerowska, o dużej zawartości krzemu a nie zawiera fosforu i siarki
-Martenowska
-Tomasowska, o dużej zawartości fosforu i małej krzemu
-Odlewnicza, do produkcji żeliwa

PRODUKCJA STALI
Proces Bessemera
•gorące powietrze przepuszcza się przez stopioną surówkę
•6 ton wsadu w ciągu 20 min.
•nie usuwa się P
P
4
O
10
+ 6Fe + 3O
2
2Fe
3
(PO
4
)
2
Fe
3
(PO
4
)
2
+ 2Fe
3
C + 3Fe
2Fe
3
P + 6FeO + 2CO
FeO + SiO
2
FeSiO
3
– zużycie materiału
•technologia opracowana przez H. Bessemera w roku
1856 zakładała stosowanie rud o bardzo niskiej
zawartości fosforu. Dla rud z dużą zawartością P
stosowano piece martenowskie (wannowe)

PRODUKCJA STALI
Proces Thomasa
• dodatek CaO lub CaCO
3
(P
4
O
10
Ca
3
(PO
4
)
2
)
• szlaka – tomasyna – nawóz
BOP (basic oxygen process) – Kaldo, LD
•zastąpienie powietrza czystym tlenem (z powodu zbyt dużej ilości azotu w stali)
•szybsza konwersja
•możliwość pracy z większymi objętościami
(300 ton/40 min)
•czysta powierzchnia bez warstw azotków
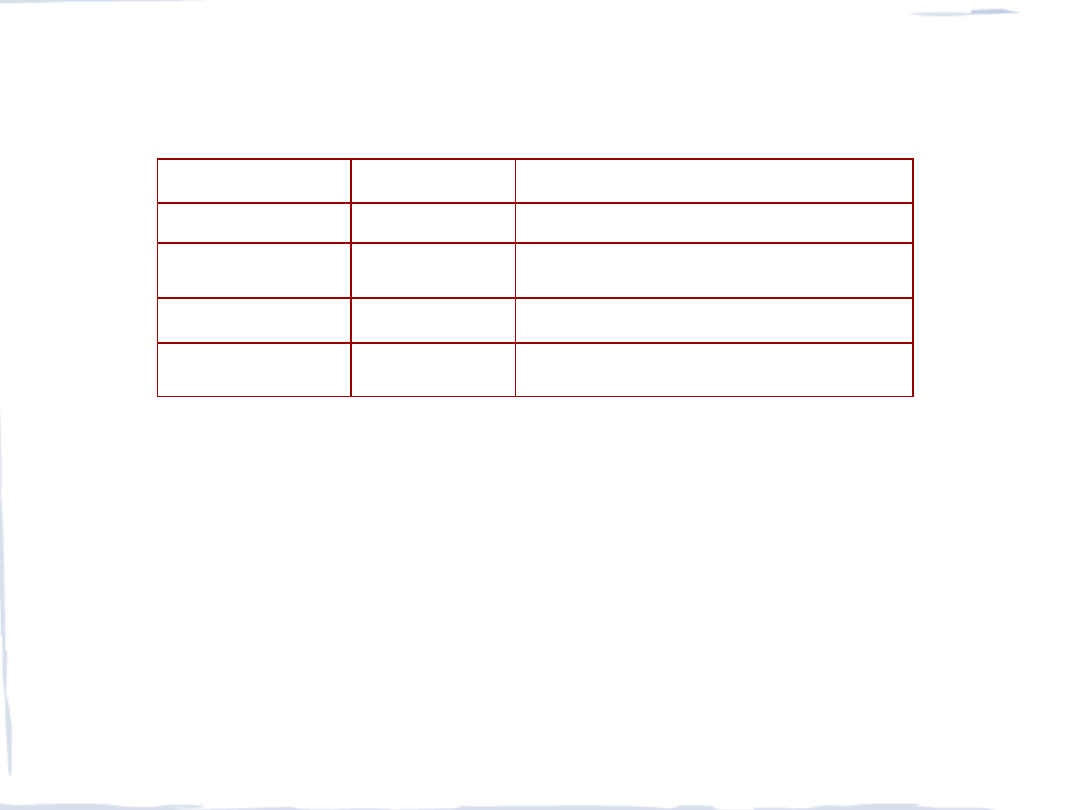
STALE
typy stali
zaw. węgla %
właściwości i zastosowania
niskowęglowa
< 0,15 plastyczność i mała twardość, druty
miękka
0,15 – 0,25 kable, gwoździe, łańcuchy, podkowy
średniowęglowa
0,20 – 0,60 dźwigary, szyny, konstrukcje
wysokowęglowa
0,60 – 1,50 noże, żyletki, narzędzia wiertnicze
Stale specjalne – z domieszkami V, Cr, Mo, W lub Mn,
np. stal nierdzewna zaw. ok. 15% Cr

PRODUKCJA ŻELAZA (MLN TON)
kraj
rudy żelaza
surówka
czyste
żelazo
stal
Chiny
1 114,9
549,4
573,6
Australia
393,9
4,4
5,2
Brazylia
305,0
25,1
0,01
26,4
Japonia
66,9
87,5
Indie
257,4
38,2
23,40
63,5
Rosja
92,1
43,9
4,70
60,0
Niemcy
0,4
20,1
0,38
32,7
ŚWIAT
1 594,9
914,0
64,50
1 232,4

ZASTOSOWANIA
Ruten
-
stopy z platyną i palladem – styki elektryczne
- RuO
2
– rezystor w chipach komputerowych (50% produkcji Ru)
- kataliza – odsiarczanie paliw RuO
2
– karbenowe kompleksy – metateza olefin
- konwersja energii słonecznej
Osm
tlenki osmu są lotne i silnie toksyczne dlatego osm stosowany jest głównie
w stopach
OsO
4
– wykrywanie odcisków palców
– ważny utleniacz w syntezie organicznej (toksyczny)
Osm dawniej wykorzystywany jako włókno w żarówkach
(
Osram
–
os
minum i wolf
r
am
)
Absorber wodoru (jak pallad)

KONFIGURACJA ELEKTRONOWA I STOPNIE UTLENIENIA
pierwiastek konfiguracja
stopnie utlenienia
Fe
Ru
Os
[Ar]3d
6
4s
2
[Kr]4d
7
5s
1
[Xe]4f
14
5d
6
6s
2
0
II III
(IV) (V) (VI)
0 II
III
IV (V) VI (VII) VIII
0 (I) (II) (III)
IV
(V) VI (VII) VIII
rozpowszechnienie w skorupie ziemskiej
Fe
Ru
Os
62 000
0,0001
0,005
4
77
72

NIEKTÓRE REAKCJE Fe, Ru I Os
reagent
Fe
Ru
Os
O
2
Fe
3
O
4
w 500
o
C
Fe
2
O
3
w wys. temp.
RuO
2
w 500
o
C OsO
4
w 200
o
C
S
FeS
FeS
2
z nadmiarem
RuS
2
OsS
2
F
2
FeF
3
RuF
5
OsF
6
Cl
2
FeCl
3
RuCl
3
OsCl
4
H
2
O
powolne rozpuszczanie
Fe
3
O
4
w temp. czerwonego żaru
brak reakcji
brak reakcji
rozc. HCl
Fe
+2
+ H
2
brak reakcji
brak reakcji
rozc. HNO
3
Fe
+3
+ H
2
brak reakcji
brak reakcji
woda królewska pasywacja
brak reakcji
OsO
4

WŁAŚCIWOŚCI FIZYCZNE
Promień
kowalencyjny
[Å]
Promień
jonowy [Å]
Temp. top.
[
o
C]
Temp.
wrzenia
[
o
C]
Gęstość
[g/cm
3
]
elektroujemność
M
+2
M
+3
Fe
Ru
Os
1,17
1,24
1,26
0,78
0,81
0,88
0,64
0,72
0,78
1 535
2 282
3 045
2 750
(4 050)
(5 025)
7,87
12,41
22,57
1,8
2,2
2,2

ZWIĄZKI ŻELAZOWCÓW
(0)
karbonylki
Fe(CO)
5
Fe
2
(CO)
9
Fe
3
(CO)
12
Ru(CO)
5
Os(CO)
5
Os
2
(CO)
9
Os
3
(CO)
12
Fe(CO)
5
+ 3NaOH
Na[HFe(CO)
4
] + Na
2
CO
3
+ H
2
O
Fe(CO)
5
+ PF
3
(PF
3
)Fe(CO)
4
+ CO
Fe
2
(CO)
9
+ 6PPh
3
Fe
2
(CO)
3
(PPh
3
)
6
+ 6CO
Fe
2
(CO)
9
+ 4NO
2Fe(CO)
2
(NO)
2
+ 5CO
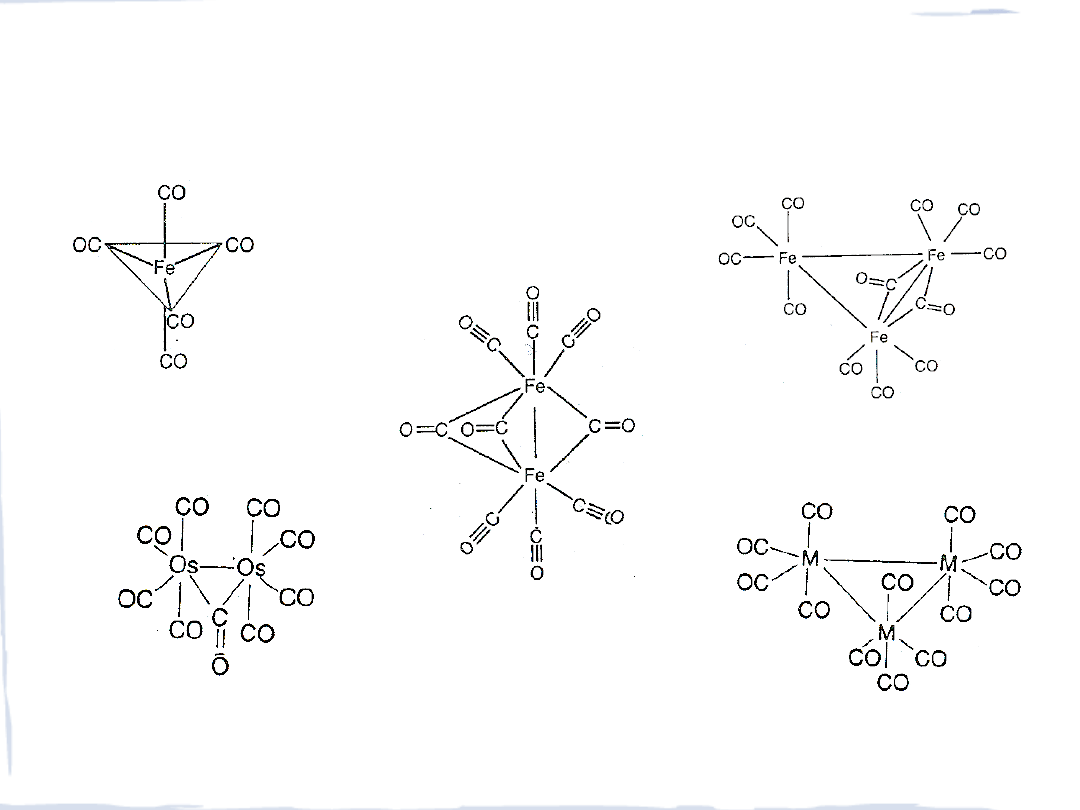
STRUKTURY KARBONYLKÓW
Fe(CO)
5
Fe
2
(CO)
9
Fe
3
(CO)
12
Os
2
(CO)
9
Ru
3
(CO)
12

ZWIĄZKI ŻELAZOWCÓW
+II
FeO (Fe
0,95
O)
Fe(COO)
2
FeO + CO
2
+ CO
4FeO
Fe
3
O
4
+ Fe
Fe
3
O
4
= Fe
II
Fe
2
III
O
4
Fe
+2
+ 2OH
-
Fe(OH)
2
FeF
2
FeCl
2
Fe + HX
FeF
2
x
8H
2
O
FeCl
2
x
4H
2
O
H
2
O
Fe(OH )
2
O
2
Fe(OH )
3
Fe
2
O
3
x
(H
2
O)
n
p owi et rz e
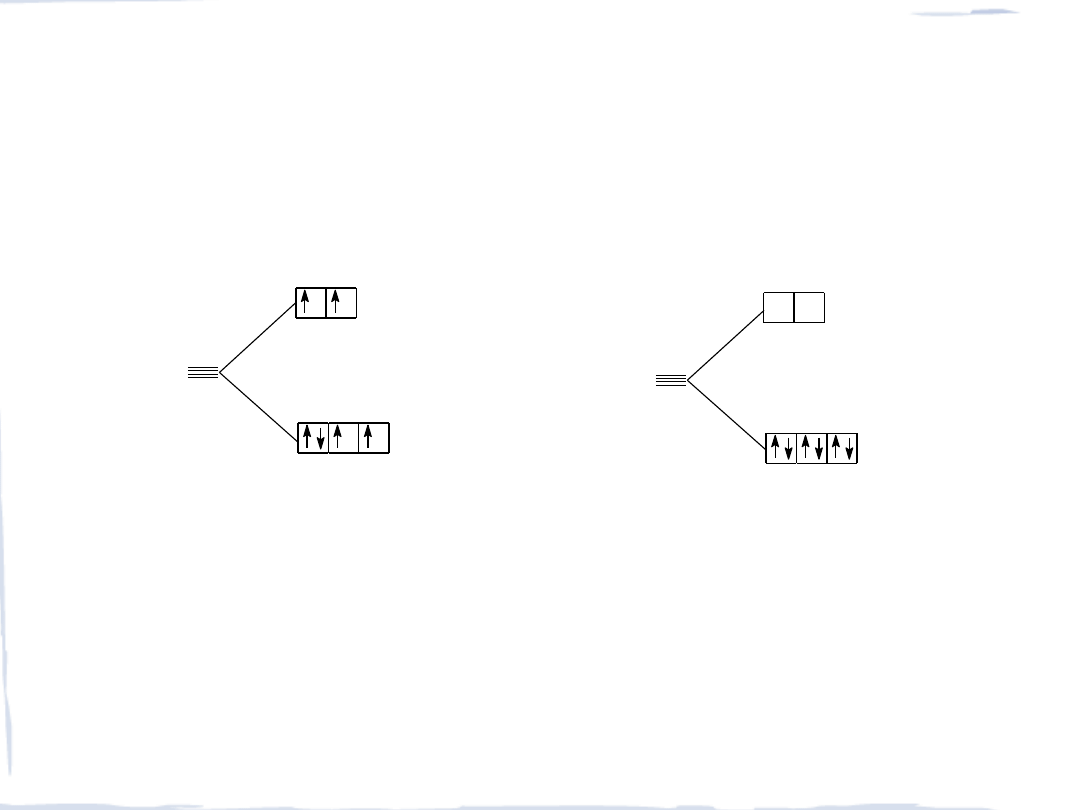
ZWIĄZKI ŻELAZOWCÓW
K
4
[Fe
II
(CN )
6
]
Fe
+2
Fe
+2
K
2
Fe
II
[Fe
II
(CN )
6
]
K
3
[Fe
III
(CN )
6
]
KFe
II
[Fe
III
(CN )
6
]
KFe
III
[Fe
II
(CN )
6
]
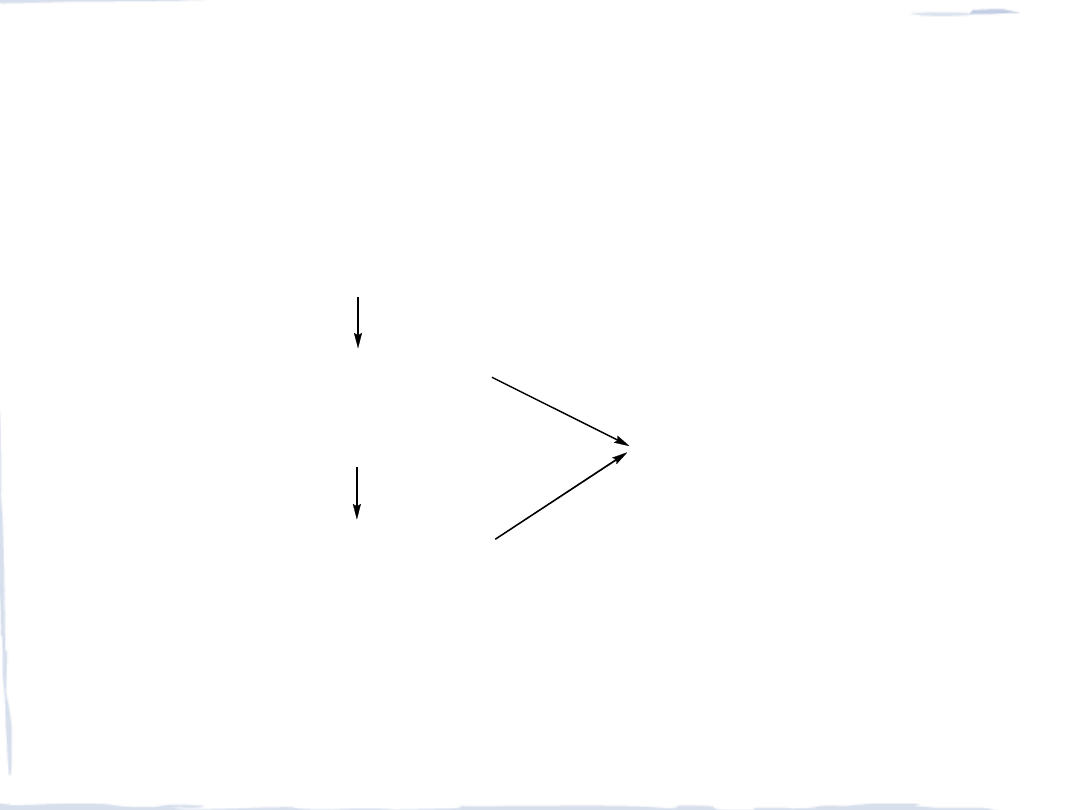
KONFIGURACJE ELEKTRONOWE d
6
JONU Fe
+2
słabe pole ligandów
silne pole ligandów

ZWIĄZKI ŻELAZOWCÓW
FeCl
3
H
2
O
Fe
2
O
3
x
(H
2
O)
n
FeO
x
OH
OH
+III
Fe
2
O
3
FeO
x
OH
Fe
3
O
4
Fe
II
Fe
III
2
O
4
Fe
2
O
3
Fe
3
O
4
FeO
Fe
2
O
3
+ Na
2
CO
3
2NaFeO
2
+ CO
2
ferryty – tlenki mieszane
FeO
x
OH
Fe
2
O
3
2Fe + 3Cl
2
2FeCl
3
FeCl
3
- utleniacz
Fe(H
2
O)
6
+3
[Fe(H
2
O)
5
OH)
+2
+ H
+
(hydroliza przy pH =2-3 a w wyższym pH
dalsza hydroliza prowadząca do wytrącenia mieszanych tlenków
uwodnionych)
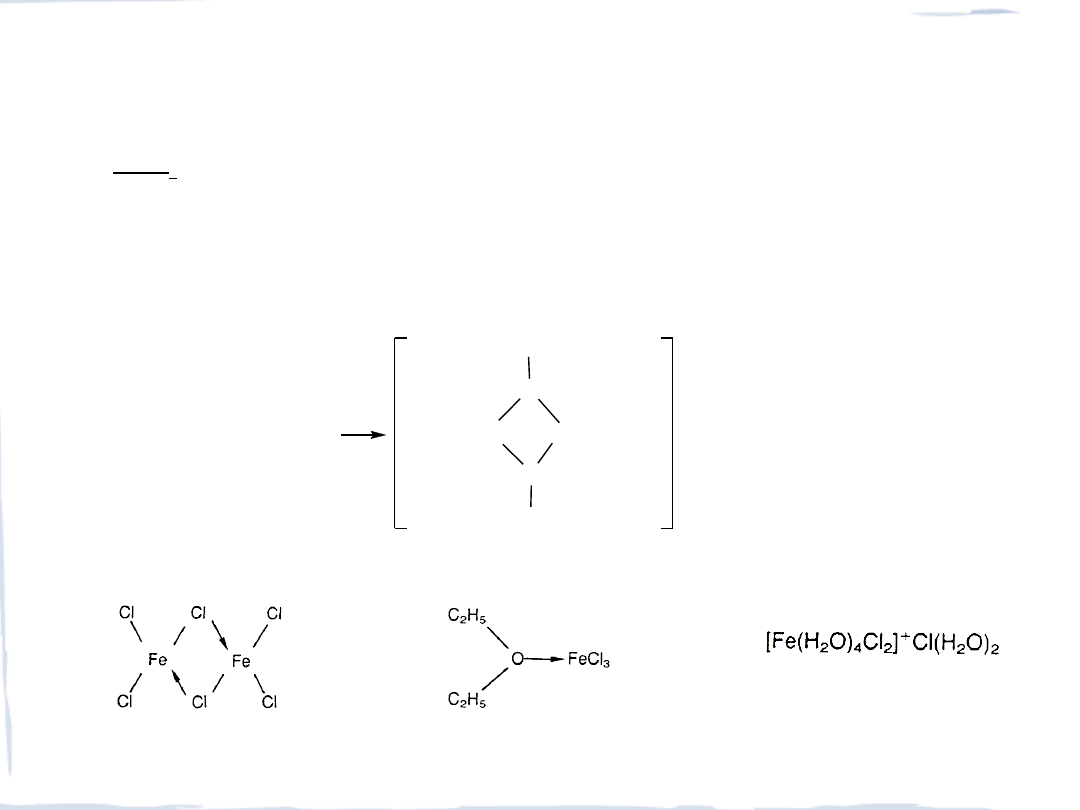
struktury FeCl
3
(FeCl
3
)
2
gaz dimer
solwatowany FeCl
3
uwodnionyFeCl
3
FeCl
3
x
6H
2
O
ZWIĄZKI ŻELAZOWCÓW
2[Fe(H
2
O)
5
x
OH ]
+2
(H
2
O)
4
Fe
Fe(H
2
O)
4
O
O
H
H
+4
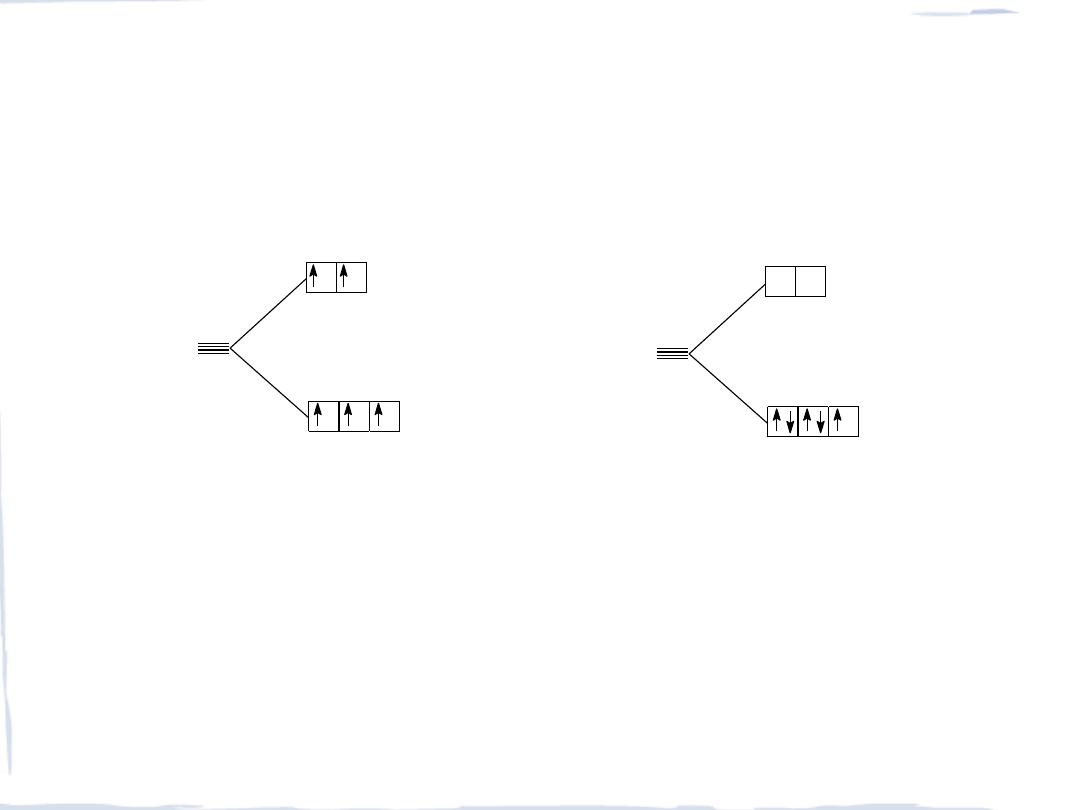
KONFIGURACJE ELEKTRONOWE d
5
JONU Fe
+3
słabe pole ligandów
silne pole ligandów

ZWIĄZKI ŻELAZOWCÓW
+IV
Ru + O
2
RuO
2
(niebieskoczarny)
Os + O
2
OsO
2
(miedziany)
+V
RuCl
3
+ KCl + 3F
2
K[Ru
V
F
6
]
+VI
FeO
4
-2
(purpurowo-czerwony jon żelazianowy – silniejszy utleniacz od MnO
4
-
, trwałe
tylko w roztworach silnie alkalicznych)
Fe
+3
+ 4NaOCl
FeO
4
-2
+ 4NaCl
2[Fe
VI
O
4
]
-2
+ 5H
2
O
Fe
+3
+ 1½O
2
+ 10OH
-
RuF
6
, OsF
6
+VIII
RuO
4
, (pomarańczowy), OsO
4
(bezbarwny) – nie wykazują właściwości zasadowych
4Ru
VIII
O
4
+ 4OH
-
4Ru
VII
O
4
-
+ 2H
2
O + O
2
nadrutenian
4Ru
VII
O
4
-
+ 4OH
-
4Ru
VI
O
4
-2
+ 2H
2
O + O
2
rutenian
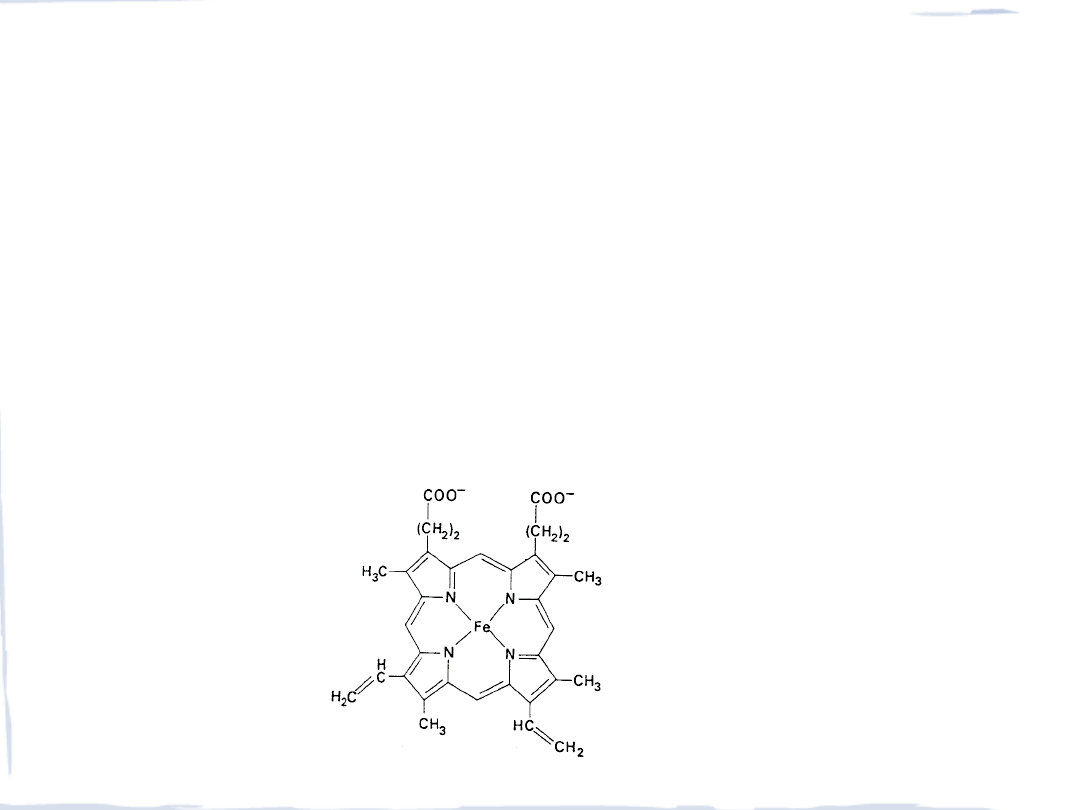
BIONIEORGANICZNA CHEMIA ŻELAZA
• transport tlenu we krwi (ssaki, ptaki, ryby) – hemoglobina
• przechowywanie tlenu w mięśniach – mioglobina
• transport ē w roślinach, u zwierząt i bakterii (cytochromy, ferodoksyny)
• do przechowywania żelaza (ferrytyna, transferyna)
• nitrogenaza
• inne enzymy (oksydazy, katalazy, peroksydazy, dehydrogenazy)
struktura hem b
ZWIĄZKI ŻELAZOWCÓW - METALOCENY
przykładowe metaloceny
[(
5
-C
5
H
5
)
2
V
II
]
[(
5
-C
5
H
5
)
2
Cr
II
]
[(
5
-C
5
H
5
)
2
Fe
II
]
[(
5
-C
5
H
5
)
2
Co
III
]
+
[(
5
-C
5
H
5
)
2
Ni
II
]
wanadocen
chromocen
ferrocen
kobaltocen
niklocen
ciemnofioletowe ciało stałe, wrażliwe na tlen
szkarłatne kryształy, bardzo wrażliwe na tlen
pomarańczowe kryształy, stabilne>500
o
C
żółta sól, stabilna w wodzie i ~400
o
C
jasnozielone ciało stałe, utlenia się w powietrzu
FeCl
2
+ 2C
5
H
5
MgBr
Fe(C
5
H
5
)
2
+ MgBr
2
+ MgCl
2
C
5
H
6
+ Na
Na
+
+ C
5
H
5
-
+ ½H
2
FeCl
2
+ 2C
5
H
5
-
(
5
-C
5
H
5
)
2
Fe + 2Cl
-
NiCl
2
+ C
5
H
5
-
(
5
-C
5
H
5
)
2
Ni + 2Cl
-
FeCl
2
+ 2C
5
H
6
+ 2Et
2
NH
Fe(C
5
H
5
)
2
+ 2EtNH
2
+ 2Et
2
NH
2
Cl
C
5
H
6
+ TlOH
2C
5
H
5
Tl + FeCl
2
H
2
O
C
5
H
5
Tl + H
2
O
T H F
(
5
-C
5
H
5
)
2
Fe + TlCl
H Cl
Fe(
5
-C
5
H
5
)
2
+ CH
3
COCl
(
5
-C
5
H
4
COCH
3
)(
5
-C
5
H
5
)Fe

KOROZJA
Procesy stopniowego niszczenia materiałów (nie tylko metalowych), zachodzące
pomiędzy ich powierzchnią, a otaczającym środowiskiem
Korozja niszczy rocznie ~25 mln ton stali (w skali światowej) czyli roczne straty
korozyjne na 1 mieszkańca wynoszą ~1 500 $
Korozja powoduje straty:
• bezpośrednie
• pośrednie
– narażenie zdrowia i życia
– zagrożenia środowiska

KOROZJA
Korozja metali jest nieuchronnym procesem powrotu metali do stanu, w jakim
występują w rudach (równowaga termodynamiczna)
Wyróżnia się:
• korozję chemiczną
• korozję elektrochemiczną
• korozję cierną (niszczenie metali pod wpływem tarcia)
• korozję (kruchość) wodorową –
niszczenie struktury metalu, przez który dyfunduje wodór

KOROZJA CHEMICZNA
Spowodowana
działaniem
substancji
chemicznych w warunkach, w których
reakcjom
chemicznym
nie
towarzyszy
przepływ prądu (redox), np. utlenianie metali
w wysokich temperaturach (walcowanie).
Korozja gazowa prowadzi do powstania
warstewek tlenków.
W hutnictwie żelaza jest przyczyną zgorzeliny
(łatwo odpadającej od metalu po ochłodzeniu,
piaskowaniu lub młotkowaniu)
walcownia żelaza w Nowej Hucie
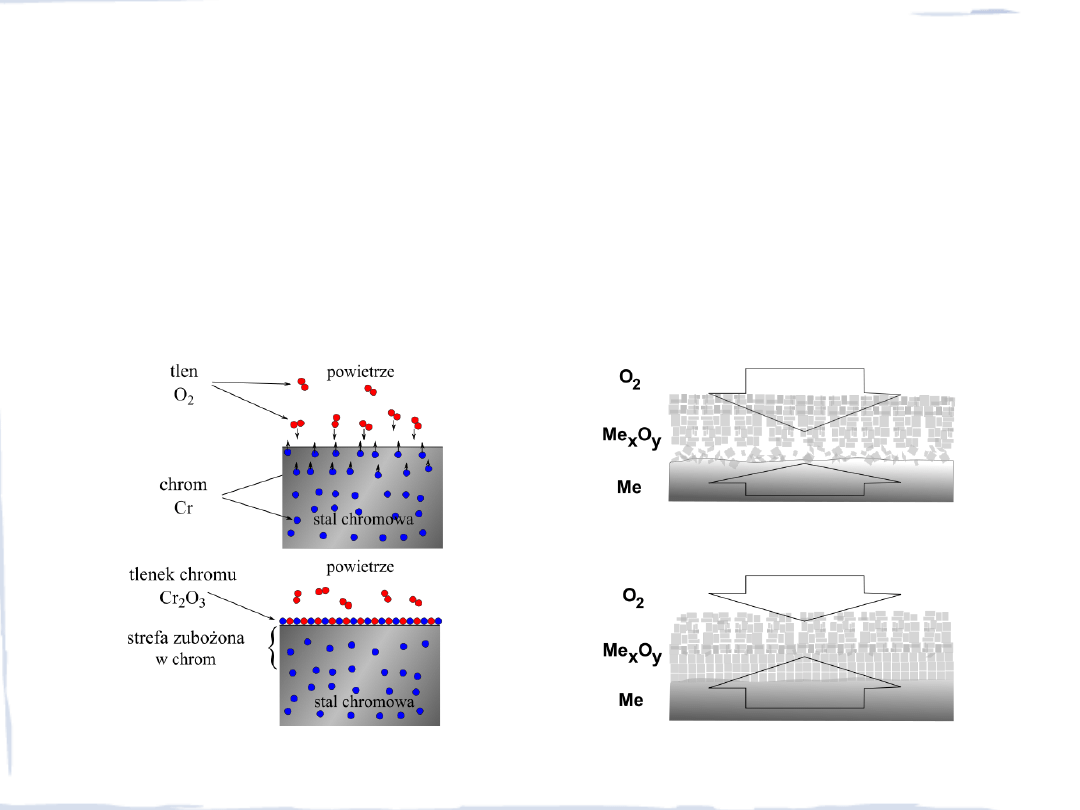
KOROZJA CHEMICZNA
Utlenianie powierzchni metalu w wysokich temperaturach rozpoczynają procesy:
• adsorpcja tlenu na powierzchni
• jonizacja zaadsorbowanych cząsteczek
• reakcja z atomami metalu na powierzchni
Warstwy szczelne mogą powstać jeżeli objętość molowa tlenku nie jest mniejsza od objętości
molowej metalu.
Metale I i II grupy nie mogą być chronione warstwą tlenku, a tlenki powstające na aluminium,
chromie lub niklu tworzą warstwy ochronne (reguła Pillinga i Bedwortha)
warstwa tlenkowa na chromie
warstwy tlenków na żelazie i na wolframie

KOROZJA ELEKTROCHEMICZNA
Spowodowana procesami elektrochemicznymi, zachodzącymi w skutek występowania
różnych potencjałów na powierzchni metalu, znajdującego się w środowisku elektrolitu.
Powstają ogniwa korozyjne, w których fragmenty powierzchni metalu o niższym
potencjale są anodami.
Na katodach ogniw korozyjnych zachodzi redukcja tzw. depolaryzatora (głównie tlen
cząsteczkowy i jony wodorowe)
Różnice między potencjałami poszczególnych fragmentów wynikają z:
• chemicznego składu stopu
• defektów sieci krystalicznej stopu
• wielkości i rodzaju naprężeń
• chemicznego składu elektrolitu

KOROZJA ELEKTROCHEMICZNA
Korozja kontaktowa (stykowa) – wieloelementowe
urządzenia, w których poszczególne, stykające się
elementy są wykonane z różnych metali, np. spawy,
nity, śruty
Ogniwa różnego napowietrzenia – korozja linii
statków morskich, wzdłuż której przebiega granica
zanurzenia kadłuba
Korozja naprężeniowa – miejsca występowania
naprężeń rozciągających są mniej szlachetne
korozja naprężeniowa
korozja różnego napowietrzania
korozja kontaktowa
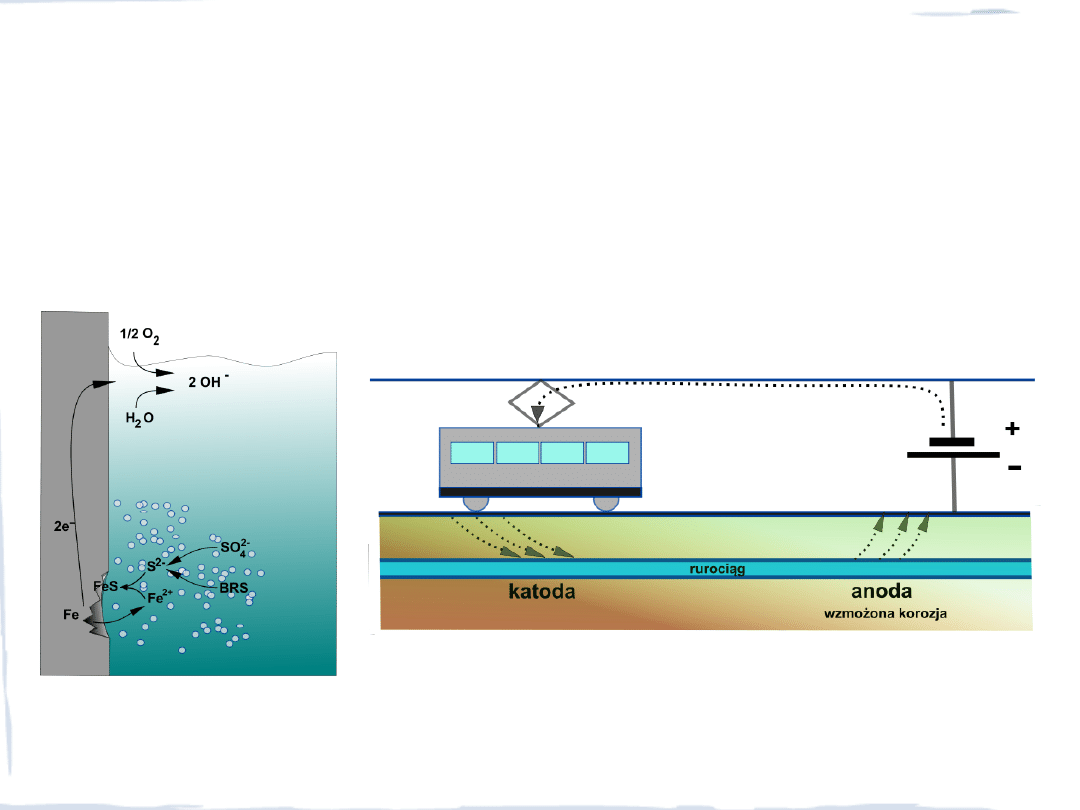
KOROZJA ELEKTROCHEMICZNA
Korozja w warunkach beztlenowych
z udziałem bakterii redukujących siarczany (BRS)
– niszczenie kadłubów statków, platform wiertniczych, instalacji hydrotechnicznych
Korozja elektrolityczna – zachodząca w gruncie, w którym występują prądy błądzące –
korozja rurociągów ciepłowniczych, układanych pod trakcją elektryczną
prądy błądzące
BRS

OCHRONA METALI PRZED KOROZJĄ
Straty, związane z korozją zmniejsza się, stosując:
•zasadę unikania możliwości powstawania ogniw korozyjnych
•ochronę galwaniczną, polegającą na użyciu zewnętrznego źródła napięcia
i zewnętrznej, trwałej elektrody o kontrolowanym potencjale
•stosowania warstw ochronnych, izolujących metal od środowiska korozji
•ochronę elektrolityczną, polegającą na stosowaniu takiej zewnętrznej elektrody,
której materiał jest mniej szlachetny
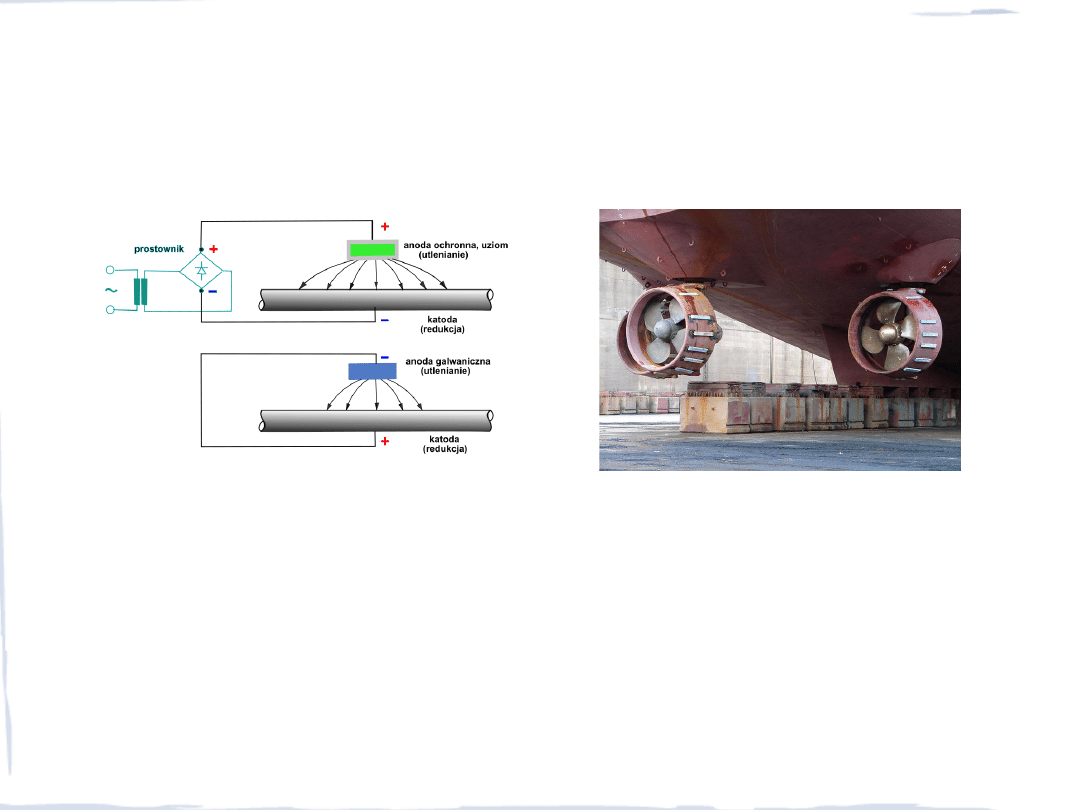
OCHRONA METALI PRZED KOROZJĄ
Ochrona katodowa
– do chronionej konstrukcji dołącza się zewnętrzną anodę. Powierzchnia
chronionego metalu staje się katodą, na której zachodzi redukcja depolaryzująca
Ochrona katodowa elektrolityczna
– stosowane są trwałe anody ochronne (uziomy),
połączone przewodnikiem z dodatnim biegunem prostownika. Materiał anodowy to grafit,
platynowany tytan lub tantal, kable miedziane. Stosowana do zabezpieczania rurociągów w
wodzie morskiej, zbiorników zakopanych w gruncie, itp.
Ochrona katodowa galwaniczna
– stosuje się kształtki o niskim potencjale (magnez, cynk,
aluminium)
ochrona katodowa
Protektor
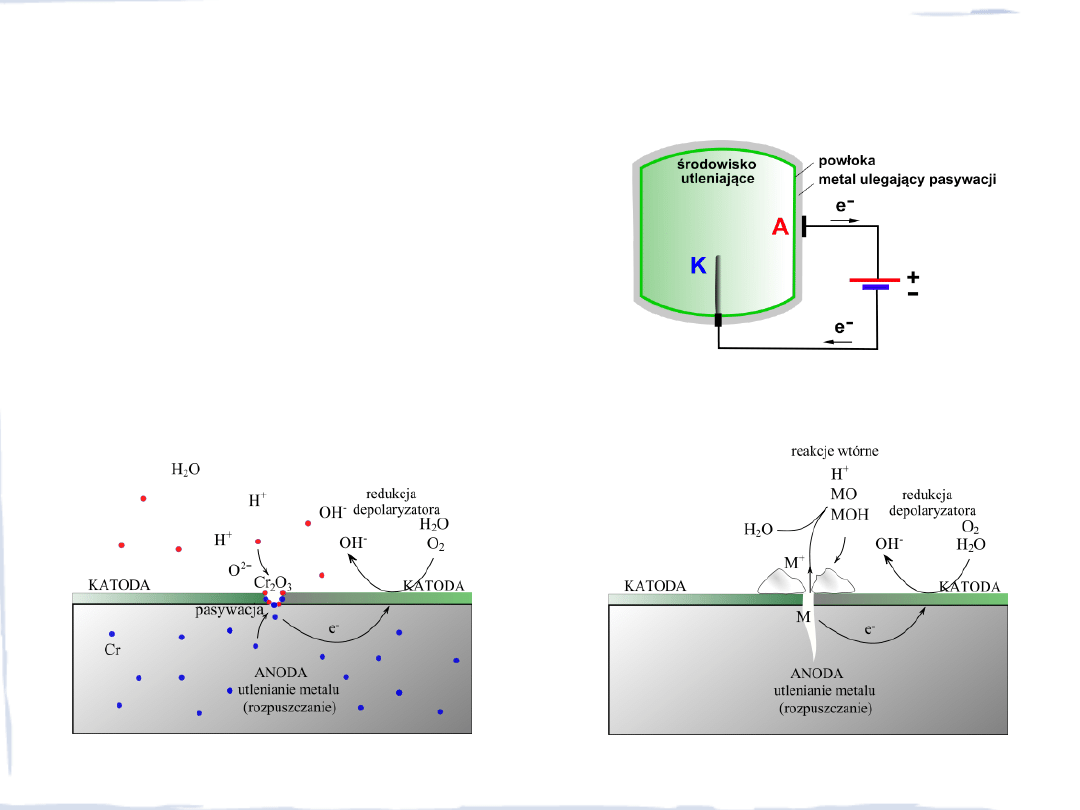
OCHRONA METALI PRZED KOROZJĄ
Ochrona anodowa
– polega na połączeniu
wszystkich elementów chronionej
konstrukcji w jeden obwód elektryczny,
w którym chroniony metal jest anodą
ochrona metaliczna 2
ochrona metaliczna 1
ochrona anodowa

OCHRONA METALI PRZED KOROZJĄ
Powłoki ochronne
– szczelna powłoka, nanoszona na powierzchnię metalu
Wyróżnia się powłoki:
•anodowe, wykazujące niższy potencjał
•chemiczne
•elektrolityczne (galwaniczne)
•emalierskie
•kondensacyjne, otrzymywane przez redukcję metalu bez udziału prądu
•konwersyjne, np. fosforanowanie
•malarskie
•metalizowane, np. poprzez natrysk
•zanurzeniowe (ogniowe), np. cynkowanie

OCHRONA METALI PRZED KOROZJĄ
Powłoki metaliczne
– warstwy innego metalu na powierzchni wyrobu
Nakładane metodami:
•elektrolityczną – pokrywanie złotem, srebrem, miedzią, niklem, chromem
•ogniową – powlekanie metalu w kąpielach stopionego metalu ochronnego (cynk,
ołów, glin)
•chemiczną – z użyciem bezprądowych kąpieli lub natryskiem soli
z reduktorem
•dyfuzyjną – nasycenie powierzchni stopu przez dyfuzję atomów metali poprzez
zewnętrzną warstwę metalu, np. tytanowanie, wanadowanie
•platerowanie – nakładanie z użyciem nacisku (srebro, miedź)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
Wyszukiwarka
Podobne podstrony:
CN II 4 2013
CN II 9 2013
CN II 10 2013
francuski pr ii 2013
hiszpanski pr ii 2013
Prawo UE Demokratyczne podstawy (II 2013)
Enzymy II 2013
pytania treningowe, pytania treningowe wyklad II 2013, I zjazd - termodynamika
Prawo UE Wprowadzenie (II 2013)
Prawo UE Wartości, cele i zasady (II 2013)
TI II 2013 14 ramowy plan zajęć Informatyka w Historii sztuki
Giełda stoma Głowa II 2013
III rok harmonogram strona wydział lekarski 2013 2014 II i III Kopia
3 NOWY Aminokwasy II 2012 2013(1)
list intencyjny1, Prywatne, Technik administracji, II semestr 2013-zima, Technika Pracy Biurowej, do
Lepkość-sciaga, Elektrotechnika AGH, Semestr II letni 2012-2013, Fizyka II - Laboratorium, laborki,
geo 1-2, Szkoła, Technikum Elektroniczne, szkoła II TA 2012;2013, Geografia
więcej podobnych podstron