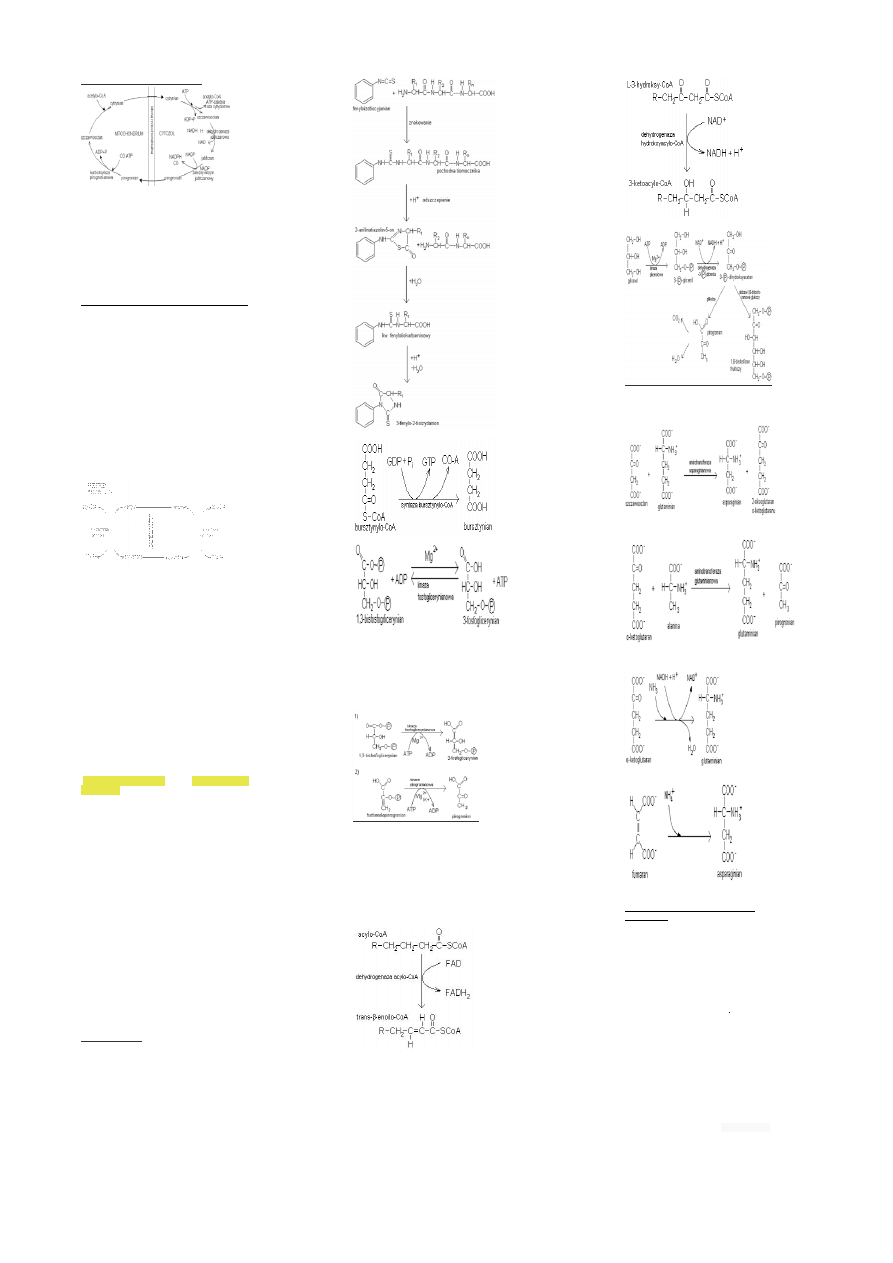
Przenoszenie acetylo-CoA z mit. do cyt.
acetylo CoA powstaje z pirogronianu w mitochondrium.Jako
że synteza kwasów tłuszczowych przebiega w
cytozolu,Acetylo-CoA musi być przeniesiony z mitochondrium
do cytozolu. Sam acetylo-CoA nie może przenikać przez
wewnętrzną błonę mitochondrialną, dlatego dochodzi do
kondensacji acetyloCoA ze szczawiooctanem prowadzącej do
powstania cytrynianu,ten jest transportowany do cytozolu,
gdzie ulega rozszczepieniu przez liazę cytrynianową,zależną
od ATP,co umożliwia odtworzenie acetylo-CoA i
szczawiooctanu,ten nie może jednak wrócić przez błonę
mitochondrialną (u zwierząt), dlatego ulega przemianie do
jabłczanu i pirogronianu
Przenoszenie CoA-SH z cytoplazmy do mitochondrium
-cząsteczki acetylo-CoA o krótkich i średnio długich
łańcuchach ( do 10 at.) łatwo przenikają przez wew. bł.
mitochondrium , -przejście cząstek acetylo-CoA o dłuższych
łańcuchach wymaga już specyficznego mechanizmu
transportu, -reszty acylowe cząstek acetylo-CoA o dłuższych
łańcuchach przekraczają wewnętrzną błonę po sprzężeniu z
polarną cząsteczką karnityny, która występuje zarówno u
roślina jak i u zwierząt
-reakcja sprzęgania katalizowana jest przez enzym ulokowany
na zewnętrznej części wewnętrznej błony mitochondrium
(ACYLOTRANSFERAZA KARNITYNOWA I) i polega na usunięciu
CoA oraz zastąpieniu go karnityną
-translokaza karnityna/acylokarnityna transportuje
acylokarnitynę przez wewnętrzną błonę mitochondrium do
matrix, -cząsteczki karnityny są uwalniane do acylokarnityny
a grupa acylowa z powrotem przenoszona jest na CoA
-reakcja katalizowana jest przez acylotransferaze karnitynową
II, znajdującą się na wewnętrznej błonie mitochodnium, od
strony matrix.
4. ENZYMY W REPLIKACJI DNA U PROCARYOTA I
EUCARYOTA
Polimeraza RNA (prymaza)
Primaza jest aktywowana przez helikazę DNA i po aktywacji
syntezuje na obu niciach DNA krótkie (11 +/-1 zasad)
komplementarne odcinki (primery) starterowego RNA
wykorzystywane przez polimerazę DNA do rozpoczęcia
syntezy nowych nici DNA w procesie replikacji DNA. Do
syntezy RNA nie potrzebuje w odróżnieniu od polimeraz DNA
odcinków starterowych z wolnym końcem 3'-OH.
Polimeraza DNA I
-wymaga udziału nukleozydówtrifosforanów 4 zasad,jonów
Mg,Dna-matrycy,startera wolną gr.OH.Pełni f.kontrolną-
koryguje błędy w zapisie zasad,usuwa błędny nukleotyd
dzięki aktywności 3’-5’egzonukleazy. Rozkłada łańcuch poli-d-
nukleotydów od końca 5’ dzięki aktywn. 5’-3’. Dysponje na
jednym łań.polipeptyd. trzema centrami katalitycznymi : 5’-
3’polimerazową,5’-3’ i 3’-5’ egzonukleazowymi.
Polimeraza DNA II i III
II-pełni f.kontrolne i naprawcze, III- właściwa dla biosyntezy
DNA,Pełni f. jak pol.I,NIE ma aktywn. 5’-3’.
Helikaza DNA
-rozplata dwuniciowy heliks poprzez degradację wiązań
wodorowych między zasadami -wykorzystuje ATP jako źródło
energii
Białko DBP i 5SB
- zapobiega odtwarzaniu się par zasad.czyli ponownemu
tworzeniu w.wodorowych -dzięki niemu każda z dwóch nici
wyjściowego DNA jest gotowa do replikacji, działają bezpośr.
przed tworzącymi się widełkami repl.utrwalają rozłączone
łańcuchy.
Ligaza DNA -spaja nić,uzupełnia brakujące w.fosfodiestr.w
szkielecie nowo zsynt.nici.wspaja fragmenty Okazaki.
Topoizomeraza I (tylko prokaryota) -enzym rozkładający
wiązania fosfodiestrowe w jednej z nici DNA (umożliwia to
swobodną rotację nici wokół drugiej roziętej nici)
Topoizomeraza II (tylko prokaryota)
-enzym rozkładający dwa
złączone pierścienie tworzące szczelinę przez którą może się
wydostać drugi enzym -następnie ten sam enzym spaja
rozcięte kręgi i w rezultacie tworzą się dwa koła,dodaje skręty
do DNA.
Telomeraza – u eukariota.kat.odbudowę końców
telomerowych,zawiera odcinek RNA-służy jako matryca do
syntezy brakującego odcinka DNA,odwrotna transkryptaza.
Polimeraza alfa – działa na terenie jądra.kom.katalizuje
syntezę nici opóźnionej DNA, Pol.delta-kat,.synteze nici
wiodącej DNA,ma aktywn,egzonukleazową. Pol.Beta i
elipson – aktywne przy naprawie błędów lub
uszkodzeń,działają na terenie jądra kom.Pol. Gamma –bierze
udz.w synt.DNA mitochondriów.
Degradacja Edmana
Służy do oznaczania N-końcowych aminokwasów w białkach
Fosfor.substr. w CKTK
Proces ten katalizowany jest przez syntetazę byrsztynylo-CoA
-energia uwalniana podczas rozerwania wiązania byrsztynylo-
CoA jest wykorzystywana do syntezy: -GTP (u zwierząt) -ATP
(wyłącznie u roślin)
Fosforylacja substratowa – przeniesienie P ze związku
ufosforyl.-substrtu,bezpośrednio na ADP lub GDP,w wyniku
czego powstaje zw.wys.energet.-ATP,GTP,
fosforyl. sybstr, w glikolizie są
dwa miejsca fosforylacji
substratowej:
B-utlenianie kwasów tłuszczowych
-rozpad kwasów tłuszczowych,polega na utlenieniu
długołańcuchowych kwasów tłuszczowych, czemu towarzyszy
wytworzenie ATP -cykl B-oksydacji obejmuje powtarzającą się
sekwencję 4 reakcji, z czego reakcjami, w których następuje
utlenianie to reakcje nr 1 i nr 3
1) utlenianie acylo-CoA do enoilo-CoA, zawierającego w
łańcuchu kwasu tłuszczowego wiązanie podwójne trans- B,
czemu towarzyszy powstanie FADH2 (redukcja katalizowana
przez dehydrogenazę acylo-CoA)
3) utlenianie 3-hydroksyacylo-CoA do 3-ketoacylo-CoA,
czemu towarzyszy powstanie NADH (reakcja katalizowana
przez dehydroksyacylo-CoA)
Przemiany glicerolu prowadzące do glukoneogenezy
Z których metabolitów cyklu Krebsa powstają aminokwasy
monoaminodikarboksylowe (reakcje)
*ze szczawioictanu -> asparaginian
*z a-ketoglutaranu -> glutaminian
*redukcyjna aminacja a-ketoglutaranu
*z fumaranu -> asparaginian
Hemoglobina-przykład białka allosterycznego
(wyjaśnienie pojęcia "allosteria" + rodzaje
hemoglobiny)mechanizm hamowania przez efektory
allosteryczne polega na ich oddziaływaniu na plastyczną
konformację cząsteczki białka w obrębie centrum
aktywnego.Centrum allosteryczne jest zdolne do
przyłączenia specyficznego efektora. Pod wpływem
przyłączonego efektora następuje zmiana struktury wtórnej
białka allosterycznego, która może polegać na rozerwaniu lub
wytworzeniu wiązań między poszczególnymi podjednostkami
białka, następuje zahamowanie aktywności enzymu.zjawisko
allosterii występuje zarówno przy hamowaniu, jak i przy
aktywacji reakcji enzymatycznych. Tlen dołącza się do jonu
żelaza II hemu „utlenowując” go, co oznacza, że nie następuje
tu zmiana wartościowości żelaza, w wyniku tego powstaje
oksyhemoglobina, polączenie to jest odwracalne, a kierunek
reakcji zależy od aktualnego stężenia tlenu w danej tkance. W
naczyniach krwionośnych tkanki płucnej stężenie to jest duże
i reakcja jest przesunięta w kierunku przyłączenia tlenu, a w
tkankach oddalonych stężenie tlenu jest małe i następuje w
nich jego oddawanie.
Miejsca regulatorowe w cyklu Krebsa
Regulowane są 3 enzymy wchodzące w cykl i dehydrogenza
pirogronianowa; -syntaza cytrynianowa, -dehydrogenaza
cytrynianowa, -dehydrogenaza α-ketoglutaranu,

1.
reakcja hamowana przez ATP i NADH, sty-
mulowana przez ADP
2.
reakcja hamowana przez bursztynylo-CoA i
NADH
3.
reakcja hamowana przez ATP i cytrynian
Na regulacje cyklu mają wpływ: -dostępność do substratów
-hamujące działanie nagromadzonych produktów -
allosteryczne hamowanie przez następne intermediaty cyklu
oparte na mechanizmie sprzężania zwrotnego -enzymy
1. Syntetaza cytrynianowa -> hamowana przez cytrynian i ATP
2. Dehydrogenaza izocytrynianowa -> hamowana przez NADH
i ATP, lecz aktywowana ADP 3. Dehydrogenaza α-
ketoglutaranowa -> hamowana przez NADH i bursztynylo-CoA
4. Dehydrogenaza pirogronianowa -> hamowana przez NADH
i acetylo-CoA (hamowanie produktu)
Podsumowując, cykl przebiega szybciej, gdy poziom energii w
komórce jest niski (duże stężenie ADP, małe stężenie ATP i
NADH), a zwalnia swój przebieg, gdy dochodzi do akumulacji
ATP (a zatem także NADH, busztynylo-CoA i cytrynianu)
Czółenko jabłczanowo- asparaginianowe
Czółenko to funkcjonuje w sercu i wątrobie
Szczawiooctan w cytozolu ulega przekształceniu w jabłczan
przez cytoplazmatyczną dehydrogenazę jabłczanową. Na tym
etapie następuje reoksydacja NADH do NADH+.
Jabłczan przeniesiony do mitochondriom przez przenośnik
jabłczanowo-α-ketoglutaronowy. U zwierząt szczawiooctan
nie przechodzi przez wewnętrzną błonę mitochondrialną,
dlatego też w reakcji transaminacji zostaje przekształcony w
asparaginian, który wówczas wychodzi z mitochondriom i w
cytozolu ulega powtórnemu przekształceniu w szczawiooctan,
dzięki transaminacji. Rezultatem netto tego cyklu reakcji jest
przeniesienie elektronów z NADH wytworzonego w cytozolu
do NADH wytworzonego w matrix mitochondrialnym.
Pomost łączący glikolizę z cyklem Krebsa
*glikolizę z cyklem Krebsa łączy oksydacyjna dekarboksylacja
pirogronianu zachodząca w matrix mitochondrialnym
To nieodwracalne przekazanie produktu glikolizy do cyklu
kwasu cytrynowego jest katalizowane przez kompleks
dehydrogenazy pirogronianowej
*pirogronian (glikoliza) ulega redukcyjnej karboksylacji
-powstały jabłczan włącza się do CKTK, gdzie z udziałem
dehydrogenazy jabłczanowej ulega odwodornieniu do
szczawiooctanu
Fosfoenolopirogronian -> to jeden z końcowych produktów
glikolizy
Czółenko glicerolo-3-fosforanowe
Czółenko błonowe to połączone reakcje enzymatyczne
pozwalające obejść barierę przepuszczalności. Takie reakcje
są konieczne gdyż wewnętrzna błona mitochondrialną jest
nieprzepuszczalna dla NADH, dlatego NADH wytworzone w
cytoplazmie podczas glikolizy musi być z powrotem utleniony.
1) fosfodihydroksyaceton jest redukowany w CYTOZOLU do
glicerolo-3-fosforanu przez dehydrogenazę glicerolo-3-
fosforanową. Na tym etapie następuje również reoksydacja
NADH do NAD+.
2) glicerolo-3-fosforan dyfunduje do wewnętrznej błony
mitochondriom gdzie ulega przekształceniu do
dihydroksyacetonu przez mitochondrialną dehydrogenazę
glicerolo-3-fosforanową, która zamiast z NAD+ współpracuje
z FAD. FADH2 związany jest z enzymem (E. FADH2) ulega
reoksydacja przez przeniesienie jego elektronów do
ubichinonu znajdującego się w wew. bł.
mitochondrialnej.Czółenko przenosi do mitochondriom 2e z
NADH i wprowadza je do łańcucha transportu elektronów.
Powiązanie syntezy fosforanu kreatyny (fosfagenu) z cyklem
ornitynowym
1) arginina – produkt pośredni cyklu mocznikowego; ulega
kondensacji z glicyną i powstaje guanidynooctan, 2)
guanidynooctan – jest etylowany przez dawcę reszty
metylowej (S-adenozynometioninę) do keratyny
3) keratyna – ulega fosforyzowaniu i przechodzi w fosforan
keratyny, Fosforan keratyny występuje w mięśniach, stanowi
zapas łatwo mobilizowanej wysokiej energii. Bierze udział w
przemianie energii w mięśniach.
Cykl Aktywnego Metylu
Grupa Ado-adenozylowa pochodząca z ATP, Rola: S-
adenozylometionina, -donor grup metylowych w licznych
reakcjach biologicznych, np. fosforan kreatyny i synteza
kwasów nukleinowych.
Powiązanie cyklu mocznikowego i Krebsa (reakcje
prowadzące do wspólnych metabolitów)
Oba cykle połączone są przez fumaran i transaminacje
szczawiooctanu do asparaginian. -synteza fumaranu przez
liazę argininobursztynianową łączy cykl mocznikowy z cyklem
Krebsa
-fumaran jest produktem pośrednim cyklu Krebsa, który po
uwodnieniu tworzy jabłczan, który utlenia się do
szczawiooctanu -powstały szczawiooctan może ulegać
transaminacji np. do asparaginian i powrócić do cyklu
mocznikowego.
Rola asparaginianu w cyklu mocznikowym
Asparaginian kondensuje się z cytruliną, do
argininobursztynianu za pomocą syntetazy
asparaginobursztynianowej.
Przemiany szczawiooctanu w komórce: 1) Transaminacja do
asparaginianu, który może następnie powrócić do cyklu
mocznikowego 2) Kondensacja z acetylo-CoA do cytrynianu,
który dalej ulega przekształceniom w CKTK
3) Przekształcenie w glukozę podczas glukoneogenezy 4)
Przekształcenie w pirogronian
Glukoneogeneza
– proces, w którym zachodzi synteza glukozy z prekursorów
nie będących cukrami -ma duże znacznie dla podtrzymania
zawartości glukozy we krwi podczas głodowania lub
intensywnego wysiłku fizycznego -zachodzi w wątrobie, w
mniejszym stopniu w nerkach -większość enzymów
glukoneogenezy znajduje się w cytozolu, natomiast
karboksylaza pirogronianowa jest w matrix mitochondrialnym
2 nukleotydy purynowe poł. wiązaniem
międzycząsteczkowym.
W skład jakiego koenzymu wchodzi wit. PP? Napisz jej wzór
-witamina PP (niacyna) wchodzi w skład koenzymów
przenoszących protony i elektrony współdziałających z
oksydoreduktazami, a konkretniej dehydrogenazą, a
mianowicie: dinukleotyd nikotynoamidoadeninowy (NAD+) i
fosforan dinukleotydu nikotynoamidoadeninowego
(NADP+)=>cząsteczki obu koenzymów składają się z 2
nukleotydów powiązanych przez fosforany ->pierwszym,
nukleotydem jest AMP -> drugim nukleotydem jest amid
kwasu nikotynowego = niacyna (Wit. PP) *zapobiega
chorobie skóry (pelagra) *bogatym źródłem są Ryny, mleko,
nasiona roślin *Trp zapobiega brakom wit. PP, bo jest jej
prekursorem w biosyntezie
Glutation- budowa i funkcje
Budowa:
*tripeptyd o nazwie 5-glutamylo-cysteino-glicyna (5-Glu-Cys-
Gly) *symbol formy zredukowanej/utlenionej = 2G-SH/G-S-S-
G *jedno z wiązań jest nietypowe, gdyż tworzy je grupa 5-
karboksylowa Glu (glutaminian), a nie jak w białkach grupa
przy C1, Funkcje: *dzięki grupie hydroksylowej pochodzącej z
Cys, łatwo ulega odwodornieniu z wytworzeniem glutationy
utlenionego
2G-SH <-> G-S-S-G + 2H+ +2e *ze względu na odwracalność
reakcji 2G-SH/G-S-S-G jest biologicznym przenośnikiem
elektronów *koenzym liazy laktoiloglutationowej,
katalizującej przemianę metyloglioksalu do kwasu
mlekowego
*jego biosynteza zachodzi w wątrobie *występuje w żółtku jaj
i czerwonych ciałkach krwi *wyizolowany po raz pierwszy w
drożdżach
Elongacja w procesie biosyntezy białka
-na tym etapie kodon inicjujący (AUG) znajduje się w miejscu
P z tMet-tRNA związanym przez sparowanie kodonu z
antykodonem -cząsteczka aminoacylo-tRNA odpowiadająca
drugiemu kodonowi wiąże się w miejscu A rybosomy w
reakcji wymagającej GTP i katalizowanej przez czynnik
elongacyjny EF-T -wiązanie peptydowe jest tworzone prze
peptydotransferazę między końcem C grupy aminoacylo-
tRNA w miejscu P, a grupą aminową aminoacylo-tRNA w
miejscy A. Koniec karboksylowy zostaje odłączony od tRNA w
miejscy P i dołączony do N-końca aminokwasu z tRNA w
miejscu A -w ostatniej reakcji etapu translokacji uwolniony
tRNA opuszcza miejsce P, nowo utworzony peptydylo-tRNA
przemieszcza się z miejsca A do P a rybosom przesuwa się
wzdłuż mRNA o 3 nukleotydy, aby umieścić następny kodon

w miejscu A
-kompleks z metionylo-tRNA umieszczony w obszarze P
rybosomy, jest gotowy do wydłużenia łańcucha peptydowego
1) związanie tRNA pasującego do kodonu znajdującego się w
obszarze A rybosomy i niosącego aminokwas następny w
łańcuchu peptydowym
2) wytworzenie wiązania peptydowego z uwolnieniem tRNA z
obszaru P i przeniesieniem rosnącego peptydu na tRNA w
obszarze A
3) translokacja peptydylo-tRNA z obszaru A do P, usunięcie
uwolnionego tRNA z rybosomu i przeniesienie mRNA o jeden
kodon do przodu w celu umieszczenia następnego kodonu w
obszarze
Etap elongacji w kom. prokariotycznych -po zakończeniu
inicjacji transkrypcji podjednostka sigma opuszcza centrum
aktywne, odłącza się od holoenzym -etap elongacji syntezy
RNA rozpoczynający się po utworzeniu pierwszego wiązania
fosfodiestrowego jest katalizowany przez rdzeń polimerazy
RNA -w powstającym transkrypcje pierwszym nukleotydem
jest zawsze pppG lub pppA -polimeraza RNA dokonuje
syntezy łańcuchów RNA w kierunku 5’-3’, wykorzystując jako
substraty 5’-trifosforany czterech rybonukleozydów (ATP, CTP,
GTP, UTP) -grupa 3’OH znajdująca się na końcu rosnącego
łańcucha RNA atakuje fosforan alfa nowo wchodzącego 5’-
trifosforanu rybonukleozydu -> co prowadzi do powstania
wiązania 3’,5’-fosfodiestrowego i uwolnienia pirofosforanu -
kompleks utworzony przez polimeraze RNA, matrycę DNA
oraz rosnący transkrypt jest określany jako bąbel
transkrypcyjny => to rejon DNA, w którym dwuniciowa helisa
DNA ulega otwarciu, umożliwiając zajście transkrypcji -
dwuniciowy DNA ulega rozplataniu przed bąblem
transkrypcyjnym i ponownemu splataniu po przeciwnej jego
stroni
Glikogen i celuloza
GLIKOGEN
Budowa:-zbudowana z jednostek glukozowych połączonych
wiązaniem
α-1,4-glikozydowym, w ten sposób tworzy się
długi łańcuch
-co 10 jednostek następuje rozgałęzienie łańcucha (wiązanie
α-1,6-glikozydowe) -zakończeniem każdego łańcucha jest
koniec nieredukujący z wolną grupą 4’OH
Enzymy: -wiązania α-1,4-glikozydowe rozkłada fosforylaza
glikogenowa, α-1,6-glikozydowe rozkładają enzymy
usuwające rozgałęzienia
-każdy wyprostowany odcinek łańcucha glikogenu tworzy
konformacje otwartej helisy, która zwiększa jego dostępność
dla enzymu
CELULOZA
Budowa:
-nierozgałęziony łańcuch -zbudowany z jednostek glukozy
połączony wiązaniem β-1,4-glikozydowym -wiązania β
między resztami glukozy tworzą długie, proste łańcuchy
ułożone równolegle we włókna
Enzymy: -ssaki, włącznie z człowiekiem, nie mają enzymów
rozkładających celulozę -przeżuwacze nie mają takiego
problemu, posiadają enzym – celulazę -> wytwarzają go
bakterie żyjące w ich przewodzie pokarmowym
Wspólne elementy strukturalne dla wszystkich tRNA
Każdy z tRNA ma strukturę drugorzędową przypominającą
liść koniczyny
Struktury typu spinka do włosów nazywane są ramionami
tRNA: -ramię antykodonowi – zawiera w swojej pętli 3
nukleotydy tworzące antykodon, parujące się w trakcie
translacji z komplementarnym kodonem w MRNA
-ramię D (lub DHU) – zawiera dihydrouracyl (zmodyfikowany
nukleozyd pirymidynowy) -ramię T (
TΨC
) – zawiera jeszcze
inny zmodyfikowany nukleozyd (pseudourycynę) leżącą w
sekwencji
TΨC, za względu na zawartość specyficznej
sekwencji nukleozydofosforanów, służy ona jako punkt
zaczepu dla enzymu aktywującego aminokwasy
-niektóre
tRNA mają również dodatkowe ramię (zmienne), którego
długość waha się od 3 do 21 nukleotydów -cząsteczki tRNA
mają też ramię aminokwasowi (to właśnie do tego ramienia,
do gr. 3’OH adenozyny występującej w sekwencji CCA,
przyłączany jest aminokwas w aminoacylo-tRNA.
Przeniesienie zaktywowanych aminokwasów na mRNA
znajdujące się na rybosomie (w celu wytworzenia aktywnej
formy aminokwasu, czyli aminoacylo-tRNA, następuje
działanie specyficznego enzymu – syntezy – aminoacylo-tRNA
z wybranym aminokwasem i ATP).
tRNA - budowa i funkcje
Budowa: -typowa cząstka zawiera 70-90 nukleotydów, będąc
przez to najmniejszą cząsteczką w komórce -występuje w
cytoplazmie podstawowej -masa cząsteczkowa 25kDa -
struktura pierwotna i wtórna dobrze poznana
-ma strukturę II rzędową => w formie liścia koniczyny, w
której to antykodon jest dostępny na końcu pętli
antykodonowej *antykodon to trójka nukleotydów, którymi
tRNA dopasowuje się do właściwego kodonu mRNA
Funkcje: -wiąże i transportuje zaktywowane aminokwasy z
cytoplazmy do miejsc syntezy białka -> rybosomów 8dla
poszczególnych aminokwasów istnieją różne tRNA różniące
się swym antykodonem -każda cząstka tRNA niesie tylko
jeden aminokwas -cząstka tRNA przyjmuje strukturę „liścia
koniczyny” zawierającą wewnątrzcząsteczkowe rejony
sparowane tworzące cztery ramiona tej struktury => 3
spośród tych ramion są strukturami typu spinki (trzon + pętla)
=> w pętli ramienia antykodonowego jest zawarta sekwencja
antykodonu => każda cząsteczka tRNA na końcu 5’ zawiera
grupę fosforanową, a na końcu 3’ znajduje się sekwencja CCA
z wolną grupą 3’-OH
Wyjaśnij pojęcia struktur białek: a-heliks, b-heliks, struktura
beta
=> należą do III-rzędowych struktur
Za względu na stopień zwinięcia łańcucha polipeptydowego
wyróżnia się:
-α helisę (prawoskrętną) – struktura regularna
-
β helisę (lewoskrętna) – struktura regularna
-strukturę β (pasmowa, pofałdowane kartki) α helisa: forma
śruby prawej
-stanowi cylindryczne, spiralne ułożenie aminokwasów w
łańcuchu polipeptydowym, utrzymywane dzięki wiązaniom
wodorowym -na 1 obrót α helisy przypada 3,6 aminokwasów
(0,54nm)
-odległość między dwoma aminokwasami wzdłuż α helisy =
0,15nm -wszystkie łańcuchy boczne aminokwasów znajdują
się na zewnątrz cylindrycznej helisy
Struktura β:
-wiązania wodorowe powstają między przylegającymi
częściami polipeptydu -płaskie wiązanie peptydowe sprawia,
że łańcuch polipeptydowy przyjmuje postać pofałdowanej
kartki z łańcuchami bocznymi znajdującymi się niżej lub wyżej
płaszczyzny -łańcuchy polipeptydowe sąsiadujące ze sobą w
strukturze β mogą być: a) równoległe b) antyrównoległe -
struktury β są zawsze lekko zakrzywione i w obecności kilku
łańcuchów polipeptydowych mogą się ścieśnić i tworzyć
beczułkę => kilka struktur β to podstawa wytrzymałości
Enzymy:
oKsydoredyktazy : 1.dehydrogenazy,reduktazy,
hydroksylazy,oksydazy,oksygenazy,peroksydazy, Utleniana gr.
w donorze: Ch-OH, CHO, CH-CH2,Ch=CH, akceptor: Nad+,
nadp+fad, cytochromy,O2,Katalizują reakcje
oksydoredukcyjne, a więc przemiany związane z
przeniesieniem elektronów, protonów i tlenu.
Transferazy –amino,fosfo(kinzy),acylo,glikozylo-transferazy.
Przenoszona grupa:C1,C=O,acyl,glikozyl,PO3H2,alkile,NH2,
akceptor:NH2, OH, -C=O
Hydrolazy: glikozydazy, paptydazy,amidazy, esterazy, :
hydrolizowane wiązania :
glikozydowe,peptydowe,amidowe,estrowe, typ estru:O-i N-
glikozydy, Peptydy, amidy, katalizują reakcje hydrolizy, czyli
rozkład wiazań z udziałem wody.nie wymagają
współdziałania wody.
Liazy : dekarboksylazy aminokwasów, deaminazy.
Rozczepiane wiązania : C-C, C-O, C-N, C-S.odwracalnie lub nie,
katalizują odłączenie grup od substratu bez udziału wody.
Izomerazy: Typ izomeryzacji: racemizacja, epimeryzacja,
izomeryzacja, cis trans, wewnątrzcząsteczkowe przemiany
oksydoredukcyjne i przeniesienia grup.
Ligazy: acetylo-s coa + co2 + atp >hooc-ch2-coScoa
Wyszukiwarka
Podobne podstrony:
biochemia kolo id 86264 Nieznany (2)
Cw 2 Biochemia OS id 121642 Nieznany
Biochemia Wyklad 2 id 86540 Nieznany (2)
# Skrypt Biochemia czesc4 id 30 Nieznany
BIOCHEMIA egzamin2 id 86591 Nieznany
Biochemia Cwiczenia 9 id 86311 Nieznany (2)
Biochemia Cwiczenia 3 id 86310 Nieznany (2)
biochemia kolo id 86264 Nieznany (2)
BIOCHEMIA 5 2 id 86299 Nieznany
biochemia3 id 86647 Nieznany (2)
Biochemia(1) id 86587 Nieznany
BIOCHEMIA skrypt 2010 id 86508 Nieznany
biochemia II 1 plus id 86425 Nieznany (2)
biochemia id 86123 Nieznany (2)
Analiza biochemiczna id 59863 Nieznany
biochemia pyt opis id 86492 Nieznany
biochemia4 id 86651 Nieznany
biochemia 6 id 86300 Nieznany (2)
więcej podobnych podstron