KOD ZDAJĄCEGO
MCH-W1D1P-021
EGZAMIN MATURALNY
Z CHEMII
Arkusz I
Czas pracy 90 minut
Instrukcja dla zdającego
1. Proszę sprawdzić, czy arkusz egzaminacyjny zawiera 9 stron.
Ewentualny brak należy zgłosić przewodniczącemu zespołu
nadzorującego egzamin.
2. Do arkusza dołączone są dwie karty stałych chemicznych.
Proszę je zatrzymać po zakończeniu pracy z arkuszem I.
Będą one służyć również do pracy z arkuszem II.
3. Proszę uważnie czytać wszystkie polecenia i informacje do
zadań.
4. Rozwiązania i odpowiedzi należy zapisać czytelnie w miejscu
na to przeznaczonym przy każdym zadaniu.
5. W rozwiązaniach zadań rachunkowych trzeba przedstawić tok
rozumowania prowadzący do ostatecznego wyniku oraz
pamiętać o jednostkach.
6. W trakcie obliczeń można korzystać z kalkulatora.
7. Proszę pisać tylko w kolorze niebieskim lub czarnym; nie pisać
ołówkiem.
8. Nie wolno używać korektora.
9. Błędne zapisy trzeba wyraźnie przekreślić.
10. Brudnopis nie będzie oceniany.
11. Obok każdego zadania podana jest maksymalna liczba
punktów, którą można uzyskać za jego poprawne rozwiązanie.
12. Do ostatniej kartki arkusza dołączona jest karta odpowiedzi,
którą wypełnia egzaminator.
Życzymy powodzenia !
ARKUSZ I
STYCZEŃ
ROK 2003
Za rozwiązanie
wszystkich zadań
można otrzymać
łącznie 40 punktów
(Wpisuje zdający przed rozpoczęciem pracy)
PESEL ZDAJĄCEGO
Miejsce
na naklejkę
z kodem
(Wpisuje zdający przed
rozpoczęciem pracy)

2
Egzamin maturalny z chemii
Arkusz I
Zadanie 1. (2 pkt)
Uzasadnij, dlaczego cynk tworzy tylko dwudodatnie kationy?
a) Napisz konfigurację atomu cynku.
.......................................................................................................................................................
b) Podaj krótkie uzasadnienie istnienia kationu Zn
2+
.
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 2. (1 pkt)
O dwóch izotopach pierwiastka
12
wiadomo, że:
2
14
6
1
6
A
A
i
Liczba protonów w
atomach A
1
i A
2
jest
Liczba neutronów w
atomach A
1
i A
2
jest
A.
różna taka
sama
B.
różna różna
C.
taka sama
taka sama
D.
taka sama
różna
Zadanie 3. (1 pkt)
W tlenku siarki(IV) między atomami tlenu a atomem siarki występują wiązania:
A. tylko kowalencyjne,
B. kowalencyjne i jonowe,
C. koordynacyjne,
D. kowalencyjne i koordynacyjne.
Egzamin maturalny z chemii
Arkusz I
3
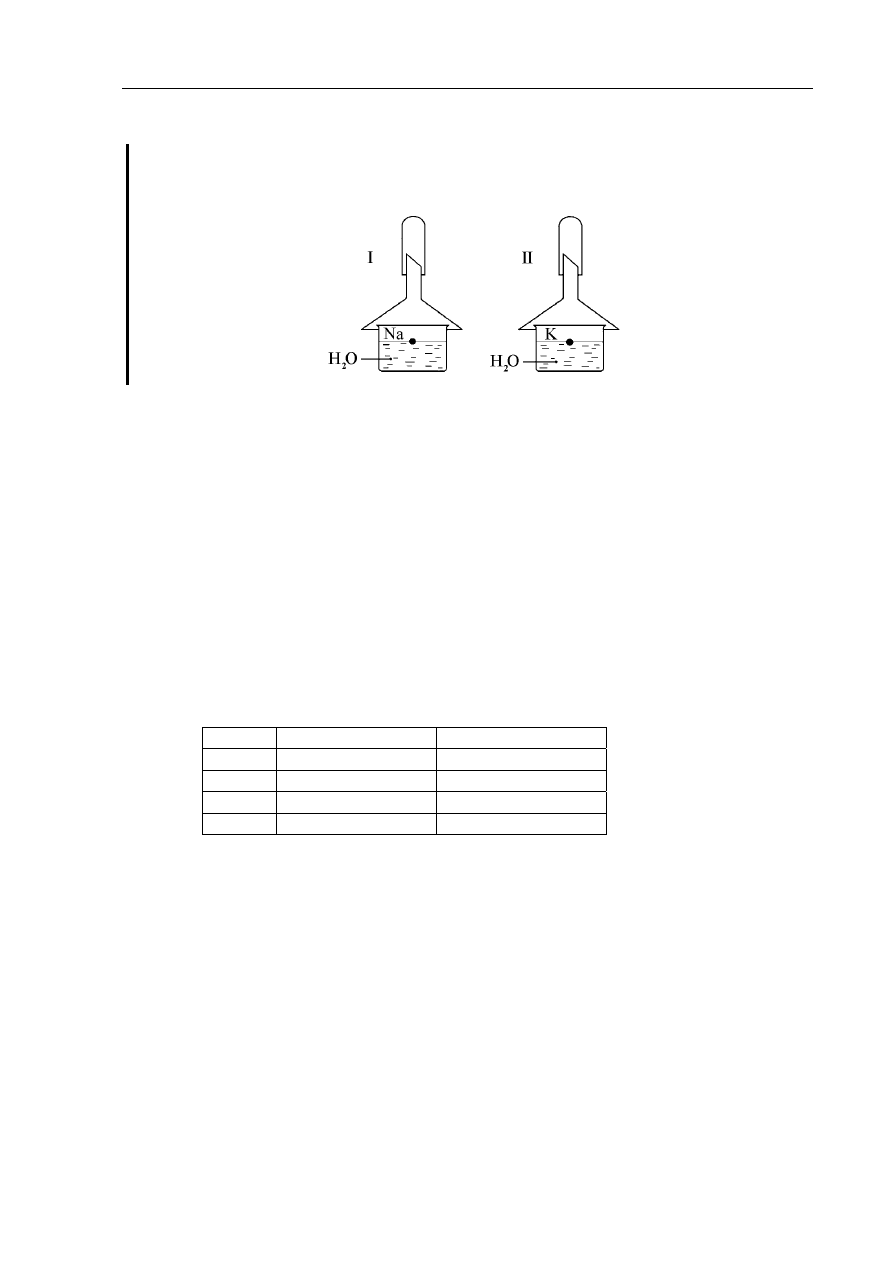
Informacje do zadań 4., 5.
Jednakowe ilości moli sodu i potasu wrzucono równocześnie do zlewek napełnionych
wodą. Schemat przeprowadzonego doświadczenia pokazuje rysunek:
Zadanie 4. (2 pkt)
W którym zestawie reakcja będzie przebiegała szybciej? Odpowiedź uzasadnij, porównując
budowę obu atomów.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 5. (1 pkt)
Roztwory w zlewkach podzielono na dwie części i dodano wskaźnika. Jakie zabarwienia
wystąpiły po dodaniu wskaźników:
Lakmus Fenoloftaleina
A. Niebieski Bezbarwny
B.
Różowy Bezbarwny
C.
Niebieski Malinowy
D.
Różowy Malinowy
Zadanie 6. (3 pkt)
7,5 g sodu wrzucono do zlewki zawierającej 50 g wody. Oblicz stężenie procentowe
otrzymanego roztworu wodorotlenku sodu.
4
Egzamin maturalny z chemii
Arkusz I
Zadanie 7. (3 pkt)
Zbadano odczyn wodnych roztworów następujących soli:
I
chlorku baru,
II
octanu amonu,
III siarczku
sodu.
Wnioski wynikające z obserwacji zebrano w tabeli.
Uzupełnij brakujące miejsca w poniższej tabeli:
wzór soli
odczyn
typ hydrolizy
(jeśli zachodzi)
BaCl
2
obojętny a
CH
3
COONH
4
obojętny b
Na
2
S c anionowy
a) ………………………………………….
b) ………………………………………….
c) ………………………………………….
Zadanie 8. (2 pkt)
Wybierz z układu okresowego dwa pierwiastki grup głównych, których jony (jednego z nich
kation a drugiego anion) mają taką konfigurację jak argon.
Zapisz skrócone konfiguracje wybranych jonów:
a) kationu: ………………………………………………………………………
b) anionu: ……………………………………………………………………….
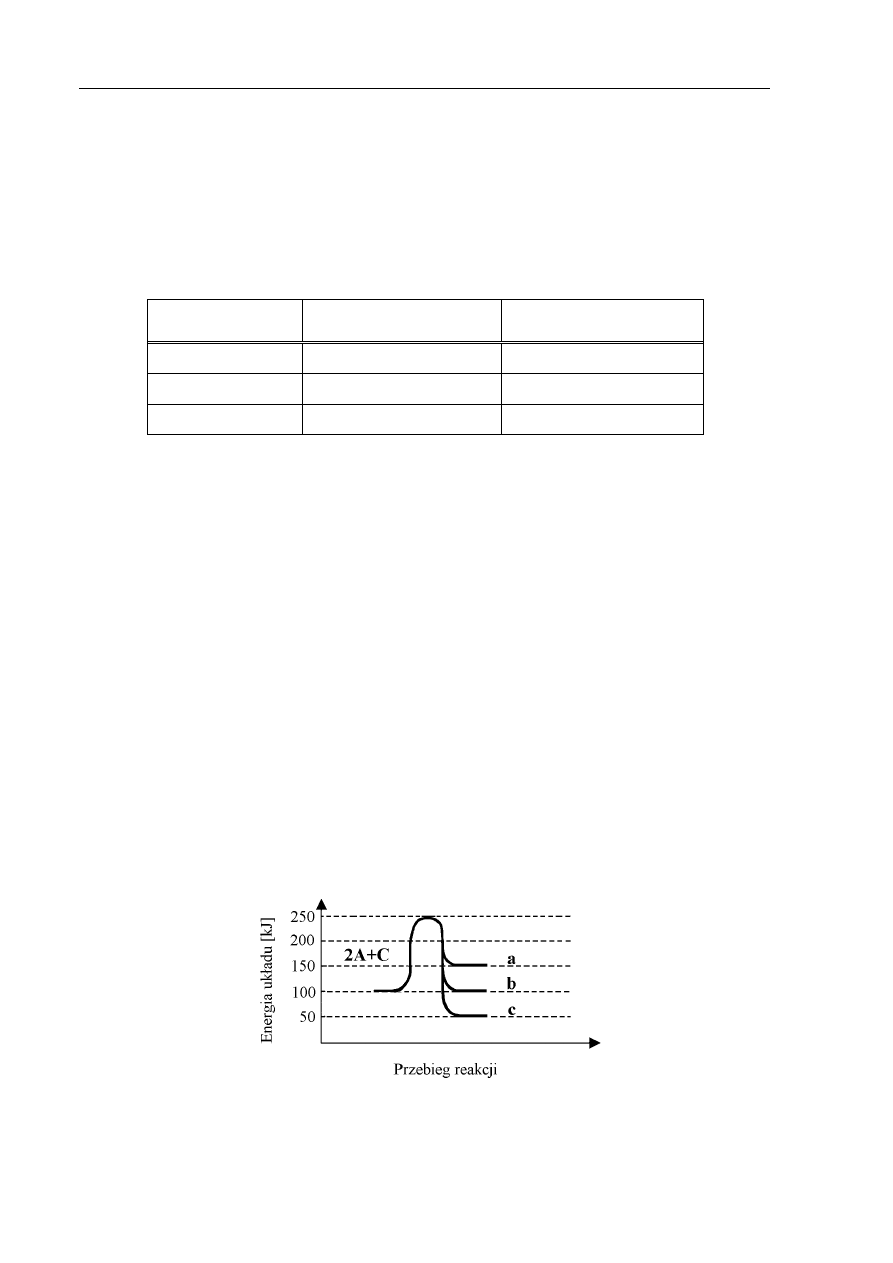
Zadanie 9. (2 pkt)
Przebieg reakcji 2A + C
→
A
2
C przedstawiono na wykresie:
Egzamin maturalny z chemii
Arkusz I
5
a) Jeżeli przedstawiona reakcja jest reakcją egzotermiczną, to jej prawidłowy przebieg jest
przedstawiony na wykresie za pomocą linii: ..............
b) Energia aktywacji wynosi:
.......................................................................................................................................................
Informacje do zadań 10., 11., 12.
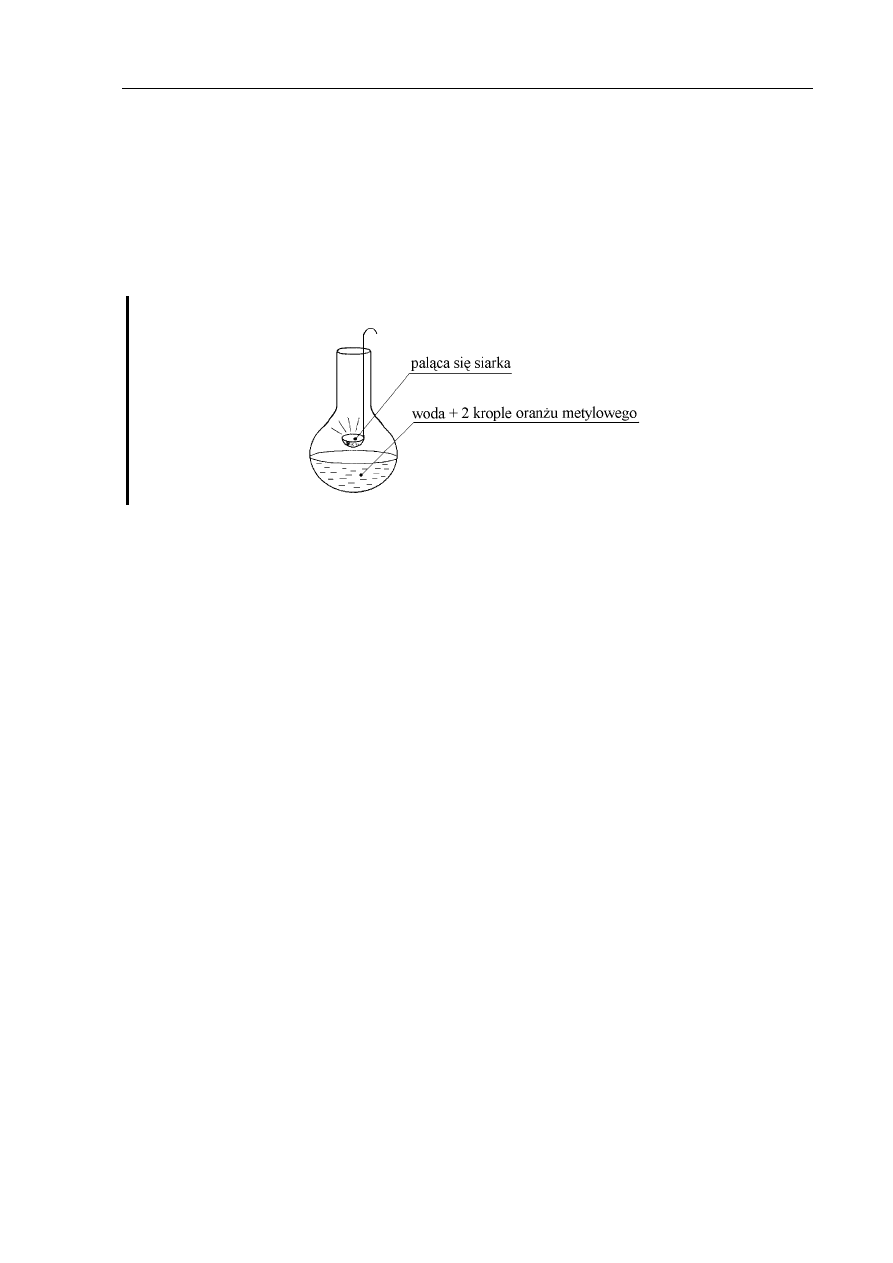
Przeprowadzono następujące doświadczenie:
Zadanie 10. (1 pkt)
Zapisz dwie różne obserwacje.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 11. (1 pkt)
Jak zabarwia się w tym doświadczeniu oranż metylowy?
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 12. (2 pkt)
Napisz równania zachodzących reakcji.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................

6
Egzamin maturalny z chemii
Arkusz I
Zadanie 13. (4 pkt)
Równowaga reakcji wyraża się równaniem:
2CO
(g)
+ O
2 (g)
2CO
2 (g)
∆ H= – 566 kJ
Jak przesunie się równowaga reakcji (w prawo czy w lewo), jeśli do układu wprowadzimy
następujące zmiany?
Zmiany w układzie: Przesunięcie równowagi:
a) podwyższenie temperatury
…………………………………..
b) usunięcie CO
2
…………………………………..
c) zwiększenie ciśnienia
…………………………………..
d) dodanie
O
2
…………………………………..
Zadanie 14. (3 pkt)
Jakie węglowodory powstają w wyniku reakcji metalicznego sodu z bromometanem oraz
mieszaniną bromometanu i bromoetanu? Napisz równania zachodzących reakcji.
.......................................................................................................................................................
.......................................................................................................................................................
.......................................................................................................................................................
Zadanie 15. (1 pkt)
Reakcja związku organicznego, np.: gliceryny, glukozy, z roztworem siarczanu(VI) miedzi(II)
i zasady sodowej, na zimno służy do wykrywania:
A. właściwości redukujących,
B. pierścienia aromatycznego,
C. grupy hydroksylowej,
D. więcej niż jednej grupy hydroksylowej.
Egzamin maturalny z chemii
Arkusz I
7
Zadanie 16. (2 pkt)
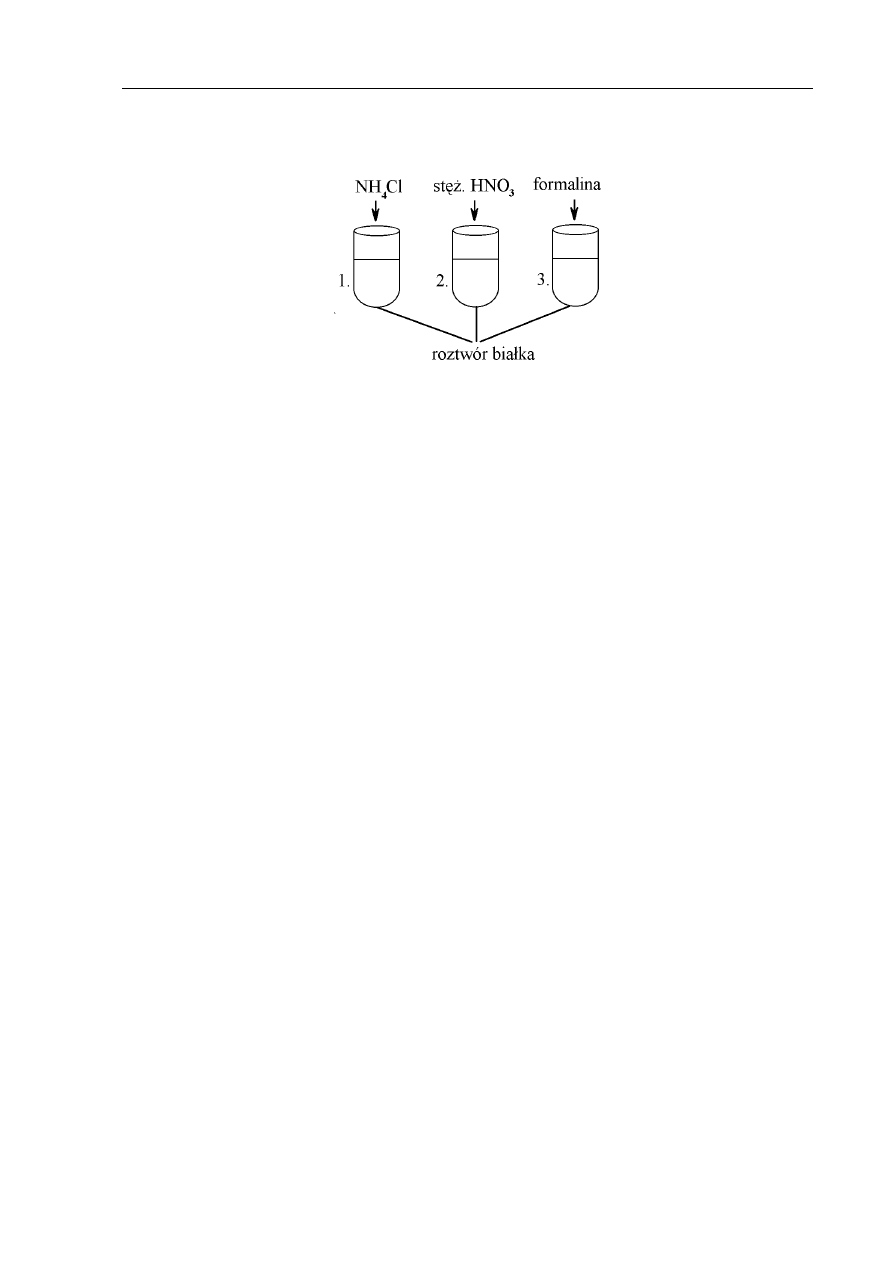
Przeprowadzono następujące doświadczenie:
a) Proces denaturacji białka następuje w probówce: ………..
b) Proces
zachodzący w probówce 1. nazywa się: ................................................................
Zadanie 17. (1 pkt)
Utlenianie 0,5 mola SO
2
do SO
3
wymaga użycia:
A. 0,1 mola tlenu,
B. 32 gramów tlenu,
C. 6,02 x 10
23
cząsteczek tlenu,
D. 5,6 dm
3
tlenu (w warunkach normalnych).
Zadanie 18. (4 pkt)
Pierwiastek posiadający skróconą konfigurację elektronową [Kr] 5s
2
4d
10
5p
5
a) ma właściwości:
……………………………………………………………………………..................................
b) występuje na stopniach utlenienia (podaj najniższy i najwyższy stopień utlenienia):
…………………………………………………………………………………………………...
c) w
związku tego pierwiastka z wodorem występuje wiązanie:
…………………………………………………………………………………………………...

8
Egzamin maturalny z chemii
Arkusz I
Zadanie 19. (1 pkt)
Przy powstawaniu wiązania w cząsteczce azotu udział biorą:
A. wszystkie elektrony walencyjne obu atomów,
B. po dwa elektrony od każdego atomu azotu,
C. pięć elektronów od jednego i jeden od drugiego atomu azotu,
D. po trzy elektrony od każdego atomu azotu.
Zadanie 20. (1 pkt)
Napisz wzór grupowy (półstrukturalny) dichloropochodnej o wzorze sumarycznym C
3
H
6
Cl
2
z atomami chloru przy drugorzędowym atomie węgla.
.......................................................................................................................................................
Zadanie 21. (2 pkt)
Wodorek sodu reaguje z wodą.
a) Napisz równanie reakcji chemicznej.
…………………………………………………………………………………………………...
b) Określ rodzaj wiązania w wodorku sodu.
…………………………………………………………………………………………………...
Egzamin maturalny z chemii – styczeń 2003 r.
ARKUSZ I
MODEL ODPOWIEDZI I SCHEMAT OCENIANIA
• Zdający otrzymuje punkty za całkowicie prawidłową odpowiedź.
• Gdy do jednego polecenia są dwie odpowiedzi (jedna prawidłowa, druga nieprawidłowa)
to zdający nie otrzymuje punktów.
• Jeżeli polecenie brzmi: Napisz równanie reakcji..., to w odpowiedzi zdający powinien
napisać równanie reakcji chemicznej, a nie jej schemat.
• Brak współczynników w równaniu reakcji chemicznej obniża punktację o 1 punkt, jeżeli
punktacja za równanie jest równa 2 pkt.
• Brak jednostek przy rozwiązaniu zadań rachunkowych obniża punktację o 1 punkt.
• Całkowicie poprawne rozwiązanie zadań rachunkowych, uwzględniające inny tok
rozumowania niż w podanym opisie, należy ocenić pełną liczbą punktów.
Punktacja
Nr
zadania
Przewidywana odpowiedź
za czynność sumarycznie
1. [Ar] 4s
2
3d
10
, lub [Ar] 3d
10
4s
2
,
lub 1s
2
2s
2
2p
6
3s
2
3p
6
4s
2
3d
10
lub K
2
L
8
M
18
N
2
a) posiada trwałą konfigurację elektronową lub inna
poprawna odpowiedź
1
1
2
2. D 1
1
3. D lub A
1
1
4. II
promień atomu potasu jest większy lub inna poprawna
odpowiedź
1
1
2
5. C 1
1
6. -obliczanie masy substancji (NaOH) = 13,04g,
-obliczanie masy roztworu = 57,17g,
- obliczanie c
p
= 22,81%.
1
1
1
3
7. a) hydroliza nie zachodzi,
b) kationowo - anionowa,
c) zasadowy
1
1
1
3
8. a) za wskazanie pierwiastków
b) za zapis konfiguracji jonów, np. [Ca
2+
]: [Ar]
i [Cl
–
]: [Ar]
1
1
2
9. a) c,
b) 150 kJ.
1
1
2
10. - np.: powstaje biały dym lubsiarka spala się
niebieskim płomieniem
- np.: zmiana zabarwienia roztworu
za dwie różne
obserwacje
1
(tylko jedna
obserwacja 0 p)
1
11. roztwór z oranżem metylowym zabarwia się na
czerwono (różowo).
1
1
12. S + O
2
→ SO
2
,
SO
2
+ H
2
O → H
2
SO
3,
lub H
2
SO
3
H
+
+ HSO
3
–
Lub SO
2
+ H
2
O H
+
+ HSO
4
2-
1
1
2
13. a) w lewo, lub ←,
b) w prawo, lub →,
c) w prawo, lub →,
d) w prawo, lub →
1
1
1
1
4
Strona 1 z 2

Egzamin maturalny z chemii – styczeń 2003 r.
14. CH
3
Br + CH
3
Br + 2 Na → CH
3
CH
3
+ 2 NaBr,
CH
3
Br + CH
3
CH
2
Br + 2 Na → C
3
H
8
+ 2 NaBr.
poprawny zapis współczynników w obu równaniach
1
1
1
3
15. D 1
1
16. a) 2 lub 3, lub 2 i 3
b) wysalanie, lub koagulacja
1
1
2
17. D 1
1
18. a) kwasotwórcze lub niemetaliczne,
b) –I, VII,
c) atomowe spolaryzowane lub kowalencyjne
spolaryzowane.
1
2
1
4
19. D 1
1
20.
CH
3
― CCl
2
― CH
3
1
1
21. a) NaH+ H
2
O→ NaOH + H
2
,
b) jonowe
1
1
2
Razem 40
Strona 2 z 2
Wyszukiwarka
Podobne podstrony:
chemia matura styczen 2003 arkusz 2 DOOLNKVR7PUVYFDVTTSM5B
fizyka matura styczen 2003 arkusz 1 YNEIP4Z27B573GY22RTYTQ
chemia-matura-styczeń 2001, arkusz 2
chemia matura styczen 2005 arkusz 1 Q3GMLEHQH36EPLCUOQ7DNK
Fizyka Matura Styczen 2003 Arkusz 2 (2)
fizyka matura styczen 2003 arkusz 1 YNEIP4Z27B573GY22RTYTQ
2003 probna matura styczen 2003 Chemia podstawowa arkusz1 id 60 (2)
2003 probna matura styczen 2003 Chemia rozszerzona arkusz2 id 6 (2)
2003 próbna matura styczeń 2003, Chemia podstawowa arkusz1-odpowiedzi
2003, próbna matura styczeń 2003 Chemia rozszerzona arkusz2 odpowiedzi
2003, próbna matura styczeń 2003 Chemia podstawowa arkusz1 odpowiedzi
Matematyka Matura Styczen 2003 poziom rozszerzony
Matematyka Matura Maj 2003 Arkusz 2
chemia matura maj 2005 arkusz 2 56UX3BDIJHTIJZIJ3U3GBS
Matematyka Matura Maj 2003 Arkusz 1
chemia matura maj 2005 arkusz 1 AHSWEJB3G5ZHA6H3ADSLFU
chemia matura maj 2002 arkusz 1 JNTVZRPRJT5DAR7ZHGMSF5
Matematyka Matura Styczen 2003 poziom podstawowy(1)
więcej podobnych podstron