
1
Materiały internetowe
• http://www.angelo.edu/faculty/kboudrea/index/Notes_C
hapter_08.pdf
• http://cwx.prenhall.com/petrucci/medialib/power_point/
Ch24.ppt
• http://web.mit.edu/2.813/www/Class%20Slides/Lecture
%207%20Mat.Prod.pdf
• http://www.google.pl/search?hl=pl&lr=&client=firefox-
a&channel=s&rls=org.mozilla:pl:official&q=uklad+okre
sowy+pierwiastkow%2BPower+Point&start=20&sa=N
•
http://www.its.caltech.edu/~chem1/Lecture%20Notes%
20pdfs/Series%204%20Periodic%20Trends.pdf
• http://zchoin.fct.put.poznan.pl
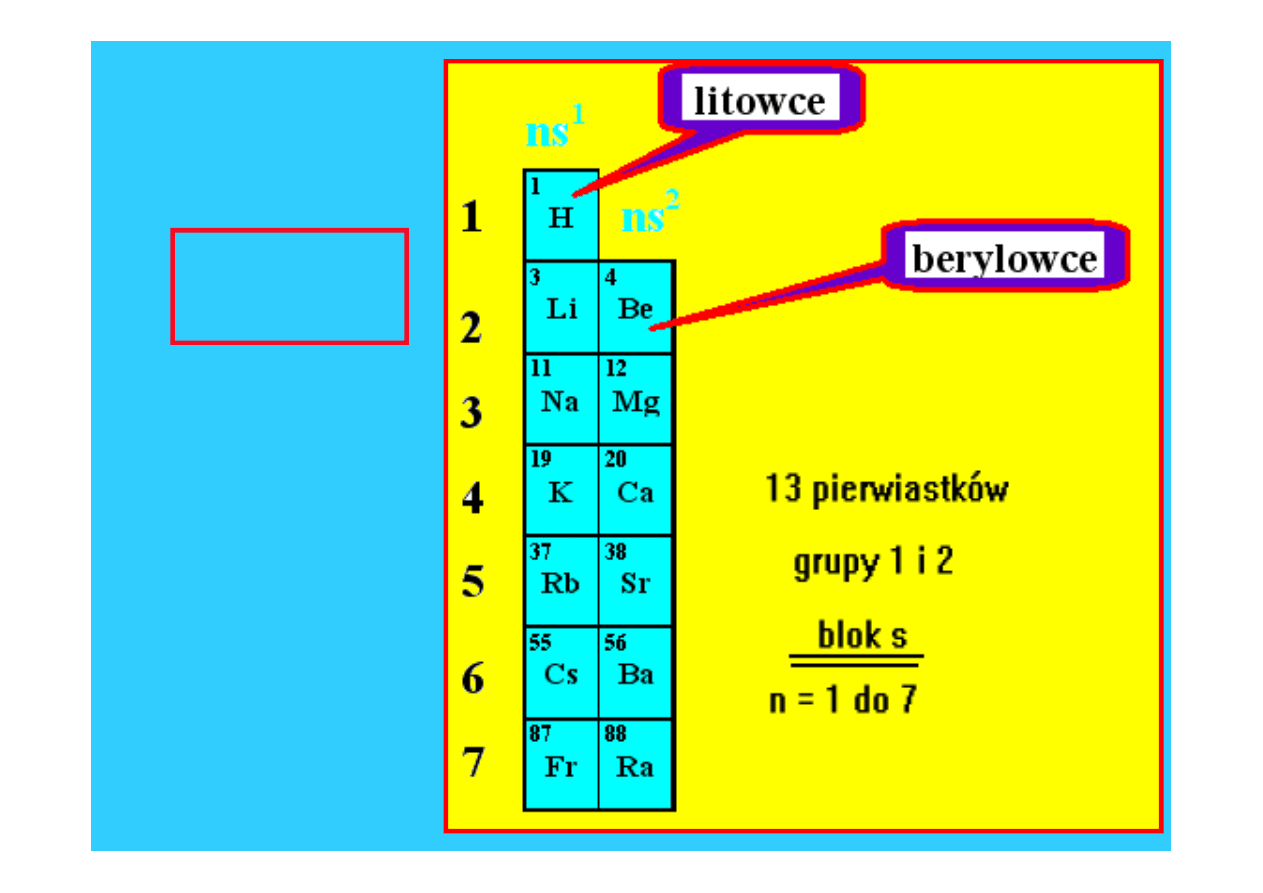
2
2 pierwsze
kolumny
układu
blok s
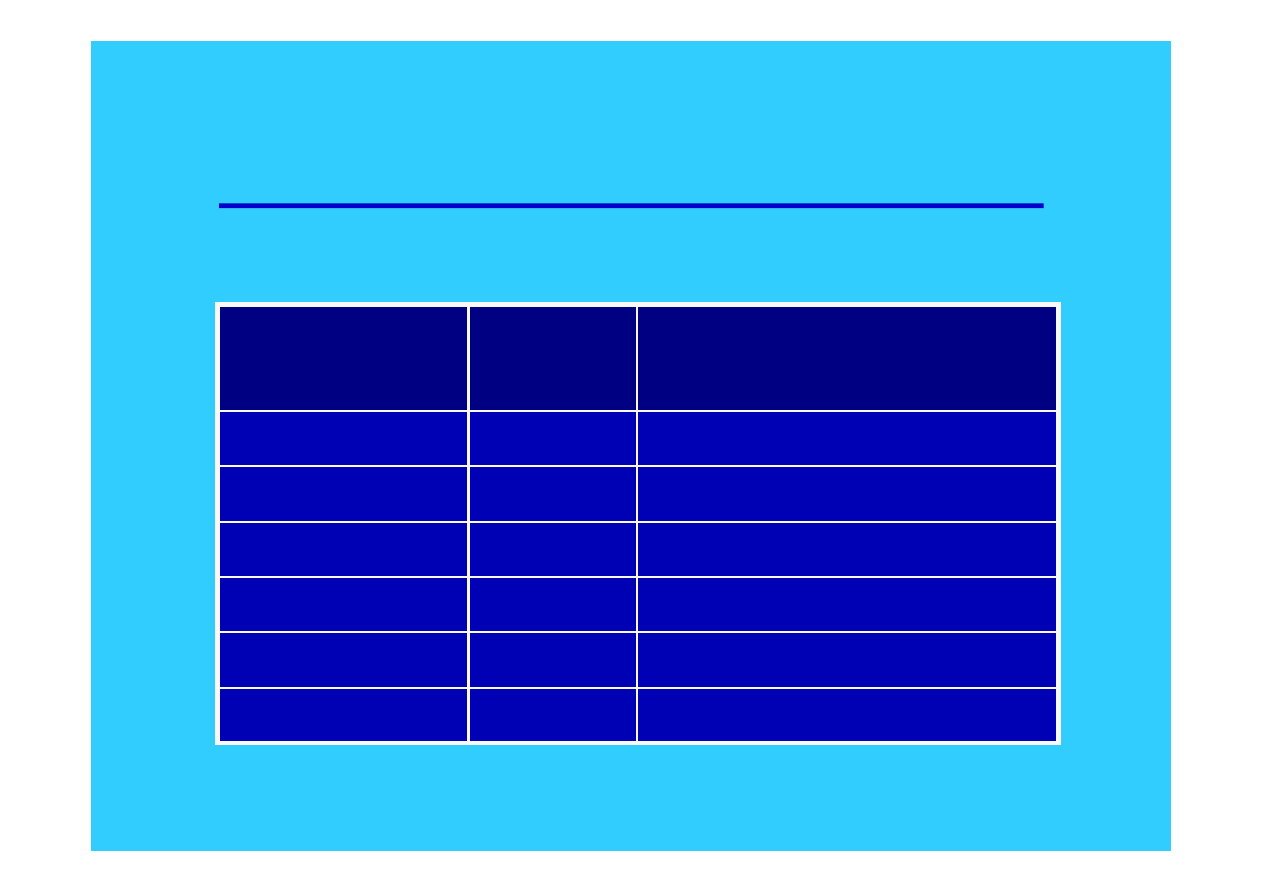
3
Struktura elektronowa litowców
Pierwiastek Symbol
Struktura
elektronowa
Lit
Li
[He] 2s
1
Sód
Na
[Ne] 3s
1
Potas
K
[Ar] 4s
1
Rubid
Rb
[Kr] 5s
1
Cez
Cs
[Xe] 6s
1
Frans
Fr
[Rn] 7s
1
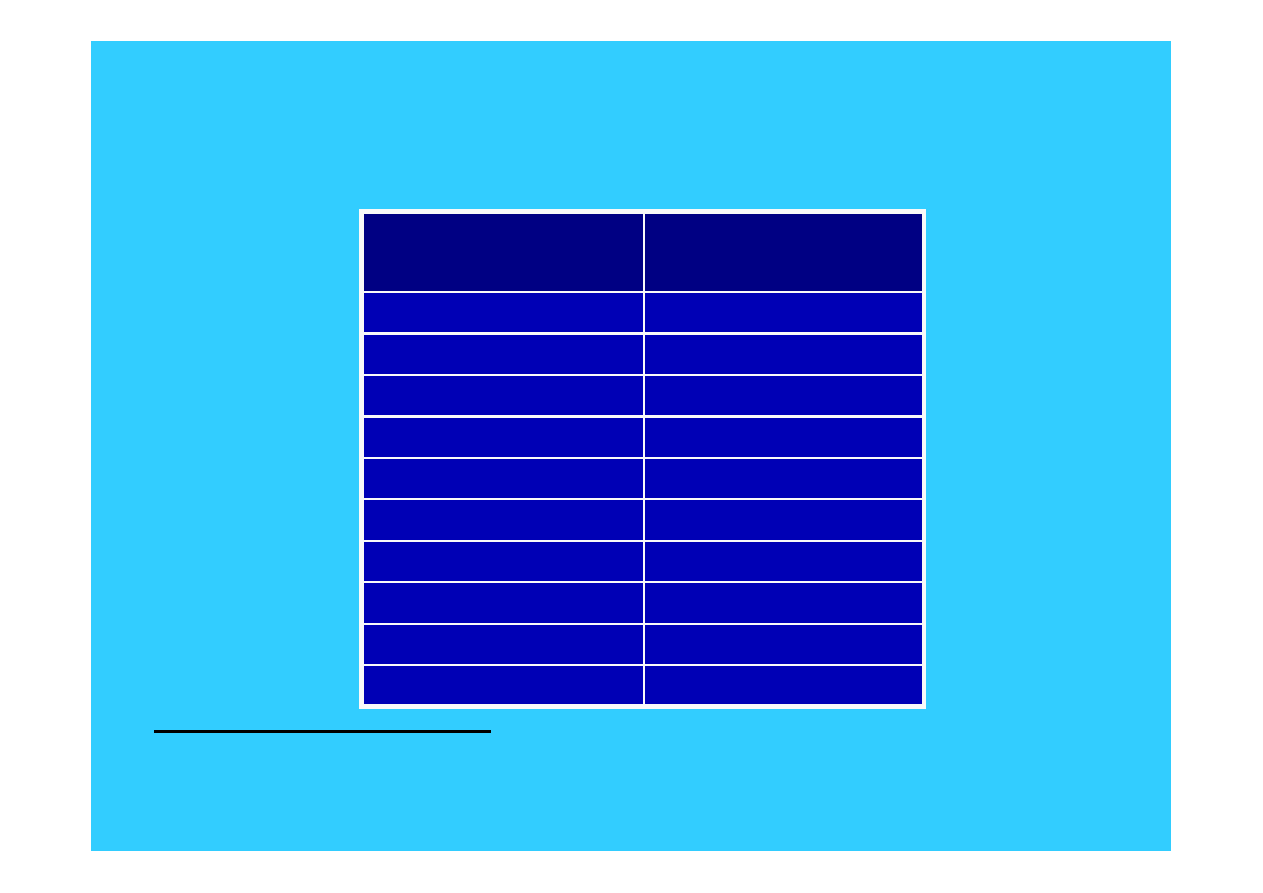
4
Rozpowszechnienie pierwiastków w
skorupie ziemskiej
Pierwiastek
Stężenie
(ppm)
Tlen
464000
Krzem
282000
Glin
83200
Żelazo
56300
Wapń
41500
Sód
23600
Magnez
23300
Potas
20900
Tytan
5700
Wodór
1400
Rozpowszechnienie:
Na
K
Rb
Li
Cs
2,6 %
2,4 %
3 10
-2
% 6 10
-3
%
3 10
-4
%

5
Minerały
Li
Występuje w skorupie ziemskiej razem z sodem i potasem,
występuje też w postaci minerału:
LiAl(Si
2
O
6
)
- spodumen
Na
NaCl
- sól kamienna (halit)
NaNO
3
- saletra chilijska
K
KCl
- sylwin
KCl MgCl
2
6H
2
O
- karnalit
KNO
3
- saletra indyjska
Rb, Cs
minerały tych pierwiastków towarzyszą minerałom sodu
i potasu
Fr
Wszystkie jego izotopy są promieniotwórcze
Najtrwalszy
87
223
Fr T
1/2
= 21 min.
K i Rb: posiadają naturalne długożyciowe izotopy promieniotwórcze:
K-40
T
1/2
= 1,3 10
9
lat
Rb- 87
T
1/2
= 6 10
10
lat

6
Woda morska jako źródło soli
litowców
Związki chemiczne
Zawartość
[%]
Chlorek sodu
2.7
Sole magnezu
0.13
Chlorek potasu
0.07
Sole wapnia
0.042
Sole bromu
0.001
Sole boru
0.00001
Ze względu na bardzo dobrą rozpuszczalność wielu prostych soli
sodu i potasu, związki tych pierwiastków dominują w wodzie morskiej.
Ze względu na bardzo dobrą rozpuszczalność wielu prostych soli
sodu i potasu, związki tych pierwiastków dominują w wodzie morskiej.

7
Standardowe potencjały elektrodowe
litowców
Pierwiastek
Potencjał
standardowy
E
o
[V]
Lit
-3.05
Sód
-2.71
Potas
-2.93
Rubid
-2.92
Cez
-2.92
Litowce to najbardziej reaktywne pierwiastki chemiczne
(najsilniejsze reduktory).
Lit ma najniższy potencjał standardowy, bo ma bardzo wysoką
energię hydratacji
Litowce to najbardziej reaktywne pierwiastki chemiczne
(najsilniejsze reduktory).
Lit ma najniższy potencjał standardowy, bo ma bardzo wysoką
energię hydratacji
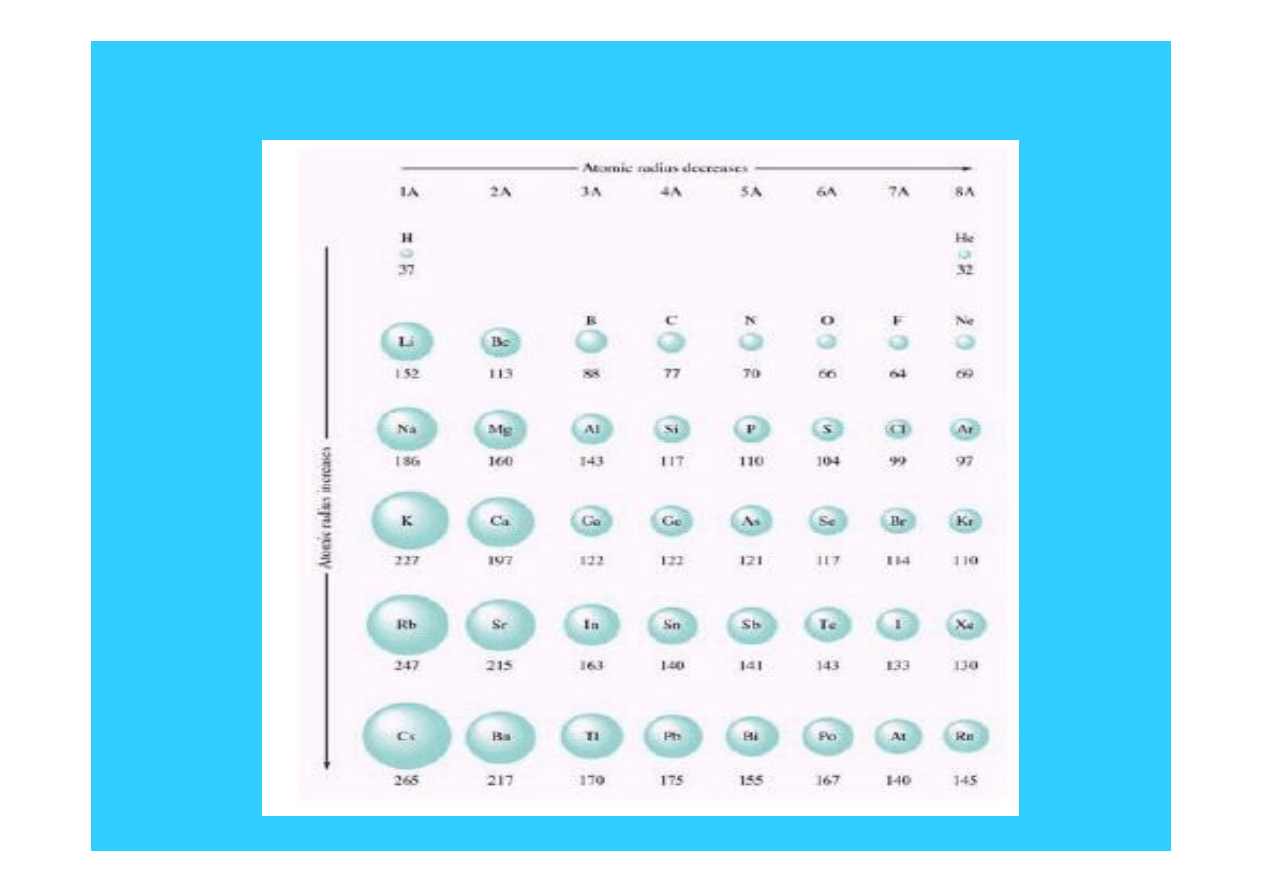
8
Zmiana promienia atomowego

9
Efektywny Ładunek Jądra
Z* dla elektronów walencyjnych wzrasta nieznacznie
wraz z przesuwaniem się w dół grupy
Jednakowa konfiguracja elektronów
walencyjnych
Jednakowa konfiguracja elektronów
walencyjnych

10
Promień atomowy
W grupie (przesuwając się ku dołowi)
1. n wzrasta
2. Z wzrasta
3. Brak wyraźnej zmiany Z* - praktycznie
pozostaje stała
Promień atomowy wyraźnie wzrasta przy
przesuwaniu się w dół grupy
W grupie (przesuwając się ku dołowi)
1. n wzrasta
2. Z wzrasta
3. Brak wyraźnej zmiany Z* - praktycznie
pozostaje stała
Promień atomowy wyraźnie wzrasta przy
przesuwaniu się w dół grupy
11
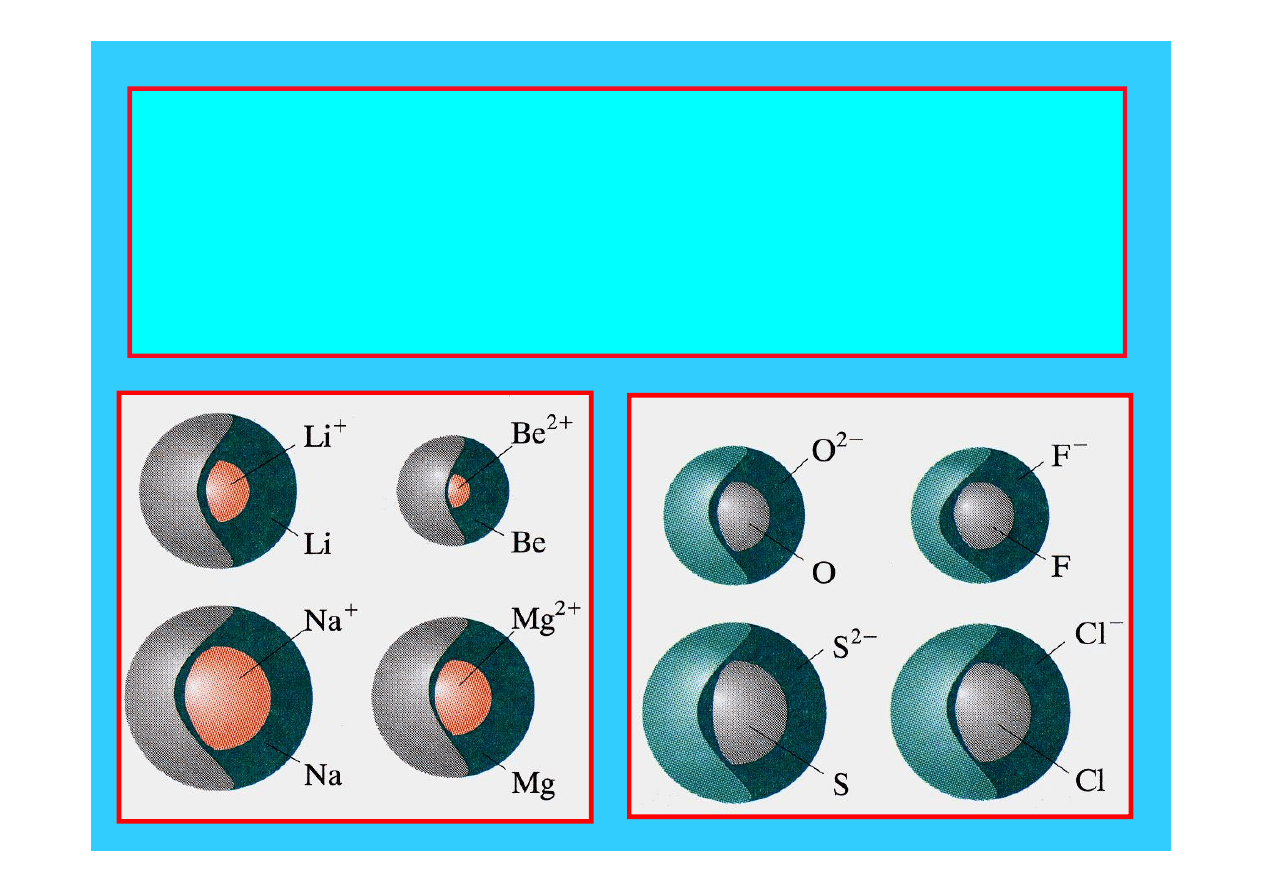
Rozmiary jonów
okresowym zmianom ulegają również jony pierwiastków:
objętość jonów ujemnych jest większa od objętości
atomów, dodatnich zaś znacznie mniejsza

12
Energia jonizacji (EI)
• Przesuwając się w dół grupy
• 1. ładunek jądra wzrasta
• 2. Z* pozostaje praktycznie stałe (efekt ekranowania)
• 3. Liczba powłok elektronowych wzrasta, wzrasta promień
atomowy.
• 4. Wzrasta ilość elektronów na wewnętrznych powłokach,
ekranujących elektrony walencyjne
• EI maleje w dół grup

13
Właściwości wynikające ze struktury
elektronowej
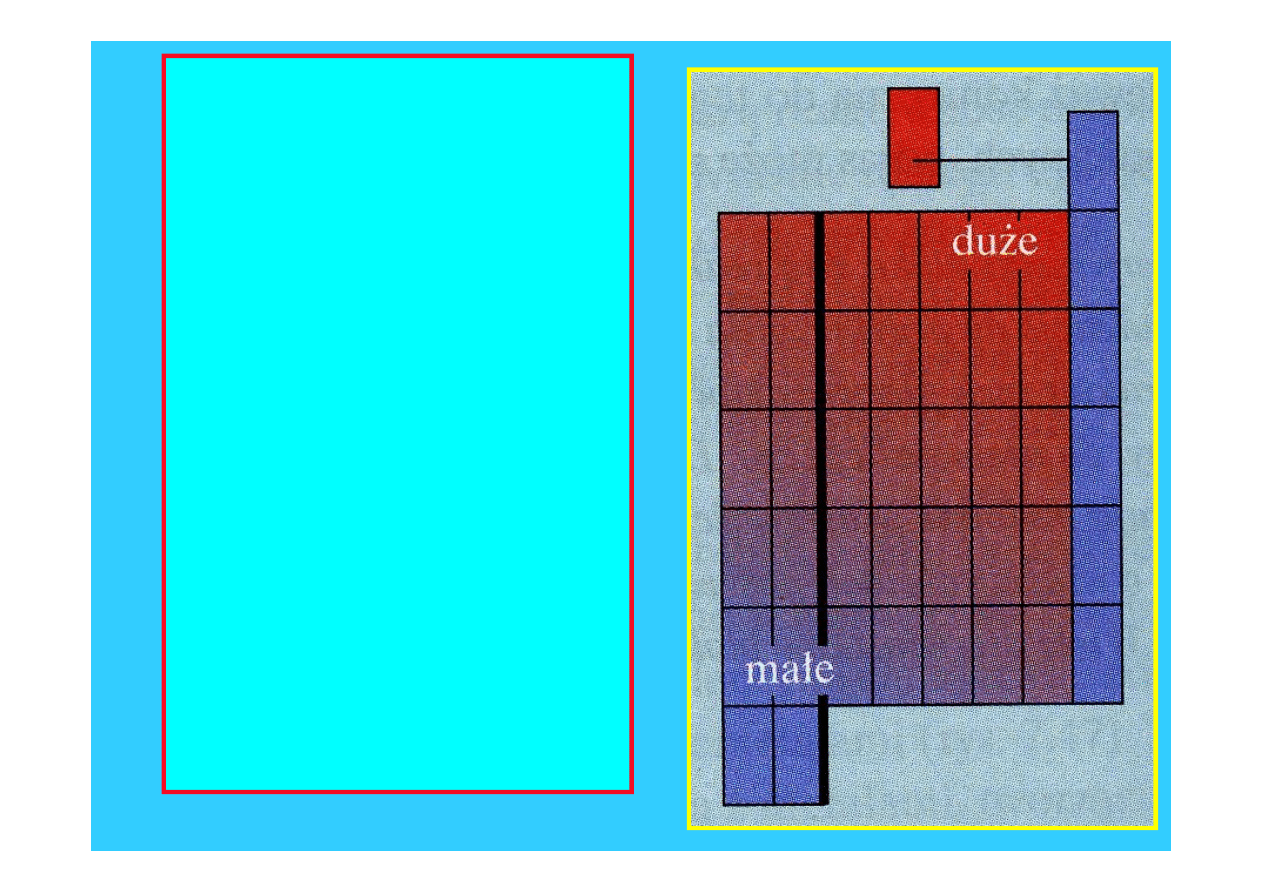
14
największe
wartości
powinowactwa
elektronowego
posiadają
pierwiastki
prawej górnej
części układu
okresowego
(chlorowce F, Cl
)

15
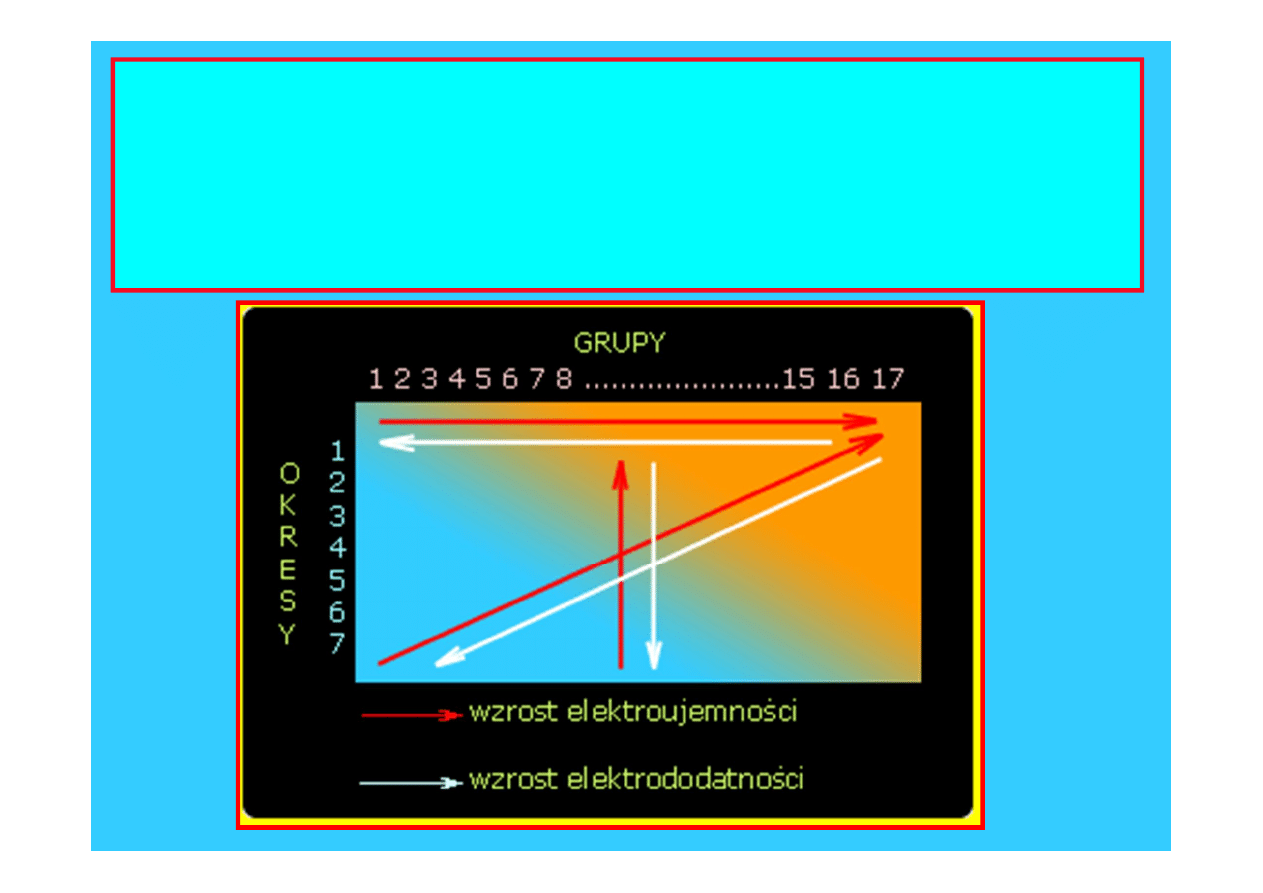
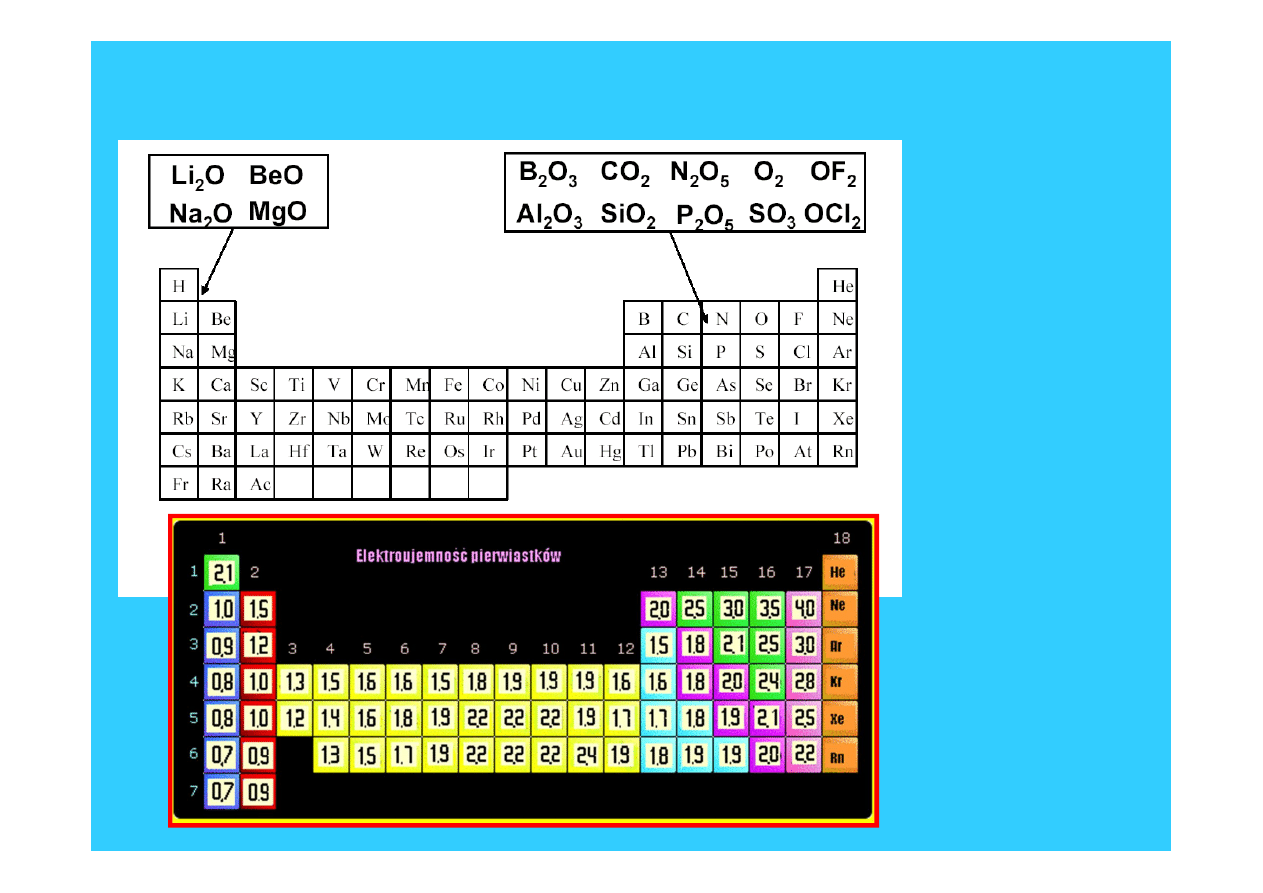
Elektroujemność
Miara tendencji pierwiastka do przyciągania elektronów
Przesuwając się w dół grupy
,
-
Z rośnie, ale Z* pozostaje praktycznie stałe
- liczba powłok elektronowych(n) wzrasta
- promień atomowy wzrasta
- siła przyciągania pomiędzy dodatkowym elektronem i
jądrem maleje
Elektroujemność maleje
16
w kolejnych
pierwiastkach
grupy charakter elektroujemny
pierwiastków maleje
w miarę wzrostu liczb atomowych wzrasta charakter
elektroujemny pierwiastków

17
Skala elektroujemności
Paulinga
Skala elektroujemności
Paulinga
18
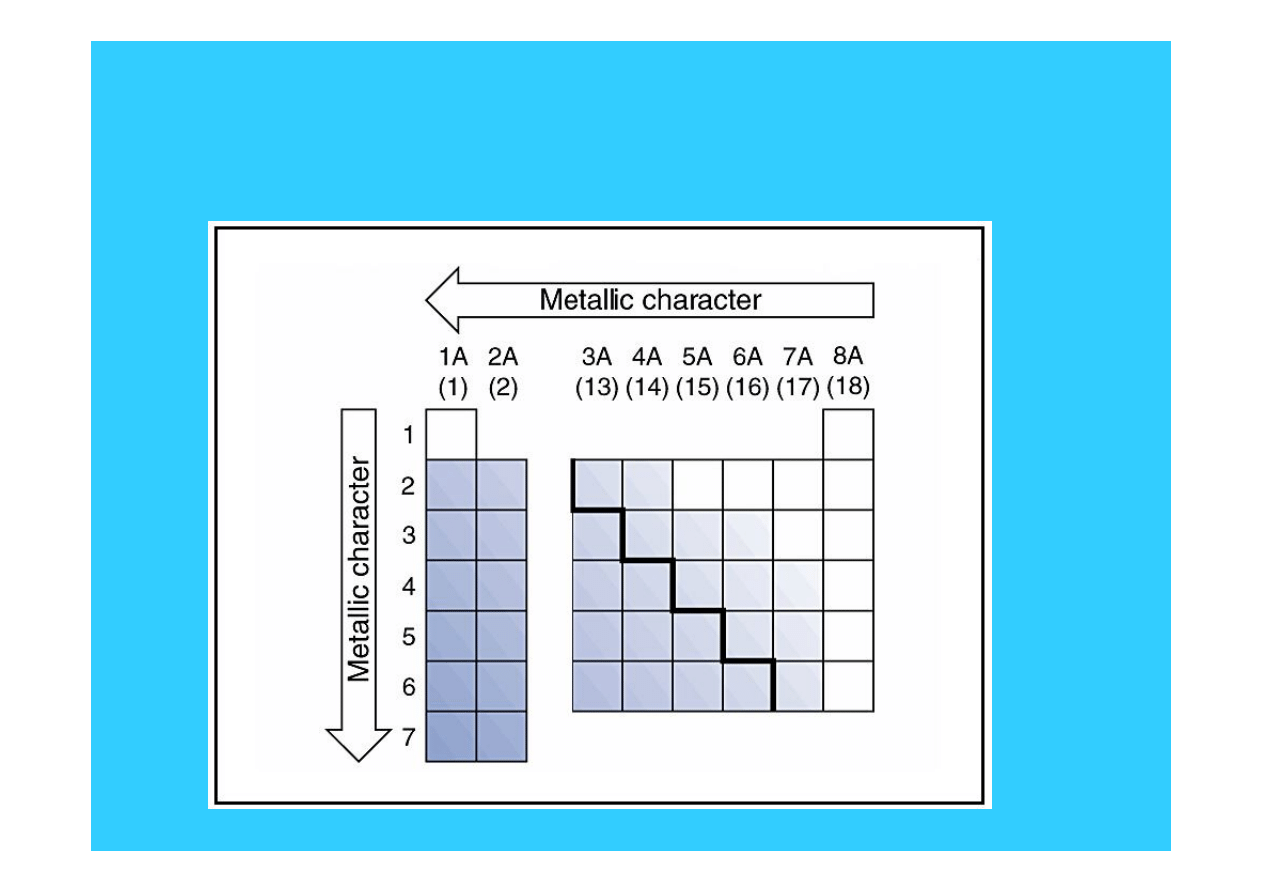
Zmiana charakteru
metalicznego grup głównych
19
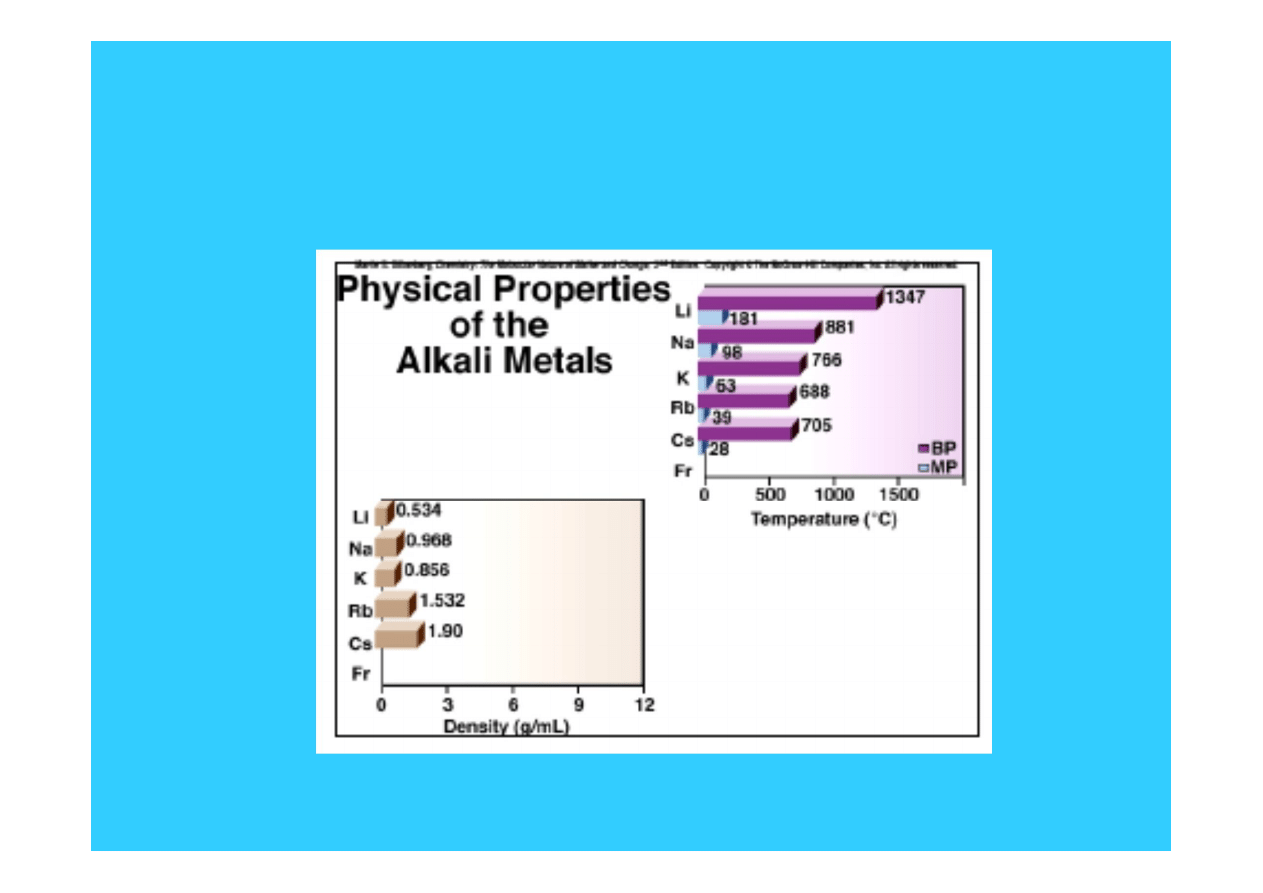
Właściwości fizyczne metali
alkalicznych

20
Otrzymywanie litowców
Litowce to najsilniejsze reduktory – nie można ich otrzymać przez redukcję
tlenków.
Otrzymywane są przez elektrolizę wodnych roztworów ich soli - katoda
elektrolizera musi być rtęciowa, aby mógł tworzyć się amalgamat (metal jest
zanieczyszczony).
Sód produkuje się metodą Castnera-Kellnera:
2Na
+
Cl
-
→ 2NaHg
n
(amalgamat) + Cl
2
Czyste litowce otrzymuje się przez elektrolizę stopionych halogenków
w obecności CaCl
2
jako topnika.
Otrzymywanie sodu:
▪ metoda Downsa (elektroliza stopionego NaCl)
▪ metoda Castnera (elektroliza stopionego NaOH)
Otrzymywanie potasu:
▪ elektroliza stopionego KCl
▪ przepuszczanie par sodu nad stopionym KCl
Na + KCl → NaCl + K
Otrzymywanie litowców
Litowce to najsilniejsze reduktory – nie można ich otrzymać przez redukcję
tlenków.
Otrzymywane są przez elektrolizę wodnych roztworów ich soli - katoda
elektrolizera musi być rtęciowa, aby mógł tworzyć się amalgamat (metal jest
zanieczyszczony).
Sód produkuje się metodą Castnera-Kellnera:
2Na
+
Cl
-
→ 2NaHg
n
(amalgamat) + Cl
2
Czyste litowce otrzymuje się przez elektrolizę stopionych halogenków
w obecności CaCl
2
jako topnika.
Otrzymywanie sodu:
▪ metoda Downsa (elektroliza stopionego NaCl)
▪ metoda Castnera (elektroliza stopionego NaOH)
Otrzymywanie potasu:
▪ elektroliza stopionego KCl
▪ przepuszczanie par sodu nad stopionym KCl
Na + KCl → NaCl + K
21
•
Zjonizowane dodatnio jony metalu tworzą gęsto
upakowana sieć krystaliczną,
• uwolnione elektrony walencyjne są zdelokalizowane,
tzn. poruszają się swobodnie w obrębie sieci krystalicznej.
+
+
+
+
+
+
+
+
+
Wiązanie metaliczne
-
-
-
-
-
-
-
-
-
Siły wiązania metalicznego
są wynikiem oddziaływania
dodatnich jonów metalu z
chmurą elektronów,
nazywaną często gazem
elektronowym.
Wysokie przewodnictwo
elektryczne i cieplne jest
wynikiem obecności
swobodnych elektronów.
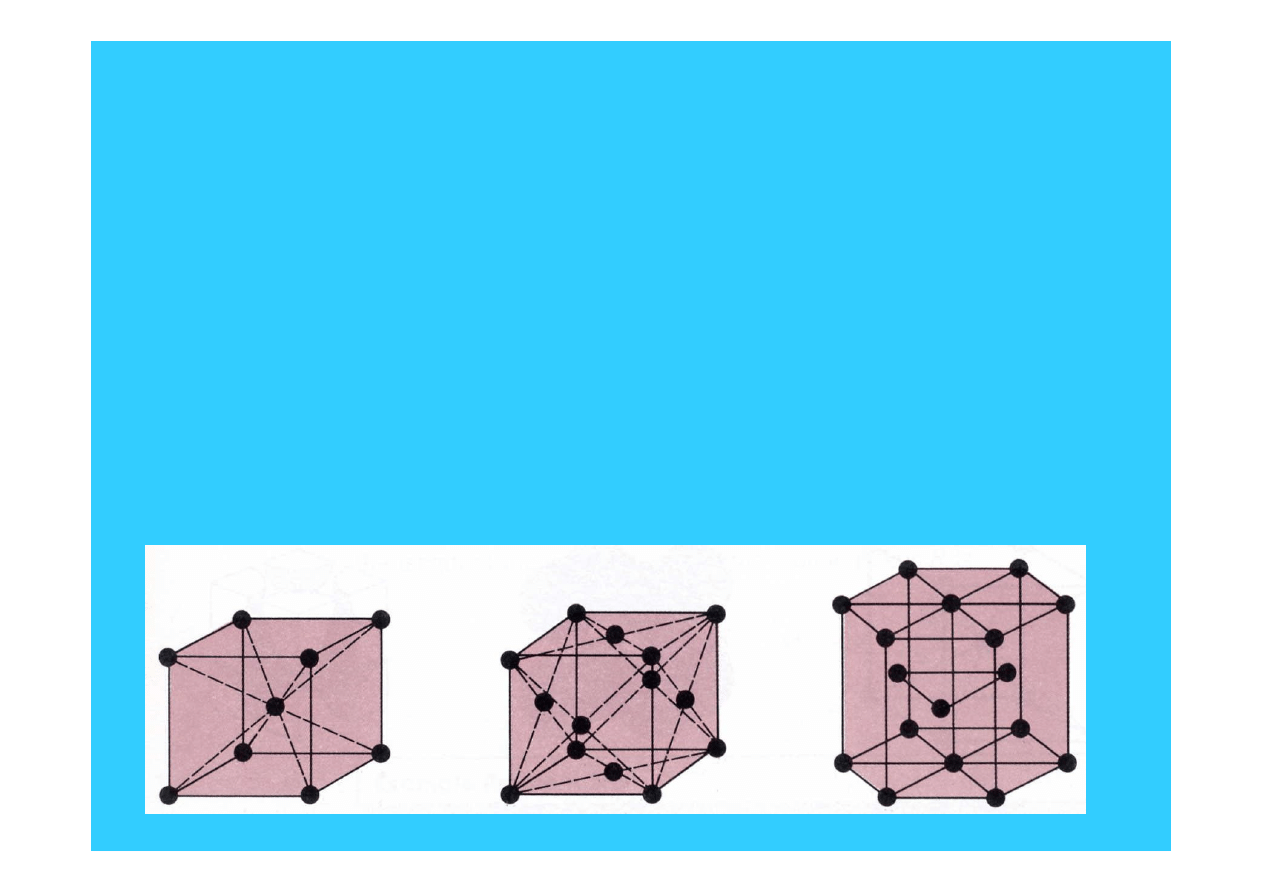
22
3
•
wykazują tendencje do gęstego upakowania
.
•
istnieje kilka przyczyn do tworzenia gęstego upakowania:
-
dla jednego pierwiastka takie same promienie atomowe.
- wiązanie metaliczne nie jest wiązaniem kierunkowym
-odległości pomiędzy atomami jak najmniejsze celem
obniżenia energii wiązania.
•
posiadają proste struktury krystaliczne.
Kryształy metaliczne
BCC
FCC
HCP
A
2
A
2
A
1
A
1
A
3
A
3
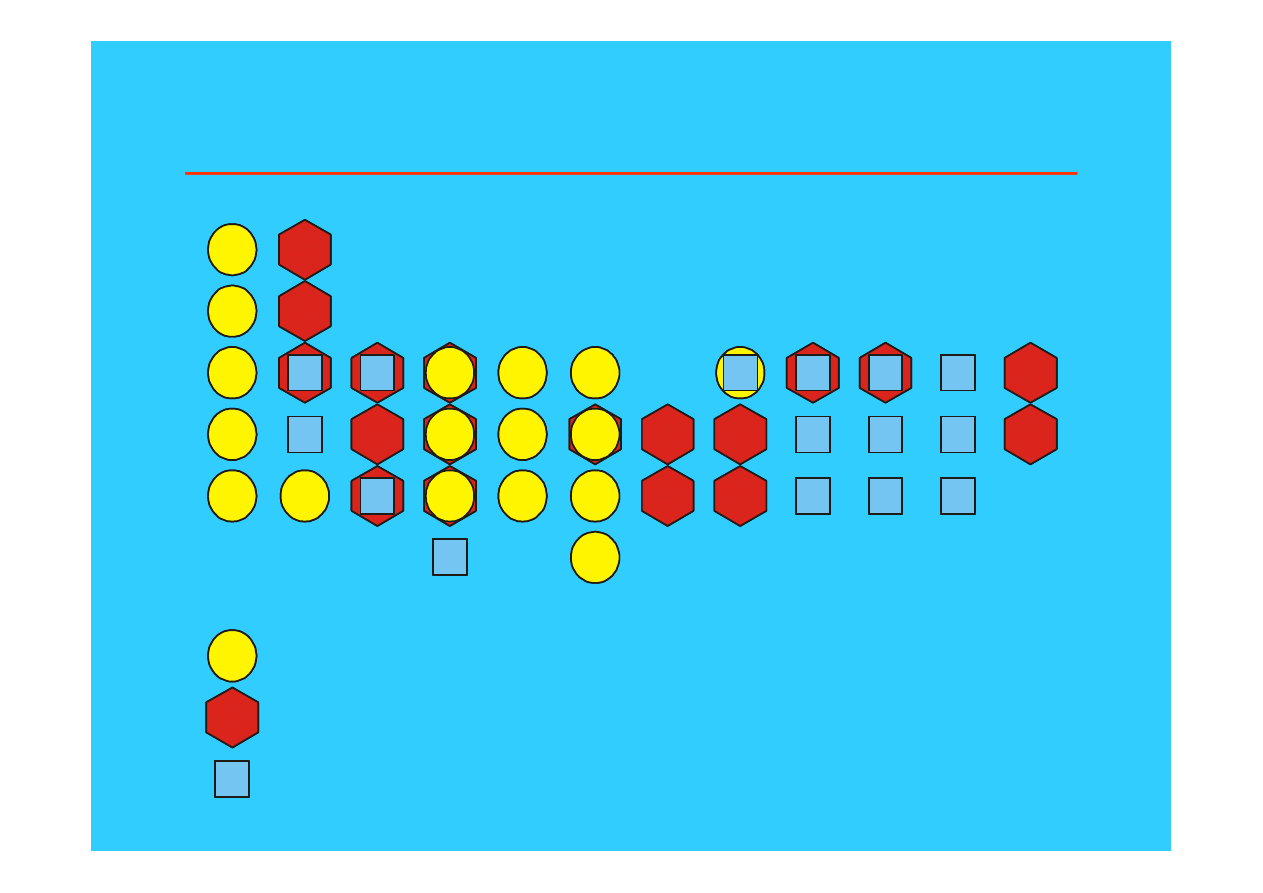
23
Zależność struktur metali od ich położenia w układzie okresowym
Zależność struktur metali od ich położenia w układzie okresowym
struktura regularna przestrzennie
centrowana
struktura regularna przestrzennie
centrowana
struktura heksagonalna zwarta
struktura heksagonalna zwarta
struktura regularna zwarta
struktura regularna zwarta
Mn
Hg
Fr
Ra
Ac
Pa
Li
Be
Na
Mg
K
Ca
Sc
Ti
V
Cr
Fe
Co
Ni
Cu
Zn
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Th
U
Mn
Hg
Fr
Ra
Ac
Pa
Li
Be
Na
Mg
K
Ca
Sc
Ti
V
Cr
Fe
Co
Ni
Cu
Zn
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Th
U

24
•
Liczba koordynacji = 8
•
Kierunek najgęstszego upakowania - przekątne sześcianu.
Struktura metalicznych litowców -
regularna centrowana przestrzennie
(BCC) -sieć A
2

25
Wodorki
W wodorkach stopień utlenienia wodoru wynosi +1 lub
-1. Stopień utlenienia w niektórych wodorkach metali
przejściowych nie jest dobrze zdefiniowany.
Trzy typy wodorków:
- wodorki jonowe (typu soli) - związki wodoru z
pierwiastkami elektrododatnimi (st. utlenienia wodoru
-1)
-wodorki kowalencyjne (związki wodoru z niemetalami)
- wodorki metaliczne (związki wodoru z metalami
przejściowymi)
W wodorkach stopień utlenienia wodoru wynosi +1 lub
-1. Stopień utlenienia w niektórych wodorkach metali
przejściowych nie jest dobrze zdefiniowany.
Trzy typy wodorków:
- wodorki jonowe (typu soli) - związki wodoru z
pierwiastkami elektrododatnimi (st. utlenienia wodoru
-1)
-wodorki kowalencyjne (związki wodoru z niemetalami)
- wodorki metaliczne (związki wodoru z metalami
przejściowymi)

26
Wodorki - X
m
H
n
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się wiązań
kowalencyjnych lub
wiązań metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają wartość
1.8-1.9. Poniżej tej
wartości powstają
wiązania metaliczne
.
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się wiązań
kowalencyjnych lub
wiązań metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają wartość
1.8-1.9. Poniżej tej
wartości powstają
wiązania metaliczne
.

27
Właściwości chemiczne litowców – reakcje metali z
wodorem
W reakcjach litowców z wodorem powstają wodorki MeH o budowie
jonowej (Me
+
H
-
):
2Me + H
2
→
2MeH (Me=Li, Na, K, Rb, Cs, Fr)
Wodorki litowców są silnymi reduktorami – reagują z wodą z
wydzieleniem wodoru:
MeH + H
2
O → MeOH + H
2
(Me=Li, Na, K, Rb, Cs, Fr)
Popularnymi reduktorami w chemii organicznej są wodorki
kompleksowe,
np. wodorek litowo-glinowy (Li[AlH
4
]) lub sodowo-borowy (Na[BH
4
]):
4LiH + AlCl
3
→
Li[AlH
4
] + 3LiCl
Właściwości chemiczne litowców – reakcje metali z
wodorem
W reakcjach litowców z wodorem powstają wodorki MeH o budowie
jonowej (Me
+
H
-
):
2Me + H
2
→
2MeH (Me=Li, Na, K, Rb, Cs, Fr)
Wodorki litowców są silnymi reduktorami – reagują z wodą z
wydzieleniem wodoru:
MeH + H
2
O → MeOH + H
2
(Me=Li, Na, K, Rb, Cs, Fr)
Popularnymi reduktorami w chemii organicznej są wodorki
kompleksowe,
np. wodorek litowo-glinowy (Li[AlH
4
]) lub sodowo-borowy (Na[BH
4
]):
4LiH + AlCl
3
→
Li[AlH
4
] + 3LiCl

28
Wodorki jonowe
Wodorki grupy 1A i 2A.
-stopione przewodzą prąd elektryczny
- w czasie elektrolizy litowiec (berylowiec)
wydziela się na katodzie a wodór na anodzie
- jon wodorowy H
-
ma własności zasadowe
(H
-
+ H
2
O = H
2
+ OH
-
wodorki sodu, litu, wapnia są silnymi zasadami. LiH
i CaH
2
są przenośnymi źródłami wodoru. LiH
reaguje z AlCl
3
dając LiAlCl
4
będący użytecznym
reduktorem w chemii organicznej.
Wodorki grupy 1A i 2A.
-stopione przewodzą prąd elektryczny
- w czasie elektrolizy litowiec (berylowiec)
wydziela się na katodzie a wodór na anodzie
- jon wodorowy H
-
ma własności zasadowe
(H
-
+ H
2
O = H
2
+ OH
-
wodorki sodu, litu, wapnia są silnymi zasadami. LiH
i CaH
2
są przenośnymi źródłami wodoru. LiH
reaguje z AlCl
3
dając LiAlCl
4
będący użytecznym
reduktorem w chemii organicznej.

29
Właściwości chemiczne litowców – utlenianie metali powietrzem
Na powietrzu (w warunkach normalnych) lit tworzy azotek a inne litowce – tlenki
:
6Li + N
2
→ 2Li
3
N
4Me + O
2
→ 2Me
2
O
(Me=Na, K, Rb, Cs, Fr)
Podczas spalania w powietrzu lit tworzy normalny tlenek, sód –
nadtlenek,
natomiast potas i dalsze litowce – ponadtlenek:
4Li + O
2
→ 2Li
2
O
2Na + O
2
→ Na
2
O
2
Me + O
2
→ MeO
2
(Me=K, Rb, Cs, Fr)
Właściwości chemiczne litowców – utlenianie metali powietrzem
Na powietrzu (w warunkach normalnych) lit tworzy azotek a inne litowce – tlenki
:
6Li + N
2
→ 2Li
3
N
4Me + O
2
→ 2Me
2
O
(Me=Na, K, Rb, Cs, Fr)
Podczas spalania w powietrzu lit tworzy normalny tlenek, sód –
nadtlenek,
natomiast potas i dalsze litowce – ponadtlenek:
4Li + O
2
→ 2Li
2
O
2Na + O
2
→ Na
2
O
2
Me + O
2
→ MeO
2
(Me=K, Rb, Cs, Fr)
30
Tlenki - X
m
O
n
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się wiązań
kowalencyjnych lub
wiązań metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają wartość
1.8-1.9. Poniżej tej
wartości powstają
wiązania metaliczne
.
Wg Paulinga
jednakowy udział
wiązania jonowego i
kowalencyjnego
pojawia się przy
różnicy
elektroujemności ok.
1.7
W miarę jak różnica
elektroujemności
maleje, wzrasta
tendencja do
tworzenia się wiązań
kowalencyjnych lub
wiązań metalicznych
Wiązania
kowalencyjne
powstają gdy
elektroujemności
pierwiastków
przekraczają wartość
1.8-1.9. Poniżej tej
wartości powstają
wiązania metaliczne
.
31
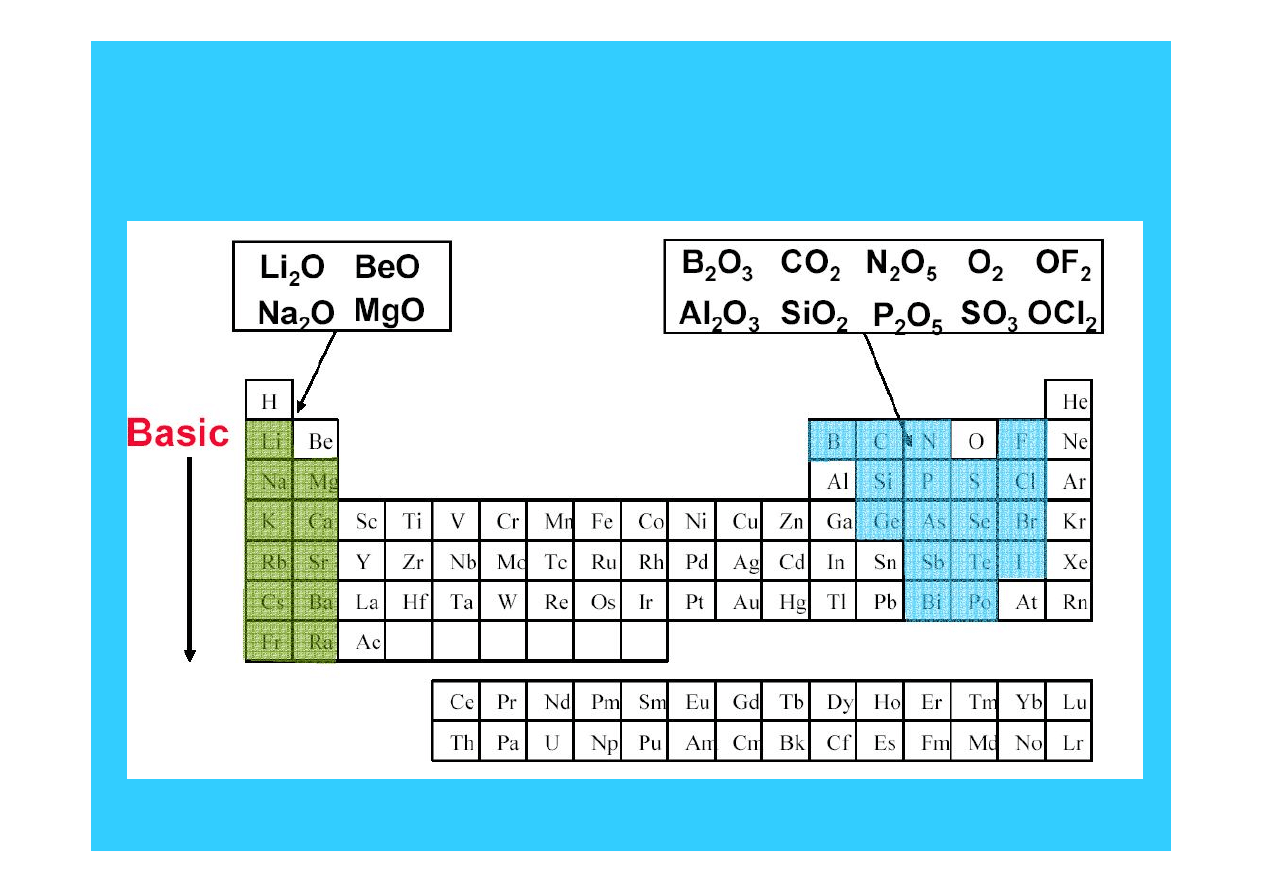
Kwasowo-zasadowe własności
tlenków
Kwasowość wzrasta w górę grupy i z lewa na prawo w okresie
Kwasowość wzrasta w górę grupy i z lewa na prawo w okresie

32
Właściwości chemiczne litowców – reakcje metali z
siarką
W reakcjach z siarką wszystkie litowce tworzą siarczki i wielosiarczki:
2Me + S → Me
2
S (Me=Li, Na, K, Rb, Cs, Fr)
2Me + 4S → Me
2
S
4
(Me=Li, Na, K, Rb, Cs, Fr)
(dokładniej – uwzględniając budowę siarki: 4Me + S
8
→ 2Me
2
S
4
)
Mogą powstawać wielosiarczki o wzorze:
Me
2
S
n
(n=2, 3, 4, 5 lub 6)
Właściwości chemiczne litowców – reakcje metali z
siarką
W reakcjach z siarką wszystkie litowce tworzą siarczki i wielosiarczki:
2Me + S → Me
2
S (Me=Li, Na, K, Rb, Cs, Fr)
2Me + 4S → Me
2
S
4
(Me=Li, Na, K, Rb, Cs, Fr)
(dokładniej – uwzględniając budowę siarki: 4Me + S
8
→ 2Me
2
S
4
)
Mogą powstawać wielosiarczki o wzorze:
Me
2
S
n
(n=2, 3, 4, 5 lub 6)

33
Związki litowców z węglem
Lit ogrzewany z węglem tworzy węglik litu:
2Li + 2C → Li
2
C
2
Inne litowce podobne związki tworzą podczas ogrzewania
z acetylenem:
2Na + C
2
H
2
→
Na
2
C
2
+ H
2
Podczas ich hydrolizy powstaje acetylen, dlatego
nazywane są acetylenkami (przez analogię do nazw soli
typowych kwasów beztlenowych):
Na
2
C
2
+ 2H
2
O → 2NaOH + C
2
H
2
Potas, rubid i cez tworzą niestechiometryczne, barwne
węgliki międzywęzłowe z grafitem (
C
60
Me
,
C
36
Me
,
C
8
Me
,
gdzie Me=K, Rb, CS).
Związki litowców z węglem
Lit ogrzewany z węglem tworzy węglik litu:
2Li + 2C → Li
2
C
2
Inne litowce podobne związki tworzą podczas ogrzewania
z acetylenem:
2Na + C
2
H
2
→
Na
2
C
2
+ H
2
Podczas ich hydrolizy powstaje acetylen, dlatego
nazywane są acetylenkami (przez analogię do nazw soli
typowych kwasów beztlenowych):
Na
2
C
2
+ 2H
2
O → 2NaOH + C
2
H
2
Potas, rubid i cez tworzą niestechiometryczne, barwne
węgliki międzywęzłowe z grafitem (
C
60
Me
,
C
36
Me
,
C
8
Me
,
gdzie Me=K, Rb, CS).

34
Związki organiczne litowców
Litowce tworzą sole z kwasami karboksylowymi:
CH
3
COOH + MeOH → CH
3
COOMe + H
2
O
(Me=Li, Na, K, Rb, Cs, Fr)
RCOOH + MeOH → RCOOMe + H
2
O
(
mydła
, gdy Me=Na, K oraz
R=C
10
÷C
22
)
Litowce mogą tworzyć wiele związków alkilowych i arylowych. Organiczne
związki litu są kowalencyjne (m.in. rozpuszczają się w eterze):
RCl + 2Li → LiR + LiCl
Alkilowe związki Na, K, Rb i Cs mają budowę jonową (Me
+
R
-
) - można je
otrzymywać ze związków alkilortęciowych:
2Me + HgR
2
→ Hg + 2 MeR
(Me=Na, K, Rb, Cs, Fr)
Związki organiczne litowców
Litowce tworzą sole z kwasami karboksylowymi:
CH
3
COOH + MeOH → CH
3
COOMe + H
2
O
(Me=Li, Na, K, Rb, Cs, Fr)
RCOOH + MeOH → RCOOMe + H
2
O
(
mydła
, gdy Me=Na, K oraz
R=C
10
÷C
22
)
Litowce mogą tworzyć wiele związków alkilowych i arylowych. Organiczne
związki litu są kowalencyjne (m.in. rozpuszczają się w eterze):
RCl + 2Li → LiR + LiCl
Alkilowe związki Na, K, Rb i Cs mają budowę jonową (Me
+
R
-
) - można je
otrzymywać ze związków alkilortęciowych:
2Me + HgR
2
→ Hg + 2 MeR
(Me=Na, K, Rb, Cs, Fr)
35
Li
CH
3
CH
3
CH
3
CH
3
H
O
O
CH
CH
O
C
O C
C
C
Li
CH
3
CH
3
CH
3
CH
3
H
O
O
CH
CH
O
C
O C
C
C
Kompleksy metali alkalicznych
Jony litowców są zbyt duże aby tworzyć trwałe kompleksy z typowymi
ligandami nieorganicznymi, mogą jednak tworzyć kompleksy chelatowe ze
związkami organicznymi (np. z aldehydem salicylowym i
acetyloacetonem).
W takich chelatach liczba koordynacyjna litowca wynosi zazwyczaj 4 lub
6:
Kompleksy metali alkalicznych
Jony litowców są zbyt duże aby tworzyć trwałe kompleksy z typowymi
ligandami nieorganicznymi, mogą jednak tworzyć kompleksy chelatowe ze
związkami organicznymi (np. z aldehydem salicylowym i
acetyloacetonem).
W takich chelatach liczba koordynacyjna litowca wynosi zazwyczaj 4 lub
6:
K
O
CHO
H
OHC
O
O
H
CHO
K
O
CHO
H
OHC
O
O
H
CHO
aldehyd salicylowy – K
+
aldehyd salicylowy – K
+
acetyloaceton – Li
+
acetyloaceton – Li
+

36
Odmienność właściwości litu i jego związków
Lit ma względnie wysokie temperatury topnienia i wrzenia, i podwyższoną
twardość.
Lit najmniej energicznie daje z tlenem normalny tlenek, a wyższe tlenki ma
nietrwałe.
Lit jest najmniej elektrododatni z litowców, dlatego Li
2
CO
3
, LiNO
3
i LiOH są mniej
trwałe, a LiHCO
3
nie istnieje w postaci stałej.
Lit tworzy azotek Li
3
N i jonowy węglik Li
2
C
2
w bezpośredniej reakcji z węglem
(podobieństwo do pierwiastków II grupy głównej).
Lit ma większą od innych litowców tendencję do tworzenia kompleksów (m.in.
tworzy akwakompleksy, a jodek aminalitu [Li(NH
3
)
4
]I istnieje w stanie stałym).
Li
2
CO
3
, Li
3
PO
4
i LiF są nierozpuszczalne w wodzie, a LiOH jest trudno rozpuszczalny
(podobieństwo do magnezu).
Kowalencyjne halogenki i związki alkilowe litu są rozpuszczalne w
rozpuszczalnikach organicznych (podobieństwo do magnezu).
Jony i związki litu są dużo lepiej hydratowane niż jony innych litowców i ich
związki.
Odmienność właściwości litu i jego związków
Lit ma względnie wysokie temperatury topnienia i wrzenia, i podwyższoną
twardość.
Lit najmniej energicznie daje z tlenem normalny tlenek, a wyższe tlenki ma
nietrwałe.
Lit jest najmniej elektrododatni z litowców, dlatego Li
2
CO
3
, LiNO
3
i LiOH są mniej
trwałe, a LiHCO
3
nie istnieje w postaci stałej.
Lit tworzy azotek Li
3
N i jonowy węglik Li
2
C
2
w bezpośredniej reakcji z węglem
(podobieństwo do pierwiastków II grupy głównej).
Lit ma większą od innych litowców tendencję do tworzenia kompleksów (m.in.
tworzy akwakompleksy, a jodek aminalitu [Li(NH
3
)
4
]I istnieje w stanie stałym).
Li
2
CO
3
, Li
3
PO
4
i LiF są nierozpuszczalne w wodzie, a LiOH jest trudno rozpuszczalny
(podobieństwo do magnezu).
Kowalencyjne halogenki i związki alkilowe litu są rozpuszczalne w
rozpuszczalnikach organicznych (podobieństwo do magnezu).
Jony i związki litu są dużo lepiej hydratowane niż jony innych litowców i ich
związki.

37
Właściwości chemiczne litowców – reakcja
metali z wodą
W reakcjach litowców z wodą powstają wodorotlenki i
wydziela się wodór:
• 2Me + 2H
2
O → 2Me+OH
-
+ H
2
(Me=Li, Na, K, Rb, Cs, Fr)
Reaktywność litowców wzrasta ze wzrostem liczby
atomowej
Rb i Cs eksplodują przy kontakcie z wodą

38
Właściwości chemiczne litowców –
reakcja tlenków metali z wodą
Produktami reakcji normalnych tlenków litowców z wodą są
wodorotlenki:
Me
2
O + H
2
O → 2MeOH (Me=Li, Na, K, Rb, Cs, Fr)
W reakcjach nadtlenków litowców z wodą powstają wodorotlenki i
nadtlenek wodoru:
• Me
2
O
2
+ 2H
2
O → 2MeOH + H
2
O
2
(Me=Na, K, Rb, Cs, Fr)
•
• W reakcjach ponadtlenków litowców z wodą powstają
wodorotlenki, nadtlenek wodoru i tlen:
• 2MeO
2
+ 4H
2
O → 2MeOH + 2H
2
O
2
+ O
2
(Me=K, Rb, Cs, Fr)
• Tlenki litowców Me
2
O mają wybitnie zasadowy charakter.
• Nadtlenki i ponadtlenki litowców (Me
2
O
2
, MeO
2
) są silnymi
utleniaczami.

39
Najważniejsze reakcje
litowców

40
Najważniejsze związki litowców – główne produkty
przemysłu sodowego
Soda
(
Na
2
CO
3
) – dwie metody produkcji wielkoprzemysłowej:
Leblanca (
NaCl → Na
2
S
;
Na
2
S + CaCO
3
→ Na
2
CO
3
+ CaS
)
2NaCl + H
2
SO
4
= Na
2
SO
4
+ 2HCl
Na
2
SO
4
+ 4C = Na
2
S + 4CO
Na
2
S + CaCO
3
= Na
2
CO
3
+ CaS
Solvaya (
NaCl + CaCO
3
→ Na
2
CO
3
+ CaCl
2
)
NH
3
+ CO
2
+ H
2
O = NH
4
HCO
3
NH
4
HCO
3
+ NaCl = NaHCO
3
+ NH
4
Cl
prażenie
2NaHCO
3
= Na
2
CO3 + CO
2
+ H
2
O
CaCO
3
=CaO + CO
2
CaO + H
2
O = Ca(OH)
2
2 NH
4
Cl + Ca(OH)
2
= CaCl
2
+NH
3
+ 2 H
2
0
Zużycie sody: przemysł chemiczny (33%), szklarski (26%), mydlarski
i środków do prania (16%).
Najważniejsze związki litowców – główne produkty
przemysłu sodowego
Soda
(
Na
2
CO
3
) – dwie metody produkcji wielkoprzemysłowej:
Leblanca (
NaCl → Na
2
S
;
Na
2
S + CaCO
3
→ Na
2
CO
3
+ CaS
)
2NaCl + H
2
SO
4
= Na
2
SO
4
+ 2HCl
Na
2
SO
4
+ 4C = Na
2
S + 4CO
Na
2
S + CaCO
3
= Na
2
CO
3
+ CaS
Solvaya (
NaCl + CaCO
3
→ Na
2
CO
3
+ CaCl
2
)
NH
3
+ CO
2
+ H
2
O = NH
4
HCO
3
NH
4
HCO
3
+ NaCl = NaHCO
3
+ NH
4
Cl
prażenie
2NaHCO
3
= Na
2
CO3 + CO
2
+ H
2
O
CaCO
3
=CaO + CO
2
CaO + H
2
O = Ca(OH)
2
2 NH
4
Cl + Ca(OH)
2
= CaCl
2
+NH
3
+ 2 H
2
0
Zużycie sody: przemysł chemiczny (33%), szklarski (26%), mydlarski
i środków do prania (16%).

41
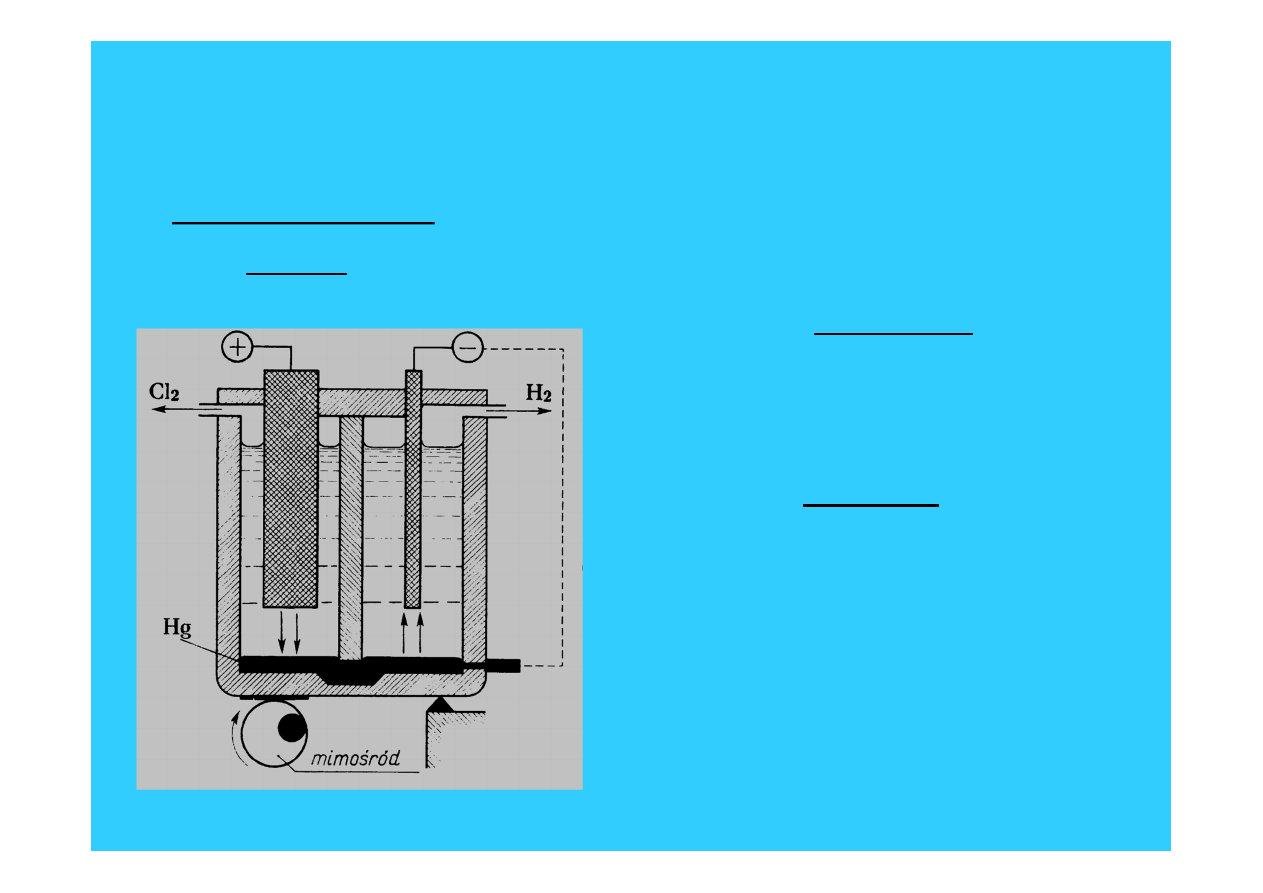
Najważniejsze związki litowców – główne
produkty przemysłu sodowego
Wodorotlenek sodu ( soda żrąca, soda kaustyczna )
- roztwór wodny NaOH - ług sodowy
a) Metoda laboratoryjna
Na + H
2
O = NaOH + 1/2 H
2
b) Metoda przemysłowa
•
elektroliza NaCl (roztwór wodny)
•
1. Metoda Siemensa-Billitera
• Anoda (+) : 2Cl
-
= Cl
2
+ 2e
• Katoda (-) : 2H
2
O + 2e = 2OH
-
+ H
2
•
•
2Na
+
+ 2OH
-
= 2NaOH
• Oddzielenie przestrzeni anodowej od katodowej przeponą !
•
NaOH + Cl
2
= NaCl + NaClO
42
Najważniejsze związki litowców – główne produkty
przemysłu sodowego
Metoda Castnera-Kellnera
•
W tej metodzie sód wydziela się (zamiast wodoru) na katodzie, którą jest ciekła rtęć.
•
Przyczyna - nadnapięcie wodoru na idealnie gładkiej powierzchni elektrody rtęciowej
jest bardzo wysokie i dlatego wydziela się sód a nie wodór.
•
cz.A Elektroliza
•
(-) Katoda Na
+
+ e = Na
•
(+) Anoda 2Cl
-
= Cl
2
+ 2e
•
Na + Hg: amalgamat Na
•
cz.B Ogniwo
•
2Na + 2H
2
O = 2NaOH +H2
•
W tej części wodór wydziela się na elektrodzie żelaznej
(katoda). Anodą jest amalgamat sodowy.
•
katoda 2H
+
+ 2e = H
2
•
(-) anoda Na = Na
+
+ e
•
Zaleta : bardzo czysty NaOH

43
Inne ważne związki litowców
Azotany (KNO
3
, NaNO
3
) – przemysł zapałczany, pirotechniczny, spożywczy, farmaceutyczny,
szklarski i ceramiczny, nawozów naturalnych i sztucznych.
Fosforany (głównie sodowe) – zmiękczanie wody, przemysł środków do prania
i czyszczenia, przemysł spożywczy (pirofosforany).
Sole fluorowe (głównie sodowe): NaF – produkcja środków ochrony roślin, impregnacja
drewna, metalurgia glinu; Na
3
AlF
6
(kriolit) – metalurgia glinu, przemysł emalierski i szklarski.
Chlorany (głównie sodowe) – do wybielania i dezynfekcji (NaClO, NaClO
2
), do utleniania
(NaClO
3
), przemysł pirotechniczny (NaClO
4
).
Sole potasowe (sylwinit – KCl + NaCl, karnalit - KCl▪MgCl
2
▪6H
2
O, K
2
SO
4
, leonit i szenit –
odpowiednio K
2
SO
4
▪MgSO
4
▪4H
2
O i K
2
SO
4
▪MgSO
4
▪6H
2
O) – całość przerabiana na KCl nawozowy.
Sól kamienna (NaCl) – stosowana bezpośrednio lub po oczyszczeniu w warzelniach, głównie
jako sól jadalna i surowiec przemysłowy.
Naturalne glinokrzemiany sodowe (np. analcym – Na
2
O▪Al
2
O
3
▪4SiO
2
▪2H
2
O) – jonity do
zmiękczania wody.
Kaoliny, gliny i skalenie (skalenie: ortoklaz – K[AlSi
3
O
8
], albit - K[AlSi
3
O
8
]) – surowce
w przemyśle materiałów ceramicznych.
Na
2
O, K
2
O, Li
2
O oraz Rb
2
O, Cs
2
O (często Na
2
CO
3
)– topniki w przemyśle szklarskim.
Na
2
SO
4
, KNO
3
, NaNO
3
, Na
2
B
4
O
7
▪10H
2
O – topniki i substancje klarujące szkło.
Inne ważne związki litowców
Azotany (KNO
3
, NaNO
3
) – przemysł zapałczany, pirotechniczny, spożywczy, farmaceutyczny,
szklarski i ceramiczny, nawozów naturalnych i sztucznych.
Fosforany (głównie sodowe) – zmiękczanie wody, przemysł środków do prania
i czyszczenia, przemysł spożywczy (pirofosforany).
Sole fluorowe (głównie sodowe): NaF – produkcja środków ochrony roślin, impregnacja
drewna, metalurgia glinu; Na
3
AlF
6
(kriolit) – metalurgia glinu, przemysł emalierski i szklarski.
Chlorany (głównie sodowe) – do wybielania i dezynfekcji (NaClO, NaClO
2
), do utleniania
(NaClO
3
), przemysł pirotechniczny (NaClO
4
).
Sole potasowe (sylwinit – KCl + NaCl, karnalit - KCl▪MgCl
2
▪6H
2
O, K
2
SO
4
, leonit i szenit –
odpowiednio K
2
SO
4
▪MgSO
4
▪4H
2
O i K
2
SO
4
▪MgSO
4
▪6H
2
O) – całość przerabiana na KCl nawozowy.
Sól kamienna (NaCl) – stosowana bezpośrednio lub po oczyszczeniu w warzelniach, głównie
jako sól jadalna i surowiec przemysłowy.
Naturalne glinokrzemiany sodowe (np. analcym – Na
2
O▪Al
2
O
3
▪4SiO
2
▪2H
2
O) – jonity do
zmiękczania wody.
Kaoliny, gliny i skalenie (skalenie: ortoklaz – K[AlSi
3
O
8
], albit - K[AlSi
3
O
8
]) – surowce
w przemyśle materiałów ceramicznych.
Na
2
O, K
2
O, Li
2
O oraz Rb
2
O, Cs
2
O (często Na
2
CO
3
)– topniki w przemyśle szklarskim.
Na
2
SO
4
, KNO
3
, NaNO
3
, Na
2
B
4
O
7
▪10H
2
O – topniki i substancje klarujące szkło.

44
Ważne reakcje metali alkalicznych

45

46
Ważne reakcje metali alkalicznych

47
Wyszukiwarka
Podobne podstrony:
litowce, berylowce oraz glin zadania
Litowce, 08. MEDYCYNA, 1.Analityka medyczna, I rok, Chemia ogólna i nieorganiczna, Inne
Litowce
Litowce
Litowce 3
ISE powtorka z chemii, ISE charakterystyka litowców i berylowców, Charakterystyka litowców i berylow
LITOWCE
Litowce i fluorowce SPRAWDZIAN, do wykorzystania w szkole
Litowce i berylowce
reakcje+litowce+i+berylowce1
litowce,?rylowce, fluorowce
Litowce i?rylowce
litowce wyklady
litowce - fluorowce, Chemia
litowceberylowce borowce
LITOWCE
Litowce, chemia
litowce 2
więcej podobnych podstron