
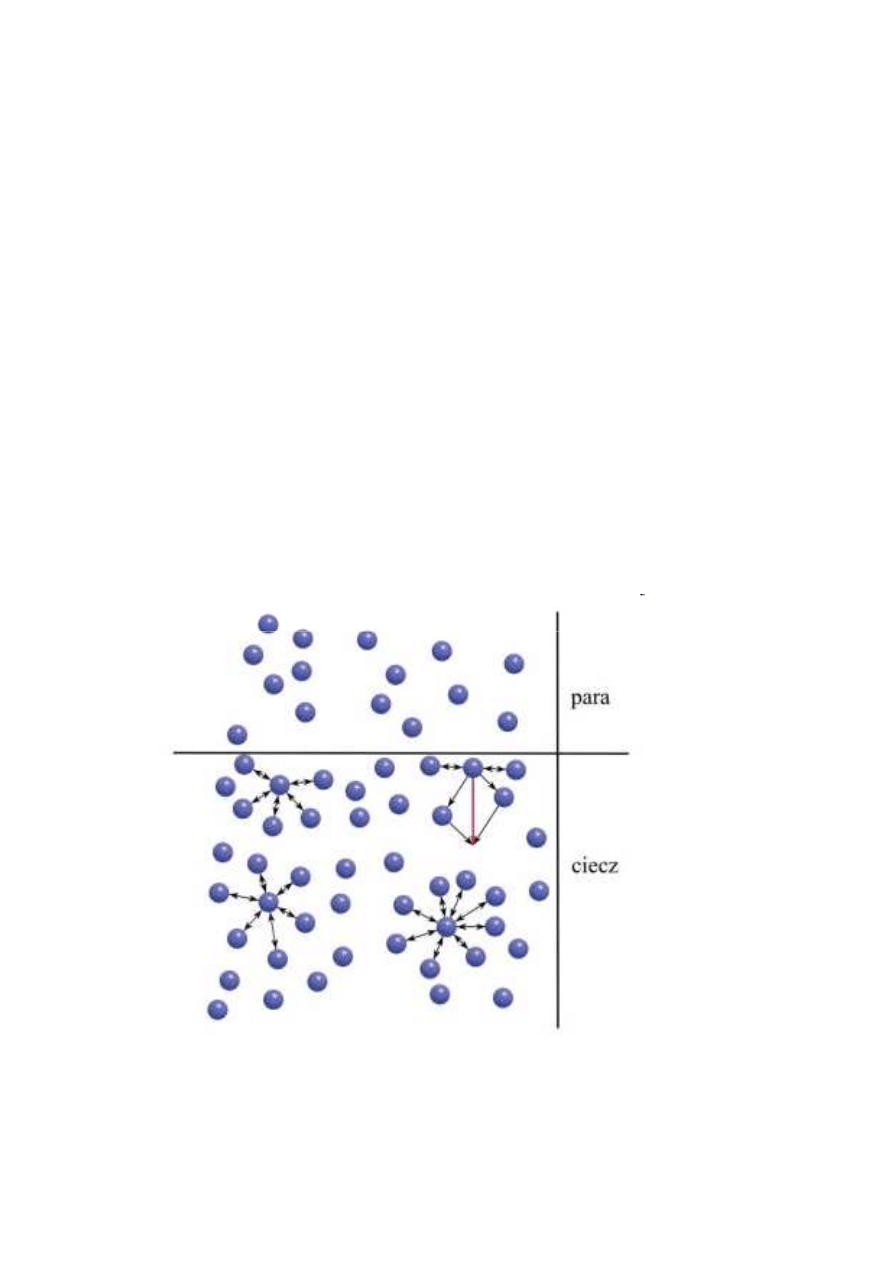
Ciecze
Stan ciekły - układ cząsteczek (atomów) w którym
oddziaływania międzycząsteczkowe są na tyle istotne,
ż
e zbiorowisko cząsteczek dąży do wypełnienia
możliwie
najmniejszej
objętości.
Powstaje
układ
ograniczony w przestrzeni wyraźną granicą fazową w
obrębie którego cząsteczki (atomy) są w ciągłym
ruchu. Ruch pojedynczej cząsteczki nie jest jednak
ruchu. Ruch pojedynczej cząsteczki nie jest jednak
zupełnie niezależny jak w stanie gazowym. Powstają
bliskie strefy wzajemnego uporządkowania (domeny)
w
których
cząsteczki
(atomy)
zachowują
stałe
odległości.
Wła
ś
ciwo
ś
ci cieczy
•
Napięcie powierzchniowe:
σ
= W/S [J/m
2
],
(stosunek pracy W potrzebnej do zmiany swobodnej
powierzchni cieczy do zmiany tej powierzchni S).
Napięcie powierzchniowe maleje wraz z temperaturą. W
temperaturze krytycznej, kiedy zanika różnica między
cieczą a parą, uzyskuje wartość równą zeru.
Oddziaływania między cząsteczkami na
powierzchni i w głębi cieczy.
-
Zjawiska kapilarne
-
wznoszenie kapilarne,
-
Zakrzywienie powierzchni:
Bańki, pęcherzyki, krople;
- Zarodkowanie (nukleacja);
-
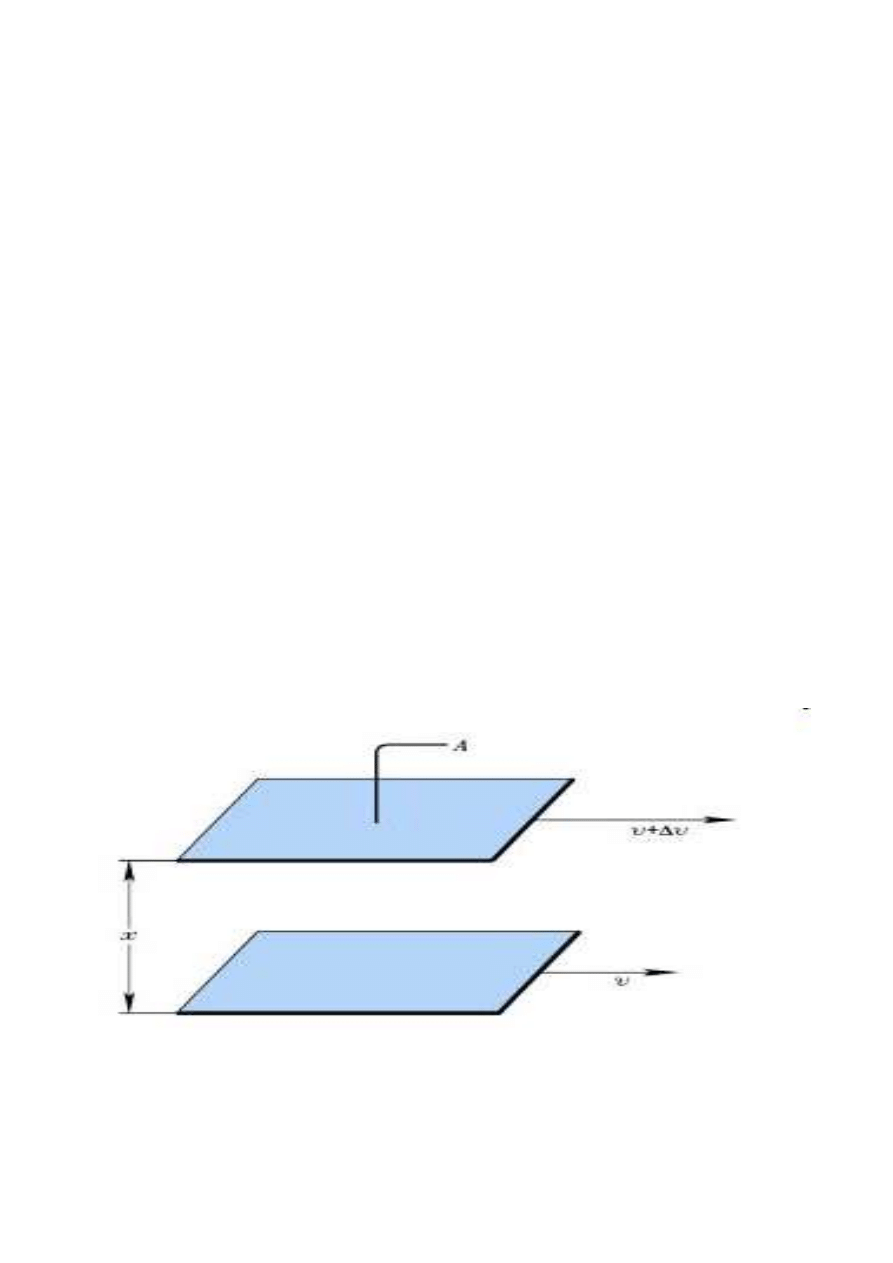
Lepkość - zwana również tarciem wewnętrznym, jest
to opór na, który natrafiają w ruchu jednostajnym
warstwy cieczy podczas przesuwania się jednych
warstw cieczy względem drugich. (Przyczyną tarcia
wewnętrznego jest istnienie sił spójności miedzy
cząsteczkami cieczy).
Opis składu układów wieloskładnikowych
1. Ułamek molowy – ilość moli B w stosunku do ogólnej
ilości substancji w układzie
∑
=
i
i
B
B
n
n
x
dla układów
dwuskładnikowych
B
A
B
B
n
n
n
x
+
=
2. Stężenie molowe – ilość moli B w jednostkowej objętości
układu [mol ·dm
-3
]
(zakładamy, że A – rozpuszczalnik)
V
n
c
B
mB
=
dla układów
dwuskładnikowych
ρ
- gęstość roztworu,
B
A
B
B
B
B
c
M
M
c
1000
c
x
+
−
=
ρ
ρ
- gęstość roztworu,
M
A
, M
B
– masy molowe
dla roztworów rozcieńczonych
ρ
1000
M
c
x
A
B
B
≈
3. Molalność – ilość moli B w jednostce masy
rozpuszczalnika [mol ·kg
-1
]
A
B
B
n
m
Μ
=
dla układów
dwuskładnikowych
B
A
B
B
m
M
1000
m
x
+
=
dla roztworów rozcieńczonych
1000
M
m
x
A
B
B
≈

Roztwory
• Roztworem nazywamy wieloskładnikowy
układ jednofazowy (homogeniczny). Składnik
znajdujący się w ilościowej przewadze nosi
nazwę rozpuszczalnika (z reguły), podczas
gdy pozostałe składniki tworzące roztwór
noszą nazwę substancji rozpuszczonej.
- roztwory doskonałe,
- roztwory rzeczywiste,
- roztwory koloidalne.
- roztwory koloidalne.
●
Rozpuszczalność - maksymalna ilość
substancji, jaką można rozpuścić w jednostce
objętości rozpuszczalnika w danej
temperaturze i ciśnieniu nosi nazwę
rozpuszczalności. Rozpuszczalność
wyrażana jest przeważnie w gramach
substancji rozpuszczonej w 1 dm3
rozpuszczalnika lub gramach na 100 gramów
rozpuszczalnika.

Rozpuszczanie
•
Roztwory powstają w wyniku rozpuszczenia substancji w
rozpuszczalniku. Tworzenie roztworu może zachodzić poprzez:
•
(a) chemiczną reakcję substancji z rozpuszczalnikiem w wyniku
której powstaje nowa rozpuszczona substancja,
•
(b) oddziaływanie substancji z rozpuszczalnikiem w wyniku
której powstaje solwatowana forma rozpuszczanej substancji,
•
Solwatacją nazywamy oddziaływanie cząsteczek lub jonów danej
substancji z cząsteczkami rozpuszczalnika w wyniku czego powstaje
solwatowana forma cząsteczki (jonu). Forma ta jest przeważnie
strukturą przestrzenną w której cząsteczka (jon) są otoczone ściśle
zorientowanymi cząsteczkami rozpuszczalnika.
•
(c) dyspersja substancji w rozpuszczalniku. Niekiedy dwie
substancje mogą samorzutnie utworzyć roztwór w wyniku
oddziaływania sił międzycząsteczkowych. Nie mamy wtedy do
czynienia z procesem solwatacji lecz w wyniku procesów dyfuzji
następuje ujednorodnienie układu jednofazowego.

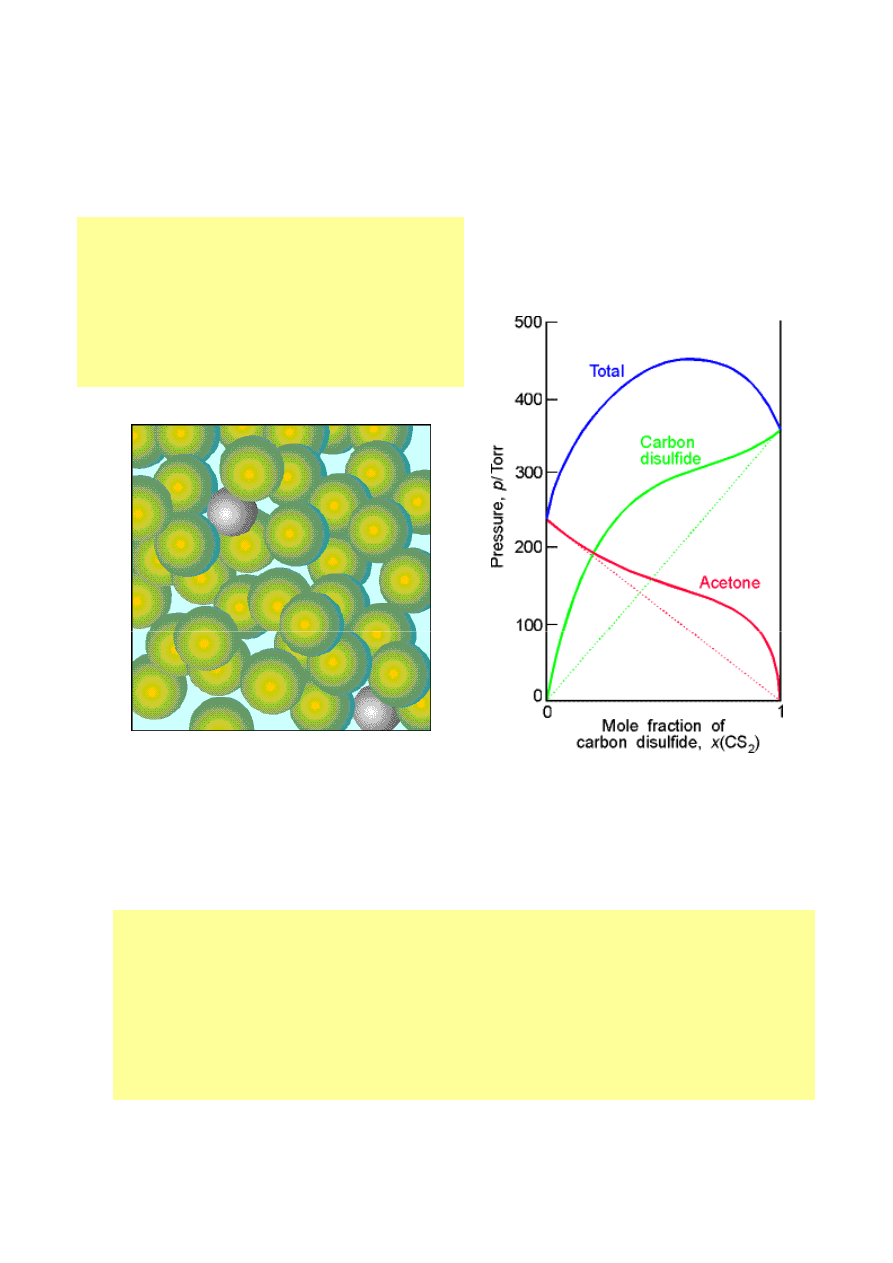
Mieszaniny proste
• Prawo Raoulta – w stanie równowagi
stosunek prężności pary każdego składnika
mieszaniny do jego prężności pary w czystej
cieczy p
A
/p
*
A
, jest w przybliżeniu równy
ułamkowi molowemu tego składnika (A), w
roztworze.
• p
A
= x
A
p
*
A
A
A
A
• Roztwory idealne – roztwory spełniające
prawo Raoulta w całym zakresie składu.
Prawo Raoulta jest prawem
granicznym dla x
→
1
Stosuje się dla rozpuszczalnika, w
którym znajduje się niewielka liczba
substancji rozpuszczonej
Układy ciecz-ciecz
- otoczenie cząsteczek
rozpuszczalnika niewiele zmienia
się w stosunku do czystego
rozpuszczalnika
Otoczenie substancji rozpuszczonej zupełnie inne niż w stanie
czystym (substancji rozpuszczonej) – duże odstępstwa od p.
Raoulta.
Jeżeli ciecze są chemicznie podobne – „widzą się” podobnie –
prawo Raoulta stosuje się w całym zakresie.
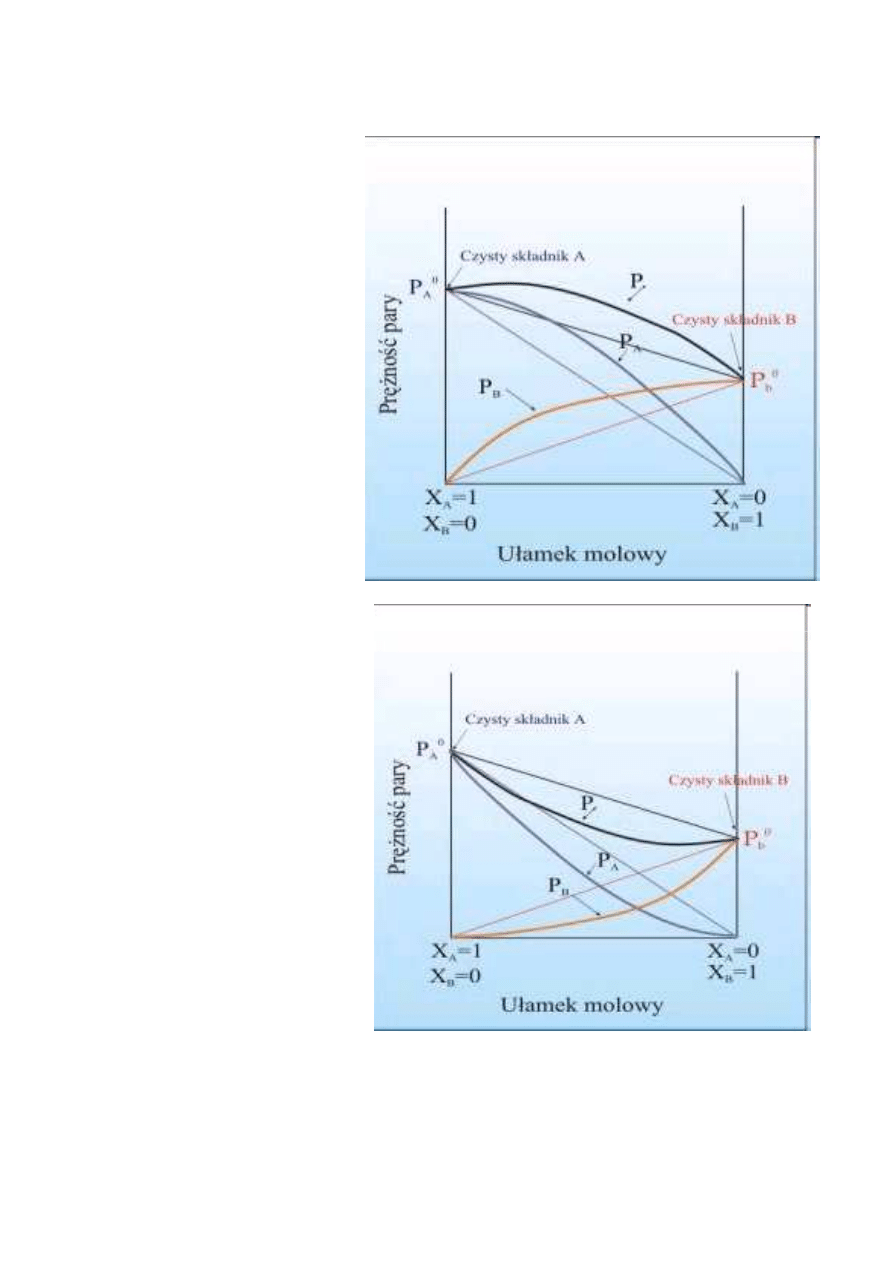
•
Zależność
prężności pary
od składu
roztworu z
dodatnim
odchyleniem od
prawa Raulta.
•
zależność
prężności pary
prężności pary
od składu
roztworu z
ujemnym
odchyleniem od
prawa Raulta
.
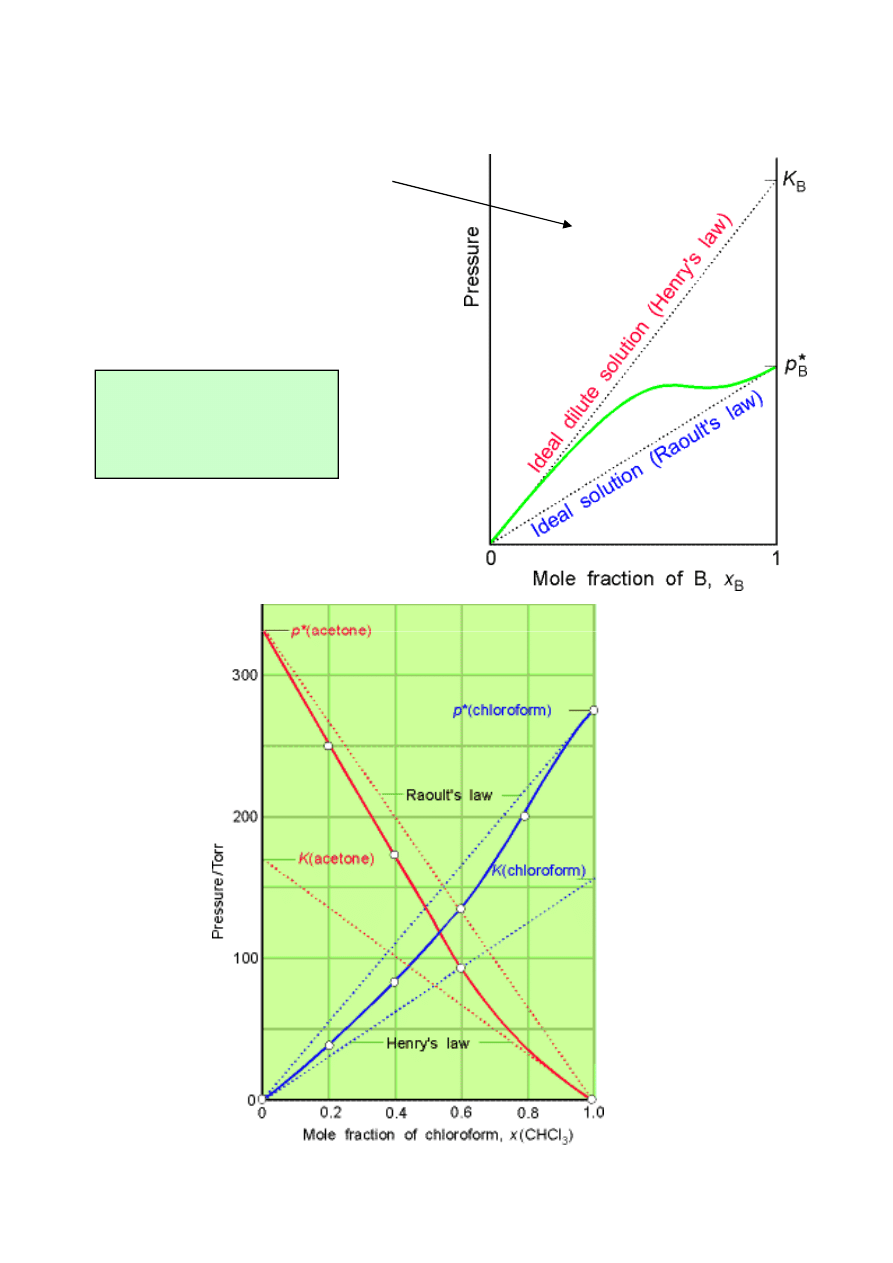
Roztwory idealnie rozcieńczone
Zawsze można
wyodrębnić pewien
obszar dla małych stężeń
x
B
<< 1 że:
B
B
B
x
K
p
=
K
B
empiryczna stała Henry’ego
prawo Henry’ego
*
B
B
p
K
≠
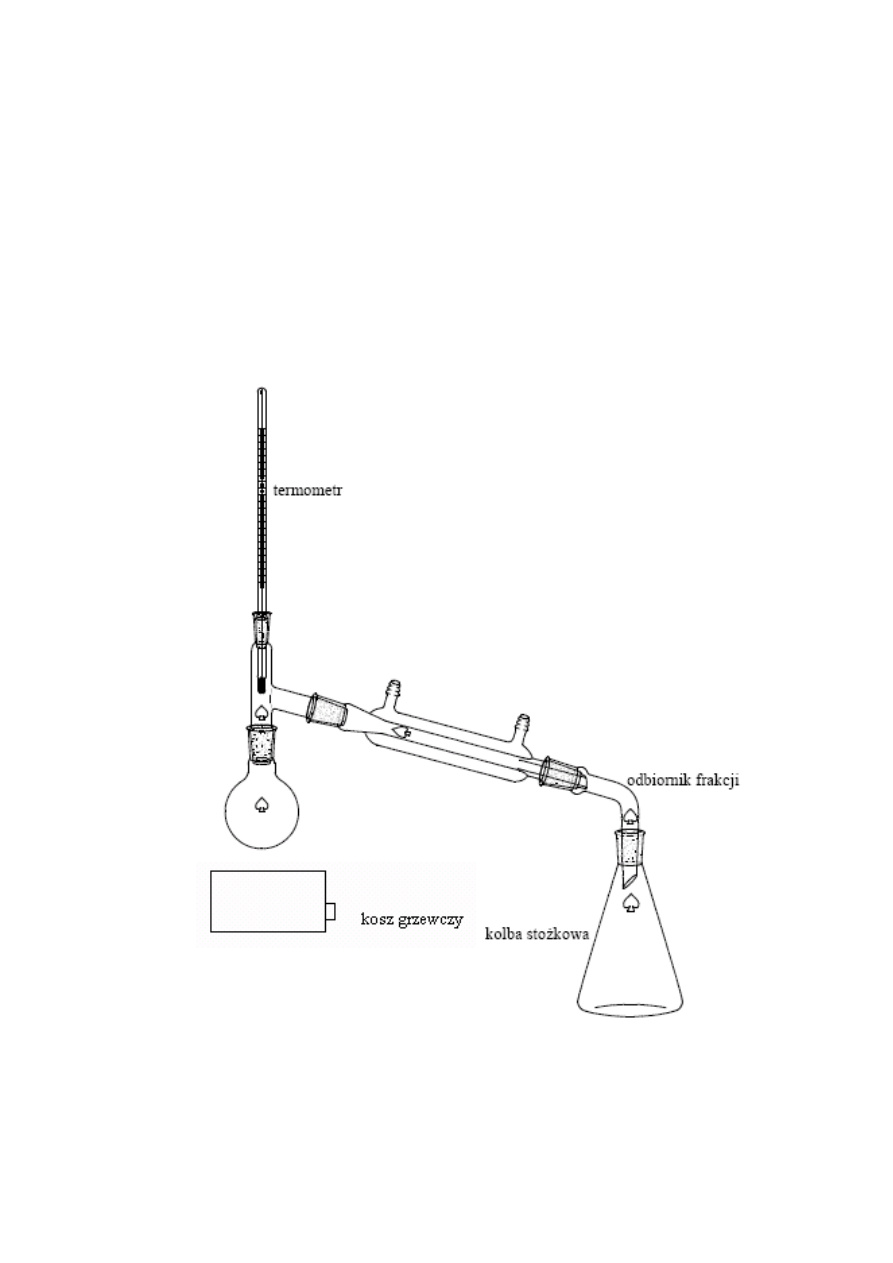
Destylacja
• DESTYLACJA PROSTA
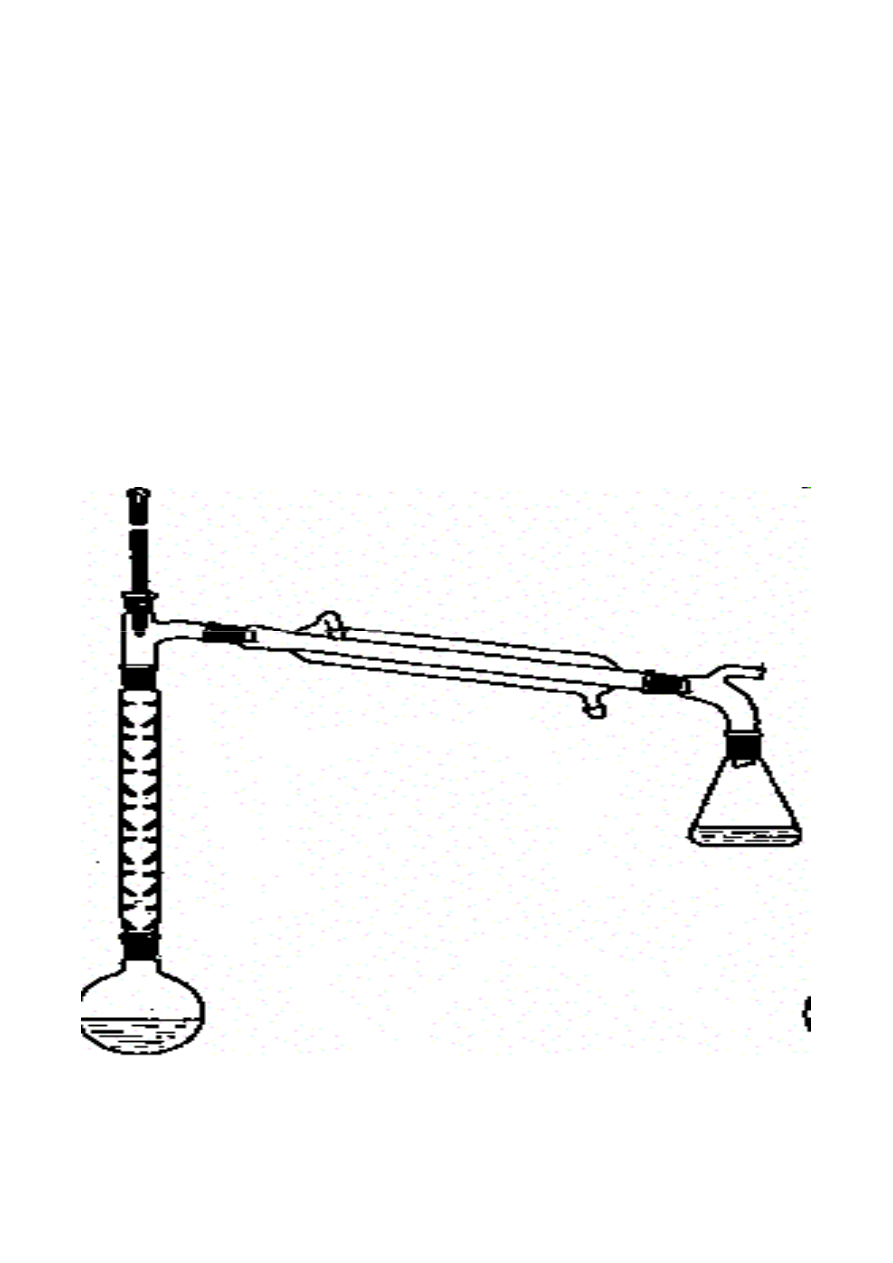
• Destylacja z parą wodną
• Destylacja pod zmniejszonym ciśnieniem
• Destylacja frakcyjna (rektyfikacja)
• Destylacja azeotropowa
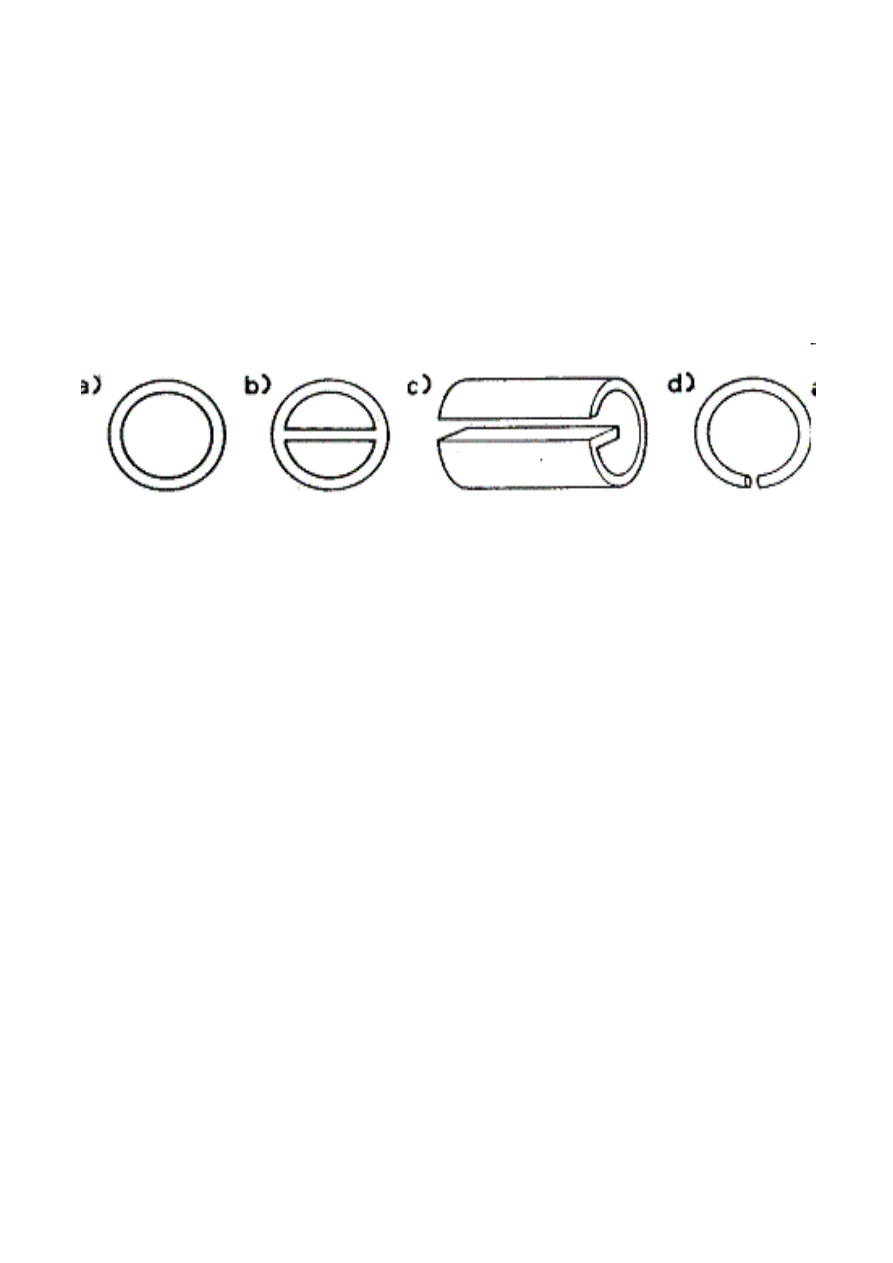
Wypełnienie kolumn destylacyjnych:
a) pier
ś
cienie Raschiga, b) porcelanowe
pier
ś
cienie Lessinga, c) metalowe pier
ś
cienie
pier
ś
cienie Lessinga, c) metalowe pier
ś
cienie
Lessinga, d) pier
ś
cienie Fenskego
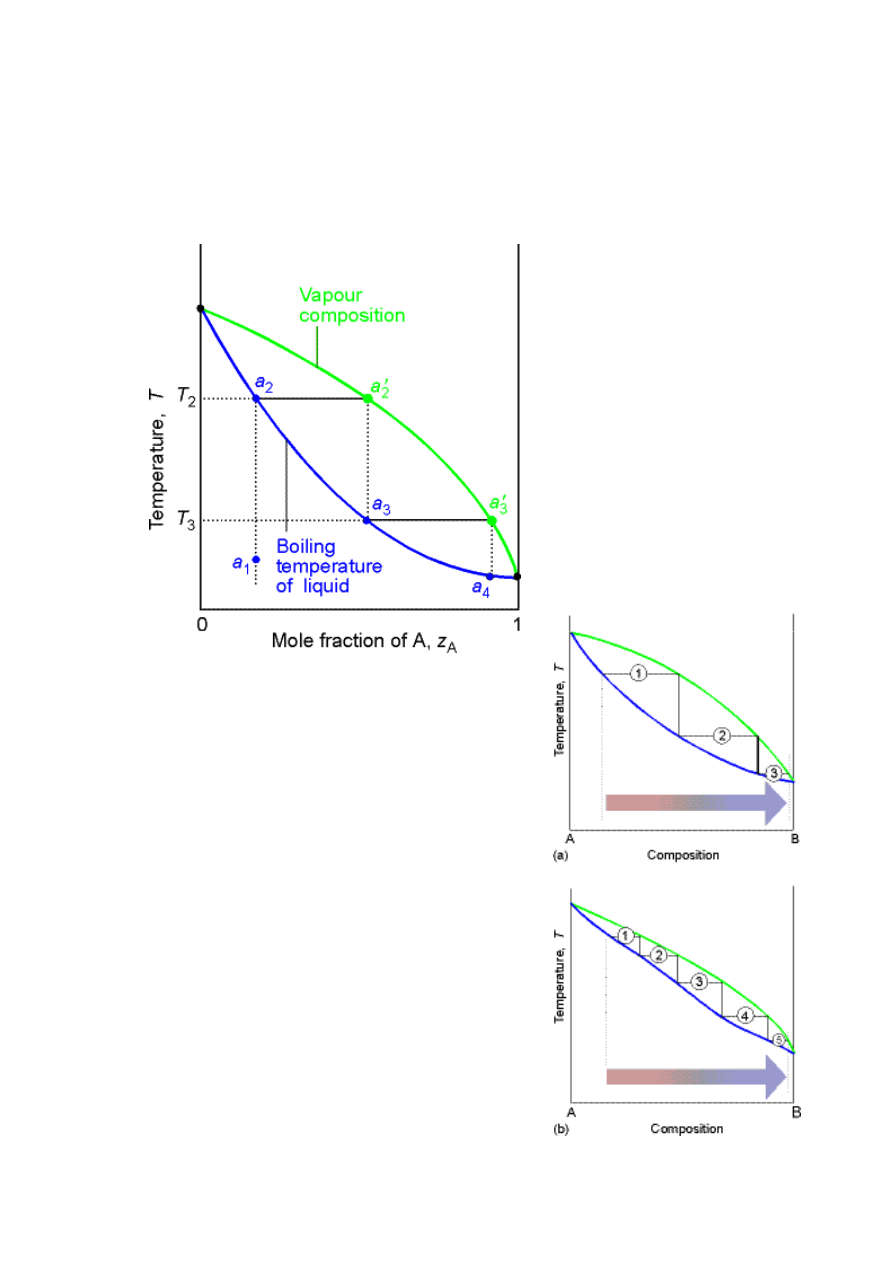
Diagramy typu: temperatura - skład
Destylacja bardziej lotnego składnika (A)
Poprzez sukcesywne
procesy wrzenia,
odbierania pary i
kondensacji możemy
otrzymać prawie
czystego składnika A –
destylacja frakcyjna
W zależności od kształtu
obszaru dwu-fazowego dla
otrzymania określonego
końcowego składu potrzebna
jest różna liczba cykli
parowania i kondensacji –
liczba półek teoretycznych
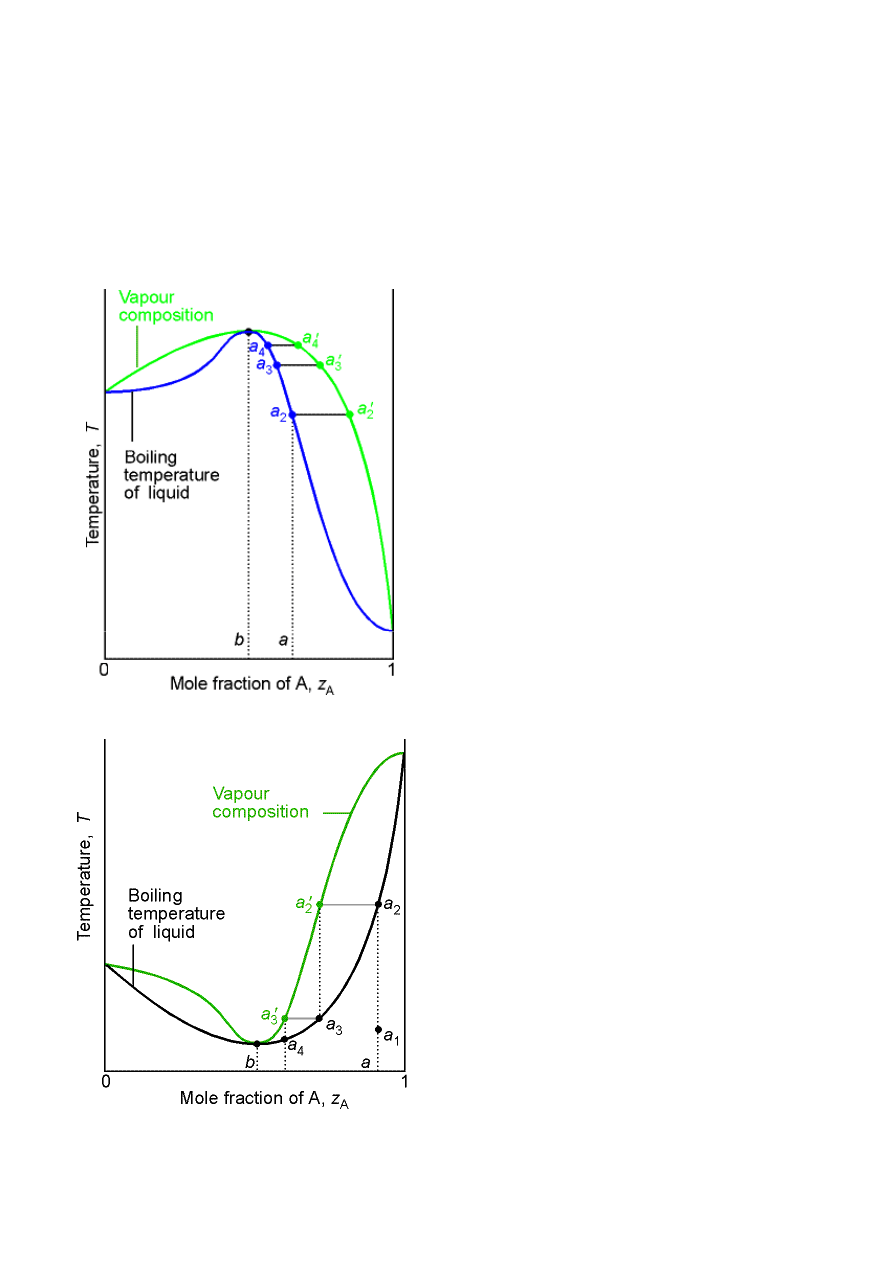
Dla mieszanin nieidealnych może wystąpić efekt azeotropii –
ekstremum na diagramie fazowym.
Ciecze mieszają się lepiej od idealnych G
E
< 0 –
maksimum na diagramie fazowym.
Nie możemy oddestylować
lotniejszego składnika
bardziej niż do składu
odpowiadającemu
punktowi b. Skład pary
taki sam jak skład cieczy –
mieszanina azeotropowa
Ciecze mieszają się gorzej od idealnych G
E
> 0 –
minimum na diagramie fazowym.
Destylacja frakcyjna prowadzi do
składu azeotropowego
odpowiadającemu punktowi b.
Spirytus rektyfikowany tylko 96%
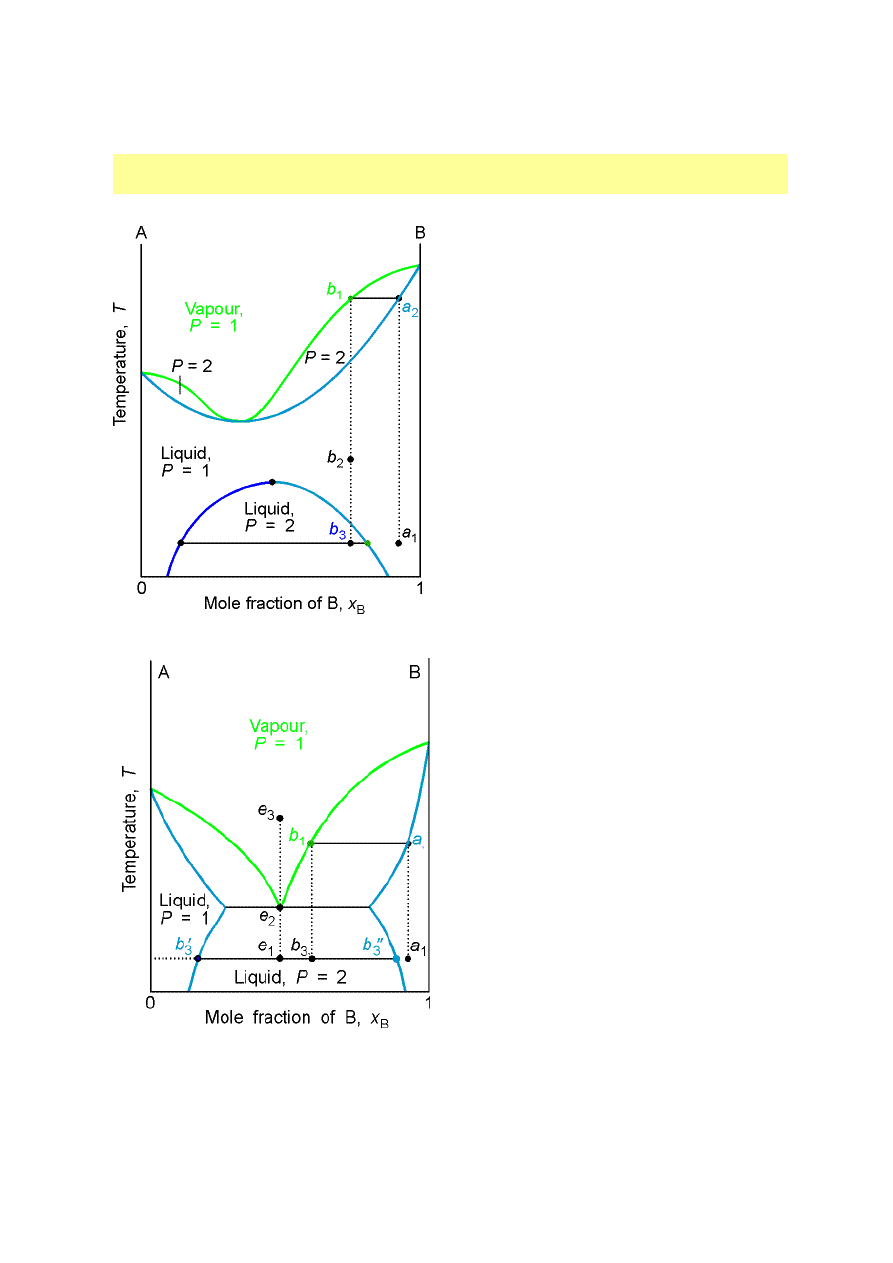
Destylacja cieczy częściowo mieszających się
Górna krytyczna temperatura
rozpuszczalności niższa niż
temperatura wrzenia.
Górna krytyczna temperatura
rozpuszczalności wyższa niż
temperatura wrzenia.
Destylat rozpada się na dwie
fazy o składach b
3
’ i b
3
’’.
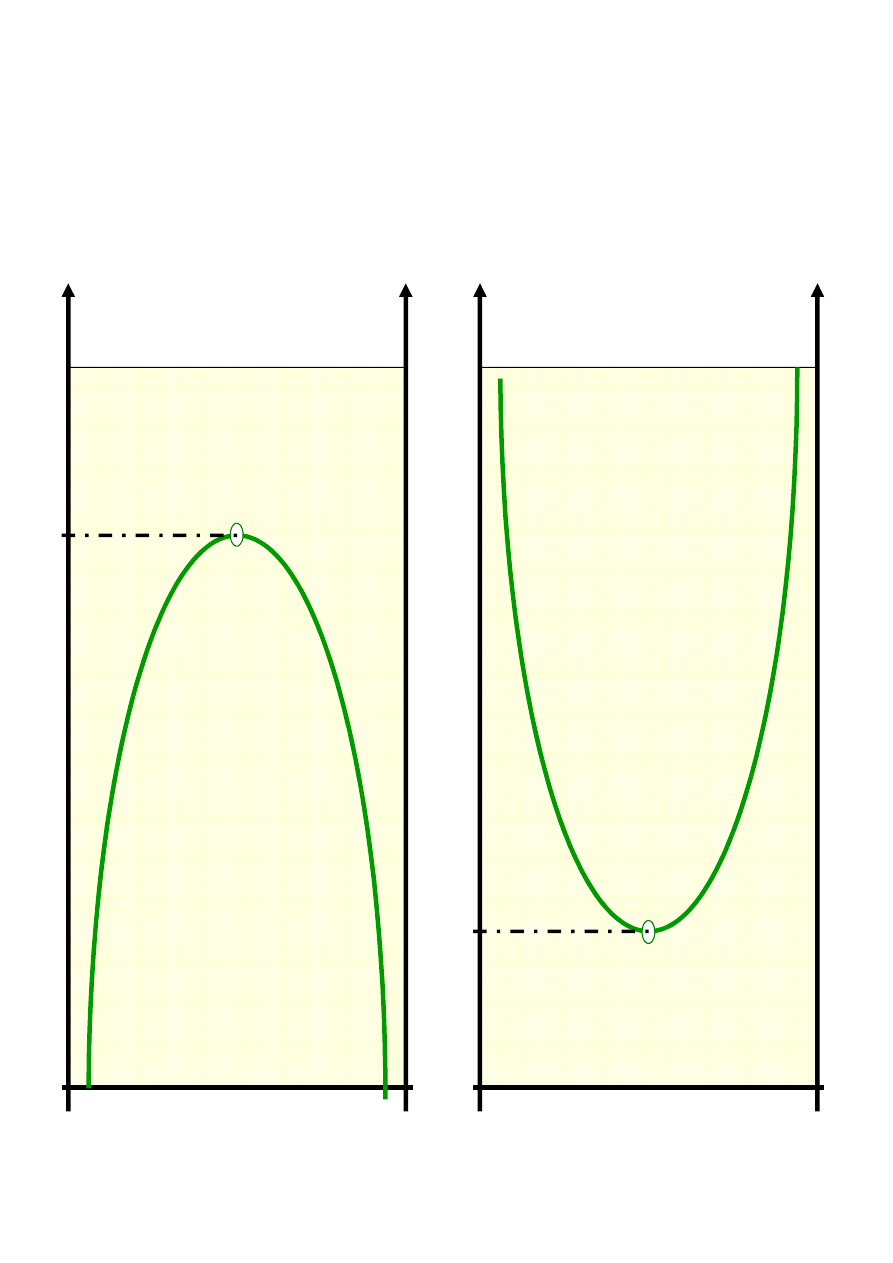
T
K
T
k
M
(gó
rna)
1
T
2
Wzajemna rozpuszczalność dwóch cieczy
o ograniczonej wzajemnej mieszalności
Diagramy fazowe ciecz - ciecz (typy):
B
A
x
B
2
B
A
x
B
K
T
k
M
(do
lna)
2
1
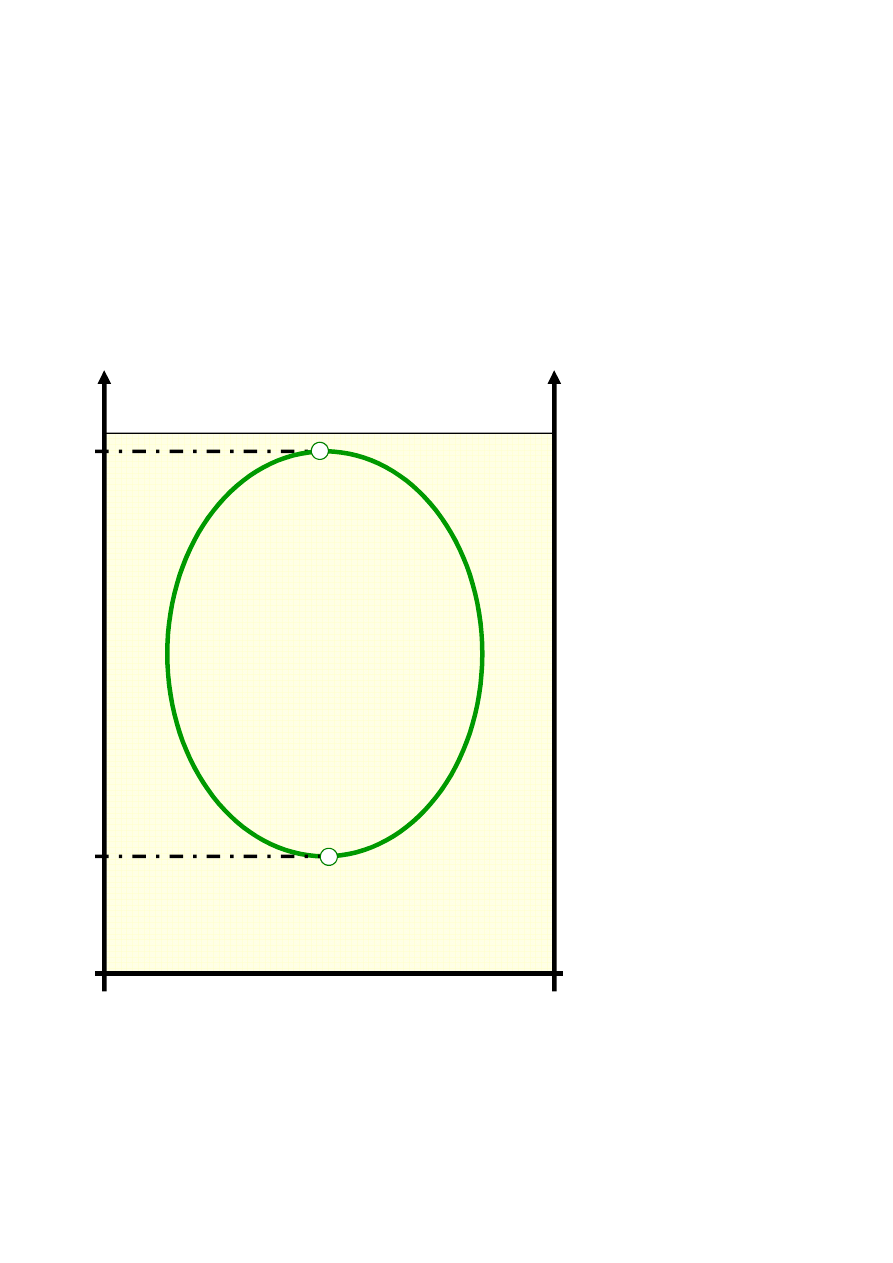
Wzajemna rozpuszczalność dwóch cieczy
o ograniczonej wzajemnej mieszalności,
cd.
T
K
T
k
M
(górna)
2
1
B
A
x
B
2
K
T
k
M
(dolna)
1

Ekstrakcja -Prawo podziału
• Jeżeli do układu złożonego z dwóch nie
mieszających się cieczy wprowadzimy trzecią
substancję rozpuszczająca się w obu cieczach,
to substancja ta tworzy roztwór bardziej
stężony z tą cieczą w której wykazuje
stężony z tą cieczą w której wykazuje
większą rozpuszczalność. Stosunek stężeń tej
substancji w obydwu warstwach cieczy w
stałej temperaturze ma wartość stałą. Prawo
podziału stanowi podstawę procesu zwanego
ekstrakcją.
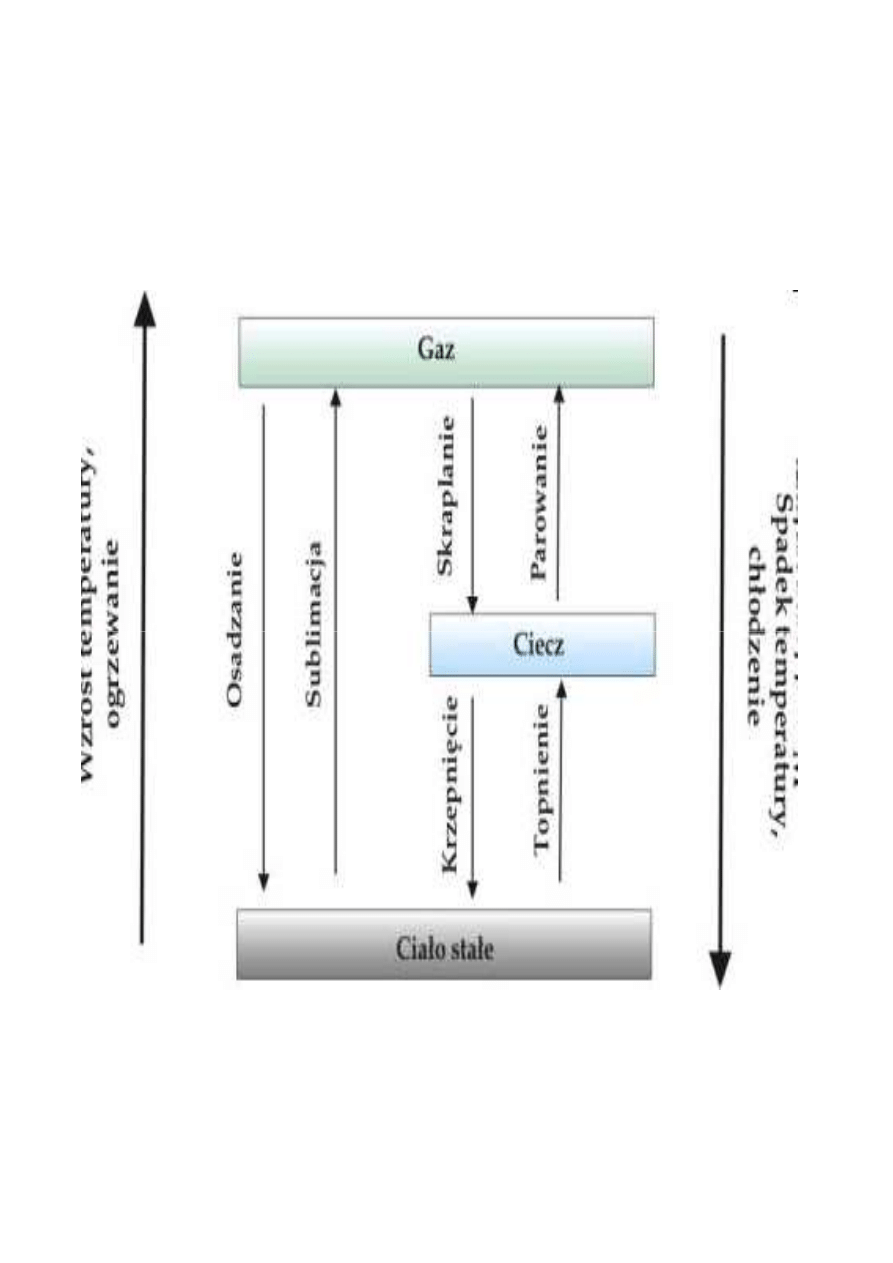
Zmiany stanu skupienia
Wyszukiwarka
Podobne podstrony:
Ciecze
Nowy Mendel cz1 CIECZE
Ciecze
Ciecze izolacyjne - referat, dielektryki ciekle, Dielektryki izolatory materiały które bardzo słabo
Mineralurgia, węgiel- ciecze ciężkie, 1
CIECZE, pomiar naprezen stycznych w cieczy, POLITECHNIKA ˙WI˙TOKRZYSKA WYDZIA˙ MECHANI
Ciecze jonowe
9.ciecze
CIECZE HYDRAULICZNE
ciecze 2
Ciecze jonowe
Fizyka 2, zbiór zadań dla gimnazjum Dział ciecze i gazy
zielone rozpuszczalniki ciecze Nieznany
1 2 Ciecze izolacyjne
Ciecze izolacyjne referat ciecze izolacyjne id 65
ciecze jonowe
więcej podobnych podstron