
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
MINISTERSTWO EDUKACJI
NARODOWEJ
Zofia Jakubiak
Małgorzata Urbanowicz
Wykonywanie podstawowych czynności laboratoryjnych
311[31].O1.01
Poradnik dla nauczyciela
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy
Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
1
Recenzenci:
dr Władysław Goworek
mgr Wanda Warska
Opracowanie redakcyjne:
mgr inż. Małgorzata Urbanowicz
Konsultacje:
dr inż. Bożena Zając
Korekta:
Poradnik stanowi obudowę dydaktyczną programu jednostki modułowej 311 [31].O1.01
„Wykonywanie podstawowych czynności laboratoryjnych” zawartej w modułowym
programie nauczania dla zawodu technik technologii chemicznej.
Wydawca
Instytut Technologii Eksploatacji – Państwowy Instytut Badawczy, Radom 2006

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
2
SPIS TREŚCI
1. Wprowadzenie
2. Wymagania wstępne
3. Cele kształcenia
4. Przykładowe scenariusze zajęć
5. Ćwiczenia
5.1. Wyposażenie i zasady pracy w laboratorium chemicznym
5.1.1. Ćwiczenia
5.2. Podstawowy sprzęt laboratoryjny. Mycie i suszenie naczyń laboratoryjnych
5.2.1. Ćwiczenia
5.3.Substancje stosowane w laboratorium chemicznym
5.3.1. Ćwiczenia
5.4.Technika ważenia na wagach technicznych i analitycznych
5.4.1. Ćwiczenia
5.5.Technika odmierzania objętości cieczy
5.5.1. Ćwiczenia
5.6. Przygotowanie roztworów wodnych o określonych stężeniach
5.6.1. Ćwiczenia
5.7. Laboratoryjne metody ogrzewania
5.7.1. Ćwiczenia
5.8. Laboratoryjne metody suszenia i prażenia
5.8.1. Ćwiczenia
5.9. Laboratoryjne metody chłodzenia
5.9.1. Ćwiczenia
5.10. Rozdzielanie mieszanin niejednorodnych: dekantacja, sączenie, wirowanie
5.10.1. Ćwiczenia
5.11. Rozdzielanie mieszanin jednorodnych – krystalizacja
5.11.1. Ćwiczenia
5.12. Rozdzielanie mieszanin jednorodnych – sublimacja
5.12.1. Ćwiczenia
5.13 Rozdzielanie mieszanin jednorodnych – ekstrakcja
5.13.1. Ćwiczenia
5.14 Rozdzielanie mieszanin jednorodnych – destylacja
5.14.1. Ćwiczenia
6. Ewaluacja osiągnięć uczniów
7. Literatura
3
5
6
7
11
11
11
12
12
13
13
15
15
16
16
17
17
18
18
19
19
21
21
23
23
25
25
27
27
29
29
31
31
33
46

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
3
1. WPROWADZENIE
Przekazujemy Państwu Poradnik dla nauczyciela „Wykonywanie podstawowych
czynności laboratoryjnych”, który będzie pomocny w prowadzeniu zajęć dydaktycznych
w szkole kształcącej w zawodzie technik technologii chemicznej 311[31].
W poradniku zamieszczono:
−
wymagania wstępne,
−
wykaz umiejętności, jakie uczeń opanuje podczas zajęć,
−
przykładowe scenariusze zajęć,
−
propozycje ćwiczeń, które mają na celu ukształtowanie umiejętności praktycznych
uczniów,
−
wykaz literatury, z jakiej uczniowie mogą korzystać podczas nauki.
Wskazane jest, aby zajęcia dydaktyczne były prowadzone różnymi metodami ze
szczególnym uwzględnieniem:
−
pokazu z objaśnieniem,
−
tekstu przewodniego,
−
ćwiczeń praktycznych.
Zajęcia powinny odbywać się w pracowni chemicznej z odpowiednim zapleczem; pokój
wagowy, podręczny magazyn odczynników chemicznych. Uczniowie powinni wykonywać
ćwiczenia indywidualnie lub w zespołach dwuosobowych.
W celu przeprowadzenia sprawdzianu wiadomości i umiejętności ucznia, nauczyciel
może posłużyć się zamieszczonym w rozdziale 6 zestawem zadań testowych. W tym
rozdziale podano również:
−
plan testu w formie tabelarycznej,
−
punktację zadań,
−
propozycje norm wymagań,
−
instrukcję dla nauczyciela,
−
instrukcję dla ucznia,
−
kartę odpowiedzi,
−
zestaw zadań testowych.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
4
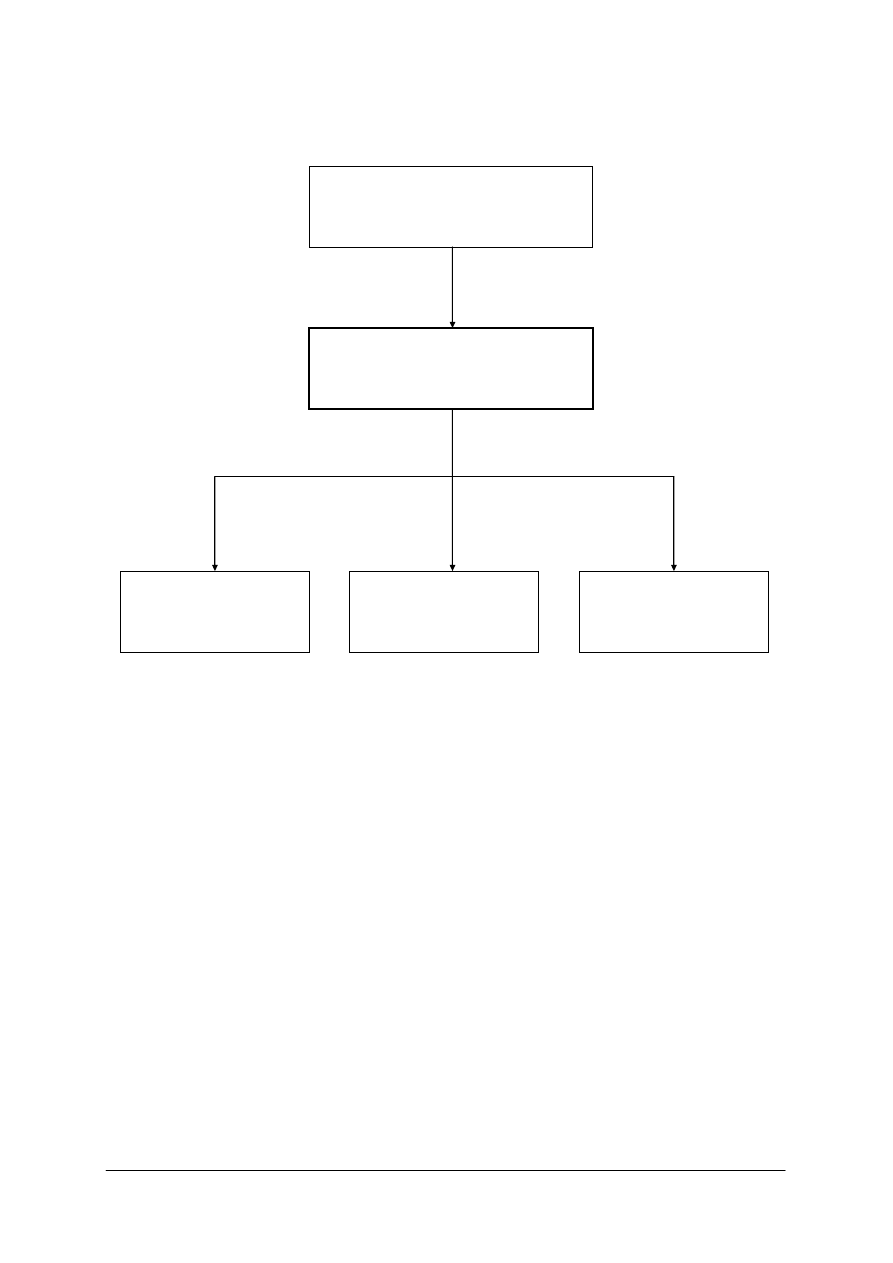
311[31].O1
Technika laboratoryjna
i analityczna
311[31].O1.01
Wykonywanie podstawowych
czynności laboratoryjnych
311[31].O1.03
Badanie fizycznych
właściwości substancji
311[31].O1.02
Wykonywanie
analiz jakościowych
311[31].O1.04
Wykonywanie
analiz ilościowych
Schemat układu jednostek modułowych

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
5
2. WYMAGANIA WSTĘPNE
Przystępując do realizacji programu jednostki modułowej uczeń, powinien umieć:
−
korzystać z różnych źródeł informacji,
−
wykonywać podstawowe działania arytmetyczne,
−
czytać tekst ze zrozumieniem,
−
odczytać wzory prostych substancji chemicznych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
6
3. CELE KSZTAŁCENIA
W wyniku realizacji jednostki modułowej uczeń powinien umieć:
−
zorganizować stanowisko pracy laboratoryjnej,
−
zinterpretować pojęcia dotyczące bezpieczeństwa i higieny pracy w laboratorium
chemicznym,
−
przewidzieć zagrożenia związane z wykonywaniem pracy laboratoryjnej,
−
posłużyć się kartami charakterystyk substancji niebezpiecznych stosowanymi w pracy
laboratoryjnej,
−
rozpoznać znaki i symbole ostrzegawcze stosowane do oznakowania substancji
niebezpiecznych,
−
posłużyć się środkami ochrony indywidualnej i zbiorowej,
−
zastosować procedury udzielania pomocy przedlekarskiej osobom poszkodowanym,
−
zareagować w przypadku zagrożenia pożarowego, zgodnie z instrukcją przeciwpożarową,
zastosować zasady bezpiecznej pracy podczas styczności z urządzeniami elektrycznymi
i mechanicznymi,
−
wykorzystać w sposób racjonalny sprzęt i aparaturę laboratoryjną,
−
wykorzystać w sposób racjonalny substancje i czynniki energetyczne,
−
przechować substancje chemiczne,
−
dokonać konserwacji sprzętu laboratoryjnego,
−
wykonać czynności laboratoryjne zgodnie z wymaganiami zawartymi w instrukcjach,
−
odmierzyć substancje ciekłe,
−
zważyć substancje stałe i ciekłe,
−
sporządzić roztwory wodne o określonym stężeniu,
−
oczyścić substancje nieorganiczne i organiczne,
−
przeprowadzić regenerację rozpuszczalników,
−
sporządzić dokumentację laboratoryjną,
−
zinterpretować wyniki pomiarów laboratoryjnych.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
7
4. PRZYKŁADOWE SCENARIUSZE ZAJĘĆ
Scenariusz zajęć 1
Osoba prowadząca.......................................................................................................................
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł: Technika laboratoryjna i analityczna 311[31].O1
Jednostka modułowa: Wykonywanie podstawowych czynności laboratoryjnych 311[31].O1.01
Temat: Przygotowanie roztworów o określonym stężeniu molowym z naważek.
Cel ogólny: kształtowanie umiejętności przygotowania roztworów o określonym stężeniu
molowym.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
obliczyć ilość substancji potrzebnej do przygotowania określonej ilości roztworu o
podanym stężeniu,
−
dobrać sprzęt laboratoryjny do przygotowania roztworu,
−
zorganizować stanowisko pracy,
−
przygotować roztwór.
Metody nauczania – uczenia się:
−
ćwiczenia praktyczne.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 135 minut
Środki dydaktyczne:
−
substancje chemiczne (sole, zasady),
−
woda destylowana,
−
kolby miarowe,
−
naczyńka wagowe,
−
tryskawki,
−
lejki zwykłe,
−
pipetki,
−
waga analityczna.
Przebieg zajęć:
1. Sprawy organizacyjne.
2. Nawiązanie do tematu, omówienie celów zajęć.
3. Realizacja tematu:
−
nauczyciel omawia z uczniami zasady bezpiecznej pracy z substancjami
wybranymi do ćwiczenia, demonstruje sposób postępowania podczas
wykonywania zadania,
−
uczniowie na podstawie instrukcji sporządzania roztworu o stężeniu molowym
obliczają ilość potrzebnej substancji do sporządzenia roztworu, dobierają sprzęt
do wykonania zadania, organizują stanowisko pracy,
−
nauczyciel ocenia wykonane obliczenia i przygotowane przez uczniów stanowiska
pracy,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
8
−
uczniowie, odważają substancje na wagach analitycznych i sporządzają roztwory,
postępując zgodnie z instrukcją.
4. Nauczyciel ocenia dokładność wykonania zadania i technikę pracy uczniów, wskazuje
mocne i słabe strony uczniów.
5. Uczniowie wskazują trudności, jakie napotkali przy wykonywaniu zadania.
Zakończenie zajęć
Praca domowa
Należy przygotować 500 cm
3
roztworu wodorotlenku sodu o stężeniu 0,2 mol dm
-3.
Ustal
zasady bezpiecznej pracy podczas sporządzania roztworu, wykonaj obliczenia i zaproponuj
kolejność czynności.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach
−
anonimowe
ankiety
ewaluacyjne
dotyczące
sposobu
prowadzenia
zajęć
i ukształtowanych umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
9
Scenariusz zajęć 2
Osoba prowadząca.......................................................................................................................
Modułowy program nauczania: Technik technologii chemicznej 311[31]
Moduł: Technika laboratoryjna i analityczna 311[31].O1
Jednostka modułowa: Wykonywanie podstawowych czynności laboratoryjnych 311 [31].O1.01
Temat: Oczyszczanie substancji stałych przez krystalizację.
Cel ogólny: kształtowanie umiejętności oczyszczania substancji stałych przez krystalizację.
Po zakończeniu zajęć edukacyjnych uczeń potrafi:
−
dobrać rozpuszczalnik do rodzaju oczyszczanej substancji,
−
obliczyć ilość rozpuszczalnika do przeprowadzenia procesu krystalizacji,
−
dobrać sprzęt laboratoryjny,
−
zaplanować kolejność czynności,
−
zorganizować stanowisko do przeprowadzenia krystalizacji,
−
oczyścić substancję przez krystalizację.
Metody nauczania – uczenia się:
−
metoda tekstu przewodniego.
Formy organizacyjne pracy uczniów:
−
indywidualna.
Czas: 180 minut.
Środki dydaktyczne:
−
substancje do oczyszczania,
−
rozpuszczalniki,
−
węgiel aktywowany, sączki,
−
sprzęt szklany,
−
źródła ciepła,
−
waga techniczna i odważniki.
Przebieg zajęć:
Zadanie dla ucznia
Oczyść 5 g kwasu benzoesowego metodą krystalizacji.
FAZA WSTĘPNA
Czynności organizacyjno-porządkowe, podanie tematu lekcji, zapoznanie uczniów z pracą
metodą tekstu przewodniego.
FAZA WŁAŚCIWA
INFORMACJE
Zapoznaj się materiałem nauczania w „Poradniku dla ucznia” roz. 4. pkt 4.11.1 i odpowiedz
na pytania.
1. W jakim celu stosowana jest krystalizacja?
2. Jakich zasad należy przestrzegać przy doborze rozpuszczalnika do substancji
oczyszczanej?
3. W jaki sposób określa się rozpuszczalność substancji?

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
10
4. Jak obliczysz ilość rozpuszczalnika potrzebną do krystalizacji określonej substancji?
5. Dlaczego niekiedy podczas krystalizacji dodawany jest węgiel aktywny?
6. Dlaczego w przypadku krystalizacji z rozpuszczalników organicznych proces
rozpuszczania prowadzi się pod chłodnicą zwrotną?
7. Jakich zasad bhp należy przestrzegać podczas krystalizacji z rozpuszczalników
palnych?
PLANOWANIE
1. Dobierz rozpuszczalnik do przeprowadzenia procesu krystalizacji.
2. Oblicz ilość rozpuszczalnika.
3. Zaplanuj sprzęt laboratoryjny.
4. Zaplanuj kolejność czynności cele przeprowadzenia procesu krystalizacji.
5. Przygotuj stanowisko pracy.
6. Ustal zasady bezpiecznej pracy.
UZGODNIENIE
1. Omów wszystkie punkty z fazy planowania z nauczycielem.
2. Odnieś się do uwag i propozycji nauczyciela.
WYKONANIE
Przeprowadź proces oczyszczania kwasu benzoesowego zgodnie z przygotowanym planem
działania.
SPRAWDZENIE
1. Przy pomocy nauczyciela oceń czystość otrzymanego preparatu..
2. Wskaż przyczyny błędów.
ANALIZA
Uczniowie wraz z nauczycielem wskazują, które etapy ćwiczenia sprawiły im najwięcej
trudności. Ustalają przyczyny popełnionych błędów.
Zakończenie zajęć
Praca domowa
Korzystając z dostępnych źródeł informacji, wskaż zastosowanie procesu krystalizacji
w przemyśle chemicznym i spożywczym.
Sposób uzyskania informacji zwrotnej od ucznia po zakończonych zajęciach
−
anonimowe
ankiety
ewaluacyjne
dotyczące
sposobu
prowadzenia
zajęć
i ukształtowanych umiejętności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
11
5. ĆWICZENIA
5.1. Wyposażenie i zasady pracy w laboratorium chemicznym
5.1.1. Ćwiczenia
Ćwiczenie 1
Płonie rozlana ciecz w pobliżu palącego się palnika. Zaproponuj sposób ugaszenia ognia.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, uczniowie powinni zapoznać się
z instrukcją przeciwpożarową znajdującą się w pracowni.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zaplanować właściwą kolejność czynności,
2) dobrać odpowiedni sprzęt przeciwpożarowy,
3) zapoznać się z obsługą podstawowego sprzętu przeciwpożarowego.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
sprzęt gaśniczy,
−
instrukcje obsługi sprzętu gaśniczego.
Ćwiczenie 2
Osoba została porażona prądem elektrycznym. Zaproponuj sposób udzielenia pierwszej
pomocy.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia
należy omówić z uczniami sytuacje,
w których może wystąpić porażenie prądem elektrycznym.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją udzielania pierwszej pomocy osobie rażonej prądem
elektrycznym,
2) zaplanować sposób udzielenia pierwszej pomocy,
3) zastosować się do pleceń zawartych w instrukcji.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem.
Środki dydaktyczne:
−
instrukcje udzielania pierwszej pomocy osobie rażonej prądem elektrycznym.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
12
5.2. Podstawowy sprzęt laboratoryjny. Mycie i suszenie naczyń
laboratoryjnych
5.2.1. Ćwiczenia
Ćwiczenie 1
Umyj i wysusz: kolbę stożkową, szkiełko zegarkowe, zlewkę, cylinder miarowy. Stosuj
odpowiednią kolejność doboru środków myjących i zasady bezpiecznej pracy.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją mycia sprzętu szklanego,
2) zorganizować stanowisko pracy do wykonania ćwiczenia,
3) zastosować się do poleceń zawartych w instrukcji mycia szkła, suszenia,
4) dobrać odpowiedni sposób suszenia szkła,
5) wykonać ćwiczenie z uwzględnieniem przepisów bhp.
Zalecane metody nauczania–uczenia się:
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
sprzęt szklany,
−
środki myjące,
−
szczotki do mycia naczyń,
−
deska do suszenia naczyń.
Ćwiczenie 2
Umyj kolbę miarową mieszaniną chromową.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją mycia sprzętu szklanego mieszaniną chromową,
2) dobrać środki ochrony osobistej,
3) zorganizować stanowisko pracy do wykonania ćwiczenia,
4) wykonać ćwiczenie z uwzględnieniem przepisów bhp.
Zalecane metody nauczania–uczenia się:
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
środki ochrony osobistej,
−
lejek zwykły,
−
mieszanina chromowa.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
13
5.3. Substancje stosowane w laboratorium chemicznym
5.3.1.Ćwiczenia
Ćwiczenie 1
Rozpoznaj znaki i symbole na etykiecie wodorotlenku sodu.
Wskazówki do realizacji:
Przed przystąpieniem do ćwiczenia, uczniowie powinni zapoznać się ze zbiorem Kart
charakterystyk substancji niebezpiecznej i preparatu niebezpiecznego znajdującym się
w pracowni chemicznej.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) narysować etykietę z opakowania,
2) zapisać znaki ostrzegawcze i ich znaczenie,
3) zapisać symbole ostrzegawcze ich znaczenie,
4) podać sposób udzielania pierwszej pomocy w razie nieszczęśliwego wypadku podczas
pracy z wodorotlenkiem sodu.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem.
Środki dydaktyczne:
−
linijka, ołówek,
−
puste opakowanie z etykietą,
−
aktualne Rozporządzenia Ministra Zdrowia dotyczące oznakowania substancji
niebezpiecznych.
Ćwiczenie 2
Oznakuj opakowanie z kwasem siarkowym (VI) o stężeniu 91%.
Wskazówki do realizacji:
Przed przystąpieniem do ćwiczenia uczniowie powinni zapoznać się ze sposobem
oznakowania odczynników chemicznych przez producentów.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z Kartą charakterystyki substancji niebezpiecznej i preparatu
niebezpiecznego. Kwas siarkowy 91%,
2) na podstawie Karty charakterystyki zapisać:
−
nazwę substancji oraz nazwę i adres producenta,
−
znak ostrzegawczy zagrożenia, jego symbol i znaczenie, zwroty S i R i ich
określenia,
−
sposób udzielania pierwszej pomocy,
3) narysować etykietę,
4) porównać etykietę firmową z narysowaną.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
14
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
karta charakterystyki substancji,
−
linijka, ołówek,
−
puste opakowanie z etykietą.
Ćwiczenie 3
Dobierz środki ochrony indywidualnej podczas pracy ze stałym wodorotlenkiem sodu.
Wskazówki do realizacji:
Przed przystąpieniem do ćwiczenia, uczeń powinien zapoznać się ze środkami ochrony
indywidualnej znajdującymi się w pracowni chemicznej i miejscem ich przechowywania.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z Kartą charakterystyki substancji niebezpiecznej i preparatu
niebezpiecznego. Sodu wodorotlenek,
2) dobrać środki ochrony indywidualnej:
−
ochrona dróg oddechowych,
−
ochrona oczu,
−
ochrona rąk,
−
ochrona ciała,
−
środki ochronne i higieny.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem.
Środki dydaktyczne:
−
Karta charakterystyki substancji niebezpiecznej i preparatu niebezpiecznego. Sodu
wodorotlenek.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
15
5.4. Technika ważenia na wagach technicznych i analitycznych
5.4.1. Ćwiczenia
Ćwiczenie 1
Zważ naczyńko wagowe na wadze technicznej.
Wskazówki do realizacji:
Przed przystąpieniem do ćwiczenia, nauczyciel powinien zademonstrować technikę
ważenia na wadze technicznej.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją ważenia na wadze technicznej,
2) zorganizować stanowisko pracy,
3) zważyć naczyńko wagowe na wadze technicznej zgodnie z instrukcją,
4) zapisać wynik ważenia.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
waga techniczna z odważnikami,
−
naczyńko wagowe.
Ćwiczenie 2
Zważ naczyńko z solą kuchenną na wadze analitycznej.
Wskazówki do realizacji:
Przed przystąpieniem do ćwiczenia, nauczyciel powinien zademonstrować technikę
ważenia na wadze analitycznej.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją ważenia na wadze analitycznej,
2) zważyć naczyńko wagowe z solą na wadze technicznej,
3) zapisać wynik ważenia,
4) zważyć naczyńko wagowe z solą na wadze analitycznej zgodnie z instrukcją,
5) zapisać wynik ważenia,
6) porównać otrzymane wyniki i zapisać wnioski.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
waga techniczna i odważniki,
−
waga analityczna,
−
naczyńko wagowe z solą kuchenną.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
16
5.5. Technika odmierzania objętości cieczy
5.5.1. Ćwiczenia
Ćwiczenie 1
Odmierz 17 cm
3
wody, oblicz błąd względny odmierzania.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać naczynie miarowe o odpowiedniej pojemności,
2) odmierzyć objętość według dolnej linii menisku,
3) podać dokładność pomiaru,
4) obliczyć błąd względny odmierzania.
5) opisać tok postępowania w dzienniczku.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
cylinder miarowy,
−
tryskawka z wodą.
Ćwiczenie 2
Wybierz cylinder i odmierz 0,27 dm
3
roztworu chlorku niklu mając do dyspozycji
cylindry o pojemnościach: 1 dm
3
, 500 cm
3
, 250 cm
3
, 100 cm
3
.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać cylinder o stosownej objętości,
2) odmierzyć roztwór według górnej linii menisku,
3) bezpiecznie wykonać ćwiczenie,
4) przelać roztwór do oznakowanej butelki,
5) udokumentować wykonanie ćwiczenia w dzienniczku.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
cylindry,
−
butelka,
−
roztwór chlorku niklu.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
17
5.6. Przygotowywanie roztworów wodnych o określonych
stężeniach
5.6.1. Ćwiczenia
Ćwiczenie 1
Przygotuj 150g wodnego roztworu soli kuchennej o stężeniu 2%.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją sporządzania roztworu o stężeniu procentowym,
2) dobrać sprzęt niezbędny do wykonania ćwiczenia,
3) obliczyć potrzebną masę soli kuchennej i objętość wody, przyjmując gęstość wody
d = 1 g cm
-1
,
4) sporządzić roztwór zgodnie z instrukcją.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
waga techniczna i odważniki,
−
sól kuchenna,
−
sprzęt laboratoryjny: cylinder miarowy, szkiełko zegarkowe, zlewka, bagietka, butelka,
łyżeczka.
Ćwiczenie 2
Przygotuj 250 cm
3
wodnego roztworu soli kuchennej o stężeniu 0,1 mol · dm
-3
.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z instrukcją sporządzania roztworu o stężeniu molowym,
2) dobrać sprzęt niezbędny do wykonania ćwiczenia,
3) obliczyć potrzebną masę soli kuchennej,
4) sporządzić roztwór zgodnie z instrukcją.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia praktyczne.
Środki dydaktyczne:
−
waga analityczna
−
sól kuchenna
−
sprzęt laboratoryjny: kolba miarowa, naczyńko wagowe, tryskawka, lejek zwykły, łyżeczka.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
18
5.7. Laboratoryjne metody ogrzewania
5.7.1. Ćwiczenia
Ćwiczenie 1
Odparuj rozpuszczalnik z wodnego roztworu sacharozy.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać racjonalny sposób ogrzewania,
2) dobrać sprzęt laboratoryjny,
3) zaplanować czynności laboratoryjne,
4) przygotować stanowisko pracy,
5) odparować wodę z roztworu z zachowaniem przepisów bhp i ppoż.,
6) udokumentować wykonywane czynności.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
sprzęt porcelanowy i metalowy,
−
wodny roztwór cukru.
Ćwiczenie 2
Ogrzej 50 cm
3
denaturatu do temperatury wrzenia na łaźni wodnej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać sprzęt laboratoryjny,
2) zaplanować czynności laboratoryjne,
3) przygotować stanowisko pracy,
4) zmontować zestaw do ogrzewania pod chłodnicą zwrotną,
5) ogrzać do temperatury wrzenia z zachowaniem przepisów bhp,
6) udokumentować wykonywane czynności.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem
,
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
zestaw do ogrzewania pod chłodnicą zwrotną,
−
łaźnia wodna,
−
szkło laboratoryjne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
19
5.8. Laboratoryjne metody suszenia i prażenia
5.8.1. Ćwiczenia
Ćwiczenie 1
Wysusz w eksykatorze 2 g Na
2
CO
3
· 10H
2
O.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zaplanować sprzęt laboratoryjny,
2) odważyć 2 g otrzymanej substancji na szkiełku zegarkowym,
3) przygotować eksykator:
−
sprawdzić czystość eksykatora,
−
umieścić środek suszący na dnie eksykatora,
−
posmarować brzeg pokrywy wazeliną,
4) umieścić odważoną substancję w eksykatorze,
5) pozostawić w eksykatorze substancję na okres jednego tygodnia,
6) ponownie zważyć substancję (wyjmować szkiełko, stosując szczypce),
7) porównać wyniki ważeń i zapisać wnioski.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
waga techniczna i odważniki,
−
szkiełko zegarkowe,
−
eksykator,
−
łyżeczka,
−
substancja higroskopijna pochłaniająca wilgoć,
−
substancja suszona.
Ćwiczenie 2
Wysusz 3 g CuSO
4
· 5H
2
O w suszarce elektrycznej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zaplanować sprzęt i aparaturę,
2) zapoznać się z instrukcją obsługi suszarki,
3) zaplanować kolejność czynności,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
20
4) odważyć substancję na szkiełku zegarkowym,
5) uruchomić suszarkę zgodnie z instrukcją obsługi,
6) suszyć substancję przez 2 godziny w temperaturze 105
0
C,
7) przenieść szczypcami szkiełko z substancją do eksykatora,
8) studzić przez pół godziny,
9) zważyć substancję ze szkiełkiem,
10) porównać wyniki ważenia i zapisać wnioski.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
suszarka elektryczna,
−
waga z odważnikami,
−
sprzęt laboratoryjny,
−
substancja suszona.
Ćwiczenie 3
Wypraż 1 g węglanu wapnia w piecu.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać sprzęt i urządzenie,
2) odczytać z Kalendarza chemicznego temperaturę rozkładu substancji,
3) odważyć na wadze analitycznej 1g substancji,
4) wstawić tygiel z substancją do pieca,
5) prażyć w temperaturze rozkładu przez 3 godziny,
6) przestrzegać przepisy bhp przy prażeniu,
7) studzić przez godzinę w eksykatorze,
8) zważyć tygielek z substancją na wadze analitycznej,
9) obliczyć ubytek masy,
10) porównać z masą obliczoną według równania reakcji i zapisać wnioski.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia praktyczne.
Środki dydaktyczne:
−
piec elektryczny,
−
waga analityczna,
−
sprzęt laboratoryjny,
−
substancja prażona.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
21
5.9. Laboratoryjne metody chłodzenia
5.9.1. Ćwiczenia
Ćwiczenie 1
Ochłodź roztwór alkoholu etylowego do temperatury – 30
o
C.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać sprzęt, przyrządy pomiarowe i urządzenie,
2) zaplanować wykonywane czynności,
3) zorganizować stanowisko pracy,
4) zmontować zestaw laboratoryjny do oziębiania cieczy według rys. 13 (Poradnik dla
ucznia),
5) dobrać składniki mieszaniny oziębiającej,
6) przygotować mieszaninę oziębiającą,
7) ochłodzić roztwór alkoholu etylowego do podanej temperatury.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
waga techniczna z odważnikami,
−
sprzęt laboratoryjny,
−
termometry,
−
substancje chemiczne,
−
mieszanina do oziębiania.
Ćwiczenie 2
Oblicz masy składników potrzebnych do przygotowania 300 g mieszaniny oziębiającej,
której użyjesz do schłodzenia cieczy do temperatury – 250
o
C.
Wskazówki do realizacji:
Aby wykonać to ćwiczenie, uczniowie powinni sprawnie korzystać z różnych źródeł
informacji.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) odczytać informację o składzie mieszaniny oziębiającej,
2) obliczyć łączną masę mieszaniny oziębiającej,
3) obliczyć masę lodu potrzebną do przygotowania 300 g mieszaniny,
4) obliczyć masę KNO
3
potrzebną do przygotowania 300 g mieszaniny,
5) obliczyć masę NH
4
NO
3
potrzebną do przygotowania 300 g mieszaniny,
6) zapisać obliczenia w dzienniczku.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
22
Zalecane metody nauczania–uczenia się:
−
ćwiczenia obliczeniowe.
Środki dydaktyczne:
−
Kalendarz chemiczny, Poradnik laboranta chemika, Poradnik fizykochemiczny.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
23
5.10. Rozdzielanie mieszanin niejednorodnych: dekantacja,
sączenie, wirowanie
5.10.1. Ćwiczenia
Ćwiczenie 1
Rozdziel zawiesinę kredy w wodzie z zastosowaniem sączenia na sączku karbowanym.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zaplanować szkło laboratoryjne i sprzęt,
2) przygotować z bibuły filtracyjnej sączek karbowany według rysunku nr 14 (Poradnik dla
ucznia),
3) zmontować zestaw do sączenia,
4) umieścić sączek karbowany w lejku,
5) przesączyć zawiesinę (wlewać tak, by nie dostała się między sączek a lejek),
6) zdemontować zestaw i umyć.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
zestaw do sączenia,
−
sączek karbowany,
−
zawiesina.
Ćwiczenie 2
Rozdziel zawiesinę kredy w wodzie pod zmniejszonym ciśnieniem.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) dobrać sprzęt laboratoryjny,
2) zapoznać się z zasadami obowiązującymi podczas sączenia pod zmniejszonym
ciśnieniem,
3) zaplanować czynności wykonywane,
4) zorganizować stanowisko pracy,
5) zmontować zestaw do sączenia pod zmniejszonym ciśnieniem,
6) założyć sączek,
7) przesączyć przestrzegając zasad właściwego sączenia,
8) zdemontować zestaw według poznanej kolejności.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
24
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
zestaw do sączenia pod zmniejszonym ciśnieniem,
−
bibuła filtracyjna,
−
zawiesina.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
25
5.11. Rozdzielanie mieszanin jednorodnych – krystalizacja
5.11.1. Ćwiczenia
Ćwiczenie 1
Oczyść 5 g kwasu benzoesowego.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) odczytać z Kalendarza chemicznego rozpuszczalność kwasu benzoesowego w wodzie
zimnej i gorącej,
2) obliczyć ilość wody potrzebnej do sporządzenia nasyconego roztworu kwasu w gorącej
wodzie,
3) zaplanować sprzęt laboratoryjny,
4) zaplanować czynności laboratoryjne,
5) przygotować stanowisko pracy,
6) przekrystalizować zanieczyszczony kwas według kolejności przedstawionej w materiale
informacyjnym,
7) stosować przepisy bhp.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
sprzęt szklany,
−
waga techniczna i odważniki,
−
Kalendarz Chemiczny,
−
źródło ciepła,
−
kwas benzoesowy,
−
węgiel aktywowany, sączki.
Ćwiczenie 2
Oczyść 2 g m-dinitrobenzenu. Jako rozpuszczalnika użyj alkoholu etylowego.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) oznaczyć rozpuszczalność substancji:
−
odważyć 0,5 g substancji,
−
dodawać z biurety do probówki taką ilość alkoholu, aby substancja się rozpuściła,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
26
−
ogrzewać na łaźni wodnej (temperatura 80
0
C),
−
obliczyć rozpuszczalność znając ilość dodanego alkoholu,
2) zmontować zestaw do ogrzewania pod chłodnicą zwrotną,
3) obliczyć ilość alkoholu niezbędną do oczyszczenia 2g substancji,
4) odważyć 2 g substancji i wsypać do kolby kulistej,
5) wrzucić porcelankę i dodać odmierzony alkohol,
6) kolbę zakryć chłodnicą zwrotną,
7) podłączyć wodę do chłodnicy,
8) ogrzewać w czaszy grzejnej 5 – 15 minut (łagodne wrzenie),
9) przygotować zestaw do sączenia pod próżnią,
10) gorący roztwór szybko przesączyć,
11) przesącz pozostawić do krystalizacji,
12) wydzielone kryształy odsączyć i wysuszyć w krystalizatorze zważyć i obliczyć
wydajność,
13) rozpuszczalnik wlać do butelki i pozostawić do regeneracji (nakleić etykietę),
14) podczas wykonywania ćwiczenia stosować zasady bezpiecznej pracy.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
sprzęt szklany,
−
waga i odważniki,
−
czasza grzewcza,
−
zestaw do ogrzewania pod chłodnicą zwrotną,
−
sprzęt metalowy,
−
zestaw do sączenia pod zmniejszonym ciśnieniem,
−
substancja oczyszczana i rozpuszczalnik.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
27
5.12. Rozdzielanie mieszanin jednorodnych – sublimacja
5.12.1. Ćwiczenia
Ćwiczenie 1
Oczyść przez sublimację 2 g jodu.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) odczytać z Kalendarza chemicznego temperaturę sublimacji jodu,
2) dobrać odpowiedni sprzęt,
3) zmontować zestaw zgodnie z rysunkiem 17 (Poradnik dla ucznia),
4) odważyć 2 g jodu na wadze technicznej,
5) umieścić jod w zbiorniku do ogrzewania substancji stałej,
6) ogrzewać łagodnie zbiornik,
7) ochładzać odbieralnik,
8) obserwować proces (zapisać spostrzeżenia),
9) zakończyć proces wyłączając ogrzewanie,
10) resublimat zważyć na szkiełku zegarkowym i obliczyć wydajność,
11) pracować pod włączonym wyciągiem (szkodliwe pary jodu).
Zalecane metody nauczania–uczenia się:
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
waga techniczna z odważnikami,
−
zestaw do sublimacji,
−
źródło ciepła,
−
sprzęt metalowy,
−
jod.
Ćwiczenie 2
Oczyść 0,5 g zanieczyszczonego naftalenu mając do dyspozycji parownicę i lejek.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) odczytać temperaturę topnienia naftalenu z Kalendarza chemicznego,
2) zaproponować stanowisko pracy,
3) dobrać źródło ogrzewania,
4) dobrać miejsce wykonania ćwiczenia,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
28
5) zmontować zestaw do sublimacji
6) przeprowadzić proces sublimacji z zachowaniem przepisów bhp,
7) obserwować resublimację,
8) zakończyć sublimację wyłączając ogrzewanie,
9) zdjąć lejek zachowując przepisy bhp,
10) przenieść substancję z lejka do słoika z etykietą.
Zalecane metody nauczania–uczenia się:
−
ćwiczenia laboratoryjne.
Środki dydaktyczne:
−
Kalendarz chemiczny,
−
dygestorium,
−
szkło laboratoryjne,
−
źródło ogrzewania,
−
rękawice ochronne,
−
naftalen.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
29
5.13. Rozdzielanie mieszanin jednorodnych – ekstrakcja
5.13.1. Ćwiczenia
Ćwiczenie 1
Przeprowadź proces ługowania cukru z 10 g buraka cukrowego stosując aparat Soxhleta.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zaplanować sprzęt szklany i metalowy,
2) zaprojektować stanowisko pracy,
3) zapoznać się z instrukcją prowadzenia operacji ługowania,
4) zaplanować czynności,
5) wykonać ługowanie zgodnie z instrukcją zawartą w materiale,
6) zastosować zasady bezpiecznej pracy.
Zalecane metody nauczania–uczenia się:
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
aparat Soxhleta,
−
sprzęt metalowy,
−
bibuła, wata,
−
waga techniczna z odważnikami,
−
burak cukrowy.
Ćwiczenie 2
Przeprowadź ekstrakcję soli kobaltu z wodnego roztworu alkoholem amylowym.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) odczytać w Kalendarzu chemicznym temperaturę wrzenia i gęstość alkoholu amylowego,
2) zorganizować stanowisko pracy,
3) odmierzyć 3 cm
3
roztworu soli kobaltu, wlać do zlewki i dodać 6 cm
3
wodnego roztworu
izotiocyjanku amonu,
4) dokonać konserwacji rozdzielacza (posmarować szlify smarem),
5) wymieszać roztwór i przelać do rozdzielacza,
6) dodawać porcje, po 10 cm
3
alkoholu amylowego i wytrząsać,
7) zamontować rozdzielacz na statywie i pozostawić do rozdzielenia warstw,
8) spuścić dolną warstwę do butelki,

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
30
9) powtarzać ekstrakcję kilkakrotnie, nowa porcją rozpuszczalnika,
10) zakończyć proces ekstrakcji po odbarwieniu warstwy wodnej,
11) pozostawić ekstrakt do regeneracji rozpuszczalnika.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem
,
−
metoda tekstu przewodniego.
Środki dydaktyczne:
−
sprzęt szklany,
−
sprzęt metalowy,
−
odczynniki chemiczne.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
31
5.14. Rozdzielanie mieszanin jednorodnych – destylacja
5.14.1. Ćwiczenia
Ćwiczenie 1
Otrzymaj 1 dm
3
wody destylowanej w destylarce.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z budową destylarki,
2) zapoznać się z obsługą destylarki,
3) sprawdzić stan techniczny destylarki,
4) uruchomić destylarkę zgodnie z obsługa, zachowując przepisy bhp,
5) odbierać pierwszą porcję wody do oddzielnego naczynia,
6) zebrać 1 dm
3
wody destylowanej do butli odpowiednio oznakowanej,
7) wyłączyć ogrzewanie,
8) zamknąć dopływ wody po spłynięciu ostatniej kropli destylatu.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia praktyczne.
Środki dydaktyczne:
−
instrukcja obsługi destylarki,
−
destylarka elektryczna,
−
butla do wody.
Ćwiczenie 2
Zmontuj zestaw do destylacji prostej.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zapoznać się z rysunkiem przedstawiającym zestaw do destylacji prostej,
2) dobrać sprzęt laboratoryjny do montażu zestawu,
3) zorganizować stanowisko pracy,
4) zapoznać się z instrukcją montażu zestawu do destylacji prostej,
5) sprawdzić stan sprzętu do montażu ,
6) posmarować złącza szlifowe smarem,
7) zmontować zestaw do destylacji prostej.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
32
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia praktyczne.
Środki dydaktyczne:
−
sprzęt szklany,
−
sprzęt metalowy,
−
węże,
−
termometr,
−
smar.
Ćwiczenie 3
Przeprowadź regenerację rozpuszczalników metodą destylacji.
Wskazówki do realizacji:
Przed przystąpieniem do realizacji ćwiczenia, nauczyciel powinien omówić jego zakres
i techniki wykonania. Zapoznać uczniów z zasadami bezpiecznej pracy.
Sposób wykonania ćwiczenia
Uczeń powinien:
1) zmontować zestaw do destylacji prostej,
2) zapoznać się z instrukcją prowadzenia destylacji i zasadami bezpiecznej pracy,
3) sprawdzić szczelność aparatury,
4) dobrać źródło ciepła,
5) odmierzyć regenerowany rozpuszczalnik,
6) wlać rozpuszczalnik do kolby (2/3 pojemności),
7) wrzucić do kolby kamyki wrzenne,
8) umieścić prawidłowo termometr w kolbie,
9) włączyć ogrzewanie,
10) zebrać frakcję główną w stałej temperaturze zgodnej z temperaturą wrzenia czystej
substancji,
11) zakończyć destylację, odłączyć źródło ogrzewania,
12) zestaw ostudzić,
13) zamknąć dopływ wody chłodzącej,
14) rozmontować zestaw,
15) zebraną frakcję główną wlać do oznakowanej butelki pod wyciągiem,
16) umyć elementy zestawu.
Zalecane metody nauczania–uczenia się:
−
pokaz z objaśnieniem,
−
ćwiczenia praktyczne.
Środki dydaktyczne:
−
zestaw do destylacji prostej,
−
źródło ogrzewania,
−
regenerowany rozpuszczalnik,
−
kamyki wrzenne,
−
oznakowana butelka.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
33
6. EWALUACJA OSIĄGNIĘĆ UCZNIÓW
Przykłady narzędzi pomiaru dydaktycznego
Test dwustopniowy do jednostki modułowej
„Stosowanie układów
automatyki i sterownia”
Test składa się z 20 zadań wielokrotnego wyboru, z których:
−
zadania 1, 2, 3, , 5, 6, 7, 8, 9, 10, 17, 18, 19, są z poziomu podstawowego,
−
zadania 4, , 11, 12, 13, 14, 15, 16, 20.są z poziomu ponadpodstawowego.
Punktacja zadań: 0 lub 1 punkt
Za każdą prawidłową odpowiedź uczeń otrzymuje 1 punkt. Za złą odpowiedź lub jej brak
uczeń otrzymuje 0 punktów.
Proponuje się następujące normy wymagań – uczeń otrzyma następujące
oceny szkolne:
−
dopuszczający – za rozwiązanie co najmniej 9 zadań z poziomu podstawowego,
−
dostateczny – za rozwiązanie co najmniej 13 zadań z poziomu podstawowego,
−
dobry – za rozwiązanie 16 zadań, w tym co najmniej 3 z poziomu ponadpodstawowego,
−
bardzo dobry – za rozwiązanie 19 zadań, w tym co najmniej 6 z poziomu
ponadpodstawowego.
Klucz odpowiedzi: 1. a, 2. d, 3. a, 4.c, 5.b, 6.b, 7.d, 8.a, 9.b, 10.d, 11.b, 12.c,
13.c, 14.b, 15.c, 16.b, 17.d, 18.c, 19.a, 20.d
Plan testu
Nr
zadania
Cel operacyjny
( mierzone osiągnięcia ucznia)
Kategoria
celu
Poziom
wymagań
Poprawna
odpowiedź
1. Wskazywać naczynia miarowe
stosowane w laboratorium chemicznym
A
P
a
2. Dobrać temperaturę wody do mycia
naczyń miarowych
B
P
d
3. Dobrać cylinder miarowy do
odmierzenia określonej objętości cieczy
B
P
a
4. Wybrać najszybszy sposób oddzielania
osadu od roztworu
D
PP
c
5. Dobrać środek gaśniczy do gaszenia
urządzenia elektrycznego znajdującego
się pod napięciem
B
P
b
6. Wskazać sposób postępowania podczas
udzielania pierwszej pomocy osobie
porażonej prądem elektrycznym
C
P
b
7. Wskazać źródła informacji o
właściwościach i zagrożeniach
C
P
d
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
34
wynikających ze stosowania substancji
niebezpiecznych
8. Rozpoznawać zagrożenia wynikające ze
stosowania substancji niebezpiecznych
na podstawie podanego symbolu ze
znakiem ostrzegawczym na opakowaniu
B
P
a
9. Wskazać sytuację w laboratorium, w
której należy zastosować środki ochrony
osobistej
C
P
b
10. Dobrać sposób ogrzewania cieczy palnej
C
P
d
11. Dobrać rozpuszczalnik do
przeprowadzenia procesu krystalizacji
C
PP
b
12. Dobrać aparaturę do przeprowadzenia
procesu sublimacji
C
PP
c
13. Dobrać warunki do prawidłowego
przebiegu procesu destylacji
C
PP
c
14. Obliczyć ilość substancji I
rozpuszczalnika do przygotowania
roztworu o określonym stężeniu
procentowym
C
PP
b
15. Ustalić sposób sporządzenia roztworu o
określonym stężeniu molowym
C
PP
c
16. Dobrać zestaw laboratoryjny do
przeprowadzenia procesu regeneracji
rozpuszczalnika
C
PP
b
17. Wskazać dokładność z jaką może być
odważona substancja na wadze
technicznej
B
P
d
18. Podać masę substancji na podstawie
ilości i masy odważników ustawionych
na szalce wagi
B
P
c
19. Dobrać zestaw laboratoryjny do
przeprowadzenia procesu ługowania
B
P
a
20. Dobrać rozpuszczalnik do
przeprowadzenia procesu ekstrakcji z
cieczy
C
PP
d

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
35
Przebieg testowania
Instrukcja dla nauczyciela
1. Omów z uczniami sposób udzielania odpowiedzi .
2. Zapewnij uczniom możliwość samodzielnej pracy.
3. Rozdaj uczniom zestawy zadań testowych i karty odpowiedzi.
4. Podaj czas przeznaczony na udzielanie odpowiedzi.
5. Zbierz zestawy zadań testowych i sprawdź testy.
6. Przeprowadź analizę uzyskanych wyników sprawdzianu i wybierz te zadania, które
sprawiły uczniom największe trudności.
7. Ustal przyczyny trudności uczniów w opanowaniu wiadomości i umiejętności.
8. Opracuj wnioski do dalszego postępowania, mającego na celu uniknięcie niepowodzeń
dydaktycznych.
Instrukcja dla ucznia
1. Przeczytaj uważnie instrukcję.
2. Podpisz imieniem i nazwiskiem kartę odpowiedzi.
3. Zapoznaj się z zestawem pytań testowych.
4. Tyko jedna odpowiedź jest prawidłowa
5. Prawidłową odpowiedź zaznacz X.
6. Jeśli się pomylisz, zaznacz kółkiem i wstaw X przy poprawnej.
Powodzenia
Materiały dla ucznia:
-
instrukcja,
-
zestaw zadań testowych,
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
36
ZESTAW ZADAŃ TESTOWYCH
1. Do sprzętu szklanego, miarowego zalicza się:
a) zlewkę,
b) cylinder,
c) kolbę stożkową,
d) naczyńko wagowe.
2. Gorącą wodą nie można myć:
a) zlewki,
b) szkiełka zegarkowego,
c) kolby stożkowej,
d) kolby miarowej.
3. 70 cm
3
wody należy odmierzyć w cylindrze o pojemności:
a) 100 cm
3
,
b) 250 cm
3
,
c) 500 cm
3
,
d) 1 dm
3
.
4. Proces oddzielania osadu od roztworu zachodzi najszybciej podczas:
a) sączenia na sączku zwykłym,
b) sączenia na sączku karbowanym,
c) sączenia pod zmniejszonym ciśnieniem,
d) wirowania.
5. Płonącego urządzenia elektrycznego, znajdującego się pod napięciem nie wolno gasić:
a) piaskiem,
b) wodą,
c) kocem,
d) gaśnicą śniegową.
6. W przypadku porażenia prądem elektrycznym, w pierwszej kolejności należy:
a) zapewnić dopływ świeżego powietrza,
b) przerwać dopływ prądu do poszkodowanego,
c) założyć jałowy opatrunek,
d) zapewnić pomoc lekarską.
7. Przed przystąpieniem do pracy z substancją niebezpieczną należy zapoznać się z jej
właściwościami i zagrożeniami na podstawie:
a) Kalendarza chemicznego,
b) podręcznika,
c) Poradnika chemicznego,
d) karty charakterystyki substancji niebezpiecznej.
8. Symbol C z odpowiednim znakiem ostrzegawczym na opakowaniu substancji
oznacza, że jest to substancja żrąca, które określenie zagrożenia on podaje:
a) powoduje poważne oparzenia,
b) substancja wysoce łatwo palna,
c) działa szkodliwie na drogi oddechowe,
d) reaguje gwałtownie z wodą.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
37
9. Środki ochrony osobistej należy stosować podczas pracy z:
a) cieczami bezpiecznymi,
b) stężonymi kwasami, stężonymi zasadami,
c) substancjami bezpiecznymi,
d) odmierzania wody.
10. Do ogrzewania cieczy palnej nie wolno używać:
a) maszynki elektrycznej,
b) łaźni wodnej,
c) czaszy grzewczej,
d) palnika.
11. Dobry rozpuszczalnik stosowany do krystalizacji powinien:
a) reagować z substancją,
b) dobrze rozpuszczać substancję oczyszczaną na gorąco, a słabo na zimno,
c) ulegać rozkładowi w wyższej temperaturze,
d) dobrze rozpuszczać zanieczyszczenia.
12. Proces sublimacji przeprowadza się:
a) w szczelnej aparaturze do oczyszczenia substancji sublimującej,
b) w otwartych naczyniach dla każdej substancji,
c) w szczelnej aparaturze do oczyszczania cieczy,
d) w otwartych naczyniach do oczyszczania cieczy.
13. Przed przystąpieniem do procesu destylacji nie należy:
a) wrzucić kamyki wrzenne,
b) sprawdzić szczelność aparatury,
c) wypełnić kolbę destylowaną cieczą do pełna,
d) dobrać odpowiedni sposób ogrzewania.
14. Do sporządzenia 200 g roztworu NaCl o stężeniu 5% należy użyć:
a) 10 g NaCl i 200 g wody,
b) 10 g NaCl i 190 cm
3
wody,
c) 20 g NaCl i 180 cm
3
wody,
d) 5 g NaCl i 200 g wody.
15. W celu prawidłowego sporządzenia roztworu o określonym stężeniu molowym należy:
a) obliczyć potrzebną ilość substancji, sporządzić odważkę, wsypać do zlewki i dodać
obliczoną ilość wody,
b) obliczyć potrzebną ilość substancji, sporządzić odważkę, wsypać do cylindra i
uzupełnić wodą do żądanej objętości,
c) obliczyć potrzebną ilość substancji, sporządzić odważkę na wadze analitycznej,
przenieść ilościowo do kolby miarowej i uzupełnić wodą do kreski,
d) obliczyć potrzebną ilość substancji, sporządzić odważkę na wadze technicznej,
wsypać do kolby miarowej i uzupełnić wodą do kreski.
16. Regenerację rozpuszczalników przeprowadza się z zastosowaniem:
a) zestawu do sączenia,
b) zestawu do destylacji,
c) zestawu do sublimacji,
d) zestawu do krystalizacji.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
38
17. Na wadze technicznej można zważyć substancję z dokładnością:
a) 5 g
b) 1 g
c) 0,1 mg
d) 10 mg.
18. Na szalce wagi technicznej umieszczono odważniki: 10 g, 5 g, 500 mg, 100 mg, 2 g,
50 mg, masa wszystkich odważników wynosi:
a) 15, 65 g,
b) 17, 55 g
c) 17,65 g,
d) 15,60 g.
19. Proces ługowania w sposób ciągły przeprowadza się w:
a) aparacie Soxhleta,
b) rozdzielaczu z korkiem,
c) zlewce,
d) cylindrze.
20. Dobry rozpuszczalnik stosowany do ekstrakcji z cieczy powinien:
a) charakteryzować się wysoką temperaturą wrzenia,
b) tworzyć emulsję z surówką,
c) wykazywać się małą różnicą gęstości w stosunku do surówki i rafinatu,
d) rozpuszczać tylko składnik ekstrahowany.
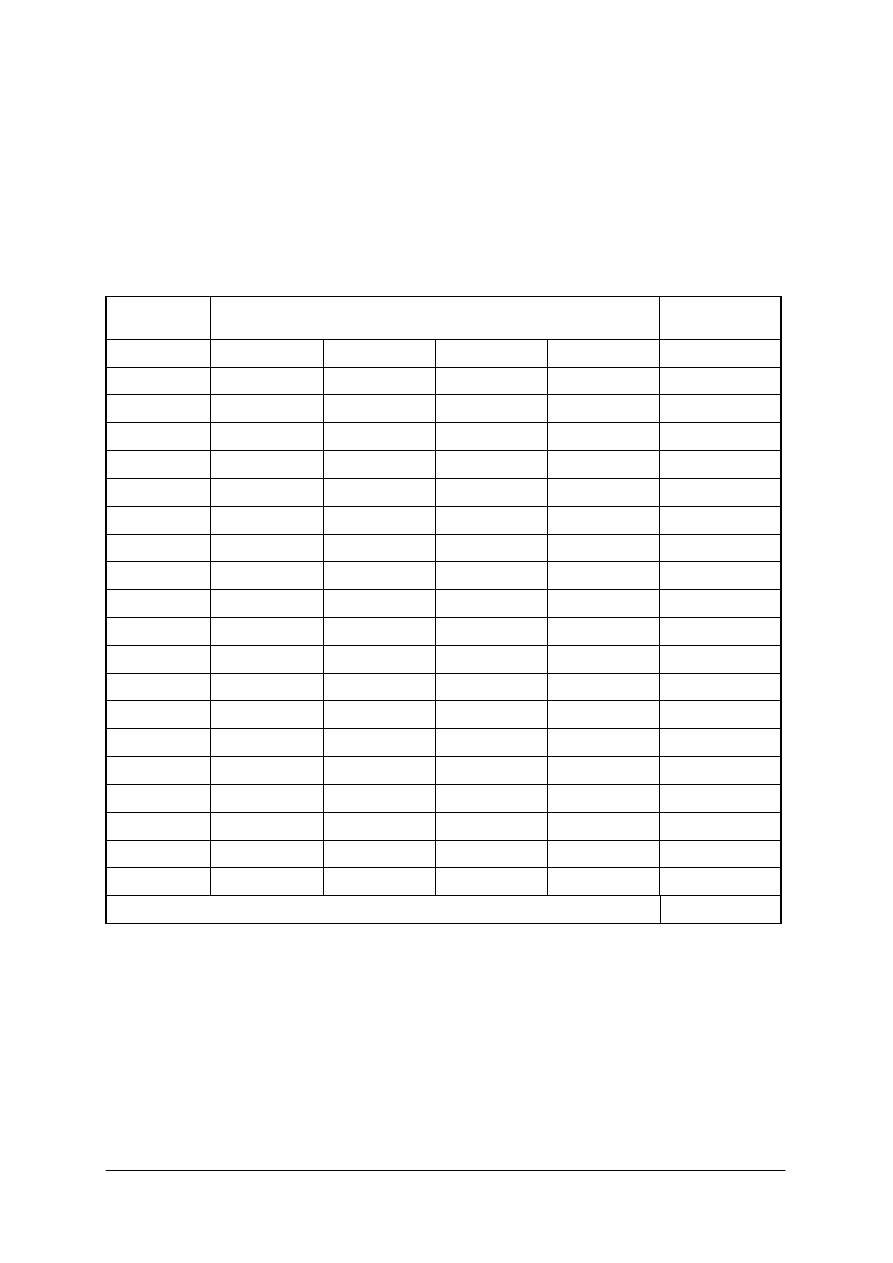
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
39
KARTA ODPOWIEDŹI
Imię i nazwisko.............................................................
Wykonywanie podstawowych czynności laboratoryjnych
Zakreśl poprawną odpowiedź, wpisz brakujące części zdania lub wykonaj rysunek.
Nr
zadania
Odpowiedź
Punkty
1.
a
b
c
d
2.
a
b
c
d
3.
a
b
c
d
4.
a
b
c
d
5.
a
b
c
d
6.
a
b
c
d
7.
a
b
c
d
8.
a
b
c
d
9.
a
b
c
d
10.
a
b
c
d
11.
a
b
c
d
12.
a
b
c
d
13.
a
b
c
d
14.
a
b
c
d
15.
a
b
c
d
16.
a
b
c
d
17.
a
b
c
d
18.
a
b
c
d
19.
a
b
c
d
20.
a
b
c
d
Razem:

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
40
Test nr 2
Test dwustopniowy do jednostki modułowej „Wykonywanie podstawowych czynności
laboratoryjnych”
Proponowany test sumujący jest przeznaczony do przeprowadzenia po zakończonym
procesie kształcenia w module „Wykonywanie podstawowych czynności laboratoryjnych”.
Test ma charakter próby pracy i pozwala na ocenę umiejętności uczniów w zakresie doboru
metod oczyszczania substancji, organizacji stanowiska pracy, sprawności wykonywania
podstawowych czynności laboratoryjnych.
Test ma charakter sprawdzający, tzn. ukierunkowany jest na porównanie wyników
z założonymi w programie celami kształcenia.
Struktura testu jest dwustopniowa, tzn., że bada on:
−
umiejętności podstawowe,
−
umiejętności ponadpodstawowe.
Zadanie
Oczyść 100 g kwasu szczawiowego metodą krystalizacji. Dobierz rozpuszczalnik.
Zaplanuj kolejność wykonywanych czynności. Przeprowadź proces oczyszczania, wysusz
preparat w suszarce (w temp. 105
o
C przez 30 minut). Oblicz wydajność procesu.
INSTRUKCJA DLA UCZNIA
1. Informacje dotyczące oczyszczanej substancji znajdziesz w Kalendarzu chemicznym lub
Poradniku fizykochemicznym.
2. Zanim przystąpisz do wykonania zadania zaplanuj pracę. Pomoże Ci w tym
KARTA PRACY.
3. Odpowiedzi wpisuj w wyznaczonych miejscach KARTY.
4. Wykonywane przez Ciebie czynności będzie obserwował i oceniał nauczyciel.
5. Po zakończeniu zadania KARTĘ PRACY i oczyszczony preparat oddaj nauczycielowi.
6. Na wykonanie zadania masz 180 minut.
7. Pracuj bezpiecznie.
Test zaliczysz, jeśli uzyskasz 13 punktów z poziomu podstawowego.
Aby otrzymać ocenę dostateczną, powinieneś wykonać zadania z poziomu
podstawowego (nr 3, 2, 5, 7 ) i uzyskać 14–15 punktów.
Aby otrzymać ocenę dobrą, powinieneś wykonać zadania z poziomu podstawowego
i dwa zadnia z poziomu ponadpodstawowego i uzyskać 16–19 punktów,
Aby otrzymać ocenę bardzo dobrą, powinieneś uzyskać 20–23 punkty wykonując,
wszystkie zadania z poziomu podstawowego, pozostałe z poziomu ponadpodstawowego.
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
41
KARTA PRACY
Imię i nazwisko
Klasa
Data
Liczba punktów
Ocena
Lp.
Zadania
Odpowiedzi
Maksymalna
liczba
punktów
1.
Dobierz rozpuszczalnik,
uzasadnij wybór
2
2.
Oblicz ilość
rozpuszczalnika potrzebną
do przekrystalizowania
100 g kwasu szczawiowego
4
3.
Dobierz źródło ciepła
1
4.
Dobierz sprzęt, odczynniki
i materiały potrzebne
do wykonania zadania
2
5.
Sporządź algorytm
czynności laboratoryjnych
3
6.
Opisz zasady bezpiecznej
pracy podczas
wykonywania zadania
3
7.
Przeprowadź proces
oczyszczania, wysusz
preparat w suszarce, zważ
i zapisz wynik ważenia
11
8.
Oblicz wydajność procesu
krystalizacji
2
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
42
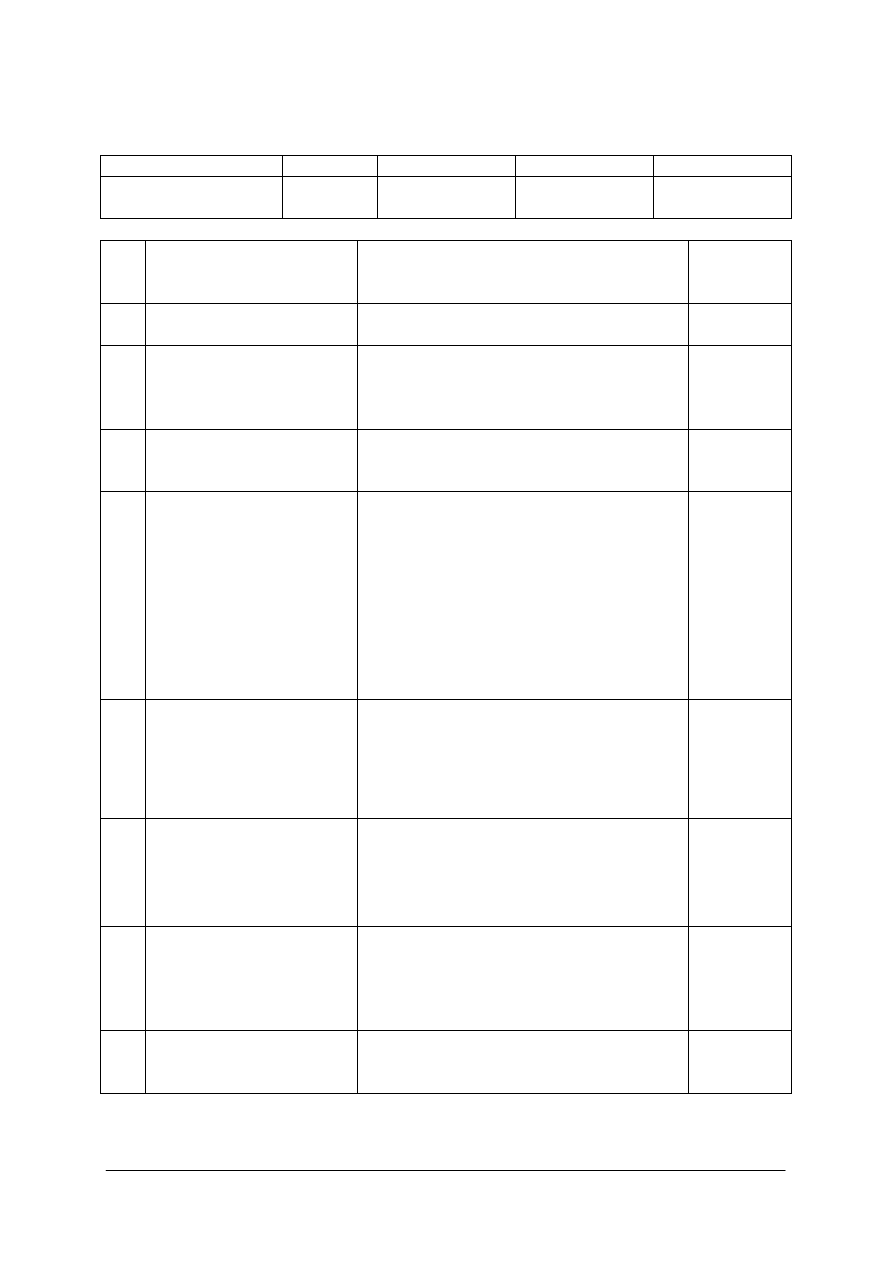
INSTRUKCJA DLA NAUCZYCIELA
1. Czas trwania testu 180 minut.
2. Należy przygotować indywidualne stanowisko pracy dla każdego ucznia.
3. Zapewnić dostęp do literatury potrzebnej do wykonania zadania.
4. Zapewnić niezbędne odczynniki chemiczne i sprzęt laboratoryjny.
5. Omówić z uczniami przebieg testu praktycznego.
6. Podczas przeprowadzenia testu nauczyciel pełni rolę obserwatora, wypełnia „Arkusz
obserwacyjny”.
7. Uczeń może maksymalnie otrzymać 25 punktów.
KARTA ODPOWIEDZI
Lp.
Zadania
Prawidłowa odpowiedź
Ocenianie
Liczba
punktów
za
czynność
Łącznie
1.
Dobierz
rozpuszczalnik,
uzasadnij wybór.
woda
tani, łatwo dostępny,
bezpieczny, duża różnica
w rozpuszczalności kwasu
szczawiowego w różnych
temperaturach.
właściwy
rozpuszczalnik
uzasadnienie
1
1
2
2.
Oblicz ilość
rozpuszczalnika
potrzebną do
przekrystalizowania
100 g kwasu
szczawiowego.
- Obliczenie, ile kwasu
i ile wody znajduje się
w 100g dwuwodnego
kwasu szczawiowego
- Obliczenie ilości
wody potrzebnej do
rozpuszczenia
bezwodnego kwasu
szczawiowego w
temp. 60
O
C,
- Obliczenie ilości
wody potrzebnej do
rozpuszczenia
uwodnionego kwasu
szczawiowego.
Obliczenia
według
podanego
schematu lub
każdy inny
sposób
obliczania
134 cm
3
wody
2
1
1
4
3. Dobierz źródło ciepła
palnik gazowy lub
ogrzewanie elektryczne
wybór jednego
ze źródeł
ogrzewania
1
1
4.
Dobierz sprzęt
materiały i odczynniki
potrzebne do
- waga techniczna
i odważniki,
- cylinder miarowy
150 cm
3
,
- szkiełko zegarkowe,
- kolba stożkowa
500 cm
3
,
- lejej zwykły,
- płaszcz grzejny do
sączenia na gorąco,
właściwy
wybór sprzętu
właściwy
wybór
materiałów
1
1
2

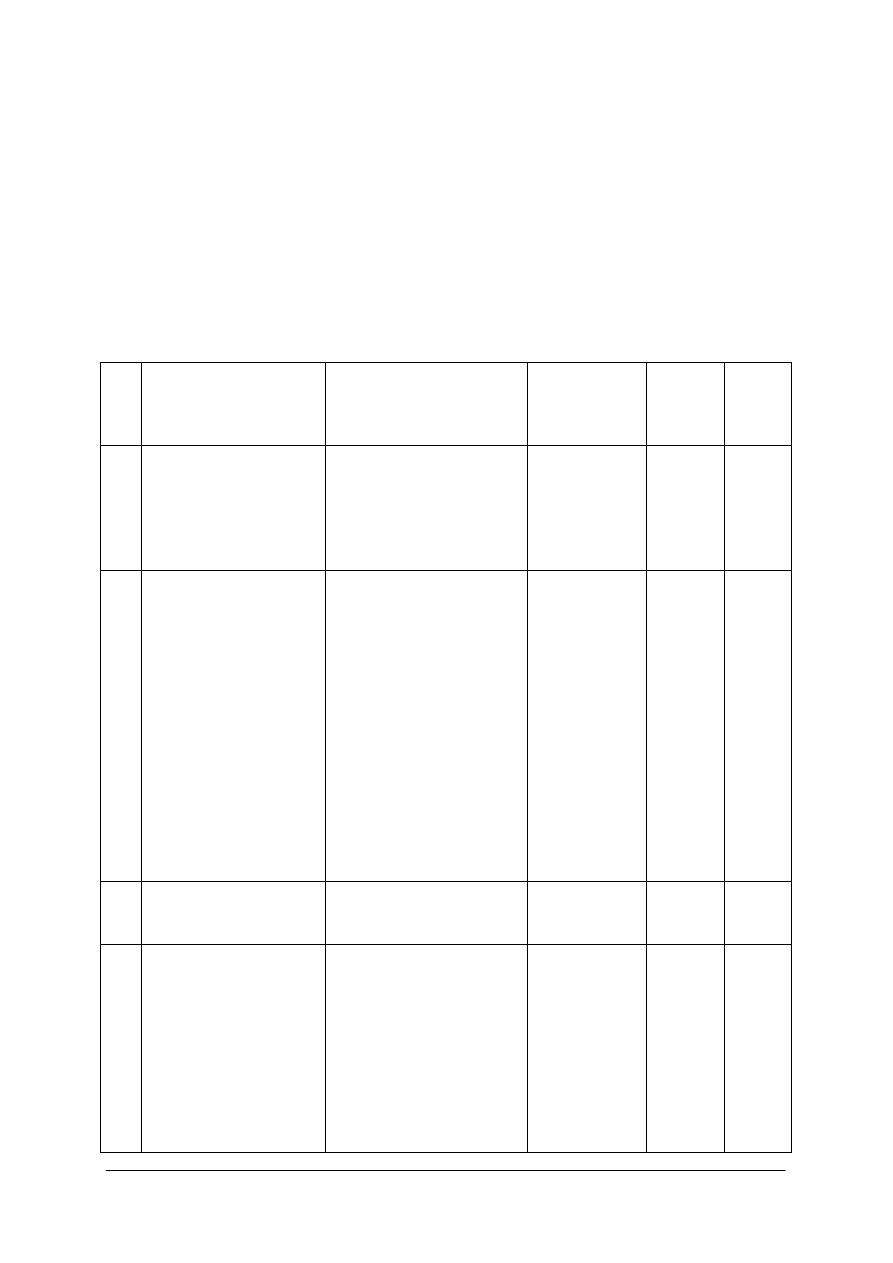
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
43
Lp.
Zadania
Prawidłowa odpowiedź
Ocenianie
Liczba
punktów
za
czynność
Łącznie
wykonania zadania
- krystalizator,
- zestaw do sączenia
pod zmniejszonym
ciśnieniem,
- bagietka,
- sączek karbowany,
- suszarka,
- kamyczki wrzenne.
- węgiel aktywny,
- kwas salicylowy,
- woda destylowana.
5.
Sprządź algorytm
czynności
laboratoryjnych.
1) odważenie
kwasu
szczawiowego,
2) odmierzenie
134 cm
3
wody,
3) rozpuszczenie
kwasu
szczawiowego
gorąco,
4) dodanie węgla
aktywnego,
5) ogrzewanie
roztworu do
łagodnego
wrzenia,
6) sączenie na
gorąco,
7) chłodzenie
przesączonego
roztworu,
8) sączenie
kryształów na
lejku sitowym,
9) suszenie
preparatu
w suszarce,
10) chłodzenie
preparatu,
11) ważenie
preparatu.
Właściwa:
kolejność
czynności,
poprawność
opisu,
dokładność
opisu.
1
1
1
3
- pracuję w fartuchu
ochronnym,
- otrzymaną substancję
traktuję jako środek
szkodliwy,
1
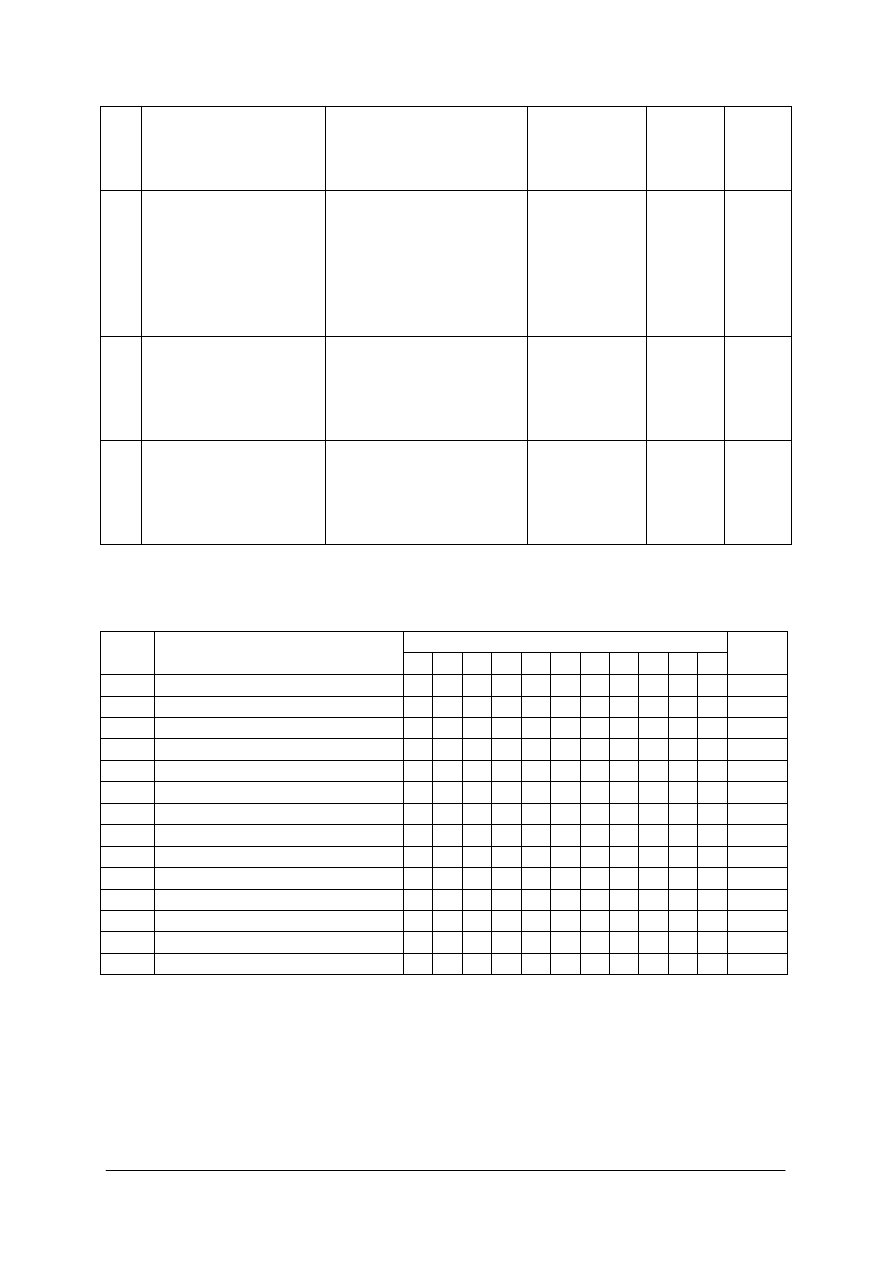
„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
44
Lp.
Zadania
Prawidłowa odpowiedź
Ocenianie
Liczba
punktów
za
czynność
Łącznie
6.
Napisz zasady
bezpiecznej pracy
podczas wykonywania
zadania.
- podczas ogrzewania
substancji i sączenia
na gorąco zachowuję
ostrożność ze względu
na możliwość
poparzenia
termicznego.
1
1
3
7. Przeprowadź
proces
oczyszczania, wysusz
preparat w suszarce,
zważ i zapisz wynik
ważenia.
Ocena zgodnie
z arkuszem
obserwacji dla
zadania 7
11·1
11
8. Oblicz
wydajność
procesu krystalizacji.
- oblicza różnicę mas
preparatu przed i po
procesie krystalizacji
- oblicza wydajność,
wynik podaje w %.
Poprawność
obliczeń
1
1
2
Arkusz obserwacyjny do zadania 7
Obserwowane czynności ucznia
Lp.
Imię i nazwisko ucznia
1 2 3 4 5 6 7 8 9 10 11
Razem
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
Uwaga:
Za każdą poprawnie wykonaną czynność uczeń otrzymuje 1 punkt.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
45
Cyfry w tabeli od 1 do 11 odpowiadają następującym czynnościom uczniów:
1) odważenie substancji,
2) odmierzenie określonej ilości rozpuszczalnika,
3) rozpuszczenie substancji na gorąco,
4) dodanie węgla aktywnego,
5) ogrzewanie roztworu do łagodnego wrzenia,
6) sączenie na gorąco,
7) chłodzenie przesączonego roztworu,
8) sączenie kryształów na lejku sitowym,
9) suszenie preparatu w suszarce,
10) chłodzenie preparatu,
11) ważenie preparatu.
Propozycja oceniania
Aby uczeń otrzymał ocenę dostateczną, powinien wykonać zadania 3, 2, 5, 7 z poziomu
podstawowego i uzyskać 15 punktów.
Aby uczeń otrzymał ocenę, dobrą powinien wykonać zadania z poziomu podstawowego
i dwa zadnia z poziomu ponadpodstawowego i uzyskać 16–19 punktów.
Aby uczeń otrzymał ocenę bardzo dobrą powinien uzyskać 20–23 punkty, wykonując
wszystkie zadania z poziomu podstawowego i z poziomu ponadpodstawowego.

„Projekt współfinansowany ze środków Europejskiego Funduszu Społecznego”
46
7. LITERATURA
1. Klepaczko-Filipiak B., Jakubiak Z., Wulkiewicz U.: Badania chemiczne. Technika pracy
laboratoryjnej. WSiP, Warszawa 1998
2. Kupryszewski G.: Podstawowe zasady bezpiecznej pracy w laboratorium chemicznym.
Wydawnictwo Gdańskie, Gdańsk 1998
3. Modzelewski M., Woliński J.: Pracownia chemiczna. Technika laboratoryjna. WSiP,
Warszawa 1996
Wyszukiwarka
Podobne podstrony:
03 Wykonywanie podstawowych rob Nieznany
04 Wykonywanie podstawowych for Nieznany (2)
01 Wykonywanie podstawowych robót ciesielskich
01 Wykonywanie reczne wyrobow t Nieznany
08 Wykonywanie podstawowych utw Nieznany
05 Wykonywanie podstawowych rob Nieznany
05 Wykonywanie podstawowych pom Nieznany (2)
01 Wykonywanie badan i pomiarow Nieznany
01 Wykonywanie podstawowych czynności laboratoryjnych
01 E CELE PODSTAWYid 3061 ppt
312[01] 01 122 Arkusz egzaminac Nieznany (2)
więcej podobnych podstron