
ZAKŁAD OPAKOWALNICTWA I BIOPOLIMERÓW
CHEMIA ŻYWNOŚCI
Ćwiczenia laboratoryjne nr 1
Wyodrębnianie i badanie właściwości fizyko-chemicznych białek
Artur Bartkowiak, Szczecin 2003

Ćwiczenie 1
1. Izolacja białek występujących w mleku
Białka mleka dzieli się ze względu na ich budowę, rolę biologiczną i właściwości funkcjonalne na
kazeiny, białka serwatki oraz białka otoczki kuleczek tłuszczowych.. Najważniejsze znaczenie
zarówno odżywcze jak i przemysłowe mają kazeiny i białka serwatki.
Frakcje Udział w masie
[%]
Punkt izoelektryczny
Masa cząsteczkowa
tys. [g/mol]
Kazeiny 78-85 4,6
Białka serwatki
α-laktoalbumina
β-laktoglobulina
15-25
5,1
5,3
14,2
18,3
Kazeiny są heterogeniczną grupą fosfoprotein, złożoną z 20 składników. Różnią się one składem
aminokwasowym oraz stopniem ufosforylowania i glikolizacji. Kazeiny strącają się z surowego,
odtłuszczonego mleka w temperaturze pokojowej przy pH 4,6. Podwyższenie pH do 6,7 powoduje
rozpuszczenie osadu.
Opis ćwiczenia
Dokładnie odważone 5 g odtłuszczonego mleka w proszku rozpuścić w 20 cm
3
ciepłej wody
destylowanej (w 100 cm
3
zlewce) lub 20 cm
3
zwykłego mleka. Zlewkę umieścić na kilka minut w
łaźni wodnej i doprowadzić temperaturę roztworu do 55ºC (temperatura nie może być wyższa niż
60ºC).
Przy ciągłym mieszaniu za pomocą bagietki dodawać stopniowo 10% wodny roztwór kwasu
octowego (nie dodawać kwasu zbyt gwałtownie). Kontynuować dodawanie kwasu (całkowita ilość
nie powinna przekroczyć 2 cm
3
) do momentu gdy kazeina przestanie się wytrącać a roztwór jest
zupełnie przezroczysty. Wszystkie operacje powinny być wykonane możliwie szybko tak aby
wytrącanie kazeiny była prowadzono w stałej temperaturze.
Istotne jest, aby dodać tylko taką ilość kwasu, która jest niezbędna do wytrącania kazeiny.
Gwałtowne obniżenie pH może doprowadzić do hydrolizy laktozy zawartej w pozostałym roztworze
(UWAGA: w sprawozdaniu przedstawić wzorami chemicznymi przebieg procesu hydrolizy laktozy
2

- jaki substancje otrzyma się w wyniku tej reakcji?). Roztwór mieszać do momentu gdy wytrącona
kazeiny utworzy na dnie bezpostaciową masę.
Klarowny roztwór A znad osadu przelać do innej zlewki (oznaczyć jego objętość i zachować do
analizy na zawartość białek i laktozy metodą Libermanna i Wöhlkego).
Wydziel pozostałą kazeinę na sączku celulozowym – filtracja próżniowa w lejku Büchnera
(wyciśnij możliwie dużo wody poprzez ugniatanie bagietką). Umieścić wydzieloną kazeinę w
zlewce 100 m i dodać 5 cm
3
mieszaniny (eter etylowy – metanol 1/1 wag.– UWAGA – substancja
łatwopalna – nie dopuścić do kontaktu z płomieniem) – całość mieszać bagietką przez kilka minut
po czym ciecz zdekantować i powtórzyć proces z nową porcją mieszaniny rozpuszczalników
organicznych. Poprzez przemywanie taką mieszaniną eterowo-metanolową usuwa się pozostałości
tłuszczu. Następnie należy kazeinę odfiltrować na lejku Büchnera a otrzymane białko osuszyć
między kartkami bibuły (10-15 min). Poczym całość wysuszyć w suszarce w temperaturze 40
ºC
(45-60 min).
Reakcja Liebermanna
Zasada: Reakcja ta jest charakterystyczna dla glikoprotein. W czasie ogrzewania ze stężonym
roztworem HCl następuje hydroliza białka, a jednocześnie z cukrów powstają pochodne
furfuralowe, które z fenolami, uwolnionymi w czasie hydrolizy, dają fioletowo zabarwione
połączenia
Wykonanie: Do 1 cm
3
roztworu A znad osadu kazeiny umieszczonego w probówce dodać 3 cm
3
stężonego HCI i ogrzewać przez kilka minut (w łaźni wodnej). Podobne doświadczenie wykonać dla
1% wodnego roztwory oczyszczonych protein serwatkowych (samodzielnie przygotować roztwór
takiej proteiny - znajduje się ona w odczynnikach przeznaczonych do tego ćwiczenia.
Próba Wöhlkego
Zasada: W czasie ogrzewania roztworu laktozy (albo maltozy) z amoniakiem w obecności KOH
powstaje czerwone zabarwienie (glukoza i fruktoza dają zabarwienie żółtobrązowe).
Wykonanie: Do 2 cm
3
roztworu badanego A (znad osadu kazeiny) dodać równą objętość stężonego
roztworu amoniaku i 2 krople 3% roztworu KOH. Wstawić do wrzącej łaźni wodnej na kilka minut.
Obserwować powstałe zabarwienie.
3
Ćwiczenie 1.2. Oznaczanie punktu izoelektrycznego pI kazeiny
W metodzie tej wykorzystuje się najmniejszą rozpuszczalność kazeiny w punkcie izoelektrycznym.
Odpowiednio dobierając stężenia CH
3
COOH i CH
3
COONa przygotowuje się szereg probówek z
roztworami o różnych wartościach pH. Dodaje się do nich jednakową ilość kazeiny. Wartość pH w
probówce, w której wystąpi najobfitszy osad, odpowiada pI kazeiny. Przygotowanie roztworu
kazeiny: Do kolbki miarowej (50 cm
3
) odważyć 0,25 g kazeiny i dodać 25 cm
3
wody (ogrzanej do
40°C) oraz 5 cm
3
1 M roztworu NaOH. Mieszać aż do rozpuszczenia się kazeiny, po czym
wprowadzić 5 cm
3
1 M roztworu CH
3
COOH i uzupełnić do kreski wodą. Otrzymuje się w ten
sposób lekko opalizujący roztwór kazeiny w 0,1 M roztworze CH
3
COONa.
Opis ćwiczenia
Przygotować 9 suchych probówek. Do pierwszej odmierzyć 3,2 cm
3
1 M roztworu CH
3
COOH i 6,8
cm
3
wody, a do następnych ośmiu po 5 cm
3
H
2
O. Po dokładnym wymieszaniu zawartości w
probówce pierwszej, przenieść z niej 5 cm
3
do drugiej, a z tej, po wymieszaniu, 5 cm
3
do trzeciej itd.
Do każdej probówki dodać po 1 cm
3
roztworu kazeiny i wymieszać. Obserwować roztwory
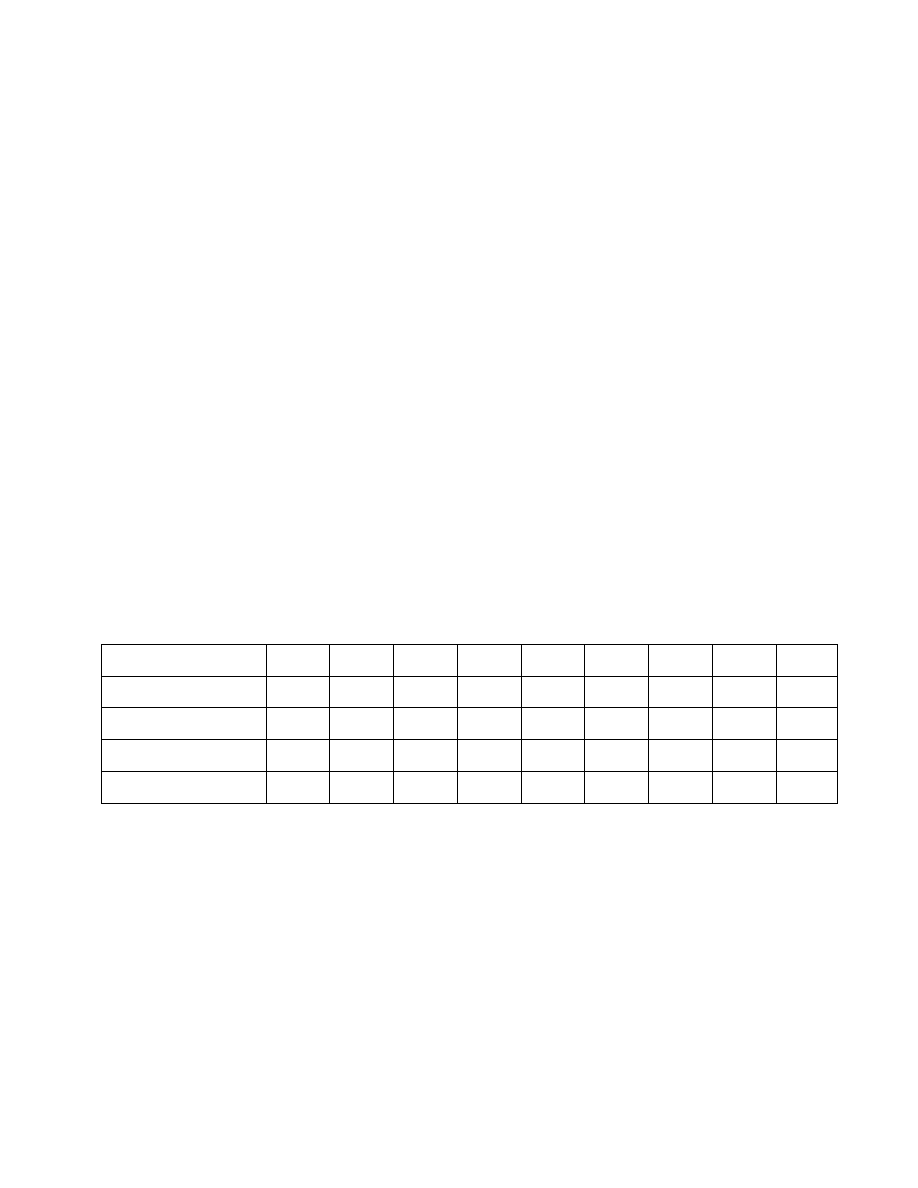
natychmiast po zmieszaniu i po 30 min. Wynik wpisać do tabelki:
Nr
probówki 1 2 3 4 5 6 7 8 9
1 M CH
3
COOH cm
3
1,6 0,8 0,4 0,2 0,1 0,05
0,025
0,012
0,006
pH
roztworu 3,5 3,8 4,1 4,4 4,7 5,0 5,3 5,6 5,9
zmętnienie
osad
4

Ćwiczenie 1.3. Strącanie białka za pomocą kationów (solami metali ciężkich)
Do doświadczeń zastosować kolejne roztwory z probówek z ćwiczenia 1.2. (po jego zakończeniu),
które powinny być uprzednio rozdzielone na 2 części tak aby odpowiednio były odpowiednio
roztwory do wykonania ćwiczenia zgodnie z opisem w części a i b.
a) Do 2,5 cm
3
roztworu kazeiny z każdej z próbówki 1-10 dodać parę kropli 1% roztworu
FeCI
3
. Opisać zmiany w każdym z roztworów w zależności od pH. Z czego wynikają
zaobserwowane różnice (kiedy następuje najobfitsze strącanie białka a kiedy nie)?
b) Do 2,5 cm
3
roztworu kazeiny z każdej z próbówki 1-10 dodać parę kropli 1% roztworu
CuSO
4
. Opisać zmiany w każdym z roztworów w zależności od pH. Następnie dodać po 2-3
krople roztworu 1 M NaOH. Z czego wynikają zaobserwowane różnice (kiedy następuje
najobfitsze strącanie białka a kiedy nie)?
Ćwiczenie 1.4. Cieplna denaturacja i koagulacja białka
Denaturacja białek
Terminem tym obejmuje się zmiany w konformacji łańcucha polipeptydowego, wskutek których
białko traci rodzime właściwości. Denaturacja następuje wówczas, kiedy pod wpływem czynników
fizycznych lub chemicznych ulega zniekształceniu lub zniszczeniu struktura IV, III lub II rzędu, tj.
kiedy dochodzi do zdeformowania ukształtowania cząsteczki, swoistego dla każdego białka, bez
hydrolitycznej de- gradacji łańcucha polipeptydowego. Czynniki denaturujące działają na wiązania,
które stabilizują przestrzenną strukturę białek.
Do wiązań tych należy zaliczyć przede wszystkim wiązania wodorowe tworzące się między
grupami =CO i =NH wiązań peptydowych (w tym samym lub różnych łańcuchach
polipeptydowych), a także między grupami funkcyjnymi łań- cuchów bocznych, takimi jak: -
COOH, -OH, -NH2 i -SH. W utrzymaniu konformacji cząsteczki białka współdziałają również
wiązania jonowe, powstające między grupami -COO- i -NR j, a także oddziaływania hydrofobowe
między aminokwasami niepolarnymi. Ważnym czynnikiem stabilizującym konformację łań-
cuchów polipeptydowych są kowalencyjne wiązania dwusiarczkowe, tworzące się między resztami
cysteiny tego samego lub różnych łańcuchów polipeptydowych. Istotną rolę odgrywają ponadto
metale, łączące ze sobą łańcuchy boczne aminokwasów wiązaniami koordynacyjnymi.
5

W wyniku rozerwania wiązań stabilizujących strukturę białka, uwolnione grupy funkcyjne
aminokwasów mogą wytworzyć inne wiązania, które zmienią konfigurację cząsteczki. Taka nowa,
zdenaturowana cząsteczka odznacza się zawsze zmianą, a nawet utratą właściwości biologicznych
(enzymatycznych, antygenowych, hormonalnych), a niekiedy zmianie ulegają również jej
właściwości fizykochemiczne. Denaturacji nie należy utożsamiać z koagulacją, ponieważ zjawisko
wypadania osadu nie jest nieodłącznie związane z denaturacją. Wiele białek ulega denaturacji
pozostając w roztworze. Można natomiast wytrącić białko z roztworu nie powodując jego
denaturacji (np. wysalanie).
Białko zdenaturowane w pH różnym od pI, czyli w form1e anionowej lub kationowej, utrzymuje się
w roztworze, gdyż stabilizuje je ładunek 'elektryczny. Dodanie elektrolitu, powodujące
"rozbrojenie" zawiesiny zdenaturowanego białka, prowadzi do strątu w postaci kłaczków
(flokulacja). Podczas denaturacji białka w pI tworzy się natychmiast strąt (koagulacja).
Nieodwracalny na ogół proces denaturacji może w pewnych wypadkach ulec cofnięciu, gdy np.
czynnik denaturujący działał krótko i nie spowodował daleko posuniętych zmian w strukturze
cząsteczki białka.
Denaturację białka wywołują niektóre czynniki fizyczne takie jak: ogrzewanie, wysychanie,
ultradźwięki, promieniowanie krótkofalowe i wstrząsanie .wodnych roztworów białka w atmosferze
powietrza. Chemiczne czynniki denaturujące to: kwasy, zasady, jony metali ciężkich,
chlorowodorek guanidyny, mocznik, detergenty, fenol, chloroform, rozpuszczalniki mieszające się z
wodą, jak: alkohol, aceton. Mocznik i chlorowodorek guanidyny powodują wybiórcze zrywanie
wiązań wodorowych w cząsteczce białka, a same łącząc się z uwolnionymi wiązaniami
peptydowymi za pomocą nowych wiązań wodorowych zmienia rodzimą strukturę molekularna
białka. Ciepło, powodując zrywanie wiązań wodorowych w cząsteczkach, prowadzi do
nieodwracalnej denaturacji białek. Proces denaturacji cieplnej rozpoczyna się dla różnych białek w
różnych temperaturach (między 40 a 100°C). Tylko nieliczne białka wytrzymują krótkie gotowanie
(np. żelatyna, rybonukleaza). Białko zdenaturowane w pI jest nierozpuszczalne.
Opis ćwiczenia
Do probówek odmierzyć po 2 cm
3
l % roztworu białka jaja kurzego i dodać kolejno: do pierwszej
probówki 0,2 cm
3
0,01 M roztworu HCl (pH 3), do drugiej 0,2 cm
3
buforu octanowego o pH 4,7, do
trzeciej 0,2 cm
3
0,01 M roztworu NaOH (pH 11). Wstawić wszystkie probówki do wrzącej łaźni
wodnej na 15 min. Oziębić. Zaobserwować wynik doświadczenia. Do probówek 1 i 3 dodać po 2
cm
3
0,01 M buforu octanowego o pH 4,7.
6
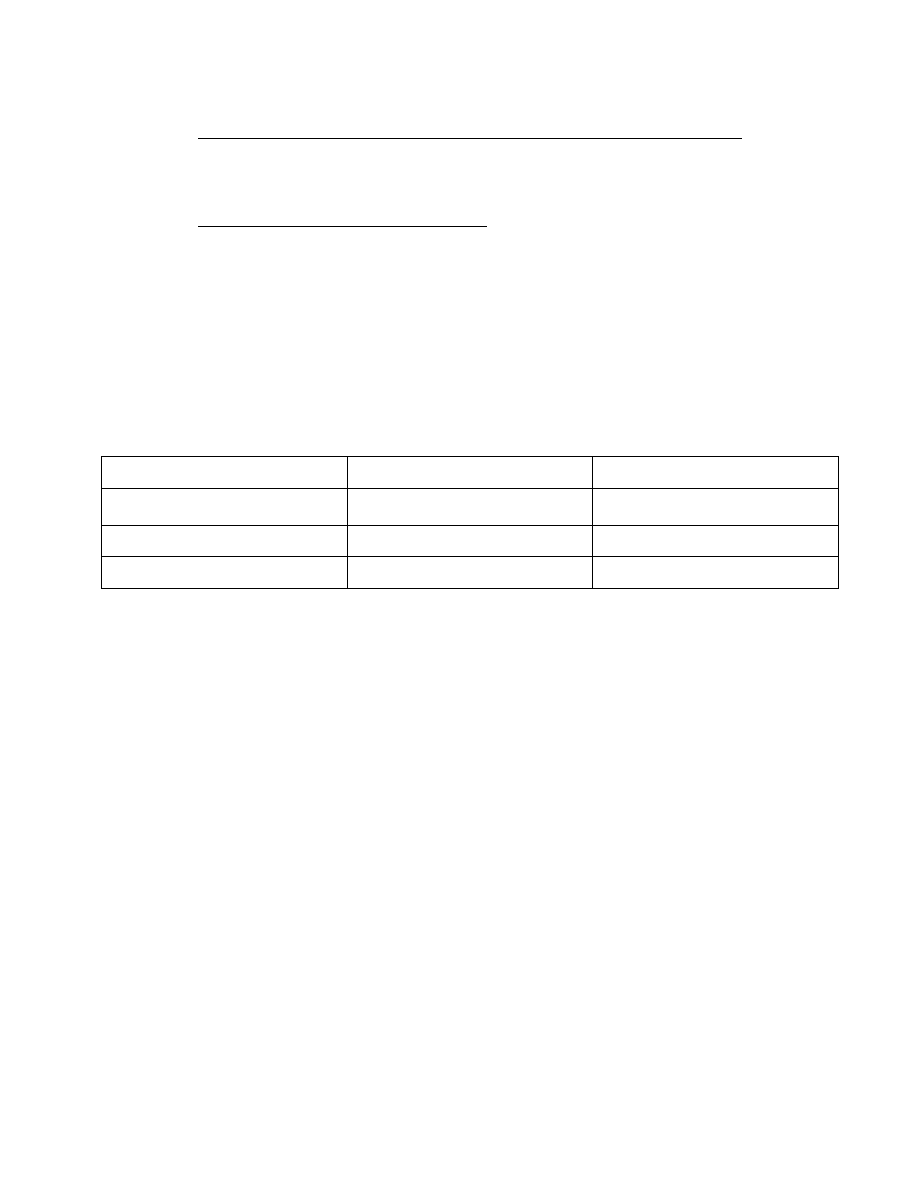
SPRAWOZDANIE Z ĆWICZENIA NR 1
Wyodrębnianie i badanie właściwości fizyko-chemicznych białek
Ćwiczenie 1. Izolacja białek występujących w mleku
a) przebieg hydrolizy laktozy (wzory strukturalne i sumaryczne)
b) określić zawartość % wag. strąconej kazeiny w mleku
masa otrzymana- ………g
Substancja Zawartość teoretyczna [%]
Zawartość oznaczona [%]
Kazeiny 21
?
Białka serwatkowe
4,8
-
Laktoza 36,5
-
Otrzymany wynik porównać z zawartością teoretyczną (Z.Sikorski, Chemia Żywności, WNT
2000) i skomentuj prawdopodobne powody otrzymanej różnicy
•
•
•
c) próba Liebermanna i Wöhlkego
Czy zaobserwowano jakieś różnice w przypadku dwóch roztworów badanych w próbie
Liebermanna?
Z czego wynikają zmiany barwy zachodzące podczas ogrzewania a z czego ich brak -
przedyskutować?
7

Ćwiczenie 2. Oznaczanie punktu izoelektrycznego pI kazeiny
Nr
probówki 1 2 3 4 5 6 7 8 9
1 M CH
3
COOH cm
3
1,6 0,8 0,4 0,2 0,1 0,05
0,025
0,012
0,006
pH
roztworu 3,5 3,8 4,1 4,4 4,7 5,0 5,3 5,6 5,9
zmętnienie
osad
Ćwiczenie 3. Strącanie białka za pomocą kationów (solami metali ciężkich)
Zastanowić, co prawdopodobnie będzie można zaobserwować, gdyby zamiast kationów
wielowartościowych zastosować aniony wielowartościowe?
•
•
•
Czy były by jakieś różnice i jaki ma to związek z punktem pI określonego białka?
Opisać takie zachowanie odpowiednimi uproszczonymi reakcjami chemicznymi
Ćwiczenie 4. Cieplna denaturacja i koagulacja białka
Czynniki denaturujące białko:
Wysalanie białka to………………
Suma punktów ………
8

9
Wyszukiwarka
Podobne podstrony:
Chemia żywnosci Cwiczenie 2 Wyodrebnianie badanie własciwosci i analiza jakosciowa sacharydow
Ćwiczenie laboratoryjne nr 1 Badania makroskopowe grunt…
materialy-do-kolokwium-do-cwiczenia-laboratoryjnego-nr-4, Chemia
ćwiczenia laboratoryjne nr 2
Ćwiczenie laboratoryjne nr 6 materiały
26, wstep, ĆWICZENIE LABORATORYJNE NR 26.
Laboratorium z techniki łączenia, Badanie właściwości łuku elektrycznego, LABORATORIUM TECHNIKI
chemia żywności ćwiczenie 1
Przykładowe zadania z równowagi chemicznej CD CH 2010 2011, Technologia chemiczna, Chemia fizyczna,
Kolokwium zaliczeniowe, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Kolokwium nr 2, Technologia chemiczna, Chemia fizyczna, Ćwiczenia, Kolokwium nr 1
Ćwiczenie Laboratoryjne nr 3- zadanie.
26, jurek 26, ĆWICZENIE LABORATORYJNE NR 26.
SPRAWOZDANIE DO ĆWICZENIA LABORATORYJNEGO NR 1
pomiar oporu elektrycznego ćwiczenie laboratoryjne nr 2
Metale Laboratorium, Konspekt, Ćwiczenie laboratoryjne nr 1 z Konstrukcji Metalowych
więcej podobnych podstron