Adsorpcja błękitu metylenowego na węglu aktywnym w obecności acetonu
Cel ćwiczenia
Celem ćwiczenia jest zbadanie procesu adsorpcji barwnika z roztworu, wyznaczenie równania
izotermy Freundlicha oraz wpływu polarności rozpuszczalnika na proces adsorpcji na węglu
aktywnym.
Zakres wymaganych wiadomości
Definicje: widmo absorpcyjne, prawo Lamberta-Beera, zjawisko adsorpcji (adsorpcja
fizyczna i chemisorpcja, najczęściej stosowane adsorbenty, adsorpcja z roztworów) równanie
izotermy Freundlicha, równowaga adsorpcyjna, adsorpcja i chromatografia, węgiel aktywny –
zastosowanie oraz działanie z uwzględnieniem procesów biologicznych.
Tabela wyników pomiarów
Nr próbki
c
0
mol/dm
3
A
0
A
k
C
k
mol/dm
3
m
c
c
k
−
0
log
log c
0
log k
1
2
3
4
5
6
7
8
gdzie: c
0
- stężenie barwnika przed adsorpcją [
mol/dm
3
]
c
k
- stężenie barwnika po adsorpcji [
mol/dm
3
]
m - masa adsorbenta (węgla aktywnego) [g]
A
0
- absorbancja roztworu przed dodaniem węgla aktywnego
A
k
- absorbancja roztworu po dodaniu węgla aktywnego
Materiały:
Błękit metylenowy (C
16
H
18
CIN
3
S)
Aceton (CH
3
COCH
3
)
węgiel aktywny w postaci tabletek lub czystego węgla

Aparatura:
Spektrofotometr UV-9200
Spektrofotometr z możliwością badania widma absorpcyjnego VIS-723G
Pojemniki na tkanki - 20 sztuk
Bibuła filtracyjna
Lejki - 4 sztuki
Statyw na probówki
Probówki
Cylinder miarowy 50 ml
Moździerz ceramiczny
Waga laboratoryjna
Pipeta automatyczna
Przebieg ćwiczenia:
Przygotować roztwór wodny błękitu metylenowego o stężeniu 1 mM.
W trakcie wykonywania pomiarów lub też na samym początku należy wyznaczyć widmo
absorpcyjne błękitu metylenowego przy wykorzystaniu spektrofotometru VIS-723G. Jest ono
niezbędne ponieważ z niej należy odczytać długość fali dla której będą prowadzone dalsze
pomiary.
Część I
1. Przygotować i podpisać osiem pojemników na tkanki o pojemności 100 ml każdy.
2. Odmierzyć do cylindra miarowego, o pojemności 50 ml 5ml acetonu oraz 1.2 ml
błękitu metylenowego o stężeniu 1mM. Uzupełnić wodą destylowaną do 50 ml.
Całość przelać do przygotowanego wcześniej pojemnika.
3.
Procedurę z pkt 2. powtórzyć siedmiokrotnie zwiększając za każdym razem ilość
acetonu o 5 ml. Dodać 1.2 ml błękitu metylenowego o stężeniu 1mM i uzupełniać
wodą destylowaną zawsze do objętości 50 ml.
4. Z pierwszego pojemnika pobrać ok. 3 ml przygotowanego roztworu i wprowadzić do
szklanej kuwety pomiarowej.
5. Do drugiej kuwety pomiarowej (szklanej) wprowadzić mieszaninę acetonu i wody
przygotowaną wcześniej w probówce (wprowadzić do probówki 0,5ml acetonu oraz
4,5ml wody destylowanej – całość wymieszać)
6.
Zarejestrować widmo absorpcyjne roztworu barwnika za pomocą spektrofotometru
VIS-723G i wyznaczyć długość fali
λ
max
światła dla której osiągnięta jest maksymalna
wartość absorpcji.
Uwaga! Pomiary, w spektrofotometrze VIS-723G i UV-9200, roztworów
zawierających aceton należy bezwzględnie wykonywać w szklanych kuwetach.
7.
Wykonać pomiar absorbancji dla wszystkich ośmiu próbek w spektrofotometrze UV-
9200 przy wyznaczonej wartości
λ
max.
Uwaga! Pamiętać o ustawieniu odpowiedniej długości fali – wyznaczonej podczas
pomiaru widma błękitu metylenowego. Roztwór z barwnikiem po pomiarze
absorbancji przelać do pojemnika, z którego został wcześniej pobrany.

8. Rozetrzeć w moździerzu 2 tabletki węgla. Do każdego pojemnika odważyć 150 mg
tabletki zawierającej węgiel aktywny.
Uwaga! Jedna tabletka węgla aktywnego o wadze 600 mg zawiera 300 mg czystego
węgla aktywnego
9. Tak przygotowane roztwory z węglem aktywnym wytrząsać 10 min.
10. Przygotować statyw na probówki, probówki, lejki oraz bibułę filtracyjną (wyciąć
odpowiednią ilość uwzględniając iż każdy z roztworów powinien być odfiltrowany co
najmniej dwukrotnie) a następnie odfiltrować każdy z roztworów.
11.
Po każdym procesie filtracji odmierzyć około 3 ml przesączu, umieścić go w szklanej
kuwecie i przy pomocy spektrofotometru odczytać wartość absorbancji roztworu
względem przygotowanego wcześniej roztworu acetonu i wody (p. 5). W przypadku
konieczności powtórzenia procesu filtracji powtórzyć wszystkie procedury z pkt. 10.
Część II
1. Przygotować i podpisać osiem pojemników na tkanki o pojemności 100 ml każdy.
2. Odmierzyć do cylindra miarowego, o pojemności 50 ml, 25 ml acetonu oraz 1.2 ml
błękitu metylenowego o stężeniu 1mM. Uzupełnić wodą destylowaną do 50 ml.
Całość przelać do przygotowanego wcześniej pojemnika.
3. Procedurę z pkt 2. powtórzyć siedmiokrotnie.
4. Wykonać pomiar absorbancji dla wszystkich ośmiu próbek w spektrofotometrze UV-
9200.
Uwaga! Pamiętać o ustawieniu odpowiedniej długości fali – wyznaczonej podczas
pomiaru widma błękitu metylenowego w pierwszej części ćwiczenia.
5. Do każdego z pojemników odważyć odpowiednio od 5 do 75 mg czystego węgla
aktywnego.
Uwaga! Jedna tabletka węgla aktywnego o wadze 600 mg zawiera 300 mg czystego
węgla aktywnego
6. Tak przygotowane roztwory wraz z węglem aktywnym wytrząsać 10 min.
7. Przygotować statyw na probówki, probówki, lejki oraz bibułę filtracyjną
a następnie odfiltrować każdy z roztworów.
8. Odmierzyć około 3 ml przesączu, umieścić go w szklanej kuwecie i przy pomocy
spektrofotometru UV-9200 odczytać wartość absorbancji roztworu.
Opracowanie wyników:
1. Obliczyć stężenie molowe oraz ilość moli roztworu błękitu metylenowego
w poszczególnych pojemnikach.
2. Wykonać wykres zależności absorbancji od stężenia barwnika przed wprowadzeniem
węgla aktywnego.
3. W oparciu o prawo Lamberta-Beera wyznaczyć stężenie barwnika w każdym
z przygotowanych pojemników.
4. Wykorzystując równanie Freundlicha:
n
kc
a
=
a - ilość zaadsorbowanej substancji na 1g adsorbentu
c - stężenie adsorbowanej substancji
k, n - stałe
wyznaczyć stałe występujące w równaniu. W celu obliczenia wartości a należy ilość
moli zaadsorbowanego barwnika podzielić przez masę adsorbentu wyrażonego
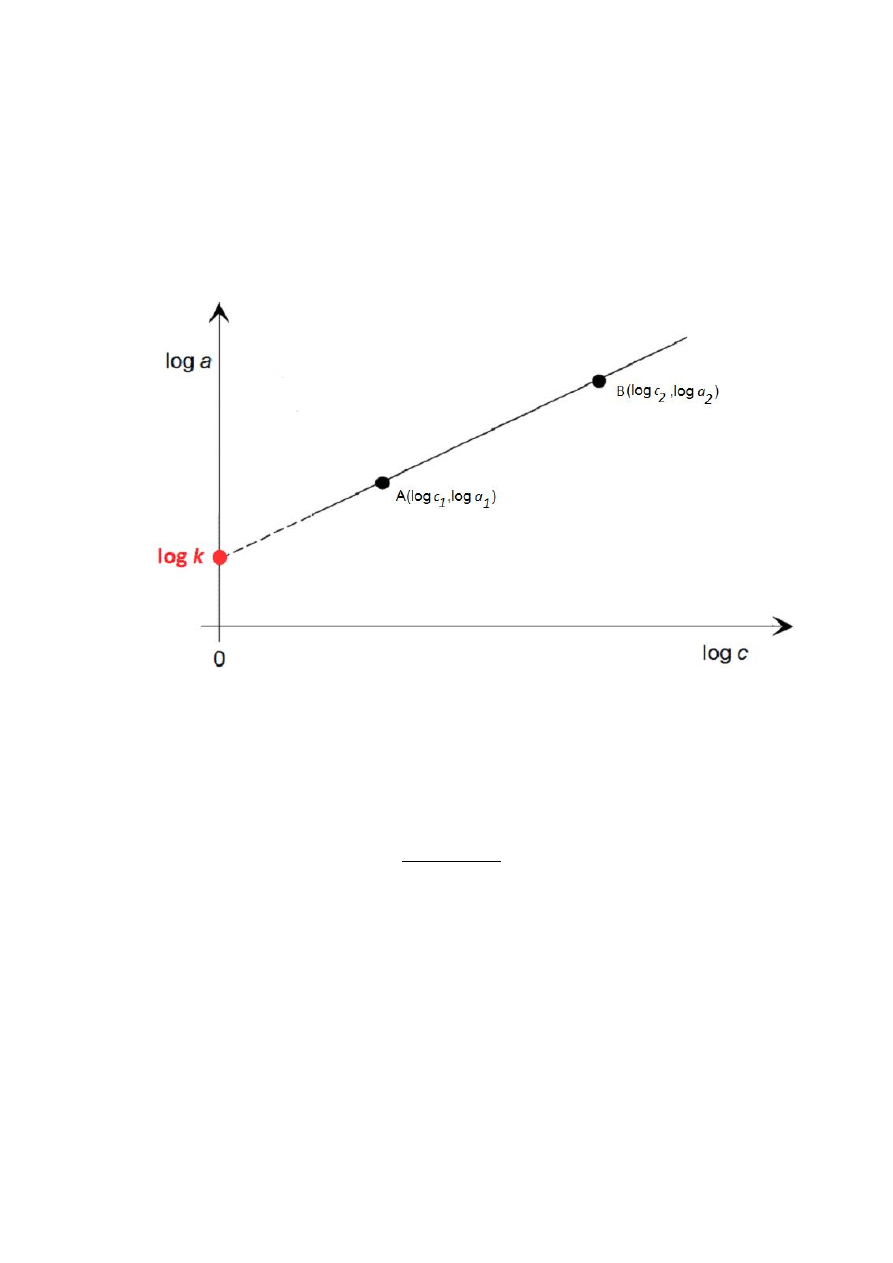
w gamach. Sporządzić wykres log(a) = f(log(c)) i wyliczyć wartości k i n
Rysunek 1. Wykres ilustrujący zlogarytmowaną postać izotermy Freundlicha. Na
wykresie zaznaczono sposób wyznaczenia log k.
Stałą n można wyznaczyć przy wykorzystaniu dwóch dowolnych punktów (A, B)
naprostuj oraz następującego wzoru:
1
2
1
2
log
log
log
log
c
c
a
a
n
−
−
=
5. Wykorzystując wiedzę literaturową przeprowadzić analizę procesu adsorpcji barwnika
na węglu aktywnym.
Literatura:
[1] P. Atkins., Chemia fizyczna, Wydawnictwo Naukowe PWN, Warszawa 2001
[2] A. Olszowski, Doświadczenia fizykochemiczne, Oficyna Wydawnicza Politechniki
Wrocławskiej, Wrocław 2004
Opracowali:
mgr Sylwia Wiśniewska – Kubka i mgr inż. Artur Wrona pod opieką dr hab. Krystiana
Kubicy

Document Outline
Wyszukiwarka
Podobne podstrony:
cwiczenie 3 011
011 Moduł Younga ćwiczenie
3 ćwiczenia BADANIE asfaltów
Ćwiczenie7
Cwiczenia 2
Ćwiczenia V
metody redukcji odpadów miejskich ćwiczenia
Ćwiczenia1 Elektroforeza
cwiczenia 9 kryzys
Ćwiczenia 1, cz 1
Ćwiczenie 8
9 ćwiczenie 2014
Cwiczenie 1
więcej podobnych podstron