
1
Geochemia analityczna II
Przykłady obliczeń
Tematyka ćwiczeń.
•
Przeliczanie analizy na wzór chemiczny minerału
•
Projekcja skały w trójkącie klasyfikacyjnym
•
Przeliczanie wyników analiz podanych w pierwiastkach na tlenki
•
Obliczanie zawartości pierwiastka w rudzie
Przeliczanie analizy na wzór chemiczny minerału
Jaki
jest
cel
wykonywania
analizy
chemicznej
minerału
i
przeliczania jej na jego wzór strukturalny?
- analiza mikroskopowa dostarcza ogólnych danych identyfikacyjnych
interesuj
ą
cego nas minerału (np. plagioklaz, oliwin, amfibol,
piroksen),
ale
nie
umo
ż
liwia
jego
dokładnego
rozpoznania
(plagioklaz: albit czy anortyt; oliwin: forsteryt czy fajalit;
amfibol: np. hornblenda czy glaukofan itd.). Na podstawie wyników
analizy chemicznej od razu wiadomo, który to dokładnie minerał i
jaki jest jego wzór strukturalny;
- niektóre metody datowania (np. uranowa) bazuj
ą
na wynikach analizy
chemicznej minerałów;
- wyznaczanie temperatur i ci
ś
nie
ń
, w których powstaj
ą
skały opiera
si
ę
m.in. na analizach chemicznych minerałów wchodz
ą
cych w ich
skład;
- odtworzenie warunków powstawania niektórych skał magmowych jest
interpretowane na podstawie wyników analiz chemicznych minerałów
wchodz
ą
cych w ich skład.
Współczesna chemia analityczna oferuje nam wiele ró
ż
nych technik
u
ż
ytecznych
dla
analizy
składu
chemicznego
minerałów.
Analiz
ę
chemiczn
ą
minerału mo
ż
na wykona
ć
stosuj
ą
c metody klasyczne lub
instrumentalne. Po
ś
ród nich najbardziej rozpowszechnione s
ą
:
1)
analiza „na mokro” (klasyczna metoda, rozpuszczenie próbki
minerału w kwasach i oznaczenie zawarto
ś
ci jego składników w
otrzymanym roztworze);
2)
analiza instrumentalna metodami spektroskopowymi np. metod
ą
fluorescencji rentgenowskiej XRF (o
ś
wietlanie promieniami X
próbki sproszkowanego minerału powoduje,
ż
e pierwiastki obecne w
próbce
wysyłaj
ą
własne
promieniowanie
pozwalaj
ą
ce
je
zidentyfikowa
ć
i oznaczy
ć
ilo
ś
ciowo ich zawarto
ść
);
3)
analiza metodami mikroanalitycznymi (najcz
ęś
ciej stosowana jest
technika
mikrosondy
elektronowej,
w
której
o
ś
wietlanie
polerowanego preparatu mikroskopowego elektronami powoduje,
ż
e
pierwiastki
obecne
w
próbce
wysyłaj
ą
charakterystyczne
promieniowanie X pozwalaj
ą
ce je zidentyfikowa
ć
i oznaczy
ć
ilo
ś
ciowo ich zawarto
ść
, przy czym próbka mo
ż
e by
ć
bardzo mała,
do kilku mikrometrów
ś
rednicy).
Ka
ż
da z wymienionych technik ma swoje wady i zalety i inne
wymagania, co do wielko
ś
ci próbki i jej preparatyki. Na przykład do

2
zalet metod „na mokro” nale
ż
y to,
ż
e pozwalaj
ą
one oznaczy
ć
zawarto
ś
ci
pierwiastków na ró
ż
nych stopniach utlenienia (na przykład Fe
+2
i Fe
+3
,
czy S
-2
i S
+6
). W metodzie klasycznej mo
ż
liwe jest tak
ż
e oznaczenie
ilo
ś
ci wody wyst
ę
puj
ą
cej w minerale w postaci grup OH
-
(woda H
2
O
+
). Z
kolei zalet
ą
mikrosondy elektronowej jest mo
ż
liwo
ść
analizy bardzo
małych próbek, dzi
ę
ki czemu unika si
ę
mo
ż
liwych wpływów zanieczyszcze
ń
czy niehomogeniczno
ś
ci. Istniej
ą
oczywi
ś
cie metody instrumentalne,
pozwalaj
ą
ce oznaczy
ć
pierwiastki na ró
ż
nych stopniach utlenienia. Nie
ma jednak jednej uniwersalnej metody instrumentalnej, przy pomocy
której mo
ż
na wykona
ć
analiz
ę
chemiczn
ą
i jednocze
ś
nie wyznaczy
ć
stopnie utlenienia pierwiastków wchodz
ą
cych w skład analizowanego
minerału. Przewaga analiz instrumentalnych nad klasycznymi polega
głównie na znacznie krótszym czasie wykonania analizy.
Zarówno
w
metodach
klasycznych,
jak
i
w
wi
ę
kszo
ś
ci
metod
instrumentalnych musimy dysponowa
ć
odpowiednio du
żą
ilo
ś
ci
ą
próbki
minerału, który b
ę
dziemy analizowa
ć
. Minerał musi by
ć
pozbawiony
jakichkolwiek domieszek i wrostków innych minerałów oraz oznak
zwietrzenia i przemian. Czasami jest bardzo trudno uzyska
ć
wi
ę
ksz
ą
ilo
ść
"czystego" materiału. Do analizy klasycznej potrzebne jest 100 -
500 mg próbki a do XRF nawet 4 g. Je
ś
li minerał, wyst
ę
puj
ą
cy w
polimineralnej próbce widoczny jest dopiero pod mikroskopem, do
analizy stosuje si
ę
mikrosond
ę
elektronow
ą
. Zdolno
ść
rozdzielcza
wi
ą
zki elektronowej wynosi około 1
µ
m, co oznacza,
ż
e mo
ż
na oznaczy
ć
skład chemiczny niewielkich ziaren minerału o rozmiarach rz
ę
du
mikrometrów.
Za wyj
ą
tkiem metali rodzimych wszystkie minerały składaj
ą
si
ę
z
dwóch lub wi
ę
cej pierwiastków. Przedstawianie ich składu przy pomocy
wzorów
chemicznych
ma
na
celu
zawarcie
w
pojedynczym
zapisie
informacji o tym, z jakich pierwiastków zbudowany jest minerał, w
jakich wyst
ę
puj
ą
one proporcjach atomowych, oraz w jaki sposób s
ą
ze
sob
ą
poł
ą
czone. Taki zapis nazywa si
ę
wzorem strukturalnym lub pół
strukturalnym minerału:
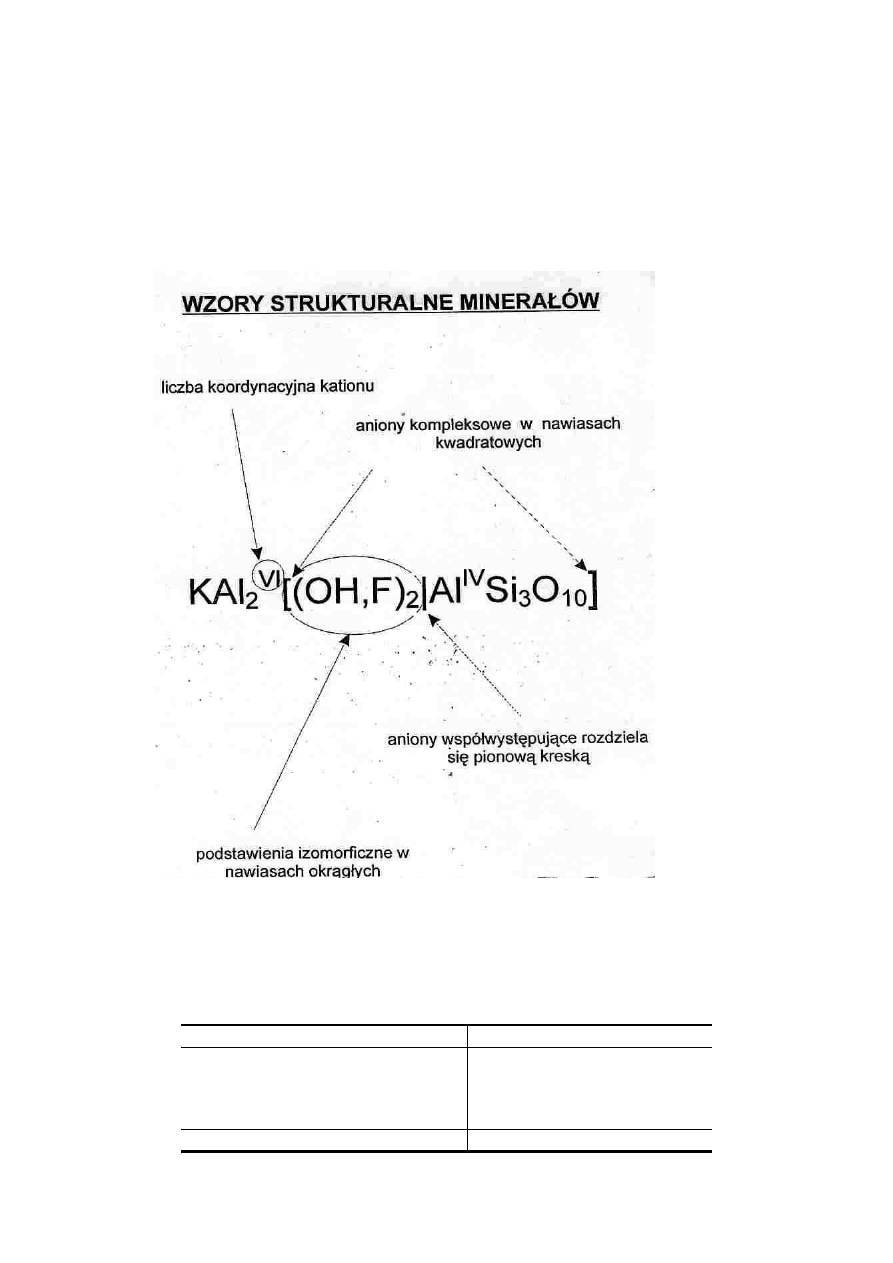
Oliwin
(Mg,Fe)
2
SiO
4
Dolomit
CaMg(CO
3
)
2
Gips
CaSO
4
.
2H
2
O
Apatyt
Ca
5
(PO
4
)
3
(F,Cl,OH)
Przy zapisie tym obowi
ą
zuj
ą
standardowe zasady zapisu wzorów
chemicznych. Kationy s
ą
wyliczone najpierw, po nich aniony i kompleksy
anionów (takie jak grupy SiO
4
, CO
3
, SO
4
czy PO
4
). Lu
ź
no zwi
ą
zane
składniki s
ą
wypisywane na ko
ń
cu wzoru (np. woda w strukturze gipsu
czy fluor, chlor i grupy hydroksylowe w apatycie). Dolne indeksy przy
symbolach i nawiasach wskazuj
ą
na wzgl
ę
dn
ą
ilo
ść
atomów lub grup
atomów uj
ę
tych w nawias, jak w przykładzie oliwinu czy apatytu.
Przecinkami oddziela si
ę
pierwiastki lub grupy pierwiastków wzajemnie
si
ę
podstawiaj
ą
ce na przykład na zasadzie diadochii. Podstawienia
izomorficzne, czyli wzajemna substytucja (zast
ę
powanie) pierwiastków w
strukturze
minerału
jest
efektem
podobie
ń
stwa
ładunku,
promieni
jonowych i elektroujemno
ś
ci. Na przykład Mg
2+
(promie
ń
jonowy 0,080 nm)
i Fe
2+
(promie
ń
jonowy 0,069 nm) podstawiaj
ą
si
ę
wzajemnie w strukturze
oliwinu (Mg, Fe)[SiO
4
]. W składzie oliwinu mo
ż
e wi
ę
c by
ć
obecny albo
magnez, albo
ż
elazo albo oba pierwiastki naraz. Substytucja tego
rodzaju nazywana jest izowalentn
ą
gdy
ż
zast
ę
puj
ą
si
ę
jony o tej samej
warto
ś
ciowo
ś
ci. W przypadku substytucji heterowaletnej zast
ę
puj
ą
si
ę
jony o ró
ż
nych warto
ś
ciowo
ś
ciach, np. jony sodu Na
+
podstawiaj
ą
ce jony
3
wapnia Ca
+2
i jednocze
ś
nie jony krzemu Si
+4
podstawiaj
ą
ce jony glinu Al
+3
w szeregu plagioklazów albit–anortyt:
Na
[Al
Si
Si
2
O
8
] -
Ca
[Al
Al
Si
2
O
8
].
Wyniki
analizy
prezentuje
si
ę
w
postaci
zawarto
ś
ci
wagowej
pierwiastków lub ich tlenków. Ró
ż
nice w zapisie wyników analizy
chemicznej zale
żą
od tego, czy minerał jest beztlenowy, na przykład
siarczek: galena PbS, Piryt FeS
2
, czy tlenowy, na przykład siarczan:
anhydryt CaSO
4
; krzemian: oliwin (Fe,Mg)SiO
4
; glinokrzemian: piroksen
Ca(Mg,Fe)(Si,Al)
2
O
6
.
Przykład zapisu wyników analizy chemicznej
minerału beztlenowego – sfalerytu:
Składnik
% wag
Fe
7,99
Cd
1,23
Zn
57,38
S
32,99
Suma
99,59
4
Przykład zapisu wyników analizy chemicznej
minerału tlenowego – oliwinu
Ilo
ś
ciowa analiza chemiczna minerału dostarcza nam informacji o
składzie pierwiastkowym i o wzajemnych proporcjach tych pierwiastków.
Nie podaje jednak informacji o tym gdzie i w jakich ilo
ś
ciach
poszczególne jony i atomy rozlokowane s
ą
w strukturze minerału.
Standardowo zapisana tabela wyników analizy chemicznej podaje nam
procentowy udział zawarto
ś
ci pierwiastków lub tlenków wyra
ż
ony w
procentach wagowych, które dodane do siebie powinny zamkn
ąć
si
ę
w 100%
(zazwyczaj wyst
ę
puj
ą
niewielkie odchylenia od tej sumy, wynikaj
ą
ce z
ograniczonej dokładno
ś
ci metod analitycznych). Dlatego aby skład
minerału był przedstawiony w formie wzoru strukturalnego trzeba wyniki
analizy chemicznej przeliczy
ć
.
Zasady przeliczenia mo
ż
na prze
ś
ledzi
ć
na poni
ż
szym przykładzie
wyliczenia wzoru skalenia.
Składnik Zawartość
w % wag.
Masa
molowa
tlenku
Ilość
kationów
w tlenku
Ilość
O
w
tlenku
Molowe
udziały
tlenków
Udziały
kationów
Udziały
anionów
(tlenu)
Udziały
kationów
na 8 atomów O
we wzorze
A
B
C
D
E
F = B/C
G = F
.
D
H = F
.
E
I=G*(8/H
tot
)
SiO
2
65,75
60,08
1
2
1,09437
1,09437
2,18874
2,94
Al
2
O
3
19,55
101,96
2
3
0,19174
0,38348
0,57522
1,03
Fe
2
O
3
1,08
159,68
2
3
0,00676
0,01352
0,02029
0,04
CaO
0,72
56,08
1
1
0,00927
0,00927
0,00927
0,02
Na
2
O
6,98
61,96
2
1
0,11797
0,23595
0,11797
0,63
K
2
O
6,23
94,20
2
1
0,06613
0,13227
0,06613
0,36
Suma
100,44
H
tot
=
2,977652
W kolumnie A wypisane s
ą
te składniki (pierwiastki w postaci
tlenków), które były analizowane. W kolumnie B podane s
ą
wyniki
analiz: zawarto
ś
ci wyra
ż
one w procentach wagowych tlenków, które
sumuj
ą
si
ę
w tym wypadku do 100,44% wagowych. Pierwszym krokiem jest
zamiana wyników analiz na molowe udziały tlenków przez podzielenie
procentu wagowego przez mas
ę
atomow
ą
tlenku (kolumna B dzielona przez
kolumn
ę
C). Wynik zapisany jest w kolumnie F.
Nast
ę
pnym krokiem jest zamiana molowych udziałów tlenków na udziały
kationów. Dokonuje si
ę
tego przez pomno
ż
enie ilo
ś
ci kationów w ka
ż
dym
tlenku (kolumna D) przez warto
ś
ci z kolumny F. Wynik zapisany jest w
kolumnie G (G=F*D). Na przykład dla krzemu jest to 1 razy 1,09437, dla
glinu jest to 2 razy 0,19174, dla
ż
elaza 2 razy 0,00676 itd. Nast
ę
pn
ą
kolumn
ę
, udziały tlenów, uzyskujemy podobnie mno
żą
c warto
ś
ci z kolumny
G przez ilo
ść
tlenów we wzorze ka
ż
dego przeliczanego tlenku (kolumna
E): otrzymujemy kolumn
ę
H (H=G*E). Na przykład dla tlenu w SiO
2
jest to
2 razy 1,09437, dla tlenu w Al
2
O
3
jest to 3 razy 0,19174, itd. W
Składnik
% wag
SiO
2
34,96
FeO
36,77
MnO
0,52
MgO
27,04
Suma
99,29

5
zasadzie w tym momencie mo
ż
emy napisa
ć
ju
ż
pół strukturalny wzór
skalenia wynikaj
ą
cy z analizy. Wygl
ą
da on tak:
Ca
0,009
Na
0,118
K
0,066
Fe
0,007
Al
0,192
Si
1,094
O
2,977
Poniewa
ż
przyj
ę
te
jest
podawanie
warto
ś
ci
we
wzorze
skalenia
proporcjonalnie do o
ś
miu atomów tlenu, wszystkie powy
ż
sze zawarto
ś
ci
mno
ż
ymy przez iloraz (8/H
tot
) czyli w tym wypadku przez 8/2,97765.
Powstaje kolumna I, w której wszystkie zawarto
ś
ci jonów w skaleniu
znormalizowane s
ą
do o
ś
miu tlenów. Otrzymany wzór wygl
ą
da tak:
(Ca
0,02
Na
0,63
K
0,36
)(Fe
0,04
Al
1,03
Si
2,94
)O
8
co jest bardzo bliskie idealnemu wzorowi (Ca,Na,K)[(Fe,Al,Si)
4
O
8
].
Ró
ż
nice wynikaj
ą
cz
ęś
ciowo z nieidealno
ś
ci naturalnego minerału a
cz
ęś
ciowo z bł
ę
dów analizy. Uwaga: prosz
ę
zwróci
ć
uwag
ę
w powy
ż
szej
tabeli,
ż
e zaokr
ą
gle
ń
dokonujemy dopiero na samym ko
ń
cu a w trakcie
oblicze
ń
u
ż
ywamy 4 lub 5 miejsc po przecinku.
Przeliczanie analiz chemicznych minerałów:
Przykład 1. Troilit FeS
1
% wagowe
2
masy atomowe
3
udziały atomowe
(kolumna 1/kol.2)
4
stosunki atomowe
Fe
63,53
55,85
1,137
S
36,47
32,07
1,137
1:1
wzór: FeS
Przykład 2. Chalkopiryt CuFeS
2
1
% wagowe
2
masy atomowe
3
udziały atomowe
(kolumna 1/kol.2)
4
stosunki atomowe
Cu 34,30
63,54
0,54982
1 1,08
Fe
30,59
55,85
0,54772
1 1,09
S
34,82
32,07
1,08575
2 2,17
suma: 99,71
Przykład 3. Sfaleryt ZnS z podstawieniami izomorficznymi:
1
% wagowe
2
masy atomowe
3
udziały atomowe
(kolumna 1/kol.2)
4
stosunki atomowe
Fe
18,25
55,85
0,3268
(0,3286•1)/1,0468 = 0,312
Mn 2,66
54,94
0,0484
(0,0484•1)/ 1,0468 = 0,046
Cd
0,28
112,40
0,0025
(0,0025•1)/ 1,0468 = 0,02
Zn
44,67
65,37
0,6833
(0,6833•1)/ 1,0468 = 0,653
S
33,57
32,07
1,0468
(1,0468•1)/ 1,0468 = 1
Suma stosunków atomowych Fe, Mn, Cd i Zn = 1,01
Wzór
: (Fe
0,31
Mn
0,04
Cd
0,002
Zn
0,65
)S
6
Przykład 4. Gips CaSO
4
•2H
2
O
1
% wagowe
2
masy molowe
3
udziały molowe
(kolumna 1/kol.2)
4
stosunki atomowe
CaO
32,44
56,08
0,57846
1,156 1
SO
3
46,61
80,08
0,58211
1,164 1
H
2
O
+
20,74
18,0
1,1522
2,304 2
Suma: 99,79
CaO•SO
3
•2H
2
O
Przykład 5. Oliwin (Mg,Fe)
2
SiO
4
1
% wagowe
2
masy molowe
3
udziały molowe
(kolumna
1/kol.2)
4a
stosunki
atomowe
kationów
4b
Stosunki
atomowe
anionów
5
liczby
kationów na 4
atomy O
SiO
2
34,96
50,09
0,58179
Si 0,5818
1,1636
0,989
FeO
71,85
71,845
0,5118
Fe
2+
0,5118
0,5118
0,879
MnO
0,52
70,94
0,00733
Mn 0,00733
0,00733
0,012
MgO
27,04
40,31
0,67080
Mg 0,6708
0,6708
1,140
Suma
99,29
2,3535
Suma FeO, MnO i MgO = 2,022
Wartości w kolumnie 4a oblicza się mnożąc wartość kolumny 3 razy ilość kationów we wzorze tlenku.
Wartość w kolumnie 4b oblicza się mnożąc wartość z kolumny 3 razy ilość tlenów we wzorze tlenku.
Obliczone liczby kationów powinny w sumie dać 2, a nie 2,022. Dlatego trzeba je dalej przeliczyć z proporcji:
Na 2,022 przypada 0,87 Fe
Na 2,022 przypada 0,012 Mn
to na 2 - x
To na 2 - x
x = (2•0,87)/2,022=0,86
x=(2•0,12)/2,022=0,011
Na 2,022 przypada 1,14 Mg
To na 2 - x
x=(2•1,14)/2,022=1,13
wzór:
(Fe
0,86
Mn
0,01
Mg
1,13
) SiO
4
Procentowy udział fajalitu i forsterytu:
Fe
0,86
0,86/1,99•100% = 43,3% Fajalitu Fe
2
SiO
4
Mg
1,13
1,13/1,99•100% = 56,7% Forsterytu Mg
2
SiO
4
Suma: 1,99

7
Przykład 6. Piroksen Ca(Mg,Fe) [(Si, Al.)
2
O
6
]
1
% wagowe
2
stosunki
atomowe
3
Stosunki
atomowe
kationów
4
liczba
tlenu
5
liczba
kationów na
6 atomów O
6
podział kationów
na pozycje
strukturalne
7
suma kationów na
pozycjach strukturalnych
SiO
2
50,38
0,8384
0,8384
1,6768
1,875
Si 1,875
Si + Al = 2,0
Al
2
O
3
3,01
0,0295
0,0590
0,0885
0,192
Al 0,125
Al 0,007
TiO
2
0,45
0,0056
0,0056
0,0112
0,012
Ti 0,12
Fe
2
O
3
1,95
0,0122
0,0244
0,0366
0,055
Fe
3+
0,055
FeO
4,53
0,00630
0,0630
0,0630
0,141
Fe
2+
0,141
MnO
0,09
0,0013
0,0013
0,0013
0,003
Mn 0,003
MgO
14,69
0,3643
0,3643
0,3643
0,815
Mg 0,815
Al+Ti+Fe
2+
+Fe
3+
+Mn+Mg
= 1,033 ≈ 1
CaO
24,32
0,4321
0,4321
0,4321
0,996
Ca 0,996
Na
2
O
0,46
0,0074
0,00148
0,0074
0,033
Na 0,033
K
2
O
0,15
0,0016
0,0032
0,0016
0,007
K 0,007
Ca+Na+K = 1,006 ≈ 1
suma
99,94
2,6828
Faktor tlenowy = 6/2,6828 = 2,236469
MgO jako MgSiO
3
(enstatyt = En)
FeO jako FeSiO
3
(ferrosilit = Fs)
CaO jako CaSiO
3
(wollastonit = Wo)
Używając proporcji molowych:
MgO =0,3644
FeO = 0,0630
CaO = 0,4321
Suma= 0,8595
%En = 42,39
%Fs = 7,33
%Wo = 50,27
Wzór:
(Ca
0,97
Na
0,03
K
0,007
)(Mg
0,815
Mn
0,003
Fe
2+
0,141
Fe
3+
0,055
Al
0,007
Ti
0,012
)[(Si
1,875
Al
0,125
)O
6
]
8
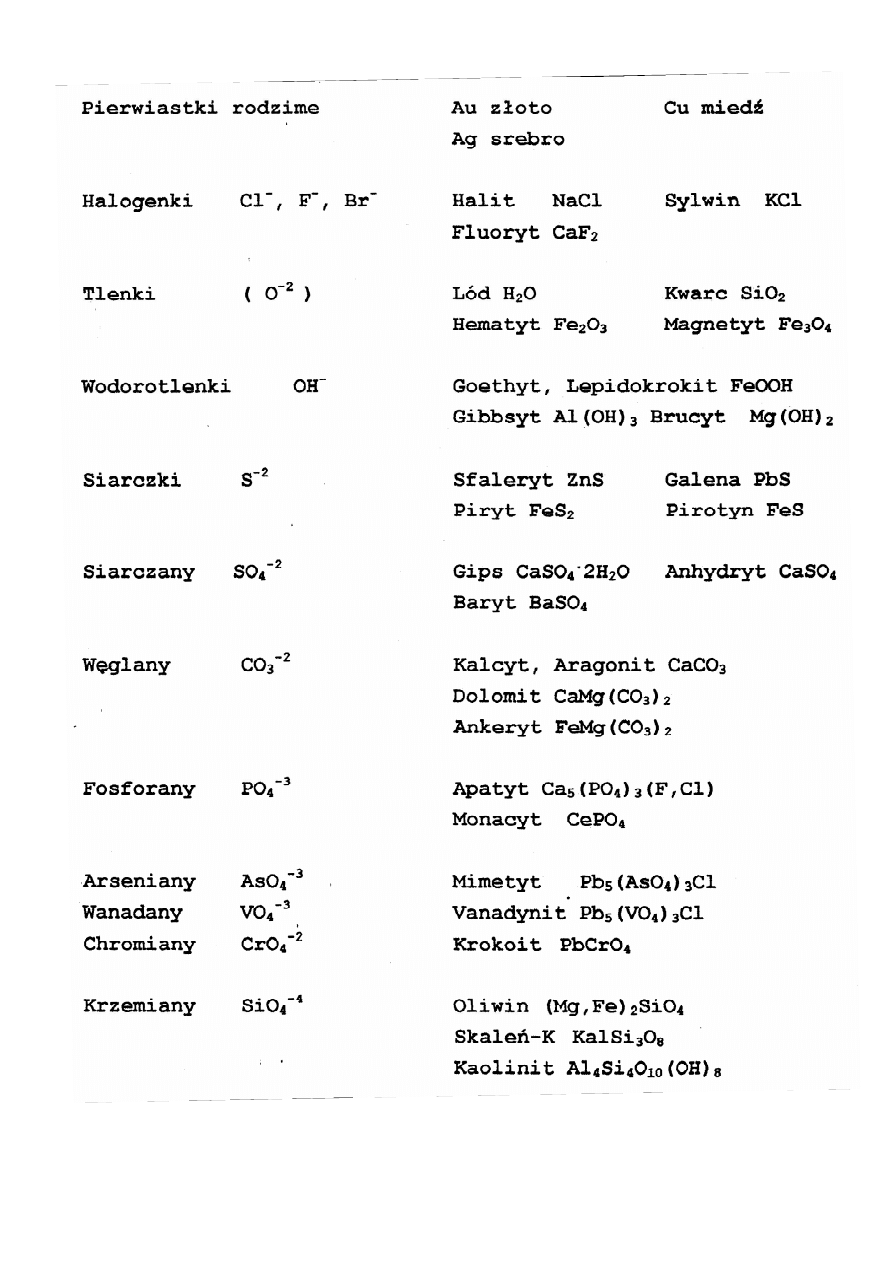
Przykłady klas chemicznych minerałów
Opracowanie konspektu:
T.Bajda i M.Manecki, 2004; M.Manecki i A.Kleszczewska 2007
Wyszukiwarka
Podobne podstrony:
Konspekt ćw 1
konspekt ćw. 9, Udostępnione, Dietetyka
konspekt ćw 10
konspekt cw 3 1 programowanie liniowe
konspekt cw 5 3 Zad 3 MRP
konspekt cw 5 2 Zad 2 MRP
konspekt cw 4 programowanie sieciowe
Konspekt ćw I 3 Usytuowanie płodu w macicy
KONSPEKT CW 1
Konspekt ćw. 4, Udostępnione, Dietetyka
Konspekt ćw 8
konspekt ćw 8
Konspekt ćw VI 1a Partogram
Konspekt ćw.kor, College, Pedagogika, rok III, Gimnastyka korekc. - kompens
Konspekt ćw - kolana szpotawe, AWF Wychowanie fizyczne, metodyka wychowania fizycznego
konspekt ćw 2, Ćwiczenia
konspekt ćw pływanie, fizjoterapia
konspekt cw 5 1 Zad 1 MRP
konspekt cw 1 planowanie, sterowanie
więcej podobnych podstron