1
2. Biochemia - woda
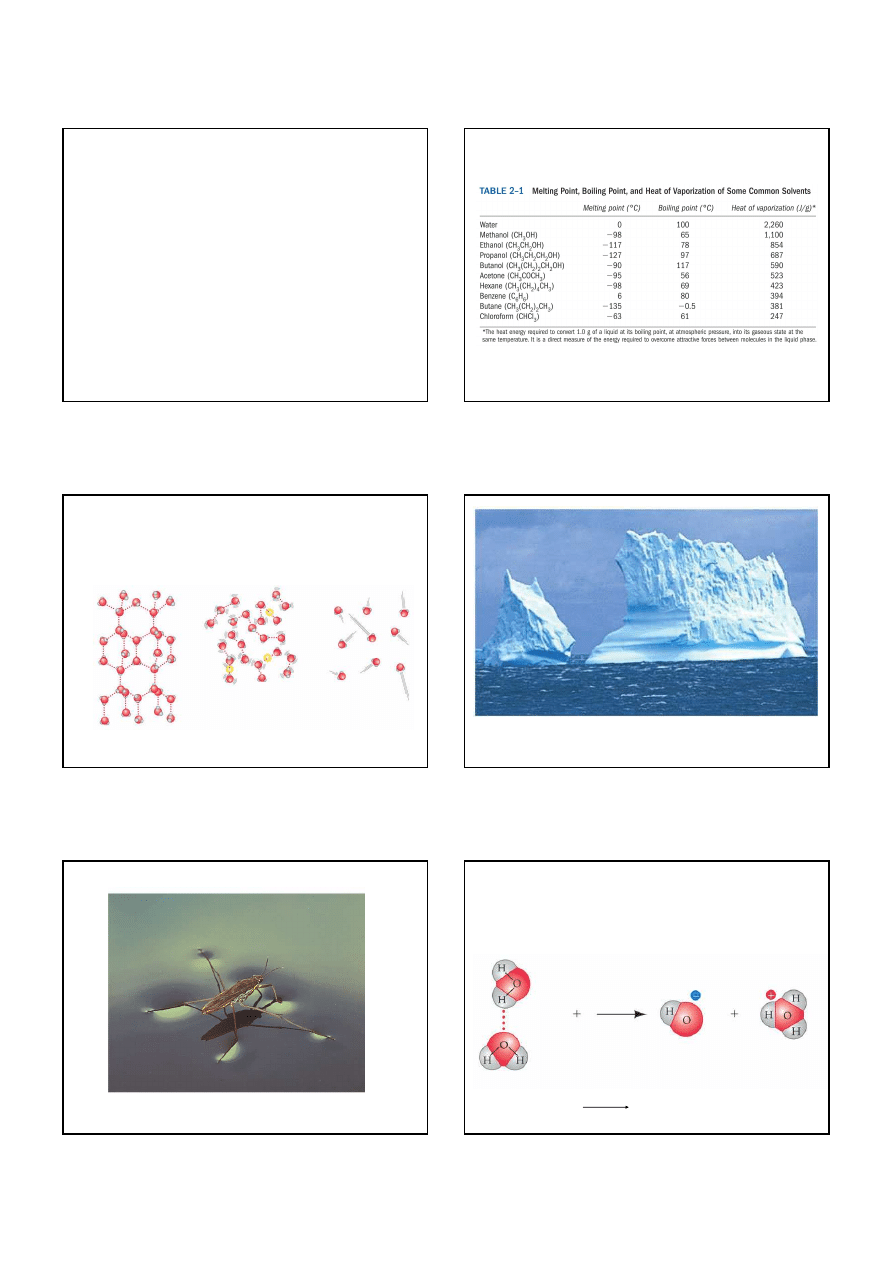
Woda ma dziwnie wysoką temperaturę topnienia i wrzenia
lód
woda
para
Wiązania wodorowe łączą cząsteczki wody
Ponieważ woda rozszerza się w czasie zamarzania, lód ma
mniejszą gęstość w stanie stałym niż woda
Kohezja między cząsteczkami wody jest przyczyną wysokiego
napięcia powierzchniowego
Nartnik porusza się po powierzchni wody
Woda jest słabym kwasem. Cząsteczki wody są w
ograniczonym stopniu zdysocjowane
H
2
O
H
2
O
OH
-
H
3
O
+
H
2
O
H
+
+ OH
-
2
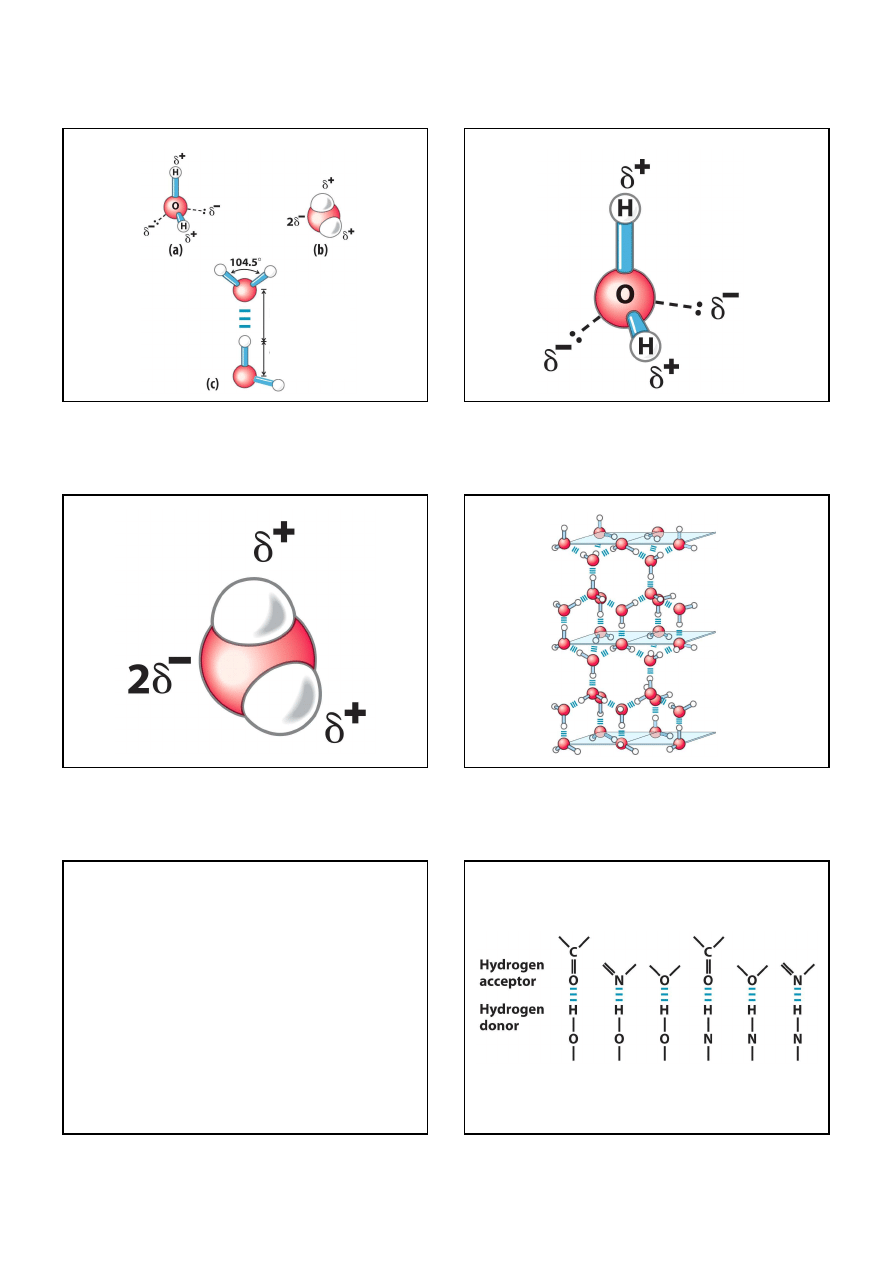
Struktura cząsteczki wody
wiązanie wodorowe:
0.177 nm
wiązanie kowalencyjne:
0.0965 nm
Dodatnie i ujemne ładunki w cząsteczce wody
Dodatnie i ujemne ładunki w cząsteczce wody
Wiązania wodorowe w krysztale lodu
Kiedy lód się topi i woda wyparowuje, następuje pochłanianie ciepła
H
2
O (stałe)
→
→
→
→
H
2
O (ciekłe)
∆∆∆∆
H = +5.9 kJ/mol
H
2
O (ciekłe)
→
→
→
→
H
2
O (gaz)
∆∆∆∆
H = +44.0 kJ/mol
∆∆∆∆
G =
∆∆∆∆
H - T
∆∆∆∆
S
G: wolna energia
H: entalpia (opisuje ilość i rodzaj wiązań chemicznych)
T: temperatura
S: entropia (opisuje stopień uporządkowania)
Proces odbywa się spontanicznie tylko wtedy, gdy
∆∆∆∆
G jest ujemna.
∆∆∆∆
H > 0 ⇒
⇒
⇒
⇒ T
∆∆∆∆
S >
∆∆∆∆
H
Wzrost entropii jest siłą, która powoduje topienie sie lodu
i parowanie wody.
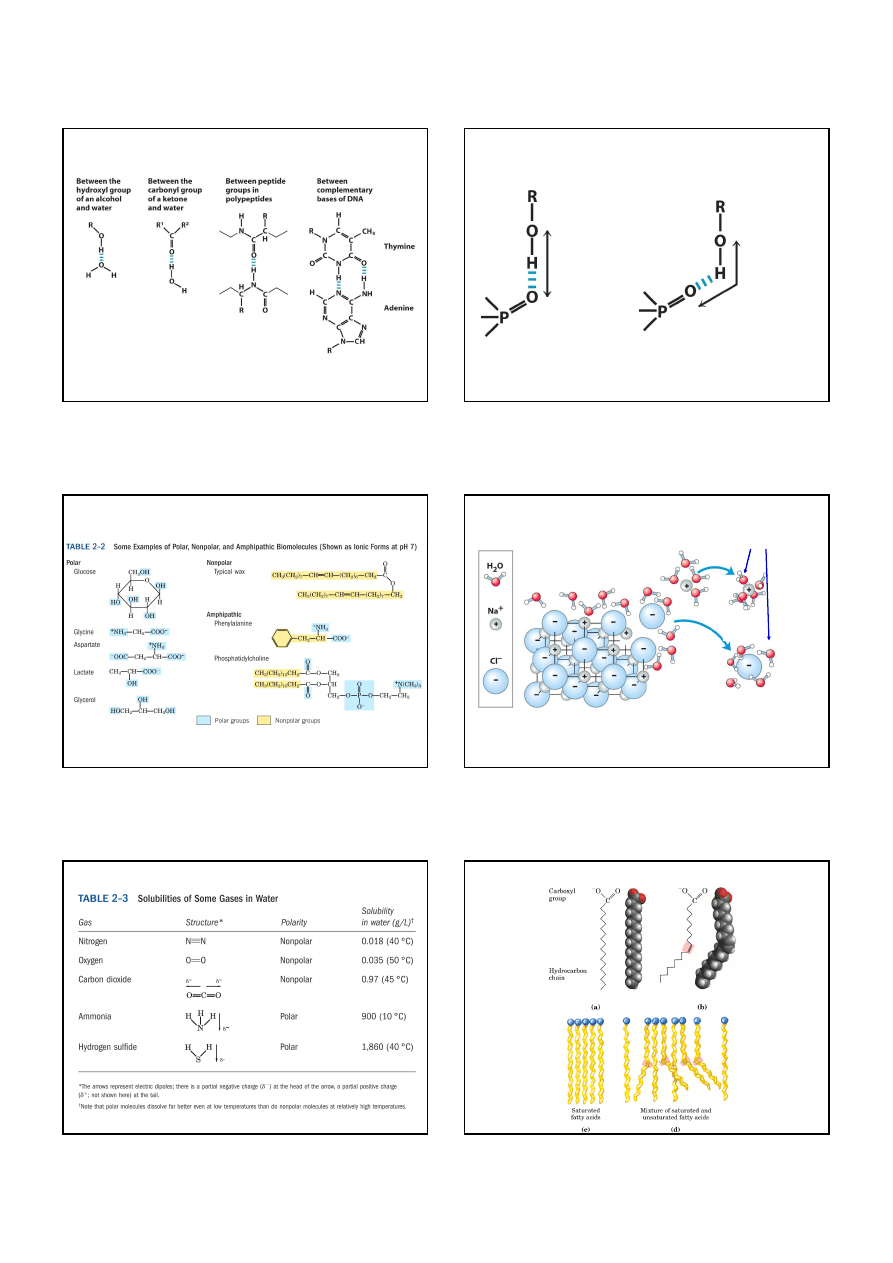
Wiązanie wodorowe w układach biologicznych
3
Wiązanie wodorowe w układach biologicznych
Silne i słabe wiązania wodorowe
silne
słabe
Wiązanie wodorowe jest najsilniejsze, gdy 3 atomy biorące
w nim udział znajdują się w linii prostej.
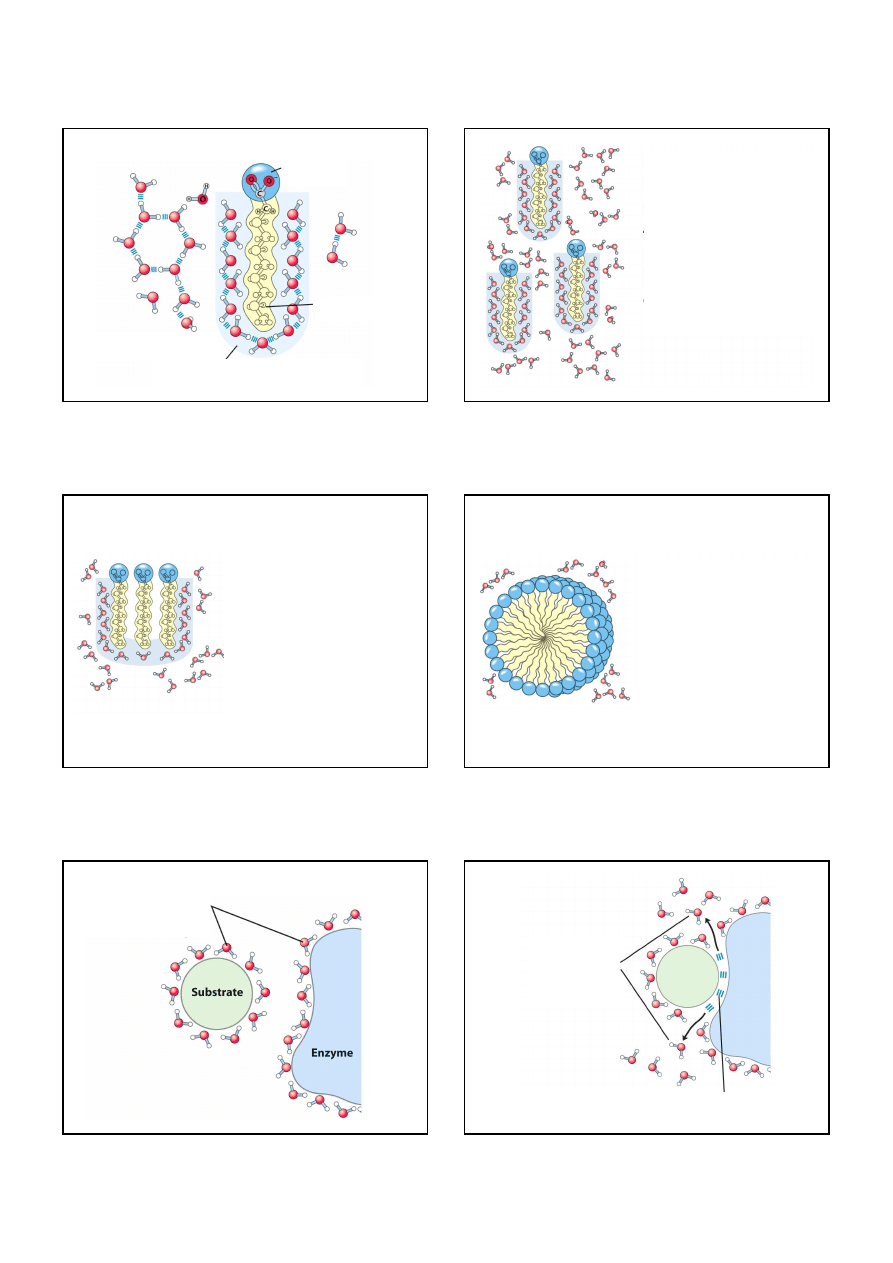
Cząsteczki polarne i niepolarne
Woda jako rozpuszczalnik
kryształy NaCl
uwodniony
jon Na
+
uwodniony
jon Cl
-
orientacja
cząsteczek H
2
O
W czasie rozpuszczania kryształu entropia wzrasta
Niepolarne gazy słabo rozpuszczają się w wodzie
Nasycone i nienasycone kwasy tłuszczowe
4
Niepolarne związki wytwarzają energetycznie niekorzystne zmiany
w strukturze wody
polarna
„głowa”
niepolarny
rdzeń
cząsteczki wody
tworzą klatkę
wokół hydrofobowego
rdzenia
Każda cząsteczka lipidu
zmusza otaczające ją
cząsteczki H
2
O
do przyjęcia wyżej zorganizowanej
struktury.
Entropia maleje!
∆∆∆∆
S < 0 ⇒
⇒
⇒
⇒
∆∆∆∆
G > 0
Lipidy tworzą „pęczki”,
które wymagają mniejszej ilości
cząsteczek wody
Micele: wszystkie hydrofobowe
fragmenty cząsteczek
znajdują się wewnątrz.
Entropia wzrasta.
Usunięcie cząsteczek wody działa na korzyść
związania substratu przez enzym
uporządkowane
cząsteczki wody
oddziałujące z
substratem
i enzymem
nieuporządkowane
cząsteczki wody
oddziaływania enzymu z substratem
stabilizowane przez wiązania wodorowe,
jonowe i hydrofobowe
Usunięcie cząsteczek wody działa na korzyść
związania substratu przez enzym
5
4 typy niekowalencyjnych oddziaływań między biocząsteczkami
w roztworze wodnym
wiązanie wodorowe
między neutralnymi grupami
między wiazaniami peptydowymi
oddziaływania jonowe
przyciąganie
odpychanie
oddziaływania hydrofobowe
siły van der Waalsa
dowolne 2 atomy
w bliskim sąsiedztwie
Siły van der Waalsa to słabe oddziaływania miedzyatomowe
Przeskakiwanie protonów
Osmoza: przenikanie wody przez przepuszczalną błonę
czysta woda
roztwór soli
błona
tłok: siła=cisnienie osmotyczne
Ciśnienie osmotyczne: siła niezbędna do przeciwstawienia się
przenikaniu wody przez błonę
Π
Π
Π
Π
= icRT
i: stała van’t Hoffa
c: stężenie
R: stała gazowa
T: temperatura
ic: osmolarność
Roztwory o takiej samej osmolarności są
izotoniczne
.
Roztwór o niższej osmolarności jest
hipotoniczny
.
Roztwór o wyższej osmolarności jest
hipertoniczny
.
Komórki w roztworach izotonicznych, hipotonicznych i hipertonicznych
roztwór izotoniczny
roztwór hipertoniczny
roztwór hipotoniczny
woda
woda
woda
woda
6
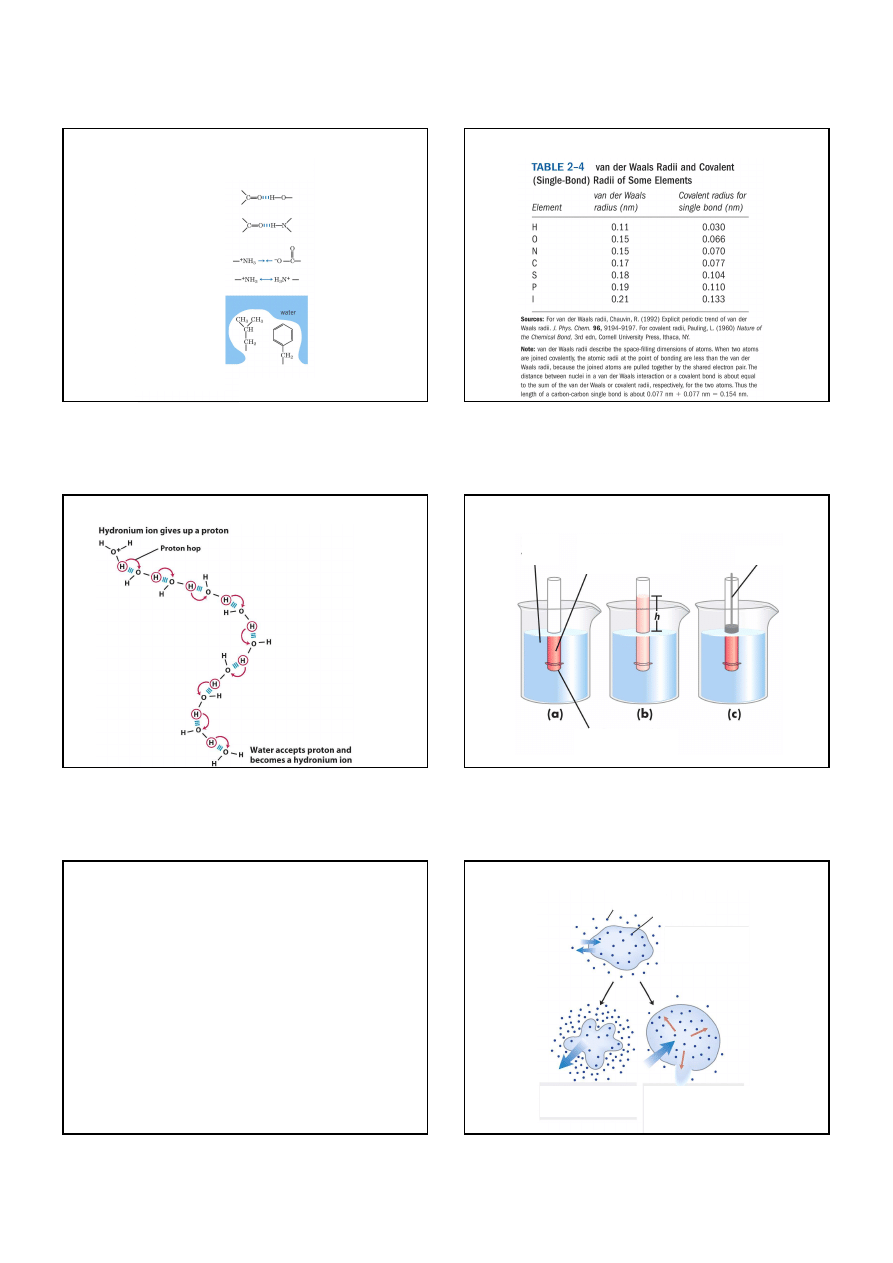
Przykład osmozy: chwytanie owadów przez rosiczkę.
Zamykanie liści jest spwodowane przez zmiany ciśnienia osmotycznego
w liściach, spowodowane przez uwolnienie jonów K
+
przez owada.
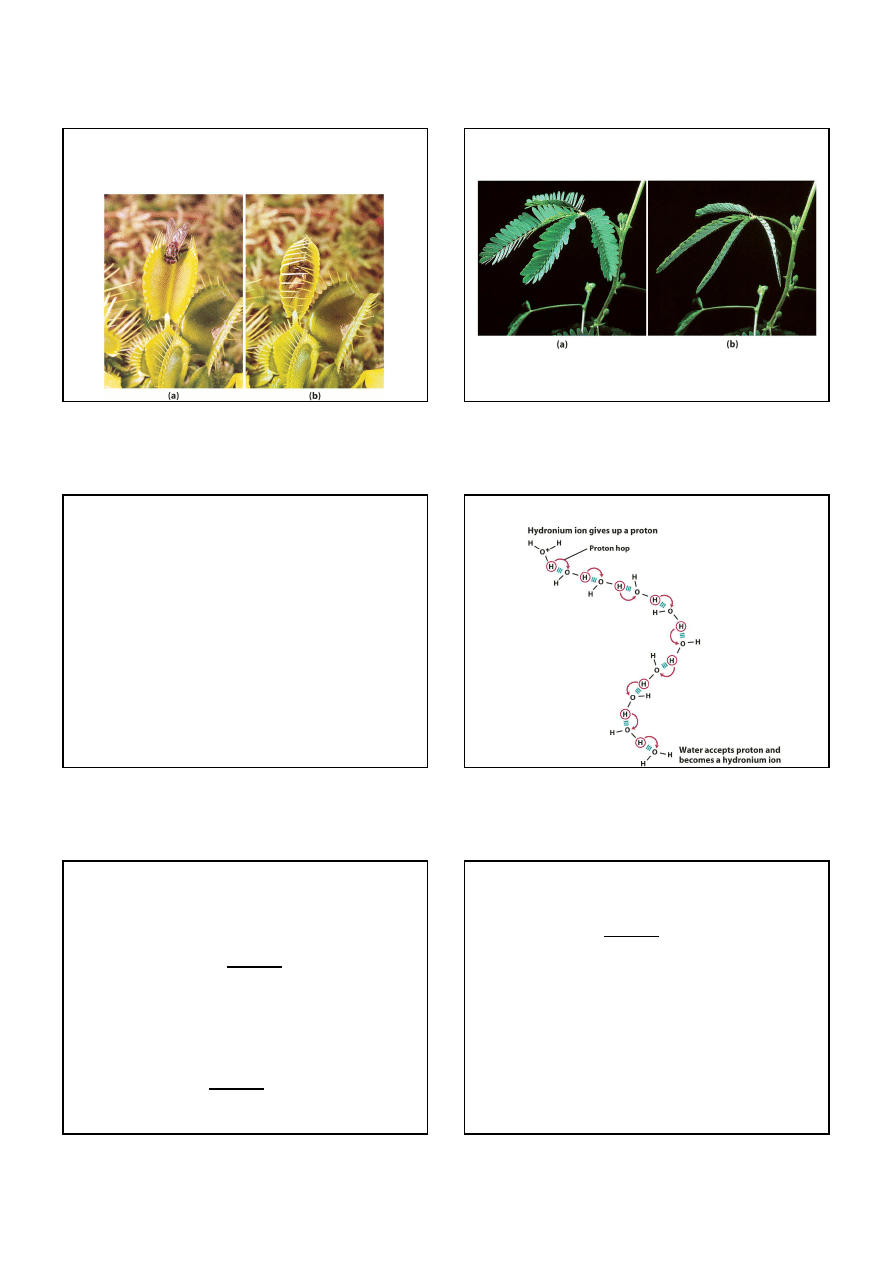
Składanie liści przez mimozę pod wpływem wiatru:
wiatr powoduje uwolnienie jonów K
+
, co powoduje zmianę ciśnienia
osmotycznego
Czysta woda jest słabo zjonizowana
H
2
O
↔
↔
↔
↔
H
+
+ OH
-
Wolne protony nie występuje w roztworze, tylko tworzą jony hydroniowe:
H
3
O
+
Przenoszenie jonu H
+
jest bardzo szybkie
Stała równowagi reakcji
A + B
↔
↔
↔
↔
C + D
K
eq
=
[C][D]
[A][B]
jonizacja wody:
H
2
O
↔
↔
↔
↔
H
+
+ OH
-
K
eq
=
[H
+
][OH
-
]
[H
2
O]
ponieważ mol H
2
O to 18 g, więc stężenie molowe wody to 55.5 mol/l
K
eq
=
[H
+
][OH
-
]
55.5 M
(55.5 M) (K
eq
) = [H
+
][OH
-
] = K
w
(iloczyn jonowy wody)
K
eq
= 1.8 x 10
-16
M
K
w
= [H
+
][OH
-
] = (55.5 M)(1.8 x 10
-16
M) =
1.0 x 10
-14
M
2
[H
+
] = [OH
-
] = 10
-7
M
pH = log 1/[H
+
] = - log[H
+
]
7
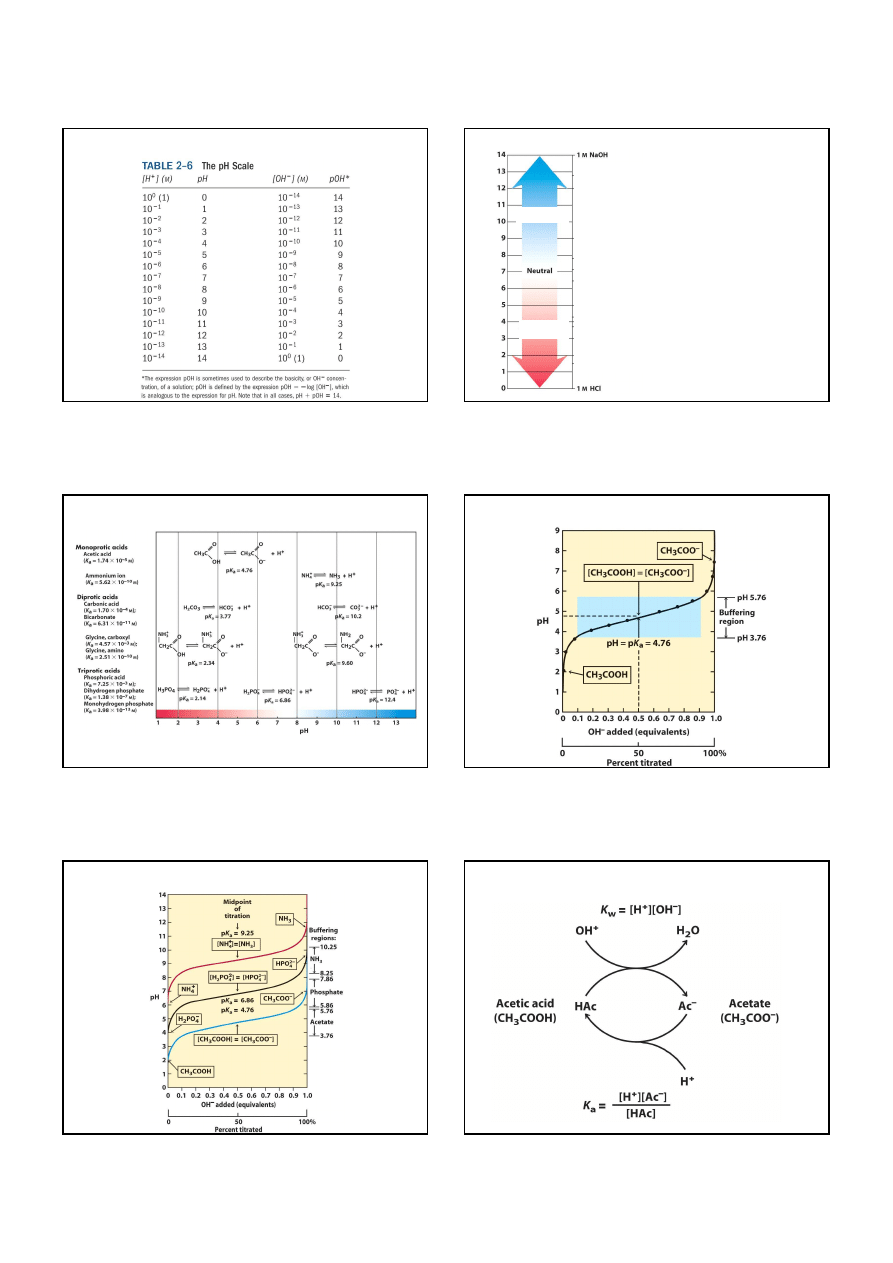
Skala pH
Skala pH
zasadowy
kwaśny
wybielacz
amoniak
roztwór sody do pieczenia
(NaHCO
3
)
woda morska, białko jaja
krew, łzy
mleko, ślina
czarna kawa
piwo
czerwone wino
Coca-cola
sok z cytryny
sok żołądkowy
Kwasy jedno- wielozasadowe
Miareczkowanie kwasu octowego
Miareczkowanie kwasu octowego, fosforowego i amoniaku
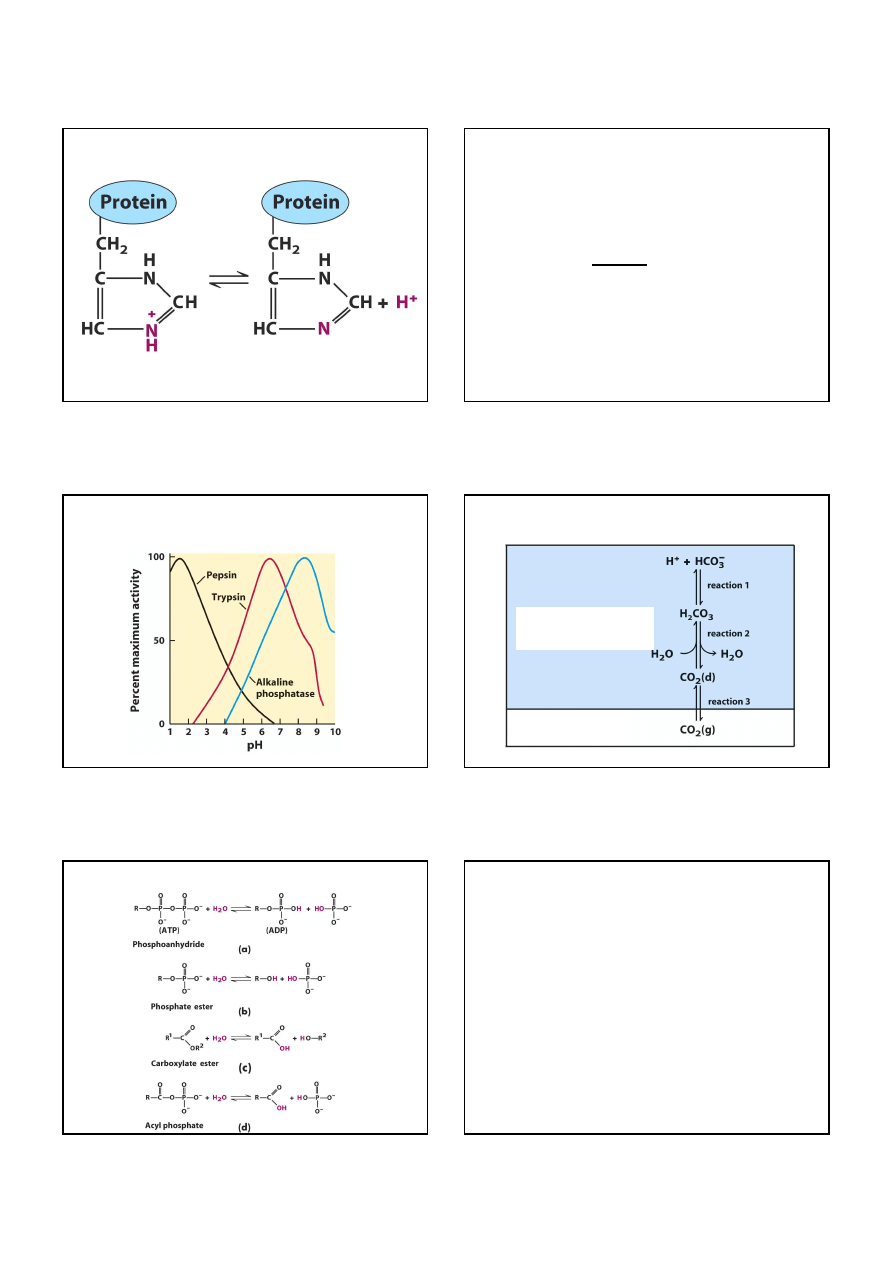
Kwas octowy jako bufor
8
Histydyna też działa jako bufor
Słabe kwasy i zasady mają charakterystyczne stałe dysocjacji (K
a
)
CH
3
COOH = H
+
+ CH
3
COO
-
HA = H
+
+ A
-
K
eq
= = K
a
[H
+
][A
-
]
[HA]
pK
a
= log 1/K
a
= -logK
a
Enzymy mają różne optymalne pH
Węglan jako system buforujący krew
faza ciekła
(krew)
faza gazowa
(płuca)
Woda jako reagent: hydroliza
02. Biochemia - woda
Tematy do zapamiętania
1. Budowa cząsteczki wody, rola wiązań wodorowych.
2. Osmoza, ciśnienie osmotyczne.
3. Skala pH.
4. Bufory.
5. Stała dysocjacji.
Wyszukiwarka
Podobne podstrony:
02 BIOCHEMIA aminokwasy i bialka
biochem woda zagadnienia seminarium, biochemia
02 BIOCHEMIA 2008 aminokwasy i bialka
04 pH roztworow i reakcje soli z woda 26 02 2015
Biochemia - W14 - 28.02.2001, Biochemia XIV
Biochemia - W13 - 21.02.2001, Biochemia XIII
b27.02.07, Prywatne, Biochemia WYKŁADÓWKA I, Biochemia wykładówka 1, WYKŁADY, wykłady II
Biochemia I Lista 02 PL id 86389 (2)
14 - 28.02.2001(cukrzyca pocz lipidów), materiały medycyna SUM, biochemia, Kolokwium VI
b7.02.07, Prywatne, Biochemia WYKŁADÓWKA I, Biochemia wykładówka 1, WYKŁADY, wykłady II
Woda pula, biochemia
Biochemia XIV - 28.02.2001, materiały medycyna SUM, biochemia, seminaria
02. Wstęp, Naika, stomatologia, Biochemia, Praca z biochemii
Biochemia-wykad 02.03.11. Wolne rodniki cd, Dietetyka CM UMK, Biochemia
więcej podobnych podstron