M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
1
M
ORFOLOGIA BAKTERII
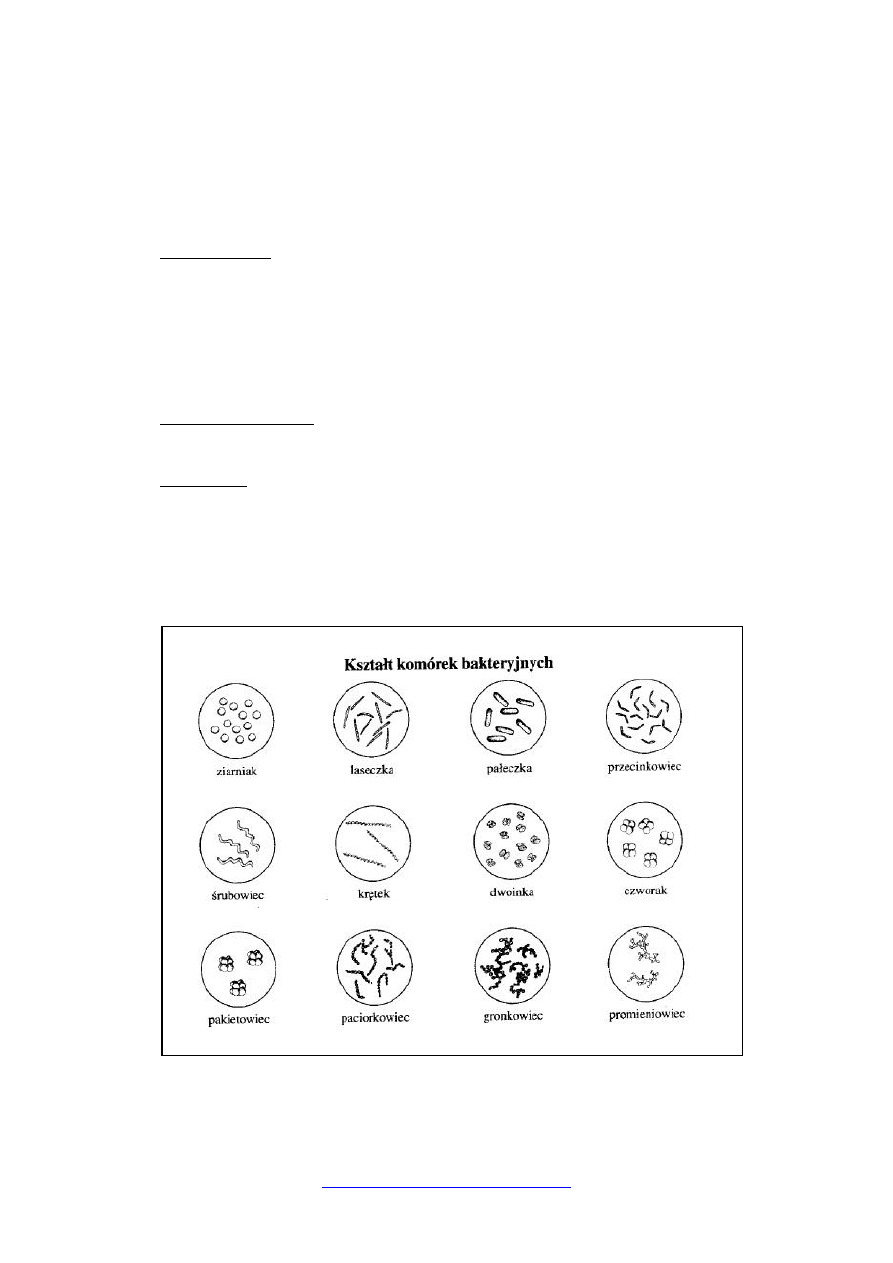
Małe zróżnicowanie kształtów, wyróżniamy 3 zasadnicze kształty: kulisty, cylindryczny
(wydłużony) i nitkowaty.
1. Formy kuliste, noszą nazwę ziarniaków (coccus) i mogą tworzyć układy (jeśli po
podziale komórki się nie rozłączają)
- ziarniak micrococcus,
- dwoinka diplococcus,
- czwórniak, czworak tetracoccus (tetragenes),
- pakietowiec (sześcianka) sarcina,
- paciorkowiec streptococcus,
- gronkowiec staphylococcus.
2. Formy cylindryczne
- laseczka bacillus (dłuższe),
- pałeczka bacterium (krótsze),
3. Inne formy
- maczugowiec corynebacterium,
- przecinkowiec vibrio,
- śrubowiec spirillum
- krętek spirochaeta
- formy nitkowate np. promieniowce mają komórki podobne do strzępek grzybów
Formy przetrwalne różnią się od komórek wegetatywnych budową i składem chemicznym.
Wykazują odporność na szkodliwe działanie czynników zewnętrznych, m.in. wysoką
temperaturę (ważna rola w skażeniach żywności). Wytwarzane są przez laseczki (tlenowe

M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
2
Bacillus i beztlenowe Clostridium), promieniowce, bakterie śluzowe. Pałeczki nie
wytwarzają przetrwalników.
Bakterie nie przekraczają 2
m średnicy i 3-5
m długości, z wyjątkiem form nitkowatych
osiągających kilkadziesiąt mikrometrów. Obserwacje bakterii prowadzi się w badaniach
mikroskopowych, w preparatach przyżyciowych, częściej jednak martwe komórki barwione
w preparatach utrwalonych.
PREPARATY MIKROSKOPOWE I BARWIENIE DROBNOUSTROJÓW
Małe wymiary komórek mikroorganizmów nie pozwalają na ich obserwację okiem
nieuzbrojonym. Do badania morfologii, oceny liczebności czy żywotności drobnoustrojów
stosuje się obserwacje mikroskopowe preparatów wykonanych bezpośrednio z materiału
badanego (np. preparaty odciskowe) lub z hodowli.
Przygotowane preparaty można oglądać bezpośrednio pod mikroskopem lub dodatkowo je
wybarwić.
Celem barwienia jest:
odróżnienie bakterii od składników otoczenia,
umożliwienie obserwacji cech morfologicznych i diagnostycznych (m.in. kształt,
wielkość, wzajemny układ komórek w hodowli, tzn. występowanie komórek
pojedynczo lub w różnych układach, obecność otoczek, zdolność ruchu, ilość i
rozmieszczenie rzęsek/wici, sposób rozmnażania się – przez podział, tworzenie
pączków, zarodników i form przetrwalnych) w celu rozróżnienia poszczególnych
grup drobnoustrojów między sobą i odróżnienia pewnych szczegółów w budowie,
wykazanie zmian czynnościowych w komórce,
ułatwienie liczenia drobnoustrojów (żywych, martwych).
Barwienie drobnoustrojów jest procesem fizykochemicznym, który polega na wniknięciu
barwnika do wnętrza komórki i utworzeniu barwnego kompleksu z cytoplazmą.
Barwienie bakterii zależy:
- od stanu fizykochemicznego barwnika i odbarwiacza,
- natury barwionych drobnoustrojów,
- zewnętrznych czynników natury fizycznej i chemicznej wspierających proces barwienia.
W zależności od sposobu barwienia wyróżniamy barwienia przyżyciowe i barwienie
preparatów utrwalonych.
1 . Przygotowanie preparatów przyżyciowych
Preparaty przyżyciowe służą do obserwacji ruchliwości, żywotności, sposobu
rozmnażania, a czasami do wykrywania substancji zapasowych. Najczęściej prowadzi się
obserwacje drożdży i pleśni ze względu na ich budowę i rozmiar. Obserwacja bakterii, ze
względu na małe rozmiary, ogranicza się jedynie do oceny ich ruchliwości.
Preparaty przyżyciowe wykonuje się na szkiełku podstawowym (w kropli spłaszczonej),
a w przypadku badania ruchliwości bakterii lub prowadzenia obserwacji nad sposobem
rozmnażania drożdży preparaty wykonujemy na szkiełku z wgłębieniem zwanym komorą
Lindnera (w kropli wiszącej).
M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
3
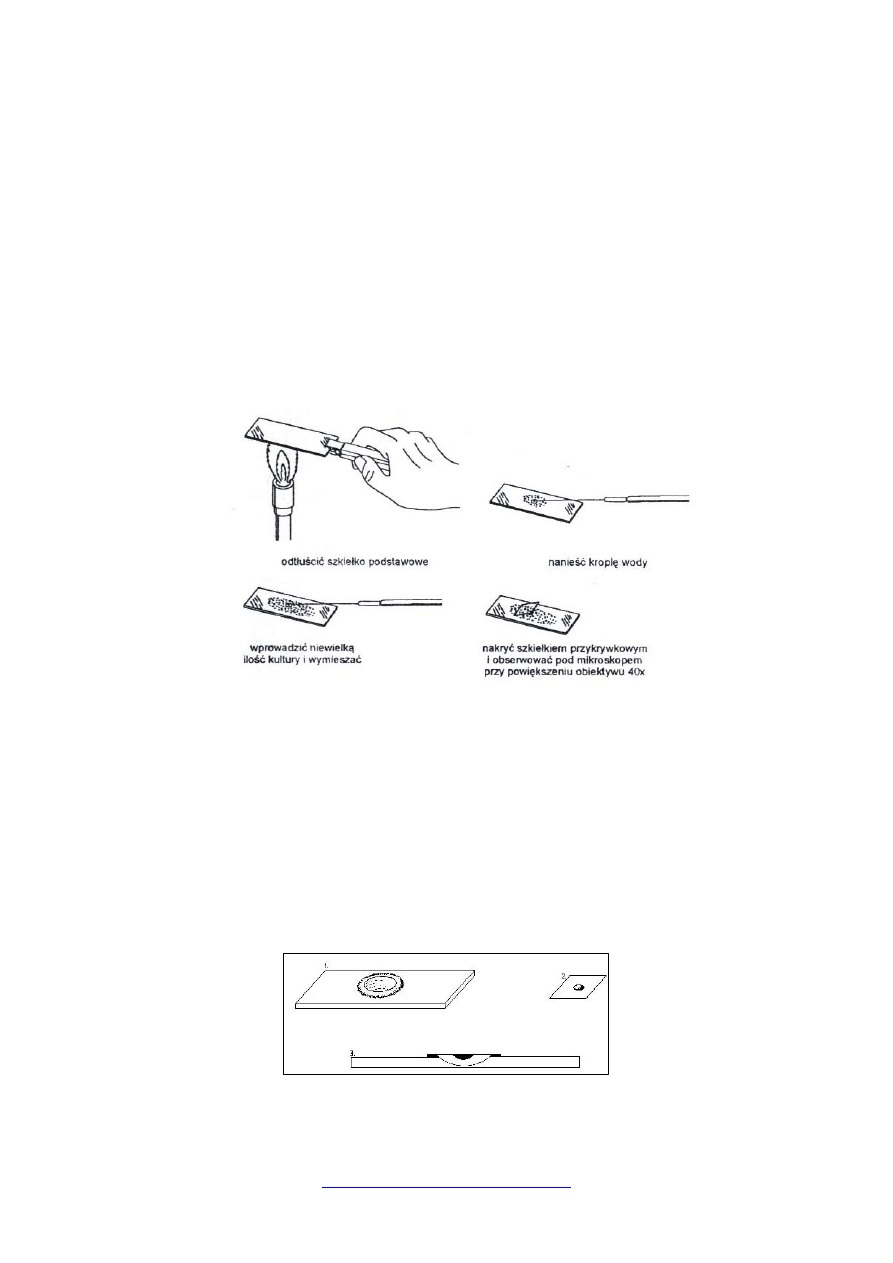
Wykonywanie preparatu w kropli spłaszczonej
Na odtłuszczonym szkiełku podstawowym (wyjęte z alkoholu, dokładnie wytarte
i trzykrotnie przeciągnięte nad płomieniem palnika) umieszcza się kroplę płynnej hodowli
drobnoustrojów i nakrywa szkiełkiem nakrywkowym, opuszczając je ukośnie w celu
wyeliminowania pęcherzyków powietrza (rys). Nadmiar płynu osusza się bibułą filtracyjną.
Przy sporządzaniu preparatu z hodowli na podłożu stałym lub z produktów o konsystencji
mazistej należy nanieść na szkiełko najpierw kroplę jałowej wody destylowanej, a następnie
pobrany za pomocą ezy materiał rozprowadzić w tej kropli. Całość nakryć szkiełkiem
nakrywkowym.
Preparaty przyżyciowe należy oglądać bezpośrednio po przygotowaniu, żeby nie
dopuścić do przeschnięcia materiału. Najlepszą jakość uzyskuje się przy preparatach cienkich,
blisko brzegu kropli.
Schemat wykonania preparatu przyżyciowego
Wykonywanie preparatu w kropli wiszącej (w komorze Lindnera)
Komora Lindnera to szkiełko podstawowe z wgłębieniem. Brzegi wgłębienia komory
Lindnera smaruje się wazeliną (1). Na środku odtłuszczonego szkiełka nakrywkowego
umieszcza się kroplę badanej hodowli (2), szkiełko szybko odwraca się i przykleja do
brzegów wgłębienia w ten sposób, aby kropla wisiała w powietrzu mniej więcej na środku
wgłębienia (3). Lekko docisnąć szkiełko, wazelina uszczelnia i spowalnia wysychanie
preparatu (rys). Najlepiej oglądać preparat blisko brzegu kropli gdzie jest najcieńszy.
Preparat w komorze Lindnera

M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
4
Barwienie preparatów przyżyciowych
Preparat przyżyciowy może być barwiony lub nie barwiony. Chcąc wykonać
barwienie obok kropli z materiałem badanym umieszcza się kroplę barwnika, miesza ezą
i przykrywa szkiełkiem nakrywkowym. Stosowane barwniki nie mogą być toksyczne i
muszą się charakteryzować wysoką kontrastowością. Mimo że używa się ich w bardzo
dużym rozcieńczeniu i tak wywołują zahamowanie rozmnażania.
Przykłady:
barwienie błękitem metylenowym (rozcieńczenie 1:10 000) pozwala ocenić żywotność
drożdży; barwnik przenika do wnętrza martwej komórki, która barwi się na
ciemnoniebiesko,
barwienie płynem Lugola umożliwia wykrycie w komórce drożdży substancji
zapasowych – glikogenu, który barwi się na brunatno, a cytoplazma komórki jasnożółto,
barwienie bakterii płynem Lugola pozwala u gatunków beztlenowych wykryć
granulozę - cukier stanowiący substancję zapasową tych bakterii.
Mechanizm barwienia przyżyciowego może być różny i nie jest on jeszcze do końca poznany.
Prawdopodobnie jest wynikiem:
- chemicznego wiązania ze składnikami komórki,
- elektroadsorpcji barwnych anionów i kationów,
- rozpuszczania się barwnika w określonych składnikach chemicznych komórki.
2. Wykonanie preparatów utrwalonych
Preparaty utrwalone możemy podzielić na:
Trwałe – mogą być używane wielokrotnie przez długi czas,
Półtrwałe – jednorazowego użytku.
Preparaty półtrwałe
Preparaty półtrwałe uzyskuje się przez wykonanie rozmazu drobnoustrojów na
szkiełku podstawowym, a następnie utrwalenie i wybarwienie (rys). Nie zatapia się ich w
balsamie.
Wykonanie rozmazu
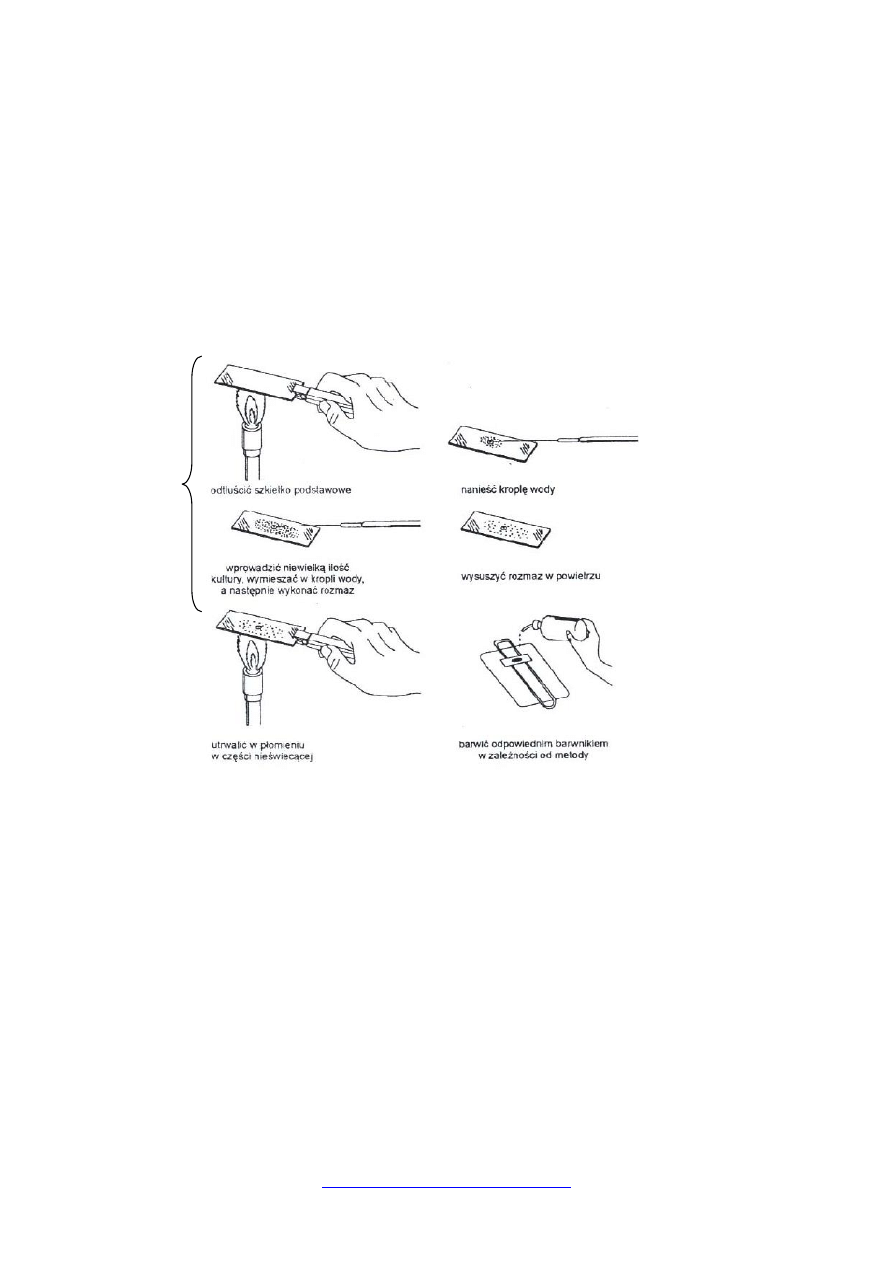
Technika zależy od konsystencji badanego materiału. Jeśli mamy do czynienia z
pożywką płynną, to sporządzenie rozmazu polega na rozprowadzeniu kropli cienką warstwą
na środku odtłuszczonego szkiełka podstawowego. Rozmaz wykonuje się ezą, suszy na
powietrzu. Jeśli materiał pochodzi z hodowli stałej należy najpierw na szkiełku umieścić
kroplę wody i następnie – pobrany ezą materiał – rozprowadzić w tej kropli.
Z mięsa i produktów mięsnych, ryb, żółtego sera wykonuje się preparaty bezpośrednio
z badanych próbek. W tym celu wycięty jałowym skalpelem kawałek (np. mięsa, sera
twardego, wędliny) przenieść jałową pincetą na szkiełko podstawowe i odcisnąć na nim
wyraźny ślad, cienki i bez wolnych przestrzeni. Po wykonaniu rozmazu preparaty zostawiamy
do wyschnięcia w temperaturze pokojowej.
Technika wykonywania preparatu bakteriologicznego (rozmaz)
M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
5
1. odtłuścić szkiełko podstawowe (wyjąć z alkoholu, dokładnie wytrzeć i trzykrotnie
przeciągnąć nad płomieniem palnika)
2. przy pomocy ezy nanieść na środek 1-2 kropli płynu fizjologicznego (lub wody)
3. przenieść niewielką ilość materiału bakteriologicznego do płynu fizjologicznego i
sporządzić zawiesinę,
4. wykonać rozmaz (rozprowadzić po całej powierzchni szkiełka),
5. wysuszyć na wolnym powietrzu,
6. trzymając szkiełko w szczypcach Cornetta, utrwalić rozmaz przesuwając go
trzykrotnie przez płomień palnika,
7. ostudzić szkiełko i ewentualnie dalej wykonać barwienie.
Schemat
wykonania
preparatu
półtrwałego
Utrwalanie preparatów
Utrwalenie przerywa zachodzące w komórkach procesy fizjologiczne i pozwala
zachować strukturę komórek, zapobiegając zmianom pośmiertnym. Ma na celu:
zabicie komórek drobnoustrojów;
przyklejenie się komórek do powierzchni szkiełka – nie spłukuje ich barwnik ani
woda;
odsłonięcie w ścianach komórkowych martwych mikroorganizmów związków, z
którymi łączy się barwnik.
Utrwalanie możemy wykonywać metodą:
termiczną – wyschnięty preparat przeprowadzamy 3-krotnie w pozycji poziomej
(rozmazem do góry) przez płomień palnika (część nie świecącą)
chemiczną – do badania struktur komórkowych, przy użyciu 60–70% alkoholu, 10%
formaliny, sublimatu lub mieszaniny eteru i alkoholu (1:1). W tym celu na wysuszony
rozmaz nalewa się odpowiedni odczynnik. Po 5–10 min. zlewa się utrwalacz, suszy na
powietrzu i barwi jedną z podanych metod. Używając sublimatu lub formaliny należy
preparat dobrze przemyć wodą i wysuszyć.
roz
m
az

M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
6
Preparaty utrwalone barwi się, co pozwala na określenie kształtu drobnoustrojów, a także
obserwację układów komórek i struktur komórkowych.
Barwienia preparatów utrwalonych
W mikrobiologii mają zastosowanie następujące sposoby barwienia:
barwienie proste – gdzie używamy jednego roztworu barwnika, preparat zalewa się
barwnikiem na kilka sekund do kilkunastu minut, barwnik zlewa się, spłukuje wodą,
alkoholem lub acetonem i osusza bibułą; stosowane w celu ustalenia kształtu i układu
komórek, np. barwienie fioletem krystalicznym lub błękitem metylenowym
barwienie złożone – stosowane znacznie częściej, z użyciem co najmniej 2
roztworów barwników, barwienie albo w ściśle określonej kolejności albo ich
mieszaniną; np. barwienie metodą Grama
W zależności od stosowanych barwników, można wyróżnić 3 sposoby barwienia:
barwienie pozytywowe (pozytywne) – polegające na zabarwieniu komórek, podczas
gdy tło zostaje bezbarwne; może być proste lub złożone,
barwienie negatywowe (negatywne) – uzyskanie kontrastu między ciemnym tłem a
nie zabarwionymi komórkami; stosowane jest zwykle do barwienia krętków i otoczek
bakterii; wykorzystuje się roztwór nigrozyny, tuszu chińskiego lub cyjanochiny,
rozmaz wykonuje się z zawiesiny komórek zmieszanych z barwnikiem, nie utrwala
się, tylko od razu po wysuszeniu ogląda pod mikroskopem, może być proste lub
złożone,
barwienie pozytywowo-negatywowe – połączenie powyższych metod, najpierw
wykonuje się barwienie negatywowe, a po wyschnięciu dobarwia się barwnikiem
pozytywowym.
Preparaty trwałe
Przygotowanie preparatów trwałych obejmuje kilka etapów, z których najistotniejsze to:
utrwalenie, barwienie i zatopienie preparatu.
Utrwalenie materiału na szkiełku podstawowym można dokonać za pomocą czynników
fizycznych (ogrzewanie szkiełka z rozmazem zawiesiny drobnoustrojów w płomieniu
palnika) lub chemicznych (etanol, metanol, formalina, kwas pikrynowy, dwuchromian
potasu). Po wyschnięciu preparat barwi się, a następnie pokrywa balsamem kanadyjskim.
Po przykryciu szkiełkiem nakrywkowym, lekko ogrzewa do rozpuszczenia balsamu, dociska
szkiełko i usuwa nadmiar balsamu. Tak przygotowany preparat może być przechowywany
przez długi czas.
Barwienie błękitem metylenowym
Jest to barwienie proste, które stosujemy w celu ustalenia kształtu i układu komórek. Na
utrwalony preparat, umieszczony w kuwecie do barwienia, nakrapia się błękit metylenowy
według Löfflera (5 min), po czym preparat spłukuje się wodą, suszy i ogląda pod immersją.
Wykonać preparat z wybranej koloni z posiewów z poprzednich ćwiczeń.
M
IKROBIOLOGIA ŻYWNOŚCI
Ćwiczenie 2
WTŻ II rok
___________________________________________________________________________
http://www.ar.krakow.pl/tz/ktfimt/
7
Barwienie fioletem krystalicznym
Jest to barwienie proste. Na utrwalony preparat, umieszczony w kuwecie do barwienia,
nakrapia się fiolet krystaliczny (2 min), po czym preparat spłukuje się wodą, suszy i ogląda
pod immersją.
Wykonać preparat z wybranej koloni z posiewów z poprzednich ćwiczeń.
Barwienie negatywne
Polega na uzyskaniu kontrastu między ciemnym tłem a nie zabarwionymi komórkami.
Stosowane jest zwykle do barwienia krętków i otoczek bakterii; wykorzystuje się roztwór
nigrozyny, tuszu chińskiego lub cyjanochiny. Rozmaz wykonuje się z zawiesiny komórek
zmieszanych z barwnikiem, nie utrwala się, tylko od razu po wysuszeniu ogląda pod
mikroskopem, może być proste lub złożone.
W barwieniu negatywnym bakterie gramdodatnie (Bacillus, Sarcina, Staphylococcus)
wykazują zjawisko atrakcji barwnika, polegające na większym skupieniu (zagęszczeniu) się
cząstek barwnika w bezpośrednim otoczeniu, na obwodzie lub na zewnątrz niezabarwionej
komórki.
Bakterie gramujemne, np. pałeczki nie wykazują zjawiska atrakcji barwnika, tło preparatu
jest równomiernie wybarwione, natomiast w wielu wypadkach można zaobserwować w
środku niewybarwionych komórek, delikatną smugę lub punkcik, co tłumaczy się większą
przepuszczalnością błony komórkowej u bakterii gramujemnych w porównaniu z
gramdodatnimi.
Protokół barwienia negatywowego
1. na szkiełko podstawowe nanieść zawiesinę komórek bakteryjnych,
2. dodać barwnik (kroplę) np. nigrozynę lub tusz,
3. wykonać rozmaz (drugim szkiełkiem podstawowym),
4. suszyć na powietrzu, nie utrwalać termicznie!
5. preparat jest gotowy do oglądania po wyschnięciu.
Wyszukiwarka
Podobne podstrony:
cwiczenie 2b pdf
CWICZENIE III pdf
cwiczenie 2c pdf
cwiczenia norweski pdf
Cwiczenie 2B id 99329 Nieznany
Joomla! 1 6 Ćwiczenia eBook Pdf
cwiczenie 2a pdf
CWICZENIE III pdf
cwiczenia norweski pdf
cwiczenie 2c pdf
cwiczenie 2a pdf
3 10 03 2014 Ćwiczenie 2b CZYM SĄ I CZY OBOWIĄZUJĄ NORMY
klucz do ćwiczeń pdf
Chemia 3 ćwiczenie pdf
EKG pdf ćwiczenia
Wojtek Sadowski grupa 2b ćwiczenie 2, gik, semestr 8, sem 8, Geodynamika, Rajner ćw 2
więcej podobnych podstron