Jacek Młynarski
Zakład Chemii Organicznej
Chemia organiczna
vit. E
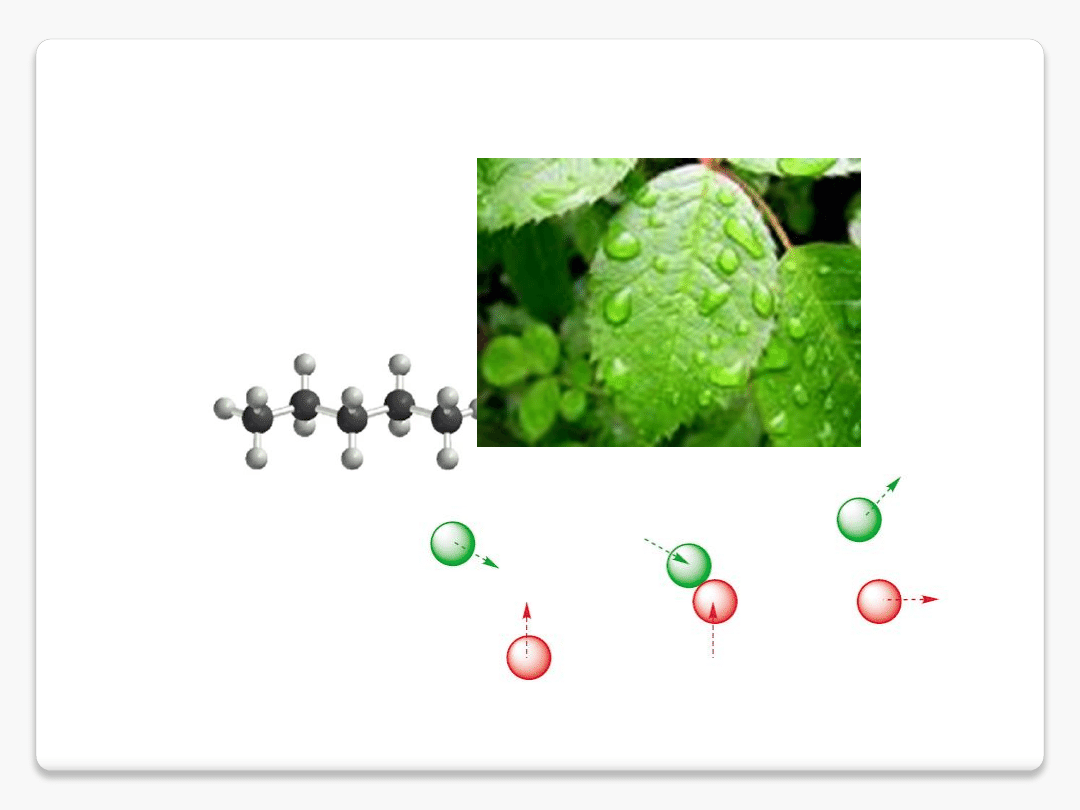
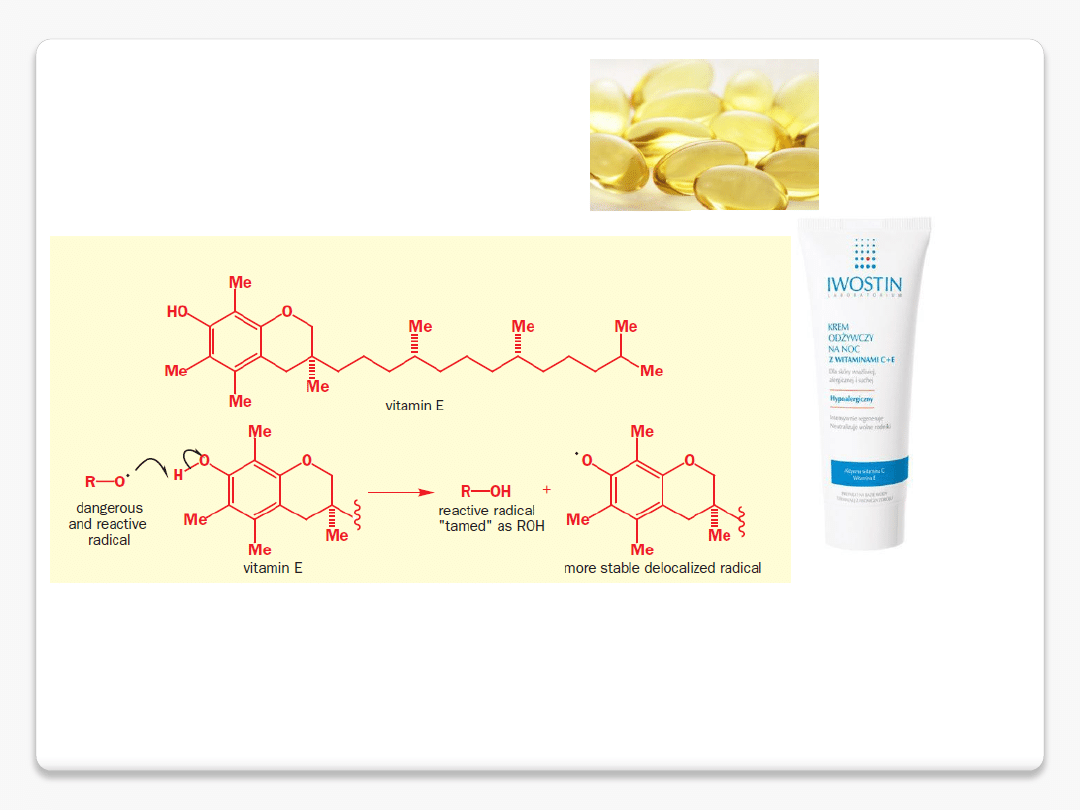
Witamina E (ATC: A 11 HA 03, )
– grupa organicznych związków chemicznych, w skład której wchodzą
tokoferole i tokotrienole. Ich
wspólną cechą jest dwupierścieniowy szkielet 6-chromanolu oraz łańcuch
boczny zbudowany z 3 jednostek izoprenowych. Stosowana jako dodatek do
żywności o numerze
E306 (ponadto syntetyczne tokoferole
noszą numery E307-309).
Zaliczana jest do witamin rozpuszczalnych w
tłuszczach, jest głównym przeciwutleniaczem
występującym w komórkach. Dla człowieka najistotniejszą rolę pełni α-tokoferol.
klasyfikacja związków organicznych
alkany
propan
C
3
H
8
butan
C
4
H
10
pentan
C
5
H
12
struktury homologiczne różnią się grupą
-CH
2
-

propan
C
3
H
8
butan
C
4
H
10
izobutan
C
4
H
10
pentan
C
5
H
12
izopentan
C
5
H
12
neopentan
C
5
H
12
klasyfikacja związków organicznych
alkany – izomeria konstytucyjna
liczba
atomów
węgla
nazwa
wzór
(C
n
H
2n+2
)
liczba
atomów
węgla
nazwa
wzór
(C
n
H
2n+2
)
1
Metan
CH
4
17
Heptadekan
C
17
H
36
2
Etan
C
2
H
6
18
Octadekan
C
18
H
38
3
Propan
C
3
H
8
19
Nonadekan
C
19
H
40
4
Butan
C
4
H
10
20
Eikozan
C
20
H
42
5
Pentan
C
5
H
12
21
Henikozan
C
21
H
44
6
Heksan
C
6
H
14
22
Dokosan
C
22
H
46
7
Heptan
C
7
H
16
23
Trikosan
C
23
H
48
8
Oktan
C
8
H
18
30
Triakontan
C
30
H
62
9
Nonan
C
9
H
20
31
Hentriakontan
C
30
H
62
10
Dekan
C
10
H
22
40
Tetrakontan
C
40
H
82
11
Undekan
C
11
H
24
50
Pentakontan
C
50
H
102
12
Dodekan
C
12
H
26
60
Heksakontan
C
60
H
122
13
Tridekan
C
13
H
28
70
Heptakontan
C
70
H
142
14
Tetradekan
C
14
H
30
80
Octakontan
C
80
H
162
15
Pentadekan
C
15
H
32
90
Nonakontan
C
90
H
182
16
Heksadekan
C
16
H
34
100
Hektan
C
100
H
202
alkany

ropa naftowa
frakcja (°C)
ilość atomów
węgla
zastosowanie
poniżej 20
C
1
–C
4
gaz
20–60
C
5
–C
6
eter naftowy
60–100
C
6
–C
7
ligroina
40–200
C
5
–C
10
benzyna
175–325
C
12
–C
18
paliwo lotnicze
250–400
C
12
i więcej
olej napędowy
nielotne
ciecze
C
20
i więcej
olej mineralny, smary
nielotne ciała
stałe
C
20
i więcej
parafina, woski, asfalt
H
3
C
C
CH
2
CH
3
CH
3
CH
CH
3
CH
3
izooktan
2,2,4-trimetylopentan
liczba oktanowa 100

rozpuszczalność
Woski
– grupa substancji stałych pochodzenia naturalnego lub syntetycznego o stosunkowo niskiej
temperaturze topnienia i niskiej
lepkości w stanie stopionym.

woski
Carnauba
– także karnauba, (łac. Cera Carnauba) jest naturalnym woskiem roślinnym pozyskiwanym
z
liści kopernicji, palmy Copernicia cerifera, rosnącej w Brazylii.
Wydziela
się w postaci drobnych łusek z liści palmowych. Ma barwę od jasnozielonawej do
brudnoszarej, a po oczyszczeniu
żółtawą lub białą. Jest najtwardszym ze znanych obecnie wosków
naturalnych.
Używany jest do utwardzania wosku pszczelego, w konserwacji dzieł sztuki, a także do produkcji
misiów Haribo oraz bialej otoczki/glazury tic-taców.

reakcje alkanów
spalanie
zapis równania reakcji
CH
4
+ 2 O
2
CO
2
+ 2 H
2
O
D
H° = –803 kJ mol
–1
2CH
4
+ 3 O
2
2CO + 4 H
2
O
reakcje chemiczne
zapis reakcji
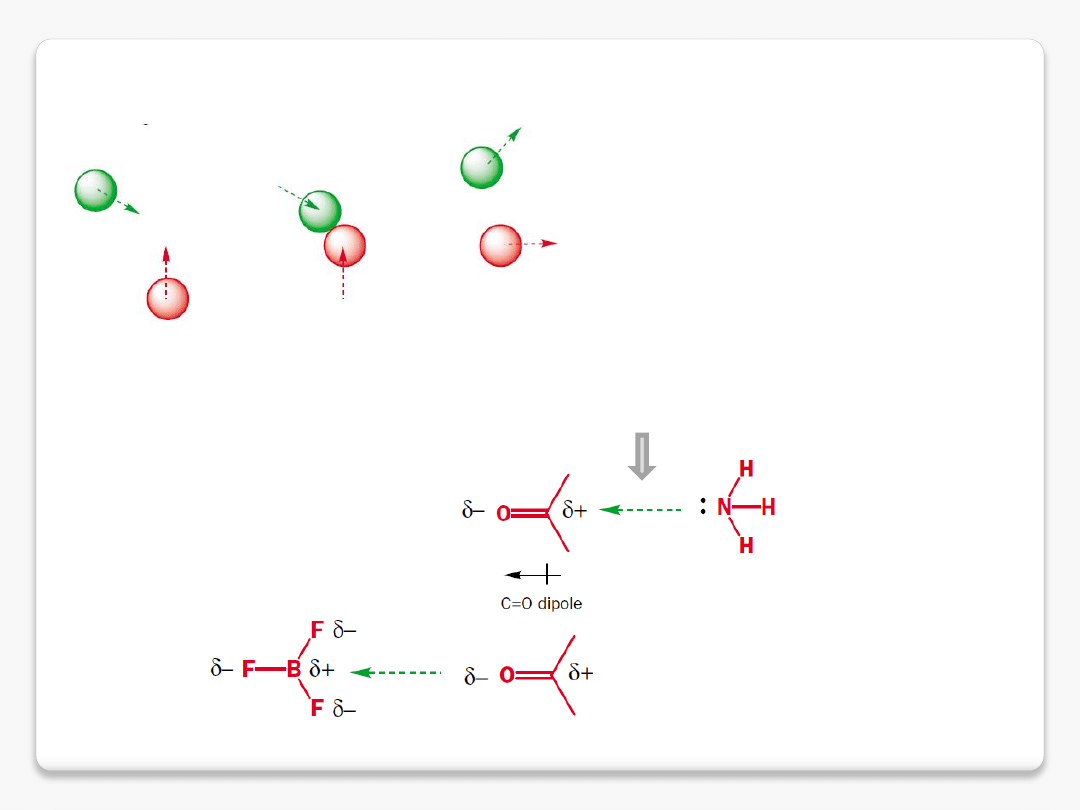
1/ oddziaływanie między ładunkami zbliża cząsteczki
przyciąganie elektrostatyczne
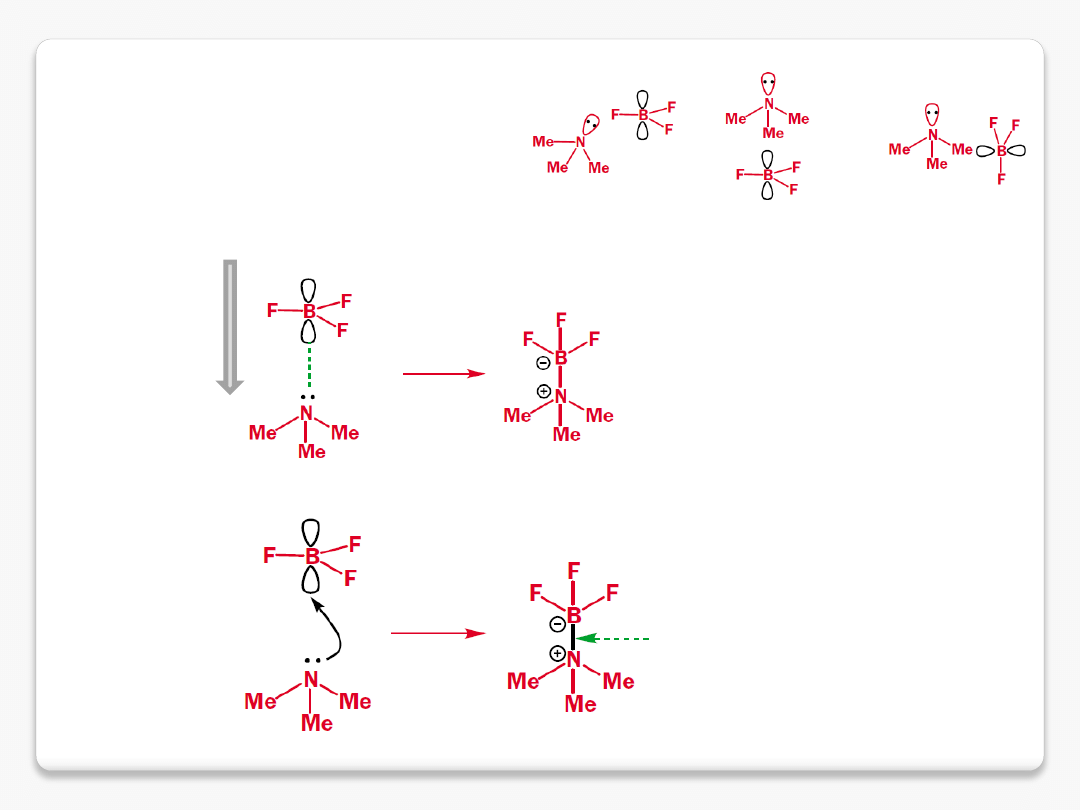
reakcje chemiczne
2/ nakładanie orbitali
3/ przepływ elektronów
elektrony z wolnej pary azotu
przepływ elektronów tworzy wiązanie
nakładanie orbitali determinuje kąt ataku
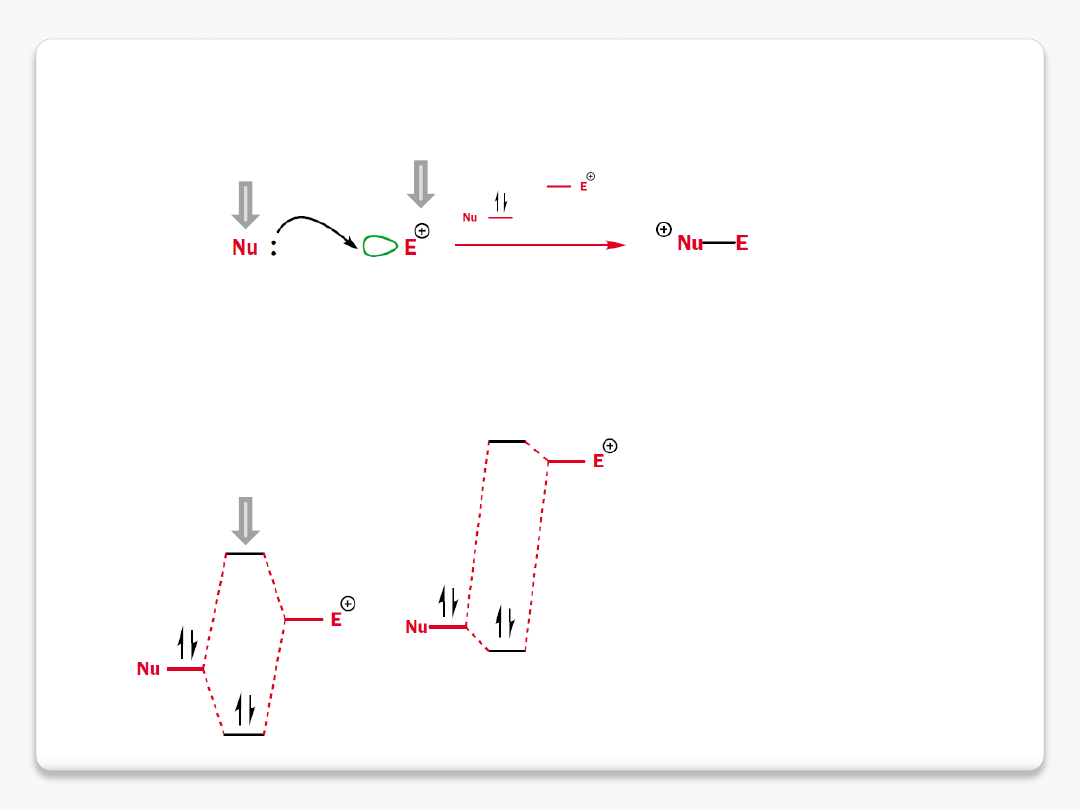
reakcje chemiczne
nukleofile i elektrofile
zapełniony
orbital
nukleofila
o
najwyższej
energii (
HOMO
) ma energię podobną do
najniższego nieobsadzonego orbitalu elektrofila
(
LUMO
)
donor elektronów
akceptor elektronów
cząsteczki przyciągają się wzajemnie z uwagi na przyciąganie
ładunków przeciwnych
oraz
w wyniku nakładania zapełnionego orbitalu o wysokiej energii
z pustym orbitalem o niskiej energii
MO
reakcje chemiczne
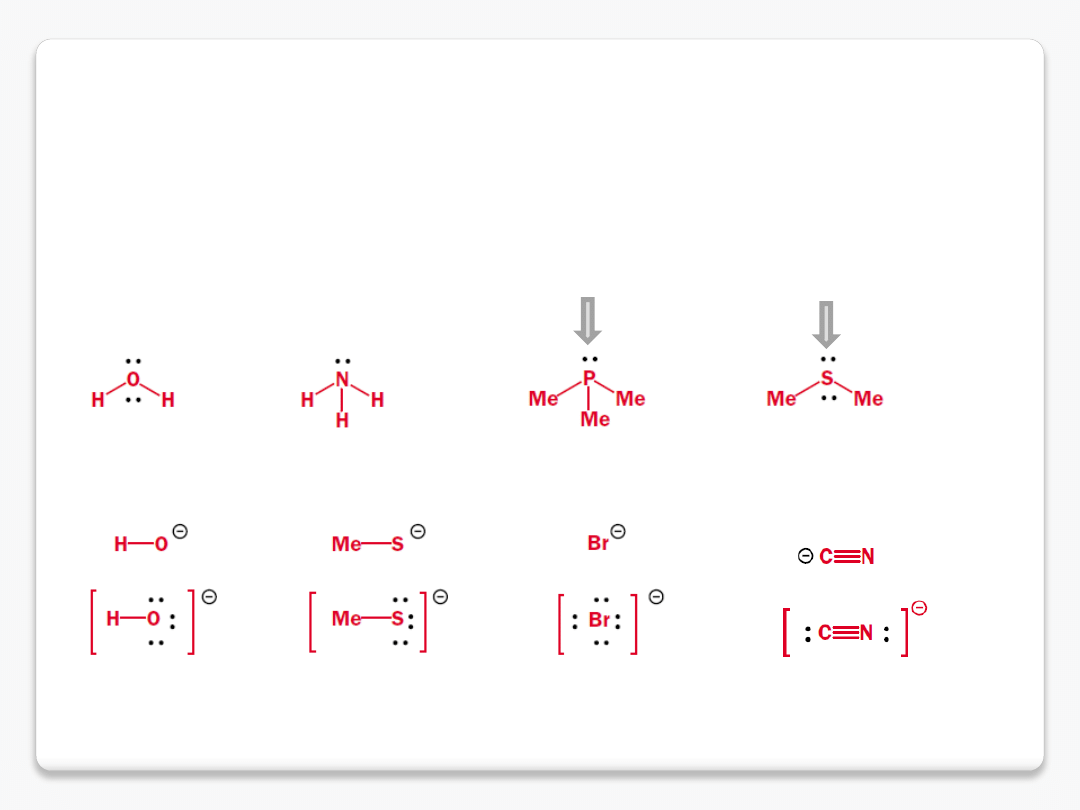
nukleofile i elektrofile
Nukleofil
– to cząsteczka lub grupa, która, jak sama nazwa wskazuje, "lubi" dodatnio naładowane
jądra innych atomów. Sama posiada nadmiar elektronów i w odpowiednich warunkach jest skłonna się
nimi
podzielić, czyli być ich donorem.
trimetylofosfina
dimetylosulfid
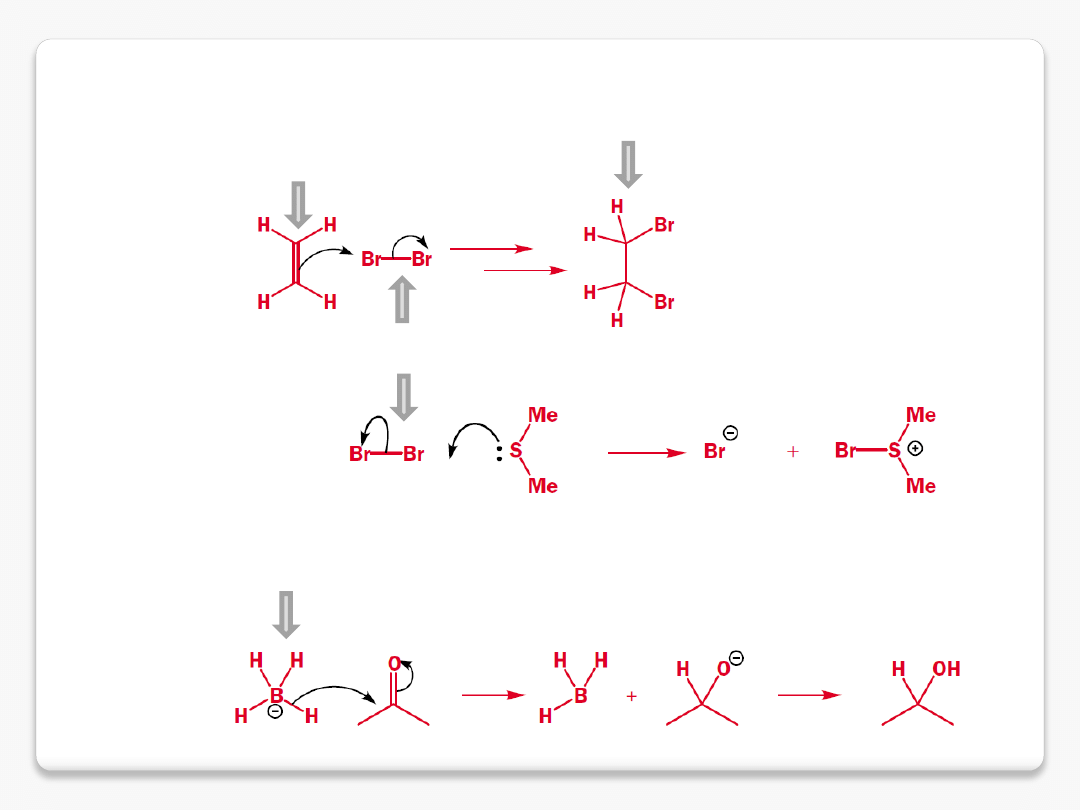
reakcje chemiczne
nukleofile i elektrofile
nukleofil (wiązanie
p
)
nukleofil (wiązanie
s
)
produkt addycji
polaryzacja następuje podczas
zbliżania reagentów
nukleofil z ładunkiem
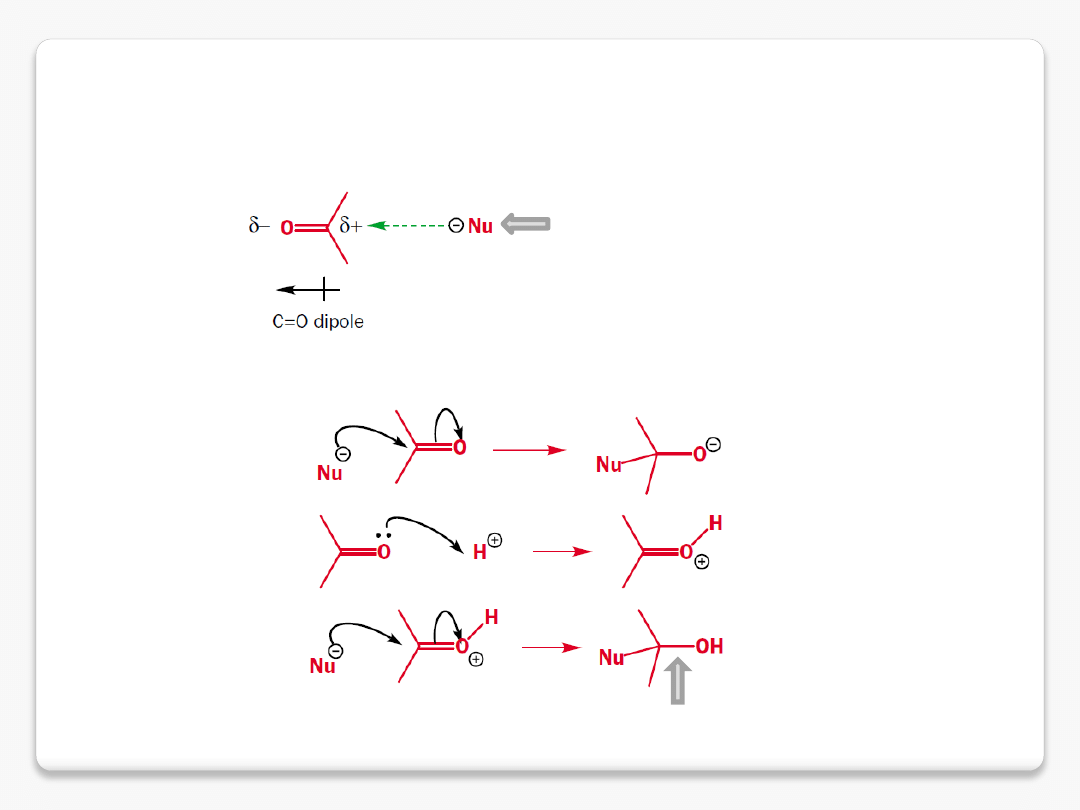
reakcje chemiczne
polaryzacja grupy karbonylowej
pozostaje wiązanie
s
reakcje chemiczne
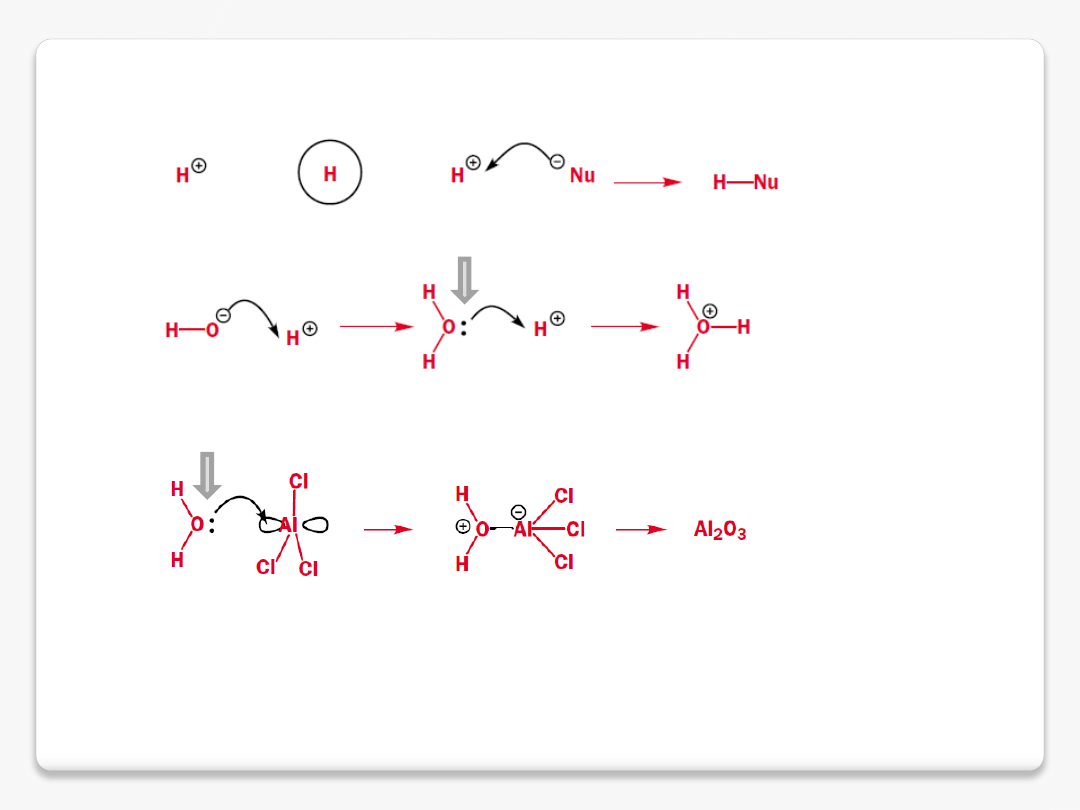
nukleofile i elektrofile
Elektrofil
– to cząsteczka lub grupa która, jak sama nazwa wskazuje, "lubi" elektrony, czyli
sama posiada ich niedomiar i w odpowiednich warunkach jest w stanie je przyjąć, czyli być ich
akceptorem.
nukleofil
nukleofil
kwas protonowy
kwas Lewisa
reakcje chemiczne
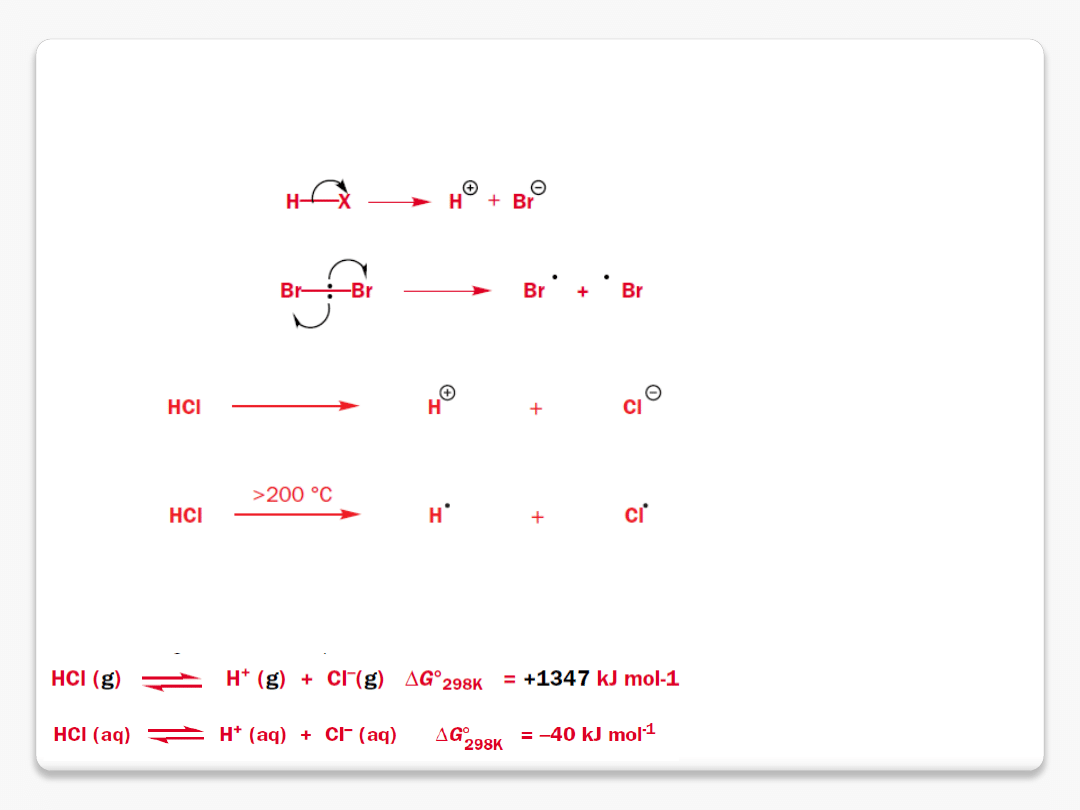
homolityczny i heterolityczny rozpad wiązań
8 elektronów na ostatniej powłoce
7 elektronów na ostatniej powłoce
homoliza
heteroliza
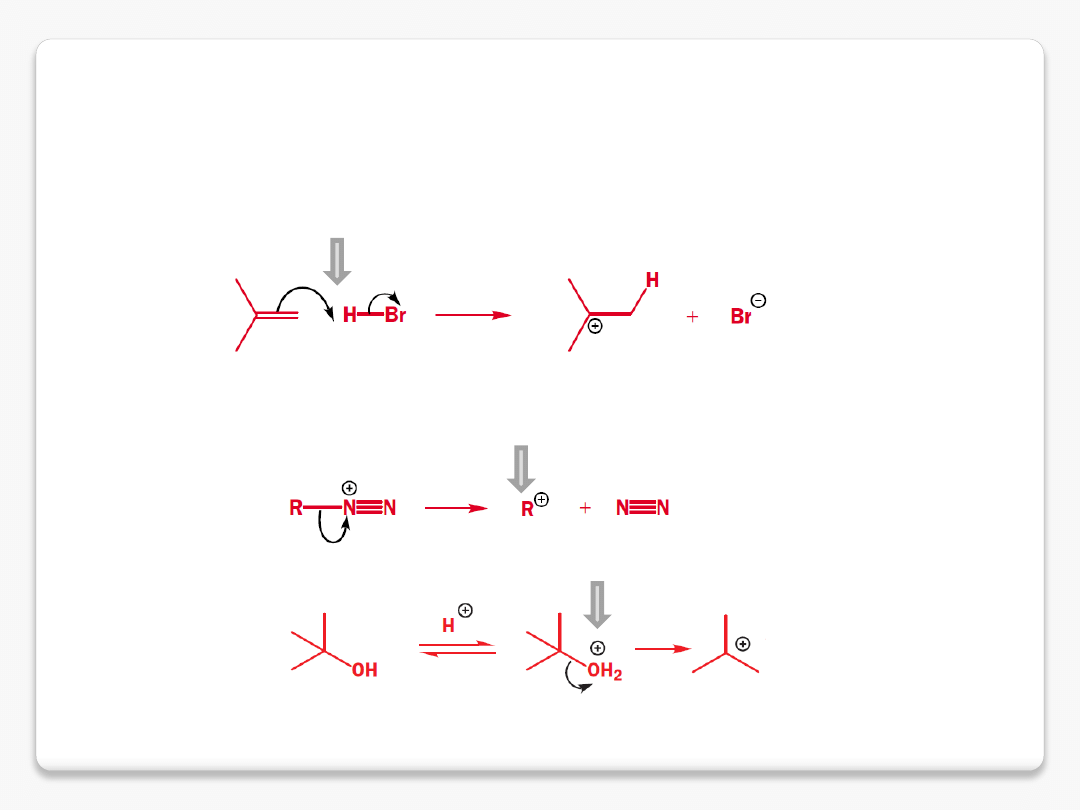
reaktywne cząstki organiczne
karbokationy
karbokation powstaje w wyniku
rozpadu kationu diazoniowego
karbokation powstaje w wyniku pierwszego etapu
reakcji przyłączenia (addycji)
grupa opuszczająca
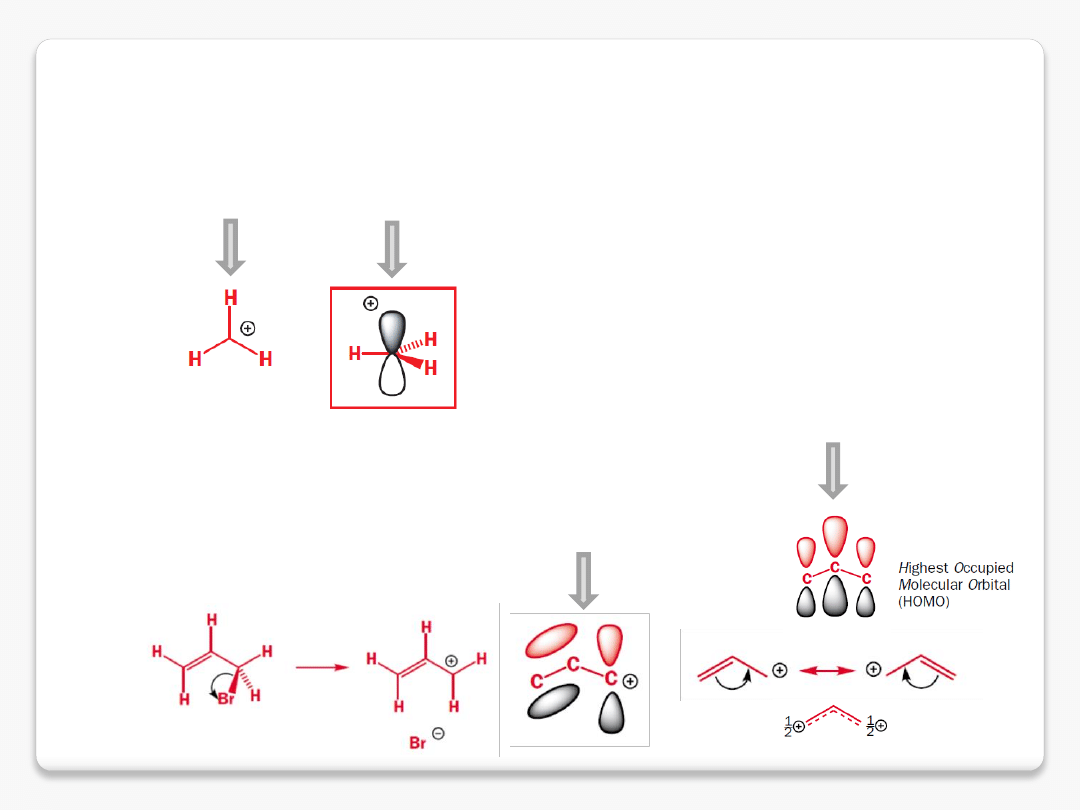
reaktywne cząstki organiczne
karbokationy
kation allilowy
kation metylowy o hybrydyzacji sp
2
większa gęstość
elektronowa na tym orbitalu
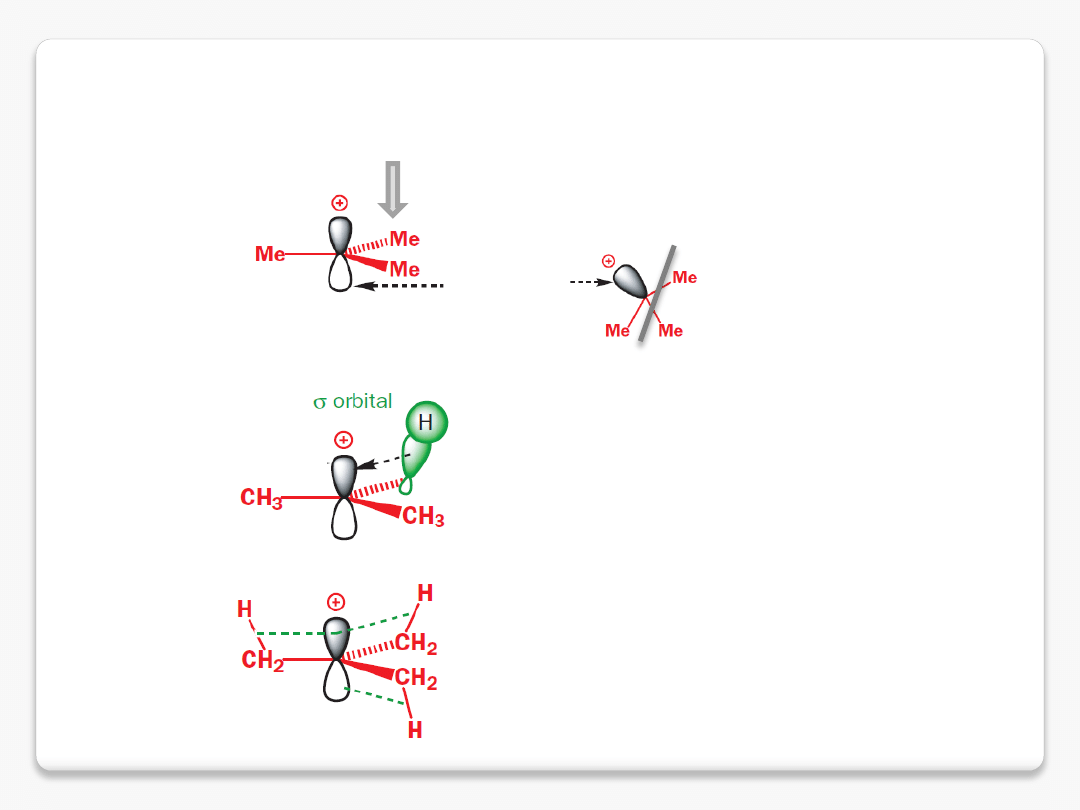
reaktywne cząstki organiczne
karbokationy
mniejsze efekty odpychania
pomiędzy zapełnionymi orbitalami
pusty orbital p
dodatkowy efekt stabilizujący
s
donorowy na pusty orbital p
płaskiego karbokationu
karbokation trzeciorzędowy
jest trwalszy
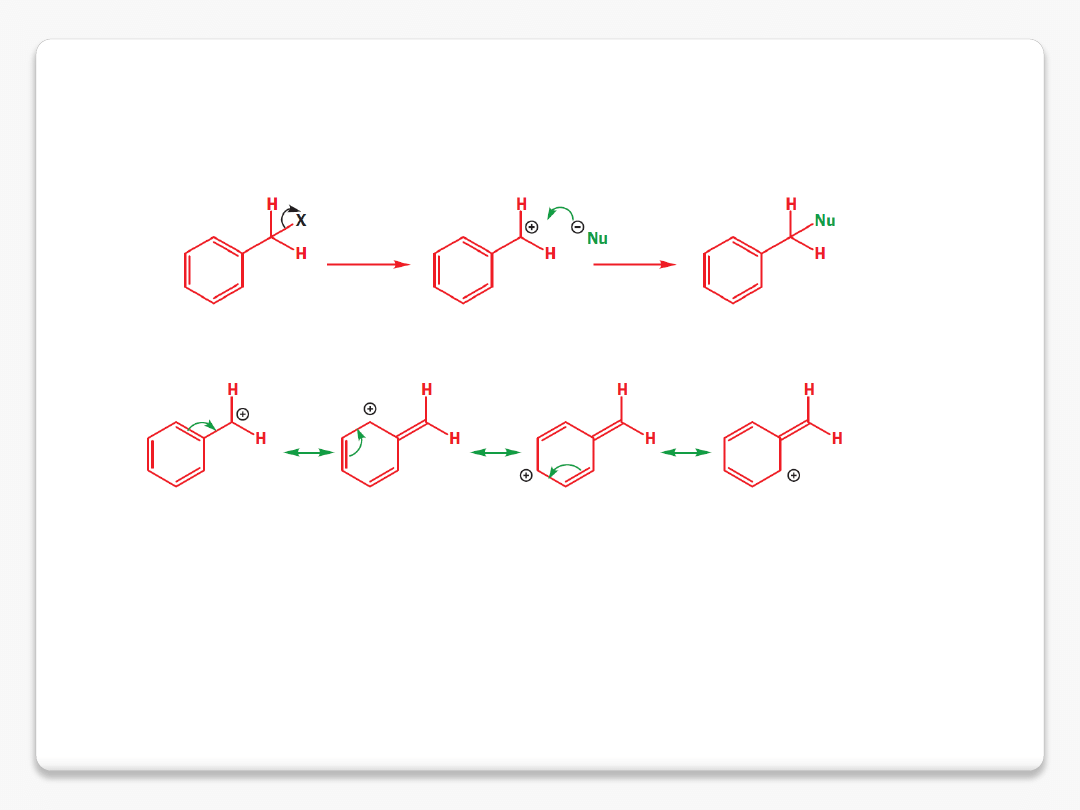
reaktywne cząstki organiczne
karbokation benzylowy
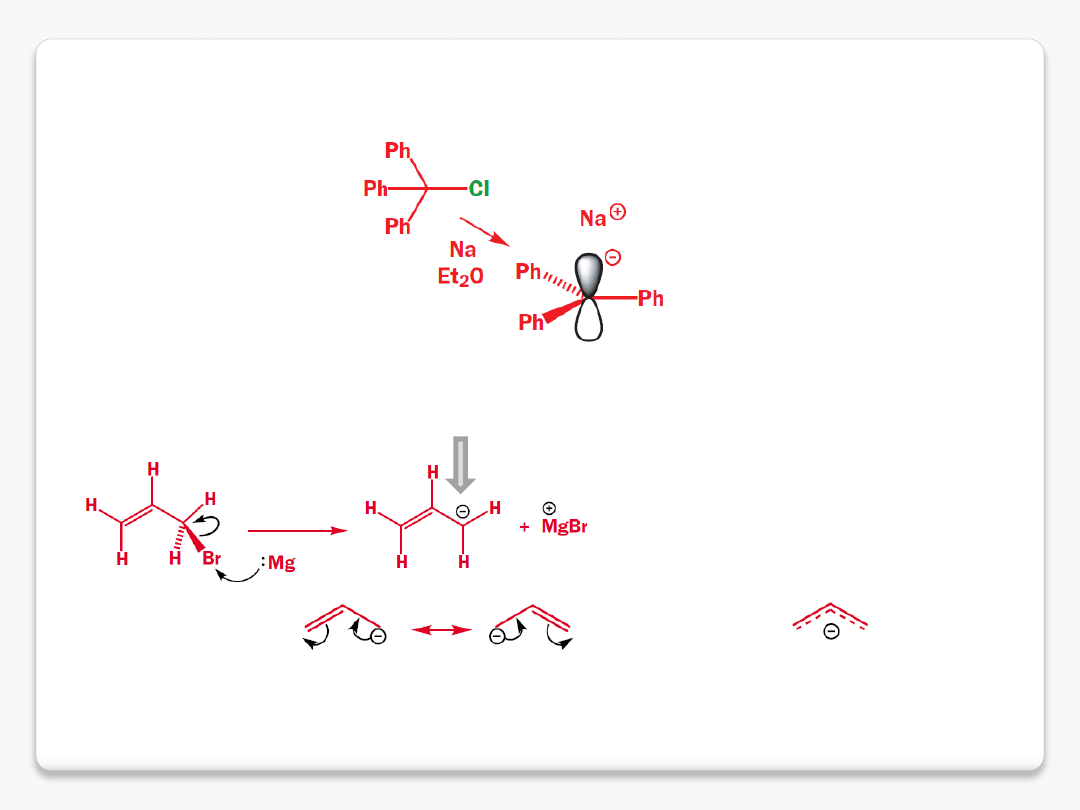
reaktywne cząstki organiczne
karboaniony
anion allilowy
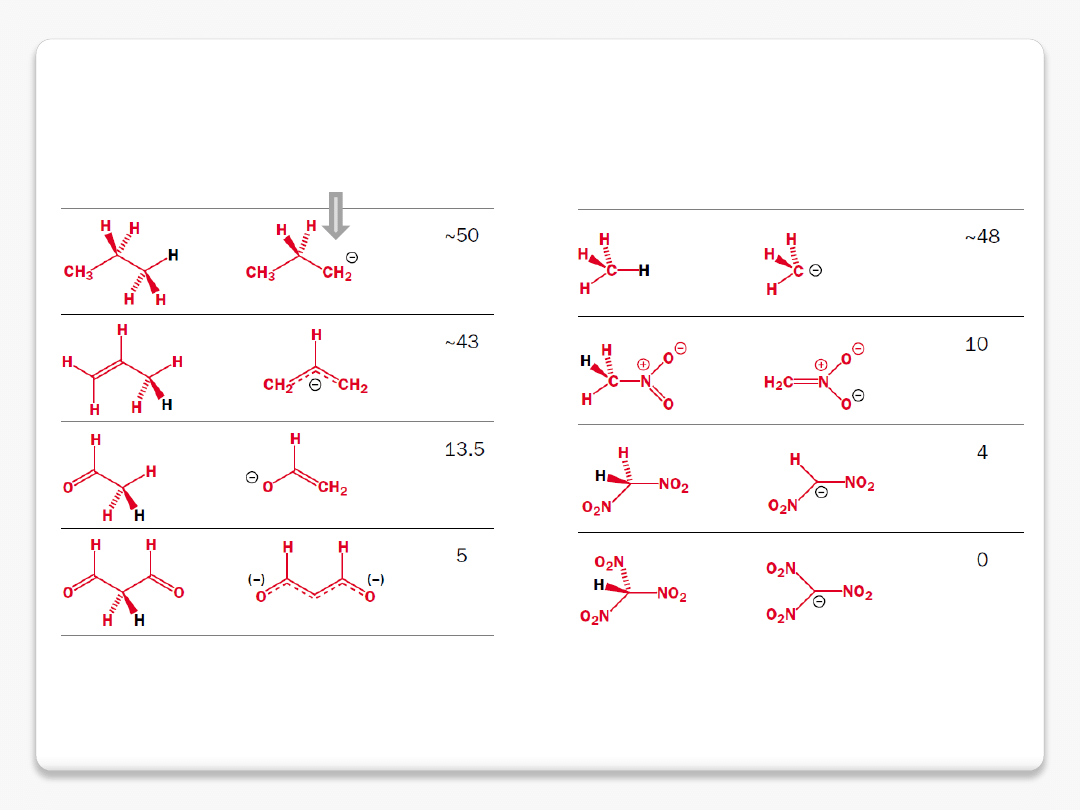
delokalizacja ładunku ujemnego
dla C-H kwasów
ładunek zlokalizowany na jednym atomie węgla, niekorzystnie z powodu
niewielkiej elektroujemności węgla
delokalizacja na układzie
p
i
elektroujemnych atomach tlenu
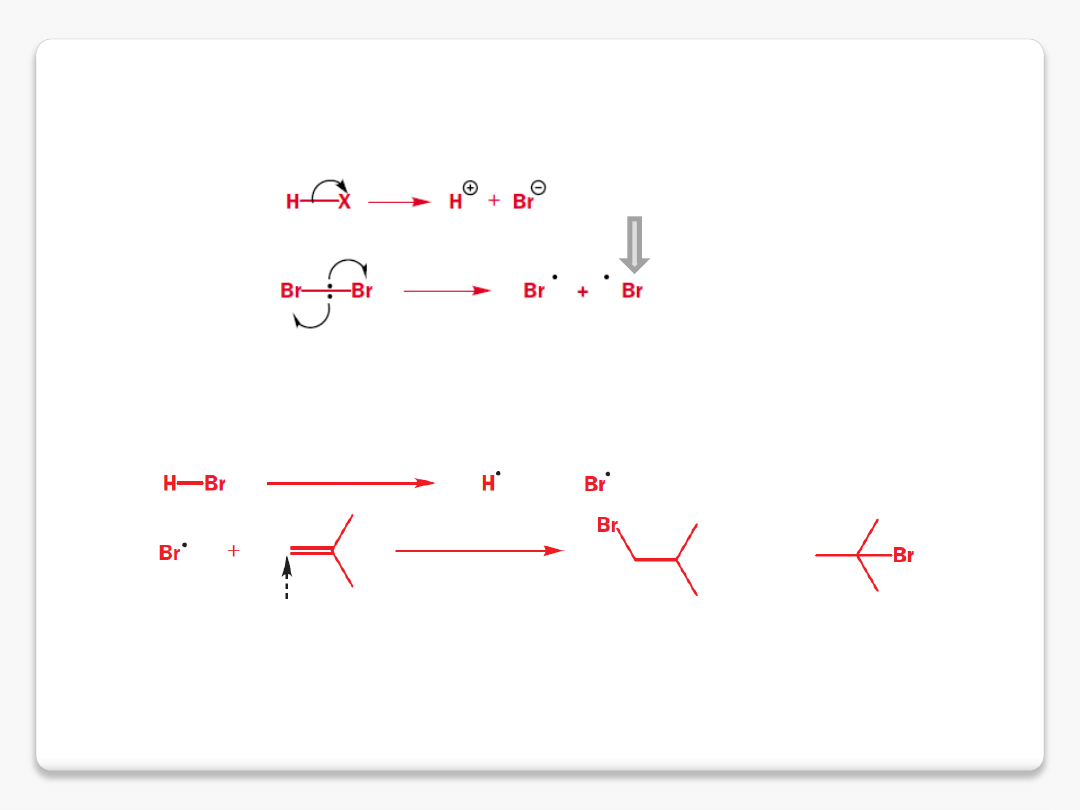
reakcje chemiczne
homolityczny i heterolityczny rozpad wiązań
atak na koniec wiązania podwójnego 91% 6%
niesparowane elektrony
homoliza
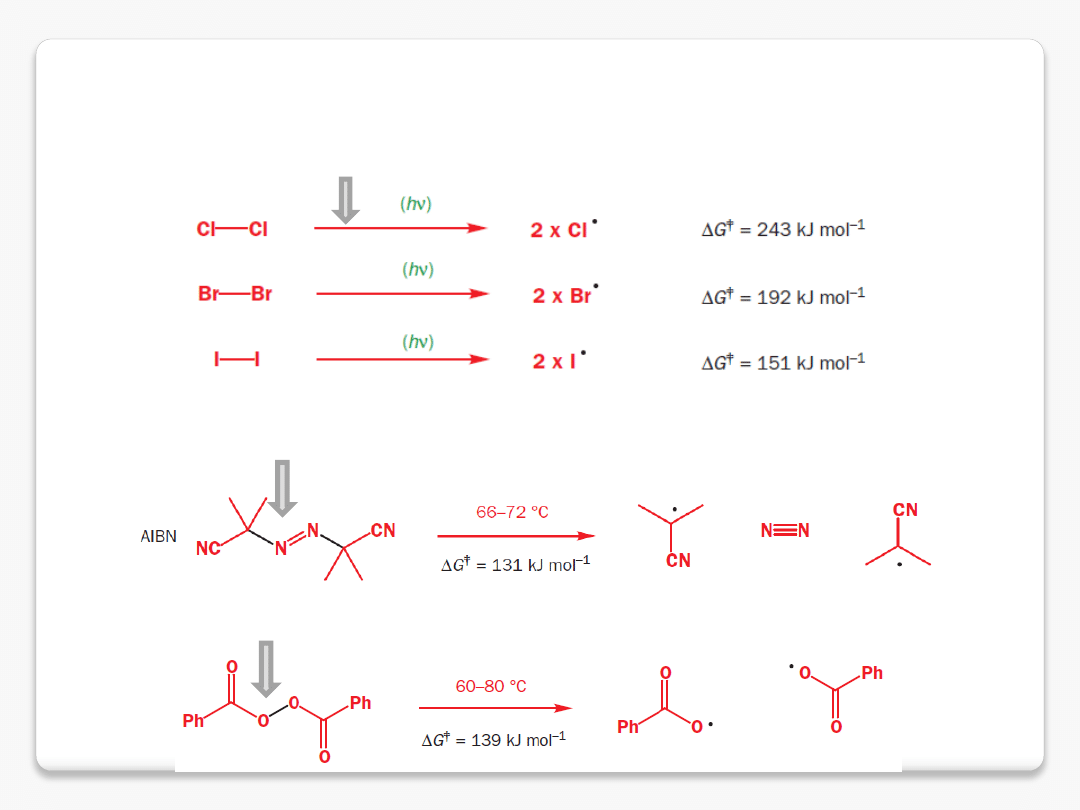
reaktywne cząstki organiczne
rodniki
nadtlenek dibenzoilu
a
zobis
i
zo
b
utyro
n
itryl
słabe wiązanie
s
łatwo ulega homolizie
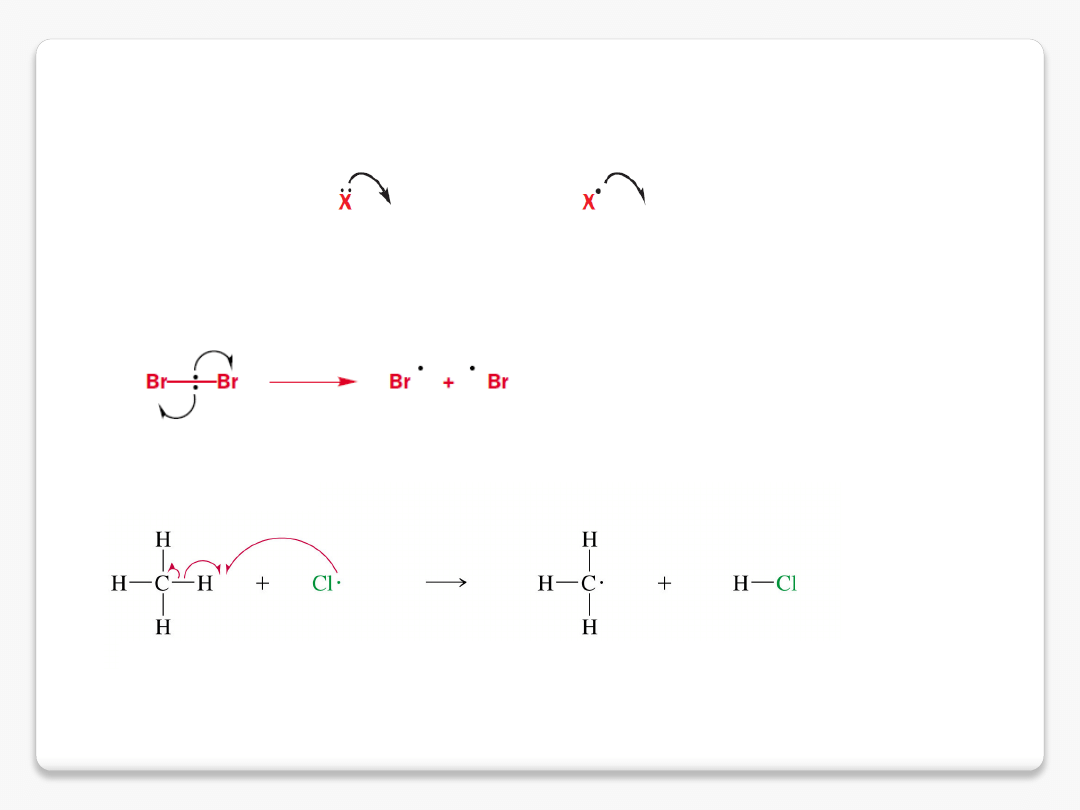
halogenowanie alkanów
zapis i mechanizm reakcji
rodnik metylowy
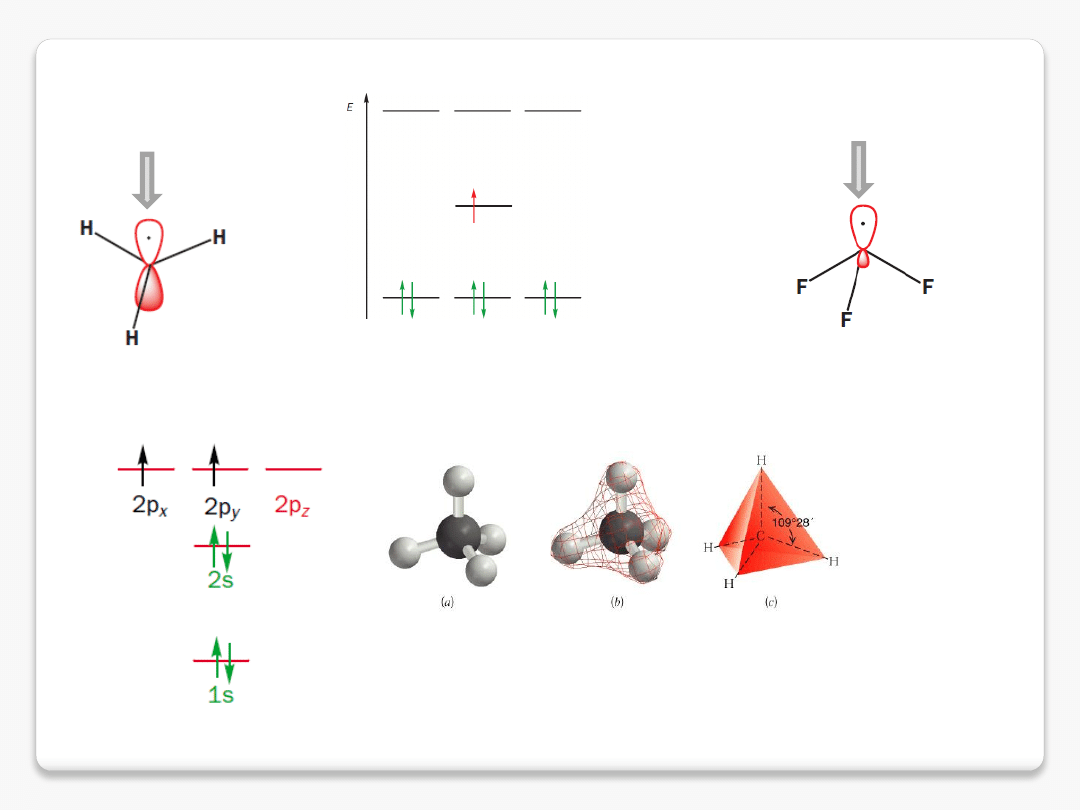
rodnik metylowy
metan
C
rodnik płaski C sp
2
rodnik zbliżony do
struktury tetraedrycznej
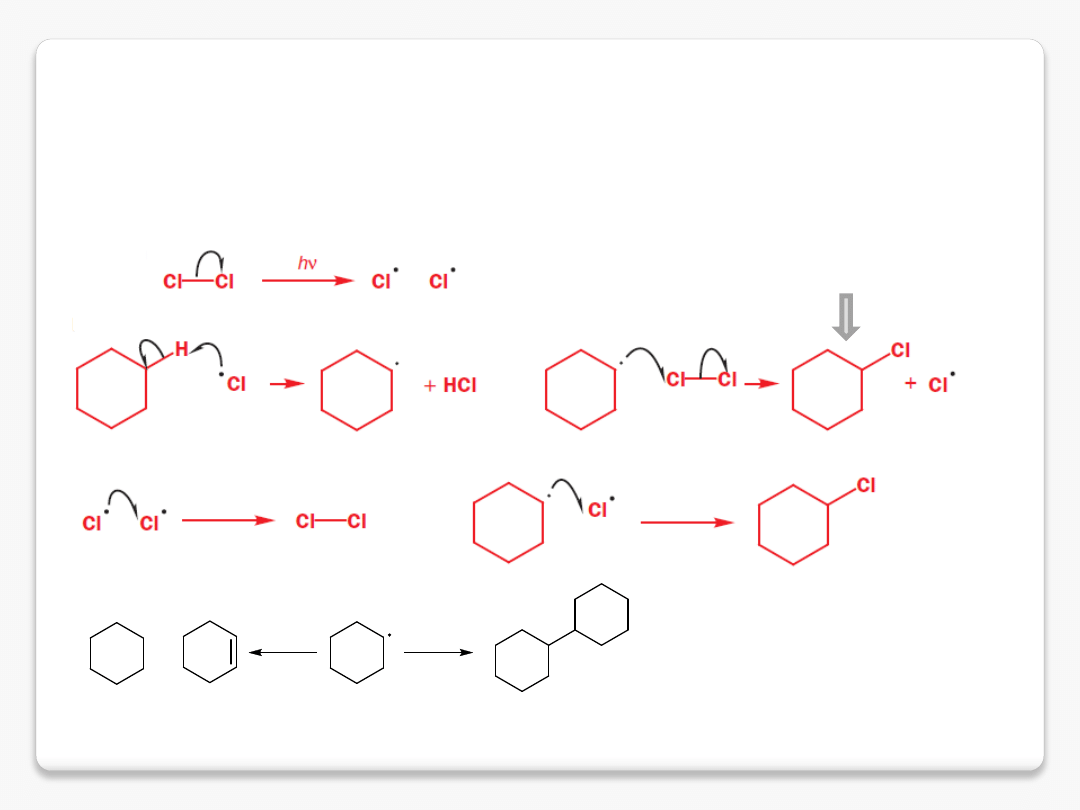
halogenowanie alkanów
reakcja łańcuchowa
inicjowanie łańcucha
propagacja
zakończenie (terminacja)
produkt podstawienia (substytucji)
+
halogenowanie alkanów
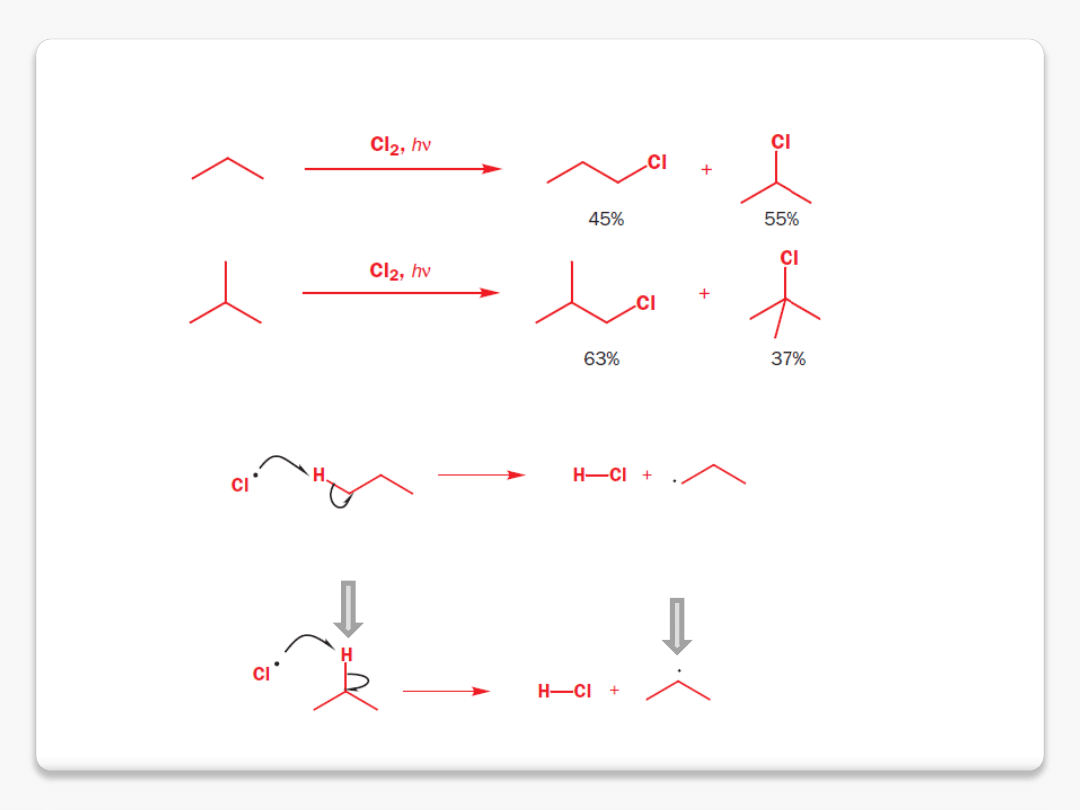
halogenowanie alkanów
drugorzędowe wiązania C-H są słabsze
drugorzędowe rodniki są trwalsze
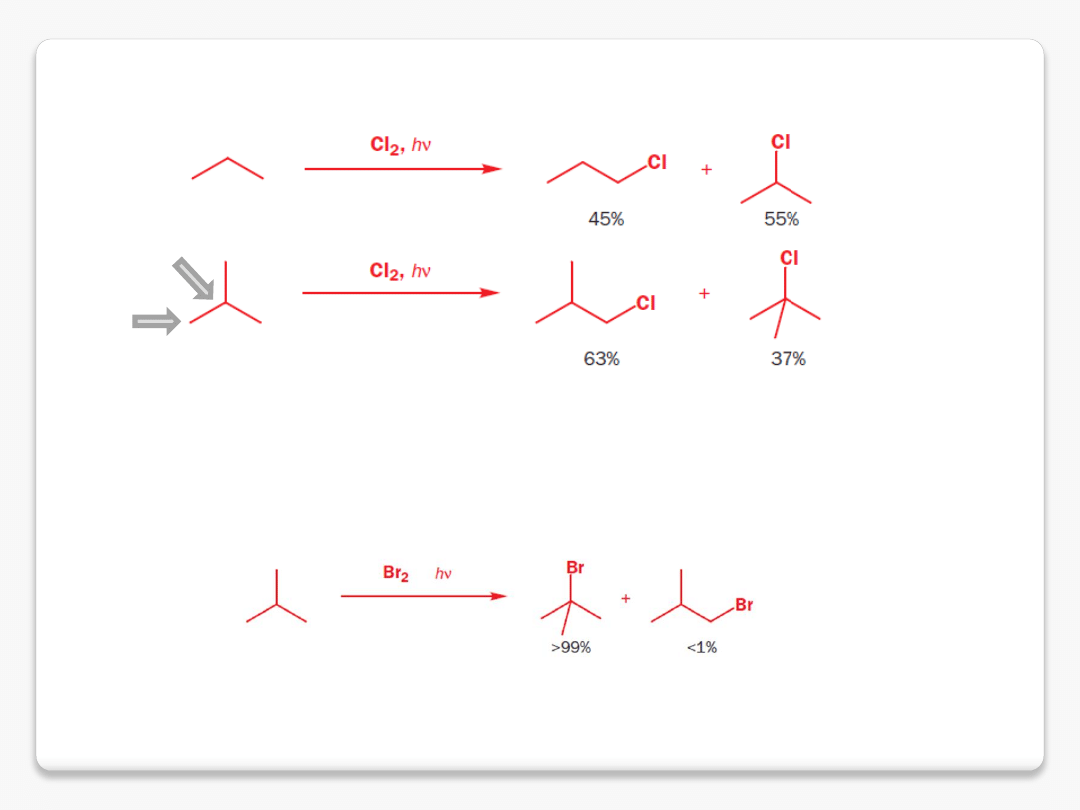
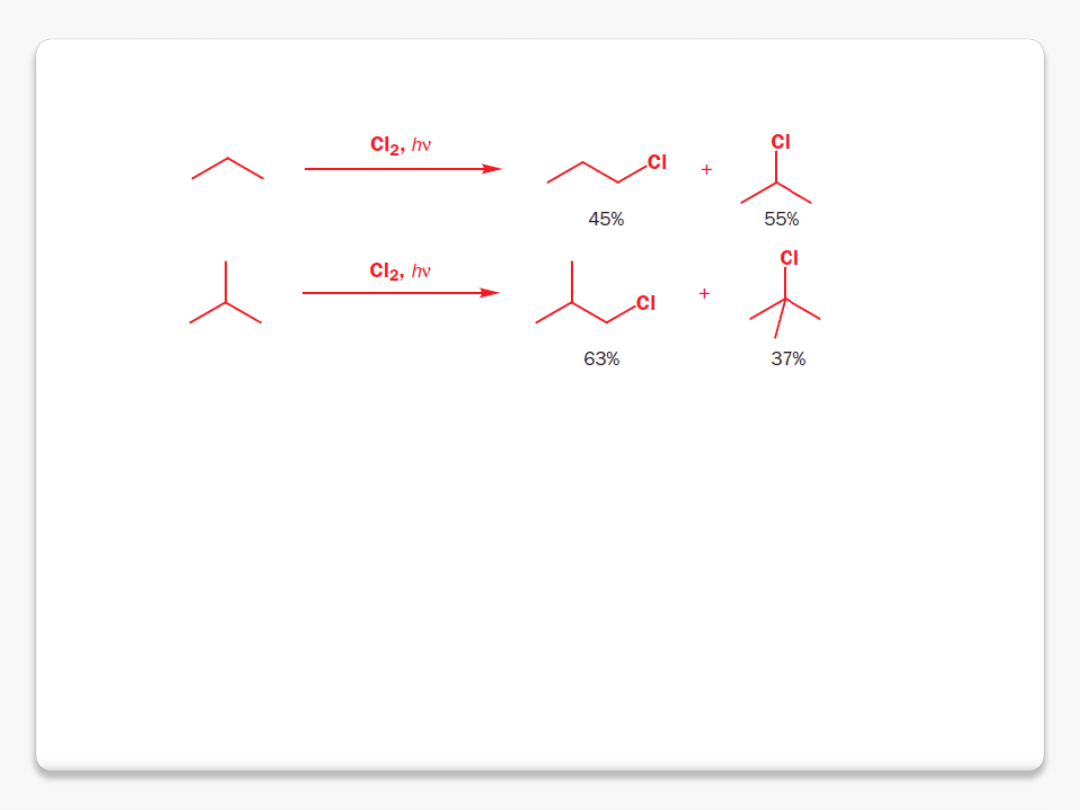
halogenowanie alkanów
3 C-H
1 C-H
trzeciorzędowy/pierwszorzędowy
37:63
liczba atomów wodoru
1:9
względna reaktywność każdego wiązania C-H 37/1:63/9 ca. 5:1
dla zainteresowanych: wyższą selektywność bromowania wyjaśnia się w oparciu o postulat Hammonda: w
przypadku chlorowania energia produktów jest tylko nieznacznie mniejsza od energii związków wyjściowych,
a więc stany przejściowe dwóch możliwych reakcji przypominają raczej związki wyjściowe niż produkty.
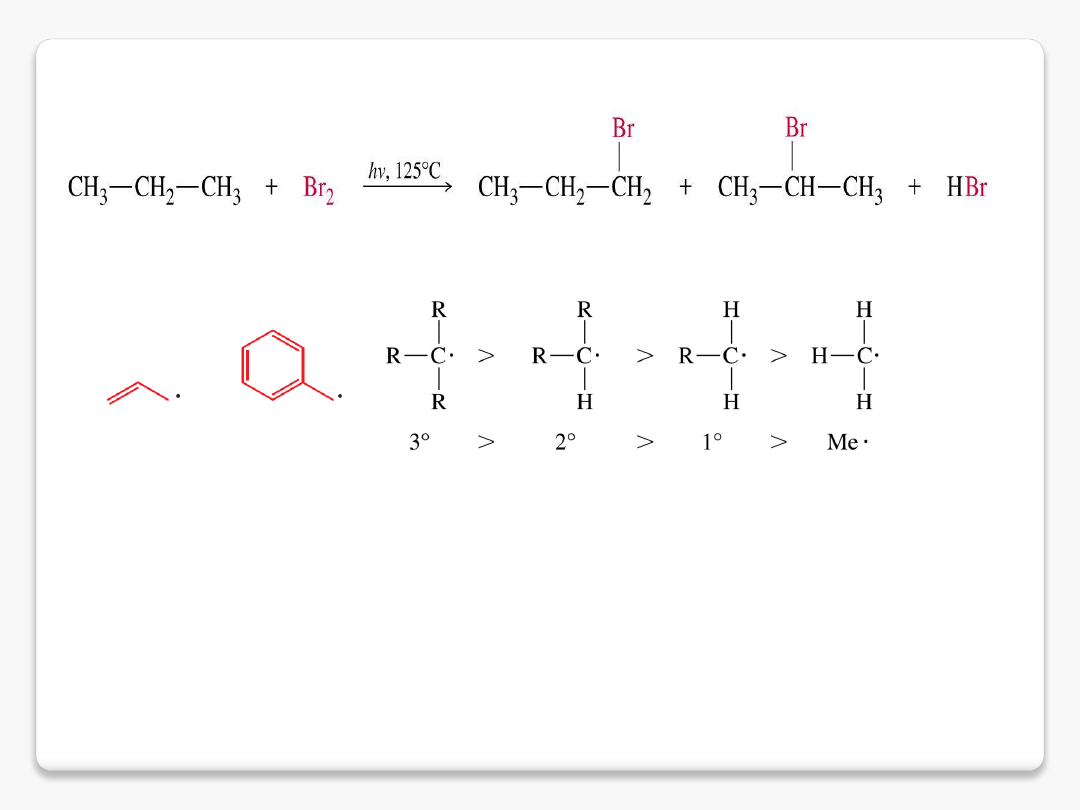
trwałość rodników
3 %
97 %
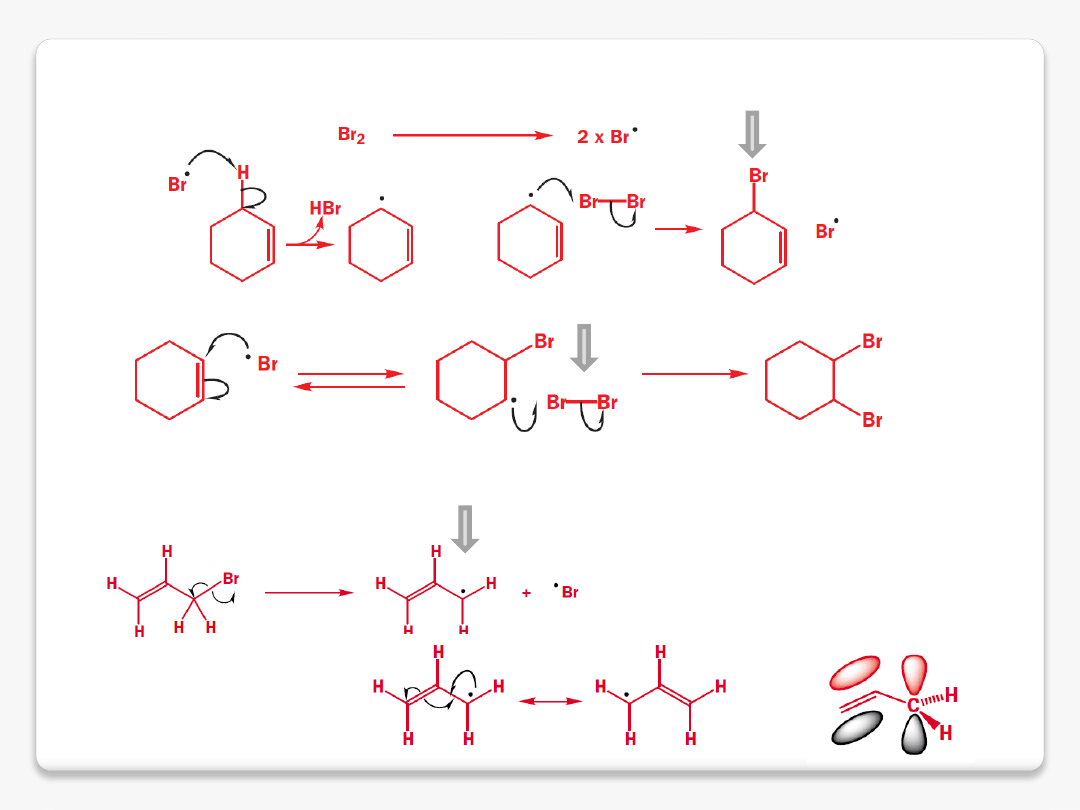
selektywne bromowanie allilowe
cząsteczka bromu
rodnik allilowy
bromek allilowy
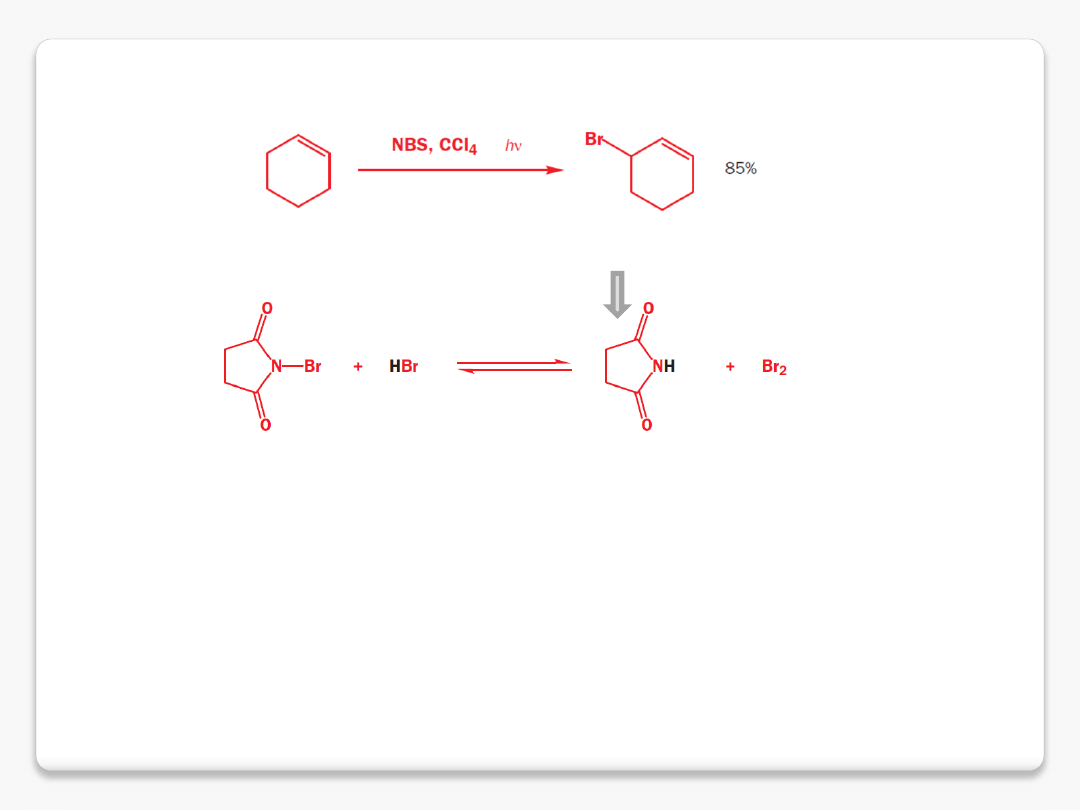
selektywne bromowanie allilowe
imid kwasu bursztynowego
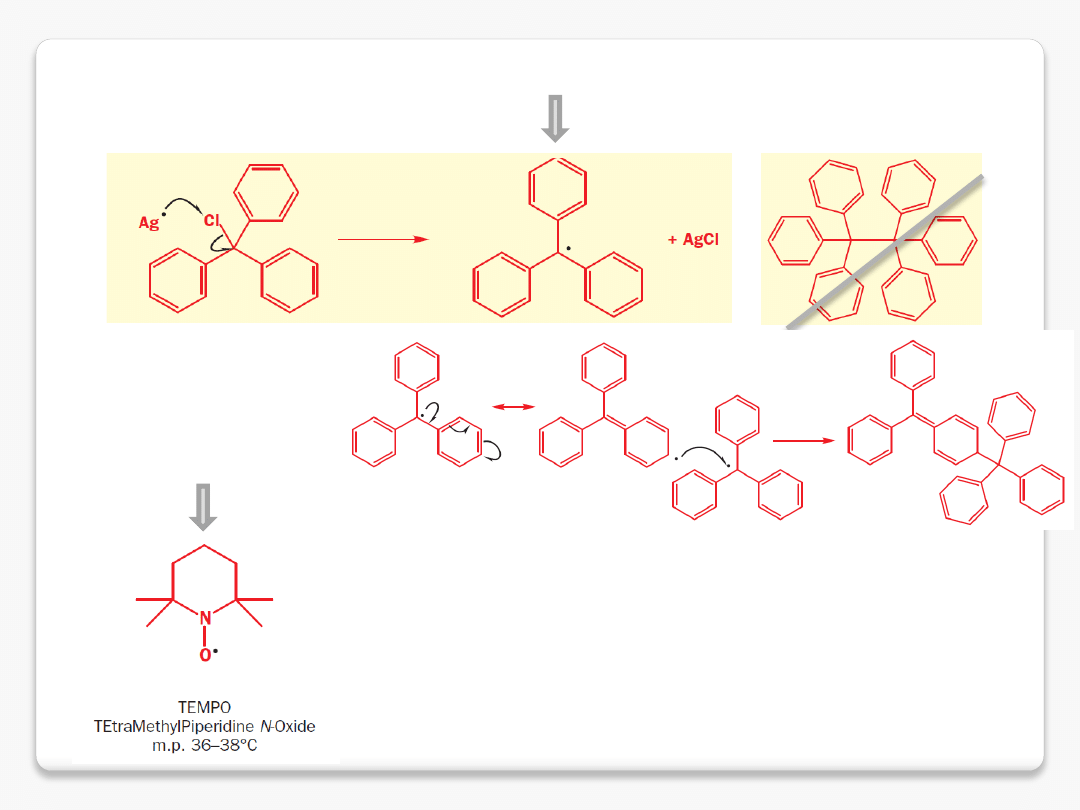
trwałe rodniki
rodnik trwały w wyniku stabilizacji
elektronowej
rodnik trwały w wyniku
obecności przeszkody
sterycznej
Wyszukiwarka
Podobne podstrony:
Ch organiczna wykład 1g
Ch organiczna wykład 1e
Ch organiczna wykład 1c
Ch organiczna wykład 1g
dyd k3a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e2b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
chemia fizyczna 1-1, SGGW - Technologia żywnosci, II semestr, SEMESTR 2, wyklady II rok, chem org,
dyd k2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd kzb, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd kza r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd e1c, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd tech11, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna
dyd k3a, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd e2a r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
dyd k3b, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna - w
dyd k1c r, chemia, 0, httpzcho.ch.pw.edu.pldydaktyk.html, Technologia Chemiczna, Chemia Organiczna -
9 Ch organiczna WĘGLOWODANY
więcej podobnych podstron