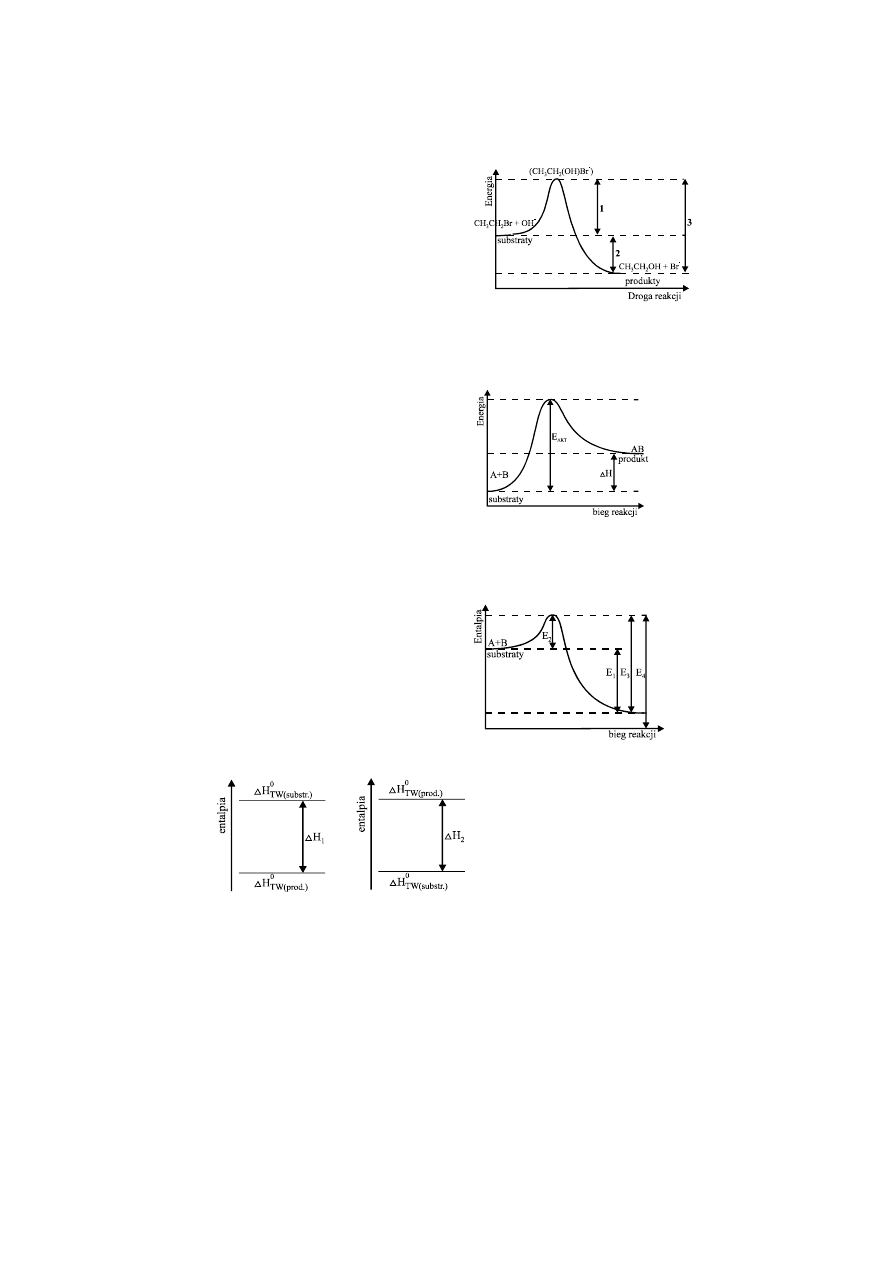
12. EFEKTY ENERGETYCZNE PROCESÓW
FIZYKO - CHEMICZNYCH
748. 1997/L
Jedną z reakcji otrzymywania etanolu może być
reakcja zapisana w następujący sposób:
CH
3
CH
2
Br + OH
−
→
CH
3
CH
2
OH + Br
−
.
Schemat przebiegu reakcji poprzez kompleks
aktywny (CH
3
CH
2
(OH)Br
−
) przedstawia poniższy
wykres:
Z tego wykresu możemy stwierdzić, że reakcja jest:
A.
egzoenergetyczna i świadczy o tym wartość energii oznaczona nr 3
B.
egzoenergetyczna i świadczy o tym wartość energii oznaczona nr 2
C.
endoenergetyczna i świadczy o tym wartość energii oznaczona nr 1
D.
endoenergetyczna i świadczy o tym wartość energii oznaczona nr 1 i 2
749. 1983/F
Wykres obrazuje zmiany energii substratów
i produktów w reakcji:
A.
zobojętniania
B.
egzotermicznej
C.
rozkładu
D.
endotermicznej
750. 1989/F
Przykładem procesu endotermicznego jest:
A. spalanie magnezu w tlenie
B. spalanie węgla w tlenie
C. otrzymywanie wapna gaszonego
D. rozkład CaCO
3
na tlenek wapnia i dwutlenek węgla
751. 1990/L
Energia aktywacji reakcji egzotermicznej
jest na rysunku oznaczona symbolem:
A.
E
1
B.
E
2
C.
E
3
D.
E
4
752. 1990/L
Na diagramach przedstawiono zmianę entalpii dwóch reakcji:
A.
diagram I przedstawia reakcję egzotermiczną, a II endotermiczną
B.
diagram I przedstawia reakcję endotermiczną, a II egzotermiczną
C.
na podstawie diagramów można określić zmianę energii aktywacji
D.
ż
adne z powyższych zdań nie jest prawdziwe
I.
II.

Chemia. Wybór testów...
106
753. 1989/F
Stężenie nasyconego roztworu KNO
3
w temperaturze 293K wynosi 24%, w temperaturze 333K -
52.4%, a w temperaturze 373K - 71.1%. Na podstawie tej informacji można powiedzieć, że proces
rozpuszczania KNO
3
:
A. jest egzotermiczny
B. nie można określić, czy jest procesem endo- czy egzotermicznym
C. zachodzi bez wymiany energii na sposób ciepła
D. jest endotermiczny
754. 1989/F
Które z podanych niżej pojęć są funkcjami stanu:
I - energia wewnętrzna
II - liczba moli
III - energia wymieniona na sposób pracy
IV - entalpia
A. I, III, IV
B. I, IV
C. I, II, IV
D. I, III
755. 1985/L
Zmiana: I - energii wewnętrznej układu
∆
U = Q
V
II - entalpii układu
∆
H = Q
p
oznacza praktycznie, że dla dwóch różnych przemian mających wspólny stan początkowy i końcowy ,
ilość energii wymienionej w formie ciepła między układem a otoczeniem są zależne wyłącznie od:
A.
stanu pośredniego układu
B.
wartości temperatury układu w stanie końcowym
C.
parametrów stanu układu na początku i na końcu
D.
parametrów stanu układu w trzech różnych punktach
756.
Stwierdzenie, że ciepło tworzenia związku chemicznego z prostych składników jest równe ciepłu
jego rozkładu na składniki proste (ze znakiem przeciwnym) jest treścią prawa:
A. Hessa
B. Lavoissiera-Laplace’a
C. Guldberga-Waagego
D. Vant’Hoffa
757.
Entalpia reakcji:
C
(s)
+ O
2
(g)
CO
2
w kierunku oznaczonym cyfrą I wynosi -393.5 kJ. Entalpia reakcji przebiegającej w kierunku
oznaczonym cyfrą II jest równa:
A. - 393.5 kJ
B. 393.5 kJ
C. 196.75 kJ
D. zero, gdyż produktami reakcji II są substancje proste
758. 1985/F
Zgodnie z prawem Hessa ilość energii wymienionej w formie ciepła między układem a otoczeniem
pod stałym ciśnieniem lub w stałej objętości (T = const.) zależy od:
A. drogi przemiany układu
B. stanu początkowego układu
C. stanu początkowego i końcowego układu
D. stanu końcowego układu
759. 1981/F
Ciepło tworzenia dwutlenku węgla
∆
H = - 393.5 kJ. Wynika z tego, że:
A.
w reakcji powstawania CO
2
energia wewnętrzna substratów jest mniejsza niż energia wewnętrzna
produktu
B.
w czasie powstawania CO
2
układ pobiera z otoczenia 393.5 kJ energii
C.
w czasie reakcji powstawania CO
2
energia wewnętrzna układu zmniejsza się o wartość 393.5 kJ
D.
reakcję otrzymywania CO
2
zaliczamy do reakcji endotermicznych
I
II

Efekty energetyczne...
107
760. 1996/F
Na podstawie wartości energii wiązań:
N – N
163 kJ/mol
N – O
210 kJ/mol
N = N
419 kJ/mol
N = O
631 kJ/mol
N
≡
N
947 kJ/mol
H – O
465 kJ/mol
H – H
436 kJ/mol
oblicz entalpię reakcji przebiegającej w fazie gazowej:
2 NO
2
+ 4 H
2
→
N
2
+ 4 H
2
O
A. 2245 kJ
B. 286 kJ
C. - 399 kJ
D. - 223 kJ
761. 1988/L
Obliczona przy wykorzystaniu podanych obok wartości energii rozrywania wiązań entalpia reakcji:
N
2 (g)
+ 3H
2(g)
→
2NH
3 (g)
wynosi:
wiązanie
energia wiązania w kJ/mol
H
−
H
436
N
≡
N
946
N
−
H
390
A. +1772 kJ
B. - 86 kJ
C. +4594 kJ
D. - 1772 kJ
762.
Poniżej podane są średnie wartości energii wiązania
C = C 613 kJ
⋅
mol
–1
;
C – C 342 kJ
⋅
mol
–1
;
C – H 412 kJ
⋅
mol
–1
;
Cl – Cl 242 kJ
⋅
mol
–1
;
C – Cl 335 kJ
⋅
mol
–1
;
Na ich podstawie oblicz entalpię addycji chloru do 1 mola cząsteczek etenu i wskaż prawidłową
odpowiedź.
A. – 157 kJ
B. – 13 kJ
C. 178 kJ
D. 255 kJ
763.
Energia wiązania C = O w CO
2
obliczona z reakcji:
CH
4
+ 2O
2
→
2H
2
O
(g)
+ CO
2
∆
H = - 802 kJ
wynosi:
A.
803 kJ
B.
2 kJ
C.
401.5 kJ
D.
20.0 kJ
wiązanie energia wiązania
C
−
H
415 kJ
H
−
O
463 kJ
O = O
498 kJ
764. 1993/L
Entalpia reakcji:
2H
2
+ O
2
→
2H
2
O
wynosi
∆
H = - 489 kJ.
Ile wynosi energia wiązania w cząsteczce tlenu, jeżeli energia wiązań H
−
O, H
−
H wynosi kolejno:
465 i 436 kJ
⋅
mol
-1
.
A. 499
B. 326
C. 450
D. 407
E. 355
765. 1990/L
Na podstawie niżej podanych reakcji :
I. CO
(g)
+ H
2
O
(g)
→
CO
2 (g)
+ H
2 (g)
∆
H
0
= - 41.0 kJ/mol CO
II. C
(s)
+ 1/2O
2 (g)
→
CO
(g)
∆
H
0
= - 110.5 kJ/mol CO
III. C
(s)
+ O
2 (g)
→
CO
2 (g)
∆
H
0
= - 393.5 kJ/mol CO
2
entalpia tworzenia H
2
O
(g)
wynosi:
A. - 151.5 kJ/mol H
2
O
B. +131.5 kJ/mol H
2
O
C. - 242.0 kJ/mol H
2
O
D. +242.0 kJ/mol H
2
O

Chemia. Wybór testów...
108
766. 1992/94/MIS MaP
Dane są równania reakcji:
C + H
2
→
CH
4
∆
H = -75 kJ
2CO + O
2
→
2CO
2
∆
H = -566 kJ
2C + O
2
→
2CO
∆
H = -222 kJ
2H
2
+ O
2
→
2H
2
O
∆
H = -484 kJ
Podane wyżej entalpie reakcji pozwalają na określenie molowego ciepła tworzenia:
A.
tylko H
2
O i CH
4
B.
tylko H
2
O, CH
4
i CO
C.
tylko CO
2
D.
wszystkich związków wymienionych w A, B i C
767. 1996/L
Przeczytaj poniższe stwierdzenia:
I. W procesie skraplania 1 mola pary wodnej z układu do otoczenia przekazywana jest na sposób
ciepła energia równa 44 kJ.
II. Standardowa entalpia tworzenia H
2
O
(g)
jest równa -242 kJ
⋅
mol
-1
.
Na podstawie powyższych stwierdzeń sądzisz, że standardowa entalpia tworzenia H
2
O
(c)
wynosi:
A. -154 kJ
⋅
mol
-1
B. -198 kJ
⋅
mol
-1
C. -286 kJ
⋅
mol
-1
D. -330 kJ
⋅
mol
-1
768. 1990/F
2H
2 (g)
+ O
2 (g)
→
2H
2
O
(c)
∆
H
0
= - 286 kJ/mol H
2
O
2H
2 (g)
+ O
2 (g)
→
2H
2
O
(g)
∆
H
0
= - 242 kJ/mol H
2
O
Z przedstawionych danych wynika, że entalpia parowania wody wynosi:
A. +44 kJ/mol
B. - 242 kJ/mol
C. - 286 kJ/mol
D. +22 kJ/mol
769. 1989/L, 1995/L
H
2 (g)
+ I
2 (s)
→
2HI
(g)
∆
H
0
= +26 kJ/mol HI
H
2 (g)
+ I
2 (g)
→
2HI
(g)
∆
H
0
= - 5 kJ/mol HI
Z przedstawionych danych wynika, że entalpia sublimacji jodu (I
2
) wynosi:
A. +31 kJ/mol
B. +21 kJ/mol
C. - 16 kJ/mol
D. +62 kJ/mol
770.
Temp.
czas
•
•
•
•
•
•
A
B
C
D
E
F
Na podstawie powyższego wykresu podaj, który z odcinków ilustruje przebieg przemiany fazowej
badanego układu:
A. CD
B. BC i DE
C. AB, CD i EF
D. AB, BC, CD, DE i EF
771. 1989/L
∆
H
0
tw CO
(g)
= - 393 kJ/mol
∆
H
0
tw SO
(g)
= - 297 kJ/mol
CS
2 (g)
+ 3O
2 (g)
→
CO
2 (g)
+ 2SO
2 (g)
∆
H
0
= - 1108 kJ/mol CS
2
Z powyższych danych wynika, że entalpia tworzenia CS
2
wynosi:
A. - 121 kJ/mol
B. +121 kJ/mol
C. - 1108 kJ/mol
D. +715 kJ/mol
2
2

Efekty energetyczne...
109
772. 1987/L
Standardowe entalpie tworzenia trzech substancji wynoszą:
substancja
∆∆∆∆
H
0
tw
(kJ/mol)
HCl
- 92.3
CH
≡
CH
+226.9
CH
2
= CHCl
+ 35.2
Entalpia reakcji addycji chlorowodoru do etylenu:
CH
≡
CH
(g)
+ HCl
(g)
→
CH
2
= CHCl
(g)
wynosi:
A. 354.4 kJ/mol
B. 169.4 kJ/mol
C. - 99.4 kJ/mol
D. - 169.4 kJ/mol
773. 1994/L
Dane są następujące wartości standardowych entalpii tworzenia (kJ/mol):
kwas octowy (ciecz) dwutlenek węgla (gaz)
woda (ciecz)
- 487.1
- 393.5
-285.8
Entalpia spalania kwasu octowego ma wartość:
A. -1166.4 kJ/mol
B. +871.5 kJ/mol
C. -871.5 kJ/mol
D. +192.2 kJ/mol
E. -192.2 kJ/mol
774. 1988/F
Obliczona w oparciu o wartości entalpii spalania węgla, siarki i dwusiarczku węgla:
S
(r)
∆
H
0
= - 297 kJ/mol
C
(gr)
∆
H
0
= - 394 kJ/mol
CS
2 (c)
∆
H
0
= - 1032 kJ/mol
entalpia reakcji:
C
(gr)
+ 2S
(r)
→
CS
2 (c)
wynosi:
A. - 1623 kJ
B. +44 kJ
C. +1623 kJ
D. - 44 kJ
775.
Oblicz entalpię tworzenia chlorku amonowego, opierając się na równaniu poniższej reakcji:
NH
3
+ HCl
→
NH
4
Cl + 179.6 kJ/mol
oraz podanych wartościach entalpii tworzenia amoniaku i chlorowodoru wynoszących odpowiednio:
∆
H
NH
3
= -46 kJ/mol,
∆
H
HCl
= -91.7 kJ/mol
A. -41.9 kJ/mol
B. +41.9 kJ/mol
C. -317.3 kJ/mol
D. -133.9 kJ/mol
776. 1998/L
Wiedząc, że trwałą odmianą alotropową węgla jest grafit oraz mając entalpie spalania do CO
2
(tlenek
węgla (IV)): grafitu
∆
H
°
298
= –394 kJ
⋅
mol
–1
i tlenku węgla (II)
∆
H
°
298
= –284 kJ
⋅
mol
–1
wskaż wartość
entalpii tworzenia tlenku węgla (II).
A. –678 kJ
⋅
mol
–1
B. –504 kJ
⋅
mol
–1
C. –174 kJ
⋅
mol
–1
D. –110 kJ
⋅
mol
–1
777. 1992/94/MIS MaP
Entalpie tworzenia (
∆
H) etanu i etylenu z substancji prostych w temp. 298 K wynoszą odpowiednio:
-85 kJ/mol oraz +52 kJ/mol. W tej temperaturze entalpia reakcji C
2
H
4
+ H
2
→
C
2
H
6
wynosi zatem:
A. -137 kJ
B. +33 kJ
C. 0 kJ
D. entalpii tej nie można obliczyć, gdyż nie znamy entalpii tworzenia wodoru (H
2
)

Chemia. Wybór testów...
110
778. 1995/MIS MaP
Standardowe entalpie spalania etenu, wodoru i etanu wynoszą odpowiednio:
-1411 kJ/mol
-286 kJ/mol
-1560 kJ/mol
Standardowa entalpia uwodornienia etenu ma wartość:
A. -137 kJ/mol
B. +137 kJ/mol
C. -1125 kJ/mol
D. +1125 kJ/mol
779.
Entalpia reakcji:
Mg(OH)
2 (s)
+ 2HCl
(g)
→
MgCl
2 (s)
+ 2H
2
O
(c)
wynosi :
A. - 104.1 kJ
∆
H
0
Tw
Mg(OH)
(s)
= - 924.7 kJ/mol
B. 1041.0 kJ
∆
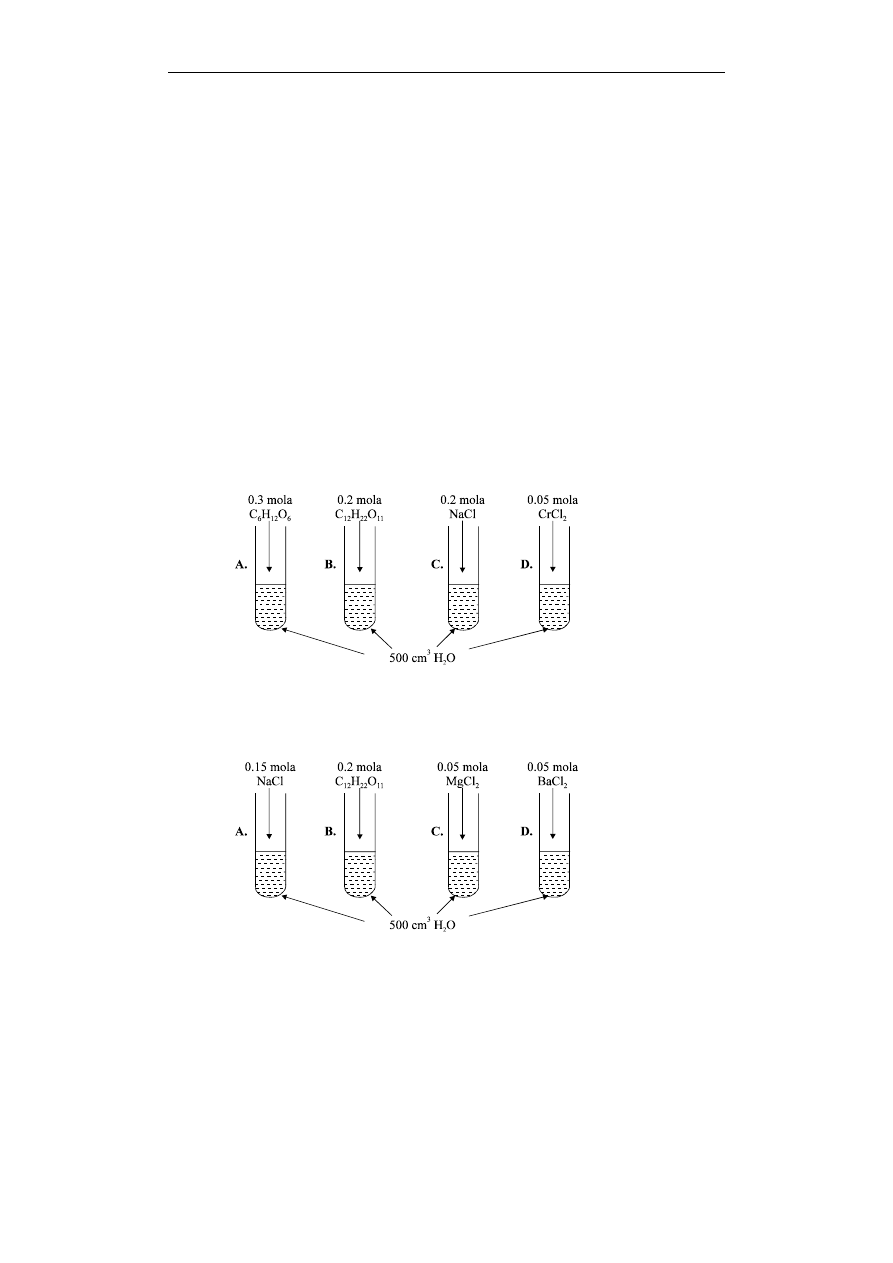
H
0
Tw
HCl (g)
= - 92.5 kJ/mol
C. 924.7 kJ
∆
H
0
Tw MgCl
(s)
= - 641.8 kJ/mol
D. - 572.0 kJ
∆
H
0
Tw H
O (c)
= - 286.0 kJ/mol
780.
Entalpia reakcji aluminotermicznej:
8Al
(s)
+ 3Mn
3
O
4 (s)
→
4Al
2
O
3 (s)
+ 9Mn
(s)
w warunkach standardowych wynosi:
A. - 2537.8 kJ
∆
H
Tw Al
O
(s)
= - 1674.7 kJ/mol
B. +253.7 kJ
∆
H
Tw Mn
O
(s)
= - 1387.0 kJ/mol
C. - 5047.2 kJ
D. - 3000.0 kJ
781.
Entalpia reakcji: SiCl
4 (s)
+ 2H
2
O
(c)
→
SiO
2 (s)
+ 4HCl
(g)
w warunkach standardowych wynosi:
A. 390.46 kJ
∆
H
Tw SiCl
(s)
= - 859.90 kJ/mol
B. - 1129.34 kJ
∆
H
Tw H
O (c)
= - 286.00 kJ/mol
C. 564.67 kJ
∆
H
Tw HCl (g)
= - 92.36 kJ/mol
D. - 672.00 kJ
∆
H
Tw SiO
(s)
= - 672.00 kJ/mol
782. 1992/94 MIS MaP
W jakim stosunku wagowym trzeba zmieszać rudę żelaza (Fe
2
O
3
) z koksem (C), aby w wielkim
piecu prowadzić reakcję według uproszczonego schematu procesu:
3C + 2Fe
2
O
3
→
4Fe + 3CO
2
∆
H = +197 kJ
C + O
2
→
CO
2
∆
H = -394 kJ
bez wymiany ciepła z otoczeniem (M
Fe
= 56):
A. 2 : 1
B. 3.8 : 1
C. 4 : 1
D. 7.6 : 1
783.
Układ dąży nie tylko do gromadzenia możliwie minimalnego zasobu energii, lecz również do
zapewnienia możliwie największej różnorodności sposobów jej podziału pomiędzy drobiny
i poszczególne rodzaje energii drobin. Miarą rozkładu energii w układzie jest entropia. W układach
chemicznych entropia rośnie:
I. w miarę rozpadania się wiązań
II. ze wzrostem temperatury
III. z obniżeniem temperatury
IV. ze wzrostem ciśnienia
V. z obniżeniem ciśnienia
Prawdziwymi są stwierdzenia:
A. I i II
B. I i V
C. tylko II
D. I, II, IV
E. I, II, V
2
2
2
2 3
3 4
4
2
2

Efekty energetyczne...
111
784.
I. W warunkach izotermiczno-izobarycznych zamknięty układ reagentów dąży do osiągnięcia
minimalnej wartości entalpii swobodnej.
II. Zamknięty układ reagentów osiąga stan równowagi termodynamicznej wówczas, gdy entalpia
układu osiąga wartość minimalną.
III. Zamknięty układ reagentów osiąga stan równowagi termodynamicznej wówczas, gdy entalpia
swobodna układu osiąga wartość minimalną.
IV. W warunkach izotermiczno-izochorycznych zamknięty układ reagentów dąży do osiągnięcia
maksymalnej wartości entalpii swobodnej.
V. Funkcja Gibbsa jest zdefiniowana równaniem:
∆
G =
∆
H - T
∆
S
Prawdziwe stwierdzenia zawierają:
A. I, II i V
B. I, II, IV i V
C. I, III i V
D. I i V
E. I, III, IV i V
785. 1997/F
Wskaż te procesy przedstawione na poniższym schemacie, w których entropia rośnie:
gaz
ciało
stałe
A. II, IV, VI
B. I, III, V
C. I, II
D. I, V
786. 1993/L
W procesach:
I - sublimacja
II - topnienie
III - parowanie
IV - krystalizacja
entropia rośnie w:
A. III, IV
B. I, III, IV
C. I, IV
D. II, IV
E. I, II, III
787.
Zmiana standardowej entropii reakcji: 2KClO
3 (s)
→
2KCl
(s)
+ 3O
2 (g)
wynosi:
A. +2.850 kJ/K
S
0
KClO
3
(s)
= 148.2 J/K
⋅
mol
B. - 2.850 kJ/K
S
0
KCl (s)
= 82.7 J/K
⋅
mol
C. +0.484 kJ/K
S
0
O
2
(g)
= 205.0 J/K
⋅
mol
D. - 2.090 kJ/K
788.
Oblicz wartość
∆
G (w temperaturze 25
o
C) dla reakcji:
2KClO
3 (s)
→
2KCl
(s)
+ 3O
2 (g)
korzystając z danych z zadania 787 i wartości
∆
H
0
podanych poniżej:
∆
H
0
KClO
3
(s)
= - 391 kJ/mol
∆
H
0
KCl (s)
= - 436 kJ/mol
A. - 234.2 kJ
B. +234.2 kJ
C. - 90.0 kJ
D. - 144.2 kJ
789.
Obliczona na podstawie poniższych wartości standardowych swobodnych entalpii przemiany:
∆
G
Fe
2
O
3
= - 751 kJ/mol
∆
G
Al
2
O
3
= -1578 kJ/mol
zmiana entalpii swobodnej układu w wyniku przebiegu reakcji aluminotermicznej wynosi:
A. - 827.0 kJ/mol Fe
2
O
3
B. +827.0 kJ/mol Fe
2
O
3
C. 2329.0 kJ/mol Fe
2
O
3
D. - 2329.0 kJ/mol Fe
2
O
3
ciecz
I
II
III
IV
VI
V

Chemia. Wybór testów...
112
790. 1998/F
Podaj, w którym przypadku poprawnie określono proces chemiczny na podstawie zaznaczonych wartości
zmian standardowych entalpii (
∆
H), entropii (
∆
S) i entalpii swobodnej (
∆
G) w danej temperaturze.
A.
∆
H > 0,
∆
S < 0,
∆
G > 0 – proces niesamorzutny
B.
∆
H < 0,
∆
S > 0,
∆
G > 0 – proces niesamorzutny
C.
∆
H < 0
∆
S > 0,
∆
G < 0 – proces samorzutny
D.
dwie odpowiedzi są poprawne
791.
2C
2
H
4 (g)
+ 6O
2 (g)
→
4CO
2 (g)
+ 4H
2
O
(c)
+ 2603 kJ
Na podstawie podanego równania termochemicznego entalpia reakcji i zmiana energii wewnętrznej
układu w warunkach standardowych wynosi odpowiednio:
A.
- 2603 kJ - 2593 kJ
B. +2603 kJ
+2595.5 kJ
C. +2603 kJ +2610.5 kJ
D. - 2603 kJ
- 2610.5 kJ
792.
CH
4 (g)
→
C
(s)
+ 2H
2 (g)
- 91 kJ
Na podstawie podanego równania termochemicznego entalpia reakcji i zmiana energii wewnętrznej
układu w warunkach standardowych wynosi odpowiednio:
A. +91 kJ
+88.5 kJ
B. -91 kJ
- 93.5 kJ
C. +91 kJ
- 93.5 kJ
D. +91 kJ
+93.5 kJ
793.
N
2 (g)
+ O
2 (g)
→
2NO
(g)
- 181 kJ
Na podstawie podanego równania termochemicznego entalpia reakcji i zmiana energii wewnętrznej
układu w warunkach standardowych wynosi odpowiednio:
A. +181 kJ
+183 kJ
B. +181 kJ
+181 kJ
C. +181 kJ
+178.5 kJ
D. - 181 kJ
- 183.5 kJ
794.
Które z poniższych stwierdzeń jest prawdziwe?
I. Proces rozpuszczania ciał stałych może być procesem egzotermicznym lub endotermicznym.
II. Rozpuszczaniu ciała stałego towarzyszą dwa efekty: efekt endotermiczny związany z niszczeniem
sieci krystalicznej i efekt egzotermiczny solwatacji jonów przez rozpuszczalnik. W zależności, który
z tych procesów przeważa entalpia procesu rozpuszczania może być dodatnia lub ujemna.
III. Efekt cieplny roztwarzania soli bezwodnej jest znacznie wyższy niż odpowiadającego jej hydratu.
A. tylko I
B. I i II
C. tylko III
D. I, II i III
795.
CaCO
3(s)
→
CaO
(s)
+ CO
2(g)
∆
H = +176 kJ/mol
Obliczona na podstawie podanego równania termochemicznego zmiana energii wewnętrznej
reagentów podczas rozkładu w warunkach standardowych 2 moli węglanu wapniowego wynosi:
A. +173.5 kJ/mol
B. +347 kJ/mol
C. +352 kJ/mol
D. - 357 kJ/mol
796. (*)
Wartość zmiany swobodnej entalpii reakcji procesów redoks przebiegających w fazie objętościowej
lub na granicy faz (ogniwa, elektroliza) może być obliczana z zależności:
∆
G = – n
⋅
F
⋅
∆
E
gdzie: n - ilość elektronów wymienianych w procesie redoks
F - stała Faraday’a (F = 96.5 kJ/V)
∆
E - różnica potencjałów utleniacza i reduktora (
∆
E = E
utleniacza
−
E
reduktora
)
Proces redoks zachodzi samorzutnie w danym kierunku wtedy, gdy:
A.
∆
E > 0
B. E
utleniacza
> E
reduktora
C. E
utleniacza
< E
reduktora
D. prawidłowe są odpowiedzi A i B
* Zadania związane z kierunkiem przebiegu reakcji redoks oraz efektami energetycznymi tych reakcji
zawierają rozdziały 22.2 i 23

Efekty energetyczne...
113
797. 1991/L
Wybierz reakcję, dla której w warunkach normalnych, wartość
∆
U i
∆
H są takie same.
A. n CH
2
= CH
2
→
( - CH
2
- CH
2
- )
n
B. H
2
O
(g)
→
H
2
O
(c)
C. Ag
+
(aq)
+ Cl
–
(aq)
→
AgCl
(s)
D. N
2 (g)
+ 3H
2 (g)
→
2NH
3 (g)
798.
Do czterech zlewek o pojemności 50 cm
3
wypełnionych do połowy wodą destylowaną dodano po
5 cm
3
kwasu siarkowego, do I - o stężeniu 20%, do II - o stężeniu 10%, III - o stężeniu 5%
i IV - o stężeniu 2%. Po upływie minuty od momentu dodania kwasu zmierzono temperaturę każdego
z roztworów stwierdzając, że:
A.
najwyższą temperaturę zarejestrowano w zlewce I
B.
najwyższą temperaturę zarejestrowano w zlewce IV
C.
temperatura w zlewce IV była 10 razy wyższa niż w I
D.
temperatury we wszystkich zlewkach były identyczne
799. 1982/L
W czasie rozpuszczania stężonego H
2
SO
4
w wodzie wydziela się ciepło. Jest to wynik:
A. własności zwęglających kwasu siarkowego
B. reakcji hydratacji jonów SO
4
2-
, która jest reakcją egzotermiczną
C. własności utleniających kwasu siarkowego
D. procesu redukcji kwasu siarkowego
800. 1997/L
W wyniku reakcji opisanej równaniem termochemicznym:
N
2(g)
+ O
2(g)
→
2NO
(g)
∆
H
°
298
= 181 kJ
otrzymano 5 moli NO (p = 1013 hPa, T = 298 K). W tym czasie energia wymieniona na sposób ciepła:
A. układ
→
otoczenie jest równa 905 kJ
B. układ
→
otoczenie jest równa 452.5 kJ
C. otoczenie
→
układ jest równa 905 kJ
D. otoczenie
→
układ jest równa 452.5 kJ
801.
Podczas reakcji cynku z 3.2g siarki wydzieliło się 20.3 kJ energii na sposób ciepła. Ciepło tworzenia
ZnS wynosi (w kJ/mol):
A. 20.3
B. 203
C. 2.03
D. 406
802.
Jaka ilość energii wydzieli się podczas syntezy pary wodnej z 7.32 dm
3
stechiometrycznej
mieszaniny tlenu i wodoru, odmierzonej w warunkach standardowych, wiedząc, że ciepło tworzenia pary
wodnej wynosi +242 kJ/mol?
A. 48.3 kJ
B. 96.8 kJ
C. 72.6 kJ
D. 24.2 kJ
803. 1986/L
Ile wynosi efekt cieplny rozpuszczania 68g CaSO
4
w wodzie, jeżeli jego ciepło rozpuszczania wynosi
- 20.2 kJ/mol:
A. - 10.1 kJ
B. - 20.2 kJ
C. - 28.5 kJ
D. - 40.8 kJ
804.
Podczas rozpuszczania 11.1g bezwodnego CaCl
2
zostaje wydzielone 7.6 kJ ciepła. Molowe ciepło
rozpuszczania bezwodnego CaCl
2
wynosi:
A. 76.00 kJ/mol
B. 0.76 kJ/mol
C. 111 kJ/mol
D. 760 kJ/mol
805. 1992/94 MIS MaP
Podczas rozpuszczania 1 mola bezwodnego Na
2
CO
3
zmierzony efekt cieplny tego procesu wynosił
25 kJ. Ciepło właściwe rozpuszczania węglanu sodu wynosi:
A. 0.24 kJ/g
B. 25.00 kJ/mol
C. 0.24 kJ/mol
D. 25 kJ/g
E. 106 kJ/g
Chemia. Wybór testów...
114
806.
Podczas rozpuszczania 1 mola bezwodnego Na
2
CO
3
wydziela się 25 kJ ciepła, natomiast podczas
rozpuszczania 1 mola Na
2
CO
3
⋅
10H
2
O zostaje pobrane 67 kJ ciepła. Efekt cieplny reakcji hydratacji
bezwodnego Na
2
CO
3
wynosi:
A.+92 kJ
B. -92 kJ
C. +42 kJ
D. -42 kJ
E. -67 kJ
807.
Podczas rozpuszczania 1 mola bezwodnego CaCl
2
zostaje wydzielone 76kJ ciepła. Podczas reakcji
hydratacji 1 mola CaCl
2
wydziela się 95.1kJ ciepła. Efekt cieplny rozpuszczania 2
moli uwodnionego
chlorku wapnia CaCl
2
⋅
6H
2
O wynosi:
A. +171.0 kJ
B. -19.1 kJ
C. +19.1 kJ
D. +114.6 kJ
E. -38.2 kJ
808.
Do wielkości charakterystycznych dla roztworów, a zależnych tylko od liczby niezależnych
cząsteczek w danej objętości roztworu (tzw. „wielkości koligatywnych”) należy:
A.
obniżenie temperatury krzepnięcia roztworu
B.
podwyższenie temperatury wrzenia roztworu
C.
ciśnienie osmotyczne
D.
wszystkie wymienione
809. 1985/F
Roztwory charakteryzują się niższą temperaturą krzepnięcia od temperatury krzepnięcia czystego
rozpuszczalnika. To obniżenie temperatury jest proporcjonalne do ilości cząsteczek lub jonów substancji
rozpuszczonej w danej ilości rozpuszczalnika. Który z poniższych roztworów posiada najniższą
temperaturę krzepnięcia?
810. 1985/L
Roztwory charakteryzują się wyższą temperaturą wrzenia od temperatury wrzenia czystego
rozpuszczalnika. To podwyższenie temperatury jest proporcjonalne do ilości cząsteczek lub jonów
substancji rozpuszczonej w danej ilości rozpuszczalnika. Który z poniższych roztworów posiada
najwyższą temperaturę wrzenia?

Efekty energetyczne...
115
811. 1999/F
Najwyższą temperaturę wrzenia będzie posiadał roztwór:
A. glukozy o stężeniu 0,2 mol/dm
3
B. chlorku sodu o stężeniu 0,15 mol/dm
3
C. siarczanu(VI) potasu o stężeniu 0,1 mol/dm
3
D. fluorku glinu o stężeniu 0,1 mol/dm
3
812. 1990/F
W 1000g wody rozpuszczono:
- 0.01 mola gliceryny
- 0.01 mola NaCl
- 0.01 mola K
2
SO
4
Temperatura krzepnięcia wody uległa:
A. podwyższeniu w jednakowym stopniu we wszystkich roztworach
B. obniżeniu w jednakowym stopniu we wszystkich roztworach
C. najsilniej podwyższeniu w roztworze gliceryny
D. najsilniej obniżeniu w roztworze siarczanu potasu
813. 1992/94/MIS MaP
Który z poniższych zabiegów wywoła maksymalne podwyższenie temperatury wrzenia pewnego
wodnego roztworu?
A. obniżenie ciśnienia nad układem
B. rozpuszczenie w roztworze 1 mola NaCl
C. rozpuszczenie w roztworze 1 mola sacharozy
D. rozcieńczanie roztworu wodą destylowaną
UWAGA! składniki roztworu nie reagują z NaCl i sacharozą
Do rozwiązania zadań testowych o numerach: 814 – 819 przydatna jest poniższa informacja:
Podwyższenie temperatury wrzenia (
∆
T
W
) podobnie jak obniżenie temperatury topnienia (
∆
T
K
)
roztworów w stosunku do czystego rozpuszczalnika jest wprost proporcjonalne do stężenia (m)
wyrażonego w molach na kg rozpuszczalnika (molalności):
∆
T
W
= m
⋅
K
E
∆
T
K
= m
⋅
K
K
gdzie wartości stałych: krioskopowej (K
K
) i ebulioskopowej (K
E
) dla roztworów wodnych wynoszą
odpowiednio: -1.86
o
C i 0.52
o
C dla substancji nie ulegających procesowi dysocjacji. W obliczeniach
należy uwzględnić fakt, że zarówno
∆
T
W
jak i
∆
T
K
są wielkościami koligatywnymi.
814.
W zimie układy chłodzenia silników samochodowych są wypełniane mieszaniną wody i glikolu
etylenowego, ponieważ mieszanina ta ma niższą temperaturę krzepnięcia niż czysta woda. W jakim
stosunku wagowym należy zmieszać wodę z glikolem, aby otrzymana mieszanina miała temperaturę
krzepnięcia -40
o
C?
A. 3 : 4
B. 4 : 3
C. 1 : 1
D. 1 : 2
815.
W zimie ulice są posypywane solą, co powoduje, że na ich powierzchni nie tworzy się pokrywa
lodowa. Jest to wynikiem tego, że powstający wtedy na powierzchni jezdni roztwór wodny NaCl (woda
pochodzi z opadów śniegu) ma temperaturę krzepnięcia znacznie niższą od zera. Jakie teoretycznie
powinien mieć stężenie roztwór wodny NaCl, aby jego temperatura krzepnięcia nie była niższa niż
–20
o
C?
A. 31.5%
B. 15.7%
C. 24%
D. 20%

Chemia. Wybór testów...
116
816.
Temperatura wrzenia roztworu otrzymanego przez rozpuszczenie 12g MgSO
4
w 500g wody wynosi
(p = 1013 hPa):
A. 100.21
o
C
B. 106
o
C
C. 112
o
C
D. 100.52
o
C
817.
W jakim stosunku wagowym należy zmieszać wodę z gliceryną, aby otrzymany roztwór wrzał w
temperaturze 120
°
C (pod ciśnieniem 1013 hPa)?
A. 1 : 1
B. 7 : 2
C. 4 : 1
D. 3 : 2
818.
Temperatura krzepnięcia roztworu otrzymanego przez rozpuszczenie 35.5g Na
2
SO
4
w 250g wody
wynosi (p = 1013 hPa):
A. - 5.58
o
C
B. 0
o
C
C. - 35.5
o
C
D. +5.58
o
C
819.
Roztwór otrzymany w wyniku rozpuszczenia w 500g wody 100g pewnego związku organicznego
(nie ulegającego dysocjacji) krzepnie w temperaturze 268.96 K. Masa molowa tego związku wynosi:
A. 92
B. 55.8
C. 180
D. 60
Wyszukiwarka
Podobne podstrony:
Znaczenie efektywności energetycznej dla bezpieczeństwa energetycznego kraju
Efektywnosc energetyczna Prezentacja 06 2010
Co to jest efektywność energetyczna, Studia, Energetyka
8 Efektywnosc energetyczna id Nieznany (2)
201 Efektywnosc energetyczna web
INNOWACJA I ROZWÓJ Efektywność energetyczna
konkurs na najbardziej efektywną energetycznie gminę w polsc, administracja, Reszta, STARE, Energety
SEE ćw 20 linia, Elektrotechnika-materiały do szkoły, Efektywność energetyczna w systemie elektroene
Efekty energetyczne reakcji
projekt ekonomiczny, Elektrotechnika-materiały do szkoły, Efektywność energetyczna w systemie elektr
20150723 List do premier Kopacz Efektywnosc Energetyczna
efektywnosc energetyczna a ubostwo energetyczne
LOKALNE PRZYKŁADY EFEKTYWNOŚCI ENERGETYCZNEJ, administracja, Reszta, STARE, Energetyka
Oszczednosc energii efektywnosc energetyczna vkp pl
Efektywność energetyczna, Studia, Energetyka
8 Efektywność energetyczna
Profil efektywności energetycznej
8 Efektywność energetyczna
więcej podobnych podstron