
Enzymologia, instrukcja do zajęć laboratoryjnych, ćwiczenie 3
1
Ćwiczenie 3. Preparacja aldolazy z mięśni królika według metody
Taylora
i wsp.
Literatura:
J. E. Taylor, A. A. Green, G.T. Cori (1948)
J.Biol.Chem.
173, 591-604
E. E. Penhoet, M. Kochman, W. J. Rutter (1969)
Biochemistry
8, 4391-4395
oraz literatura podana do ćwiczenia 1.
Odczynniki, szkło i aparatura wykorzystywane przy wykonywaniu ćwiczenia:
•
zamrożone mięśnie królika
•
woda destylowana
•
lód
•
5 % roztwór amoniaku
•
nasycony roztwór siarczanu amonu (sporządzony na poprzednich zajęciach)
•
papierek wskaźnikowy
•
roztwory do oznaczania aktywności aldolazowej:
o
10 mM bufor Tris/HCl, 1 mM EDTA, pH 7.2
o
100 mM Tris/HCl, 1 mM EDTA, 2.6 mM siarczan hydrazyny, pH 7.5
o
30 mM FDP
•
wirówka preparatywna Beckman J-21 B, rotor JA-14
•
duże probówki wirówkowe
•
spektrofotometr
•
kuwety pomiarowe
•
zlewki, cylindry, pipety, bagietki
Zadanie 3. Jaką objętość nasyconego roztworu siarczanu amonu należy dodać do
100 ml 50 % roztworu siarczanu amonu, aby otrzymać 52 % roztwór?
W celu wykonania ćwiczenia 3 niezbędna będzie również instrukcja do ćwiczenia 1.
1.
Zamrożone mięśnie królika (50 g) rozmrozić, pokroić na mniejsze kawałki i
zmielić w maszynce do mięsa.
2.
Następnie do zmielonych mięśni dodać 100 ml wody i mięśnie
zhomogenizować.
3.
Homogenat przenieść do zlewki umieszczonej w łaźni lodowej i mieszając
bagietką, ekstrahować białka przez około 20 min.
4.
Przelać mieszaninę do probówki wirówkowej i zrównoważyć na wadze
względem mieszaniny przygotowanej przez inną grupę ćwiczeniową.
UWAGA! Próbówki wirówkowe należy wytrzeć do sucha przed położeniem na
wadze oraz przed umieszczeniem w rotorze wirówki!
5.
Tkankę oddzielić od roztworu białek (tj. frakcji białek rozpuszczalnych)
poprzez wirowanie mieszaniny w wirówce J-21 B przez 20 min,
13000 obr/min, tj. ok. 17000 x g w temperaturze 2-4
o
C.

Enzymologia, instrukcja do zajęć laboratoryjnych, ćwiczenie 3
2
6.
W tym czasie umyć zlewkę i schłodzić ją wraz z cylindrem miarowym (
ad.
100
ml) w łaźni lodowej.
7.
Uzyskany
po
wirowaniu
mieszaniny
supernatant
przesączyć
do
przygotowanego cylindra miarowego przez lejek zawierający watę szklaną.
8.
Pobrać 0.5 ml przesączu do probówki chemicznej opisanej jako „przesącz 1”,
mieszaninę utrzymywać w obniżonej temperaturze, tj. w łaźni lodowej.
9.
Dwie osoby z grupy przystępują do pomiaru aktywności aldolazy zawartej w
pobranej próbce przesączu (instrukcja do ćwiczenia 1, ale do pomiaru A
280
wziąć 100
µ
l przesączu 1, a do pomiaru A
240
– 50
µ
l rozcieńczonego przesączu
1), natomiast trzecia osoba kontynuuje preparację.
10.
Uzupełnić Tabele 2 i 3.
11.
Odczytać objętość pozostałego w cylindrze przesączu, zanotować wartość w
Tabeli 1.
12.
Przelać przesącz do schłodzonej zlewki i przenieść pod włączony wyciąg, pod
którym powinny znajdować się: 5% roztwór amoniaku, pipeta Pasteura,
papierki uniwersalne.
13.
Zmiareczkować przesącz za pomocą amoniaku do pH 7-7.5, kontrolując ilość
dodanego amoniaku, a jego objętość zapisać w protokole jako V
NH
3
H
2
O
.
(1 kropla to 50 – 100
µ
l, pojemność pipety Pasteura – 1 ml).
14.
Obliczyć objętość nasyconego roztworu siarczanu amonu
1
)
(
4
2
4
SO
NH
V
, jaką należy
dodać do zmiareczkowanego przesączu (V
przesączu_1
+ V
NH
3
H
2
O
), aby uzyskać
50 % jego wysycenia. Wartość wpisać do Tabeli 1.
15.
Do zmiareczkowanego przesączu dodawać małymi porcjami (przez ok. 10 min)
nasycony roztwór siarczanu amonu w objętości
1
)
(
4
2
4
SO
NH
V
. Przesącz powinien
być cały czas trzymany w łaźni lodowej i mieszany bagietką. Co pewien czas
sprawdzać pH mieszaniny i wyrównywać je do poziomu 7-7.5. Korygować w
protokole wartość V
(NH
4
)
2
SO
4
uwzględniając objętość dodawanego amoniaku.
16.
Otrzymaną wysoloną zawiesinę białek mieszać w łaźni lodowej przez 15 min.
17.
Przelać zawiesinę do probówki wirówkowej i zrównoważyć na wadze
względem mieszaniny przygotowanej przez inną grupę ćwiczeniową.
UWAGA! Próbówki wirówkowe należy wytrzeć do sucha przed położeniem na
wadze oraz przed umieszczeniem w rotorze wirówki!
18.
Mieszaniny wirować w wirówce J-21 B przez 25 min, 13000 obr/min, tj. ok.
17000 x g w temperaturze 2-4
o
C.
19.
Uzyskany podczas wirowania supernatant przelać do schłodzonego cylindra
miarowego.
20.
Pobrać 0.5 ml przesączu do probówki chemicznej opisanej jako „przesącz 2”,
mieszaninę utrzymywać w obniżonej temperaturze, tj. w łaźni lodowej.
21.
Dwie osoby z grupy przystępują do pomiaru aktywności aldolazy zawartej w
pobranej próbce przesączu (jak w punkcie 9), a trzecia osoba kontynuuje
preparację.
Enzymologia, instrukcja do zajęć laboratoryjnych, ćwiczenie 3
3
22.
Uzupełnić Tabele 2 i 3.
23.
Odczytać objętość pozostałego w cylindrze przesączu i zanotować wartość w
Tabeli 1.
24.
Przelać przesącz do zlewki schłodzonej w łaźni lodowej.
25.
Policzyć objętość nasyconego roztworu siarczanu amonu
2
)
(
4
2
4
SO
NH
V
, jaką należy
dodać do otrzymanego przesączu (V
przesączu_2
), aby uzyskać 52 % jego
wysycenia. Wartość wpisać do Tabeli 1.
26.
Do zmiareczkowanego przesączu dodawać małymi porcjami (przez ok. 10 min)
nasycony roztwór siarczanu amonu w objętości
2
)
(
4
2
4
SO
NH
V
. Przesącz powinien
być cały czas trzymany w łaźni lodowej i mieszany bagietką. Co pewien czas
sprawdzać pH mieszaniny i wyrównywać je do poziomu 7-7.5. Korygować w
protokole wartość V
(NH
4
)
2
SO
4
uwzględniając objętość dodawanego amoniaku.
27.
Otrzymaną mieszaninę pozostawić do krystalizacji, która będzie przebiegać w
temperaturze ~5
o
C przez tydzień.
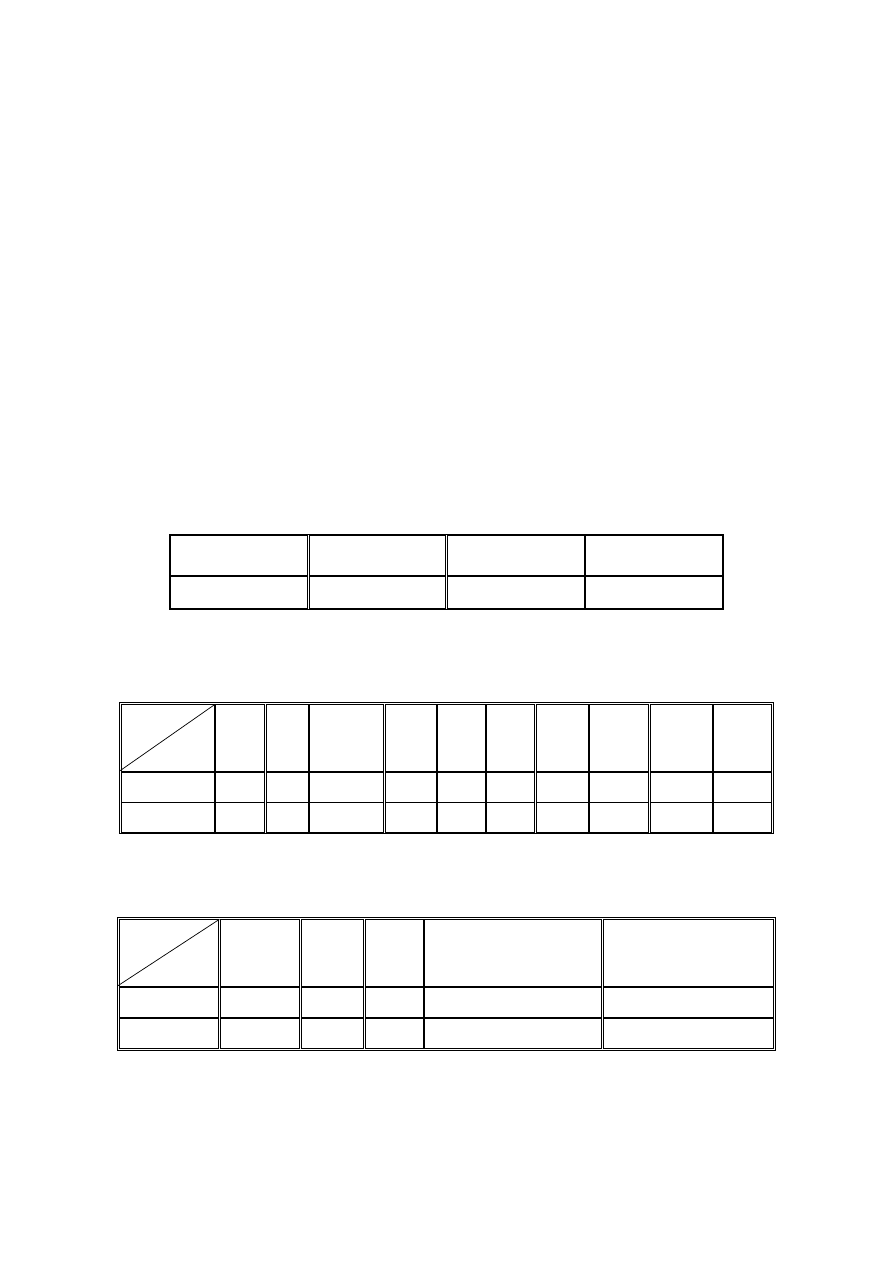
Tabela 1.
V
przesączu_1
1
)
(
4
2
4
SO
NH
V
V
przesączu_2
2
)
(
4
2
4
SO
NH
V
Tabela 2. Obliczenia
dla roztworu aldolazy w kuwetach pomiarowych.
2
1
→
V
[
µ
l]
A
280
2
bialek
C
[mg/ml]
3
2
→
V
[
µ
l]
p
A
240
k
A
240
∆
A
240
∆
t
[min.]
3
ald
Akt
[U/ml]
3
tot
Akt
[U]
przesącz 1
przesącz 2
Tabela 3.
Obliczenia dla pobranych próbek przesączu.
1
bialek
C
[mg/ml]
1
ald
Akt
[U/ml]
1
tot
Akt
[U]
Całkowita masa białek
1
bialek
m
[g]
Wydajność preparacji
[%]
przesącz 1
przesącz 2
Wyszukiwarka
Podobne podstrony:
Cwiczenie 3A id 99454 Nieznany
Ćwiczenie 3A (2)
cwiczenie 3a, Ochrona Środowiska UR Kraków, Rok II, Semestr III, Hydrologia i ochrona wód
Instrukcja do ćwiczenia 3A
C3a Cwiczenia 3a
cwiczenie 3a przepompownia id 1 Nieznany
Ćwiczenie 3A
ćwiczenie 3a
Cwiczenie 3A Excel
4 10 03 2014 Ćwiczenie 3a METODY TECHNICZNEGO NORMOWANIA PRACY
Ćwiczenie 3a 01 04 2014 Zadanie nr 1
lista 3a, Elektrotechnika, PODSTAWY ELEKTROTECHNIKI, ćwiczenia
podstawy automatyki ćwiczenia lista nr 3a
3a. Teoretyczne źródła socjologii grup społecznych, Ćwiczenia - dr K
zad 1-3 gr 3a, Geodezja PW, Stare dzieje, Geod fiz + graw, Ćwiczenia
więcej podobnych podstron