





Antybiotyki
z gr. ἀντί – anti, „przeciw", βίοτίκοσ – biotikos - „zdolny do
życia„
Drobnocząsteczkowe substancje, które działają
przeciwdrobnoustrojowo, zabijają lub hamują rozmnażanie komórek
drobnoustrojów.
Na początku za antybiotyki uważano substancje pochodzenia naturalnego
wykazujące aktywność przeciwbakteryjną. Obecnie chemioterapeutyki
(substancje wytworzone przez człowieka metodami chemicznymi)
uznawane są również za antybiotyki .
Antybiotyki zabijając drobnoustroje lub hamując ich rozmnażanie ułatwiają
organizmowi gospodarza opanowanie zakażenia.
Dzięki antybiotykom możliwe stało się leczenie bardzo poważnych zakażeń
bakteryjnych, takich jak np. zapalenie płuc, gruźlica, zakażenia krwi, trąd.

Te choroby przed wprowadzeniem antybiotyków były śmiertelne.
Niestety obserwujemy w świecie bardzo groźne zjawisko narastania
antybiotykooporności. Zakażenia wywołane przez bakterie oporne na
antybiotyki nie poddają się leczeniu. Grozi nam powrót do stanu sprzed
odkrycia penicyliny i te poważne choroby zakaźne mogą znów stać się
śmiertelne.
Dlatego konieczna jest wiedza dotycząca antybiotyków, aby stosować
racjonalną antybiotykoterapię, która daje szansę na spowolnienie
procesu narastania oporności bakterii.
Racjonalna antybiotykoterapia
zlecanie antybiotyków wtedy i tylko wtedy, kiedy jest to korzystne dla
pacjenta
dokonywanie wyboru antybiotyku, dawki i czasu leczenia, tak aby uzyskać
optymalną skuteczność leczenia, przy minimalnym ryzyku działań
niepożądanych i wpływie na lekooporność oraz jak najmniejszych kosztach.
Antybiotyki i chemioterapeutyki
Antybiotyki – substancje produkowane przez drobnoustroje (bakterie lub
grzyby) działające przeciwko innym drobnoustrojom
Chemnioterapeutyki – substancje działające przeciwdrobnoustrojowo,
wytworzone (opracowane i produkowane) przez człowieka, nie mają
naturalnego wzorca w przyrodzie. Obecnie zaliczane do antybiotyków.
Podział antybiotyków ze względu na pochodzenie
Naturalne – produkowane przez drobnoustroje (metabolity
drobnoustrojów), oczyszczone i podawane jako leki.
Półsyntetyczne – pochodne antybiotyków naturalnych uzyskiwane
poprzez chemiczną modyfikację
Syntetyczne – syntetyzowane chemicznie w sposób odtwarzający
budowa antybiotyku występującego naturalnie.
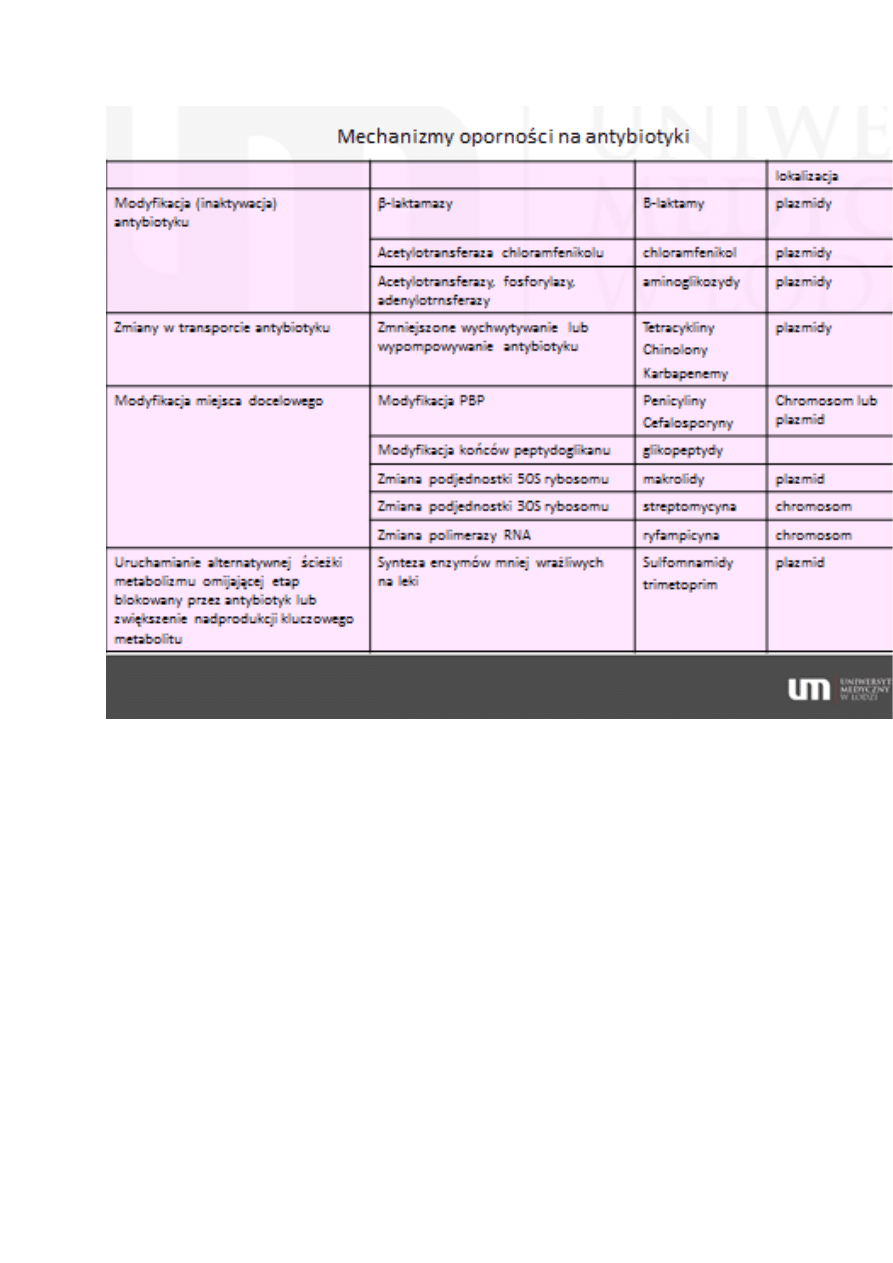
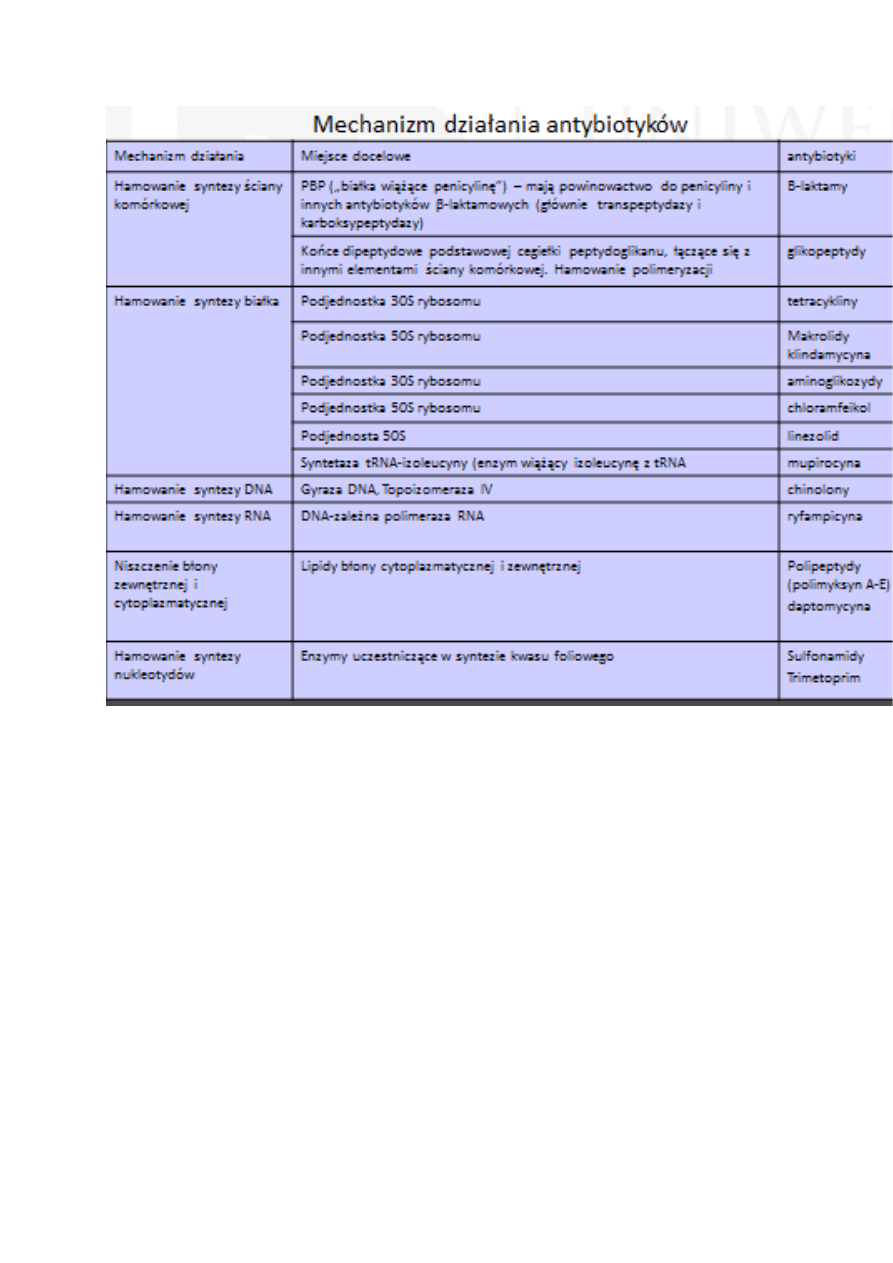
Mechanizm działania antybiotyków
Hamowanie syntezy ściany komórkowej
Β-laktamy – wiążą się z PBP („białka wiążące penicylinę”). PBP mają
powinowactwo do penicyliny i innych antybiotyków β-laktamowych. Są to:

Transpeptydazy i karboksypeptydazy - biorą udział w wiązaniu krzyżowym
peptydoglikanu przez D-alanyo-D-alaninę. Do tych enzymów termin PBP
jest stosowany najczęściej.
Białka receptorowe – przekazują sygnał do indukcji β-laktamaz
Β-laktamazy – enzymy produkowane przez bakterie hudrolizujące
antybiotyki β-laktamowe
Ostatecznie powoduje to lizę komórki bakteryjnej
Glikopeptydy - Hamują polimeryzację. Wiążą się z końcami dipeptydowymi
podstawowej cegiełki peptydoglikanu, które łączą się z innymi elementami
ściany komórkowej.
Hamowanie syntezy białka
Tetracykliny – łączą się z podjednostką 30S rybosomu i niedopuszczają
do wiązania aminoacylo-tRNA w rybosomie. Hamują przyłączanie kolejnych
aminokwasów do łańcucha peptydowego.
Makrolidy i linkozamidy– wiążą się odwracalnie z większą podjednostką
rybosomu 50S, uniemożliwiając wydłużanie łańcucha białka.
Aminoglikozydy – hamują translację poprzez wiązanie z małą
podjednostką rybosomu 30S. Powodują zaburzenia sekwencji
aminokwasów lub zakańczenie procesu translacji. Antybiotyki te działają
również na błonę komórkową co w sumie doprowadza do śmierci komórki.
Chloramfenkol – łączy się z 50S rybosomu, co uniemożliwia łączenie z
aminoacylo-tRNA .
Oksazolidynony – uniemożliwiają połączenie podjednostki 30S i 50S i
powstanie kompleksu 70S rybosomu.
Hamowanie syntezy DNA
Chinolony – hamują aktywność z gyrazy DNA i topoizomerazy IV. Poprzez
stabilizację połączenia enzym-DNA. Połączenie jest nieodwracalne.
Skutkiem jest zahamowanie syntezy DNA i szybka śmierć komórki.
Gyraza DNA – wprowadza ujemne superhelikalne skręty do nici DNA,
co umożliwia replikację i transkrypcję.
Topoizomeraza IV – bierze udział w rozdzielaniu chromosomów, co
pozwala na przechodzenie ich do komórki potomnej.
Hamowanie syntezy RNA

Ryfampicyna – hamuje działanie DNA-zależnej polimerazy RNA
Niszczenie błony zewnętrznej i cytoplazmatycznej
Polipeptydy (polimyksyna A-E) – łączą się z lipidowymi składnikami błony
zewnętrznej i cytoplazmatycznej, co powoduje utratę szczelności obu błon.
Hamowanie syntezy nukleotydów
Sulfonamidy –są antagonistami kwasu p-aminobenzoesowego, który
bierze udział w syntezie kwasu foliowego. Zastępowanie kwasu prowadzi
do zahamowania syntezy nukleotydów i uniemożliwia namnażanie bakterii.
Trimetoprim – inhibitor bakteryjnej reduktazy kwasu dihydrofoliowego,
hamuje powstawanie w komórce bakteryjnej kwasu tetrahudrofoliowego
(aktywnej postaci kwasu foliowego), co powoduje zahamowanie syntezy
nukleotydów i
Działanie antybiotyków
Bakteriostatyczne – hamowanie wzrostu bakterii:
Tetracykliny
Makrolidy, ketolidy
Sulfomamidy
Oksazolidynony
Tigecyklina
Bakteriobójcze – zabijanie komórek bakteryjnych:
Aminoglikozydy
Β-laktamy
Chloramfenikol
Chinolony
Polimyksyny
Glikopeptydy
Daptomycyna

Linkozamidy
Oporność na antybiotyki
Oporność – stan, w którym antybiotyk nie działa przeciwdrobnoustrojowo
(nie zabija ani nie hamuje namnażania). Taki szczep bakteryjny jest oporny
na dany antybiotyk. Leczenie takim antybiotykiem jest nieskuteczne.
Naturalna (pierwotna) – uwarunkowana genetycznie niewrażliwość
pewnych gatunków, rodzajów lub grup bakterii na dany antybiotyk. Jest to
cecha stała bakterii, która była obecna jeszcze przed odkryciem i
zastosowaniem antybiotyków (np. drobnoustroje Gram-ujemne są
naturalnie oporne na glikopeptydy, Pseudomonas aeruguinosa jest
naturalnie oporny na penicylinę, Stenorophomonas sp. na karbapenemy))
W przypadku zakażenia danym drobnoustrojem już przed
rozpoczęciem leczenia wiadomo, że antybiotyki, na które jest on naturalnie
oporny nie będą skuteczne.
Nabyta – pojawienie się nierważliwości na dany antybiotyk bakterii
uprzednio wrażliwej. Pojawia się w wyniku mutacji lub przeniesienia genów
oporności z jednej komórki bakteryjnej do drugiej. Materiał genetyczny
zawierający geny oporności może być przenoszony pomiędzy komórkami
drobnoustrojów odległych systematycznie.
Oporność krzyżowa – rozwój oporności na jeden antybiotyk pociąga za
sobą oporność na antybiotyki tej samej grupy
Oporność na antybiotyki - sposoby nabywania oporności
Mutacja – pierwotne zjawisko prowadzące do powstania oporności.
Mutacje spontaniczne - zachodzą samorzutnie, niezależnie od
obecności antybiotyku w środowisku. Są to błędy podczas replikacji DNA.
Mutacje indukowane – pojawiają się po zadziałaniu mutagenów – w
warunkach naturalnych zachodzi niezwykle rzadko.
Selekcja – utrwalenie mutacji. Komórki, które uległy mutacji prowadzącej
do powstania oporności na antybiotyk obecny w środowisku, przeżywają w
obecności tego antybiotyku i stają się początkiem populacji opornej .
Lokalizacja genów oporności
Chromosomy – oporność chromosomalna
Plazmidy – oporność plazmidowa
Transpozony

Integrony
Sposoby przenoszenia oporności
Pionowe (wertykalne) – z komórki macierzystej do komórki potomnej
Poziome (horyzontalne) – przenoszenie z jednej komórki bakteryjnej do
innej (również innych gatunków) genów oporności zlokalizowanych na, na
drodze:
koniugacji - wymiana materiału genetycznego pomiędzy
komórką męską a żeńską (tego samego gatunku)
transdukcja – przenoszenie materiału genetycznego
pomiędzy komórkami bakterii (tego samego gatunku, a nawet szczepu) za
pośrednictwem bakteriofagów.
transformacja – bezpośrednie pobieranie materiału
genetycznego ze środowiska. Materiał genetyczny w pobierany dostaje się
do środowiska na skutek śmierci komórki lub jej rozpadu. W ten sposób
mogą być pobierane geny oporności od innych gatunków drobnoustrojów.
Flora fizjologiczna stanowi rezerwuar genów oporności dla drobnoustrojów
patogennych
Metody oznaczania lekowrażliwości
Metody te są podstawą terapii celowanej
Jakościowa
Dyfuzyjno-krążkowa
Ilościowa
Seryjnych rozcieńczeń
E-test
Półilościowa
Terapia empiryczna – oparta jest na domniemaniu najbardziej
prawdopodobnego czynnika etiologicznego zakażenia i jego
przypuszczalnej wrażliwości na antybiotyki. Empiryczny dobór leku musi
być oparty na analizie wyników badań klinicznych i lokalnych danych
epidemiologicznych.

Terapia celowana jest metodą, w której wyboru antybiotyku dokonuje się
po potwierdzeniu w badaniu mikrobiologicznym aktywności leku in vitro
wobec wyizolowanego czynnika etiologicznego zakażenia (antybiogram).
Leczenie pierwszego rzutu (leczenie początkowe) – polega na
zastosowaniu antybiotyku o udowodnionej skuteczności i bezpieczeństwie.
W odniesieniu do większości ostrych bakteryjnych zakażeń górnych
dróg oddechowych, jak i zaostrzeń zakażeń przewlekłych, empiryczne
leczenie początkowe powinno być skuteczne w większości przypadków, a
cena leku stosowanego w leczeniu początkowym jest zwykle niższa niż
leków stosowanych w kolejnych rzutach.
Zalecane postępowanie terapeutyczne ujęte jest w poszczególnych
Rekomendacjach
Ocena aktywności przeciwbakteryjnej
Antybiogram
Wynik badania wrażliwości danego drobnoustroju na działanie
antybiotyków.
Wrażliwy „S” – wrażliwość drobnoustroju na standardowe dawki leku,
wysokie prawdopodobieństwo sukcesu klinicznego
Średnio wrażliwy „I”– szczepy w zakresie MIC pomiędzy wrażliwym a
opornym, sukces terapeutyczny niepewny, może być osiągnięty, gdy lek
jest zagęszczany (np. w drogach moczowych) lub może być stosowany w
większej dawce (np. przy niskiej toksyczności)
Oporny „R”– wysokie prawdopodobieństwo niepowodzenia
terapeutycznego, niezależnie od dawki leku i lokalizacji infekcji
MBC (minimal bacteriocidal activity) – najmniejsze stężenie
bakteribójcze
MIC (minimal inhibitory concentration) – najmniejsze stężenie
hamujące
Efekt poantybiotykowy (postantibiotic effect) -
zahamowanie wzrostu bakteryjnego pomimo spadku stężenia antybiotyku
w surowicy poniżej wartości MIC lub przy całkowitym jego braku.
Dotyczy aminoglikozydów (najdłuższy), makrolidów, fluorochinolonów,
karbapenemów.

Metoda dyfuzyjno-krążkowa
Oparta jest na dyfuzji antybiotyku zawartego w krążku do podłoża.
Antybiotyk dyfunduje promieniście, tworząc gradient stężeń. Największe
jego stężenie jest przy brzegach krążka i zmniejsza się wraz z odległością
od krążka. Wielkość strefy zahamowania wzrostu bakterii jest wprost
proporcjonalna do stopnia wrażliwości bakterii na antybiotyk - im większa
jest strefa zahamowania, tym bakteria jest bardziej wrażliwa. W zależności
od wielkości strefy zahamowania wzrostu, bakterie określa się jako:
wrażliwe, średnio wrażliwe lub oporne na podstawie przyjętych standardów
(rekomendacje).
Jest to metoda dobrze wystandaryzowana, powtarzalna, relatywnie tania.
Oznaczanie lekooporności metodą dyfuzyjno-krążkową:
Materiały:
podłoże agar Mueler- Hinton (MHA)
1 ml jałowej 0,85% soli fizjologiczna (NaCl)
krążki bibułowe z antybiotykiem
zawiesina bakteryjna
wzorzec skali
jałowe wymazówki
Gęstość zawiesiny oznaczyć nefelometrycznie przy użyciu kolorymetru
Metoda seryjnych rozcieńczeń
pozwalaja na określenie minimalnego stężenia antybiotyku (MIC –
minimum inhibitory concetration) hamującego wzrost bakterii. Seryjne
rozcieńczenia antybiotyku przygotowuje się w podłożu płynnym lub
podłożu agarowym, do których następnie dodaje się odpowiednie
inoculum i inkubuje. Metody pracochłonne, wykorzystywane głównie w
badaniach naukowych.
E-test
łączy dyfuzję antybiotyku w agarze i ilościowe określenie stężenia
hamującego – MIC. Wykorzystuje się paski nasycone antybiotykiem w
gradiencie stężeń.

Metody półilościowe
W niektórych gotowych systemach (ręczne, automatyczne) stosowane są
metody półilościowe. Określa się w nich hamowanie wzrostu bakterii na 2,
3 lub więcej stężeń krytycznych (ang. breakpoint – wartość graniczna -
określona wartość MIC lub wartość strefy zahamowania wzrostu wokół
antybiotykiem kwalifikująca szczep jako: S, I, R) dla stopni wrażliwości S, I,
R.
MBQ – oznaczanie skuteczności antybiotyku wobec drobnoustroju-
-Metoda interpretacji MIC
MBQ (ang. MIC breakpoint quotient)
iloraz wartości granicznej stężenia antybiotyku dla szczepu wrażliwego (BP
- break point) do wartości MIC dla szczepu badanego
MBQ = BP/MIC
BP (breakpoint) -
stężenie graniczne wartości MIC. Punkt
odcięcia dla
kategorii lekowrażliwości (S)
Im wyższa
wartość MBQ tym większe
prawdopodobieństwo osiągnięcia sukcesu
terapeutycznego
MIC i MBQ łącznie pozwalają ocenić oczekiwaną skuteczność
przeciwbakteryjną antybiotyku.
Grupy antybiotyków
Β-laktamy (penicyliny, cefalosporyny, karbapenemy, monobaktamy,
inhibitory β-laktamaz)
Glikopeptydy (wankomycyna, teikoplanina, telawancyna)
Aminoglikozydy (amikacyna, gentamycyna, netylmycyna,
streptomycyna, tobramycyna, neomycyna)
Tetracykliny i glicylocykliny (doksycyklina, tetracyklina, minocyklina,
tygecyklina)
Makrolidy , ketolidy (erytromycyna, spiramycyna, josamycyna,
azytromycyna, roksytromycyna, klarytromycyna, telitromycyna)
BP
S: </=
0,064
I: 0,094-1
R: >\=1,5

Linkozamidy (linkomycyna, klindamcyna)
Streptograminy (chinupristyna, dalfopristyna, pristinamycyna)
Oksazolidynony (linezolid)
Chinolony (ciprofloksacyna, lewofloksacyna, moksyfloksacyna,
norfloksacyna, ofloksacyna)
Sulfonamidy (kotrimoksazol)
Nitroimidazole (ornidazol, metronidazol)
Nitrofurany (furagin, nifuroksazyd, nitrofurantoina)
Kwas fusydowy, fosfomycyna, polimyksyny
(kolistyna),
daptomycyna, mupirocyna, ansamycyny (ryfampicyna)
β-laktamy
Charakteryzują się obecnością w cząsteczce pierscienia β-laktamowego,
odpowiedzialnego za działanie przeciwbakteryjne.
Każda grupa antybiotyków β-laktamowych posiada w swojej budowie
charakterystyczny rdzeń, podstawiony różną liczba podstawników. Liczba
antybiotyków w obrębie danej grupy zależy od liczby miejsc, które można
podstawić.
Wykazują podobny mechanizm działania.
Cechą charakterystyczną β-laktamów jest niewielka ich toksyczność.
Spektrum przeciwbakteryjne:
Bakterie tlenowe i beztlenowe
Ziarniaki Gram-dodatnie
Ziarniaki Gram-ujemne
Pałeczki Gram-ujemene (Enterobacteriaceae, niefermentujące, hemofilne)
Laseczki Gram-dodatnie
Pałeczki Gram-dodatnie
Krętki
Promieniowce

Nie są aktywne wobec bakterii atypowych (bakterie nie posiadające ściany
komórkowej)
Mechanizm działania
Wiążą się z PBP („białka wiążące penicylinę”). PBP mają powinowactwo do
penicyliny i innych antybiotyków β-laktamowych. Są to:
Transpeptydazy i karboksypeptydazy - biorą udział w wiązaniu krzyżowym
peptydoglikanu przez D-alanyo-D-alaninę. Do tych enzymów termin PBP
jest stosowany najczęściej.
Białka receptorowe – przekazują sygnał do indukcji β-laktamaz
Β-laktamazy – enzymy produkowane przez bakterie hudrolizujące
antybiotyki β-laktamowe
Ostateczny efekt działania β-laktamów powoduje to lizę komórki
bakteryjnej.
Podział β-laktamów
Podgrupy:
Penicyliny
Cefalosporyny
Monobaktamy
Karbapenemy
Inhibitory β-laktamaz
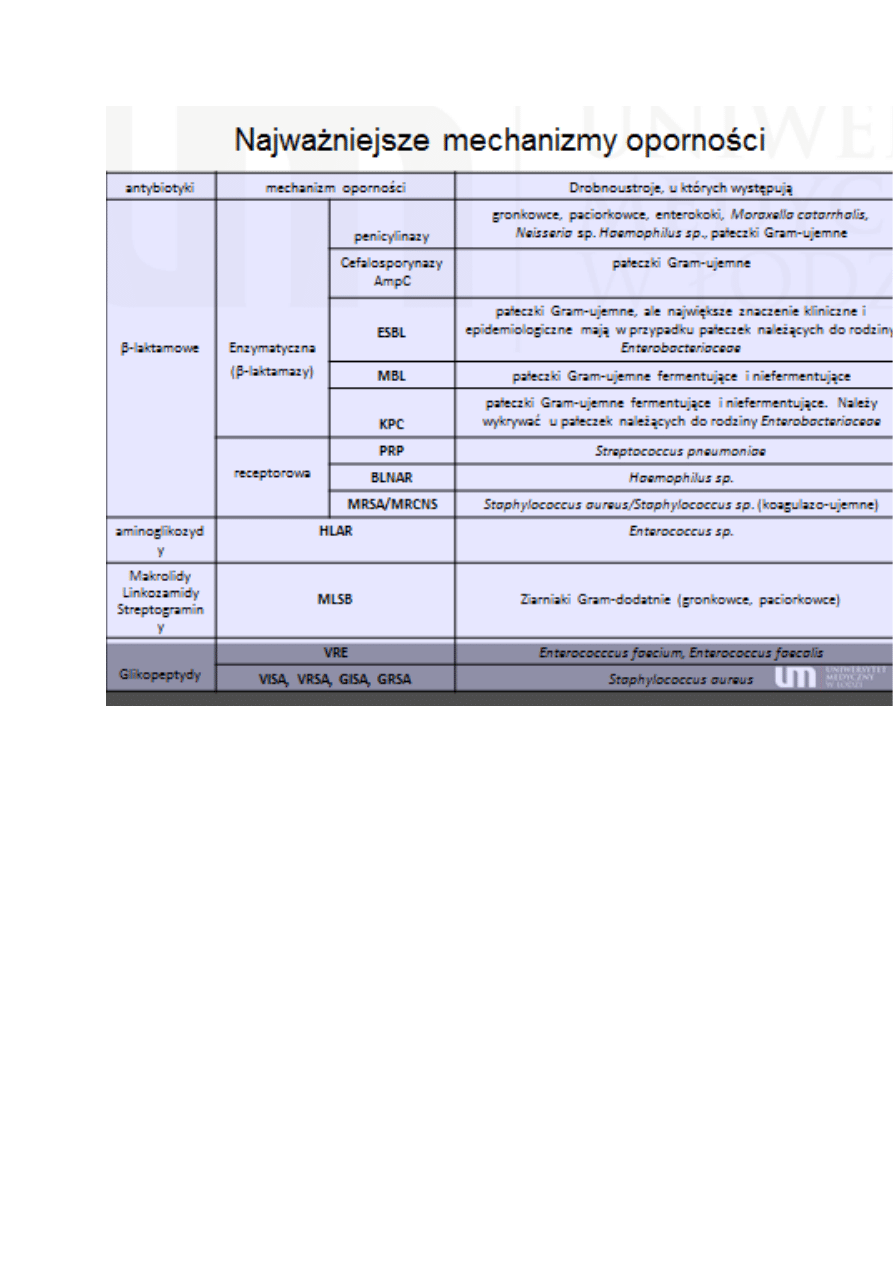
Mechanizmy oporności beta-laktamów
Enzymatyczna
produkcja β-laktamaz - enzymów niszczących aktywne wiązanie w
pierścieniu β-laktamowym. Bakterie Gram-dodatnie wydzielają je na

zewnątrz komórki, a bakterie Gram-ujemne wydzielają je do przestrzeni
periplazmatycznej.
Mogą mieć powinowactwo do penicylin, cefalosporyn, karbapenemów:
penicylinazy – gronkowce, paciorkowce, enterokoki, moraxella
catarrhalis, neisseria sp. haemophilus sp., pałeczki Gram-ujemne.
Cefalosporynazy – pałeczki Gram-ujemne
ESBL - β-laktamazy o rozszrzonym spektrum substratowym - zdolne do
hydrolizy penicylin, cefalosporyn (z wyjątkiem cefamycyn, np.
cefoksytyny) i monobaktamów (aztreonamu). Są wrażliwe na działanie
inhibitorów β-laktamaz.
Produkowane są przez pałeczki Gram-ujemne, ale największe
znaczenie kliniczne i epidemiologiczne mają w przypadku pałeczek
należących do rodziny Enterobacteriaceae.
AmpC (cefalosporynazy klasy - hydrolizują penicyliny, cefalosporyny (z
wyjątkiem leków IVgeneracji) i aztreonam. Z reguły nie są one też podatne
na działanie inhibitorów β-laktamowych.
Produkowane przez pałeczki Gram-ujemne fermentujące i
niefermentujące. Ale znaczenie kliniczne i epidemiologiczne mają w
przypadku pałeczek z rodziny Enterobacteriaceae.
Szczepy AmpC (+) mogą być wrażliwe na cefepim i karbapenemy.
karbapenemazy MBL (metalo-beta-laktaazy) – szczepy posiadające
enzymy zdolne do hydrolizy wszystkich beta-laktamów: penicylin,
cefalosporyn i karbapenemów (a także połączenia b-laktamów z
inhibitorami).
produkowane przez pałeczki niefermentujące i fermentujące.
Szczepy MBL(+) mogą być wrażliwe jedynie na aztreonam i kolistynę
karbapenemazy KPC (Klebsiella pneumoniae carbapenemase) -
szczepy posiadające enzymy zdolne do hydrolizy wszystkich beta-
laktamów: penicylin, cefalospory, karbapenemów i aztreonamu
(a także połączenia b-laktamów z inhibitorami).
Wśród szczepów KPC(+) obserwuje się wrażliwość jedynie na
gentamicynę (i niekiedy amikacynę), kolistynę i tigecyklinę. - Jednak

brak jest badań klinicznych udowadniających skuteczność tych
antybiotyków w leczeniu zakażeń wywołanych przez szczepy KPC+.
Są one stosowane na ratunek („salvage therapy”) z powodu braku opcji
terapeutycznych o udowodnionej skuteczności.
U Enterobacteriaceae należy wykrywać jednocześnie oba typy
karbapenemaz MBL i KPC u wszystkich izolatów niewrażliwych
(średniowrażliwych i opornych) przynajmniej na jeden karbapenem
(imipenem, meropenem, ertapenem, doripenem).
Przed wprowadzeniem rekomendacji EUCAST (2010r.) wykrycie takiego
mechanizmu oporności jak ESBL, MBL lub KPC wykluczało użycie
antybiotyków objętych spektrum działania tych enzymów z terapii
zakażenia bakterią posiadającą mechanizm oporności typu ESBL.
Obecnie: „wykrycie ESBL nie wyklucza zastosowania
cefalosporyn III i IV generacji oraz aztreonamu w przypadku
stwierdzenia na nie wrażliwości. Jednocześnie w przypadku
szczepów ESBL+ zaleca się oznaczenie MIC cefalosporyny wyższej
generacji (lub aztreonamu), jeśli jest ona planowana do leczenia,
a także monitorowanie skuteczności stosowanej terapii”.
Receptorowa
Zmiana struktury punktu docelowego działania antybiotyku. Zmiana w
genach kodujących białaka PBP powodująca zmniejszenie lub utratę
powinowactwa do antybiotyku.
PRP – (ang. Penicillin resistant pneumococci) oporność na penicylinę.
Występuje u pneumokoków.
BLNAR - szczepy β-laktamazo-ujemne oporne na ampicylinę (ang. Beta-
Lactamase- Negative, Ampicillin Resistant). Mechanizm oporności
związany ze zmianami w strukturze białek wiążących penicylinę PBP
3
MRSA (ang. Metycillin restant Staphylococcus aureus) – gronkowce
złociste oporne na metycylinę - są oporne na wszystkie z obecnie
stosowanych antybiotyków β-laktamowych, z wyjątkiem cefalosporyn
o udowodnionej aktywności wobec MRSA i z ustalonymi wartościami
granicznymi (w Polsce niedostępne).
Posiadają gen oporności na metycylinę mecA warunkujący syntezę
zmienionego białka PBP2 - PBP2a lub PBP2’.

MRCNS - Szczepy oporne na metycylinę wśród gronkowców
koagulazo-ujemnych.
Szczepy MRCNS są również oporne na wiele dostępnych antybiotyki
zachowaną wrażliwością na glikopeptydy, kwas fusydowy, linezolid,
daptomycynę oraz tygecyklinę.
Pierwsze szczepy MRSA pojawiły się w 1961 uważane za synonim
szczepów szpitalnych (HA-MRSA - hospital acquired MRSA).
Toksynotwórcze szczepy metycylinooporne nie związane ze środowiskiem
szpitalnym (CA-MRSA - community acquired MRSA) - pierwsze
szczepy w latach 90-tych.
Działania niepożądane
Nadwrażliwość
Natychmiastowa- występuje 0-1 godz. od podania. Reakcją jest:
wstrząs, podciśnienie, obrzęk głośni, pokrzywka.obrzęk naczyniouchowy,
skurcz oskrzeli.
Przyspieszona – występuje 1-72 godz. Od podania. Reakcją jest: obrzęk
głośni, pokrzywka.obrzęk naczyniouchowy, skurcz oskrzeli.
Późna – występuje >72 godz. Od podania. Reakcją jest: wysypka
odropodobna, śródmiąższowe zapalenie nerek, niedokrwistość
hemolityczna, neutropenia, trombocytopenia, choroba posurowicza,
gorączka polekowa, zespół Stevensa-Johnsona, Złuszczające zapalenie
skóry.
Chinolony/Fluorochinolony
Fluorochinolony - grupa chinolonów, które posiadają atom fluoru jako
podstawnik
Chinolony nie zawierające fluoru, zwane są po porostu chinolonami
(„stare chinolony”). Ich stosowanie nie jest zalecane (ze względu na
szerzenie się oporności i działania niepożądane). Wychodzą z użycia i nie
będą szerzej omawiane.
Chinolony
Hamują aktywność gyrazy DNA i topoizomerazy IV. Poprzez stabilizację
połączenia enzym-DNA. Połączenie jest nieodwracalne. Skutkiem jest
zahamowanie syntezy DNA i szybka śmierć komórki.

Gyraza DNA – wprowadza ujemne superhelikalne skręty do nici DNA, co
umożliwia replikację i transkrypcję.
Topoizomeraza IV – bierze udział w rozdzielaniu chromosomów, co
pozwala na przechodzenie ich do komórki potomnej.
Zakres działania:
Tylko bakterie tlenowe
Pałeczki Gram-ujemne fermentujące i niefermentujące
Gronkowce (szybko nabywają oporność!)
Paciorkowce
Enterokoki
Haemophilus
Neisseria
Bakterie atypowe
Mechanizm oporności
Oporność nabyta związana jest przede wszystkim z:
Zahamowaniem transportu do komórki
Modyfikacją gyrazy
Działania niepożądane
Dolegliwości ze strony układu pokarmowego – biegunki, nudności,
wymioty, brak łaknienia, wolne stolce.
Reakcje skórne – nadwrażliwość na światło (najczęściej reakcje
fototoksyczne). Występują w kilka godzin po pierwszym kontakcie z
lekiem
Ból głowy, zawroty głowy, senność
Zaburzenia czynności wątroby
Nefrotoksycznosć - rzadko
Aminoglikozydy
Ze względu na ich potencjalną toksyczność powinny być zarezerwowane
do stosowania szpitalnego.
Poznanie mechanizmów działania przeciwbakteryjnego i toksyczności
wpływa na bardziej bezpieczne ich stosowanie.

wykazują synergizm działania z antybiotykami β-laktamowymi i właśnie w
skojarzeniu powinny być stosowane.
Zbudowane są z aminocukru i aminocyklitolu.
Pierwsza zastosowana – streptomycyna – izolowana z hodowli
Streptomyces griseus (1944r)
Aminoglikozydy
Gentamycyna
Amikacyna
Tobramycyna
Netymycyna
Neomycyna
Sisomycyna
Dibekacyna
Isepamycyna
Streptomycyna
Spektinomycyna
Mechanizm działania
Hamują translację poprzez wiązanie z małą podjednostką rybosomu 30S.
Powodują zaburzenia sekwencji aminokwasów lub zakończenie procesu
translacji. Antybiotyki te działają również na błonę komórkową co w sumie
doprowadza do śmierci komórki.
Działają tylko na bakterie tlenowe:
Pałeczki Gram-ujemne
Ziarniaki Gram-dodatnie
Prątki gruźlicy
Mechanizm oporności
Oporność na aminoglikozydy spowodowana jest najczęściej:
Wytwarzaniem enzymów (aminoglikozydazy-transferazy) – powodują
modyfikację cząsteczki tych leków
Zmianą w miejscu wiązania antybiotyku (oporność rybosomalna) –
uniemozliwienie lub utrudnienie w wiązaniu antybiotyku
Obniżenie lub inaktywacja mechanizmów czynnego transportu.
HLAR (ang. high-level aminoglycoside resistance) - szczepy enterokoków
opornych na wysokie stężenia aminoglikozydów.

HLAR
Enterokoki są naturalnie oporne na niskie stężenia aminoglikozydów.
Związane jest to ze słaba przepuszczalnością bakteryjnych osłon
komórkowych dla cząsteczek antybiotyku i uniemożliwia stosowanie tych
leków w monoterapii. Skuteczne w leczeniu jest natomiast zastosowanie
terapii skojarzonej aminoglikozydu z penicylinami lub glikopeptydami, pod
warunkiem wrażliwości in vitro na te grupy antybiotyków. Połączenie
wykazuje działanie synergistyczne i umożliwia osiągniecie efektu
bakteriobójczego. Badanie lekowraliwosci enterokoków powinno
uwzględniać oznaczenie poziomu oporności na antybiotyki
aminoglikozydowe, bowiem wystąpienie wysokiego poziomu oporności na
aminoglikozydy oznacza nabycie oporności (fenotyp HLAR) i wyklucza
zastosowanie terapii skojarzonej aminoglikozydu z penicylinami lub
glikopeptydami.
Działania niepożądane
Ototoksyczność – uszkodzenie komórek receptorowych VIII nerwu
czaszkowego, może dotyczyć ślimaka lub błędnika. Odstawienie leku w
bardzo wczesnej fazie może umożliwić powrót do ich funkcji, ale kliniczna
utrata słuchu jest z reguły nieodwracalna.
Neferotoksyczność – objawowe uszkodzenie nerek. Pierwszy objaw, to
wzrost aktywności fosfatazy alkalicznej w moczu. Pierwsze objawy o
znaczeniu klinicznym, to wzrost poziomu kreatyniny i zmniejszenie
przesączania kłębuszkowego.
Makrolidy i ketolidy
Zbudowane są z dużego pierścienia laktonowego zawierającego 14-15
atomów węgla połączonego z cząsteczką cukru kladinozy i aminocukru
desozaminy.
Cechą charakterystyczną makrolidów jest szybkie i łatwe narastanie
oporności bakterii, zwykle mającej charakter krzyżowy.
Ketolidy – makrolidy, które zamiast cukru kladinozy mają grupę ketonową
(od tego pochodzi ich nazwa).
Makrolidom przypisuje się działanie przeciwzapalne, ale nie udowodnione
jeszcze klinicznie.
Makrolidy w większości zakażeń są lekiem drugiego rzutu (zakażenia dróg
oddechowych).

Lekiem z wybory są w leczeniu zakażeń bakteriami atypowymi!!!
Makrolidy i ketolidy
Erytromycyna
Azitromycyna
Klaritromycyna
Diritromycyna
Spiramycyna
Roksytromycyna
Telitromycyna – ketolid
Mechanizm działania
Wiążą się odwracalnie z większą podjednostką rybosomu 50S,
uniemożliwiając wydłużanie łańcucha białka.
Efektem jest zahamowanie wzrostu
•
Działają przede wszystkim na bakterie Gram-dodatnie tlenowe i
beztlenowe
•
W mniejszym stopniu na bakterie Gram-ujemne w tym tlenowe i
beztlenowe pałeczki oraz Neisseria i Moraxella
•
Duże znaczenie kliniczne ma ich aktywność wobec bakteriii
wewnątrzkomórkowych, takich jak Mycoplasma, Chlamydia i
Legionella (bakterie atypowe)
Streptograminy, makrolidy i linkozamidy
Często zaliczane są do jednej dużej grupy antybiotyków. Antybiotyki te
wykazują znaczne różnice w budowie i zakresie działania
przeciwbakteryjnego, ale mają wspólne miejsce docelowe (wiązania) i
wspólne mechanizmy oporności.
Oporność na makrolidy, linkozamidy i streptograminy B - MLS
B
Szczepy posiadające mechanizm oporności MLS
B
- oporne są na
makrolidy, linkozamidy i streptograminy B.
Oporność typu MLS
B
występuje u ziarniaków Gram-dodatnich (gronkowce,
paciorkowce)

Glikopeptydy
Są to antybiotyki o dużych cząsteczkach, zbudowane z pierścienia
peptydowego połączonego z dwiema cząsteczkami cukru.
Wankomycyna
Teikoplanina
Telawacyna
Mechanizm działania
Hamują syntezę peptydoglikanu. Wiążą się z końcami dipeptydowymi
podstawowej cegiełki peptydoglikanu, które łączą się z innymi elementami
ściany komórkowej, a to uniemożliwia polimeryzację.
Efektem jest śmierć komórki.
Działają tylko na bakterie Gram-dodatnie tlenowe i beztlenowe
Oporność
VRE – szczepy enterokoków oporne na wankomycyne.
Szczepy o fenotyfie vanA są również oporne na teikoplaninę. Gen
oporności VanA zlokalizowany jest na transpozonie Tn 1546.
Szczepy o fenotypach VanB i VanC oporne są tylko na wankomycynę.
Pierwszy VRE w Polsce w 1999r
VISA - szczepy gronkowca złocistego średniowrażliwe na wankomycynę –
pojawiły się w latach 90-tych. Mechanizm oporności związany ze zmianą
przepuszczalności ściany komórkowej.
VRSA – szczepy gronkowca złocistego oporne na wankomycynę - pierwsze
doniesienia w 2002 roku. Posiadają operon VanA w transpozonie Tn156
występujący u gatunków należących do rodzaju Enterococcus opisanych w
1968 roku.
GISA i GRSA - szczepy średniowrażliwe i oporne na glikopeptydy
Działania niepożądane
Wankomycyna:
Reakcje alergiczne
Zapalenia żył w miejscu wstrzyknięcia
Zespół czerwonego karku
Gorączka

Uszkodzenie słuchu
Uszkodzenie nerek
Neutropenia – pojawia się zwykle, gdy czas leczenia przekracza 14
dni
Teikoplania:
Ocenia się, że powoduje mniej działań niepożądanych niż wankomycyna,
ale brak dużych badań porównawczych.
Tetracykliny
Wprowadzone do lecznictwa niedługo po penicylinie. Ze względu na
szeroki zakres działania i zachęcająca reklamę (zachęcała do używania bez
ograniczeń m.in. w zakażeniach dróg oddechowych), były masowo
przepisywane. Ostrzeżenia , że „częste stosowanie antybiotyków o
szerokim zakresie działania jest zwykle przykrywką braku precyzji
diagnostycznej” nie przyniosły oczekiwanych rezultatów. Oporność na tą
grupę leków zaczęła gwałtownie narastać na całym świecie. Reakcją na to
zjawisko był spadek zużycia tych antybiotyków, a co za tym idzie
stopniowe zmniejszanie oporności, w wielu krajach, niestety nie w Polsce.
Do pojawienia się wysokiej oporności drobnoustrojów na tetracykliny
przyczyniło się również powszechne stosowanie ich w rolnictwie ( w
lecznictwie weterynaryjnym i dla przyspieszenia przyrostu masy ciała
zwierząt hodowlanych).
Oporność na tę grupę leków ma charakter krzyżowy.
Narastającej oporności nie można ograniczyć syntetyzowaniem nowych
preparatów, dlatego stosowanie tetracyklin powinno być ograniczone.
Tetracykliny
Tetracyklina
Doksycyklina
Minocyklina – niezarejestrowana w Polsce
Tigecyklina – pochodna minocykliny (grupa glicylcyklin)
Chlorotetracyklina – przeznaczona tylko do receptury (stosowanie
miejscowe)
Mechanizm działania
Zbudowane są z 4 pierścieni karbocyklicznych.

Pierwotnie otrzymane ze szczepów Streptomyces aureofaciens
Mają szerokie spektrum działania (bakterie tlenowe i beztlenowe):
-
Bakterie Gram-dodatnie
-
Bakterie Gram-ujemne
-
Krętki
-
Bakterie atypowe
Łączą się z podjednostką 30S rybosomu i niedopuszczają do wiązania
aminoacylo-tRNA w rybosomie. Hamują przyłączanie kolejnych
aminokwasów do łańcucha peptydowego.
Efektem jest zahamowanie wzrostu komórki.
Działania niepożądane
Dolegliwości pokarmowe – nudności, wymioty, biegunka, zgaga, ból
brzucha
Zapalenie lub owrzodzenie przełyku
Uszkodzenie wątroby
Hamowanie syntezy białka gospodarza – przerwanie procesów
katabolicznych, co prowadzi do nasilenia azotemii u osób z niewydolnością
nerek
Nadwrażliwość na światło
Oksazolidynony
Nowa grupa leków syntetycznych. Tylko linezolid dopuszczony do obrotu
w niektórych krajach w tym w Polsce.
Mechanizm działania - uniemożliwiają połączenie podjednostki 30S i 50S
i powstanie kompleksu 70S rubosomu.
Zakres działania: bakterie Gram-dodatnie
Mechanizm oporności - szczepy wytwarzające kodowaną przez plazmidy
metylazę Cfr – po raz pierwszy opisane w 2008 roku. W Polsce jeszcze nie
występuje Dotychczas nie wykazano groźnych działań niepożądanych
Wyszukiwarka
Podobne podstrony:
Probiotyki antybiotyki id 66316 Nieznany
Konspekt; kolko id 245880 Nieznany
konspekt lab6 id 245555 Nieznany
MSI w2 konspekt 2010 id 309790 Nieznany
MSI w1 konspekt 2010 id 309789 Nieznany
konspekt odpowiedzialnosc id 24 Nieznany
konspekty z internetu id 246070 Nieznany
Konspekt 1a id 245441 Nieznany
antybiotyki id 66312 Nieznany
neurochemia konspekt BD id 3173 Nieznany
Kopia konspekt godziny 2 id 247 Nieznany
9 Antybiotyki id 48018 Nieznany
KONSPEKT III id 245541 Nieznany
Antybiotyki 4 id 66255 Nieznany (2)
MSI w4 konspekt 2010 id 309792 Nieznany
Modele konspektow lekcji id 305 Nieznany
Konspekt nr 4 id 245629 Nieznany
konspekt meeega id 245614 Nieznany
więcej podobnych podstron